分析化学第六讲配位滴定二
分析化学第六章--配位滴定法[精编文档]
![分析化学第六章--配位滴定法[精编文档]](https://img.taocdn.com/s3/m/34d081a4ba0d4a7302763a96.png)
(指示剂的僵化)
4) In本身性质稳定,便于储藏使用
三、指示剂的封闭、僵化现象及消除方法
指示剂的封闭现象:化学计量点时不见指 示剂变色
产生原因:
干扰离子: 变颜色
KNIn
>
KNY
→指示剂无法改
消除方法:加入掩蔽剂
例如:滴定Ca2+和Mg2+时加入三乙醇胺掩蔽 Fe3+,Al3+以消除其对EBT的封闭
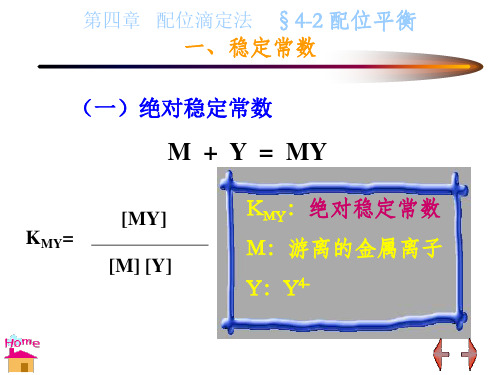
K MY
MY
lg KM' Y lg KMY lg M lg Y
三、配位滴定中适宜pH条件的控制
lg cKM' Y 6
KMY '
MY M Y'
[M
[MY ]
][Y ]Y
(
H
)
K MY
Y (H )
lg c lg KMY lg Y (H ) 6
示意图
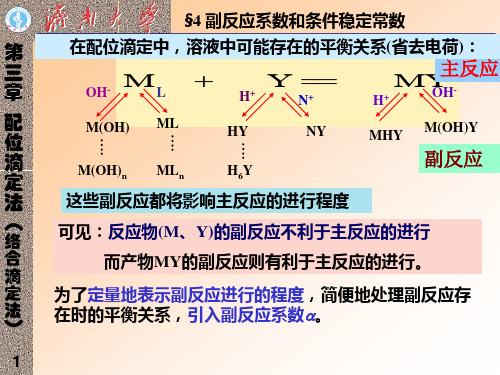
主反应:
M
+
Y
副反应:
L
OH - H +
N
ML
MOH HY
NY
ML2
M(OH)2? H2Y
MY
H+
OH -
MHY
M(OH)Y
MLn
M(OH)n H6Y
辅助配 位效应
羟基配 酸效应 位效应
不利于主反应进行
干扰离 子效应
混合配位效应
利于主反应进行
注:副反应的发生会影响主反应发生的程度 副反应的发生程度以副反应系数加以描述
EDTA(Y)
EBT
2d
Mg
Mg-EBT (Mg)
分析化学 配位滴定法

配位剂种类:
早期以 AgNO3为标准溶液的配位滴定反应:
Ag+ + 2CN
[Ag(CN)2]-
K稳
[Ag(CN) 2 ] 21.1 10 [Ag ][CN ] 2
无机配位剂:形成分级络合物,简单、不稳定
有机配位剂:形成低络合比的螯合物,复杂而稳定
常用有机氨羧配位剂 ——乙二胺四乙酸
[Co(NH3)6]Cl3
(罗马数字)
(III) 合 金属离子 钴 (离子的化合价
3 配离子为阴离子的配合物的命名
命名次序:配体、中心离子、外界阳离子。
中心离子与外界阳离子名称之间加“酸”字。
配位个数用一、二、三、四等数字表示。
中心离子的氧化态以加括号的罗马数字表示并置于
中心离子之后。
• • K2[PtCl6] 六氯合铂(IV)酸钾 K3[Fe(CN)6] 六氰合铁(II )酸钾
例如:EDTA 配位滴定法
测定水的硬度所形成的
Ca2+-EDTA配合物。
H2C N O C O
分析化学中的配合物
简单配体配合物 螯合物
O C
多核配合物
Cu(NH 3 ) 2 4
H2C H2C N O C O
O CH2 CH2 Ca CH2 O C O O C CH2 O N
[(H 2O)4Fe
4.配离子的电荷:等于中心离子与配位体电荷的代数和。 [说明] 由多齿配体与同一金属离子形成的具有环状结构的配合 物称为螯合物。形成的环为螯环,以五元环和六元环最稳定。
项目 配合物 [Ag(NH3)2]Cl
配体 配位数
NH3
2
配体数 中心体 氧化数 2 +1
配位 原子 N
分析化学配位滴定法2

25
4. 化学计量点后,加入EDTA 20.02mL
c(MY ) 1 c( M ) / c c(Y ') K f '(MY )
20.00m L c( ZnY ) c0 ( M ) 1.00102 m ol/ L (20.00 20.02)m L
(20.02 20.00)m L c(Y ' ) 0.02000 ol/ L m 1.00105 m ol/ L (20.00 20.02)m L
11
2. 共存离子(干扰离子)效应系数
Y ( N )
c(Y ') c(Y ) c( NY ) 1 K NY c( N ) c(Y ) c(Y )
注:c(Y’) ——EDTA 与 N 配合物平衡浓度 和Y4-平衡浓度之和 c(Y) ——Y4-的平衡浓度
结论: Y ( N ) , c(Y ) 副反应越严重
(20.00 19.98)m L c( Zn ) 0.02000 ol/ L m (20.00 19.98)m L
2
1.0010 m ol/ L
5
p(Zn2+) = 5.00
24
3.化学计量点时
c( MY ) / c K f ' ( MY ) c( M ) / c c(Y ') / c
c( MY ') / c c( M ') / c (Y ') / c c
' MY
19
c(Y ') c( M ') 由 Y H) 和 M L) ( ( c(Y ) c( M )
K
' MY
MY c( MY ) MY K MY M c( M ) Y c(Y ) M Y
《配位滴定法》课件

配位滴定法的优点和缺点
1 优点
对于大多数金属离子具有 良好的选择性和灵敏度。
2 优点
操作简单且成本较低。
3 缺点
不能应用于无机离子以外 的其他物质。
配位滴定法和其他滴定法的比 较
配位滴定法与酸碱滴定法和氧化还原滴定法等其他滴定方法相比,具有不同 的适用范围和优势。配位滴定法更适合于测定金属离子的含量,而酸碱滴定 法和氧化还原滴定法则更适合于其他化学物质的测定。
溶液制备
准备待测溶液和滴定剂的溶液。
2
指示剂添加
向待测溶液中加入适当的指示剂。
3
滴定过程
逐滴加入滴定剂到待测溶液中,观察滴定终点。
配位滴定法的设备与试剂
滴定管和滴定管架
用于控制滴定剂的滴加速度。
滴定瓶
容纳待测和滴定剂的溶液。
指示剂
用于指示滴定过程中的终点。
容量瓶
用于准确制备溶液。
配位滴定法的常见误差
配位滴定法可能存ห้องสมุดไป่ตู้几种误差。这包括试剂的误差,如滴定剂和指示剂的纯 度,溶液的误差,如溶液的浓度和纯度,以及操作误差,如溶液的滴定速度 和终点的判定。了解和控制这些误差可以提高滴定结果的准确性。
配位滴定法的精度和准确性
配位滴定法通常具有较高的精度和准确性。但要获得准确和可靠的结果,必须注意实验条件,并使用高纯度的 试剂和良好校准的仪器。校准滴定剂和指示剂的浓度也是确保结果准确性的关键。
配位滴定法的实验操作注意事项
1 实验前准备
2 实验操作
正确校准仪器并准备好所需的试剂。
控制滴定剂的滴加速度,避免过快或过慢。
3 终点判定
仔细观察指示剂的颜色变化或溶解度变化。
配位滴定法的结果计算
第6章 配位滴定法

效应 效应 配位效应
EDTA 副反应
混合配 位效应
不利于主反应进行
利于主反应进行
提出问题: 用什么来表示副反应对主反应的影响呢?
为了表示副反应对主反应的影响,定量
表示副反应进行的程度,引入副反应系数α
副反应系数的定义式:
=未参加主反 该应 组组 分分 的的 平各 衡型 浓体 度的总浓度=XX
6.3.1副反应系数(α)
[Y ] [N1Y ] [N2Y ] [NnY ] [Y ]
Y Y (H ) Y (N1) Y (N2 ) Y (Nn ) n
当n=1时:
Y Y (H ) Y (N) 1 (二)金属离子的副反应及αM
1.辅助配位效应 由于其他配位剂存在使金属离子参加主反
应能力降低的现象
2.αM(L)
i
[MLi ] cM
[M]
i [M ] [ L]i (1 i[L]i )
i [ L]i
(1 i[L]i )
铜氨络合物各种型体的分布
1.0
0.8
Cu2+
Cu(NH3)42+
分布系数
分 布 0.6
Cu(NH3)22+
分 数
0.4 Cu(NH3)2+
Cu(NH3)32+
0.2
0.0
654321 lgK1-4 4.1 3.5 2.9 2.1
4.金属离子M的总的副反应系数
A若存在n种配位副反应: αM
M
M M
M(L1
)
M(L2
)
M(Ln
)
(n
1)
B若存在2种配位副反应:
练习:
M
M M
M(L1
第6章 配位滴定法

lgK 8.7 Fe2+ 10.7 La3+
Al3+ Zn2+ Cd2+ Pb2+ Cu2+
lgK
lgK
14.3 Hg2+ 21.8
15.4 Th4+ 23.2
16.1 Fe3+ 25.1
16.5 Bi3+ 27.9
16.5 ZrO2+ 29.9
18.0
18.8
乙二胺四乙酸 (3)
EDTA几乎可以与所有M络合,配位比大多是1:1 MY大多带电荷,MY能溶于水 M无色,MY无色;M有色,MY颜色加深 MY的稳定性不同 实验室常用二钠盐的形式
lg YH 6.60
EDTA的酸效应曲线
25
20
15
lg YH
10
5
0 0
pH
2 4 6 8 10 12
EDTA的副反应系数Y(2)
H
Y
Ni
YH
YNi
NY Y YN Y
Y
Y'
Y
Y
HY
H 2 Y Y
H 6 Y
NY
Y
HY
H2Y Y
H
6Y
Y
NY Y
Y Y
YH YN 1
1 Y KNY
金属离子的副反应系数M(2)
ML
M'
M
M
ML
ML 2 M
ML n
1 0
M
M
1
M2 2 M
Mn
n
1 L1 L2 2 Ln n
M YOH YL 1
n
M MOH MLi n 1
分析化学课件-配位滴定法

lgK
Fe2+ La3+ Al3+ Zn2+ Cd2+ Pb2+ Cu2+
14.3 15.4 16.1 16.5 16.5 18.0 18.8
lgK
Hg2+ 21.8 Th4+ 23.2 Fe3+ 25.1 Bi3+ 27.9 ZrO2+ 29.9
第八页第,七共页46页。
5.2 配合物的稳定性
一、配合物的稳定常数
因为多数条件下,不形成MHY和MOHY,或形成的不稳定,上式
可简化为:
lg K’MY=lg KMY–lg αM – lg αY
第二十二第页二十,一页共46页。
5.3 配位滴定法原理
一、滴定曲线 以浓度为c(0.01mol/L)EDTA溶液滴定浓度为c0
( 0.01mol/L )体积为V0(20.00ml)Ca2+溶液为例,计 算pH=12时,滴定过程中pCa的变化,以pCa作纵坐标,加 入EDTA溶液的百分数作横坐标,绘制滴定曲线如下图:
金属离子与EDTA反应大多形成1:1配合物: M+Y=MY(为简化计,省去了离子电荷)
反应的平衡常数表达式为:
KMY=[MY]/([M]*[Y]) KMY是配合物MY的稳定常数。可以用它来衡量配合物的稳定性。 KMY值
越大,配合物越稳定。
金属离子还能和配位剂L形成MLn型配合物。MLn型配合物 是逐级形成的,它的逐级形成反应和相应的稳定常数是:
(二)金属离子的副反应系数αM
M的存在形式
主反应产物 MY
副反应产物
M(OH)i, MAj, MBk
i =1,2..m; j=1,2,..n; k=1,2..p
第六章配位滴定法

配位效应系数的大小仅与共存配位剂L的种类 和浓度有关。共存配位剂的浓度越大,与被测 金属离子形成的配合物越稳定,则配位效应越 显著,对主反应的影响越大。
3.配合物MY的副反应系数
主要是酸效应和碱效应,但由于他们的产 物大多不太稳定,一般计算时可忽略不计。
M + Y = MY
αM(OH)
二、配位滴定中的滴定剂 氨羧络合剂,是一类含有氨基二乙羧基 团的有机化合物。
HOOCH2C N CH2COOH
其分子中含有氨氮和羧氧两种络合能力很 强的络合原子,可以和许多金属离子形成 环状结构的络合物。
在络合物滴定中常遇到的氨羧络合剂有以下 几种:
(一)氨三乙酸,(二)乙二胺四乙酸
(三)环己烷二胺四乙酸,(四)二胺四丙酸 (五)乙二醇二乙醚二胺四乙酸
1、配位剂副反应系数(α) 是指未参与配位反应的EDTA各种型体的
总浓度[Y`]与能直接参与主反应的Y4-的平 衡浓度[Y]之比。
配位剂的副反应主要有酸效应和共存离子效应
(1)EDTA的酸效应系数
在滴定体系中有H+存在时,H+离子与EDTA之 间发生反应,使参与主反应的Y4-浓度减小, 主反应化学平衡向左移动,配位反应的程度降 低,这种现象称为EDTA的酸效应。酸效应的 大小用酸效应系数来衡量。
pKa1=0.9
pKa2=1.6
pKa3=2.07
H6Y2+
H5Y+
H4Y
H3Y-
pKa4=2.75
H2Y2-
pKa5=6.24
pKa6=10.34
HY3-
Y4-
其中只有Y4-离子能与金属离子形成稳定的螯合物。
pH <1 2.67 ~ 6.16 > 10.26
分析化学第6章 配位滴定法

ML型配合物稳定常数
M+Y
K不稳
离解常数
MY KMY=
[MY] [M][Y]
MY的稳定常数
影响配位平衡的主要因素
M L ML1 OH M(OH) + H
+
Y N NY H
+
MY
OH
-
HY
MHY
M(OH)Y
ML2
M(OH)2
H2Y
MLn
M(OH)n
H6Y
配位效应 水解效应
酸效应
共存离子效应 酸式配合物 碱式配合物
金属离子的配位效应
M+L
K1
ML
溶液中未与EDTA配位的M
CM=[M]+[ML]+ ... +[MLn] = [M](1+β 1[L]+...+β n[L]n)
M ( L)
CM 2 n 1 1 L 2 L n L M
金属离子水解效应
' K CaY
SP CCa ' K CaY
1 1 SP ' pCa ( pCCa lg K CaY ) ( lg 5.0 10 3 lg1010.24 ) 6.27 2 2
在配位滴定中,计算计量点时pM值的一般 公式为 1 SP ' pM Sp ( pCM lg K MY ) 2 有副反应时,
结论
大多数无机配位体与金属离子逐级 生成简单配位化合物,不能用于配 位滴定
氨羧配位剂
氨基二乙酸
N
螯合剂
CH2COOH CH2COOH
O C O .. -
氨氮 .
羧氧
配位滴定2
H Y 4 HY
1010.34
ห้องสมุดไป่ตู้ n
HnA c
H n H n Ka1 H n1 Ka1Ka2 Kan
n1
H n1A c
Ka1 H n1 H n Ka1 H n1 Ka1Ka1 Kan
·
·
·
0
An c
Ka1Ka2 Kan H n Ka1 H n1 Ka1Ka2 Kan
6H
H 6Y 2
1
1 Ka6
2
1 Ka5Ka6
3
1 Ka4Ka5Ka6
4
1 Ka3Ka4Ka5Ka6
5
1 Ka1Ka2 Ka3Ka4 Ka5Ka6
6
1 Ka1Ka2 Ka3Ka4 Ka5Ka6
3、 酸效应及酸效应系数
由于H+与Y4-之间发生副反应而 使Y4- 参加主反应的能力下降
酸效应
酸效应系数:用来衡量酸效应的大小
1 1 H 2 H 2 3 H 3 4 H 4 5 H 5 6 H 6
不同pH值时的αY(H)
pH
lgαY(H)
pH
lgαY(H)
pH
0.0
24.0
3.4
9.70 6.8
0.4
21.32 3.8
8.85 7.0
0.8
19.08 4.0
8.6
7.5
1.0
18.80 21.8 23.0 23.2 25.1 25.90 27.94
影响配合物稳定大小的因素
金属离子方面
离子电荷 离子半径 电子层结构
外界条件的影响
溶液的酸度 溶液的温度 其他配位剂的存在
M+ Y
MY 主反应
分析化学《配位滴定》课件

EDTA 水溶性稍差 (溶解度 0.2 gL-1),故分析中使用
EDTA 二钠盐 Na2H2Y (溶解度 110 gL-1)
EDTA
EDTA 与大多数金属离子在室温下快
速反应,生成 1:1 螯合物 (chelate)
Mn+ + H4Y = MY(n-4)+ + 4H+
第四章 配位滴定
配位反应和滴定分析
配位反应非常多,但可用于滴定分析的很少
“汞量法”配位滴定:Hg 2+ + Cl− ⇌ HgCl2 ,
或者Hg 2+ + 2SCN− ⇌ Hg(SCN)2
+
−
“氰量法”配位滴定:Ag + 2CN ⇌
−
AgCN2
或者Ni2+ + 4CN − ⇌ NiCN42−
究 M-EDTA 配位体系。
参与主反应,浓度 [MY]
金属离子 M 去向
未参与主反应,浓度[M]
物料平衡:cM = [MY] + [M]
对比
物料平衡:cM = [MY] + [M] + [ML] + [ML2] + …
基础概念
第四章第一节
1. 表观浓度使定量表达式简洁
无论发生何种副反应、无论有多少副反应
副反应系数
条件稳定常数 (代替稳定常数)
′
计算:M、Y、MY
有时需要近似处理才能得到
第四章第一节
基础概念
配位平衡体系的精确解析策略
等式:物料平衡式
概念: Y ′′ = [Y]Y(H)
′′
=
Y(H)
济南大学 分析化学课件 配位滴定2
(
(4) pH=12时 ,同理可得:Zn(OH)=108.50,Zn(NH3)=105.10
络 合
则: Zn=Zn(OH)+Zn(NH3)-1 Zn(OH) =108.50+105.10-1=108.50
滴 计算表明,在pH5、10的情况下可以忽略金属离子的水解效应的影响,
定 法
)
尽管在pH=10时水解效应增加,但相对配位效应仍可以忽略;在pH=11 时两种效应势均力敌,必须同时考虑它们的影响;当pH升至12时,主 要以Zn2+的水解效应为主。
第 例5:计算pH=5、10、11、12时,当溶液中游离的氨的平衡浓度均为
三 章
0.1mol/L时,Zn2+的总副反应系数。已知,Zn(OH)42+的lg1~lg4为 4.4,10.1,14.2,15.5;Zn(NH3)42+的lg1~lg4为2.27,4.61,7.01,9.06。
(p101eg8)
(
络
,Y(H)越小。它反映了酸度对滴定剂的影响程度.
合
滴 定
当Y(H)=1时,不存在酸效应的影响。
法
)
1
§4 副反应系数和条件稳定常数
第
三 例1 计算pH=5.00时,αCN(H)及lgαCN(H)。
章 配
αCN(H)=1+KH[H+] =1+109.21×10-5.00=104.21
位 滴
lgαCN(H)=4.21
1 K1H
H
K1H
K
H 2
H
2
K1H
K
H 2
K
H 6
H
分析化学教案第六章

第五章:配位滴定法§5-1概述一、配位滴定法:以配位反应为基础的滴定分析方法。
例:AgNO3标液滴定CN-:Ag++ 2CN-⇌[Ag(CN)2]- , K=1.0⨯1021滴定达到化学计量点时,多加一滴AgNO3溶液,Ag+就与[Ag(CN)2]-反应生成白色的Ag[Ag(CN)2]-沉淀,以指示终点的到达。
终点反应为:[Ag(CN)2]-+ Ag+⇌Ag[Ag(CN)2]-配合物的稳定性以配合物稳定常数K稳表示。
配位反应在分析化学中应用非常广泛,许多显色剂、萃取剂、沉淀剂、掩蔽剂等都是配合物。
二. 配合物的分类(一)无机配位剂(一般无机配位剂很少用于滴定分析)原因:⑴与金属离子形成的配位化合物不够稳定;⑵存在逐级配位现象,化学计量关系不稳定。
M + n L == ML n (L只有一个配位原子)与多元酸相似,无机配合物通常是逐级形成的(分步),一般稳定性不高。
例:配合离子Cu(NH3)42+的形成过程Cu + NH3== Cu(NH3)2+k1 = 1.4⨯104Cu(NH3)2++ NH3== Cu(NH3)22+k2 = 3.1⨯103Cu(NH3)22++ NH3== Cu(NH3)32+k3 = 7.8⨯102Cu(NH3)32++ NH3== Cu(NH3)42+k4 = 1.4⨯102(1)分步稳定常数:k,1/k = k离,n ——分步离解常数(2)累计稳定常数:β第一级累积稳定常数β1 = k1第二级累积稳定常数β2= k1k2┇┇第n级累积稳定常数β4 = k1 k2…k n(3)总稳定常数K:K= βn(二)有机配位剂(用于配位滴定的通常是有机配位剂,而有机配位剂中最常用的又是氨羧配位剂)氨羧配位剂指:含有—N(CH2COOH)2基团的有机化合物。
几乎能与所有金属离子配合。
目前已研究的有几十种,重要的有:乙二胺四乙酸(EDTA)、氨三乙酸(NTA)、乙二胺四丙酸(EDTP)等。
《 配位滴定法》课件

2
添加指示剂
根据滴定剂的特性选择合适的指示剂,并将其添加到待测样品中。
3
滴定过程
缓慢滴加滴定剂到待测样品中,观察指示剂颜色的变化,直到达到滴定终点。
4
计算结果
根据滴定剂的浓度以及滴定过程中消耗的体积,计算出样品中配位物的浓度或相关参 数。
实验结果及分析
滴定终点的颜色变化
观察滴定过程中指示剂的 颜色变化,确定滴定终点 并记录所消耗的滴定剂体 积。
2 注意实验条件的控制
实验过程中需要控制温度、pH值等条件,确保实验结果的可重复性和准确性。
3 确性。
参考文献
1. 何昊, 张二华, 张家瑞. 分析化学定量分析基础[M]. 高等教育出版社, 2017. 2. Gary D. Christian, Kevin A. Schug, and David H. O’ Hair. Analytical Chem istry[M]. John
2 评估配位物的稳定
性
通过滴定过程中反应的 终点变化,我们可以评 估配位物的稳定性,并 了解其在不同条件下的 反应特性。
3 研究化学反应的动
力学
通过配位滴定法测定配 位物与滴定剂反应的速 率,我们可以探索不同 反应条件下的化学反应 动力学过程。
实验原理
滴定剂与配位物的反应
滴定剂会与待测样品中的配位 物发生反应,滴定剂的浓度可 以通过滴定过程中的体积变化 来确定。
《配位滴定法》PPT课件
通过这个PPT课件,我们将详细介绍《配位滴定法》的实验目的、实验原理、 实验步骤、实验结果及分析、实验注意事项以及参考文献。希望能够清晰明 了地向大家展示这一实验方法的重要性和应用价值。
实验目的
1 确定配位物的化学
【分析化学课件】配位滴定第2讲

= 7.0 – 1.6 = 5.4
不同pH下EBT的(pMg)t
pH (pMg)t 5.0 0 6.0 1.0 7.0 2.4 8.0 3.4 9.0 10.0 11.0 12.0 4.4 5.4 6.3 6.9
(pM)t 可查有关数据表
注意:(pM)t 即为滴定终点的(pM)ep,
多为实验测得.
四、常用金属指示剂
金属指示剂的作用原理 EDTA In + M MIn + M A色 MY + In B色
要求: 1)A、B颜色不同(合适的pH); 2)反应快,可逆性好; 3)稳定性适当,KMIn < KMY .
EBT(铬黑T)
ON N
-
HO
O3S
+ Mg2+
HIn2- (蓝)
NO2 O Mg N N
3、化学计量点时
Ca2+与EDTA几乎全部络合成CaY2-络离子:
20.00 [CaY2-]=0.02000×20.00 20.00 = 1.00×102 -1
mol· L 同时,pH=10.00时, [Ca2+]=[Y]=x mol· -1 L 即
0.01 x2
= 1010.24(生成反应)
K 'MIn
MIn K M In
MIn In H
1 当[MIn]=[In]时,K’ MIn= [M]t
pM t = lg K 'MIn = lg K MIn - lg In H pMt = lg K MIn - lg In H - lg M = pM t - lg M
200
五、配位滴定与酸碱滴定的比较
六、终点误差计算(林邦公式)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
LOGO
第六节 混合离子的分别滴定
一、单一离子测定的滴定条件
▪ 1.准确滴定的判定式:
pM 0.2,TE% 0.1%
满足CM
K
' MY
106
或
lg
CM
K
' MY
6
准确滴定判别式
lg
C
M
K
' MY
6
当CM
0.01mol
/
L
满足
lg
K
' MY
8
分析化学第六讲配位滴定二
LOGO
→加快置换速度
分析化学第六讲配位滴定二
第五LO节GO 金属指示剂
及其它指示终点的方法
五、常用金属离子指示剂
1. 铬黑T(EBT) 终点: 酒红→纯蓝 适宜的pH: 7.0~11.0(碱性区) 缓冲体系: NH3-NH4CL 封闭离子: AL3+,Fe2+,(Cu2+,Ni2+) 掩蔽剂: 三乙醇胺,KCN
注:低于最低酸度,
M(OH)
,K
' MY
,TE%
分析化学第六讲配位滴定二
LOGO
第六节 混合离子的分别滴定 3.缓冲溶液的作用 ▪ 作用——控制溶液酸度
使EDTA离解的H+不影响pH值 ▪ EBT(碱性区)→加入NH3-NH4CL(pH=8~10) ▪ XO(酸性区)→加入HAc-NaAc(pH=5~6)
及其它指示终点的方法
3. PAN 1-(2-吡啶偶氮)-2-奈酚 终点: 紫红→绿 适宜的pH范围 1.9-12 封闭离子: Ni2+ 掩蔽剂: 三乙醇胺,氟化胺 不可同时加入能与铜离子形成更稳 定配合物的掩蔽剂
分析化学第六讲配位滴定二
第五LO节GO 金属指示剂
及其它指示终点的方法
六、其它指示终点的方法 1、光度滴定法 利用分光光度计指示配位滴定过程中反应物或者产物的颜 色强度的变化。例如,铜的水和离子颜色较浅,而铜与 EDTA配合物呈深蓝绿色,在波长650nm处有强烈的吸收, 在pH=5时用EDTA滴定铜离子,以EDTA的体积为横坐标, 吸光度为纵坐标,得到滴定曲线,通过切线法可确定滴定 终点。 2、电位滴定 利用汞或银指示电极,或者离子选择电极的电位变化,指 示滴定过程中金属离子浓度的变化,制作滴定曲线,通过 切线法确定滴定终点。
显游离指示剂颜色
▪ 变色实质:EDTA置换少量与指示剂配位的金属离子
▪ ▪ 注:
释放指示剂,从而引起溶液颜色的改变
§ In为有机弱酸,颜色随pH值而变化→注意控制溶液的pH值 § EDTA与无色M→无色配合物,与有色M→颜色更深配合物
分析化学第六讲配位滴定二
第五LO节GO 金属指示剂
及其它指示终点的方法
LOGO
第六节 混合离子的分别滴定 (一) 控制酸度分步滴定
三、指示剂应具备的条件
▪ 1)MIn与In颜色明显不同,显色迅速,变色可逆性好
▪ 2)MIn的稳定性要适当:KMY / KMIn >100
▪
a. KMIn太小→置换速度太快→终点提前
▪
b. KMIn >KMY→置换难以进行→终点拖后或无终点
▪ 3)In本身性质稳定,便于储藏使用
▪ 4)MIn易溶于水,不应形成胶体或沉淀
第六节 混合离子的分别滴定
2.滴定适宜酸度范围(最高~ 最低允许酸度)
设仅有Y的酸效应和M的水解效应
lg
K
' MY
lg
KMY
lg Y (H )
lg M (OH)
1)最高允许酸度:
由lg KM' Y lg KMY lg Y (H ) lg Y (H ) lg KMY lg KM' Y
▪ 待测离子: KMY < KMIn→M与In反应不可逆或过慢 ▪ 消除方法:返滴定法
例如:滴定AL3+定过量加入EDTA,反应完全后再加入 EBT,用Zn2+标液回滴
分析化学第六讲配位滴定二
第五LO节GO 金属指示剂
及其它指示终点的方法
❖ 指示剂的僵化现象:化学计量点时指示剂变色缓慢
产生原因 ▪ MIn溶解度小→与EDTA置换速度缓慢→终点拖后 ▪ 消除方法:加入有机溶剂或加热→提高MIn溶解度
▪ 特点:(与酸碱指示剂比较) 金属离子指示剂——通过[M]的变化确定终点 酸碱指示剂——通过[H+] 的变化确定终点
分析化学第六讲配位滴定二
第五LO节GO 金属指示剂
及其它指示终点的方法 二、指示剂配位原理
终点前 M + In
滴定过程 M + Y
MIn 显配合物颜色 MY
终点
Min + Y
MY + In (置换)
已知CM
0.01mol
/
L时,满足
lg
K
' MY
8
lg Y(H) lg KMY 8 查表求得最高酸度
注:超过最高酸度,Y(H)
,K
' MY
,TE%
分析化学第六讲配位滴定二
LOGO
第六节 混合离子的分别滴定
▪ 2)最低允许酸度
OH n K SP(MOH) [M ]
最低酸度 pH 14 pOH
LOGO
第六讲 配位滴定(二)
分析化学第六讲配Байду номын сангаас滴定二
本LO讲GO内 容
金属指示剂及其它指示终点的方法 混合离子的分别滴定 配位滴定的方式和应用
分析化学第六讲配位滴定二
第五LO节GO 金属指示剂
及其它指示终点的方法
一、金属离子指示剂及特点:
▪ 金属离子指示剂:配位滴定中,能与金属离子生
成有色配合物从而指示滴定过程中金属离子浓度 变化的显色剂(多为有机染料、弱酸)。
分析化学第六讲配位滴定二
第五LO节GO 金属指示剂
及其它指示终点的方法
四、指示剂的封闭、僵化现象及消除方法
❖ 指示剂的封闭现象:化学计量点时不见指示剂变色
产生原因: ▪ 干扰离子: KNIn > KNY →指示剂无法改变颜色
▪ 消除方法:加入掩蔽剂 例如:滴定Ca2+和Mg2+时加入三乙醇胺掩蔽Fe3+,AL3+ 以消除其对EBT的封闭
分析化学第六讲配位滴定二
第五LO节GO 金属指示剂
及其它指示终点的方法
2. 二甲酚橙(XO) 终点: 紫红→亮黄 适宜的pH范围 <6.0(酸性区) 缓冲体系: HAc-NaAc 封闭离子: AL3+,Fe2+,(Cu2+,Co2+,Ni2+) 掩蔽剂: 三乙醇胺,氟化胺
分析化学第六讲配位滴定二
第五LO节GO 金属指示剂
分析化学第六讲配位滴定二
LOGO
第六节 混合离子的分别滴定
二、提高混合离子配位滴定的选择性 ✓ 前提:几种离子共存——M,N(干扰离子)
K MY K NY 有可能在 N存在下准确滴定 M K MY K NY 无法准确滴定 M,应先掩蔽 N
▪ 控制酸度分步滴定 ▪ 使用掩蔽剂选择性滴定
分析化学第六讲配位滴定二
