无机及分析化学课件之配位平衡和配位滴定法
合集下载
无机及分析化学第九章 配位滴定法

注: 指示剂的颜色随pH而变化→注意控制溶液的pH
第六章
配位化合物
二、指示剂应具备的条件
1)MIn与In颜色明显不同,显色迅速,变色 可逆性好 2)MIn的稳定性要适当:KMY / KMIn >102 a. KMIn太小→置换速度太快→终点提前 b. KMIn 太大→置换难以进行→终点拖后或 无终点 3) In本身性质稳定,便于储藏使用 4)MIn易溶于水,不应形成胶体或沉淀
第六章
配位化合物
表观稳定常数K’稳越大,突跃范围越大。
cM=0.01mol· -1, L K’稳<108,无突跃。
第六章
配位化合物
溶液酸度
lgK’稳= lgK稳 – lgα
pH↑→酸效应系数α ↓ →K’稳↑ →突跃范围↑
第六章
配位化合物
金属离子被准确滴定的条件
lgcMK'稳≥6 若cM=0.01mol/L, lg(0.01×K'稳)≥6 则:lgK’稳≥8
CNK’NY稳<106
第六章
配位化合物
几种离子共存——M,N( N为干扰离子)
a. MY的允许最低 pH比NY的低:
N M
控制酸度, 减小K’NY
使 CNK’NY<106 ; CMK’MY>106
b. MY的允许最低 pH比NY的高:
第六章
配位化合物
3.钙指示剂(简称NN或钙红): 紫黑色粉末
终点:酒红→纯蓝
适宜pH:12.0~13.0(碱性区) pKa1=9.26 pKa2=13.67
H2In2pH<8
HIn3-+H+
pH=8~13
In4-+2H+
pH>13
酒红色
第六章
配位化合物
二、指示剂应具备的条件
1)MIn与In颜色明显不同,显色迅速,变色 可逆性好 2)MIn的稳定性要适当:KMY / KMIn >102 a. KMIn太小→置换速度太快→终点提前 b. KMIn 太大→置换难以进行→终点拖后或 无终点 3) In本身性质稳定,便于储藏使用 4)MIn易溶于水,不应形成胶体或沉淀
第六章
配位化合物
表观稳定常数K’稳越大,突跃范围越大。
cM=0.01mol· -1, L K’稳<108,无突跃。
第六章
配位化合物
溶液酸度
lgK’稳= lgK稳 – lgα
pH↑→酸效应系数α ↓ →K’稳↑ →突跃范围↑
第六章
配位化合物
金属离子被准确滴定的条件
lgcMK'稳≥6 若cM=0.01mol/L, lg(0.01×K'稳)≥6 则:lgK’稳≥8
CNK’NY稳<106
第六章
配位化合物
几种离子共存——M,N( N为干扰离子)
a. MY的允许最低 pH比NY的低:
N M
控制酸度, 减小K’NY
使 CNK’NY<106 ; CMK’MY>106
b. MY的允许最低 pH比NY的高:
第六章
配位化合物
3.钙指示剂(简称NN或钙红): 紫黑色粉末
终点:酒红→纯蓝
适宜pH:12.0~13.0(碱性区) pKa1=9.26 pKa2=13.67
H2In2pH<8
HIn3-+H+
pH=8~13
In4-+2H+
pH>13
酒红色
配位平衡和配位滴定法PPT课件
第2页/共44页
形成配合物的条件
配位键是配合物与其它物质最本质的区别
第3页/共44页
第4页/共44页
(1)中心原子:
中心原子又称中心体。根据配位化合物的 定义,中心原子是配合物中具有接受孤对 电子或能提供空轨道的离子或原子。
例: [SiF6]2-
[FeF6]3- Fe(CO)5 Ni(CO)4
22
第22页/共44页
4.无外界的配合物
[Ni(CO)4] 四羰基合镍 [Pt(NH3)2Cl2] 二氯•二氨合铂(Ⅱ)
第23页/共44页
练习:命名下列配合物
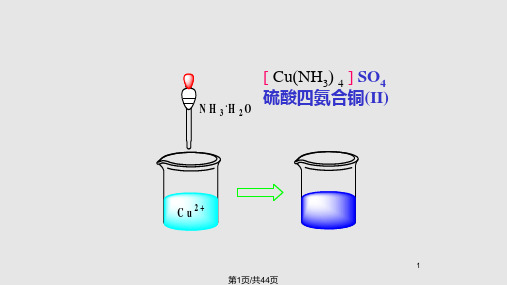
Cu(3)N 4SH O 4 硫酸四氨合铜(Ⅱ) K3Fe(NC 6S) 六异硫氰根合铁(Ⅲ)酸钾
Cu(3)N 4(H O2H)氢氧化四氨合铜(Ⅱ) Co2)(3(N N 3)O 3H三硝基•三氨合钴(Ⅲ)
EDTA配合物的结构
第10页/共44页
第11页/共44页
不是配体
(3) 配位数(coordination number) 的数目 配合物中,直接与中心原子配合的配位原 子的数目称为中心原子的配位数。
单齿配体: 配位数 = 配体的总数 多齿配位体:配位数 = 配体数*齿数
第12页/共44页
[Ca(EDTA)]2-或CaY2-
④同一金属离子,配体离子半径越大,配位数越小
如[AlF6]3- , [AlCl4]-
第16页/共44页
4、 配离子的电荷
配离子的电荷数 = 中心离子与配位体电荷的 代数和
如[Fe(CN)6]x x = 3 + (-1) 6 = 3
可由外界离子所带的电荷总数求得
[Co(en)3]Cl3
[Co(en)3]3+
形成配合物的条件
配位键是配合物与其它物质最本质的区别
第3页/共44页
第4页/共44页
(1)中心原子:
中心原子又称中心体。根据配位化合物的 定义,中心原子是配合物中具有接受孤对 电子或能提供空轨道的离子或原子。
例: [SiF6]2-
[FeF6]3- Fe(CO)5 Ni(CO)4
22
第22页/共44页
4.无外界的配合物
[Ni(CO)4] 四羰基合镍 [Pt(NH3)2Cl2] 二氯•二氨合铂(Ⅱ)
第23页/共44页
练习:命名下列配合物
Cu(3)N 4SH O 4 硫酸四氨合铜(Ⅱ) K3Fe(NC 6S) 六异硫氰根合铁(Ⅲ)酸钾
Cu(3)N 4(H O2H)氢氧化四氨合铜(Ⅱ) Co2)(3(N N 3)O 3H三硝基•三氨合钴(Ⅲ)
EDTA配合物的结构
第10页/共44页
第11页/共44页
不是配体
(3) 配位数(coordination number) 的数目 配合物中,直接与中心原子配合的配位原 子的数目称为中心原子的配位数。
单齿配体: 配位数 = 配体的总数 多齿配位体:配位数 = 配体数*齿数
第12页/共44页
[Ca(EDTA)]2-或CaY2-
④同一金属离子,配体离子半径越大,配位数越小
如[AlF6]3- , [AlCl4]-
第16页/共44页
4、 配离子的电荷
配离子的电荷数 = 中心离子与配位体电荷的 代数和
如[Fe(CN)6]x x = 3 + (-1) 6 = 3
可由外界离子所带的电荷总数求得
[Co(en)3]Cl3
[Co(en)3]3+
无机及分析化学全套课件第八章 配位化合物与配位滴定

[Ni(CO) 4]
只有内界无外界, 电荷为零
2019/2/20
第八章 配位化合物与配位滴定
14
8.1.2 配位化合物的命名
配合物的命名:阴离子在前,阳离子在后; 配阳离子 [Co(NH3)6]Br3 三溴化六氨合钻(Ⅲ) (某化某、某酸某) 配阴离子 K2[SiF6] 六氟合硅(Ⅳ)酸钾 (某酸某) 配体数—配体名称—合—中心离子(罗马数字表示氧化数) 配体数用二、三等中文数字表示;配体间用圆点“·” 分开,也可省略; 配体次序:阴离子—中性配体;无机—有机配体; 阴离子次序:简单离子—复杂离子—有机酸根离子。 中性分子次序:按配位原子元素符号英文字母顺序排列。
2019/2/20
第八章 配位化合物与配位滴定
8
2019/2/20
第八章 配位化合物与配位滴定
9
常见单齿配体
中性分子 配体 配位原子 阴离子 配体 配位原子 阴离子 配体 配位原子 F氟 F H2O 水 O Cl- Br氯 溴 Cl Br NH3 氨 N I碘 I CO 羰基 C OH羟基 O CN氰 C CH3NH2 甲胺 N NO2硝基 N
30
外轨型配合物与内轨型配合物性质的差异:
* 磁性 外轨型配合物,单电子数多,磁矩大; 内轨型配合物,单电子数减少,磁矩减小。 * 稳定性 内轨型配合物的键能大,较稳定,在水中 不易离解。 外轨型配合物的健能小,不稳定,在水中 易离解。
2019/2/20
第八章 配位化合物与配位滴定
31
*配合物几何构型实例
22
外轨型配合物
全部由最外层ns、np、nd 轨道 杂化所形成的配位化 合物称 外轨型配合物,该类配合物键能小,稳定性较 低。
4
2019/2/20
第七章配位平衡与配位滴定精品PPT课件

第一节 配位化合物
一、配合物的定义
许多化合物可看似由简单化合物“加合”而成,例如:
Cu4 S 4N O 3 H [Cu 3)4 (]S N 4O H S4 i F2H F H 2[S6]iF
Ni4CO [Ni(C4]O)
在化合过程中,既没有质子的传递,又没有形成新的传统意义的 共价键。实际上,它们是形成了复杂离子的配位化合物(简称配合物)。
2、配位体和配位原子
与中心离子或中心原子结合的中性分子或阴离子成为配位体,简 称配体。直接与中心离子或原子以配位键结合的原子称为配位原子。
单齿配体-----提供一对孤对电子的配体 多齿配体-----两个及以上的原子提供多对孤对电子的配体
(形成螯合物)
基础化学
第七章 配位平衡与配位滴定
3、配位数---中心原子结合的配位原子总数 多为2 3 4 5 6 7 8,与中心离子电荷有关,与配位体有关。
外界
[Fe(CN)6]3+
配
离
中配 心体 原
子
配 位 数
配 离 子 电
子
荷
基础化学
第七章 配位平衡与配位滴定
1、中心离子(或原子)
中心离子(或中心原子)是配合物的形成体,位于配合物的中心,一
般 为 带 正 电 荷 的 金 属 离 子 或 中 性 原 子 。 例 如 [ Cu(NH3)4 ] SO 4 中 的 Cu2+, H2[SiF6] 中的Si2+等。
H2[PtCl6] [Cu(NH3)4]SO4
六氯合铂(Ⅳ)酸 K4[Fe(CN)6] 硫酸四氨合铜(Ⅱ) [PtCl4(NH3)2]
六氰合铁(Ⅱ)酸钾 四氯·二氨合铂(Ⅳ)
[Co(NH3)5(H2O)]Cl3 [Co(NH3)6]Cl3
第八章配位平衡和配位滴定法ppt课件

K f
1
(
K
a
)6
Kf越小,即生成的配合物稳定性越小;Ka越小, 即生成 的酸越弱,K就越大。
Fe3+ + 6F3OH-
[FeF6]3+
Fe(OH)3↓
既要考虑配位体的酸效应,又要考虑金属离子的水解效应。
2. 沉淀反应对配位平衡的影响
[Cu(NH3) 4]2+
Cu2+ + 4NH3 +
S2-
CuS↓
y 2.2310-7
二、配位平衡的移动
Mn+ + x L-
水解 氧化还原 沉淀
酸效应
MLx(n-x)
1. 酸度的影响 2.沉淀影响 3.氧化还原的影响
1. 酸度的影响
Fe3+ + 6F+ 6H+
[FeF6]36HF
总反应为:[FeF6]3- +6H+
Fe3+ + 6HF
K
c(Fe3 ) c6 (HF) c(Fe3 ) c6 (HF) • c6 (F- ) c([FeF6 ]3 ) c6 (H ) c([FeF6 ]3 ) c6 (H ) c6 (F- )
2. 配位体和配位原子 有孤电子对
Na[BF4]中[BF4]-是配位体, F为配位原子. a 单基配位体(一个配位体中只有一个配位原子)
含氮配位体 NH3 、 NCS-
含氧配位体 H2O 、 OH-
含卤素配位体 F- 、 CI- 、 Br- 、 I- 含碳配位体 CN- 、 CO
含硫配位体 SCN-
代入稳定常数表达式得:
Kf
c(Ag(NH3 )2 ) c(Ag )c2 (NH3 )
8_配位平衡与配位滴定法

6/11/2015
类型
Inorganic & Analytical Chemistry
上一页
下一页
材料科学与化学工程学院
配位原子:能提供孤对电子,直接与中 心原子或离子结合的原子。 单基配体(亦称“单齿配体”)( unidentate ligand):只含一个配位原子的配体。 多基配体(亦称“多齿配体”)(multidentate ligand):含有两个或两个以上配位原子的配体。
Ag+ + 2NH3 ⇌
Ag(NH3)2+
0 0.02-x ≈0.02
起始浓度/mol· L-1 0.02 1.0 平衡浓度/mol· L-1 x 1.0-2×0.02+2x ≈0.96 + c[Ag(NH3 )2 ] 0.02 Kf + 2 c(Ag )c (NH3 ) x 0.962
通常,在配位反应中会加 入相当过量的配体,促使 配位平衡向右移动,以保 证达到最大的配位数,使 用总稳定常数即可! 最后一级累积稳定常数
显然
6/11/2015
n K f
=
配合物总的稳定常数
上一页 下一页
Inorganic & Analytical Chemistry
材料科学与化学工程学院
(1962合成第一个惰性元素的化合物)
6/11/2015
Inorganic & Analytical Chemistry
上一页
下一页
材料科学与化学工程学院
二、配合物的价键理论——略
价键理论要点 1) 中心离子与配位体之间的化学键是配位键。 2) 中心离子提供空轨道,配体提供孤对电子。 3) 中心离子的空轨道在成键过程中进行了 杂化,杂化轨道的类型决定配合物的空 间构型。
类型
Inorganic & Analytical Chemistry
上一页
下一页
材料科学与化学工程学院
配位原子:能提供孤对电子,直接与中 心原子或离子结合的原子。 单基配体(亦称“单齿配体”)( unidentate ligand):只含一个配位原子的配体。 多基配体(亦称“多齿配体”)(multidentate ligand):含有两个或两个以上配位原子的配体。
Ag+ + 2NH3 ⇌
Ag(NH3)2+
0 0.02-x ≈0.02
起始浓度/mol· L-1 0.02 1.0 平衡浓度/mol· L-1 x 1.0-2×0.02+2x ≈0.96 + c[Ag(NH3 )2 ] 0.02 Kf + 2 c(Ag )c (NH3 ) x 0.962
通常,在配位反应中会加 入相当过量的配体,促使 配位平衡向右移动,以保 证达到最大的配位数,使 用总稳定常数即可! 最后一级累积稳定常数
显然
6/11/2015
n K f
=
配合物总的稳定常数
上一页 下一页
Inorganic & Analytical Chemistry
材料科学与化学工程学院
(1962合成第一个惰性元素的化合物)
6/11/2015
Inorganic & Analytical Chemistry
上一页
下一页
材料科学与化学工程学院
二、配合物的价键理论——略
价键理论要点 1) 中心离子与配位体之间的化学键是配位键。 2) 中心离子提供空轨道,配体提供孤对电子。 3) 中心离子的空轨道在成键过程中进行了 杂化,杂化轨道的类型决定配合物的空 间构型。
第十章 配位平衡和配位滴定法

+ 3 2 −1
⑵ 判断两种配离子之间转化的可能性 例题 25℃时 Ag(NH3 )+ 溶液中 2
+ 3 2 −1 −1
c(Ag(NH ) ) = 0.10m ⋅ L ,c(NH3 ) =1.0m ⋅ L , ol ol
2 加入Na2S2O3 使 c(S2O3− ) =1.0m ⋅ L−1 ,计算平 ol
d
同类型的配离子 K ↑ 稳定性↑
f
Cu + NH3 Cu(NH3 )
2+ 2+ 3 2
2+
2+ 2+ 3 2
K =10
f,1 f,2 2+ 3 3 f,3
4.31 3.67
Cu(NH3 ) + NH3 Cu(NH )
K =10 K =10
Cu(NH ) + NH3 Cu(NH )
2
c(Ag(NH3 )+ ) = 8.7×10−8 m ⋅ L−1 ol 2 c(NH3 ) =1.2m ⋅ L−1 ol
配合物形成时的特征
1.颜色的改变
3− 6
Fe(H2O)3+ + 6NCS− Fe(NCS)3− + 6H2O 6 6
血 红 − 3− 6 无 色 −
Fe(NCS) + 6F FeF + 6NCS
衡时溶液中NH3、 Ag(NH ) 的浓度。
+ 3 2
已 知:K (Ag(NH ) ) =10
f f 3− 3 2
+ 3 2
7.05 13.46
K (Ag(S2O ) ) =10
Ag(NH ) + 2S2O 反应前 c 0.10 反应后 c 0 平 衡c x 1.0
⑵ 判断两种配离子之间转化的可能性 例题 25℃时 Ag(NH3 )+ 溶液中 2
+ 3 2 −1 −1
c(Ag(NH ) ) = 0.10m ⋅ L ,c(NH3 ) =1.0m ⋅ L , ol ol
2 加入Na2S2O3 使 c(S2O3− ) =1.0m ⋅ L−1 ,计算平 ol
d
同类型的配离子 K ↑ 稳定性↑
f
Cu + NH3 Cu(NH3 )
2+ 2+ 3 2
2+
2+ 2+ 3 2
K =10
f,1 f,2 2+ 3 3 f,3
4.31 3.67
Cu(NH3 ) + NH3 Cu(NH )
K =10 K =10
Cu(NH ) + NH3 Cu(NH )
2
c(Ag(NH3 )+ ) = 8.7×10−8 m ⋅ L−1 ol 2 c(NH3 ) =1.2m ⋅ L−1 ol
配合物形成时的特征
1.颜色的改变
3− 6
Fe(H2O)3+ + 6NCS− Fe(NCS)3− + 6H2O 6 6
血 红 − 3− 6 无 色 −
Fe(NCS) + 6F FeF + 6NCS
衡时溶液中NH3、 Ag(NH ) 的浓度。
+ 3 2
已 知:K (Ag(NH ) ) =10
f f 3− 3 2
+ 3 2
7.05 13.46
K (Ag(S2O ) ) =10
Ag(NH ) + 2S2O 反应前 c 0.10 反应后 c 0 平 衡c x 1.0
无机化学及分析化学 配位滴定法

所以,在配位滴定中选择和控制溶液的酸度十分重要。 条件稳定常数公式也可表示为: 9
7.4
配位滴定法
7.4.1 滴定曲线和滴定条件 7.4.2金属指示剂 7.4.3 提高配位滴定选择性的方法 7.4.4 配位滴定方式及其应用
7.4.1 滴定曲线和滴定条件: 1、滴定曲线
例:
滴定过程中,用金属离子浓度负对数pM值变化 表示其滴定曲线。
0.01000× 20.00 3 1 5.0 ×10 mol · [CaY ] L 20.00 20.00
因为: [Ca2+] = [Y ]
'
[Ca ]
2
5.0 10 10.68 10
×
3
1 3.3 ×10 7 mol · L
pCa2+=-lg(3.3×10-7)=
没有其它络 合剂的影响
lgKCaY ' lg K CaY lg aY ( H ) 10.68
即
K CaY ' 10
10 .68
13
(1)滴定前: c(Ca2+)为原始浓度决定。 [Ca2+] = 0.01000 mol· L-1
pCa = -lg 0.01000 = 2.0
(2)计量点前-0.1%:Ca2+ + CaY2若加入EDTA为19.98ml,溶液中Ca2+为:
[ H ] [ H ]2 [ H ]3 [ H ]6 1 K a6 K a6 K a5 K a6 K a5 K a 4 K a 6 K a 5 K a 4 K a 3 K a 2 K a1 1 [H ]1 [H ]2 2 [H ]6 6
27
7.4
配位滴定法
7.4.1 滴定曲线和滴定条件 7.4.2金属指示剂 7.4.3 提高配位滴定选择性的方法 7.4.4 配位滴定方式及其应用
7.4.1 滴定曲线和滴定条件: 1、滴定曲线
例:
滴定过程中,用金属离子浓度负对数pM值变化 表示其滴定曲线。
0.01000× 20.00 3 1 5.0 ×10 mol · [CaY ] L 20.00 20.00
因为: [Ca2+] = [Y ]
'
[Ca ]
2
5.0 10 10.68 10
×
3
1 3.3 ×10 7 mol · L
pCa2+=-lg(3.3×10-7)=
没有其它络 合剂的影响
lgKCaY ' lg K CaY lg aY ( H ) 10.68
即
K CaY ' 10
10 .68
13
(1)滴定前: c(Ca2+)为原始浓度决定。 [Ca2+] = 0.01000 mol· L-1
pCa = -lg 0.01000 = 2.0
(2)计量点前-0.1%:Ca2+ + CaY2若加入EDTA为19.98ml,溶液中Ca2+为:
[ H ] [ H ]2 [ H ]3 [ H ]6 1 K a6 K a6 K a5 K a6 K a5 K a 4 K a 6 K a 5 K a 4 K a 3 K a 2 K a1 1 [H ]1 [H ]2 2 [H ]6 6
27
