第13章__立体异构现象
武汉大学版无机化学课后习题答案(第三版)第13章 配位化学原理

配位化学基础1.某物质的实验式为PtCl 4・2NH 3,其水溶液不导电,加入AgNO 3亦不产生沉淀,以强碱处理并没有NH 3放出,写出它的配位化学式。
解[Pt(NH 3)2Cl 4]2. 下列化合物中哪些是配合物?哪些是螯合物?哪些是复盐?哪些是简单盐?(1)CuS0”・5HQ (2)KPtCl4226(3)Co(NH 3)6Cl 3(4)Ni(en)2Cl 2(5)(NH )o S0/FeS0/6HQ (6)Cu (NHCHCOO )o42442222(7)Cu (OOCCH 3)2(8)KClMgCl 2・6H 2O 解配合物:K 2PtCl 6,C O (NH 3)6C13,C U SO 4・5H 2O螯合物:Ni(en)2Cl 2,Cu(NH 2CH 2COO)2复盐:(NH 4)2SO 4・FeSO 4・6H 2OKClMgCl^^O 简单盐:Cu(OOCH 3)2(3) 三氯化三(乙二胺)合钻(III ) (4) 氯化二氯•四水合钻(III ) (5) 二水合溴化二溴•四水合钻(III ) (6) 羟・水•草酸根•乙二胺合铬(III ) (7) 六硝基合钻(III )配阴离子 (8) 氯•硝基•四氨合钻(III )配阳离子(9)三氯•水•二吡啶合铬(III )(10)二氨•草酸根合镍(II )3. 命名下列各配合物和配离子:(1)(NH 4)3[SbCl 6] (3)[Co (en )3]Cl 3(5)[Cr (H 2O )4Br 2]Br.2H 2O (7)Co (NO 2)6]3 (9)[Cr (Py )2(H 2O )Cl 3] 解(1)六氯合锑(III )酸铵(2)四氢合铝(III )酸锂(2)Li[AlH 4] (4)[Co (H 2O )4Cl 2]Cl6)[Cr (H 2O )(en )(C 2O 4)(OH )2248)[Co (NH 3)4(NO 2)C]+ 10)[Ni (NH 3)2(C 2O 4)]4. 指出下列配合物的空间构型并画出它们可能存在的立体异构体:1)[Pt (NH 3)2(NO 2)Cl] 3)Pt (NH 3)2(OH )2Cl 2] 5)[Co (NH 3)3(OH )3] 7)[Cr (en )2(SCN )2]SCN 9)[Co (NH 3)(en )Cl 3](2)Pt (Py )(NH 3)ClBr] (4)NH 4[Co (NH 3)2(NO 2)4] (6)[Ni (NH 3)2Cl 2] (8)[Co (en )3]Cl 310)[Co (en )2(NO 2)2]Cl 2解(1)[Pt (NH 3)2(NO 2)Cl]平面正方形2种异构体H 3NH 3N3)[Pt(NH 3)2(OH)2Cl 2]八面体5种异构体H 3N 2)OHHOHONH 3210)[Co(en)2(NO 2)2]Cl 2ClNH 3 HOOH八面体7) 8) [Co(NH 3)3(OH)3]八面体 H 3NOH[Ni(NH 3)2Cl 2] 无异构体[Cr(en)2(SCN)2]SCN[Cr(en)2(SCN)2]-八面体 [Co(en)3]Cl 3[Co(en)3]3+ 八面体2种异构体[Co(NH 3)(en)Cl 3]八面体2种异构体5) 4)[Co(NH 3)2(NO 2)4]-NH 32种异构体NO 2NH3四面体 2种异构体NH 3SCNNCS2种异构体en24.90B.M 。
05-立体化学基础:手性分子2

COOH COOH
所有基团 都重合
H H
C C
H H CH3 3 CH
丙酸分子 没有手性
若实物与其镜像能够完全重合,则实物与镜像所 代表的两个分子为同一个分子。
8
但有些分子如乳酸, 两个互为实物与镜像关系的分 子不能重合。
COOH H C CH3 HOOC H3 C C HO
不能与其镜像重 合 的 分 子 称 为 手 性分 H 子(chiral molecule)。 它们是彼此成镜 像 关 系 , 又 不 能 重合 的 一 对 立 体 异 构 体, 互称为对映异构体 (enantiomer) 。 镜 像 的 不 重 合 性 是 产 生对 映 异 构 现 象 的 充 分必 要条件。
相同?
OH H H Cl CO2H CO2H HO Cl
CO2H H H CO2H
H
C C
CO2H OH H HO
CO2H H Cl CO2H
H
Cl CO2H
(1)
(2)
(3)
(4)
43
第四节
外消旋体
一对对映体的等量混合物称为外消旋体(racemic mixture 或 racemate)。通常用(±) 或 dl 表示。外消 旋体是混合物。
11
一个手性碳原子所连的4个不同原子或基团位于 四面体的四个顶角,在空间具有2种不同的排列方式 (也称两种构型), 它们彼此构成一对对映体。
* CH3CHCOOH
OH
乳酸
COOH C CH3 H
COOH H C OH CH3
HO
有一个手性碳的化合物必定是手性化合 物,只有一对对映体。
12
一对对映体有相同的物理性质
9
2020版高三化学大一轮复习__第十三章 有机化学基础_选修_ _课时作业 (2)

解析:有机物的合成,常采用逆推法,要生成 1,2-丙二醇, 则需要通过 1,2-二氯丙烷的水解反应,要生成 1,2-二氯丙烷,则 需要利用丙烯和氯气的加成反应,而丙烯的生成,可利用 2-氯丙 烷的消去反应,所以依次经过的反应类型为消去反应―→加成反 应―→取代反应。
7.(2019·山东滕州一中月考)下列关于甲、乙、丙、丁四种有机
解析:分析 C 与 G 反应产物的结构简式,结合流程可得, D(C2H2)为乙炔,与 Br2 加成生成 E(C2H2Br2),E 的结构简式为
;根据已知②可知,E 与 HCN 发生取代反应生成 F,F
)、
b
的说法正确的是( C )
A.a、b、c 的分子式均为 C8H8
B.a、b、c 均能与溴水发生反应
C.a、b、c 中只有 a 的所有原子会处于同一平面
D.a、b、c 的一氯代物中,b 有 1 种,a为 C8H8,c 的分子式为 C8H10,A 项 错误;a、c 分子中均含有碳碳双键,能与溴水发生加成反应,b 中不含不饱和键,不能与溴水发生反应,B 项错误;b、c 中均含 有饱和碳原子,所有原子不能处于同一平面,C 项正确;c 的一 氯代物有 7 种,D 项错误。
解析:Q 中两个甲基上有 6 个等效氢原子,苯环上有 2 个等 效氢原子,峰面积之比应为 3∶1,A 项错误;Q 中苯环上的卤 素原子无法发生消去反应,P 中与卤素原子相连的碳原子的邻位 碳原子上缺少氢原子,无法发生消去反应,B 项错误;在适当条 件下,卤素原子均可被 OH 取代,C 项正确;Q 中苯环上的氢原 子、甲基上的氢原子均可被氯原子取代,其一氯代物有 2 种,D 项错误。
物说法正确的是( B )
A.四种物质中分别加入氯水,均有红棕色液体生成 B.四种物质中加入 NaOH 溶液共热,然后加入稀硝酸至溶液 呈酸性,再滴入 AgNO3 溶液,均有沉淀生成 C.四种物质中加入 NaOH 的醇溶液共热,然后加入稀硝酸至 溶液呈酸性,再滴入 AgNO3 溶液,均有沉淀生成 D.乙发生消去反应得到两种烯烃
第十三章章 立体异构

第十三章立体异构学习目标掌握立体异构、顺反异构、旋光异构、构象异构的定义,产生顺反异构的条件和命名方法,手性分子的判断,旋光异构的表示方法和命名;熟悉构象异构的产生、表示方法及重叠构象、交叉构象、稳定构象、优势构象等基本概念。
了解顺反异构和旋光异构在性质上的差异及在医药上的应用。
有机化合物普遍存在同分异构现象,这是构成有机化合物种类繁多、结构复杂的原因之一。
分子的结构包括构造、构型和构象。
分子的构造是指有机化合物分子中的原子或原子团相互连接的顺序和方式。
分子的构型是指具有一定构造的分子中,由于原子在不同方向的连接所引起的原子或原子团在空间的排列方式。
分子的构象是指具有一定构型的化合物分子,由于单键的旋转或扭曲所产生的原子或原子团在空间排列方式。
分子组成相同,由于原子和原子间的连接方式不同而引起的异构现象称为构造异构。
前面各章介绍的碳链异构、位置异构、官能团异构、互变异构,都属于构造异构。
各种构造异构所形成的同分异构体之间,分子组成相同,但原子的连接方式不同。
分子组成相同,由于原子或原子团在空间的排列方式不同而引起的异构现象称为立体异构。
立体异构体的分子中,原子与原子间的连接方式相同,只是空间排列方式不同,这是与构造异构不同之处。
立体异构可分为构型异构和构象异构,构型异构又包括顺反异构和旋光异构。
同分异构的分类总结如下:分子的立体结构与其性质关系密切,同种化合物的不同异构体在性质上存在一定的差异,生理作用就可能不同。
学习立体异构方面的有关知识,对今后学习药学方面的专业课程十分必要。
第一节顺反异构一、 顺反异构在含有双键的有机物分子中,由于双键是由一个σ键和一个π键组成的,双键的旋转必然破坏π键,因此双键的旋转就受到了限制。
连在双键碳原子上的原子或原子团就会有不同的空间排列方式,即可以产生不同的构型。
例如:2-丁烯有两种不同的构型,可分别表示为:顺-2-丁烯 反-2-丁烯熔点-139.4℃ 熔点-105.4℃同理,在脂环化合物中的环内碳原子,由于受环本身的限制,不能绕碳碳单键旋转,当有两个或两个以上的成环碳原子所连的基团不同时,就会有不同的空间排列方式。
有机化合物的同分异构现象-高二化学课件(人教版2019选择性必修3)

对映异构——存在于手性分子中 手性分子——如果一对分子,它们的组成和 原子的排列方式完全相同,但如同左手和右 手一样互为镜像,在三维空间里不能重叠, 这对分子互称为手性异构体。有手性异构体 的分子称为手性分子。(分子内能找到对称 轴或对称中心的分子为非手性的)
丙氨酸的一对对映异构体模型
三、有机化合物的同分异构现象
A.具有相似的化学性质 B.具有相似的物理性质 C.具有相同的分子结构 D.分子式相同,但分子内碳原子的连接方式不同
[同步练习]
C 2. 下列说法正确的是
A.两种烃相对分子质量相同,但结构不同,性质也不同, 一定是同分异构体
B.有机物和无机物之间不可能出现同分异构体 C.两种有机物若互为同分异构体,则它们一定不互为同系物 D.两种烃所含有碳元素的质量分数相同,一定互为同分异构体
添H!
丙酸甲酯 C C COO C
丁酸甲酯?×
书写步骤:类别异构→碳架异构→位置异构
【思考与交流5】分子式为C5H10O2的羧酸、酯类的同分异构体有?种
4 + 9 =13
羧酸[C4H9—COOH]丁基(C4H9—)有4种,所以C4H9—COOH有4种
酯 甲酸丁酯 HCOO C4H9 4种
乙酸丙酯 C COO C3H7 2种 丙酸乙酯 C C COO C C 1种
物质的种类 烯烃、环烷烃 炔烃、二烯烃、环烯烃: 饱和一元链状醇、醚 饱和一元链状醛、酮 饱和一元羧酸、酯、羟基醛、羟基酮等
氨基酸、硝基化合物:
【思考与交流4】写出化学式C4H8O2的羧酸、酯类的同分异构体 6种
羧酸[C3H7—COOH] C C C COOH C C C
酯 甲酸丙酯
COOH
HCOO C C C HCOO C C 乙酸乙酯 C COO C C C
食品分析《农药残留的检测》(第13章)

2、农药加工落后,助剂研究滞后 我国原药与制剂比例较低,目前为1:9但发达国家为1: 10—30。 3、生产规模小,工艺技术落后,产品质量差,我国农药产 量约占全球的25%但销售额不足8%。 4、生物农药还应大力发展。 农药在防治农作物病虫害、控制人类传染病、提高农畜 产品的产量和质量以及确保人体健康等方面,都起着重要的 作用。但是,大量广泛用农药也会造成对食物的污染。 农药残留是指农药施用后,残存在生物体、农副产品和 环境中的微量农药原体、有毒代谢产物、降解物和杂质的总 称。残留的数量叫残留量。
小资料:我国将全面禁用5种高毒农药包括:甲胺磷、久效 磷、甲基对硫磷、对硫磷、磷胺。这5种农药目前年总产量 达10万吨;占我国农药生产总量的20%—25%。 禁用方案分3阶段:第一阶段(2004年1月1日—12月31日): 撤消5种高毒农药产品生产、销售、使用的有关证书,开始 部分禁用,使用比例下降15%。 第二阶段(2005年1月1日—2006年12月31日): 禁止5种高毒 农药原药生产企业外的其他企业生产或加工此类产品,并将 其使用范围局限于棉花、小麦、玉米、水稻4种作物。 第三阶段(2007年1月1日): 中国全面禁止5种高毒农药的使用。
样品的预处理 1.提取 — 用丙酮、己烷、乙醚、石油醚等。 2.净化—用H2SO4磺化处理,除脂肪、蜡质、色素等。 3.浓缩—K-D减压浓缩。 检验标准 GB/T 5009.19 (二)GC-ECD法测定有机氯农药残留 (三)TLC法测定有机氯农药残留
有机磷农药残留及其检测 (一)有机磷农药的特性及种类 1.常见的有机磷农药及其结构 有机磷农药(Organophosphorus Pesticides)是农药中一类含 磷的有机化合物,其种类很多,目前大量生产与使用至少有60 多种,按其毒性可分成高毒、中等毒及低毒三类;按其结构则 可划分为磷酸酯及硫代磷酸酯两大类,其结构通式如下: 根据R,Rl及X等基团 不相同,可构成不同 的有机磷农药。
13第十三章-不对称合成

羰基不对称加成——非螯合加成:
在无手性因素时,普通亲核试剂进攻羰基碳的 Re和Si面的几率相同,产物是一对外消旋体:
与手性碳相邻的羰基碳,由于手性碳的影响使 得Re面与Si面进攻能量存在差别,因此存在非 对映过量(de)
7:4
羰基不对称加成:非螯合加成
Cram(克拉姆)规则:
亲核进攻试剂主要通过位阻最小的一侧进攻
当存在特定金属时,它可与羰基氧及α-C上的 氧结合,这种螯合结构的形成导致亲核进攻试 剂只能通过相反的位置进攻羰基碳:
de>98%
螯合结构导致反应的立体选择性大大提高
手性辅助基团参与的羰基加成
螯合结构使得手性底物与小位阻试剂也能 实现高de值的手性合成
将无手性中心或手性中心不合适的底物引入手 性辅助基团,就能实现高产率的单一手性合成
由于双烯体或亲双烯体上难以存在手性基团, 因此控制不对称环合反应主要有两种方法:
通过在双烯体、亲双烯体上引入手性辅助基团
使用手性催化剂催化环合反应
12.5 不对称氢化与氧化
概述:
氢化反应可以将π键还原为单键而得到新的手 性中心,氧化则通过氧化π键而得到新的手性 中心。他们得到单一手性产物的前提是在手性 因素(如催化剂或试剂)存在下进行反应
e键稳定 含量90%
反应具有立体选择性
a键能量高 含量10%
立体专一性:
不同的立体异构体反应得到不同的单一产物的 反应称为立体专一性反应,如还原反应:
还原产物均为单一纯品,具有立体专一性
还原产物为外消旋体,不具有立体专一性
对映过剩(ee)与非对映过剩(de):手性合成 效率的标准
对映选择的反应使用ee:
通过特定方式反应,也能生成单一手性产物
《有机化学-结构和性质相关分析与功能》第三版_课本答案全

4.π键的成键方式:成键两原子的p轨道沿着与连接两个原子的轴垂直的方向“肩并肩”重叠而形成。π键特点:①电子云平面对称;②与σ键相比,其轨道重叠程度小,对外暴露的态势大,因而π键的可极化度大,在化学反应中易受到亲电试剂的进攻而发生共价键的异裂;③由于总是与σ键一起形成双键或叁键,所以其成键方式必然限制σ键单键的相对旋转。
思路3见第六章
第五章旋光异构
问题五参考答案
5-1
5-2(3)代表图4-5中乳酸(B)的构型。
习题五参考答案
1.(1)旋光性:使偏振光振动平面发生旋转的性质。
(2)比旋光度:一定波长和一定温度下,测得单位浓度、单位盛液管长度某物质的旋光度。
(3)手性:实物和镜像不能完全重合的特征。
(4)手性碳原子:连有不相同的四个原子或基团的饱和碳原子。
7-4由于硝基是极强的致钝间位定位基,所以2,4-二硝基苯酚和2,4,6-三硝基苯酚与大多数的酚不同,其酸性比碳酸强,所以能溶于碳酸氢钠水溶液。
7-5得到的仲丁醇构型与原料相同。因为该反应机理为SN2,空间位阻小反应活性大的CH3—O键异裂,生成溴甲烷,不涉及O—CH(CH3)CH2CH3的断裂,所以仲丁醇构型构型不变。
(6) 2-甲基-3-异丙基-1,4-萘醌(7) 3-(4-甲基苯基)-2-丁酮
4.*无机试剂和一个碳的有机试剂任选(溶剂例外)
或
(5)用(1)的中间产物和最终产物合成
5.能发生碘仿反应的是:(2) (4) (5) (8) (10);
能与NaHSO3加成的是:(1) (6) (8) (9) (10);
5.(1) (2) (5)易溶于水;(5) (4) (6)难溶于水。
第一章有机化学名词解释

名词解释1.构造式—表达原子的结合方式和次序的式子例如:CH3CH2CH2CH32.构型式—表达原子的空间连接方式和次序的式子例如:C CHCH3 HH3C3.构象式—表达未连接原子的空间相对位置的式子4.分子式—表示分子中所含的各种原子的数量5.最低系列原则—是指碳链以不同方向编号,得到两种或两种以上的不同编号系列,比较各系列不同位次,最先遇到的位次最小者,定为“最低系列”6.顺式\反式—两个相同或相似的基团处于双键的同侧叫做顺式,反之叫反式。
7.顺反异构现象—由于双键碳原子连接不通基团而形成的异构现象叫做顺反异构现象。
形成的同分异构体叫做顺反异构体。
8.顺反命名法—当烯烃双键的两个碳原子分别连有两个不同的原子或基团,并且两个双键碳原子或基团有一对或两对相同时,可采用顺反命名法。
两个相同基团位于双键同侧的叫做顺式,反之叫做反式。
例如:C CCH3H3CH H顺-2-丁烯C CCH3H3CHH反-2-丁烯9.Z、E命名法—如果两个碳原子上各自所连的优先基团处于双键的同侧,称为“Z”式构型,处于异侧的称为“E”式构型。
例如:C CC2H5CH3H3CH(Z)-3-甲基-2-戊烯10.多环烃—脂环烃分子中含有两个或两个以上的碳环的化合物. 11.环烯烃—环上有双键的脂环烃例如:环戊烯12.桥环化合物—多环烃中共用两个碳原子的双环化合物例如: CH 3CH 37,7-二甲基双环[4.1.0]庚烷13. 螺环化合物—多环烃中共用一个碳原子的双环化合物 例如: 螺[4,5]癸烷14. 桥头碳—桥环化合物中各桥共用的两个碳原子15. 螺原子—螺环化合物中两环共用的碳原子16.单环芳烃—分子中含有一个苯环的芳烃 例如:CH (CH 3)2异丙苯17. 多环芳烃—分子中含有两个或两个以上芳环的烃例如:联苯18. 酚—羟基直接连在芳环上的化合物 例如:OH苯酚19.羧酸衍生物—羧基中的羟基被其他原子或基团取代后所生成的化合物。
高分子物理各章节答案第1章

第一章填空题1、对于聚乙稀自由旋转链,均方末端距与链长的关系是()。
解:2、等规聚丙烯经体中分子链处于()构象。
解:螺旋3、C5链至少有()种构象。
解:94、高分子链的柔顺性越大,它在溶液中的构象数越(),其均方末端距越()。
解:多小5、聚异戊二烯可以生成()种有规异构体,它们是()。
解:六顺式1,4加成聚异戊二烯,反式1,4加成聚异戊二烯,全同1,2加成聚异戊二烯,间同1,2加成聚异戊二烯,全同3,4加成聚异戊二烯,间同3,4加成聚异戊二烯判断题1、下列聚合物分子链柔顺性的顺序是()硅橡胶>聚异丁烯>聚甲基丙烯酸甲酯>聚二甲基苯基醚氧解析:表述正确。
2、-{-CH2CH2-St-}-和-{-CH=CH-St-}-两种聚合物的分子链都含有苯环,所以刚性较好,在室温下都可以作为塑料使用()解析:高分子链的柔性与实际材料的刚柔性不能混为一谈。
判断材料的刚柔性,必须同时考虑分子内的相互作用以及分子间的相互作用和凝聚状态。
3、不同聚合物分子链的均方末端距越短,表示分子链柔顺性越好()解析:这种说法是错误的。
4、高斯链的均方末端距远大于自由旋转链的均方末端距()解析:这种说法是错误的。
5、理想的柔性链运动单元为单键()解析:表述正确。
对于真实的柔性链运动单元为链段。
6、因为天然橡胶相对分子质量很大,加工困难,故加工前必须塑炼()解析:表述正确。
7、因为聚氯乙烯分子链柔顺性小于聚乙稀,所以聚氯乙烯塑料比聚乙稀塑料硬(对?)解析:表述正确。
8、无规聚丙烯分子链中的-C-C-单键是可以内旋转的,通过单键内旋转可以把无规立构的聚丙烯转变为全同立构体,从而提高结晶度()解析:全同立构及无规立构指的是高分子链的构型,而要改变构型,必须经过化学键的断裂和重组。
通过单键内旋转只能改变其构象。
9、主链由饱和单键构成的高聚物,因为分子链可以围绕单键进行内旋转,故链的柔性大,若主链中引入了一些双键,因双键不能内旋转,故主链柔顺性下降()解析:当主链含有含有孤立双键时,大分子的柔性也比较大,由于双键旁的单键内旋转容易,因此柔性好。
构象异构体

手性碳原子
三、旋光性和物质结构的关系
• 3、手性碳原子
• 在绝大多数情况下,分子有无手性常与分子中是否含有 手性碳原子有关。所 谓手性碳原子,是指和四个不同的 原子或基团连接的饱和碳原子,通常用C*标注,例如:
* C H 3 CH C H 2 C H 3 Cl * HC * HCH CH CH3 C 2 3 Cl Cl
三、命名
• 1、顺-反命名法
HOOC H
COOH C=C H
H C=C HOOC
COOH H
顺-2-丁烯二酸
反-2-丁烯二酸
3、命名
• 1、顺-反命名法——2-丁烯
H3C C=C H 顺-2-丁烯 H
H3C 反-2-丁烯
CH3
H C=C
CH3 H
3、命名
• 1、顺-反命名法——1,3-二甲基环丙烷
在实际工作中,常常可以用不同长度的盛液管和不 同的样品浓度测定某物质溶液的旋光度α,并按下 式进行换算得出该物质的比旋光度。
2、比旋光度
[ α]
t
λ
α =
ρB×l
• 式中,α为旋光仪所测得的旋光度(°); • t为测定时的温度,一般为20℃; • λ为所用光源的波长,常用钠光,波长589.3nm, 标记为D; • l为盛液管的长度,单位是dm; • ρB为被测溶液的质量浓度,单位是g· mL-1。若被 测物质是纯液体,可用该液体的密度ρ替换上式中 的ρB来计算。
有机化学课后习题答案第13章
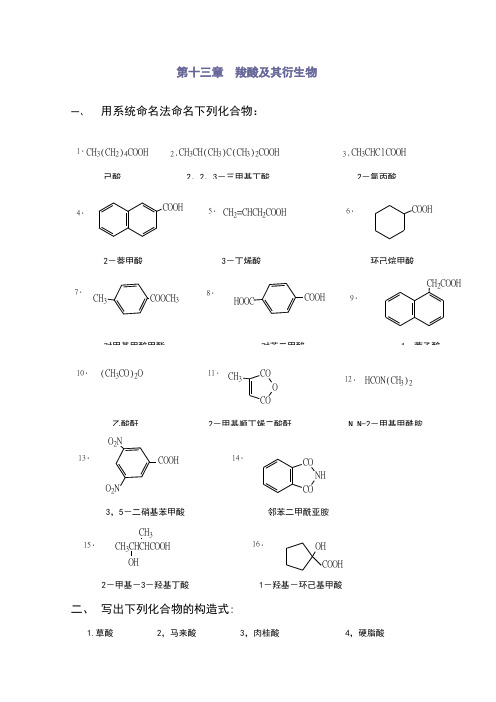
第十三章 羧酸及其衍生物一、 用系统命名法命名下列化合物:1.CH 3(CH 2)4COOH2.CH 3CH(CH 3)C(CH 3)2COOH3.CH 3CHClCOOH4.COOH5.CH 2=CHCH 2COOH6.COOH7.CH 3COOCH 38.HOOCCOOH9.CH 2COOH10.(CH 3CO)2O11.COO CO CH 312.HCON(CH 3)213.COOHO 2NO 2N14.CO NH3,5-二硝基苯甲酸 邻苯二甲酰亚胺15.CH 3CHCHCOOH CH 3OH16.OH COOH2-甲基-3-羟基丁酸 1-羟基-环己基甲酸二、 写出下列化合物的构造式:1.草酸 2,马来酸 3,肉桂酸 4,硬脂酸HOOCCOOHC C H H COOH COOHCH=CHCOOHCH 3(CH 2)16COOH5.α-甲基丙烯酸甲酯 6,邻苯二甲酸酐 7,乙酰苯胺 8,过氧化苯甲酰胺CH 2=C CH 3COOCH 3CO O CONHCOCH3CO C O OO NHC O H 2NCOOC 2H 5CNH C NHO OH 2N CNH 2NHCOO COnCH 2CH O C OCH 3[]n三、写出分子式为C 5H 6O 4的不饱和二元酸的所有异构体(包括顺反异构)的结构式,并指出那些容易生成酸酐:解:有三种异构体:2-戊烯-1,5-二酸;2-甲基-顺丁烯二酸;2-甲基-反丁烯二酸。
其中2-甲基-顺丁烯二酸易于生成酸酐。
CC H COOHCOOH C C H COOHCH 3HOOCCH 3HOOC CH=CHCH 2COOH2-戊烯-1,5-二酸; 2-甲基-顺丁烯二酸; 2-甲基-反丁烯二酸四、比较下列各组化合物的酸性强度:1,醋酸, 丙二酸, 草酸, 苯酚, 甲酸CH 3COOH ,HOOCCOOH HOOCCH 2COOH ,,OH ,HCOOHHOOCCOOHHOOCCH 2COOHHCOOHOHCH 3COOH>>>>2.C 6H 5OH ,CH 3COOH ,F 3CCOOH ,ClCH 2COOH ,C 2H 5OHF 3CCOOHClCH 2COOH CH 3COOH C 6H 5OHC 2H 5OH>>>>3.NO 2COOHCOOHNO 2COOHOHOHNO 2COOHCOOH NO 2COOH OHOH>>>>五、用化学方法区别下列化合物:1.乙醇,乙醛,乙酸2.甲酸,乙酸,丙二酸3.草酸,马来酸,丁二酸4,COOHCOOHCH 2OHOH2-羟基苯甲酸 苯甲酸 苯甲醇5.乙酰氯,乙酸酐,氯乙烷六、写出异丁酸和下列试剂作用的主要产物:1.Br 2/PCH 3CH 3CHCOOH Br /PCH 3CCOOH BrCH 32.LiAlH 4/H 2OCH 3CHCOOH CH 3LiAlH /H 2OCH 3CH 3CHCH 2OH 3.SOCl 2CH 3CH 3CHCOOH2CH 3CH 3CHCOCl4.(CH 3CO)2O/CH 3CH 3CHCOOH (CH 3CO)2O/CH 3CHCO)2CH 3(O +CH 3COOH5.PBr 3CH 3CH 3CHCOOH PBr (CH 3)2CHCOBr6.CH 3CH 2OH/H 2SO 4CH 3CH 3CHCOOH CH 3CH 2OH/H 2SO 4(CH 3)2CHCOOC 2H 57.NH 3/CH 3CH 3CHCOOHNH/(CH 3)2CHCONH 2七、分离下列混合物:CH 3CH 2COCH 2CH 3,CH 3CH 2CH 2CHO ,CH 3CH 2CH 2CH 2OH ,CH 3CH 2CH 2COOHCH 3CH 2CH 2COOH CH 3CH 2CH 2CH 2OH CH 3CH 2CH 2CHO CH 3CH 2COCH 2CH 3NaOHaqCH 2CH 2COONaCH 3CH 2CH 2COOHCH 3CH 2CH 2CH 2OH CH 3CH 2CH 2CHO CH 3CH 2COCH 2CH 3CH 3CH 2CH 2CHSO 3NaOHH +,H OCH 3CH 2CH 2CHOCH 3CH 2COCH 2CH 3NH 23NHOHCH 3CH 2CCH 2CH 3NNHOHHClCH 3CH 2COCH 2CH 3CH 3CH 2CH 2CH 2OH八、写出下列化合物加热后生成的主要产物:1, 1,2-甲基-2-羟基丙酸2, 2,β-羟基丁酸3, 3,β-甲基-γ-羟基戊酸 4, 4,δ-羟基戊酸5, 5,乙二酸九、完成下列各反应式(写出主要产物或主要试剂)1.CH 3CH 2CN (A)H 2O,H +CH 3CH 2COOHCH 3CH 2COCl(B)SOCl2(G)H 2,Pd/BaSO 4CH 3CH 2CHO2CONH 2P 2O 5(C)NH 3NaOBr,NaOH CH 3CH 2NH 22.C=O1.C 2H 5MgBr 2H 3O OH C 2H 5PBr 31.Mg,(C H )2O 2CO 2,H 3OC 2H 5COOH3.ClC ClO2NH 3H 2NC NH 2OH 2N CNH 2OH 2NC ONHC NH 2O4.C=O24OH CNH O +OH COOHOO OC O C十、完成下列转变:1.CH 3CH 2COOH CH 3CH 2CH 2COOHCH 3CH 2COOH CH 3CH 2CH 2OHPBr CH 3CH 2CH 2BrCH 3CH 2CH 2CN H O +CH 3CH 2CH 2COOH2.CH 3CH 2CH 2COH CH 3CH 2COOHCH 3CH 2CH 2COOH 2CH 3CH 2CHCOOHCl-OHCH 3CH 2CHCOOHOHKMnO ,H +CH 3CH 2COOH3.2CH 2COOHCH 2COOHC=CH 2+HBrROORCH 2Br25)OCH 2MgBr122,H 3O4.CH 3COCH 2CH 2CBr(CH 3)2CH 3COCH 2CH 2C(CH 3)2COOHCH 3COCH 2CH 2CBr(CH 3)222+CH 3CCH 2CH 2CBr(CH 3)2O OMg,(C 2H 5)OOOCH 3C CH 3CH 2CH 2CMgBrCH 3122.H 3OCH 3COCH 2CH 2C(CH 3)2COOH十一、试写出下列反应的主要产物:6.(R )-2-溴丙酸 + (S)-2-丁醇 H +/⊿C 2H 5HCH 3OO CBr H CH 3H +HCH 3OHCH 3CH 2+CH 3H COOHBr7.CH 3CH 2COONa+CH 3CH 2CH 2COClCH 3CH 2CH 2CO O CCH 2CHCH 3O 8.CH 2CH 2C CO O+2C 2H 5OHC 2H 5OC O CH 2CH 2COC 2H 5O9.CH 3CONH 2+NaOBr-OHCH 3NH 210.CNCONH 2+P 2O 5十二、预测下列化合物在碱性条件下水解反应的速度顺序。
第13章 糖类生物化学-简版

碳水化合物(carbohydrate) Cn(H2O)m
化学本质
多羟基醛或多羟基酮及其衍 生物,或水解时能产生这 些化合物的物质 。
一 单 糖 (一)单糖的分子结构 ⒈ 链状结构
以葡萄糖为例
D-葡萄糖 C6H12O6
单糖的链状结构有醛糖和酮糖之分
H
CHO
O C
CH2OH
H H C C HO H
② 成苷作用
单糖半缩醛羟基很容易与醇或酚的羟基反应失水而形成缩醛 式衍生物,通称糖苷 由于单糖有两种形式α型、β型,故有两种α-糖苷和β-糖苷
③ 脱水作用:单糖与盐酸作用即产生糠醛,能与酚类
化合物产生结构尚不明了的各种有色物质
④ 氨基化作用:单糖分子中的羟基被氨基取代称为糖胺。
自然界存在的天然氨基糖多以乙酰氨基糖的形式存在如
1.麦芽糖
α -葡萄糖和β-葡萄糖按α (1-4)形成糖苷键, ⑴ 化学性质:还原性、成脎作用 ⑵ 物理性质:溶于水白色晶体、甜度仅次 于蔗 糖,有旋光度与变旋作用
⒉ 蔗糖
蔗糖是由α-G和β-F各一分子按α(1-2)糖苷键缩合 失水形成的 ⑴化学性质:无游离醛基、不具还原性 ⑵物理性质:溶于水、甜度高
⑤ 脱氧作用:单糖羟基之一失去氧即成脱氧核糖,
二 寡 糖 (oligosaccharides)
由2~20 个单糖分子缩合而成的糖
种类 麦芽糖 蔗糖 乳糖 纤维二糖 构成 还原性 α-G和β-G按α (1-4)形 还原性 成糖苷键 α-G和β-F按α(1-2)形 不具还原性 成糖苷键 β-L和α(β)-G按β(1-4) 有还原性 糖苷键形成 2分子葡萄糖按β(1-4) 键型
糖与非糖物质如脂类或蛋白质共价结合,分别 形成糖脂(glycolipids)、糖蛋白(glycoproteins)和蛋 白聚糖(proteoglycans) ,总称为结合糖和复合糖
有机化学第13章 配位化合物

若配位单元为配阴离子,或配位单元 为配阳离子而阴离子为复杂的酸根,则在 内外界之间加 “酸” 字。如
Cu2 [ SiF6 ]
六氟合硅(IV)酸亚铜
[ Cu(NH3)4 ] SO4 硫酸四氨合铜(II)
2 配位单元
在配位单元中,先配体后中心,配体 与中心之间加‘合’字 。
配体前面用 二、三、四 ···表示该配 体的个数。
但少数配离子只存在于固体中,如复盐 LiCl▪CuCl2▪3H2O 和 KCl▪CuCl2, 在 固 态 时 存 在配离子CuCl3-
大多数复盐不属于配合物。
2 配位化合物的构成
内界: 配位单元
外界: 带有与内界异号电荷的离子
配位化合物
内界
外界
[ Co(NH3)6 ]Cl3
[ Co(NH3)6 ]3+ Cl-
注意不要将配体的个数与配位数混淆。
如 [ Co(NH3)6 ]Cl3 中,
配位原子
N
配体个数
6
配位数
6
在 [ Cu(NH2CH2COO)2 ] 中,
配位原子 配体个数 配位数
N,O 2 4
影响配位数的因素: 若中心的电荷高,半径大,则利于 形成高配位数的配位单元;
而配体的电荷高,半径大,利于低 配位数。
由中心原子(离子)和几个配体分 子(离子)以配位键相结合而形成的复 杂分子或离子,通常称为配位单元。
含有配位单元的化合物称为配位化 合物。
配位单元分类 配阳离子 如 [ Co(NH3)6 ]3+,[ Cu(NH3)6 ]3+
配阴离子 如 [ Cr(CN)6 ]3-,[ Co(SCN)4 ]2- 中性配分子 如 [ N(i CO)4 ],[ Cu(NH2CH2COO)2 ]
第一章有机化学名词解释

名词解释1.构造式—表达原子的结合方式和次序的式子例如:CH3CH2CH2CH32.构型式—表达原子的空间连接方式和次序的式子例如:C CHCH3 HH3C3.构象式—表达未连接原子的空间相对位置的式子4.分子式—表示分子中所含的各种原子的数量5.最低系列原则—是指碳链以不同方向编号,得到两种或两种以上的不同编号系列,比较各系列不同位次,最先遇到的位次最小者,定为“最低系列”6.顺式\反式—两个相同或相似的基团处于双键的同侧叫做顺式,反之叫反式。
7.顺反异构现象—由于双键碳原子连接不通基团而形成的异构现象叫做顺反异构现象。
形成的同分异构体叫做顺反异构体。
8.顺反命名法—当烯烃双键的两个碳原子分别连有两个不同的原子或基团,并且两个双键碳原子或基团有一对或两对相同时,可采用顺反命名法。
两个相同基团位于双键同侧的叫做顺式,反之叫做反式。
例如:C CCH3H3CH H顺-2-丁烯C CCH3H3CHH反-2-丁烯9.Z、E命名法—如果两个碳原子上各自所连的优先基团处于双键的同侧,称为“Z”式构型,处于异侧的称为“E”式构型。
例如:C CC2H5CH3H3CH(Z)-3-甲基-2-戊烯10.多环烃—脂环烃分子中含有两个或两个以上的碳环的化合物. 11.环烯烃—环上有双键的脂环烃例如:环戊烯12.桥环化合物—多环烃中共用两个碳原子的双环化合物例如: CH 3CH 37,7-二甲基双环[4.1.0]庚烷13. 螺环化合物—多环烃中共用一个碳原子的双环化合物 例如: 螺[4,5]癸烷14. 桥头碳—桥环化合物中各桥共用的两个碳原子15. 螺原子—螺环化合物中两环共用的碳原子16.单环芳烃—分子中含有一个苯环的芳烃 例如:CH (CH 3)2异丙苯17. 多环芳烃—分子中含有两个或两个以上芳环的烃例如:联苯18. 酚—羟基直接连在芳环上的化合物 例如:OH苯酚19.羧酸衍生物—羧基中的羟基被其他原子或基团取代后所生成的化合物。
高中化学有机异构体教案

高中化学有机异构体教案
主题:有机化合物的异构体
目标:了解有机化合物的异构体的概念和分类,学会通过分子结构推断其异构体关系。
一、概念介绍
1. 异构体的概念:异构体是指化学式相同、结构不同的化合物。
2. 异构体的分类:结构异构体(分子结构不同)和立体异构体(空间构型不同)。
二、结构异构体
1. 位置异构体:取代基在分子内的不同位置。
示例:2-氯丙烷和1-氯丙烷。
2. 链式异构体:酒精、醚、胺、脂肪酸的同分异构体。
示例:正丁醇和异丁醇。
三、立体异构体
1. 同分异构体:同一分子式下,空间构型不同。
示例:顺-异戊二烯和反-异戊二烯。
2. 共轭异构体:双键的位置不同。
示例:1,3-丁二烯和1,4-丁二烯。
四、实验验证
1. 碘反应:己烷和异己烷的碘反应。
2. 溴反应:正丁烷和异丁烷的溴反应。
五、小结与讨论
1. 异构体的概念和分类。
2. 通过分子结构判断异构体间的关系。
3. 异构体在化学实验中的应用。
教学方法:讲解、示例演示、实验操作。
教学时长:1节课。
备注:教师应引导学生在课后练习中加深对有机异构体概念的理解,并能熟练应用于实际问题中。
(最新整理)大学有机化学之立体异构

号碳原子放在上方。
2021/7/26
26
COOH C3H
OH
H
OH
H OH HO H H 3C COO HO HOC C 3HH C3H
C3H
COOH H
OH COO
(Ⅰ )
(Ⅱ )
(Ⅲ )
(Ⅳ )
(V )
如何判定不同Fischer投影式是否为同一构型?
1.不离开纸平面旋转180˚投影式相同,构型相 同,如(Ⅰ)和(Ⅱ),(Ⅲ)和(Ⅳ)。
2021/7/26
12
第二节 对映异构 对映异构又称旋光异构或光学异构。
从动物肌肉中提取出的乳酸和糖发酵所得的乳
酸 , 具 有 相 同 的 结 构 式 CH3-CH(OH)-COOH。 但前者能使平面偏振光向右旋转,叫做右旋乳酸;
后者却能使平面偏振光向左旋转,叫做左旋乳酸。
旋光性不同的异构体,对人和机体的生理效 应和药理效应常常是不同的。如右旋维生素C有 抗坏血病的作用,而左旋体则没有;左旋氯霉素 治疗伤寒等疾病有效,右旋体则几乎无效。
2021/7/26
2
同分异构的分类归纳如下:
同分异构
碳链异构
位置异构
结构异构 官能团异构
互变异构
价键异构
顺反异构
构型异构
立体异构
对映异构(旋光异构,光学异构)
构象异构
2021/7/26
3
第一节 顺反异构 一、顺反异构的概念和形成条件
丁烯二酸:
H
COOHH
H
CC
CC
HOOH C
HOOC COOH
延胡索酸
2021/7/26
H CCC 3H HOO H C
反-2-丁烯酸
王全瑞主编《有机化学》习题及思考题答案
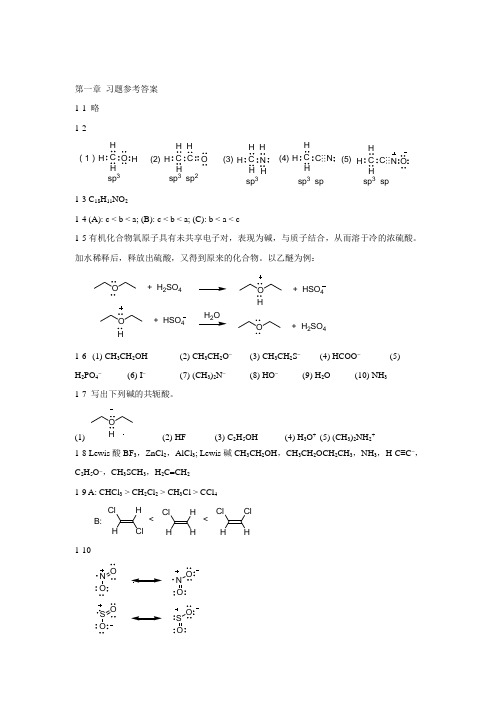
第一章 习题参考答案 1-1 略 1-2C O H H H C C OH H (1)(2)H(3)sp 3sp 3 sp 2C NH H H H C C H H H ⋯⋯N (4)(5)C C HHH ⋯⋯N O sp 3 sp 3sp sp 3 sp1-3 C 18H 11NO 21-4 (A): c < b < a; (B): c < b < a; (C): b < a < c1-5有机化合物氧原子具有未共享电子对,表现为碱,与质子结合,从而溶于冷的浓硫酸。
加水稀释后,释放出硫酸,又得到原来的化合物。
以乙醚为例:O+ H 2SO 4O + HSO 4H+ HSO 4HH OO+ H 2SO 41-6 (1) CH 3CH 2OH (2) CH 3CH 2O - (3) CH 3CH 2S - (4) HCOO -(5)H 2PO 4-(6) I -(7) (CH 3)2N -(8) HO -(9) H 2O (10) NH 31-7 写出下列碱的共轭酸。
(1) O H(2) HF (3) C 2H 5OH (4) H 3O + (5) (CH 3)2NH 2+1-8 Lewis 酸BF 3,ZnCl 2,AlCl 3; Lewis 碱CH 3CH 2OH ,CH 3CH 2OCH 2CH 3,NH 3,H-C ≡C -,C 2H 5O -,CH 3SCH 3,H 2C =CH 2 1-9 A: CHCl 3 > CH 2Cl 2 > CH 3Cl > CCl 4HCl H HHCl Cl H HCl HCl B:<<1-10N ON OS S ON OON OON OO第二章 习题参考答案 2-1(1)3-甲基-4-乙基庚烷;(2)2-甲基-4-异丙基己烷;(3)新壬烷;(4)2-甲基-5-乙基庚烷 (5)2-甲基-3-丙基己烷;(6)4-叔丁基辛烷;2-2 (1)(2)CH 3CHCHCH 3H 3CCH 3C CH 2CH 3CH 3CH 3H 3C (3)CH 3CHCH2CH 2CH 3CH32-3(1)庚烷(2)2-甲基己烷(3)(4)(5)(6)(7)(8)(9)3-甲基己烷2, 2-二甲基戊烷3, 3-二甲基戊烷2, 3-二甲基戊烷2, 4-二甲基戊烷3-乙基戊烷2, 2, 3-三甲基丁烷2-4CH 3—C —CH 2—CH —CH 2—CH 3CH 3CH 3CH 31°2°3°2°4°1°1°1°1°2-5 该化合物分子式为C 8H 18,结构式 命名为:2,2,3,3-四甲基丁烷 2-6 化合物沸点依次降低顺序:(4)>(2)>(3)>(5)>(1)H 3CH 3CC C CH 3CH 3H3CCH 3(7) (CH 3)2CHCH 2CH 3(8) (CH 3)2CHCHCH 2CH 2 CCH 2CH 3CH 2CH 3CH 3CH 2CH 3(9)(10)2-7 熔点:(1)>(2);沸点:(1)<(2) 2-8 稳定性大小:(1)>(3)>(2)>(4)2-9 1,2-二溴乙烷的四种典型构象式(从左到右稳定性依次降低)H HBr H H BrH H H HBrH H H HHHBr HBrH BrBr对位交叉式邻位交叉式 部分重叠式 全重叠式3, 4-二甲基己烷的优势构象为:2-10链引发:Cl 22Cl •链增长:Cl •+Cl•+ HCl•+ Cl 2Cl •+链终止:Cl •Cl •+Cl 2•Cl •+Cl•+•2-11 主要的原因是:甲基环己烷分子结构中有1个3º H ,10个2º H ,3个1º H ,进行溴代CH 3Br25反应时,不同类型氢原子的反应活性大小是3º H ∶2º H ∶1º H = 1600∶82∶1,可以初步计算出3º H 被溴取代后的产物所占百分比例大约是66%,因此反应主要得到 2-13 该化合物为: Cl 2++ HClC C H 3C H 3C H 3C CH 3CH 3CH 3C C H 3C H 3C H 3C CH 3CH 3CH 2Cl第三章 习题参考答案 3-1(1)甲基环戊烷 (2)1-甲基-4-乙基环己烷 (3)2-甲基-3-环丙基-6-环丁基辛烷 (4)反-1-甲基-2-异丙基环丁烷 (5)1-甲基-3-环戊基环己烷 (6)2-甲基-8-乙基螺[4.5]癸烷 (7)2, 7, 7-三甲基二环[4.1.0]庚烷 (8)二环[3.3.3]十一烷(9)1-甲基二环[2.2.2]辛烷(10) (11) (12) (13)3-2 该烃分子可能为下列化合物之一:甲基环己烷 乙基环戊烷 丙基环丁烷 丁基环丙烷 3-3(1)2) H 2OBrBr CH 2BrOHC C H 3C H 3C H 3C CH 3CH 3CH 3(2)HBrBr3-4顺-1-甲基-4-丙基环己烷的椅式构象式 反-1-甲基-4-丙基环己烷的椅式构象式CH 3C(CH 3)3H 3CC(CH 3)3CH 3C(CH 3)3C(CH 3)3CH 3最优势构象 3-5(1)CH 3H 3CC(CH 3)3(2) CH 3C 2H 5CH 3(3)CH 3(4) C(CH 3)3C 2H 5(5)C 2H 5C 2H 5H 5C 23-6 3, 4-二溴-1-叔丁基环己烷可能的构象异构体如下:C(CH 3)3C(CH 3)3Br BrC(CH 3)3BrBr C(CH 3)3BrBrC(CH 3)3Br BrBrBr C(CH 3)3BrBrC(CH 3)3BrBrC(CH 3)3BrBr3-7 化合物A 是: 化合物B 是: Br反应式:溴水褪色BrCH2BrBr3-8溴 水褪 色褪 色无变化无变化褪 色3-9 反-1,2-二甲基环己烷采用ee 构象时,亚甲基和甲基是处在对位交叉式,分子内能较小;而在aa 构象中,亚甲基和甲基是处在邻位交叉式,分子扭转张力相对比较大,同时由于1,3-竖键作用,空间张力大。
第13章 糖类2016

O
H O C H 2 OH H 3 OH 4 H OH 5 CH2OH
1
5
HO CH2
4
O H
2
H
1
H OH
H 3
OH OH
β-D-呋喃核糖
D-核糖(开链结构)
α-D-呋喃核糖
31
单糖环状结构的哈沃斯式和构象式
由开链式写哈沃斯式: ①画出杂环骨架(朝前的3个C-C键用粗线 表示)。 ②氧原子写在右上角,按顺时针将碳环编 号。C5上的羟甲基在环平面上方为D型。 ③将开链式中左边的写在环平面的上方, 右边的写在环平面的下方。即“左上右下”
9
第一节 单糖
一、单糖的分类
1. 据官能团分:醛糖、酮糖
最小的醛糖
最小的酮糖
2.据碳原子数分:丙、丁、戊、已 糖
10
二、单糖的结构
1.单糖的开链结构和构型 一般单糖碳链无支链
醛糖:C1为醛基 酮糖:C2为酮基
其它碳上都各连有一个羟基
CHO (CHOH)n CH2OH
醛糖
CH2OH C O (CHOH) n CH2OH
D—阿洛酮糖
CH2OH C O HO H H OH H OH CH2OH
D—果糖
CH2OH C O H OH HO H H OH CH2OH
D—山梨糖
CH2OH C O HO H HO H H OH CH2OH
D—塔洛糖
18
2.葡萄糖的环状结构和变旋光现象
(1)变旋光现象
葡萄糖具有羰基和羟基的典型反应 但是还有一些性质却不能用开链结构说明
洋地黄毒苷
5
氨基糖苷类抗生素是一大类含糖的抗生素,其
5 立体化学(土木13)

规定 右旋甘油醛以 I 式表示,左旋以 II 表示; 把 手性碳原子上 OH 在右边的叫做 D-构型, 反之称为 L-构型
由甘油醛推乳酸的构型:
CHO H OH CH2OH [O] COOH H OH CH2OH [H] COOH H CH3 OH
极限构象:
H 2 H H 1 H H 250pm H 3 H 6 H 5 H H 4 H H
H H
6
183pm
5 4
H H
3
H H
1
H
H H
H
2
H
H
椅式
(优势构象)
船式
转 环 作 用 中 的 能 量 变 化
稳定性:椅式构象 > 船式构象 室温下,平衡有利于椅式构象(优势构象)
平伏键
H H H H H
COOH C
OHCOOH
COOH COOH HO
COO C
H3
C CH C CH H H H CH3 OHHOOCHO CH CH OH CH 3 3 3 HO (S)(R )(S)-(R)(S)(S)-2-羟基丙酸 (R)-2-羟基丙酸
C
(R)-
Cl H Br C CH3 Br
Cl CH3 H
(R)-1-氯-1-溴乙烷
环己烷的构象优势构象船式构象室温下平衡有利于椅式构象优势构象直立键竖键axialbonds平伏键横键equatorialbonds平伏键直立键一取代环己烷的构象优势构象二取代环己烷的构象优势构象eeee键型异构体比eaaa键型异构体稳定顺14二甲基环己烷反14二甲基环己烷含相同取代基的环己烷多元取代物最稳定的构象是e取代基最多的构象hassel规则环上有不同取代基时大的取代基在e键上的最稳定baton规则环己烷衍生物优势构象的判定讨论指出下列构象异构体中哪一个是优势构象ch写出化合物的优势构象ohchohchoh四对映异构旋光异构光学异构肌肉乳酸发酵乳酸乳糖coohchcoohchs乳酸r乳酸1偏振光和旋光性平面偏振光光源光束先进方向nicol棱镜非旋光性物质旋光性物质旋光性物质能使偏光振动平面发生偏转的性质旋光物质具有旋光性的物质又称
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
存在于分子中的一个平面,它将分子分成互为实物和镜像的两半。
HH
Cl
H
CC
H
Cl
C
CHH3
CCll
CCll
具有对称面的分子不是手性分子,没有旋光性和对映异构。
2.对称中心
若分子中有一点 P ,通过 P 点画任何直线,如果在离 P点等距离 直线两端有相同的原子或基团,则点 P 称为分子的对称中心。例如:
(六)不含手性碳原子化合物的对映异构
若盛液管中为旋光性物质,该物质会使穿过的偏光向左或向右旋 转一定的角度。如果要使旋转一定角度后的偏光能够透过检偏棱晶, 则必须将检偏棱晶相应旋转一定的角度,目镜处视野才明亮。由刻度 盘可以读出检偏棱晶旋转的角度,此即为该物质的旋光度α。如下图 所示:
光源
目镜
普通光 起偏棱晶
样品管
检偏棱晶
2.比旋光度
Cl
.Cl
H
F HP H F
. CH2 P
CH2
H
Cl
CH2
CH2
Cl
具有对称中心的分子不是手性分子,没有旋光性和对映异构。
结论:
分子中既无对称面也没有对称中心的,一般可初步判定为是手性分子。
(三)手性碳原子
分子中连有四个不相同基团的碳原子称为不对称碳原子(手性
碳原子),在结构式中用C*表示。
* CH3 CH COOH
HO C H
H C OH H C OH HO C H
COOH
(Ⅰ)
COOH
(Ⅱ)
COOH
(Ⅲ)
COOH
(Ⅳ)
(Ⅰ)与(Ⅱ)是对映体,(Ⅲ)与(Ⅳ)看起来是对映体,实际 上二者是相同的。分子内存在一个对称面,不是手性分子,所以,没有 对映异构。
分子内含有两个相同手性碳原子的非手性分子称为内消旋体,以 i 或 meso 表示。如: meso-酒石酸
α——从旋光仪中读到的旋光度; ρ——溶液的质量浓度或纯液体的密度(g/mL); l ——样品管的长度(dm); t ——测量时的温度(℃); λ——光的波长,通常用钠光灯作光源(λ=589.3nm)。
当溶液的浓度为1g/mL,盛液管的长度为1dm时,所测物质的旋光
度即为比旋光度。
最常用的光源是钠光(D),λ=589.3nm,所测得的旋光度记为
例如:乳酸
CH3 CH COOH OH
(二)手性和对称因素 手性:物体和它的镜像不能重合的特性称为手征性或手性
特征: (1)不能完全重叠; (2)呈现物体与镜象关系(左右手关系)。 物质分子互为实物和镜象关系(象左手和右手一样)彼此不能完全 重叠的特征,称为分子的手性。具有手性(不能与自身的镜象重叠)的 分子叫做手性分子。
HH CH3 CH3
CH3 H H CH3
二、顺反异构体的命名
(一)顺/反命名法 顺式:两个不能自由旋转的碳原子上所连的两个相同的原子或 基团处于双键或脂环的同侧 反式:两个不能自由旋转的碳原子上所连的两个相同的原子或 基团处于双键或脂环的异侧
CH3
CH2CH3
CC
H
H
顺-2-戊烯
cis-2-戊烯
1.两个手性碳原子不相同 分子中含有 n 个不相同的手性碳原子时,则构型异构体数目=2n 2-羟基-3-氯丁二酸
HOOC C*H *CH COOH
OH Cl
COOH
COOH
COOH
COOH
H C OH HO C H
H C OH HO C H
H C Cl
Cl C H
Cl C H
H C Cl
COOH
COOH
第四章 立体异构现象
同分异构
构造异构
碳架异构 CH3CH2CH2CH3
CH3CHCH3 CH3
官能团位置异构 CH2 CHCH2CH3
CH3CH
CHCH3
官能团异构 CH CCH2CH3
CH2 CH CH CH2
构型异构
顺反异构 CH3
CH3
CC
H
H
HH
CH3 C
H
H
CH3
H C
CH3
立体异构
构象异构
脱水反应温度/℃ pKa1 pKa2
体内代谢情况
顺-丁烯二酸 130.5 78.8 200 1.83 6.07
不能代谢
反-丁烯二酸 286.5 0.63 275 3.03 4.44 能代谢
OH
HO
反己烯雌酚 生理活性强
HO
OH
顺己烯雌酚
生理活性弱
亚油酸(Δ9,12-十八碳二烯酸) 花生四烯酸(Δ5,8,11,14-二十碳四烯酸) 维生素A
H H
CH3 CH3
CH3 H
对映异构,又称旋光异构
HH
H
COOH
COOH
H
H
H
OH HO
H
H H
H
H
H
CH3
CH3
第一节 顺反异构
构造:分子中各原子的连接方式和连接次序 顺反异构体是分子中各原子的连接方式和次序相同,而分子 中原子的空间排列方式不同,即分子构型不同,所以顺反异构是 构型不同的化合物。由于构型不同而引起的异构现象又叫立体异 构现象。
手性与旋光性的关系:具有旋光性的物质,其分子一定是手性分 子。反过来说,手性分子一定具有旋光性。
所以,通常将手性作为判断物质是否具有旋光性和对映异构现象 的必要条件。
手性的判断:物质分子能否与其镜象完全重叠(是否有手性), 可以从分子中有无对称因素来判断,最常见的对称因素有对称面和对 称中心。
1.对称面(镜面)——用σ 表示
CH3 CC
H
顺式 Z式
CH2CH3 H
CH3
CH2CH3
CC
H
反式
CH3
Z式
分子中有多个双键存在顺反异构,则每个双键的构型均需标出,
并在构型符号前加上相应双键的位次编号。
CH3 C
H
H C
C H
CH2CH3 C
H
(2Z,4E)-2,4-庚二烯
(2E,4E)-2,4-庚二烯
三、顺反异构体的性质
顺反异构体的构型不同,它们的物理性质、化学性质以及生理 活性也不相同。
作为起偏振器的常用材料有: ① 尼科尔棱晶
由方解石(成份为CaCO3)加工制成; ② 偏振片
赛璐珞或其它透明材料的薄片,表面涂一层细微晶体物质硫酸 碘-金鸡钠霜或硫酸金鸡钠碱(金鸡钠碱即奎宁)。
2.物质的旋光性
偏振光是在1808年由马露首先发现的。随后,拜奥特发现有些石 英的晶体能够将偏振光振动平面向右或向左旋转,1815年,他进一步 发现某些有机物也具有使偏振光振动平面旋转的性能。
自然界葡萄糖、肌肉乳酸使偏振光振动平 面向右(顺时针)旋转, 记为:(+)-乳酸或 d-乳酸。
自然界果糖、发酵乳酸使偏振光振动平面 向左(逆时针)旋转, 记为:(-)-乳酸或 l-乳酸。
(二)旋光仪和比旋光度
1.旋光仪 测定化合物的旋光度是用旋光仪进行的,旋光仪的主要部件有光
源、两个尼科尔棱晶(起偏棱晶和检偏棱晶)、一个盛液管、一个刻 度盘和一个目镜组装而成。
D
A'
以光波的每个振动方向作一个平面,该平面同时通过传播方向,
则普通光有无数多个振动平面。
在光前进的方向上放一个起偏振器,它只允许与棱晶晶轴互相
平行的平面上振动的光线透过棱晶,而在其它平面上振动的光线则
被挡住。
A
A
光源
A' 普通光
起偏振器
A' 平面偏振光
这种只在一个平面上振动的光称为平面偏振光,简称偏振光或 偏光。偏振光所在的平面称为偏光振动平面或偏振面。起偏振器允 许通过光的振动方向称为偏振化方向。
CH3
CH3
CC
H
H
熔点/℃ 沸点/℃ 密度/g.cm-3 折射率nD
顺-2-丁烯 -138.9 3.7 0.6213 1.3931
CH3 C
H C
H
CH3
反-2-丁烯
-105.5
0.9
0.6042
1.3848
HOOC C
H
COOH HOOC
C
C
H
H
H C
COOH
熔点/℃ 溶解度/g(100gH2O)-1
α 。t D
所用溶剂不同也会影响物质的旋光度。因此,在不用水为溶剂时,
需注明溶剂的名称。例如,20℃时右旋酒石酸在5%的乙醇中的比旋光
度为: α
20= +3.79°(乙醇,5%)。
D
公式中知道三个量,即可求出第四个量。
例:葡萄糖 α D20=+52.5°,l=1dm, α=+3.4°
ρ= α lα
= 3.4 1×52.5
左旋乳酸 (-)-乳酸
右旋乳酸 (+)-乳酸
二者互称为对映异构体,简称对映体。对映异构体都有旋光性, 其中一个是左旋的,一个是右旋的。所以对映异构体又称为旋光异构 体。
等量的左旋体和右旋体的混合物没有旋光性,称为外消旋体,一
般用(±)或(dl)来表示。如:(±)-乳酸
(五)含有两个手性碳原子化合物的对映异构
H
4
23
H
5 67
1
H
反,顺-2,4-庚二烯
两个不能自由旋转的碳原子上所连的基团都不相同时,则 顺/反命名法不适用。
CH3
CH2CH3
CC
H
Br
CH3
Br
CC
H
CH2CH3
(二)Z/E命名法
Z式:双键碳原子上两个较优基团处于双键同侧 E式:双键碳原子上两个较优基团处于双键异侧
