2021年高考化学二轮复习 专题训练 物质的量浓度
2021届高三化学二轮复习——一定物质的量浓度的液体的配置专题测试

2021届高中化学高三化学二轮复习——一定物质的量浓度的液体的配置专题测试一、单选题1.实验室需配制480 mL-1NaOH溶液,下列叙述正确的是1mol LA.用托盘天平称量19.2 g NaOHB.待NaOH全部溶解后应立即将溶液转移至容量瓶中C.定容时若俯视刻度线观察液面,会使所配制的NaOH溶液的浓度偏高D.摇匀后发现液面略低于刻度线,应再加水到达刻度线2.下面是某同学在配制100mL 1.00mol/L NaCl溶液时的操作细节,其中会引起浓度偏高..的操作是A.操作前清洗容量瓶后有少量蒸馏水残留。
B.用托盘天平称量氯化钠固体时砝码和药品的位置颠倒。
C.将溶液转移至容量瓶时有少量液体洒出。
D.定容时俯视刻度线。
3.容量瓶是用来配制一定物质的量浓度的溶液的定量仪器,其上标有以下六项中的①温度②浓度③容量④压强⑤刻度线⑥分刻度线A.②④B.①③⑥C.①②④D.①③⑤4.将12 mol·L-1的盐酸(ρ=1.10 g·cm-3)50 mL稀释成6 mol·L-1的盐酸(ρ=1.055 g·cm-3),需加水的体积为()A.50 mL B.50.5 mL C.55 mL D.59.5 mL5.以下六项中需在容量瓶上标出的是①温度②浓度③容量④压强⑤刻度线⑥酸式或碱式A.①②④B.②③⑤C.①⑤⑥D.①③⑤6.下列仪器中,没有“0”刻度线的是( )A.量筒B.温度计C.酸式滴定管D.托盘天平游码刻度尺7.配制一定物质的量浓度的NaOH溶液时,下列造成所配溶液浓度偏低的原因是A.容量瓶没有充分干燥B.称量氢氧化钠过程用时过长C.装入试剂瓶时有少量NaOH溶液残留在容量瓶内D.向容量瓶加水定容时俯视液面8.配制一定物质的量浓度的稀硫酸,下列情况会使配制结果偏大的是①溶解后未冷却即转移、定容②定容时仰视容量瓶刻度线③用量筒量取一定体积的浓硫酸时俯视④将量筒、烧杯、玻璃棒洗涤2~3次,转移至容量瓶A.①②B.②③C.①④D.②③④9.配制一定物质的量浓度的NaOH 溶液时,会造成实验结果偏高的是A.定容后,轻轻振荡、摇匀、静置,液面下降再加水至刻度线B.定容时观察液面俯视C.有少量NaOH 溶液残留在烧杯中D.容量瓶中原来有少量蒸馏水10.容量瓶是用来配制一定物质的量浓度溶液的定量仪器,其上标有:①温度、②浓度、③容量、④压强、⑤刻度线这五项中的A.②④⑤B.②③⑤C.①②④D.①③⑤11.用某种仪器量取液体体积时,平视时读数为x mL,仰视时读数为y mL,俯视时读数为z mL,若y<x<z,则所用仪器可能是( )A.酸式滴定管B.碱式滴定管C.量筒D.以上仪器都不是12.某同学欲配制溶质质量分数为8%的食盐水80g,在用托盘天平称量食盐时,他把食盐和砝码的位置放颠倒了(1g以下用游码),那么实际上他所配制的食盐水的溶质质量分数为A.8.5% B.7.5% C.14% D.7.1%13.测定胆矾晶体中结晶水含量的实验中,有关操作所用仪器错误的是A.研磨B.称量C.加热D.冷却14.配制100mL 1mol/L NaOH溶液必须的仪器是()A.量筒B.试管C.容量瓶D.分液漏斗15.配制一定物质的量浓度的NaOH溶液时,导致浓度偏高的原因可能是( )A.容量瓶盛过NaOH溶液,使用前未洗涤B.定容时仰视刻度线C.容量瓶中原有少量的蒸馏水D.移液时,不慎将液体流到瓶外二、实验题16.硫酸铜是一种具有很多用途的化学物质,在工业领域(涂料工业、印染工业及有机工业)和农业领域(配制杀菌剂)都有广泛应用。
2021年高中化学高三二轮专题——一定物质的量浓度的溶液的配制专题训练(含答案)

2021年高中化学高三二轮专题——一定物质的量浓度的溶液的配制专题训练一、单选题1.在保证安全的前提下,学以致用是我们化学学习中一直倡导的理念,某同学参阅了“84消毒液”说明中的配方,欲用NaClO 固体配制480 mL 质量分数为25%,密度为1.2 g·cm -3的消毒液,下列说法正确的是( ) A .需用托盘天平称量NaClO 固体的质量为144 gB .容量瓶用蒸馏水洗净后必须烘干才能用于配制溶液C .定容时俯视容量瓶的刻度线,会造成所配制溶液物质的量浓度偏低D .该消毒液的物质的量浓度约为4.0 mol·L -12.用98%的浓硫酸(密度为31.84 g cm -⋅)配制180 mL 2.5 mol L -⋅的稀硫酸。
现给出下列仪器(配制过程中可能用到):①25 mL 量筒 ②10 mL 量筒 ③50 mL 烧杯 ④托盘天平 ⑤100 mL 容量瓶 ⑥胶头滴管 ⑦玻璃棒 ⑧80 mL 容量瓶,按使用仪器的先后顺序排列正确的是( )A .①⑥③⑦⑤⑥B .①⑤⑦⑥C .②⑥③⑦⑤D .④③⑦⑧⑥3.下列实验设计合理或能达到实验目的是A .探究影响物质溶解性的条件B .探究燃烧的条件C.测定空气中氧气的含量D.配制一定浓度的氢氧化钠溶液4.下列实验装置设计正确且能达到目的的是A.实验I:除去Cl2中的HCl B.实验Ⅱ:静置一段时间,小试管内有晶体析出C.实验III:配制一定物质的量浓度的稀硫酸D.实验Ⅳ:分离乙酸乙酯-乙醇混合物5.取VmL某溶液(其质量分数为A%),加入等体积的水稀释后其质量分数为0.6A%,则原溶液的密度(忽略混合时溶液体积的变化)A.大于1g/cm3B.等于1g/cm2C.小于1g/cm3D.无法确定6.利用碳酸钠晶体(Na2CO3·10H2O)来配制1.0mol·L-1 Na2CO3溶液500mL。
假如其他操作都准确无误。
下列情况会引起所配溶液浓度偏高的是()A.称取在空气中久置的碳酸钠晶体143.0 gB.定容时,仰视观察刻度线C.转移溶液时,用于溶解碳酸钠晶体的烧杯没有洗涤D .定容后,将容量瓶振荡摇匀、静置时发现液面低于刻度线,又加少量水至刻度线7.实验室里需480mL 1.0mol/L NaOH 溶液,若用固体NaOH 配制,则应取NaOH 的质量为( ) A .19.2g B .20.0g C .29.6g D .39.2g8.化学研究小组用如图装置测定锌(含有少量铜)的纯度,下列操作能达到实验目的的是( )A .用装置甲量取一定体积的浓硫酸B .用装置乙配制100mL 3mo1•L -1的稀硫酸C .用装置丙称量一定质量的粗锌D .用装置丁测量金属锌与稀硫酸反应产生氢气的体积 9.为预防新型冠状病毒肺炎,某同学购买了一瓶84消毒液,其包装说明如图所示。
2021届高考化学二轮专题训练: 配制一定物质的量浓度的溶液

配制一定物质的量浓度的溶液1.下列溶液配制实验的描述完全正确的是A.在容量瓶中先加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸B.用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1)通常需要用容量瓶等仪器C.配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4以防水解D.用pH=1的盐酸配制100 mL pH=2的盐酸所需全部玻璃仪器有100 mL容量瓶、烧杯、玻璃棒、胶头滴管【答案】C【解析】A项,不能在容量瓶中稀释浓硫酸;B项,应用烧杯、玻璃棒配制该盐酸溶液;D项,少量筒。
2.下列说法正确的是( )A.现需480 mL 0.1 mol·L-1硫酸铜溶液,则需要称量7.68 g硫酸铜固体B.100 g硫酸溶液的物质的量浓度为18.4 mol·L-1,用水稀释到物质的量浓度为9.2 mol·L-1,需要水100 gC.将10 g CuSO4溶解在90 g水中,配制质量分数为10%的CuSO4溶液D.使用量筒量取一定体积的浓硫酸配制一定物质的量浓度的稀硫酸,将浓硫酸转移至烧杯后须用蒸馏水洗涤量筒,并将洗涤液一并转移至烧杯【答案】C【解析】应选择500 mL的容量瓶来配制,需硫酸铜的质量为0.5 L×0.1 mol·L-1×160 g·mol-1=8.0 g,A错误;由c1×m1ρ1=c2×m2ρ2,且ρ1≠ρ2可知,m2≠2m1,B错误;将10 g CuSO4溶解在90 g水中,溶液的质量是100 g,得到质量分数为10%的CuSO4溶液,C正确;量取的液体倒出的量就是所读的量,不能洗涤,D错误。
3.实验室配制500 mL 0.4 mol/L的NaCl溶液,有如下操作步骤:①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解。
②把①所得溶液小心转入一定容积的容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切。
【2021高考化学】物质的量的相关计算专题练习含答案

2021届高三化学物质的量的相关计算专题练习一、单选题1.现有CO、CO2、O3三种气体,它们含有的氧原子数目相等,则三种气体的物质的量之比是()A. 1∶1∶1B. 1∶2∶3C. 3∶2∶1D. 6∶3∶22.相同物质的量的钠、镁、铝与过量的稀硫酸反应,在标况下产生氢气的体积比是()A. 1:1:1B. 1:2:3C. 6:3:2D. 23:24:273.用等质量的金属钠进行下列实验,产生氢气最多的是( )A. 将钠放入足量的稀盐酸中B. 将钠放入足量的稀硫酸中C. 将钠放入足量的硫酸氢钠溶液中D. 将钠用铝箔包好,并刺穿一些小孔,放入足量的水中4.下列说法正确的是()A. 摩尔是国际单位制中7个基本物理量之一B. 阿伏加德罗常数等于6.02×1023个12C中含有的碳原子数C. 物质的量是能把物质的质量和微观粒子数联系起来的一个物理量D. 若一分子NO、N2O的质量分别为ag、bg,则N原子的摩尔质量是(b-a) g/mol5.下列物质中含原子数最多的是()A. 6.4g O2B. 8.8g CO2C. 0.1mol N2D. 3.01×1022个H2O6.关于2 mol二氧化碳的叙述中,正确的是( )A. 质量为44gB. 摩尔质量为88g/ molC. 分子数为6.02×1023D. 有6mol原子7.标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6 g硫化氢④0.2 mol NH3。
下列对这四种气体的关系从小到大表示错误的是()A. 体积:④<①<②<③B. 密度:①<④<③<②C. 质量:④<①<③<②D. 氢原子数:②<④<③<①8.有15 g A物质与10.5 g B物质恰好完全反应,生成7.2 g C物质、1.8 g D物质和0.3 mol E物质。
2021届高考化学二轮复习逐题专练: 化学工艺流程大题 (解析版)

化学工艺流程大题【原卷】1.Mn3O4可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。
以软锰矿(主要含MnO2,还含有Fe2O3、SiO2、Al2O3、CaO和MgO等)为原料经过下列过程可以制得Mn3O4。
(1)酸浸、还原:向软锰矿中加入硫酸、同时加入铁屑,充分反应后,过滤,所得溶液中主要含有Mn2+、Fe3+、Al3+、Mg2+、H+和SO2-4。
写出酸浸、还原过程中MnO2发生反应的离子方程式:___________。
(2)调pH:向酸浸、还原所得滤液中加入MnCO3固体,调节溶液的pH,过滤。
若要使和Fe3+和Al3+沉淀完全,则需调节溶液的pH最小值为___________。
(已知溶液中金属离子的物质的量浓度≤10-5 mol·L-1时可以看成沉淀完全,K sp[Fe(OH)3]=1×10-37.4,K sp[Al(OH)3]=1×10-33)(3)沉锰:向调pH后所得滤液中加入一定量的氨水,可以得到Mn(OH)2沉淀。
①其他条件一定,沉锰过程中锰离子的沉淀率与溶液温度的关系如图所示。
50℃后,溶液温度越高,锰离子的沉淀率越低的原因是___________。
②沉锰过程中溶液中存在平衡:Mn2++4NH 3[Mn(NH3)4]2+。
与Mn2+形成配位键的原子是___________。
(4)氧化:向沉锰所得Mn(OH)2中加入H2O2溶液,可以得到Mn3O4。
写出该反应的化学方程式:___________.2.(辽宁省辽西地区2021届高三大联考)某工业的含碲废渣中含有较多23Na TeO ,同时含有23Na SiO 、22Na PbO 、2SiO 、2Cu Se 等杂质。
某研究小组设计了如流程回收碲。
(1)为提高含碲废渣的浸取率,可采取的措施为___________(任写一种)。
(2)“滤渣Ⅱ”的主要成分为PbS 和3CaSiO ,写出生成PbS 的化学方程式:___________。
高考化学考点复习《物质的量浓度》真题练习含答案

高考化学考点复习《物质的量浓度》真题练习含答案1.(2022年7月黑龙江省学业水平合格考试)如图所示的体检报告中,表示钙(Ca)元素指标的物理量是A.物质的量B.密度C.物质的量浓度D.质量【答案】C【解析】根据表格数据可知钙元素的含量是1.754 m mol/L,这是物质的量浓度的单位,故合理选项是C。
2.(2021年陕西省普通高中学业水平考试)配制100mL0.5mol/L的氯化钠溶液,需量取5mol/L的氯化钠溶液A.20.0mL B.15.0mL C.10.0mL D.5.0mL【答案】C【解析】溶液稀释过程中,溶质的物质的量不变,设需5mol/L氯化钠溶液体积为V,则V×5mol/L=0.5mol/L×0.1L,解得V=0.01L;应该量取10.0mL;故选C。
3.(2021年河南省普通高中学业水平考试)表中是某人体检报告的部分指标,表中“单位”对应的物理量是项目名称英文缩写检查结果单位参考范围钾K 4.1mmol/L 2.5~5.0钙Ca 2.43mmol/L 2.43~2.70甘油三酯TG 1.50mmol/L0.45~1.70A .质量B .密度C .物质的量D .物质的量浓度 【答案】D 【解析】表中“单位”对应的物理量是mmol/L ,是物质的量浓度的单位,故答案选D 。
4.(2021年内蒙古自治区普通高中学业水平考试)100mL 0.50mol L 的2CaCl 溶液中,Cl -的浓度为 A .0.50mol LB .1.0mol LC .0.050mol LD .0.10mol L 【答案】B【解析】100mL 0.50mol L 的2CaCl 溶液中,2Cl 20.c()50m =2c(Ca ol L 1Cl ).0L =mol -⨯=,答案选B 。
5.(2021年海南省普通高中学业水平合格性考试)钙元素在人体血液中以钙离子的形式存在,正常指标参考值为2.13×10-3~2.70 ×10-3 mol·L -1。
考点06 一定物质的量浓度溶液的配制-高考化学二轮复习专题练(通用版) (解析版)
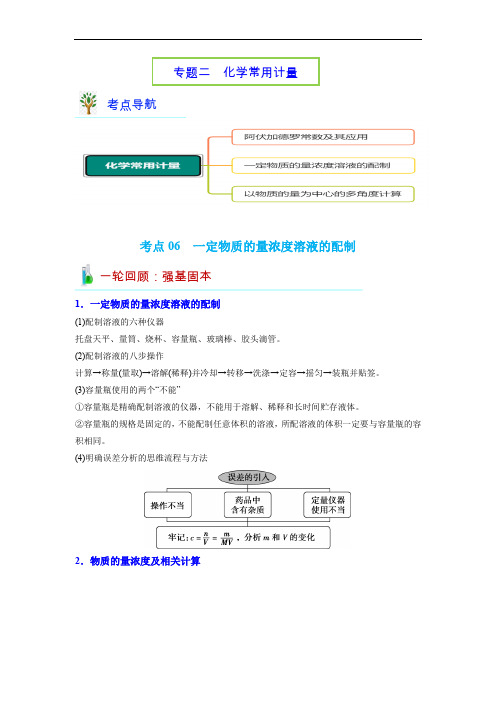
专题二化学常用计量考点导航考点06 一定物质的量浓度溶液的配制一轮回顾:强基固本1.一定物质的量浓度溶液的配制(1)配制溶液的六种仪器托盘天平、量筒、烧杯、容量瓶、玻璃棒、胶头滴管。
(2)配制溶液的八步操作计算→称量(量取)→溶解(稀释)并冷却→转移→洗涤→定容→摇匀→装瓶并贴签。
(3)容量瓶使用的两个“不能”①容量瓶是精确配制溶液的仪器,不能用于溶解、稀释和长时间贮存液体。
②容量瓶的规格是固定的,不能配制任意体积的溶液,所配溶液的体积一定要与容量瓶的容积相同。
(4)明确误差分析的思维流程与方法2.物质的量浓度及相关计算易错点聚焦溶液配制操作的注意事项(1)仪器的选用要注意思维有序,从配制步骤角度排查还需要的仪器。
(2)用玻璃棒引流时,玻璃棒末端应插入刻度线以下并接触瓶壁,但玻璃棒不能接触瓶口。
(3)溶液配制过程中,若有任何引起误差的操作均应重新配制。
(4)导致溶液浓度偏低的错误操作:NaOH在称量纸上称量;左码右物(用游码);洗涤或转移时溶液溅出;未洗涤烧杯及玻璃棒;超过刻度线时用胶头滴管吸出液体;定容时仰视;定容摇匀后发现液面低于刻度线再加水。
(5)导致溶液浓度偏高的错误操作:砝码生锈;定容时俯视;未等溶液冷却至室温就定容。
二轮突破:强弱克难一、一定物质的量浓度溶液配制的常考点分析1.配制一定物质的量浓度的溶液,填写缺少的仪器一般从以下三种仪器中选择:容量瓶、胶头滴管、玻璃棒,填写时一定要注明容量瓶的规格。
2.误差分析的来源(1)导致c B偏低的错误操作:垫滤纸称量NaOH固体;左码右物(用游码);称量时间过长(潮解);洗涤或转移时溶液溅出;未洗涤烧杯及玻璃棒;超过刻度时用滴管吸出液体;定容时仰视;定容后发现液面低于刻度线再加水。
(2)导致c B偏高的错误操作:砝码生锈;定容时俯视;未等溶液冷却至室温就定容。
(3)定容时俯视、仰视对结果的影响:务必确保按眼睛视线→刻度线→凹液面最低点的顺序,做到“三点一线”。
2021届高考二轮精品专题二 化学计量及其应用 教师版

1.了解物质的量及其单位摩尔(mol)、摩尔质量、气体摩尔体积、物质的量浓度和阿伏加德罗常数的含义。
2.根据物质的量与微粒(分子、原子、离子等)数目、气体摩尔体积(标准状况)之间的相互关系进行相关计算。
3.了解溶液浓度的表示方法,理解溶液中溶质的质量分数和物质的量浓度的概念,并进行相关计算。
4.掌握配制一定溶质质量分数的溶液和物质的量浓度溶液的方法。
5.关系式法计算在滴定中的应用。
新课标全国卷命题强调知识的综合性,往往通过阿伏加德罗常数将化学基本概念、基本原理、以及元素化合物知识与化学计量联系起来,从物质状态、物质组成、化学键、气体摩尔体积、弱电解质的电离、盐类水解、以及氧化还原反应中电子的转移等角度设计问题。
Ⅰ.客观题(1)考查“常数”:结合阿伏加德罗常数,以物质的组成、电解质溶液、氧化还原反应等为载体,考查摩尔质量、气体摩尔体积、溶液浓度、电子转移数目等的简单计算。
(2)考查“实验”:结合一定物质的量浓度溶液的配制,考查仪器使用、基本操作和误差分析。
(3)考查“化学用语”:化学式、分子式、电子式、结构简式、结构示意图的判断。
Ⅱ.主观题(考查“计算”)(1)与氧化还原反应、化学反应与能量、反应速率、平衡常数等相结合考查物质的量、物质的量浓度的相关计算。
(2)渗透于化学工艺流程题或综合实验题中,考查物质的量浓度的相关计算。
(3)在综合题中,考查常用的化学用语及方程式的书写。
(4)在综合题中,常常应用关系式法和滴定结合计算物质的含量的测定。
一、常用化学计量——物质的量1.与物质的量相关的重要定律阿伏伽德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
注意:(1)使用范围:气体(2)使用条件:同温、同压、同体积(3)特例:标准状况下的气体摩尔体积(V m=22.4L/mol)质量守恒定律:参加反应的各物质质量总和等于反应后生成物的质量总和(或反应前后各原子的种类及个2.物质的量和其它物理量之间的关系3.物质的量在化学计算中的典型应用(1)物质的量与其他化学常用计量间的相互求算,是重要的基本化学计算。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2021年高考化学二轮复习专题训练物质的量浓度一、单项选择题1.已知某饱和溶液的①体积、②密度、③溶质和溶剂的质量比、④溶质的摩尔质量,要根据溶质的溶解度计算该溶液的物质的量浓度,上述条件中必不可少的是( )A.②④B.①④C.①②③D.①②③④2.(xx·广州模拟)质量分数为a%,物质的量浓度为cmol·L-1的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为( )A.等于2cmol·L-1B.大于2cmol·L-1C.小于2cmol·L-1D.在c2cmol·L-1之间3.配制100mL0.1mol·L-1Na2CO3溶液,下列操作正确的是( )A.称取1.06g无水碳酸钠,加入100mL容量瓶中,加水溶解、定容B.称取1.06g无水碳酸钠,加入100mL蒸馏水,搅拌、溶解C.转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中D.定容后,塞好瓶塞,反复倒转,摇匀4.(xx·广州模拟)由硫酸钾、硫酸铝和硫酸组成的混合溶液的pH=1,其中c(Al3+)=0.4mol·L-1,c(S)=0.8mol·L-1,则c(K+)为( )A.0.15mol·L-1B.0.2mol·L-1C.0.3mol·L-1D.0.4mol·L-15.标准状况下,VL氨气溶解在1L水中(水的密度近似为1g·mL-1),所得溶液的密度为ρg·mL-1,质量分数为ω,物质的量浓度为cmol·L-1,则下列关系中不正确的是( )A.ρ=B.ω=C.ω=D.c=6.配制250mL0.10mol·L-1NaOH溶液时,下列实验操作会使所配得的溶液浓度偏大的是( )A.转移溶液后未洗涤烧杯和玻璃棒就直接定容B.在容量瓶中定容时仰视刻度线C.在容量瓶中定容时俯视刻度线D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度7.(xx·无锡宜兴一中改编)下列叙述正确的是( )A.将5.85gNaCl晶体溶入100mL水中,制得0.1mol·L-1NaCl溶液B.将1体积cmol·L-1硫酸溶液用水稀释为5体积,得到0.2cmol·L-1硫酸溶液C.将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol·L-1D.将wga%的NaCl溶液蒸发掉g水,得到4a%的NaCl溶液8.(xx·合肥一中)现有VL浓度是0.5mol·L-1的盐酸,欲使其物质的量浓度增大一倍,采取的措施可行的是( )A.通入标准状况下的HCl11.2LB.加入10mol·L-1盐酸0.1VL,再稀释至1.5VLC.将溶液加热浓缩至0.5VLD.加入VL1.5mol·L-1盐酸混合均匀9.在配制一定物质的量浓度的HCl溶液时,下列错误操作可使所配制的溶液浓度偏高的是( )A.用量筒量取浓盐酸时仰视读数B.稀释搅拌时有液体飞溅C.定容时仰视容量瓶瓶颈刻度线D.摇匀后见液面下降,再加水至刻度线10.配制一定物质的量浓度溶液时,下列操作对所配得的溶液的浓度无影响的是( )A.使用蒸馏水洗涤容量瓶后未进行干燥B.固体样品溶解于水后立即转移到容量瓶C.转移溶液时,少量溶液溅出容量瓶D.移液后未洗涤烧杯和玻璃棒二、非选择题11.(1)下图是某医院病人输液使用的一瓶质量分数为5%的葡萄糖注射液标签,请认真观察标签上所列内容后填空:①该溶液中含水g。
②该溶液的密度约为g·mL-1。
③该溶液的物质的量浓度为。
(2)某溶液中含有Na+、Mg2+、Cl-、S四种离子,其中,Na+、Mg2+、Cl-离子个数比为4∶7∶6,若Na+个数为4a,则S个数为。
(3)标准状况下,336LNH3溶于1L水中,所得溶液的质量分数为,若该溶液的密度为ag·cm-3,则物质的量浓度为。
将上述氨水全部转化为NH4Cl,所需4mol·L-1盐酸的体积为。
(4)10.6gNa2CO3溶于水配成1L溶液:①该溶液中Na2CO3的物质的量浓度为,溶液中Na+的物质的量浓度为。
②向该溶液中加入一定量NaCl固体,使溶液中Na+的物质的量浓度为0.4mol·L-1(假设溶液体积不变)需加入NaCl的质量为,Cl-的物质的量浓度为。
12.实验室用密度为1.25g·mL-1,质量分数为36.5%的浓盐酸配制0.1mol·L-1盐酸,请回答下列问题:(1)浓盐酸的物质的量浓度为。
(2)实验中需要用240mL0.1mol·L-1盐酸,请完成下表:应量取浓盐酸的体积/mL 应选用容量瓶的规格/mL(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.用30mL水洗涤23次,洗涤液均注入容量瓶,振荡B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀C.将已冷却的盐酸沿玻璃棒注入容量瓶中D.将容量瓶盖紧,振荡,摇匀E.改用加水,使溶液凹液面恰好与刻度线相切F.继续往容量瓶内小心加水,直到液面接近刻度线处(4)操作A中,将洗涤液都移入容量瓶,其目的是。
(5)若实验过程中出现如下情况,应如何处理?①加蒸馏水时不慎超过了刻度线。
②向容量瓶中转移溶液时不慎有溶液溅出。
13.实验室用碳酸钠晶体配制1.00mol·L-1Na2CO3溶液100mL,回答下列问题:(1)所需主要仪器为药匙、、、、、和。
(2)本实验需称量碳酸钠晶体(Na2CO3·10H2O)的质量为g。
(3)容量瓶上标有、等字样及。
(4)容量瓶使用前检验是否漏水的方法是。
(5)某同学将称量好的碳酸钠晶体用适量的蒸馏水在烧杯中溶解,冷却后直接倒入所选的且经检查不漏水的容量瓶中,洗涤烧杯23次,洗涤液也移至容量瓶中,然后加水至离刻度线2cm处,改用滴管加水至刻度线,然后将溶液转移到试剂瓶中,请指出上述操作中的3处错误。
①。
②。
③。
14.(xx·广州执信中学)某同学进行实验探究时,欲配制1.0mol·L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(相对分子质量为315)。
在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。
为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100gH2O)分别为2.5、3.9和5.6。
(1)烧杯中未溶物仅为BaCO3,理由是。
(2)假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计实验方案,进行成分检验,在下表中写出实验步骤、预期现象和结论。
(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管。
(3)将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量。
实验如下:①配制250mL约0.1mol·L-1Ba(OH)2·8H2O溶液:准确称取wg试样,置于烧杯中,加适量蒸馏水, ,将溶液转入,洗涤,定容,摇匀。
②滴定:准确量取25.00mL所配的Ba(OH)2溶液于锥形瓶中,滴加指示剂,将(填“0.020”、“0.05”、“0.1980”或“1.5”)mol·L-1盐酸装入50mL酸式滴定管,滴定至终点,记录数据。
重复滴定2次。
平均消耗盐酸VmL。
③计算Ba(OH)2·8H2O的质量分数= (只列出算式,不做运算)。
(4)室温下, (填“能”或“不能”)配制1.0mol·L-1Ba(OH)2溶液。
专题一化学实验基础课时5 物质的量浓度1.A2.B3.D4.C5.A6.C7.B8.B9.A10.A11.(1)①237.5 ②1 ③0.278mol·L-1(2)6a(3)20.32% 11.95amol·L-1 3.75L(4)①0.1mol·L-10.2mol·L-1②11.7g 0.2mol·L-1(4)①10.6g碳酸钠为0.1mol,则Na2CO3的物质的量浓度为0.1mol·L-1,Na+的物质的量浓度为0.2mol·L-1。
②钠离子浓度扩大1倍,则所加入氯化钠的钠离子为0.2mol,即氯化钠质量为11.7g,氯离子浓度为0.2mol·L-1。
12.(1)12.5mol·L-1(2)2 250 (3)BCAFED 烧杯和玻璃棒胶头滴管12cm (4)将溶质全部转移到容量瓶中,否则所配浓度偏小(5)①需要重新配制,否则浓度偏小②需要重新配制,否则浓度偏小13.(1)托盘天平烧杯量筒玻璃棒100mL容量瓶胶头滴管(2)28.6 (3)100mL 20℃刻度线(4)往容量瓶内加适量水,塞好瓶塞,用食指顶住瓶塞,用另一只手的五指托住瓶底,把瓶倒立过来,如不漏水,把瓶正立过来,将瓶塞旋转180°后塞紧,再把瓶倒立过来,若不漏水,才能使用(5)①不应将液体直接倒入容量瓶中,而应用玻璃棒引流②洗涤液注入容量瓶之后、向容量瓶中加蒸馏水之前,应将溶液振荡摇匀③定容后应将容量瓶倒转摇匀(3)容量瓶上标有容积、温度和刻度线。
(5)根据实验操作及所用仪器来找操作中的错误。
14.(1)Ba(OH)2·8H2O与CO2作用转化为BaCO3(2)(3)①溶解、过滤250mL容量瓶中②0.1980③×100%(4)不能③25×c×2=0.1980×V得c=V,Ba(OH)2·8H2O的质量分数=×100%。
(4)若能配成,则1L1.0mol·L-1Ba(OH)2溶液含171gBa(OH)2,可以推测100mLBa(OH)2溶液含Ba(OH)217.1g,但293K时Ba(OH)2溶解度只有3.9。
23291 5AFB 嫻 32583 7F47 罇oD38919 9807 頇W20166 4EC6 仆 28927 70FF 烿35624 8B28 謨38750 975E 非[#。
