环氧乙烷残留量检验报告
环氧乙烷残留量检测

环氧乙烷残留量检测
动物半致死剂量(LD50):72mg/kg(大鼠、吞食) 动物半致死浓度(LC50):800ppm(4小时,大 鼠、吸入)
立即危害浓度(IDLH):致癌性物质,800ppm 致癌性:确定人体致癌性
环氧乙烷残留量检测
废弃处置方法: 不含过氧化物的废液经浓缩后, 控制一定的速度燃烧。含过氧化物的废液经浓
气相色谱法其缺点是仪器价格贵,但是操作简便用 时短,结果准确灵敏。
本文主要介绍环氧乙烷的气相色谱测定方法。
环氧乙烷残留量检测
二.医疗器械环氧乙烷灭菌 残留量的气相色谱测定方法
环氧乙烷残留量检测
GB-T 14233.1-1998、GB 15980-1995和 GB/T16886.7-2001都有详细的介绍环氧乙 烷灭菌残留量的测定方法。
GB 15980-1995:用100ml玻璃针筒从纯环氧乙烷小 钢瓶中抽取环氧乙烷标准气(重复放空二次,以排除原 有空气),塞上橡皮头,用10ml针筒抽取上述100ml针 筒中纯环氧乙烷标准气10ml,用氮气稀释到100ml(可 将10ml标准气注入到已有90ml氮气的带橡皮塞头的针筒 中来完成)。用同样方法根据需要再逐级稀释2~3次 (稀释1000~10000倍),作三个浓度的标准气体。按 换氧乙烷小钢瓶中环氧乙烷的纯度、稀释倍数和室温计 算出最后标准其中的环氧乙烷浓度。
环氧乙烷残留量检测
在《GB-T 14233.1-1998医用输血、输 液、注射器具检验方法 第一部分化学分 析方法 第三篇 环氧乙烷残留量测定方法》 中有介绍气相色谱法和比色分析法。其中 气相色谱法的原理就是在一定的温度下, 用水作为萃取剂萃取样品中所含的环氧乙 烷,用顶空气相色谱法测定环氧乙烷的含 量。
环氧乙烷残留量检测方法学验证

环氧乙烷残留量检测方法学验证一、目的二、背景三、范围四、组织与职责五、内容六、附件仅供参考一、目的用气相色谱GC-2010A型气相色谱仪(含顶空器)进行环氧乙烷残留量的检测方法学的研究,证明其适用于塑料瓶环氧乙烷残留量的检测。
二、背景环氧乙烷在医疗器械及卫生用品的消毒方面应用广泛。
在药品包装材料生产领域,口服药用塑料瓶在内包装后也进行环氧乙烷灭菌。
环氧乙烷穿透性强,消毒后因被消毒材料对其吸附能力不同,其完全消散时间也不同。
残留的环氧乙烷对人体有一定的毒性,因此需要对灭菌后的塑料瓶进行环氧乙烷残留的检测。
气相色谱法是采用气体为流动相流经装有填充剂的色谱柱进行分离测定的色谱方法。
物质经气化后被载气带入色谱柱进行分离,各组分先后进入检测器,用数据处理系统记录色谱信号。
现采用顶空法来检测环氧乙烷残留。
样品在顶空器内先将环氧乙烷气化,气化后的环氧乙烷再进入气相色谱中。
顶空法的另外一个优点就是能提高检测的灵敏度。
根据《医疗东西生物学评价第7部分:环氧乙烷灭菌残留量》(参考文献《顶空毛细管柱气相色谱法测定口服药用塑料瓶中环氧乙烷残留量》(XXX,XXX)中方法:检测前提为:1)顶空器前提:炉温(OVEN TEMP):70℃样品检测时间(SAMPL INTERV):10min阀温(MANIF TEMP):80℃管道温度(TUBE TEMP):80℃平衡时间(INCUB TIME):20min2)气相条件:色谱柱HP-INNOWAX柱长30m,直径0.320mm,膜厚0.25μm进样口温度:200℃柱温:70℃检测器温度:250℃三、范围本验证方案适用于GC-2010A型气相色谱仪(含顶空器)检测药用滴眼剂塑料瓶(免洗)环氧乙烷残留量的方法学验证。
四、组织及职责五、内容1系统适应性试验仅供参考色谱系统的适应性试验包括理论板数(n)和拖尾因子(T)。
1)、色谱柱的理论板数(n):用于评价色谱柱的分离效果。
在检测中的测定物质为环氧乙烷,其理论板数不得小于4000.2)、拖尾系数(T):用于评价色谱峰的对称性。
环氧乙烷灭菌验证报告.doc

消毒灭菌方法本消毒服务站是采用的HMQ-3型环氧乙烷菌器[卫生许可证号:(2002)京卫消准字第0025号],进行消毒灭菌处理。
环氧乙烷浓度:≥99.6%灭菌温度:54±2℃,水箱温度:90℃箱体温度:上限56℃,下限52℃相对湿度:(30-80)%RH抽真空速率:1.5kpa/min加药量: 2.5kg预热时间: 2.5h消毒灭菌时间: 8h换气次数: 3次压力控制范围: -0.08Mpa~+0.08Mpa,控制误差: ±0.005Mpa。
环氧乙烷消毒灭菌验证方案1目的:对HMQ-3型灭菌器按规定要求进行验证,根据所得数据对本消毒服务站的灭菌工艺进行修改和完善。
2验证依据:GB18279-2000《医疗器械-环氧乙烷灭菌确认与常规控制》。
3验证时间:200X年X月~200X年X月4验证人员:XXX XXX XXX XXX5人员分工:XXX:负责整个灭菌验证过程组织、协调工作。
XXX:负责设备的接收、操作、维修和确认。
XXX:负责计量仪器的鉴定。
XXX:负责灭菌的日常操作。
XXX、XXX:负责生物指示剂和微生物的检测。
XXX:负责领导此次验证,并对报告进行确认。
6 具体验证项目:6.1 交付试验:6.1.1 试运行, 检验灭菌器的具体使用情况和基本性能。
6.1.2 验证所有计量仪器、仪表是否具有法定检定机构检定的合格证。
6.1.3 空载试验:验证设备空箱时的温度均匀分布情况和升温速率。
6.1.4 负载试验:验证设备在装载产品时的温度均匀分布情况,以及各个点的升温速率。
6.1.5 校正温度传感探头。
6.2 物理性能确认6.2.1 确认设备的抽真空速率。
6.2.2 验证设备的加温能力。
6.2.3 进行设备的真空正压泄漏度试验。
7 微生物性能确认7.1 半周期法:在灭菌工艺、负载、装载时、包装不变的情况下,将已知含菌量的符合标准的生物指示剂放置负载中,分3个灭菌作用时间进行灭菌,找出细菌全部杀灭时间临界值,确认2次,从而确定能全部杀灭细菌安全的灭菌所用时间。
环氧乙烷残留量检验原始记录.docx
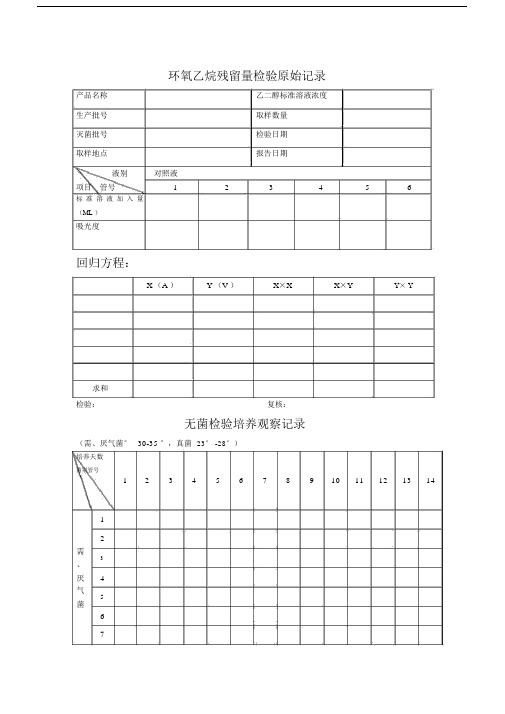
环氧乙烷残留量检验原始记录
产品名称乙二醇标准溶液浓度
生产批号取样数量
灭菌批号检验日期
取样地点报告日期
液别对照液
项目管号123456
标准溶液加入量
(ML )
吸光度
回归方程:
X (A )Y (V )X×X X×Y Y× Y
求和
检验:复核:
无菌检验培养观察记录
(需、厌气菌°30-35 °,真菌23° -28°)
培养天数
菌别管号
1234567891011121314
1
2
需
3
、
厌4
气
5
菌
6
7
8
9
10
阳性对照
阴性对照
1
2
3
4
5
真
菌6
7
8
9
10
结论:
无菌检查原始记录
检验名称规格检验数量生产批号灭菌批号
检验日期完成日期
检查方法浸提法□投入法□检验依据根据2010 版《中华人民共和国药典》二部中《无菌检查法》
培养基供液:
硫乙醇酸盐(流体)培养基供液
生产批号
有效期限
生产厂家
培养基量ml/管接种管数管接种量ml/管
改良马丁培养基供液
生产批号有效期限
生产厂家
培养基量ml/管阳性对照:金黄色葡萄菌【稀释倍数:
接种均数:
检验:接种管数管
CMCC(B)26003 】
接种量:
接种代数:
复核:
接种量ml/管
ml。
环氧乙烷残留量检测方法学验证

欢迎阅读目录一、 目的 二、 背景 三、 范围 四、 组织与职责 五、 六、用气相色谱GC-2010A型气相色谱仪(含顶空器)进行环氧乙烷残留量的检测方法学的研究,证明其适用于塑料瓶环氧乙烷残留量的检测。
二、背景环氧乙烷在医疗器械及卫生用品的消毒方面应用广泛。
在药品包装材料生产领域,口服药用塑料瓶在内包装后也进行环氧乙烷灭菌。
环氧乙烷穿透性强,消毒后因被消毒材料对其吸附能力不同,其完全消散时间也不同。
残留的环氧乙烷对人体有一定的毒性,因此需要对灭菌后的塑料瓶进行环物质经气现采用),环氧浙江(1阀温((2)气相条件:色谱柱HP-INNOWAX柱长30m,直径0.320mm,膜厚0.25μm进样口温度:200℃柱温:70℃检测器温度:250℃三、范围本验证方案适用于GC-2010A型气相色谱仪(含顶空器)检测药用滴眼剂塑料瓶(免洗)环氧乙烷残留量的方法学验证。
四、组织及职责1系统适应性试验色谱系统的适应性试验包括理论板数(n)和拖尾因子(T)。
1)、色谱柱的理论板数(n):用于评价色谱柱的分离效果。
在检测中的测定物质为环氧乙烷,其理论板数不得小于4000。
2)、拖尾系数(T):用于评价色谱峰的对称性。
为保证分离效果和测量精度,环氧乙烷峰的拖尾系数应不得大于1.5。
取100ml解,、2专属性化水+3检测限4线性、1.25ug/ml5准确度高浓度环,3个分别加入5ml低浓度环氧乙烷标准品溶液1.25ug/ml,按上述方法测定环氧乙烷浓度,计算加样回收率。
回收率应满足80%~120%之间。
回收率(%)= 通过峰面积计算环氧乙烷标准品溶液实际浓度(以3次的平均值计)×100% 环氧乙烷标准品溶液的理论浓度6精密度1)重复性取5ml环氧乙烷标准品溶液2.5ug/ml置于顶空瓶中,重复进样6个,计算RSD,RSD应小于3%。
2)中间精密度取5ml环氧乙烷标准品溶液2.5ug/ml,置于顶空专用瓶中,按上述方法测定环氧乙烷浓度,由不同人员,不同时间共计完成3次检测,每次检测制备3个样品作为平行,并计算RSD。
一次性使用输液器 (带针)EO残留量解析时间的确定和验证报告

一次性使用输液器(带针)环氧乙烷残留量扩散曲线放行程序的验证报告确认依据:ISO10993.7-2008、GB/T16886.7-2001ISO11135.1-2007、GB18279-2000编制:日期:年月日审核:日期:年月日批准: 日期: 年月日一次性使用输液器(带针)环氧乙烷残留量扩散曲线的确认一、重新验证的条件1、生产工艺(新产品和原料等)、包装、通风条件等发生改变;2、新的灭菌设备投入生产;3、灭菌设备的重新复审和确认;三、重新验证的原因灭菌设备的重新确认。
四、验证原理与目的:灭菌周期完成后,EO从多数材料和被灭菌产品上的扩散遵循一级动力学原理,即In[EO]正变于灭菌后的时间,根据实验测定不同灭菌批次的样品EO 的残留量,再由其浓度的自然对数对应于灭菌后时间的曲线为线性,来确定扩散曲线的线性方程,再用其方程预测与该样品同类产品的EO残留量达到标准要求所需的时间;同理用此扩散曲线来确定今后连续生产的产品,被灭菌后EO残留量的解析时间,作为该类一族相似产品放行上市的依据。
200X年XX月XX日~XX月XX日七、验证步骤:1、样品的来源与抽样方法样品来源:本次验证自定选用型号规格为:Va-10.55×20(B)、生产批号为:20080716的一次性使用输液器(带针)。
抽样方法:按照GB18279所述的受控条件制造并灭菌的产品,如果数据来自不同时间的三个以上的灭菌批,产品就可以放行的原则。
进行抽样灭菌批号为:08071721、08071921、08072121、08072321;每个灭菌批的样品均为 6 套,总共24套分析样品;2、样品的处理在样品分析之前,把样品与同类产品在相同的解析环境下共同存放;待到验证要求的时间,将其样品与产品分离,迅速冷藏、密闭封存转置化验室,在尽可能短的时间内对样品进行分析。
3、分析方法与实验原理分析方法:根据GB/T14233.1-1998《医用输液、输血、注射器具检验方法第1部分:化学分析方法》第三篇环氧乙烷残留量分析方法9、气相色谱法。
EO解析曲线图

E O解析曲线图-CAL-FENGHAI.-(YICAI)-Company One1环氧乙烷残留量解析周期分析报告(解析温度: 12-28℃)1、产品名称:一次性使用药液转移器2、规格: YZQ-1 包装材料:纸塑包装生产批号:150401 装量:1套3、生产厂家:湖南慈辉医疗科技有限公司4、检测依据:ISO10993-7 医疗器械生物学评价环氧乙烷灭菌GB/ 医用输液、输血、注射器具检验方法第1部分:化学分析方法5、通风区条件通风是在独立的通风区域内进行,采用大功率的排气扇来强制气体循环、通风良好。
6、检测方法(极限浸提法)供试液制备:取药液转移器去包装后精确称量(mg),将其截为10mm2的片状物,取放入20mL萃取容器,精密加入5mL水,密封,(v),在60℃±1℃下平衡40min。
环氧乙烷标准贮备液的配制:取外部干燥的50mL容量瓶,加入约30mL水,加瓶塞,精确称重。
用注射器注入约环氧乙烷,不加瓶塞,轻轻摇匀,称重,前后两次称之差,即为溶液中所含环氧乙烷重量。
加水至刻度制成约含环氧乙烷10mg/mL的溶液,作为标准贮备液。
绘制标准曲线:用贮备液配制1ug/mL—10ug/mL六个系列浓度的标准溶液。
精确量取5mL,置20mL萃取容器中,密封,恒温(60℃±1℃)中平衡40min。
用进样器依次从平衡后的标准样迅速取上部气体,注入进样室,记录环氧乙烷的峰高(或面积)。
绘出标准曲线(X:EO浓度,ug/mL;Y:峰高或面积)。
试验样品的测量:用进样器从平衡后的试样萃取容器中迅速取上部气体,注入进样室,记录环氧乙烷的峰高(或面积)。
根据标准曲线计算出相应的浓度。
7、检测条件:柱箱温度:120℃进样器温度:200℃检测器温度:250℃氮气压力:a氢气压力:a电压:-10~10UF进样方式:一次性进样进样量:1000uL8、测试结果:灭菌日期:2015年4月30日灭菌主要参数:温度:50℃湿度:63%灭菌剂量:预真空:-15KPa灭菌时间:8H灭菌后第3天:解析区室温:20℃计算:W EO=5c1/m C1-标准曲线上找出的供试液相应的浓度,ug/mlm-称样量,gC1=样品的峰面积/标样的峰面积*标样浓度*1=5*=g灭菌后第5天:解析区室温:21℃计算:W EO=5c1/mc1=*1=5*= ug/g灭菌后第7天:解析区室温:24℃计算:W EO=5c1/mC1 =*1=5*= ug/g灭菌后第9天:解析区室温:25℃计算:W EO=5c1/mC1=*1=*5/=g灭菌后第12天:解析区室温:26℃计算:W EO=5c1/mC1=*1=5*= ug/g灭菌后第17天:解析区室温:26℃计算:W EO=5c1/mC1=*1=5*= ug/g10、分析:根据以上数据分析,该产品灭菌后第5天,EO残留量就已达到产品技术要求规定的范围内,随着解析时间的延长,EO的残留越来越少,解析的速度在前9天较快,在解析9天之后,解析的速度变绶。
环氧乙烷灭菌验证报告

消毒灭菌方法本消毒服务站是采用的HMQ-3型环氧乙烷菌器[卫生许可证号:(2002)京卫消准字第0025号],进行消毒灭菌处理。
环氧乙烷浓度:≥99.6%灭菌温度:54±2℃,水箱温度:90℃箱体温度:上限56℃,下限52℃相对湿度:(30-80)%RH抽真空速率:1.5kpa/min加药量: 2.5kg预热时间: 2.5h消毒灭菌时间: 8h换气次数: 3次压力控制围: -0.08Mpa~+0.08Mpa,控制误差: ±0.005Mpa。
环氧乙烷消毒灭菌验证方案1目的:对HMQ-3型灭菌器按规定要求进行验证,根据所得数据对本消毒服务站的灭菌工艺进行修改和完善。
2验证依据:GB18279-2000《医疗器械-环氧乙烷灭菌确认与常规控制》。
3验证时间:200X年X月~200X年X月4验证人员:##X ##X ##X ##X5人员分工:##X:负责整个灭菌验证过程组织、协调工作。
##X:负责设备的接收、操作、维修和确认。
##X:负责计量仪器的鉴定。
##X:负责灭菌的日常操作。
##X、##X:负责生物指示剂和微生物的检测。
##X:负责领导此次验证,并对报告进行确认。
6 具体验证项目:6.1 交付试验:6.1.1 试运行, 检验灭菌器的具体使用情况和基本性能。
6.1.2 验证所有计量仪器、仪表是否具有法定检定机构检定的合格证。
6.1.3 空载试验:验证设备空箱时的温度均匀分布情况和升温速率。
6.1.4 负载试验:验证设备在装载产品时的温度均匀分布情况,以与各个点的升温速率。
6.1.5 校正温度传感探头。
6.2 物理性能确认6.2.1 确认设备的抽真空速率。
6.2.2 验证设备的加温能力。
6.2.3 进行设备的真空正压泄漏度试验。
7 微生物性能确认7.1 半周期法:在灭菌工艺、负载、装载时、包装不变的情况下,将已知含菌量的符合标准的生物指示剂放置负载中,分3个灭菌作用时间进行灭菌,找出细菌全部杀灭时间临界值,确认2次,从而确定能全部杀灭细菌安全的灭菌所用时间。
医疗器械-环氧乙烷验证报告

验证合格证书验证项目名称:XXXXXXXXXXXXXX环氧乙烷灭菌验证验证方案编号:验证报告编号:验证完成日期:验证有效期至:上述验证项目已按确认方案进行确认,各项确认结果符合标准要求,批准该验证项目投入使用。
管理者代表签名:年月日XXXXX环氧乙烷灭菌验证报告目录1. 概述2. 验证目的3. 相关文件4. 验证组织职责5. 验证实施时间6. 验证内容与方法7. 漏项、偏差的处理程序8. 验证周期9. 验证结果评定与结论10.附件附件1:产品族划分研究附件2:灭菌协议附件3:人员资格确认表附件4:灭菌适用性确认表附件5:生物指示剂检测报告附件6:环氧乙烷灭菌剂检验报告附件7:初始微生物负载检验记录附件8:HQM-系列环氧乙烷灭菌器确认验证报告附件9:环氧乙烷灭菌器运行记录附件10:无菌检验记录附件11:生物指示剂检验记录附件12:成品检验记录附件13:环氧乙烷残留量检验记录1.概述宁波骏马医用器械有限公司生产的XXXXXXXXXXX将会直接与患者的器官和组织接触,器械以无菌的形式提供给医院。
XXXXXXXXXXX的包装总体分3层,从内向外依次是无菌包装、彩盒包装和瓦楞纸箱包装。
每一个无菌包装中放置一套器械,瓦楞纸箱包装是最终的运输包装。
其中无菌包装是由两部分组成的,医用聚乙烯薄膜和透析纸。
然后用专用的热封机将封口热封合到一起,形成完整的阻菌屏障。
由于透析纸具有一定的通气性,故EO混合气体可以穿过盖材进入包装内,从而实现杀灭的目地。
2.验证目的通过本次测试,验证XXXXX系列产品采用的热封工艺和EO灭菌工艺,产品能够达到以下标准:a)热封工艺有稳定可重复的输出结果,满足厂内标准;b)在合适的EO灭菌工艺参数下能确保足够的无菌保证水平;c)能可靠的在有效期内处于无菌状态;d)灭菌工艺对产品的使用性能不产生影响;3.相关文件3.1 环氧乙烷灭菌器作业指导书3.2 《医疗器械生产质量管理规范》及无菌医疗器械附录4.验证组织职责4.1验证人员职责管理者代表:负责验证方案、验证报告的批准;负责签发验证证书。
01、环氧乙烷残留检验记录
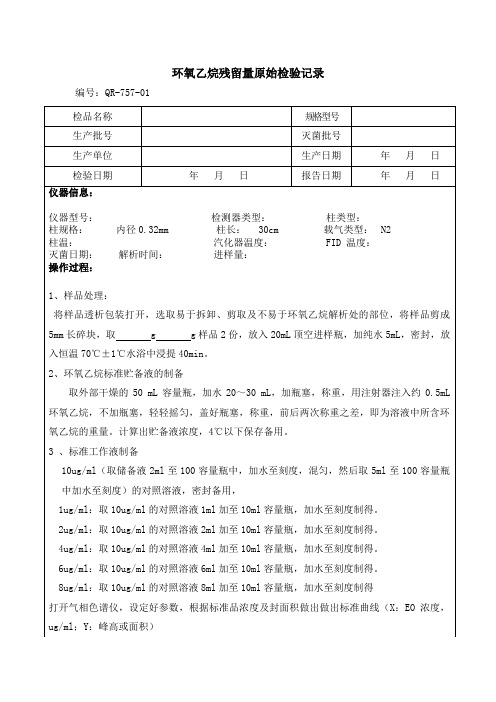
6ug/ml:取10ug/ml的对照溶液6ml加至10ml容量瓶,加水至刻度制得。
8ug/ml:取10ug/ml的对照溶液8ml加至10ml容量瓶,加水至刻度制得
打开气相色谱仪,设定好参数,根据标准品浓度及封面积做出做出标准曲线(X:EO浓度,ug/ml;Y:峰高或面积)
分 析 结 果
峰号
组份
保留时间
面积
高度
面积/高度
面积百分含量
分离度
拖尾因子
Байду номын сангаас理论塔板
1
2
3
4
5
6
合计:
根据标准曲线计算出样品中环氧乙烷残留量。
CEO= 5c/m
CEO---产品中环氧乙烷的相对含量,单位为微克每克
5 ---量取浸提液的体积
C ---标准曲线上找出供试液相应的浓度,单位为微克每毫升
M---称样量单位为克
3 、标准工作液制备
10ug/ml(取储备液2ml至100容量瓶中,加水至刻度,混匀,然后取5ml至100容量瓶中加水至刻度)的对照溶液,密封备用,
1ug/ml:取10ug/ml的对照溶液1ml加至10ml容量瓶,加水至刻度制得。
2ug/ml:取10ug/ml的对照溶液2ml加至10ml容量瓶,加水至刻度制得。
检验结果:
结 论
本品依据环氧乙烷灭菌残留量检验标准检测,结果:
负责人
复核人
检验人
1、样品处理:
将样品透析包装打开,选取易于拆卸、剪取及不易于环氧乙烷解析处的部位,将样品剪成5mm长碎块,取gg样品2份,放入20mL顶空进样瓶,加纯水5mL,密封,放入恒温70℃±1℃水浴中浸提40min。
EO残留量测试原始记录

EO残留量测试原始记录实验名称:EO残留量测试目的:测定其中一种产品中的EO(环氧乙烷)残留量,确保产品符合相关标准。
实验仪器:EO残留量测试仪、实验样品、外部标准实验步骤:1.准备工作:a.将测试仪校准并确保其正常工作。
b.准备实验样品,确保样品的数量足够进行测试,并确保样品的代表性。
c.预处理实验样品,例如去除可能的污染物等。
2.采样:a.使用已校准的采样器,从样品中采集足够数量的样品。
b.将样品放入标记好的容器中,确保容器干净,并记录样品的相关信息,如采样时间、样品编号等。
3.测试:a.将样品放入测试仪中,并将仪器设置为相应的测试方法。
b.启动测试仪,按照仪器说明书的要求进行测试。
c.在测试完成后,仔细记录测试结果,包括残留量的数值以及单位等。
4.外部标准检查:a.使用提前准备好的外部标准进行检查。
b.将外部标准加入测试仪器中进行测试,以验证仪器的准确度。
c.比较外部标准的测试结果与已知值,并记录比较结果。
5.数据处理:a.将测试结果进行统计分析,计算平均值和标准偏差等。
b.比较测试结果与产品标准要求进行对比,并判断是否合格。
实验注意事项:1.实验过程中需要佩戴适当的个人防护装备,如实验手套、安全眼镜等。
2.样品处理过程中需要避免污染,避免使用可能导致实验污染的材料和设备。
3.确保仪器的准确度,使用外部标准进行验证。
4.实验过程中应注意操作规范,避免误操作导致数据错误。
5.尽量保持实验环境的稳定,避免干扰因素对实验结果的影响。
6.实验结果需要进行统计分析并与产品标准要求进行对比,以确保产品的质量符合相关标准。
实验结果记录:实验样品编号:001采样时间:2024年9月1日测试结果:残留量为5.6 mg/kg实验样品编号:002采样时间:2024年9月3日测试结果:残留量为4.8 mg/kg实验样品编号:003采样时间:2024年9月5日测试结果:残留量为6.2 mg/kg统计分析结果:平均残留量:5.5 mg/kg标准偏差:0.6 mg/kg产品标准要求:残留量不得超过5.0 mg/kg结论:根据测试结果,样品001和样品003的残留量超过了产品标准要求。
20180627环氧乙烷残留量气相色谱法分析报告

2.4 色谱的基本概念-速率理论
用速率方程重新定义塔板高度,并提出影响柱效的动力学因素:涡流扩 散、分子扩散、传质阻力 速率方程(也称范.弟姆特方程式)
H = A + B/u + C·u
H:理论塔板高度, u:载气的线速度(cm/s)
灭菌:EO具有顽强的扩散和穿透能力,对 细菌芽孢、真菌和病毒等各种微生物均 有灭杀作用,属于广谱灭菌剂。
机理:烷基化反应
1.1 环氧乙烷的综述
残留物: 1. EO Ethylene Oxide 环氧乙烷 2.ECH ethylene chlorohydrin 氯乙醇 3.EG Ethylene Glycol 乙二醇
。
2.1色谱的基本概念-分配系数
分配比与分配系数的关系
k
MS
MS VS
VS
cs
VS
K
Mm
MS Vm
Vm
cm Vm
式中β为相比,流动相体积Vm 与 固定相体积VS之比
分配比k 与保留时间tR的关系 - k的实验求解
k
tR
tM
t
' R
tM
tM
2.2 色谱的基本概念
1.基线
无试样通过检测器时,检测到 的信号即为基线。
2008器械分类eoech短期接触24h4mg9mg长期接触24h60mg30d60mg30d持久接触类30d一生25g一生10g表面接触器械和植入器械的可耐受接触限量tcl或极轻微刺激5gcm或极轻微刺激人工晶状体05gd4xeo建议限量血细胞分离器单采10mg22mg血液氧合器60mg45mg心肺旁路装臵20mg9mg血液透析器46mg46mg接触完好皮肤的手术单10gcm或极轻微刺激5mgcm或极轻微刺激医疗器械环氧乙烷的接触量限度12环氧乙烷限量13环氧乙烷分析方法比色分析法环氧乙烷在酸性条件下水解生成乙二醇乙二醇经高碘酸氧化生成甲醛甲醛与品红亚硫酸试液反应生成产生紫红色化合物通过比色分析法可求得环氧乙烷含量
YH-QMS-WI-322-A 环氧乙烷残留量检验指导书

版权所有,注意保密版权所有,注意保密1.0 目的为了规范无菌产品环氧乙烷残留量的检验操作,确保产品的环氧乙烷残留量性能达到标准规定的要求。
2.0 范围本检验规程只适用于产品灭菌后的环氧乙烷残留量的测试。
3.0 职责质量法规部:➢微生物检验员负责产品灭菌后环氧乙烷残留量的检测。
➢质量负责人负责数据的审核。
4.0 工作要求4.1溶液的配制➢0.1mol/L盐酸:取9ml盐酸稀释至1000ml。
➢0.5%高碘酸溶液(5g/L):称取高碘酸0.5g,溶于水,稀释至100ml。
➢1%硫代硫酸钠溶液(10g/L):称取硫代硫酸钠1.0g,溶于水,稀释至100ml。
➢10%亚硫酸钠溶液(100g/L):称取10g无水亚硫酸钠,溶于水,稀释至100ml。
➢品红-亚硫酸试液:称取0.1g碱性品红,加入120ml热水溶解,冷却后加入10%亚硫酸钠溶液20ml、盐酸2ml置于暗处,试液应无色,若发现有微红色,应重新配制。
➢乙二醇标准贮备液:取一外部干燥、清洁的50ml容量瓶,加水30ml,精确称量,移取0.5ml 乙二醇,迅速加入瓶中,摇匀,精确称量,两次称量之差即为溶液中所含的重量,加水到刻度,摇匀,按下列公式计算其浓度。
C=w/50×1000式中C—乙二醇标准贮备液浓度g/Lw—溶液中乙二醇质量g乙二醇标准溶液浓度C1=(C×10-3)精确移取标准贮备液1.0ml,用水稀释至1000ml。
4.2 试液制备将试样截为5mm长碎块,称取2.0g置于具塞玻璃容器中,加入0.1mol/L盐酸10ml,密塞,室温放置1小时。
4.3 试验步骤4.3.1取5支纳氏比色管,分别精确加入0.1mol/L盐酸2ml,再精确加入0.5ml、1.0ml、1.5ml、2.0ml、2.5ml乙二醇标准溶液,另取一支纳氏比色管,精确加入0.1mol/L盐酸2ml作空白版权所有,注意保密对照。
4.3.2于上述各管中分别加入0.5%高碘酸溶液0.4ml,放置1h,然后分别滴加硫代硫酸钠溶液至出现的黄色恰好消失,再分别加入品红—亚硫酸钠试液0.2ml,用蒸镏水稀释至10ml,摇匀。
UNIK.PG27环氧乙烷残留量试验

5.5设置温度:柱温:col+L.temp+enter
进样器:inj+enter
氢火焰检测器:shift+det+enter
5.6实际温度:柱温:montt+col
进样器:montt+inj
检测器:montt+shift+det
5.7极性的设置:pol+数字(1,2)+enter
注:环氧乙烷的取法
先用冰水冷冻20ml取液瓶,把环氧乙烷瓶上的管子与取液瓶瓶口连接,使环氧
乙烷气体变成液体,进入取液瓶。再用注射器取出需要的量。
4.2试样制备
4.2.1试样制备应在取样后立即进行,否则应将供试样样品由聚皿氟乙烯密封好,在金属容器中保存。
4.2.2将样品截为5mm长碎块,取2.0g放入20ml顶空瓶中,压实加水10ml,顶端有空间,容器内压力为常压,在恒温水浴锅中60°C+/-1°c放置20min。
2010年10月10作业指导书环氧乙烷残留量试验unikpg27版本b修改修改日期环氧乙烷残留量检查依据根据gbt1423311998第九章气相色谱法执行定义环氧乙烷残留量检查是指残留量是否符合国家标准检测31仪器电子天平gc1690气相色谱仪系列冰箱烧杯容量瓶等
发布部门:文控中心
佳合医材(苏州)有限公司
生效日期:2010年10月10日
文件类别
文件名称
文件编号
作业指导书
环氧乙烷残留量试验
UNIK.PG27
版本B
第次修改
修改日期年月
环氧乙烷残留量试验(可吸收)
1.环氧乙烷残留量检查依据
根据GB/T 14233.1-1998第十章比色分析法执行。
2.定义
环氧乙烷残留量试验是指残留量是否符合国家标准。
