病毒包装实验整体规程及原理(慢病毒、腺病毒)
腺相关病毒包装原理及步骤

腺相关病毒包装原理及步骤采用第2代重组腺相关病毒包装系统制备病毒颗粒。
该包装系统包含3个质粒和一株包装细胞株。
1)1个转移质粒:含有两侧有AAVITR序列的转基因表达盒子。
2)1个Rep-cap表达质粒:表达Rep和Cap两个基因。
3)1个辅助质粒:包含来自腺病毒的一些基因(E4、E2a和VA)。
这些腺病毒的基因可以促进AAV基因组的复制。
4)1株含有腺病毒E1基因的293细胞。
野生型腺相关病毒基因组是一条长约4.7 kb的线性单链DNA (ssDNA)分子。
基因组两末端各有一个145 nt长的Inverted Terminal Repeat (ITR),ITR序列是对称的,自己能形成发夹结构。
病毒感染细胞后,释放出单链病毒基因组,末端发夹结构促使腺相关病毒以单链基因组为模板复制互补链,形成双链DNA。
野生型病毒只表达2个基因:rep (replication) 和cap (capsid),Rep编码非结构蛋白,Cap编码结构蛋白。
腺相关病毒基因组不编码polymerase,基因组DNA的复制需要用到宿主细胞表达的polymerase。
将基因组上的Rep和Cap基因删除,克隆到质粒上,然后将目的基因克隆在两个ITR 之间,这个质粒就成为转移质粒。
而Rep和Cap基因被克隆到另外一个质粒上,成为Rep-cap表达质粒。
除了Rep-cap表达质粒,还需要一个辅助质粒。
这个辅助质粒表达腺病毒的一些基因(E4、E2a和VA),这些腺病毒基因可以促进AAV基因组的复制。
除了3个质粒外,腺相关病毒包装系统还需要一株表达腺病毒E1基因的293细胞。
每次包装重组腺相关病毒,辅助质粒均固定不变,只要血清型不变,Rep-cap质粒也是相对固定,变化的是编码目的基因的转移质粒。
病毒感染细胞实验整体流程及原理

病毒感染细胞实验整体流程及原理目的基因不能直接整合到大多数真核细胞,常用的手段是将目的基因包装成病毒来感染细胞,从而得到表达满足实验需求。
1、病毒的种类病毒有很多种,常见的有慢病毒和腺病毒1.1慢病毒1.1.1原理慢病毒(Lentivirus)是逆转录病毒的一种。
构建的siRNA / miRNA慢病毒载体,与化学合成的siRNA 和基于瞬时表达载体构建的普通 siRNA 载体相比,一方面可以扩增替代瞬时表达载体使用,另一方面,Lentivirus-siRNA 克隆经过慢病毒包装系统包装后,可用于感染依靠传统转染试剂难于转染的细胞系如原代细胞、悬浮细胞和处于非分裂状态的细胞,并且在感染后可以整合到受感染细胞的基因组,进行长时间的稳定表达。
1.1.2特点1)直接包装成为假病毒颗粒,对分裂和非分裂细胞均有感染作用,适合 RNAi 研究和体内实验中难于转染的细胞 (比如神经元细胞、干细胞或其它原代细胞)。
2)可以通过简单方式,在短时间内获得稳定表达特定基因的多种细胞株。
3)可用于基因敲除、基因治疗和转基因动物研究。
4)无需任何转染试剂,操作简便。
5)可以根据客户需要制备多种标记。
1.1.3慢病毒包装简要流程:1)含有目的基因的慢病毒 RNAi 干扰载体的构建和质粒纯化提取。
2)慢病毒载体,包装系统共转染病毒包装细胞293T等。
3)培养 48hrs - 72hrs 左右,收集含有病毒的上清培养液。
4)病毒的纯化和浓缩。
5)分装、- 80 ℃保存。
6)滴度测定目的基因检定,并出具检测报告。
1.2、腺病毒1.2.1 原理腺病毒(Adenovirus,Ad)是一种无包膜的线状双链DNA病毒,其复制不依赖于宿主细胞的分裂。
有近50个血清型,大多数Ad载体都是基于血清型2和5,通过转基因的方式取代E1和E3基因,降低病毒的复制能力。
这些重组病毒仅在高水平表达E1和E3基因的细胞中复制,因此是一种适用于治疗的高效控制系统。
慢病毒载体包装构建过程
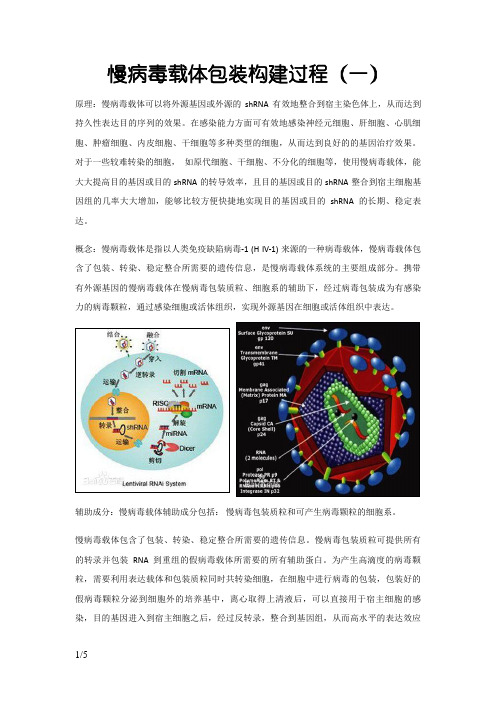
慢病毒载体包装构建过程(一)原理:慢病毒载体可以将外源基因或外源的shRNA有效地整合到宿主染色体上,从而达到持久性表达目的序列的效果。
在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果。
对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,使用慢病毒载体,能大大提高目的基因或目的shRNA的转导效率,且目的基因或目的shRNA整合到宿主细胞基因组的几率大大增加,能够比较方便快捷地实现目的基因或目的shRNA的长期、稳定表达。
概念:慢病毒载体是指以人类免疫缺陷病毒-1 (H IV-1) 来源的一种病毒载体,慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息,是慢病毒载体系统的主要组成部分。
携带有外源基因的慢病毒载体在慢病毒包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞或活体组织,实现外源基因在细胞或活体组织中表达。
辅助成分:慢病毒载体辅助成分包括:慢病毒包装质粒和可产生病毒颗粒的细胞系。
慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息。
慢病毒包装质粒可提供所有的转录并包装RNA 到重组的假病毒载体所需要的所有辅助蛋白。
为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
基本原理:慢病毒载体系统由两部分组成,即包装成分和载体成分。
包装成分:由HIV-1基因组去除了包装、逆转录和整合所需的顺式作用序列而构建,能够反式提供产生病毒颗粒所必需的蛋白。
包装成分通常被分开构建到两个质粒上,一个质粒表达Gag和Pol蛋白,另一个质粒表达Env蛋白,其目的也是降低恢复成野生型病毒的可能。
将包装成分与载体成分的3个质粒共转染细胞(如人肾293T细胞),即可在细胞上清中收获只有一次性感染能力而无复制能力的、携带目的基因的HIV-1载体颗粒。
慢病毒包装实验流程、原理与步骤

慢病毒包装实验流程、原理与步骤慢病毒(Lentivirus)是逆转录病毒的一种,它需要相对较长的孵育时间,所以称之为“慢”病毒,Lenti在拉丁文中就是慢的意思。
它包括人免疫缺陷病毒(HIV)、猫免疫缺陷病毒(FIV)、猿免疫缺陷病毒(SIV)、牛免疫缺陷病毒等。
其中研究最多的是HIV-1慢病毒。
慢病毒载体(Lentivirus vector)是以慢病毒基因组为基础,由所需的目的基因取代部分基因构建而成。
目前使用的慢病毒载体多采用HIV-1基因组改造而来。
与一般的逆转录病毒载体相比,慢病毒载体对分裂细胞和非分裂细胞均具有感染能力而具有更广的宿主范围。
慢病毒载体还可以将外源基因有效地整合到宿主染色体上,从而实现持久表达。
在感染能力方面可以有效感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,又很少引发机体免疫反应,能达到良好的基因治疗效果,具有广阔的应用前景。
慢病毒包装实验流程如下:1.根据目的基因相关信息(序列,基因序列号等)获取目的基因;2.根据客户要求选择对应载体;3. 将目的基因构建到慢病毒载体获得含有目的基因的重组载体;4. 测序鉴定重组质粒,高纯化(不含内毒素)提取的重组质粒;5. 使用高纯提重组载体和慢病毒包装质粒共转染 293FT 细胞,进行病毒包装并收集上清液;6. 通过超滤和超速离心浓缩和纯化病毒;7. 使用病毒液感染 293T 细胞,药物筛选细胞,构建稳定表达细胞系。
慢病毒使用安全及注意事项1.慢病毒相关实验请在生物安全柜内操作。
如果使用超净台请不要打开风机。
2.慢病毒感染实验时,请穿实验服,佩戴口罩和手套,尽量不用将身体的任何部位裸露在安全柜内。
3.操作病毒时尽量避免气雾或者飞溅。
如果溅出,请立即用70%乙醇加1%的SDS溶液擦拭干净。
4.如果需要离心,应使用密封性好的离心管,或者用Parafilm膜封口后离心。
5.废弃的含有病毒的培养基或者病毒接触过的枪头、离心管、培养板及培养瓶请用84消毒液(1:20),浸泡一天后丢弃。
腺病毒包装操作手册

汉恒重组腺病毒操作手册目录腺病毒安全使用和注意事项腺病毒储存与稀释的注意事项一、整体实验流程二、实验材料三、腺病毒包装和浓缩四、重组腺病毒滴度(PFU)的测定五、重组腺病毒感染目的细胞六、重组腺病毒用于动物实验附1:汉恒生物腺病毒载体附2:腺病毒感染细胞最佳MOI的摸索(表达荧光的病毒) 附3:汉恒生物常见三种病毒感染目的细胞比较腺病毒安全使用和注意事项➢腺病毒安全使用注意事项(*非常重要*)1) 腺病毒相关实验请在生物安全柜(BL-2级别)内操作。
2) 操作病毒时请穿实验服,佩戴口罩和手套,尽量不要裸露双手及手臂的皮肤。
3) 操作病毒时需要特别小心病毒溅出。
如果操作时超净工作台有病毒污染,请立即用70%乙醇加 1%的SDS溶液擦拭干净。
4) 接触过病毒的枪头、离心管、培养板及培养瓶请用84消毒液浸泡后统一处理。
5) 如实验过程中需要离心,应使用密封性好的离心管,必要时请用封口膜封口后离心。
6) 病毒相关的废弃物需要特殊收集,统一经高温灭菌后处理。
7) 实验完毕后请用香皂清洗双手。
➢腺病毒储存与稀释的注意事项1)腺病毒的储存收到病毒液后若在短期内使用,可将病毒放置于 4℃保存(一周内使用完最佳);如需长期保存请分装后放置于 -80 ℃ 。
注:a.反复冻融会降低病毒滴度(每次冻融会使病毒滴度降低10%~50%),因此在病毒使用过程中尽量避免反复冻融。
汉恒生物对病毒已进行分装(200 μl/tube),收到后请直接放置-80℃冰箱保存即可。
b.若病毒储存时间超过6个月,汉恒生物建议在使用前重新测定病毒滴度(参见附表2-慢病毒滴度测定方法)。
2)腺病毒的稀释需要稀释病毒时,请将病毒取出置于冰浴融解后,使用PBS或培养目的细胞用的无血清培养基(含血清或含双抗不影响病毒感染)混匀分装后置于 4℃保存(一周内使用完最佳)。
重组腺病毒是一种复制缺陷的腺病毒载体系统,在基因治疗、基础生命科学研究等领域被广泛应用。
病毒感染细胞实验整体流程和原理

病毒感染细胞实验整体流程及原理目的基因不能直接整合到大多数真核细胞,常用的手段是将目的基因包装成病毒来感染细胞,从而得到表达满足实验需求。
1、病毒的种类病毒有很多种,常见的有慢病毒和腺病毒1.1慢病毒1.1.1原理慢病毒(Lentivirus)是逆转录病毒的一种。
构建的siRNA / miRNA慢病毒载体,与化学合成的siRNA 和基于瞬时表达载体构建的普通siRNA 载体相比,一方面可以扩增替代瞬时表达载体使用,另一方面,Lentivirus-siRNA 克隆经过慢病毒包装系统包装后,可用于感染依靠传统转染试剂难于转染的细胞系如原代细胞、悬浮细胞和处于非分裂状态的细胞,并且在感染后可以整合到受感染细胞的基因组,进行长时间的稳定表达。
1.1.2特点1)直接包装成为假病毒颗粒,对分裂和非分裂细胞均有感染作用,适合RNAi 研究和体内实验中难于转染的细胞(比如神经元细胞、干细胞或其它原代细胞)。
2)可以通过简单方式,在短时间内获得稳定表达特定基因的多种细胞株。
3)可用于基因敲除、基因治疗和转基因动物研究。
4)无需任何转染试剂,操作简便。
5)可以根据客户需要制备多种标记。
1.1.3慢病毒包装简要流程:1)含有目的基因的慢病毒RNAi 干扰载体的构建和质粒纯化提取。
2)慢病毒载体,包装系统共转染病毒包装细胞293T等。
3)培养48hrs - 72hrs 左右,收集含有病毒的上清培养液。
4)病毒的纯化和浓缩。
5)分装、- 80 ℃保存。
6)滴度测定目的基因检定,并出具检测报告。
1.2、腺病毒1.2.1 原理腺病毒(Adenovirus,Ad)是一种无包膜的线状双链DNA病毒,其复制不依赖于宿主细胞的分裂。
有近50个血清型,大多数Ad载体都是基于血清型2和5,通过转基因的方式取代E1和E3基因,降低病毒的复制能力。
这些重组病毒仅在高水平表达E1和E3基因的细胞中复制,因此是一种适用于治疗的高效控制系统。
1.2.2特点1)几乎可以感染所有类型的细胞2)可以获得复制缺陷型(E1 和E3 缺失) 的腺病毒3)病毒滴度高,产生病毒经过浓缩后可以达到1012 PFU/mL,能有效的进行增殖。
慢病毒包装操作方案

慢病毒包装操作流程一、材料1 细胞培养试剂试剂名称终浓度试剂品牌DMEM/High glucose基础培养基90%Invitrogen胎牛血清10%Invitrogen/Gibco丙酮酸钠1mM Invitrogen2 慢病毒包装试剂试剂名称浓度试剂品牌Lipofectamine 2000InvitrogenPEG6000溶液50%WakoHBSS溶液Invitrogen3 耗材50 mL离心管15 mL离心管10 cm细胞培养皿μm过滤器2 mL EP管二、操作流程1细胞培养1.1293T/293FT细胞的复苏1)将完全培养液从4°C中取出放置到室温预热30 min左右。
在超净台内,用吸管吸取6~7mL完全培养液至15 mL离心管中;2)快速将冻存的细胞从液氮中取出,并迅速用镊子夹住盖子放入37°C 水浴中快速晃动(水不要没到盖子),使其在1~2分钟内完全融化;3)在超净台内,用酒精棉球擦拭冻存管外壁消毒,用吸管吸取所有融化的细胞悬液至装准备好的完全培养液中,轻轻吹打混匀,使冻存液分散开(目的是让DMSO分散,降低恢复室温的DMSO对细胞造成的毒性作用)。
4)在室温条件下,250 g离心4分钟。
5)离心后,在超净台内小心倒去上清,用吸管吸取2 mL新鲜完全培养液重悬细胞至单细胞悬液,再转移已经加好培养基的培养瓶/培养皿中,写上细胞名称、日期,放置37°C、5% CO2饱和湿度培养箱内培养。
(首次复苏细胞时,离心重悬后需取样计数,根据细胞数选择面积合适的培养容器。
)6)复苏翌日,给复苏的293T细胞更换新鲜的完全培养基。
1.2293T/293FT细胞传代1)待细胞长至60%-70%融合度即可传代。
将培养瓶里的所有培养液全部移去,用1×PBS洗涤细胞两次(洗涤速度要快,避免细胞干涸时间过长),以去除残余的培养液和血清(血清含有胰酶的抑制因子);2)加入适当的胰酶溶液,能使其完全浸过细胞即可,室温孵育1-2分钟。
高效包装腺相关病毒的原理及流程

高效转染病毒
源井生物可以提供不同质量标准的慢病毒,腺病毒,腺相关病毒。
在基因编辑方面,源井生物可以提供体外细胞感染用的浓缩病毒,也可以提供动物体内使用的超纯化病毒,满足客户的不同科研需求。
三种病毒的比对:
腺相关病毒包装原理
腺相关病毒( adeno-associated virus,AAV) 是一类细小病毒,基因组为单链DNA,对分裂细胞和非分裂细胞均具有感染能力。
通常需要腺病毒或疱疹病毒帮助其在体内复制扩增。
重组腺相关病毒(recombinant AAV, rAAV)是利用
AAV2 型基因组与不同血清型的衣壳蛋白基因组结合产生的混合体病毒载体,可将目的基因的CDS 区序列或者RNAi 干扰序列插入rAAV 表达质粒中,包装病毒后感染细胞完成对目的基因的操作。
腺相关病毒具有感染温和,免疫原性小,长效稳定表达的特点,主要应用于动物体内注射。
源井生物提供的腺相关病毒颗粒经过超速离心纯化,并通过qPCR对病毒基因拷贝进行滴定。
腺相关病毒的滴度在10^12~10^13GC/ml,可以满足各类整体实验的使用要求。
不同血清型的AAV组织感染嗜亲性各不相同,表现出一定的器官靶向特异性。
下表列举了不同的AAV血清型及对应的组织亲和性:
产品规格:
服务流程及质量控制:
基因敲除腺相关病毒
源井生物构建基因敲除腺相关病毒载体并包装为腺相关病毒,经过超速离心纯化后,可用于动物定位注射和整体注射实验。
细胞感染腺相关病毒后,可稳定表达gRNA和Cas9蛋白,达到敲除靶基因的目的。
基因敲除腺相关病毒载体选择:
注明| 文章是源井生物原创,转载请注明。
慢病毒包装实验流程介绍

慢病毒包装实验流程介绍
慢病毒包装流程:
1、载体质粒与系统质粒共转染293T细胞。
2、收集48~72h的细胞上清液。
3、超速离心纯化浓缩。
4、纯化分装。
5、滴度检测。
慢病毒包装具体实验步骤如下:
一、质粒转染
1、转染前,依次准备好转染试剂、Opti-MEM培养基、目的质粒、骨架质粒、EP管。
2、然后,配置质粒和OMEM的混合液。
3、配置转染试剂和OMEM的混合液。
4、轻轻混匀,静置5min。
5、将配好的质粒与转染试剂混合后形成转染体系。
6、轻轻混匀,静置20min。
7、从培养箱中取出10cm培养皿,弃去培养液,更换为OMEM 培养液。
8、转染,轻轻混匀。
9、在培养皿盖上做好标记,放回培养箱继续培养。
10、转染后6-8h,更换为新鲜的DMEM培养基。
11、转染后次日,显微镜下观察转染效率。
12、转染后48h,收集上清液于干净的50ml离心管中。
13、加入新鲜的DMEM培养基,继续培养。
14、转染后72h,再次收集上清液。
二、浓缩纯化
1、将收集好的上清液离心,弃去细胞碎片。
2、用0.22μm滤膜过滤,分装到超速离心管中。
3、超速离心。
4、离心结束后,将所收获的病毒颗粒重新悬浮,于4℃冰箱中溶解,过夜。
5、次日,再次将溶解后的病毒过滤、分装、入库。
病毒包装实验整体流程及原理

病毒感染细胞实验整体流程及原理目的基因不能直接整合到大多数真核细胞,常用的手段是将目的基因包装成病毒来感染细胞,从而得到表达满足实验需求。
1、病毒的种类病毒有很多种,常见的有慢病毒和腺病毒1.1慢病毒1.1.1原理慢病毒(Lentivirus )是逆转录病毒的一种。
构建的siRNA / miRNA慢病毒载体,与化学合成的siRNA和基于瞬时表达载体构建的普通siRNA载体相比,一方面可以扩增替代瞬时表达载体使用,另一方面,Len tivirus-siRNA 克隆经过慢病毒包装系统包装后,可用于感染依靠传统转染试剂难于转染的细胞系如原代细胞、悬浮细胞和处于非分裂状态的细胞,并且在感染后可以整合到受感染细胞的基因组,进行长时间的稳定表达。
1.1.2特点1) 直接包装成为假病毒颗粒,对分裂和非分裂细胞均有感染作用,适合RNAi研究和体内实验中难以转染的细胞(比如神经元细胞、干细胞或其它原代细胞)。
2) 可以通过简单方式,在短时间内获得稳定表达特定基因的多种细胞株。
3) 可用于基因敲除、基因治疗和转基因动物研究。
4) 无需任何转染试剂,操作简便。
5) 可以根据客户需要制备多种标记。
含有目的基因的慢病毒RNAi干扰载体的构建和质粒纯化提取。
2) 慢病毒载体,包装系统共转染病毒包装细胞293T等。
3) 培养48hrs - 72hrs 左右,收集含有病毒的上清培养液。
4) 病毒的纯化和浓缩。
5) 分装、-80 C保存。
6) 滴度测定目的基因检定,并出具检测报告。
1.2、腺病毒1) 2) 3) 4) 5)1.2.1原理腺病毒(Adenovirus , Ad)是一种无包膜的线状双链DNA 病毒,其复制不依赖于宿主细胞的分裂。
有近50个血清型,大多数Ad 载体都是基于血清型 2和5,通过转基因的方式取 代E1和E3基因,降低病毒的复制能力。
这些重组病毒仅在高水平表达 E1和E3基因的细胞中复制,因此是一种适用于治疗的高效控制系统。
病毒包装实验整体流程及原理

病毒感染细胞实验整体流程及原理目的基因不能直接整合到大多数真核细胞,常用的手段是将目的基因包装成病毒来感染细胞,从而得到表达满足实验需求。
1、病毒的种类病毒有很多种,常见的有慢病毒和腺病毒1.1慢病毒1.1.1原理慢病毒(Lentivirus)是逆转录病毒的一种。
构建的siRNA / miRNA慢病毒载体,与化学合成的siRNA 和基于瞬时表达载体构建的普通siRNA 载体相比,一方面可以扩增替代瞬时表达载体使用,另一方面,Lentivirus-siRNA 克隆经过慢病毒包装系统包装后,可用于感染依靠传统转染试剂难于转染的细胞系如原代细胞、悬浮细胞和处于非分裂状态的细胞,并且在感染后可以整合到受感染细胞的基因组,进行长时间的稳定表达。
1.1.2特点1)直接包装成为假病毒颗粒,对分裂和非分裂细胞均有感染作用,适合RNAi 研究和体内实验中难以转染的细胞(比如神经元细胞、干细胞或其它原代细胞)。
2)可以通过简单方式,在短时间内获得稳定表达特定基因的多种细胞株。
3)可用于基因敲除、基因治疗和转基因动物研究。
4)无需任何转染试剂,操作简便。
5)可以根据客户需要制备多种标记。
1.1.3慢病毒包装简要流程:1)含有目的基因的慢病毒RNAi 干扰载体的构建和质粒纯化提取。
2)慢病毒载体,包装系统共转染病毒包装细胞293T等。
3)培养48hrs - 72hrs 左右,收集含有病毒的上清培养液。
4)病毒的纯化和浓缩。
5)分装、- 80 ℃保存。
6)滴度测定目的基因检定,并出具检测报告。
1.2、腺病毒1.2.1原理腺病毒(Adenovirus,Ad)是一种无包膜的线状双链DNA病毒,其复制不依赖于宿主细胞的分裂。
有近50个血清型,大多数Ad载体都是基于血清型2和5,通过转基因的方式取代E1和E3基因,降低病毒的复制能力。
这些重组病毒仅在高水平表达E1和E3基因的细胞中复制,因此是一种适用于治疗的高效控制系统。
1.2.2特点1)几乎可以感染所有类型的细胞2)可以获得复制缺陷型(E1 和E3 缺失) 的腺病毒3)病毒滴度高,产生病毒经过浓缩后可以达到1012 PFU/mL,能有效的进行增殖。
(整理)病毒感染细胞实验整体流程及原理

病毒感染细胞实验整体流程及原理目的基因不能直接整合到大多数真核细胞,常用的手段是将目的基因包装成病毒来感染细胞,从而得到表达满足实验需求。
1、病毒的种类病毒有很多种,常见的有慢病毒和腺病毒1.1慢病毒1.1.1原理慢病毒(Lentivirus)是逆转录病毒的一种。
构建的siRNA / miRNA慢病毒载体,与化学合成的siRNA 和基于瞬时表达载体构建的普通siRNA 载体相比,一方面可以扩增替代瞬时表达载体使用,另一方面,Lentivirus-siRNA 克隆经过慢病毒包装系统包装后,可用于感染依靠传统转染试剂难于转染的细胞系如原代细胞、悬浮细胞和处于非分裂状态的细胞,并且在感染后可以整合到受感染细胞的基因组,进行长时间的稳定表达。
1.1.2特点1)直接包装成为假病毒颗粒,对分裂和非分裂细胞均有感染作用,适合RNAi 研究和体内实验中难于转染的细胞(比如神经元细胞、干细胞或其它原代细胞)。
2)可以通过简单方式,在短时间内获得稳定表达特定基因的多种细胞株。
3)可用于基因敲除、基因治疗和转基因动物研究。
4)无需任何转染试剂,操作简便。
5)可以根据客户需要制备多种标记。
1.1.3慢病毒包装简要流程:1)含有目的基因的慢病毒RNAi 干扰载体的构建和质粒纯化提取。
2)慢病毒载体,包装系统共转染病毒包装细胞293T等。
3)培养48hrs - 72hrs 左右,收集含有病毒的上清培养液。
4)病毒的纯化和浓缩。
5)分装、- 80 ℃保存。
6)滴度测定目的基因检定,并出具检测报告。
1.2、腺病毒1.2.1原理腺病毒(Adenovirus,Ad)是一种无包膜的线状双链DNA病毒,其复制不依赖于宿主细胞的分裂。
有近50个血清型,大多数Ad载体都是基于血清型2和5,通过转基因的方式取代E1和E3基因,降低病毒的复制能力。
这些重组病毒仅在高水平表达E1和E3基因的细胞中复制,因此是一种适用于治疗的高效控制系统。
1.2.2特点1)几乎可以感染所有类型的细胞2)可以获得复制缺陷型(E1 和E3 缺失) 的腺病毒3)病毒滴度高,产生病毒经过浓缩后可以达到1012 PFU/mL,能有效的进行增殖。
病毒感染细胞实验整体流程及原理

成都百美科生物QQ7742053病毒感染细胞实验整体流程及原理目的基因不能直接整合到大多数真核细胞,常用的手段是将目的基因包装成病毒来感染细胞,从而得到表达满足实验需求。
1、病毒的种类病毒有很多种,常见的有慢病毒和腺病毒1.1慢病毒1.1.1原理慢病毒(Lentivirus)是逆转录病毒的一种。
构建的siRNA / miRNA慢病毒载体,与化学合成的siRNA 和基于瞬时表达载体构建的普通siRNA 载体相比,一方面可以扩增替代瞬时表达载体使用,另一方面,Lentivirus-siRNA 克隆经过慢病毒包装系统包装后,可用于感染依靠传统转染试剂难于转染的细胞系如原代细胞、悬浮细胞和处于非分裂状态的细胞,并且在感染后可以整合到受感染细胞的基因组,进行长时间的稳定表达。
1.1.2特点1)直接包装成为假病毒颗粒,对分裂和非分裂细胞均有感染作用,适合RNAi 研究和体内实验中难于转染的细胞(比如神经元细胞、干细胞或其它原代细胞)。
2)可以通过简单方式,在短时间内获得稳定表达特定基因的多种细胞株。
3)可用于基因敲除、基因治疗和转基因动物研究。
4)无需任何转染试剂,操作简便。
5)可以根据客户需要制备多种标记。
1.1.3慢病毒包装简要流程:1)含有目的基因的慢病毒RNAi 干扰载体的构建和质粒纯化提取。
2)慢病毒载体,包装系统共转染病毒包装细胞293T等。
3)培养48hrs - 72hrs 左右,收集含有病毒的上清培养液。
4)病毒的纯化和浓缩。
5)分装、- 80 ℃保存。
6)滴度测定目的基因检定,并出具检测报告。
1.2、腺病毒成都百美科生物QQ77420531.2.1原理腺病毒(Adenovirus,Ad)是一种无包膜的线状双链DNA病毒,其复制不依赖于宿主细胞的分裂。
有近50个血清型,大多数Ad载体都是基于血清型2和5,通过转基因的方式取代E1和E3基因,降低病毒的复制能力。
这些重组病毒仅在高水平表达E1和E3基因的细胞中复制,因此是一种适用于治疗的高效控制系统。
病毒包装实验整体流程及原理(慢病毒、腺病毒)

广州英思特生物科技有限公司为您提供高效快速的病毒包装实验外包服务,公司网址:有需要请联系丘先生病毒感染细胞实验整体流程及原理目的基因不能直接整合到大多数真核细胞,常用的手段是将目的基因包装成病毒来感染细胞,从而得到表达满足实验需求。
1、病毒的种类病毒有很多种,常见的有慢病毒和腺病毒1.1 慢病毒1.1.1 原理慢病毒( Lentivirus )是逆转录病毒的一种。
构建的siRNA / miRNA 慢病毒载体,与化学合成的siRNA 和基于瞬时表达载体构建的普通siRNA 载体相比,一方面可以扩增替代瞬时表达载体使用,另一方面,Lentivirus-siRNA 克隆经过慢病毒包装系统包装后,可用于感染依靠传统转染试剂难于转染的细胞系如原代细胞、悬浮细胞和处于非分裂状态的细胞,并且在感染后可以整合到受感染细胞的基因组,进行长时间的稳定表达。
1.1.2 特点1) 直接包装成为假病毒颗粒,对分裂和非分裂细胞均有感染作用,适合RNAi 研究和体内实验中难于转染的细胞(比如神经元细胞、干细胞或其它原代细胞)。
2) 可以通过简单方式,在短时间内获得稳定表达特定基因的多种细胞株。
3) 可用于基因敲除、基因治疗和转基因动物研究。
4) 无需任何转染试剂,操作简便。
5) 可以根据客户需要制备多种标记。
1.1.3 慢病毒包装简要流程:1) 含有目的基因的慢病毒RNAi 干扰载体的构建和质粒纯化提取。
1) 2) 3) 4) 5)2) 慢病毒载体,包装系统共转染病毒包装细胞 293T 等。
3) 培养48hrs - 72hrs 左右,收集含有病毒的上清培养液。
4) 病毒的纯化和浓缩。
5) 分装、-80 C 保存。
6)滴度测定目的基因检定,并出具检测报告。
1.2、 腺病毒 1.2.1原理腺病毒(Adenovirus , Ad)是一种无包膜的线状双链DNA 病毒,其复制不依赖于宿主细胞的分裂。
有近50个血清型,大多数Ad 载体都是基于血清型 2和5,通过转基因的方式取 代E1和E3基因,降低病毒的复制能力。
慢病毒包装的方法、步骤详细教程分享

慢病毒包装的⽅法、步骤详细教程分享本⽂梳理了慢病毒包装的全部流程,并结合具体实例介绍了慢病毒包装的⽅法、步骤,并对包装过程中的关键点进⾏了细致的分析。
使初学者也能握毫⽆障碍地⾃主完成病毒包装、纯化、滴度测定等实验。
以293T细胞为例:慢病毒感染293T细胞 - 合肥知恩⽣物慢病毒感染293T细胞1.293T细胞分盘转染前⼀天,将已经长好的细胞以合适的⽐例传代到10cm培养⽫中,当细胞长到80%时准备转染,步骤如下:1)弃去培养液,加⼊5 mL 灭菌PBS溶液,轻轻晃动,洗涤细胞⽣长⾯,然后弃去 PBS 溶液。
2)⽤2 mL 胰蛋⽩酶消化对数⽣长期的293T细胞。
3)以含10%⾎清的培养基调整细胞密度为5 ×106个/10 mL,重新接种于10cm细胞培养⽫中,37 ℃,5% CO2 培养箱继续培养,转染前细胞密度80%左右。
注意:293T细胞的状态⾮常重要,⼀般建议购买新的细胞株后分批多次冻存,以保证每次包装病毒时细胞的代数不会超过10代。
同时尽量不要使⽤国产⾎清。
复苏后的细胞需要传2代后才能进⾏病毒的包装,并且传达后18-24h 需要密度达到80%左右。
2.转染前换液转染前1~2h 将需要转染的细胞换新鲜的培养基,8mL/10cm⽫。
注意:293T细胞贴壁性不是很好,换液时应⼩⼼滴加尽量避免冲起细胞。
3.转染(1)以⼀个10cm平⽫为例,取2个EP管,分别加⼊500 µl⽣理盐⽔,标记为A、B;(2)A管加⼊60µg PEI,并充分涡旋混匀,B管加⼊过表达质粒和两个辅助质粒pSPAX2、pMD2.G,三质粒⽐例为4:3:1,共24µg;(3)将A管PEI加⼊到B管中,轻轻混匀,静置20min;将混合液加⼊细胞中,过夜培养。
注意:质粒提取的质量,包括浓度和纯度。
浓度⾄少要超过500ng/ul,因为浓度低,加⼊的体积就会相应增⼤,会增加细胞污染的风险。
纯度可以使⽤核酸测定仪进⾏检测,260/280在1.8-2.0之间。
腺病毒包装原理及步骤

腺病毒包装原理及步骤
采用第1代重组腺病毒包装系统制备腺病毒颗粒。
该包装系统包含一个腺病毒载体和一株包装细胞株。
1、一个腺病毒载体:缺失了E1和E3区域的腺病毒基因组序列被克隆到质粒上。
2、一株包装细胞株:E1基因片段被整合到293细胞。
野生型腺病毒基因组是一条约36kb的线性双链DNA(dsDNA)分子。
基因组的两个末端被称为Inverted Terminal Repeat(ITR),末端之间含有腺病毒DNA复制所需基因。
在病毒DNA复制周期早期表达的基因,称为早期基因,主要有4个,按表达先后顺序依次是E1、E2、E3、E4。
在病毒DNA复制周期晚期表达的基因,称为晚期基因,主要有5个,按表达先后顺序依次为L1、L2、L3、L4、L5。
为了制备出自我失活的重组腺病毒,E1基因会被删除,使重组腺病毒成为一种安全的基因运输工具。
为了增加包装能力,E3基因也同时被删除,因为E3基因产物会提高宿主的免疫反应,而且对病毒生产不重要。
缺失了E1和E3基因的腺病毒基因组序列被克隆到质粒上构建成腺病毒载体。
E1基因片段被整合到293细胞基因组中,包装病毒颗粒时,Pacl 消化的腺病毒载体转染到表达E1基因的293细胞。
E1基因激活了其他早期基因和晚期基因的表达,这些基因表达产物和Pacl消化的质粒DNA组装成病毒颗粒。
慢病毒包装实验

慢病毒包装试验慢病毒包装试验慢病毒(Lentivirus)载体是以 HIV1 (人类免疫缺陷 1 型病毒)为基础进展起来的基因治疗载体。
慢病毒具有感染谱广泛、可以有效感染分裂期和静止期细胞、长期稳定表达外源基因等优点,因此成为导入外源基因的有力工具。
现在慢病毒系统已经被广泛应用到各种细胞系的基因过表达、RNA 干扰、microRNA 讨论以及活体动物试验中。
一、试验流程图 1、慢病毒包装试验流程图二、试验仪器与试验材料psPAX2 质粒,pMD2.G 质粒,pHBLVTM系列质粒;293T 细胞;wan全培育基;DH5α 菌株;Stbl3 菌株。
三、试验步骤1. 质粒扩增。
将构建好的慢病毒载体和包装质粒使用大抽试剂盒进行质粒的去内毒素抽提,浓度建议不低于 1 μg/μl,A260/280 在 1.71.8 间方可用于病毒包装。
推举使用 Qiagen 大抽试剂盒进行质粒的大量去内毒素抽提(质粒质量会极大影响后续转染效率和病毒的滴度)。
2. 脂质体转染。
转染前一天,在10 cm皿中接种生长状态良好的293T细胞,以第二天汇合度能达到 30% ~ 50% 为宜。
24 h 后转染,转染前需要把 DMEM 和慢病毒包装专用转染试剂 LentiFitTM恢复至室温,使用前需摇匀。
每个皿的质粒成分如下:表 1、慢病毒包装转染体系用于包装的三个质粒摩尔比通常为 1:1:1,可以依据情况稍加调整。
请参考 LentiFitTM转染试剂说明书进行转染操作,转染后46 h 换新鲜培育基。
3. 病毒收集和离心。
转染后 48 h 和 72 h 分别两次收集病毒上清(48 h 收集后置换新鲜培液),将收集的上清用0.45 μm滤器过滤,然后放于超速离心管中,4 ℃,72000 g 离心 120 min。
4. 病毒重悬和保存。
弃上清,500 μl 重悬液重悬病毒沉淀,一周内使用则置于4 ℃ 保存,如需长时间存放需置于80 ℃ 或液氮罐保存。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
广州英思特生物科技有限公司为您提供高效快速的病毒包装实验外包服务,
病毒感染细胞实验整体流程及原理目的基因不能直接整合到大多数真核细胞,常用的手段是将目的基因包装成病毒来感染细胞,从而得到表达满足实验需求。
1、病毒的种类
1.1
1.1.1
体,一方面
1.1.2
1)研。
? 2)可以通过简单方式,在短时间内获得稳定表达特定基因的多种细胞株。
3)可用于基因敲除、基因治疗和转基因动物研究。
4)无需任何转染试剂,操作简便。
5)可以根据客户需要制备多种标记。
1.1.3慢病毒包装简要流程:
1)含有目的基因的慢病毒 RNAi 干扰载体的构建和质粒纯化提取。
2)慢病毒载体,包装系统共转染病毒包装细胞293T等。
3)培养 48hrs - 72hrs 左右,收集含有病毒的上清培养液。
4)病毒的纯化和浓缩。
5)分装、- 80 ℃保存。
6)滴度测定目的基因检定,并出具检测报告。
1.2
1.2.1
达E1
1.2.2
1)
2)
3)
4)
5)
1.2.3腺病毒包装简要流程
1)构建表达 siRNA/miRNA 的腺病毒载体
2)采用 PacI 消化纯化的质粒。
3)消化好的腺病毒表达载体转染 293A 细胞,收获细胞以制备病毒粗提液。
4)将病毒粗提液感染 293A 细胞以扩增病毒。
5)分装,-80℃保存。
1.3、慢病毒和腺病毒的比较
2、构建目的基因到载体
2.1构建手段
一般是根据原始质粒信息确定克隆方案,有以下两种手段。
1)如果原始质粒与载体有匹配酶切位点,采用相应的内切酶切下相应片段,回收并连接到载体,酶切,并测序鉴定
DNA分子。
质粒在宿主细胞体内外都可复制。
通过个些特性,人们可以把一些目的DNA片断构建在质粒中,通过转化入大肠杆菌中,利用选择培养基来筛选从而不断的复制,来得到目的产物。
3、质粒DNA在大肠杆菌里转化
连接上目的基因的质粒转化大肠杆菌是为了让目的基因在大肠杆菌里扩增,然后提取质粒,以下是质粒DNA在大肠杆菌里转化的三步骤。
3.1大肠杆菌感受态细胞的制备
30min
2)离心管放到42℃保温90s
3)冰浴2min
4)每管加800ulLB液体培养基,37℃培养1h(150r/min)
5)取适当体积(100ul)的复苏细胞,涂布在选择性培养基上,正置
6)倒置平皿37℃,12~16h,出现菌落
3.3质粒提取步骤
1)取1~4ml在LB培养基中培养过夜的菌液,12000转离心1min,弃上清
一次。
10)12000转离心3min,以彻底去除纯化柱中残留的液体。
11)将DNA纯化柱置于新的离心管中,悬浮滴加50-100ul溶液Eluent (为无菌的双蒸水,PH为8.0-8.5),室温放置2min。
12)12000转离心1min,此时管底即为高纯度的质粒DNA,质粒于-20℃
质粒提取步骤:吸取液体培养基于1.5ml离心管中12000转离心1min,弃上清,吸取培养基重复离心弃上清离心,留取少量菌液作为菌种保存,可直接置于-20℃——加250ulBufferS1悬浮细菌,悬浮均匀——加250ulBufferS2温和充分的上下翻转4-6次混合均匀,使菌体裂解——加350ulBufferS3温和上下翻转12000离心10min——取上清液转移到专用的制备管(2ml)12000转离心1min,弃滤液——加500ulBufferW112000转离心1min,弃滤液——加500ulBufferW212000转离心1min,弃滤液,重复一遍——将制备管置回2ml离心管12000转离心1min——将制备管移入新的1.5ml离心管中,加60~80ulEluent
4、质粒DNA和其他包装质粒共转染293T细胞产生病毒(即病毒包装)
4.1名词解释
4.1.1293T细胞是由293细胞派生, 表达SV40大T抗原的人肾上皮细胞系, 被广泛应用于瞬时转染以过表达各种目标蛋白, 或是用以包装病毒。
5. 6-10h后,移除含有DNA-脂质体复合物的培养基,代之以正常培养液DMED+10%FB(从此刻开始算时间)。
第三天:
1.转染24h后,荧光显微镜下观察,转染效率应达到70%以上
第四天:
1.转染后48和72h分别收获含病毒的上清。
2.3000 rpm 离心20min,0.45um滤膜过滤,去除细胞沉淀。
3.12000转离心浓缩细胞、分装-80°C贮存。
4.滴度测定目的基因检定,并出具检测报告。
4.3病毒包装的原理
细胞是无害的并且高效的将目的基因转然到靶细胞基因组中。
5、慢病毒感染细胞
5.1流程图
5.2感染步骤
1)铺板:将对数生长期的细胞消化重悬后,按1*105/L密度接种于12孔板,生长过夜
2.感染病毒时培养基量少,以保证病毒的浓度,在培养10h左右可根据培养基颜色加培养基。
3.在不明确细胞感染复数情况下,可进行浓度梯度感染,计算细胞感染复数。
4.在加病毒后一般24h左右可换液,48小时即可看荧光,具体时间
根据细胞状态来看。
6、感染后的细胞检测方法
6.1荧光初步检测
若有荧光,则表示病毒感染成功,但并不能确定目的基因是否整合到细胞中,待进一步检测,荧光有强弱之分,与病毒加入的量有关。
6.2RNA的提取及RT-PCR检测
6.2.3RT-PCR步骤:
RT是一个逆转录的过程,用前一天提取好的总RNA,在加入引物,模版和酶,并在PCR仪的温度设置下,RNA可逆转录为cDNA。
PCR是cDNA在模版,引物,酶的作用下进行复制成双链DNA。
(具体步骤省略)
6.3蛋白提取及Western检测
western-Bloting:蛋白免疫印迹(Western blotting 或Immunoblotting)一般由凝胶电泳、样品的印迹和免疫学检测三个部分组成。
第一步是做 SDS 聚丙烯酰胺凝胶电泳,使待测样品中的蛋白质按分子量大小在凝胶中分成带。
第二步把凝胶中已分成条带的。
