检测方法及试剂代码
化学试剂检测标准范围
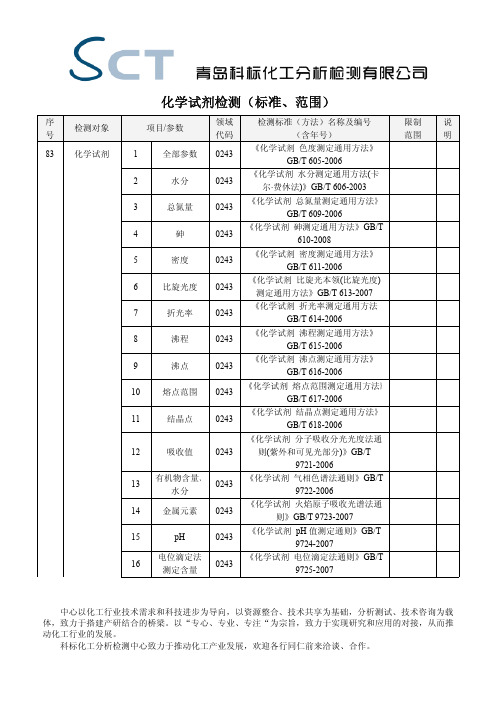
化学试剂检测(标准、范围)
中心以化工行业技术需求和科技进步为导向,以资源整合、技术共享为基础,分析测试、技术咨询为载体,致力于搭建产研结合的桥梁。
以“专心、专业、专注“为宗旨,致力于实现研究和应用的对接,从而推动化工行业的发展。
中心以化工行业技术需求和科技进步为导向,以资源整合、技术共享为基础,分析测试、技术咨询为载体,致力于搭建产研结合的桥梁。
以“专心、专业、专注“为宗旨,致力于实现研究和应用的对接,从而推
动化工行业的发展。
动化工行业的发展。
动化工行业的发展。
动化工行业的发展。
中心以化工行业技术需求和科技进步为导向,以资源整合、技术共享为基础,分析测试、技术咨询为载体,致力于搭建产研结合的桥梁。
以“专心、专业、专注“为宗旨,致力于实现研究和应用的对接,从而推
动化工行业的发展。
中心以化工行业技术需求和科技进步为导向,以资源整合、技术共享为基础,分析测试、技术咨询为载体,致力于搭建产研结合的桥梁。
以“专心、专业、专注“为宗旨,致力于实现研究和应用的对接,从而推
动化工行业的发展。
中心以化工行业技术需求和科技进步为导向,以资源整合、技术共享为基础,分析测试、技术咨询为载体,致力于搭建产研结合的桥梁。
以“专心、专业、专注“为宗旨,致力于实现研究和应用的对接,从而推
动化工行业的发展。
HER2检测试剂盒(免疫组化法)说明书-Agilent

DAB 显色液。 5% 3, 3’-二氨联苯胺四盐酸显色剂溶液。
3×500mL
2×5
抗原修复液(包含清洗剂)(10×)。 0.1 mol/L柠檬酸盐缓冲液,1% 吐温-20,pH 5.7。
质控切片
P04605CN_01_SK00121-2CN/2017.02 2/26
P04605CN_01
10 × 试剂瓶
外。该试剂盒所提供的材料足够用于最多 10 次免疫组化染色。
数量
说明
1×22 mL
过氧化物酶阻断剂。 3%的过氧化氢,含有15 mmol/L的叠氮钠(NaN3)。
1×12 mL
1×22 mL
兔抗人HER2多克隆抗体。 即用型亲和分离的抗体,保存在0.05 mol/L Tris/HCl, 0.1 mol/L NaCl, 1%BSA, 酒 石黄(Tartrazin), 专利蓝V(Patentblue V), 15 mmol/L NaN3, pH 7.2溶液中。 免疫原:合成的HER2蛋白的C-末端(细胞质部分)片段部分,并偶联至血蓝蛋 白上。
2×22 mL
阴性质控试剂。
与HER2抗体等价蛋白浓度下的正常兔血清免疫球蛋白成分,保存在0.05 mol/L Tris/HCl, 0.1 mol/L NaCl, 15 mmol/L NaN3, pH 7.2,并含有1%BSA稳定剂的溶液 内。
1×1mL
DAB底物缓冲液。 50 mM咪唑, 1mM N, N'-乙基双 (2-[2-羟基苯基]甘氨酸) (EDHPA), 0.1%乙基苯基 聚乙二醇(Nonidet P-40), 0.02% 过氧化氢, 0.01% 氯化苯二甲烃铵, pH 7.5。
【检测原理】
HercepTest™检测试剂盒包含对常规处理的、石蜡包埋的样本进行两步法免疫组化染色 所需要的全部试剂。兔抗人 HER2 蛋白一抗孵育后,该试剂盒采用基于葡聚糖技术的即用型 显色试剂。该试剂包含羊抗兔二抗和偶联至葡聚糖多聚体骨架上的辣根过氧化酶分子。因此, 不需要再依次使用连接抗体,人免疫球蛋白显色试剂和胎牛血清之间的交叉反应也因为使用 固相吸附材料而消除。依次填加的色素原的酶转换,也使得显色反应发生于抗原所在部位。 标本需要复染和封片。反应结果在光学显微镜下观察。质控玻片包含 3 个福尔马林固定、石 蜡包埋的人类乳腺癌细胞系,染色强度分别在 0、1+、以及 3+,提供用于对染色结果进行 评估。这些细胞的染色强度与其所表达的受体密度一致。
抗核抗体谱(IgG)检测标准操作规程

抗核抗体谱(IgG)检测标准操作规程1.目的规范抗核抗体谱(IgG)检测,保证结果的准确性。
2.适用范围检验科免疫组工作人员。
3.试剂规格名称与组成型号名称:ANA 谱 1靶抗原:nRNP/Sm,Sm,SS-A,Ro-52,SS-B,Scl-70,Jo-1,CENP B,dsDNA,核小体,组蛋白,核糖体 P 蛋白类型:规格:164.、Scl-70、IgG5.6.及核糖蛋性率在风湿疾病—多肌炎/7.8.储存条件及有Array效期:2-8°C 保存,不要冷冻。
未开封前,除非特别说明,试剂盒自生产日起可稳定 18 个月。
稀释后的酶结合物和清洗缓冲液需在一个工作日内用完。
9.样本要求样本:人血清或EDTA、肝素或柠檬酸盐抗凝的血浆。
稳定性:待检患者样本于 2-8°C 可稳定 14 天,稀释后的样本应在同一个工作日内检测。
样本稀释:患者样本用样本缓冲液匀。
10.10.12-8°C-- 稀释如:- 酶结合物:10 倍浓缩。
使用时用干净的吸管从瓶中吸取所需酶结合物,并用样本缓冲液 1:10 稀释。
如需温育一条检测膜条,用 1.35 ml 样本缓冲液稀释 0.15 ml 酶结合物。
已稀释的酶结合物应在同一个工作日用完。
- 样本缓冲液:直接使用。
- 清洗缓冲液:10 倍浓缩。
使用时用干净的吸管从瓶中吸取需要量用蒸馏水 1:10 稀释。
如需温育一条膜条,用 9ml 蒸馏水稀释 1ml 浓缩缓冲液。
稀释后的缓冲液应在同一个工作日用完。
- 底物液:直接使用,对光敏感,使用后应立即盖紧瓶盖。
10.2操作流程预处理:取出所需的膜条,将其放入温育槽内。
膜条上有编号的一面朝上。
在温育槽中分别加入 1.5ml 样本缓冲液,于室温在摇摆摇床上温育 5 分钟后,吸去温育槽中的液体。
血清温育第一次:在温育槽中分别加入 1.5 ml 已稀释的血清样本,在摇摆摇床上室温(18°C-25°C)温育 30 分钟。
沈阳化学试剂

2019年沈阳市化学试剂产品质量监督抽查方案沈阳产品质量监督检验院2019年沈阳市化学试剂产品质量监督抽查方案1.范围本方案适用于沈阳市化学试剂产品质量监督抽查。
抽查的产品为沈阳市行政区域范围内生产领域的化学试剂等,包括盐酸、硝酸、硫酸、氢氧化钠、氨水、无水乙醇、甲醛溶液等产品。
2.产品分类产品分类及代码见表1。
表1 化学试剂产品分类及代码3.企业规模划分依据化学试剂产品行业的实际情况,生产企业规模以化学试剂产品年销售额为标准划分为大、中、小型企业,见表2。
表2 企业规模划分4.检验依据下列引用的文件,其最新版本或修改单均适用于本方案。
GB/T 622-2006 化学试剂盐酸GB/T 626-2006 化学试剂硝酸GB/T 676-2007 化学试剂乙酸(冰醋酸)GB/T 678-2002 化学试剂乙醇(无水乙醇)GB/T 625-2007 化学试剂硫酸GB/T 629-1997 化学试剂氢氧化钠GB/T 2306-2008 化学试剂氢氧化钾GB/T 631-2007 化学试剂氨水GB/T 685-2013 化学试剂甲醛溶液现行有效的企业标准及产品明示质量要求相关的法律法规、部门规章和规范5.检验项目及重要程度检验项目及重要程度分类见表3—表11。
表3化学试剂盐酸检验项目及重要程度分类表4化学试剂硝酸检验项目及重要程度分类表5 化学试剂乙酸(冰醋酸)检验项目及重要程度分类表6化学试剂乙醇(无水乙醇)检验项目及重要程度分类表7化学试剂硫酸检验项目及重要程度分类表8化学试剂氢氧化钠检验项目及重要程度分类表9化学试剂氢氧化钾检验项目及重要程度分类表10化学试剂氨水检验项目及重要程度分类表11化学试剂甲醛溶液检验项目及重要程度分类注:A类为极重要质量项目;B类为重要质量项目。
极重要质量项目是指直接涉及人体健康、使用安全的指标;重要质量项目是指产品涉及环保、能效、关键性能或特征值的指标。
6.抽样方法及数量采用简单随机抽样法。
ELISA检测试剂及方法

ELISA检测试剂1. 包被稀释液:0.05mmol/L碳酸盐缓冲液pH9.6Na2CO3 1.6gNaHCO3 2.9g加蒸馏水至1000 ml2. 洗涤液(PBST):10mmol/L PBS(pH7.4);0.05% Tween-2010mmol/L PBS(pH7.4)NaCl 8gKCl 0.2gNa2HPO4 1.42gK2HPO40.27g加蒸馏水至1000 ml3. 封闭液:10mmol/L PBS(pH7.4);1.0% BSA4. 抗体稀释液:(10mmol/L PBS(pH7.4);0.05%Tween-20;0.5%BSA)5. 显色液:a. TMB: 称取固体TMB 溶于DMSO 配成1mg/ml液体,4度避光保存,用前要检查其状态,若有凝固,可用手温将其融化。
b. 底物缓冲液(pH5.0): 柠檬酸1.02g,Na2HPO4.12H2O 3.58g,溶于100ml 水中。
c. 30% 过氧化氢:4℃避光保存。
使用前即时按照下列比列配制:1份TMB加9份底物缓冲液, 加0.01份H2O2即100:900:1。
如:底物缓冲液(pH5.0) 9ml,加TMB 1ml,加30%H2O2 10μl(即配即用)。
ELISA检测准步骤1.标本稀释:抗体稀释液1:5、1:25倍稀释唾液,1:200、1:400倍稀释血清。
2.加入标本:将上述稀释的标本加入已包被的ELISA板,100μl/孔,37℃,60min,洗涤液洗4次。
3.加入酶标抗体:加入1:20,000稀释的HRP标记的羊抗兔IgA。
100μl/孔,37℃,30min,洗涤液洗4次。
4.显色:加入TMB底物显色液,100μl/孔,室温(或25℃)避光显色5-15min,50μl终止液终止反应。
5.检测:450nm测定各孔OD值,均做2孔重复,取平均值计算。
用于中性粒细胞胞外诱捕网检测的试剂盒及检测方法

用于中性粒细胞胞外诱捕网检测的试剂盒及检测方法中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)是一种重要的免疫反应机制,其通过释放DNA纤维形成的结构来捕捉和杀灭病原体。
NETs在感染、炎症、肿瘤和自身免疫性疾病等疾病中发挥着重要的作用。
因此,快速、准确检测NETs的能力对于疾病的早期诊断、病情判断和治疗策略的制定至关重要。
为了满足这些需求,研究人员开发了用于中性粒细胞胞外诱捕网检测的试剂盒和检测方法。
这些试剂盒主要包括特异性抗体、染料和相关的检测试剂。
以下是一个使用试剂盒进行中性粒细胞胞外诱捕网检测的基本步骤:1.血液或其他样本的采集:从受试者的静脉中采集血液样本,或者从其他体液(例如尿液、唾液等)中采集样本。
2.缓冲液的制备:根据试剂盒的说明书,制备相应的缓冲液,用于稀释和处理样本。
3.样本的准备:将采集到的样本转移到离心管中,离心以除去固体颗粒。
然后,将上清液转移到新的离心管中。
4.细胞抗原的处理:将特定浓度的抗体加入到上一步骤中的离心管中,与样品中的细胞抗原发生特异性结合。
5.染料处理:将染料加入到上一步骤中的离心管中,用于检测或标记特定的细胞成分或结构。
6.洗涤:通过离心和上清液的去除,将非特异性的结合物洗涤干净,以减少背景干扰。
7.信号检测:使用特定的检测试剂盒,对样品中的特定标记进行信号检测。
这可以通过光学显微镜观察、流式细胞仪读数或其他信号检测方法来完成。
8.数据分析:对得到的信号进行定量或定性分析,以获得有关样品中中性粒细胞胞外诱捕网的信息。
这是一个基本的流程,实际使用的试剂盒和方法可能会因不同的实验目的和要求而有所不同。
此外,还可以根据具体疾病的特点和临床需求进行优化和调整。
总的来说,中性粒细胞胞外诱捕网检测的试剂盒和方法在临床研究和诊断中起到了重要的作用,有助于提高疾病的早期诊断和治疗水平。
BOD5检测仪、试剂、操作步骤及计算方法介绍

BOD5检测仪、试剂、操作步骤及计算方法介绍生化需氧量是指微生物在特定条件下分解水中某些可氧化物质,特别是有机物的化学过程所消耗的溶解氧量。
BOD5是指在20℃培育5天前后溶解氧的测量值。
两者之差为BOD5值,以氧的mg/L表示,测试范围为2mg/l~6000mg/l。
——仪器恒温培育箱20ml系口玻璃瓶1000ml量筒玻璃搅棒:棒的长度长于一般玻璃棒,在棒的底端固定一个直径比量筒底小,并带有几个小孔的硬橡胶板。
溶解氧瓶:250ml,带有磨口玻璃塞并且有供水封用的钟形口。
移液管:供分取水样和添加稀释水用。
——试剂磷酸盐缓冲溶液:将8.5g磷酸二氢钾,21.75g磷酸氢二钾,33.4g七水合磷酸氢二钠和1.7g氯化铵溶于水中,稀释至1000ml,此溶液的pH值应为7.2硫酸镁溶液:将22.5g七水合硫酸镁溶于水中,稀释至1000ml。
氯化钙溶液:将27.5无水氯化钙溶于水,稀释1000mL氯化铁溶液:将0.25g六水合氯化铁(FeCl3·6H2O)溶于水中稀释至1000ml盐酸溶液:将40ml(=1.18mg/l)盐酸溶于水,稀释至1000ml氢氧化钠溶液:将20g氢氧化钠溶于水中,稀释至1000ml。
亚硫酸钠溶液:将1.575g亚硫酸溶于水中,稀释至1000ml。
葡萄糖谷氨酸标准溶液:将葡萄糖和谷氨酸在103℃干燥1h后,各称取150mg溶于水中,移入1000ml容量瓶内稀释至标线,混合均匀。
此标准溶液临用前配制。
稀释水:在520L玻璃瓶内装入肯定量水。
掌控水温在20℃左右,然后用无油空气压缩机,将吸入的空气经活性碳吸附管及洗涤管后,导入稀释水内曝气2.8h。
使稀释水中的溶解氧接近饱和。
放置于20℃培育箱中放置数小时。
使水中的溶解氧达到8mg/l左右,临用前每升加入氯化钙、氯化铁溶液。
磷酸盐缓冲液1ml,并混合均匀的PH值为7.2。
其BOD5应为小于0.2mg/l.接种液:城市污水,在室温下放置一昼夜,取上清液使用。
GB 4789.10-2016 食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验

中华人民共和国国家标准G B4789.10 2016食品安全国家标准食品微生物学检验金黄色葡萄球菌检验2016-12-23发布2017-06-23实施中华人民共和国国家卫生和计划生育委员会前言本标准代替G B4789.10 2010‘食品安全国家标准食品微生物学检验金黄色葡萄球菌检验“㊁S N/T0172 2010‘进出口食品中金黄色葡萄球菌检验方法“㊁S N/T2154 2008‘进出口食品中凝固酶阳性葡萄球菌检测方法兔血浆纤维蛋白原琼脂培养基技术“㊂本标准与G B4789.10 2010相比,主要变化如下:试验用增菌液统一为7.5%氯化钠肉汤㊂食品安全国家标准食品微生物学检验金黄色葡萄球菌检验1范围本标准规定了食品中金黄色葡萄球菌(S t a p h y l o c o c c u s a u r e u s)的检验方法㊂本标准第一法适用于食品中金黄色葡萄球菌的定性检验;第二法适用于金黄色葡萄球菌含量较高的食品中金黄色葡萄球菌的计数;第三法适用于金黄色葡萄球菌含量较低的食品中金黄色葡萄球菌的计数㊂2设备和材料除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:2.1恒温培养箱:36ħʃ1ħ㊂2.2冰箱:2ħ~5ħ㊂2.3恒温水浴箱:36ħ~56ħ㊂2.4天平:感量0.1g㊂2.5均质器㊂2.6振荡器㊂2.7无菌吸管:1m L(具0.01m L刻度)㊁10m L(具0.1m L刻度)或微量移液器及吸头㊂2.8无菌锥形瓶:容量100m L㊁500m L㊂2.9无菌培养皿:直径90mm㊂2.10涂布棒㊂2.11p H计或p H比色管或精密p H试纸㊂3培养基和试剂3.17.5%氯化钠肉汤:见A.1㊂3.2血琼脂平板:见A.2㊂3.3 B a i r d-P a r k e r琼脂平板:见A.3㊂3.4脑心浸出液肉汤(B H I):见A.4㊂3.5兔血浆:见A.5㊂3.6稀释液:磷酸盐缓冲液:见A.6㊂3.7营养琼脂小斜面:见A.7㊂3.8革兰氏染色液:见A.8㊂3.9无菌生理盐水:见A.9㊂第一法金黄色葡萄球菌定性检验4检验程序金黄色葡萄球菌定性检验程序见图1㊂图1金黄色葡萄球菌检验程序5操作步骤5.1样品的处理称取25g样品至盛有225m L7.5%氯化钠肉汤的无菌均质杯内,8000r/m i n~10000r/m i n均质1m i n~2m i n,或放入盛有225m L7.5%氯化钠肉汤无菌均质袋中,用拍击式均质器拍打1m i n~ 2m i n㊂若样品为液态,吸取25m L样品至盛有225m L7.5%氯化钠肉汤的无菌锥形瓶(瓶内可预置适当数量的无菌玻璃珠)中,振荡混匀㊂5.2增菌将上述样品匀液于36ħʃ1ħ培养18h~24h㊂金黄色葡萄球菌在7.5%氯化钠肉汤中呈混浊生长㊂5.3分离将增菌后的培养物,分别划线接种到B a i r d-P a r k e r平板和血平板,血平板36ħʃ1ħ培养18h~ 24h㊂B a i r d-P a r k e r平板36ħʃ1ħ培养24h~48h㊂5.4初步鉴定金黄色葡萄球菌在B a i r d-P a r k e r平板上呈圆形,表面光滑㊁凸起㊁湿润㊁菌落直径为2mm~3mm,颜色呈灰黑色至黑色,有光泽,常有浅色(非白色)的边缘,周围绕以不透明圈(沉淀),其外常有一清晰带㊂当用接种针触及菌落时具有黄油样黏稠感㊂有时可见到不分解脂肪的菌株,除没有不透明圈和清晰带外,其他外观基本相同㊂从长期贮存的冷冻或脱水食品中分离的菌落,其黑色常较典型菌落浅些,且外观可能较粗糙,质地较干燥㊂在血平板上,形成菌落较大,圆形㊁光滑凸起㊁湿润㊁金黄色(有时为白色),菌落周围可见完全透明溶血圈㊂挑取上述可疑菌落进行革兰氏染色镜检及血浆凝固酶试验㊂5.5确证鉴定5.5.1染色镜检:金黄色葡萄球菌为革兰氏阳性球菌,排列呈葡萄球状,无芽胞,无荚膜,直径约为0.5μm~1μm㊂5.5.2血浆凝固酶试验:挑取B a i r d-P a r k e r平板或血平板上至少5个可疑菌落(小于5个全选),分别接种到5m LB H I和营养琼脂小斜面,36ħʃ1ħ培养18h~24h㊂取新鲜配制兔血浆0.5m L,放入小试管中,再加入B H I培养物0.2m L~0.3m L,振荡摇匀,置36ħʃ1ħ温箱或水浴箱内,每半小时观察一次,观察6h,如呈现凝固(即将试管倾斜或倒置时,呈现凝块)或凝固体积大于原体积的一半,被判定为阳性结果㊂同时以血浆凝固酶试验阳性和阴性葡萄球菌菌株的肉汤培养物作为对照㊂也可用商品化的试剂,按说明书操作,进行血浆凝固酶试验㊂结果如可疑,挑取营养琼脂小斜面的菌落到5m LB H I,36ħʃ1ħ培养18h~48h,重复试验㊂5.6葡萄球菌肠毒素的检验(选做)可疑食物中毒样品或产生葡萄球菌肠毒素的金黄色葡萄球菌菌株的鉴定,应按附录B检测葡萄球菌肠毒素㊂6结果与报告6.1结果判定:符合5.4㊁5.5,可判定为金黄色葡萄球菌㊂6.2结果报告:在25g(m L)样品中检出或未检出金黄色葡萄球菌㊂第二法金黄色葡萄球菌平板计数法7检验程序金黄色葡萄球菌平板计数法检验程序见图2㊂图2金黄色葡萄球菌平板计数法检验程序8操作步骤8.1样品的稀释8.1.1固体和半固体样品:称取25g样品置于盛有225m L磷酸盐缓冲液或生理盐水的无菌均质杯内,8000r/m i n~10000r/m i n均质1m i n~2m i n,或置于盛有225m L稀释液的无菌均质袋中,用拍击式均质器拍打1m i n~2m i n,制成1ʒ10的样品匀液㊂8.1.2液体样品:以无菌吸管吸取25m L样品置于盛有225m L磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1ʒ10的样品匀液㊂8.1.3用1m L无菌吸管或微量移液器吸取1ʒ10样品匀液1m L,沿管壁缓慢注于盛有9m L磷酸盐缓冲液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支1m L 无菌吸管反复吹打使其混合均匀,制成1ʒ100的样品匀液㊂8.1.4按8.1.3操作程序,制备10倍系列稀释样品匀液㊂每递增稀释一次,换用1次1m L无菌吸管或吸头㊂8.2样品的接种根据对样品污染状况的估计,选择2个~3个适宜稀释度的样品匀液(液体样品可包括原液),在进行10倍递增稀释的同时,每个稀释度分别吸取1m L样品匀液以0.3m L㊁0.3m L㊁0.4m L接种量分别加入三块B a i r d-P a r k e r平板,然后用无菌涂布棒涂布整个平板,注意不要触及平板边缘㊂使用前,如B a i r d-P a r k e r平板表面有水珠,可放在25ħ~50ħ的培养箱里干燥,直到平板表面的水珠消失㊂8.3培养在通常情况下,涂布后,将平板静置10m i n,如样液不易吸收,可将平板放在培养箱36ħʃ1ħ培养1h;等样品匀液吸收后翻转平板,倒置后于36ħʃ1ħ培养24h~48h㊂8.4典型菌落计数和确认8.4.1金黄色葡萄球菌在B a i r d-P a r k e r平板上呈圆形,表面光滑㊁凸起㊁湿润㊁菌落直径为2mm~ 3mm,颜色呈灰黑色至黑色,有光泽,常有浅色(非白色)的边缘,周围绕以不透明圈(沉淀),其外常有一清晰带㊂当用接种针触及菌落时具有黄油样黏稠感㊂有时可见到不分解脂肪的菌株,除没有不透明圈和清晰带外,其他外观基本相同㊂从长期贮存的冷冻或脱水食品中分离的菌落,其黑色常较典型菌落浅些,且外观可能较粗糙,质地较干燥㊂8.4.2选择有典型的金黄色葡萄球菌菌落的平板,且同一稀释度3个平板所有菌落数合计在20C F U~ 200C F U之间的平板,计数典型菌落数㊂8.4.3从典型菌落中至少选5个可疑菌落(小于5个全选)进行鉴定试验㊂分别做染色镜检,血浆凝固酶试验(见5.5);同时划线接种到血平板36ħʃ1ħ培养18h~24h后观察菌落形态,金黄色葡萄球菌菌落较大,圆形㊁光滑凸起㊁湿润㊁金黄色(有时为白色),菌落周围可见完全透明溶血圈㊂9结果计算9.1若只有一个稀释度平板的典型菌落数在20C F U~200C F U之间,计数该稀释度平板上的典型菌落,按式(1)计算㊂9.2 若最低稀释度平板的典型菌落数小于20C F U ,计数该稀释度平板上的典型菌落,按式(1)计算㊂9.3 若某一稀释度平板的典型菌落数大于200C F U ,但下一稀释度平板上没有典型菌落,计数该稀释度平板上的典型菌落,按式(1)计算㊂9.4 若某一稀释度平板的典型菌落数大于200C F U ,而下一稀释度平板上虽有典型菌落但不在20C F U~200C F U 范围内,应计数该稀释度平板上的典型菌落,按式(1)计算㊂9.5 若2个连续稀释度的平板典型菌落数均在20C F U~200C F U 之间,按式(2)计算㊂9.6 计算公式式(1):T =A BC d(1)式中:T样品中金黄色葡萄球菌菌落数;A某一稀释度典型菌落的总数;B某一稀释度鉴定为阳性的菌落数;C某一稀释度用于鉴定试验的菌落数;d 稀释因子㊂式(2):T =A 1B 1/C 1+A 2B 2/C 21.1d(2)式中:T样品中金黄色葡萄球菌菌落数;A 1第一稀释度(低稀释倍数)典型菌落的总数;B 1第一稀释度(低稀释倍数)鉴定为阳性的菌落数;C 1第一稀释度(低稀释倍数)用于鉴定试验的菌落数;A 2第二稀释度(高稀释倍数)典型菌落的总数;B 2第二稀释度(高稀释倍数)鉴定为阳性的菌落数;C 2第二稀释度(高稀释倍数)用于鉴定试验的菌落数;1.1计算系数;d 稀释因子(第一稀释度)㊂10 报告根据9中公式计算结果,报告每g (m L )样品中金黄色葡萄球菌数,以C F U /g(m L )表示;如T 值为0,则以小于1乘以最低稀释倍数报告㊂第三法 金黄色葡萄球菌M P N 计数11 检验程序金黄色葡萄球菌M P N 计数检验程序见图3㊂图3金黄色葡萄球菌M P N法检验程序12操作步骤12.1样品的稀释按8.1进行㊂12.2接种和培养12.2.1根据对样品污染状况的估计,选择3个适宜稀释度的样品匀液(液体样品可包括原液),在进行10倍递增稀释的同时,每个稀释度分别接种1m L样品匀液至7.5%氯化钠肉汤管(如接种量超过1m L,则用双料7.5%氯化钠肉汤),每个稀释度接种3管,将上述接种物36ħʃ1ħ培养,18h~24h㊂12.2.2用接种环从培养后的7.5%氯化钠肉汤管中分别取培养物1环,移种于B a i r d-P a r k e r平板36ħʃ1ħ培养,24h~48h㊂12.3典型菌落确认按8.4.1㊁8.4.3进行㊂13结果与报告根据证实为金黄色葡萄球菌阳性的试管管数,查M P N检索表(见附录C),报告每g(m L)样品中金黄色葡萄球菌的最可能数,以M P N/g(m L)表示㊂附录A培养基和试剂A.17.5%氯化钠肉汤A.1.1成分蛋白胨10.0g牛肉膏5.0g氯化钠75g蒸馏水1000m LA.1.2制法将上述成分加热溶解,调节p H至7.4ʃ0.2,分装,每瓶225m L,121ħ高压灭菌15m i n㊂A.2血琼脂平板A.2.1成分豆粉琼脂(p H7.5ʃ0.2)100m L脱纤维羊血(或兔血)5m L~10m LA.2.2制法加热溶化琼脂,冷却至50ħ,以无菌操作加入脱纤维羊血,摇匀,倾注平板㊂A.3B a i r d-P a r k e r琼脂平板A.3.1成分胰蛋白胨10.0g牛肉膏5.0g酵母膏1.0g丙酮酸钠10.0g甘氨酸12.0g氯化锂(L i C l㊃6H2O)5.0g琼脂20.0g蒸馏水950m LA.3.2增菌剂的配法30%卵黄盐水50m L与通过0.22μm孔径滤膜进行过滤除菌的1%亚碲酸钾溶液10m L混合,保存于冰箱内㊂A.3.3制法将各成分加到蒸馏水中,加热煮沸至完全溶解,调节p H至7.0ʃ0.2㊂分装每瓶95m L,121ħ高压灭菌15m i n㊂临用时加热溶化琼脂,冷至50ħ,每95m L加入预热至50ħ的卵黄亚碲酸钾增菌剂5m L摇匀后倾注平板㊂培养基应是致密不透明的㊂使用前在冰箱储存不得超过48h㊂A.4脑心浸出液肉汤(B H I)A.4.1成分胰蛋白质胨10.0g氯化钠5.0g磷酸氢二钠(12H2O)2.5g葡萄糖2.0g牛心浸出液500m LA.4.2制法加热溶解,调节p H至7.4ʃ0.2,分装16mmˑ160mm试管,每管5m L置121ħ,15m i n灭菌㊂A.5兔血浆取柠檬酸钠3.8g,加蒸馏水100m L,溶解后过滤,装瓶,121ħ高压灭菌15m i n㊂兔血浆制备:取3.8%柠檬酸钠溶液一份,加兔全血4份,混好静置(或以3000r/m i n离心30m i n),使血液细胞下降,即可得血浆㊂A.6磷酸盐缓冲液A.6.1成分磷酸二氢钾(K H2P O4)34.0g蒸馏水500m LA.6.2制法贮存液:称取34.0g的磷酸二氢钾溶于500m L蒸馏水中,用大约175m L的1m o l/L氢氧化钠溶液调节p H至7.2,用蒸馏水稀释至1000m L后贮存于冰箱㊂稀释液:取贮存液1.25m L,用蒸馏水稀释至1000m L,分装于适宜容器中,121ħ高压灭菌15m i n㊂A.7营养琼脂小斜面A.7.1成分蛋白胨10.0g牛肉膏3.0g氯化钠5.0g琼脂15.0g~20.0g蒸馏水1000m LA.7.2制法将除琼脂以外的各成分溶解于蒸馏水内,加入15%氢氧化钠溶液约2m L调节p H至7.3ʃ0.2㊂加入琼脂,加热煮沸,使琼脂溶化,分装13mmˑ130mm试管,121ħ高压灭菌15m i n㊂A.8革兰氏染色液A.8.1结晶紫染色液A.8.1.1成分结晶紫1.0g95%乙醇20.0m L1%草酸铵水溶液80.0m LA.8.1.2制法将结晶紫完全溶解于乙醇中,然后与草酸铵溶液混合㊂A.8.2革兰氏碘液A.8.2.1成分碘1.0g碘化钾2.0g蒸馏水300m LA.8.2.2制法将碘与碘化钾先行混合,加入蒸馏水少许充分振摇,待完全溶解后,再加蒸馏水至300m L㊂A.8.3沙黄复染液A.8.3.1成分沙黄0.25g95%乙醇10.0m L蒸馏水90.0m LA.8.3.2制法将沙黄溶解于乙醇中,然后用蒸馏水稀释㊂A.8.4染色法a)涂片在火焰上固定,滴加结晶紫染液,染1m i n,水洗㊂b)滴加革兰氏碘液,作用1m i n,水洗㊂c)滴加95%乙醇脱色约15s~30s,直至染色液被洗掉,不要过分脱色,水洗㊂d)滴加复染液,复染1m i n,水洗㊁待干㊁镜检㊂A.9无菌生理盐水A.9.1成分氯化钠8.5g蒸馏水1000m LA.9.2制法称取8.5g氯化钠溶于1000m L蒸馏水中,121ħ高压灭菌15m i n㊂附录B葡萄球菌肠毒素检验B.1试剂和材料除另有规定外,所用试剂均为分析纯,试验用水应符合G B/T6682对一级水的规定㊂B.1.1 A㊁B㊁C㊁D㊁E型金黄色葡萄球菌肠毒素分型E L I S A检测试剂盒㊂B.1.2p H试纸,范围在3.5~8.0,精度0.1㊂B.1.30.25m o l/L㊁p H8.0的T r i s缓冲液:将121.1g的T r i s溶解到800m L的去离子水中,待温度冷至室温后,加42m L浓H C L,调p H至8.0㊂B.1.4p H7.4的磷酸盐缓冲液:称取N a H2P O4㊃H2O0.55g(或N a H2P O4㊃2H2O0.62g)㊁N a2H P O4㊃2H2O2.85g(或N a2H P O4㊃12H2O5.73g)㊁N a C l8.7g溶于1000m L蒸馏水中,充分混匀即可㊂B.1.5庚烷㊂B.1.610%次氯酸钠溶液㊂B.1.7肠毒素产毒培养基B.1.7.1成分蛋白胨20.0g胰消化酪蛋白200m g(氨基酸)氯化钠5.0g磷酸氢二钾1.0g磷酸二氢钾1.0g氯化钙0.1g硫酸镁0.2g菸酸0.01g蒸馏水1000m Lp H7.3ʃ0.2B.1.7.2制法将所有成分混于水中,溶解后调节p H,121ħ高压灭菌30m i n㊂B.1.8营养琼脂B.1.8.1成分蛋白胨10.0g牛肉膏3.0g氯化钠5.0g琼脂15.0g~20.0g蒸馏水1000m LB.1.8.2制法将除琼脂以外的各成分溶解于蒸馏水内,加入15%氢氧化钠溶液约2m L校正p H至7.3ʃ0.2㊂加入琼脂,加热煮沸,使琼脂溶化㊂分装烧瓶,121ħ高压灭菌15m i n㊂B.2仪器和设备B.2.1电子天平:感量0.01g㊂B.2.2均质器㊂B.2.3离心机:转速3000g~5000g㊂B.2.4离心管:50m L㊂B.2.5滤器:滤膜孔径0.2μm㊂B.2.6微量加样器:20μL~200μL㊁200μL~1000μL㊂B.2.7微量多通道加样器:50μL~300μL㊂B.2.8自动洗板机(可选择使用)㊂B.2.9酶标仪:波长450n m㊂B.3原理本方法可用A㊁B㊁C㊁D㊁E型金黄色葡萄球菌肠毒素分型酶联免疫吸附试剂盒完成㊂本方法测定的基础是酶联免疫吸附反应(E L I S A)㊂96孔酶标板的每一个微孔条的A~E孔分别包被了A㊁B㊁C㊁D㊁E 型葡萄球菌肠毒素抗体,H孔为阳性质控,已包被混合型葡萄球菌肠毒素抗体,F和G孔为阴性质控,包被了非免疫动物的抗体㊂样品中如果有葡萄球菌肠毒素,游离的葡萄球菌肠毒素则与各微孔中包被的特定抗体结合,形成抗原抗体复合物,其余未结合的成分在洗板过程中被洗掉;抗原抗体复合物再与过氧化物酶标记物(二抗)结合,未结合上的酶标记物在洗板过程中被洗掉;加入酶底物和显色剂并孵育,酶标记物上的酶催化底物分解,使无色的显色剂变为蓝色;加入反应终止液可使颜色由蓝变黄,并终止了酶反应;以450n m波长的酶标仪测量微孔溶液的吸光度值,样品中的葡萄球菌肠毒素与吸光度值成正比㊂B.4检测步骤B.4.1从分离菌株培养物中检测葡萄球菌肠毒素方法待测菌株接种营养琼脂斜面(试管18mmˑ180mm)36ħ培养24h,用5m L生理盐水洗下菌落,倾入60m L产毒培养基中,36ħ振荡培养48h,振速为100次/m i n,吸出菌液离心,8000r/m i n 20m i n,加热100ħ,10m i n,取上清液,取100μL稀释后的样液进行试验㊂B.4.2从食品中提取和检测葡萄球菌毒素方法B.4.2.1牛奶和奶粉将25g奶粉溶解到125m L㊁0.25M㊁p H8.0的T r i s缓冲液中,混匀后同液体牛奶一样按以下步骤制备㊂将牛奶于15ħ,3500g离心10m i n㊂将表面形成的一层脂肪层移走,变成脱脂牛奶㊂用蒸馏水对其进行稀释(1ʒ20)㊂取100μL稀释后的样液进行试验㊂B.4.2.2脂肪含量不超过40%的食品称取10g样品绞碎,加入p H7.4的P B S液15m L进行均质㊂振摇15m i n㊂于15ħ,3500g离心10m i n㊂必要时,移去上面脂肪层㊂取上清液进行过滤除菌㊂取100μL的滤出液进行试验㊂B.4.2.3脂肪含量超过40%的食品称取10g样品绞碎,加入p H7.4的P B S液15m L进行均质㊂振摇15m i n㊂于15ħ,3500g离心10m i n㊂吸取5m L上层悬浮液,转移到另外一个离心管中,再加入5m L的庚烷,充分混匀5m i n㊂于15ħ,3500g离心5m i n㊂将上部有机相(庚烷层)全部弃去,注意该过程中不要残留庚烷㊂将下部水相层进行过滤除菌㊂取100μL的滤出液进行试验㊂B.4.2.4其他食品可酌情参考上述食品处理方法㊂B.4.3检测B.4.3.1所有操作均应在室温(20ħ~25ħ)下进行,A㊁B㊁C㊁D㊁E型金黄色葡萄球菌肠毒素分型E L I S A检测试剂盒中所有试剂的温度均应回升至室温方可使用㊂测定中吸取不同的试剂和样品溶液时应更换吸头,用过的吸头以及废液处理前要浸泡到10%次氯酸钠溶液中过夜㊂B.4.3.2将所需数量的微孔条插入框架中(一个样品需要一个微孔条)㊂将样品液加入微孔条的A~G 孔,每孔100μL㊂H孔加100μL的阳性对照,用手轻拍微孔板充分混匀,用黏胶纸封住微孔以防溶液挥发,置室温下孵育1h㊂B.4.3.3将孔中液体倾倒至含10%次氯酸钠溶液的容器中,并在吸水纸上拍打几次以确保孔内不残留液体㊂每孔用多通道加样器注入250μL的洗液,再倾倒掉并在吸水纸上拍干㊂重复以上洗板操作4次㊂本步骤也可由自动洗板机完成㊂B.4.3.4每孔加入100μL的酶标抗体,用手轻拍微孔板充分混匀,置室温下孵育1h㊂B.4.3.5重复B.4.3.3的洗板程序㊂B.4.3.6加50μL的TM B底物和50μL的发色剂至每个微孔中,轻拍混匀,室温黑暗避光处孵育30m i n㊂B.4.3.7加入100μL的2m o l/L硫酸终止液,轻拍混匀,30m i n内用酶标仪在450n m波长条件下测量每个微孔溶液的O D值㊂B.4.4结果的计算和表述B.4.4.1质量控制测试结果阳性质控的O D值要大于0.5,阴性质控的O D值要小于0.3,如果不能同时满足以上要求,测试的结果不被认可㊂对阳性结果要排除内源性过氧化物酶的干扰㊂B.4.4.2临界值的计算每一个微孔条的F孔和G孔为阴性质控,两个阴性质控O D值的平均值加上0.15为临界值㊂示例:阴性质控1=0.08阴性质控2=0.10平均值=0.09临界值=0.09+0.15=0.24B.4.4.3结果表述O D值小于临界值的样品孔判为阴性,表述为样品中未检出某型金黄色葡萄球菌肠毒素;O D值大于或等于临界值的样品孔判为阳性,表述为样品中检出某型金黄色葡萄球菌肠毒素㊂B.5生物安全因样品中不排除有其他潜在的传染性物质存在,所以要严格按照G B19489‘实验室生物安全通用要求“对废弃物进行处理㊂附录C金黄色葡萄球菌最可能数(M P N)检索表每g(m L)检样中金黄色葡萄球菌最可能数(M P N)的检索见表C.1㊂表C.1金黄色葡萄球菌最可能数(M P N)检索表阳性管数0.100.010.001M P N 95%置信区间下限上限000<3.0 9.5 0013.00.159.6 0103.00.1511 0116.11.218 0206.21.218 0309.43.638 1003.60.1718 1017.21.318 102113.638 1107.41.320 111113.638 120113.642 121154.542 130164.542 2009.21.438 201143.642 202204.542 210153.742 211204.542 212278.794阳性管数0.100.010.001M P N95%置信区间下限上限220214.542 221288.794 222358.794 230298.794 231368.794 300234.694 301388.7110 3026417180 310439180 3117517200 31212037420 31316040420 3209318420 32115037420 32221040430 323290901000 330240421000 331460902000 33211001804100 333>1100420注1:本表采用3个稀释度[0.1g(m L)㊁0.01g(m L)和0.001g(m L)]㊁每个稀释度接种3管㊂注2:表内所列检样量如改用1g(m L)㊁0.1g(m L)和0.01g(m L)时,表内数字应相应降低10倍;如改用0.01g (m L)㊁0.001g(m L)㊁0.0001g(m L)时,则表内数字应相应增高10倍,其余类推㊂。
化学试剂的纯度和杂质检测方法

化学试剂的纯度和杂质检测方法化学试剂的纯度是指其中所含的目标物质的含量,而杂质则是指与目标物质不相关的其他物质。
高纯度的化学试剂对于各种实验研究至关重要,因为杂质的存在可能会干扰实验结果,并导致数据误差。
因此,对于化学试剂的纯度和杂质检测方法进行研究及验证,具有极大的意义。
一、纯度检测方法1. 数量检测法:数量检测法是最常见的一种纯度检测方法。
通过测定化学试剂中目标物质的含量来评估其纯度。
这种方法包括滴定法、重量法、气相色谱法等。
这些方法具有简便、快速、准确的特点,被广泛应用于化学试剂的质检工作中。
2. 色谱法:色谱法是一种分离和纯化化学试剂的有效方法。
常见的色谱法包括气相色谱、液相色谱等。
色谱法通过分离试剂中的不同物质,在吸附剂或移动相的作用下,使目标物质与杂质能够分离开来,从而评估化学试剂的纯度。
3. 光谱学方法:光谱学方法是一种通过测定化学试剂中物质的吸收、发射或散射光谱来评估其纯度的方法。
常见的光谱学方法包括紫外可见光谱、红外光谱、核磁共振等。
这些方法通过物质分子的特征吸收峰或发射峰,来判断其纯度及含量。
二、杂质检测方法1. 灰分确定法:灰分确定法是一种常用的杂质检测方法。
通过在高温条件下将化学试剂加热,将其中的有机物热分解为无机物,从而测定无机物的含量。
灰分确定法适用于有机试剂的纯度检测,能够评估试剂中是否含有无机杂质。
2. 蒸发残渣法:蒸发残渣法是一种通过将化学试剂蒸发至干燥得到残渣,然后对残渣进行定性或定量分析,从而检测试剂中的杂质。
这种方法适用于对颜色、结晶性、溶解性等特征敏感的杂质。
3. 离子色谱法:离子色谱法是一种专门用于分析溶液中离子量的方法。
通过离子交换柱对溶液中的离子进行分离和检测,从而确定化学试剂中的离子杂质的类型和含量。
综上所述,化学试剂的纯度和杂质检测是化学实验和研究中的重要环节。
选择合适的纯度检测方法和杂质检测方法有助于确保化学试剂的质量符合实验要求,并提高实验结果的准确性。
免疫显色试剂说明书

免疫显色试剂说明书【产品名称】免疫显色试剂【包装规格】【预期用途】在免疫组化反应或原位杂交反应中与首要抗原抗体结合,通过染色,将靶点进行标记。
【检测原理】免疫显色试剂是二步法免疫组化试剂盒,适合与兔或鼠源一抗配用。
其主要过程为,一抗与切片中的靶抗原形成抗原抗体复合物,酶标羊抗鼠/兔IgG聚合物与抗原抗体复合物中的一抗结合,再利用辣根过氧化物酶催化二氨基联苯胺(DAB)在抗原部位形成棕色显色。
由于该系统不含生物素和链亲和素,所以不受内源性生物素干扰,染色背景非常清晰。
【主要组成成分】其他需要但未提供的材料:PBST缓冲液(pH7.2-7.4)、纯化水、酒精、脱蜡液、苏木素染色液、中性树胶、塑料湿盒、染色缸、染色架等。
【储存条件及有效期】储存条件:2-8℃,有效期18个月。
请在开瓶3个月内使用。
生产日期、有效期至:见标签。
【样本要求】常规经福尔马林固定、石蜡包埋的组织切片。
【检测方法】常规脱蜡水化:石蜡切片经常规脱蜡和水化。
抗原热修复:参照一抗说明书进行抗原修复。
DAB工作液的配制:按每毫升DAB缓冲液(试剂D)中加入50μL DAB色原(试剂C)(约1滴)的比例配制DAB工作液,DAB工作液应现配现用。
配制好的DAB 工作液需在2小时内使用,如出现沉淀,使用前先混匀。
操作步骤:1)抗原修复完毕后自然冷却的切片,用自来水清洗。
2)除去切片上组织周围的液体,用免疫组化笔圈定玻片上的待测组织区域并放入PBST缓冲液中。
3)取出切片,除去PBST缓冲液,滴加内源性过氧化物酶阻断剂(试剂A)(视切片大小以完全覆盖切片组织为宜),于组织上孵育10分钟,用PBST清洗切片。
4)除去PBST缓冲液,滴加100μL左右一抗工作液(视切片大小以完全覆盖切片组织为宜),于组织上进行孵育(按照各自一抗说明书操作)。
一抗孵育完毕,用PBST清洗切片。
5)除去PBST缓冲液,每张切片加酶标羊抗鼠/兔IgG聚合物(试剂B)100μL左右(视切片大小以完全覆盖切片组织为宜),室温下孵育30分钟。
实验室认可领域分类代码

第 6 页 共 154 页 备注
适用于以上未涉及的物理化学性 能、物理等检测
硫化氢\总硫 水露点\碳同位素 灰分、挥发分、全硫、发热量、 碳、氢。 煤灰熔融性
2015 年 06 月 01 日发布
2015 年 06 月 01 日实施
CNAS-AL06:2015 一二级代码 三级代码 020702 020799 0208.原油 020801 020802 020899 0209.燃料 020901 020902 020903 020904 020905 020999 0210.润滑 剂、 工业用油 021001 和相关产品 021002 产品/项目/参数 结构或鉴定 (或显微镜/电镜 检测) 其他 化学检测 物性检测 其他 气体燃料(天然气除外) 液化石油气 馏分燃料 残渣燃料 石油焦 其他
第 7 页 共 154 页 备注 鉴定、古生物。 孔隙结构、含油量、渗透率等。 地表原油物性及地层原油的高压 物性 主要由来源于石油的甲烷和/或 乙烷组成的气体燃料 主要由 C3 和 C4 烷烃或烯烃或其 混合物组成 包括:汽油\柴油\喷气燃料等。 含有来源于石油加工残渣的液体 燃料 如:电极用焦、冶炼用焦、燃料 焦等。 包括:新型燃料(如生物柴油、乙 醇汽油)、凝析油。
诊断试剂盒 润滑剂 燃料和油 清洁剂 纸浆和纸 包装材料 临检标本 污物,粪便 其他
02.化学(三级代码为检测方法时,若同一标准中涉及多个方法,请填写多个对应的代码。) 0201.金属与 合金 020101 020102 020103 020104 020105 020106 020107 020108 020109 020110 020111 020112 020113 020114 020199 0202.金属镀 层与处理溶 液 020201 电感耦合等离子体原子发射 光谱分析方法 火花源/电弧原子发射光谱 分析方法 X 射线荧光光谱分析方法 辉光放电发射光谱分析方法 原子荧光光谱分析方法 原子吸收光谱分析方法 紫外-可见吸收光谱分析方 法 金属中碳硫分析方法 金属中气体成分(O、N、H) 分析方法 电感耦合等离子体质谱分析 方法 电化学分析方法 物相(相/夹杂/状态) 分离分 析方法 重量分析方法 滴定分析方法 其他 电感耦合等离子体原子发射 光谱分析方法 火花源/电弧原子发射光谱 分析方法 X 射线荧光光谱分析方法 2015 年 06 月 01 日实施
叔丁醇钾检测方法

我有叔丁醇钾的方法如下供参考
总碱量测定
准确称取本品1.0g,加入50ml蒸馏水和2~3滴甲基红-溴酚蓝(1∶4,
0.005%)混合指示剂,摇匀,用1M 盐酸标准滴定液滴定至溶液由蓝变红色,30秒不变色为终点。
计算:
总碱量=
V×C×112
×100%
G×1000
游离碱含量测定
在K.F.滴定反应瓶中加入1g苯甲酸,用K.F.试剂扣除空白,然后准确称取本品1.0g,加入到K.F.滴定反应瓶中,再用K.F.试剂滴定至终点。
计算:
游离碱含量=
V×T×3.111
×100%
G×10
叔丁醇钾含量=总碱量-游离碱含量
结构式:(CH3)3COK
分子量:112
Cas No:865-47-4
规格和性质:
含量≥ 98 %
游离碱≤ 1.5-2.0 %
外观白色或类白色粉末
产品用途:作为强碱广泛应用于化工,医药,农药等有机合成中的缩合,重排和开环等反应中。
产品的包装和贮运: 20KG 或 25KG 塑料袋纸桶或铁桶装,本品是有机碱性腐蚀品,强吸湿应密封保存,在贮运中注意防火,防晒以及要存放在阴凉通风土燥处。
希悦尔(原泰华施) 过氧乙酸浓度检测及试剂配置方法

Divosan牌过氧乙酸消毒液浓度检测方法一、检测方法1、滴瓶滴定法1、用去离子水冲洗一个250ml的烧杯2至3次。
2、吸取2 ml待测样品放入烧杯中3、加约1ml A溶液, 用B溶液滴定至微红色(注意刚好微红色,不要过量)。
4、加入数滴C溶液,溶液将变成黄褐色。
用D溶液滴至溶液澄清(维持10秒即可)。
每一滴都应混合均匀。
根据PAA的大致浓度选择C溶液的添加量。
5、计算浓度:PAA,ppm = 滴数x 62●测试范围:50 - 5000 ppm注: A —— 5 N 硫酸溶液 B —— 0.1N高锰酸钾溶液C —— 10%碘化钾溶液D —— 0.1N硫代硫酸钠溶液2、移液管滴定法:1. 用去离子水冲洗一个250ml的烧杯2至3次2. 吸取 10 ml待测样品放入烧杯中3. 加5ml A溶液,用B溶液缓慢滴定至微红色,4. 加入1ml C溶液,溶液将变成黄褐色。
用D溶液滴至溶液澄清(维持10秒)每一滴都应混合均匀。
记录D溶液的毫升数(V )5. 计算:PAA ppm = V(mls) x 380●测试范围:50 - 5000 ppm注:A—— 1 N 硫酸溶液 B —— 0.1N高锰酸钾溶液C —— 10%碘化钾溶液D ——0.1N硫代硫酸钠溶液3、试纸检测法:1、用烧杯取50ml检测溶液2、取1片PAA试纸(检测范围:100-500ppm)浸入检测溶液1秒钟3、将PAA试纸的拿出和比色版进行颜色对比,最接近的颜色对应的浓度就是检测溶液的浓度。
注:以上方法仅限于稀释液的浓度检测。
二、溶液配置:1、A溶液(1 N 硫酸溶液)的配置:称取50克浓硫酸,将称取的浓硫酸转移至1000毫升的容量瓶中,用蒸馏水定容至1000毫升。
A溶液(5N 硫酸溶液)的配置:称取250克浓硫酸,将称取的浓硫酸转移至1000毫升的容量瓶中,用蒸馏水定容至1000毫升。
2、B溶液(高锰酸钾溶液)的配置称取3.95g分析纯高锰酸钾晶体(KMnO4),置于500ml烧杯,加去离子水400ml,搅拌溶解,转移到1000ml棕色容量瓶,定容至1000ml放置于黑暗处或棕色容器中保存,3、10%碘化钾溶液的配置:准确称取90克水于烧杯中准确称取10克碘化钾,加入前面称取的90克水中。
格氏试剂的检验与标定
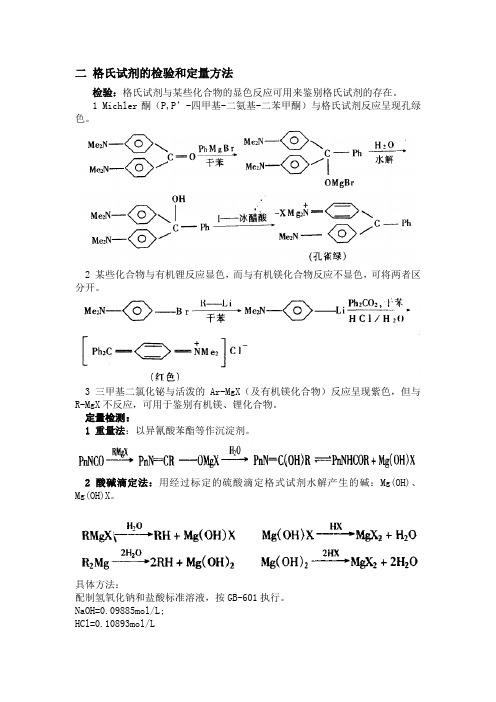
二格氏试剂的检验和定量方法
检验:格氏试剂与某些化合物的显色反应可用来鉴别格氏试剂的存在。
1 Michler酮(P,P’-四甲基-二氨基-二苯甲酮)与格氏试剂反应呈现孔绿色。
2 某些化合物与有机锂反应显色,而与有机镁化合物反应不显色,可将两者区分开。
3 三甲基二氯化铋与活泼的Ar-MgX(及有机镁化合物)反应呈现紫色,但与R-MgX不反应,可用于鉴别有机镁、锂化合物。
定量检测:
1 重量法:以异氰酸苯酯等作沉淀剂。
2酸碱滴定法:用经过标定的硫酸滴定格式试剂水解产生的碱:Mg(OH)、Mg(OH)X。
具体方法:
配制氢氧化钠和盐酸标准溶液,按GB-601执行。
NaOH=0.09885mol/L;
HCl=0.10893mol/L
操作:
1、 1ml离心管取格氏试剂(因格氏试剂中含有镁屑会使结果偏高,故用0.45μ的滤膜过滤),精确称重到0.0001。
2、取一个锥形瓶,加入50ml蒸馏水、10ml盐酸标准滴定溶液、3~5滴溴甲酚绿甲基红指示剂(配制方法见实验员手册)。
3、称好的格氏试剂倒入锥形瓶中水解,溶液呈桔红色,用氢氧化钠标准溶液滴定到呈绿色达到终点,记下氢氧化钠消耗量VNaOH。
计算:
(VHCl*0.10893-VNaOH*0.09885)/W=( )mol/g
W:称取的格氏试剂和重量。
滴定结果都是不准确的,一般的格式反应收率在80%左右!
3 气体分析法:仅适用于水解能产生气体的格式试剂。
4 碘滴定法:
5以邻菲罗啉为指示剂标定格氏试剂
参考Gilmann的方法,在甲苯中与醇反应,以邻菲萝啉作为指示剂。
显色剂配制及代号

显色剂配制及代号在化学实验和检测中,显色剂是用于识别和检测物质的重要工具。
以下是几种常见的显色剂配制及其代号:1. 酚酞显色剂代号:PF配制方法:将0.5g酚酞溶解于500ml乙醇中,加入1.0ml氢氧化钠溶液(浓度为1mol/L)即可。
用途:用于酸碱滴定和pH值指示剂。
2. 甲基橙显色剂代号:MO配制方法:将0.1g甲基橙溶解于100ml水中。
用途:用于酸碱滴定和指示剂。
3. 碘显色剂代号:ID配制方法:将2g碘和1g碘化钾溶解于100ml水中,搅拌均匀即可。
用途:用于检测淀粉和糖类物质。
4. 溴显色剂代号:BR配制方法:将5ml溴溶解于50ml己烷中,加入1滴酚酞指示剂即可。
用途:用于检测醇和酚类物质。
5. 亚甲蓝显色剂代号:MB配制方法:将0.5g亚甲蓝溶解于100ml乙醇中。
用途:用于检测氧化还原反应和某些物质的含量。
6. 罗丹明B显色剂代号:RB配制方法:将适量罗丹明B溶解于甲醇中,加入适量磷酸酸化即可。
用途:用于荧光分析。
7. 荧光素钠显色剂代号:FLU配制方法:将适量荧光素钠溶解于水或乙醇中。
用途:用于荧光分析。
8. 硫酸奎宁显色剂代号:QU配制方法:将适量硫酸奎宁溶解于硫酸中。
用途:用于检测生物碱和某些有机化合物。
9. 溴甲酚绿显色剂代号:BCG配制方法:将适量溴甲酚绿溶解于乙醇中,加入适量氢氧化钠溶液(浓度为1mol/L)即可。
10. 酚酞试纸显色剂代号:FPD配制方法:将适量酚酞溶解于乙醇中,然后将适量该溶液浸渍在滤纸上即可。
用途:用于测定溶液的酸碱性。
注意:1. 不同的显色剂有不同的配制方法和用途,应按照需求选择合适的显色剂。
2. 配制显色剂时应遵循正确的操作步骤,确保安全。
3. 对于一些具有毒性的显色剂,应采取适当的防护措施,避免对人体造成危害。
4. 显色剂应储存于干燥、避光的地方,避免受潮和阳光直射。
5. 在使用显色剂时,应仔细阅读说明书或遵循相关操作规范,确保准确性和安全性。
新试剂名称和检测方法及用途
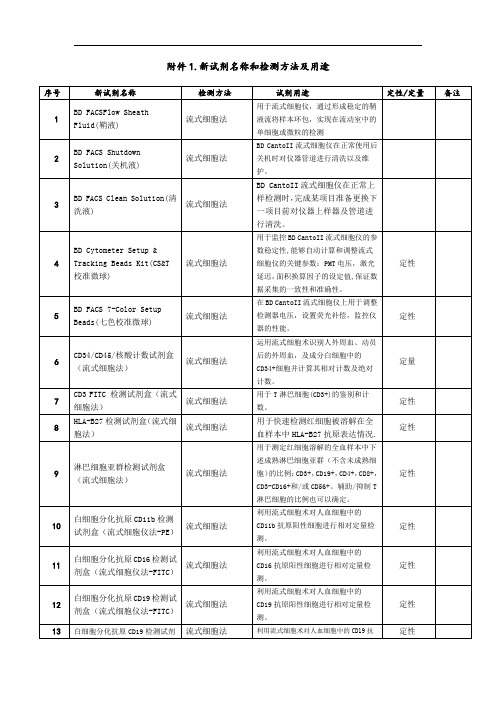
用于快速检测红细胞被溶解在全血样本中HLA-B27抗原表达情况.
定性
9
淋巴细胞亚群检测试剂盒(流式细胞法)
流式细胞法
用于测定红细胞溶解的全血样本中下述成熟淋巴细胞亚群(不含未成熟细胞)的比例:CD3+,CD19+,CD4+,CD8+,CD3-CD16+和/或CD56+。辅助/抑制T淋巴细胞的比例也可以确定。
定性
31
白细胞分化抗原CD8检测试剂盒(流式细胞仪法-PE)
流式细胞法
为单色直接免疫荧光试剂,用于计算红细胞被裂解的全血中(LWB)人类成熟的抑制性/细胞毒性(CD8+)淋巴细胞的百分比
CD38 APC (HB-7)检测试剂(流式细胞法)
流式细胞法
可以鉴别表达CD38抗原的细胞。
定性
18
CD4 APC-Cy7 检测试剂(流式细胞法)
流式细胞法
可以鉴别表达CD4抗原的细胞。
定性
19
CD20 APC-Cy7 检测试剂(流式细胞法)
流式细胞法
可以鉴别表达CD20抗原的细胞。
定性
20
CD15 FITC 检测试剂(流式细胞法
定性
6
CD34/CD45/核酸计数试剂盒(流式细胞法)
流式细胞法
运用流式细胞术识别人外周血、动员后的外周血,及成分白细胞中的CD34+细胞并计算其相对计数及绝对计数。
定量
7
CD3 FITC 检测试剂盒(流式细胞法)
流式细胞法
用于T淋巴细胞(CD3+)的鉴别和计数。
定性
8
HLA-B27检测试剂盒(流式细胞法)
附件1.新试剂名称和检测方法及用途
试剂盒检测方法

试剂盒检测方法试剂盒检测方法是一种常用的实验室技术,用于检测特定物质的存在或浓度。
它在医学诊断、生物学研究、食品安全等领域有着广泛的应用。
本文将介绍试剂盒检测方法的原理、步骤和常见技术要点,希望能为相关领域的研究者提供一些帮助。
首先,我们来看一下试剂盒检测方法的原理。
试剂盒检测方法通常基于特定的生物化学反应,利用酶、抗体、抗原等生物分子与待测物质发生特异性反应的原理,来实现对待测物质的定量或定性检测。
这些生物分子会与待测物质发生特定的结合,产生可观测的信号,如颜色变化、荧光发射等,从而实现对待测物质的检测。
接下来,我们将介绍试剂盒检测方法的一般步骤。
首先是样品的处理,通常需要将样品进行预处理,如离心、稀释等操作,以便获得适合检测的样品。
然后是试剂的配置,根据实验需要,将试剂按照一定比例配置好,以备使用。
接着是反应体系的建立,将待测样品与试剂混合反应,观察反应结果。
最后是结果的分析,根据实验结果,可以通过比色、测光、荧光检测等方法,对待测物质进行定量或定性分析。
在进行试剂盒检测方法时,有一些技术要点需要注意。
首先是实验操作的精准性,需要严格按照操作流程进行,避免操作失误导致结果的偏差。
其次是对试剂的保存和使用要求,一些试剂需要在低温、避光等特定条件下保存,使用时也需要注意避免受到污染。
另外,对于不同样品的处理方法也需要有所区别,针对不同的样品特性,需要选择合适的处理方法,以确保实验结果的准确性和可靠性。
总的来说,试剂盒检测方法是一种简便、快速、准确的检测技术,广泛应用于各个领域。
通过本文的介绍,希望能够帮助读者更好地理解试剂盒检测方法的原理和操作步骤,从而在实验中能够更加准确、可靠地进行相关检测工作。
希望本文能对您有所帮助,谢谢阅读!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
201上海科华生物工程股份有限公司
202英科新创(厦门)科技有限公司
203北京万泰生物药业有限公司
204珠海丽珠试剂有限公司
205上海荣盛生物药业有限公司
206河南华美生物工程有限公司
207郑州安图绿科生物工程有限公司
208中山生物工程有限公司
209潍坊三维生物工程有限公司
210兰州生物制品研究所
方法学代码方法学名称
109重组免疫印迹试验(RIBA)
110不加热血清反应素试验(USR)
111快速血浆反应素试验(RPR)
112甲苯胺红不加热血清试验(TRUST)
113梅毒螺旋体血凝试验(TPHA)
114荧光密螺旋体抗体吸收试验(FTA-ABS)
115其它
注:梅毒螺旋体颗粒凝集试验(TPPA)请按代码106填写。
240罗氏诊断公司Roche Diagnostics
241雅培制药有限公司Abbott
242伯乐公司Bio-Rad
243索林诊断公司DiaSorin
244日本富士瑞必欧株式会社Fujirebio
245Murex Biotech Ltd.
246Ortho-Clinical Diagnostics
247Omega Diagnostics Limited
248Alere Medical Co.,Ltd
249其它
注:梅毒螺旋体抗体诊断试剂(凝集法)SERODIA-TP·PA的用户请按代码244填写。
人类免疫缺陷病毒(HIV)1+2型抗体诊断试剂盒(胶体硒法)Determine HIV-1/2的用户请按代码248填写;
231兰州标佳生物技术有限公司诊断试剂厂
232广州万孚生物技术有限公司
233深圳华美圣科生物工程有限公司
234深圳康生保生物技术有限公司
235深圳华康生物医学工程有限公司
236宁波天润生物药业有限公司
237厦公司
239生物梅里埃公司bioMerieux
211北京金豪制药有限公司
212北京现代高达生物技术有限责任公司
213北京科卫临床诊断试剂有限公司
214北京华大吉比爱生物技术有限公司
215北京天坛生物制品股份有限公司
216北京北大未名诊断试剂有限公司
217北京肝炎试剂研制中心
218北京贝尔生物工程有限公司
219北京北方生物技术研究所
220北京金伟凯医学生物技术有限公司
附表2检测方法及试剂代码表
方法学代码方法学名称
101酶联免疫吸附试验(ELISA)
102化学发光免疫试验(CLIA)
103电化学发光免疫试验(ECLIA)
104放射免疫试验(RIA)
105免疫渗滤/层析试验(ICA/IFA)
106乳胶颗粒凝集试验(PA)
107微粒子酶免疫试验(AxSYM)
108免疫印迹试验(WB)
221北京科美东雅生物技术有限公司
222艾康生物技术(杭州)有限公司
223上海华泰生物工程实业有限公司
224上海复星长征医学科学有限公司
225上海万兴生物制药有限公司
226沈阳惠民生物工程有限公司
227成都生物制品研究所
228武汉生物制品研究所
试剂代码试剂名称
229重庆医学检验试剂研究所
230重庆埃夫朗生物技术有限责任公司
