2010版药典药用乙醇
药典知识简介

附录一药典知识简介一、凡例部分1.标准品、对照品标准品、对照品是指在鉴别、检查、含量测定中应用的标准物质。
标准品与对照品(不包括色谱方法中用的内标物质)均由国务院药品监督管理部门指定的单位制备、标定和供应。
标准品是指生物检定、抗生素或生化药品含量或效价测定中应用的标准物质,按效价单位(或μg)计,以国际标准品进行标定;对照品除另有规定外,均按干燥品(或无水物)进行计算后使用。
标准品与对照品的建立或变更批号,应与国际标准品、国际对照品或原批号标准品、对照品进行对比,并经过协作标定和一定的工作程序进行技术审定。
标准品与对照品均附有使用说明书、质量要求(包括水分等)、使用效期和装量等。
2.试药、试液、指示剂试验用的试药,除另有规定外,均应根据附录试药项下的规定,选用不同等级并符合国家标准或国务院有关行政主管部门规定的试剂标准。
试液、缓冲液、指示剂与滴定剂等,均应符合附录的规定或按照附录的规定制备。
试验用水,除另有规定外,均系指纯化水。
酸碱度检查所用的水,均系指新沸并放冷至室温的水。
酸碱性试验时,如未指明用何种指示剂,均系指石蕊试纸。
未指明乙醇浓度时,均指95%(ml/ml)的乙醇。
3.计量(1)计量仪器要求药物分析检验中用的计量仪器均应符合国务院质量技术监督部门的规定。
(2)滴定液和试液的浓度表示方法以mo1/L(摩尔/升)表示的滴定液,如其浓度要求精密标定,则以“XXX滴定液(YYY mol/L)”表示;当作其他用途不需精密标定其浓度时,用“YYY mol/L XXX溶液”表示。
(3)百分比用“%”符号表示,系指重量的比例;对于溶液的百分比,如无特殊规定是指溶液100 ml中含溶质若干克;此外,还有一些特殊表示方法:表示100 g溶液中含有溶质若干克用%(g/g)表示,100 ml溶液中含有溶质若干毫升用%(ml/ml)表示;100 g溶液中含有溶质若干毫升%(ml/g)表示。
乙醇的百分比系指在20℃时容量的比例。
中国药典年版药用辅料概述

• 美国 2006-7
牙膏含DEG-未报道死亡
• 巴拿马 2007
牙膏含DEG-未报道死亡
• 尼日利亚 2008-9 牙科药中的丙二醇受DEG污染-84人死亡
儿童用制剂辅料的安全性应引起关 注
• 为提高顺应性,儿童用药需更多辅料:矫味
剂、口感改善(爽滑)、口崩片(针对 吞 咽困难)、体积应小、剂量应易于调整、防 腐剂的问题
成分以外一切物料的总称、是药物制剂的重要组成成分。
• 作为:有意加入提高药品的安全性、有效性、稳定性、依
从性为目的的。
药用辅料的作用
• 作为必须的赋形剂 • 例如片剂的粘合剂,乳剂的乳化剂,混悬剂的助悬剂,脂
质体的磷脂,气雾剂的抛射剂等等,在药物制剂中是必需 的,其在制剂中存大是不可或缺的。
• 作为附加剂或填充剂 • 要原充则分上考不虑改填变充药剂物对剂药型物的的性影能响,,可例以如选,择乳的糖余是地一较个大常,用但
• 4、辅料的质量标准不断升级:FRCs
口崩片:我国制剂之痛!!
• 1、发达国家:认为ODT是革命性新制剂;鼓励开
发;技术从冻干、模印,到压制;有专门预混辅 料(可压、速崩、味好等)
• 2、我国:2002-2007:成为低水平研发重灾区
(微晶纤维素加高效崩解剂);目前已有20多个 品种批准,但无法生产(易碎、患者需要学会使 用、味苦、沙粒感);中国药典2010年版不收载 (倒退VS进步)
原因有两个:硬脂酸镁能与阿司匹林形成相应的乙酰水杨酸镁,溶解 度增加:硬脂酸镁具弱碱性而有催化作用。有研究表明阿司匹林单独 的水解机制异于阿司匹林和硬脂酸镁一起的水解。所以选用阿司匹林 片的润滑剂时,就考虑到主药的稳定性,故而选用滑石粉或硬脂酸。 因此,药用辅料的选择应考虑对药物的稳定性的影响。
中国药典2010年版附录

化学药品质量控制按剂型分ⅠA片剂ⅠB注射剂ⅠC酊剂ⅠD栓剂ⅠE胶囊剂ⅠF软膏剂乳膏剂糊剂ⅠG眼用制剂ⅠH丸剂ⅠJ植入剂(增订)ⅠK糖浆剂ⅠL气雾剂粉雾剂喷雾剂ⅠM膜剂ⅠN颗粒剂ⅠO口服溶液剂口服混悬剂口服乳剂ⅠP散剂ⅠQ耳用制剂ⅠR鼻用制剂ⅠS洗剂冲洗剂灌肠剂ⅠT搽剂涂剂涂膜剂ⅠU凝胶剂ⅠV贴剂片剂系指药物与适宜的辅料混匀压制而成的圆片状或异形片状的固体制剂。
片剂以口服普通片为主,另有含片、舌下片、口腔贴片、咀嚼片、分散片、可溶片、泡腾片、阴道片、阴道泡腾片、缓释片、控释片与肠溶片等。
含片系指含于口腔中,药物缓慢溶解产生持久局部作用的片剂。
含片中的药物应是易溶性的,主要起局部消炎、杀菌、收敛、止痛或局部麻醉作用。
含片应进行释放度检查。
舌下片系指置于舌下能迅速溶化,药物经舌下黏膜吸收发挥全身作用的片剂。
舌下片中的药物与辅料应是易溶性的,主要适用于急症的治疗。
口腔贴片系指粘贴于口腔,经黏膜吸收后起局部或全身作用的片剂。
口腔贴片应进行溶出度或释放度检查。
咀嚼片系指于口腔中咀嚼或吮服使片剂溶化后吞服,在胃肠道中发挥作用或经胃肠道吸收发挥全身作用的片剂。
咀嚼片口感、外观均应良好,一般应选择甘露醇、山梨醇、蔗糖等水溶性辅料作填充剂和黏合剂。
咀嚼片的硬度应适宜。
分散片系指在水中能迅速崩解并均匀分散的片剂。
分散片中的药物应是难溶性的。
分散片可加水分散后口服,也可将分散片含于口中吮服或吞服。
分散片应进行溶出度检查。
可溶片系指临用前能溶解于水的非包衣片或薄膜包衣片剂。
可溶片应溶解于水中,溶液可呈轻微乳光。
可供外用、含漱等用。
泡腾片系指含有碳酸氢钠和有机酸,遇水可产生气体而呈泡腾状的片剂。
泡腾片中的药物应是易溶性的,加水产生气泡后应能溶解。
有机酸一般用枸橼酸、酒石酸、富马酸等。
阴道片与阴道泡腾片系指置于阴道内应用的片剂。
阴道片和阴道泡腾片的形状应易置于阴道内,可借助器具将阴道片送入阴道。
阴道片为普通片,在阴道内应易融化、崩解并释放药物,主要起局部消炎杀菌作用,也可给予性激素类药物。
中国药典2010版[1]
![中国药典2010版[1]](https://img.taocdn.com/s3/m/2eed273de2bd960590c67714.png)
计量---计量单位
长度:米,分米,厘米,毫米,微米,纳米
体积:升,毫升,微升 质量:千克,克,毫克,微克,纳克 压力:兆帕,千帕,帕 密度:千克每立方米,克每立方厘米
波数:负一次方厘米
动力粘度:帕秒
试药、试液、指示剂
试药:除另有规定外,选用不同等级并符合 国家有关行政主管部门规定的试剂标准
编排
乙酰唑胺
Acetazolamide
《中国药品通用名称》
按WHO编订的国际非专利 药品名称命名
C4H6N4O3S2,222.25
N-[5-(氨磺酰基)-1,3,4噻二唑-2-基]乙酰胺。 中国化学会《有机化学命名
原则》IUPAC
项目与要求
溶解度
极易溶解 :系指溶质1g(ml)能在溶剂不到1ml 易溶:系指溶质1g(ml)能在溶剂1~不到10ml 溶解:系指溶质1g(ml)能在溶剂10~不到30ml 略溶:系指溶质1g(ml)能在溶剂30~不到100ml 微溶:系指溶质 1g(ml) 能在溶剂 100 ~ 不到 1000ml 中溶 解; 极 微 溶 解 : 系 指 溶 质 1g(ml) 能 在 溶 剂 1000~ 不 到 10000ml 几乎不溶或不溶:系指溶质1g(ml)在溶剂10000ml中不能 完全溶解
主要国外药典标准
(四)《日本药局方》(日本薬局方)
Japanese Pharmacopoeia(简称JP)。
1、目前为第16版。
2、由一部和二部组成,共一册。第一部主要收载原 料药及其基础制剂。第二部主要收集生药、家庭药制 剂和制剂原料。
3、日本厚生省专门出版一本关于抗生素质量标准的 法典《日本抗生物质基准解说》, 简称“日抗基”。
银杏叶2010版药典

银杏叶Yinxin gyeGINKGO FOLIUM本品为银杏科植物银杏G i nkgo biloba L.的干燥叶。
秋季叶尚绿时采收,及时干燥。
【性状】本品多皱折或破碎,完整者呈扇形,长3~12cm,宽5~15cm。
黄绿色或浅棕黄色,上缘呈不规则的波状弯曲,有的中间凹入,深者可达叶长的4/5。
具二叉状平行叶脉,细而密,光滑无毛,易纵向撕裂。
叶基楔形,叶柄长2~8cm。
体轻。
气微,味微苦。
【鉴别】(1)取本品粉末1g,加40%乙醇10ml,加热回流10分钟,放冷,滤过,取滤液作为供试品溶液。
另取银杏叶对照药材1g,同法制成对照药材溶液。
照薄层色谱法(附录ⅥB)试验,吸取上述两种溶液各6μl,分别点于同一含4%醋酸钠的羧甲基纤维素钠溶液为黏合剂制备的硅胶G薄层板上,以乙酸乙酯-丁酮-甲酸-水(5:3:l:1)为展开剂,展开,取出,晾干,喷以3%三氯化铝乙醇溶液,热风吹干,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光主斑点。
(2)取本品粉末1g,加50%丙酮溶液40ml,加热回流3小时,滤过,滤液蒸干,残渣加水20ml使溶解,用乙酸乙酯振摇提取2次,每次20ml,合并乙酸乙酯液,蒸干,残渣加15%乙醇5ml使溶解,加人已处理好的聚酰胺柱(30~60目,lg,内径为1cm,用水湿法装柱)上,用5%乙醇40ml洗脱,收集洗脱液,置水浴上蒸去乙醇,水液用乙酸乙酯振摇提取2次,每次20In l,合并乙酸乙酯液,蒸干,残渣加丙酮1m l使溶解,作为供试品溶液。
另取银杏内酯A对照品、银杏内酯B对照品、银杏内酯C对照品及白果内酯对照品,加丙酮制成每1m1各含银杏内酯A0.5mg、银杏内酯BO.5)mg、银杏内酯C0.5。
乙醇、滑石粉、甘油 国食药监保化[2011]500号 附件
![乙醇、滑石粉、甘油 国食药监保化[2011]500号 附件](https://img.taocdn.com/s3/m/7f92ca582b160b4e767fcfe6.png)
附件1:化妆品用乙醇原料要求为规范化妆品原料技术要求,提高化妆品卫生质量安全,根据我国化妆品监管相关规定,编写《化妆品用乙醇原料要求》,本要求针对性地规定了乙醇的安全性要求及检验方法,其他相关要求及检验方法按相应规定执行。
1. 基本信息1.1 名称乙醇1.1.1 INCI名称及其ID号ALCOHOLID:651.1.2 INCI标准中文译名乙醇1.1.3 化学名称乙醇(Ethanol)1.1.4 《中国药典》中名称2010年版《中国药典》(二部)中名称:乙醇1.1.5 常见别名酒精1.2 登记号1.2.1 CAS登记号64-17-51.2.2 EINECS登记号200-578-61.3 分子式、结构式及分子量分子式:C2H6O结构式:CH3CH2OH分子量:46.071.4 性状及理化常数无色澄清液体,具有特征性气味,味灼烈;易挥发,易燃烧,燃烧时显淡蓝色火焰。
与水、甘油、三氯甲烷或乙醚能任意混溶。
乙醇(95%)沸点:78.2℃,乙醇(95%)凝固点:-114.1℃,乙醇(95%)相对密度:0.8129(20℃)。
2. 技术要求2.1 原料使用目的乙醇在化妆品产品中可作为溶剂、消泡剂、粘度调节剂、收敛剂等使用。
2.2 原料适用范围乙醇广泛用于化妆品中。
2.3 限量要求2.3.1 乙醇含量要求乙醇(φ/%)≥95.0(20℃)。
2.3.2 乙醇中相关组分限量要求乙醇中甲醇体积分数(φ/%)≤0.2。
3. 检验方法3.1 乙醇鉴别试验方法参见2010年版《中国药典》(二部)所载乙醇的鉴别试验方法(见附1)。
3.2 乙醇含量测定方法乙醇样品含量(φ/%)≥95.0,则相对密度应≤0.8129(20℃)。
乙醇样品相对密度检验方法参见2010年版《中国药典》(二部)所载相关内容(见附2)。
3.3 乙醇中甲醇体积分数的测定方法3.3.1 色谱条件以(6%)氰丙基苯基-(94%)二甲基聚硅氧烷为固定液;起始温度40℃,维持12分钟,以每分钟10℃的速率升温至240℃,维持10分钟;进样口温度为200℃;氢火焰离子化检测器,检测器温度为280℃;载气为氮气。
药用辅料大全

BeiJing University of Chinese Medicine
2、丙二醇
【来源与制法】本品是用环氧丙烷为原料,与水水合制得;或用环氧 丙烷与水在硫酸作催化剂条件下,间接水合制得;或用丙烯为原料通 入氯水转化成氯乙醇,然后用碳酸钠水解成1, 2-环氧丙烯,在质子 存在下进一步水解,使1, 2-环氧丙烯转化成丙二醇而得。 【性状】本品为澄明、无色、黏稠,几乎无臭、具吸湿性的液体,几 乎无毒。冰点-59℃ ,沸程185~189℃,与水、丙酮、乙醇、甘油、 氯仿能混溶,与乙醚的溶解比为1:6。与轻矿物油、不挥发性油不相 混溶,可溶解某些芳香油。常温下稳定,高温条件下易生成丙醛、乳 酸、丙酮、乙酸。
2.山梨酸
【配伍变化】当非离子型表面活性剂存在或在塑料容器中时, 本品抑菌活性有所降低。丙烯和乙二醇能增加其活性。本品易 被氧化剂氧化,重金属能起催化作用加速其氧化。 【安全性】本品连续用于皮肤之后有过敏反应和刺激作用发生 。每日允许摄入量0-25mg/kg ( FAO/WHO, 1985), LD50>36g/kg(大鼠,经口),在体内极易被氧化分解而排出 体外。一般公认是安全的。但本品粉尘对眼和呼吸道黏膜有刺 激性,使用时,要适当采取保护措施。 【相关品种】山梨酸钾
【别名】清凉茶酸 【来源与制法】1.天然山梨酸是以内酯形式存在,可从山琌果(蔷薇科 )中提取而得。 2.合成法 【性状】本品为白色有光泽的鳞片状或针状结晶或结晶性粉末,无气味或 微有类似安息香或苯甲醛的气味。室温下微具挥发性,能与水蒸气同 时挥发,约100℃开始升华。水溶液显酸性反应。易溶于乙醇、氯仿、 乙醚和丙酮,能溶于苯、二氧化碳、松节油及油类,在沸水中溶解, 在水中微溶。相对密度1.321,沸点249.2℃。
乙醇测定方法

乙醇测定方法一、气相色谱法本法系采用气相色谱法(2010年版药典一部附录ⅥE)测定各种制剂中在20℃时乙醇(C2H5OH)的含量(%)(ml/ml)。
除另有规定外,按下列方法测定。
第一法(毛细管柱法)色谱条件与系统适用性试验用键合交联聚乙二醇为固定液的毛细管柱;起始温度为50℃,维持7分钟,再以每分钟10℃的速率升温至110℃;进样口温度190℃;检测器温度220℃。
理论板数按正丙醇峰计算应不低于8000,乙醇峰与正丙醇峰的分离度应大于2.0。
校正因子测定精密量取恒温至20℃的无水乙醇4ml、5ml、6ml,分别置100ml量瓶中,分别精密加入恒温至20℃的正丙醇(内标物质)5ml,用水稀释至刻度,摇匀,精密量取上述各溶液1ml,分别置100ml量瓶中,用水稀释至刻度,摇匀(必要时可进一步稀释),作为对照品溶液。
取上述三种溶液各适量,注入气相色谱仪,分别连续进样3次,测定峰面积,计算校正因子,所得校正因子的相对标准偏差不得大于2.0%。
测定法精密量取恒温至20℃的供试品适量(相当于乙醇约5ml),置100ml量瓶中,精密加入恒温至20℃的正丙醇5ml,用水稀释至刻度,摇匀,精密量取该溶液1ml,置1 00ml量瓶中,用水稀释至刻度,摇匀(必要时可进一步稀释),作为供试品溶液。
取1μl注入气相色谱仪,测定,即得。
第二法(填充柱法)色谱条件与系统适用性试验用直径为0.18~0.25mm的二乙烯苯-乙基乙烯苯型高分子多孑L小球作为载体;柱温为120~150℃。
理论板数按正丙醇峰计算应不低于70 0,乙醇峰与正丙醇峰的分离度应大于2.0。
校正因子测定精密量取恒温至20℃的无水乙醇4ml、5ml、6ml,分别置100ml量瓶中,分别精密加入恒温至20℃的正丙醇(内标物质)5ml,用水稀释至刻度,摇匀(必要时可进一步稀释),取上述三种溶液适量,注入气相色谱仪,分别连续进样3次,测定峰面积,计算校正因子,所得校正因子的相对标准偏差不得大于2.0%。
医用酒精国标

医用酒精执行标准又称乙醇消毒剂卫生标准。
配方中使用的乙醇应符合《中华人民共和国药典》(二部×2010年版)中“乙醇”的要求;以食用乙醇为原料的应符合GB10343的要求。
生产用水应为去离子水。
配方中的其他组分应符合国家有关标准和规定(包括纯度规格等)。
用于手、皮肤消毒的消毒液不得使用工业级原材料。
法律依据:《乙醇消毒剂卫生标准》第三条配方中使用的乙醇应符合《中华人民共和国药典》(二部×2010年版)中“乙醇”的要求;以食用乙醇为原料的应符合GB10343的要求。
生产用水应为去离子水。
配方中的其他组分应符合国家有关标准和规定(包括纯度规格等)。
用于手、皮肤消毒的消毒液不得使用工业级原材料。
2010版中国药典三部(生物制品)凡例

凡例总则一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。
《中国药典》一经颁布实施,其同品种的上版标准或其原国家标准即同时停止使用。
《中国药典》由一部、二部、三部及其增补本组成,内容分别包括凡例、正文和附录。
除特别注明版次外,《中国药典》均指现行版《中国药典》。
本部为《中国药典》三部。
二、国家药品标准由凡例、通则与正文及其引用的附录共同构成。
本部药典收载的凡例、附录对药典以外的其他生物制品国家标准具同等效力。
三、凡例是为正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、附录及与质量检定有关的共性问题的统一规定。
四、凡例和附录中采用的“除另有规定外”这一用语,表示存在与凡例或附录有关规定不一致的情况时,则在正文中另作规定,并按此规定执行。
五、正文所设各项规定是针对符合《药品生产质量管理规范》(Good Manufacturing Practices,GMP)的产品而言。
任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。
六、《中国药典》的英文名称为Pharmacopoeia of The People’s Republic of China;英文简称ChinesePharmacopoeia;英文缩写为Ch.P.。
正文七、正文系根据生物制品自身的理化与生物学特性,按照批准的原材料、生产工艺、贮藏运输条件等所制定的、用以检测生物制品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。
八、正文内容根据品种和剂型不同,按顺序可分别列有:(1)品名(包括中文通用名称、汉语拼音与英文名);(2)定义、组成及用途;(3)基本要求;(4)制造;(5)检定(原液、半成品、成品);(6)保存、运输及有效期;(7)使用说明(预防类制品)。
附录九、附录主要收载制剂通则、通用检测方法和指导原则。
中国药典2010年版一部附录 (二)

附录Ⅴ 分光光度法分光光度法是通过测定被测物质在特定波长处或一定波长范围内的吸光度或发光强度,对该物质进行定性和定量分析的方法。
常用的波长范围为:(1) 200~400nm 的紫外光区;(2)400~760nm 的可见光区;(3) 760~2500nm 的近红外光区;(4)2.5~25μm (按波数计为4000~ 400cm -1)的中红外光区。
所用仪器为紫外分光光度计、可见分光光度计(或比色计)、红外分光光度计或原子吸收分光光度计。
为保证测量的精密度和准确度,所用仪器应按照国家计量检定规程或本附录规定,定期进行校正检定。
单色光辐射穿过被测物质溶液时,在一定的浓度范围内被该物质吸收的量与该物质的浓度和液层的厚度(光路长度)成正比,其关系如下式:A=lg T 1=Ecl式中 A 为吸光度;T 为透光率;E 为吸收系数,采用的表示方法是%11cm E ,其物理意义为当溶液浓度为1%(g/ml ),液层厚度为1cm 时的吸光度数值;c 为100ml 溶液中所含被测物质的重量(按干燥品或无水物计算),g ; l 为液层厚度,cm 。
物质对光的选择性吸收波长,以及相应的吸收系数是该物质的物理常数。
当已知某纯物质在一定条件下的吸收系数后,可用同样条件将该供试品配成溶液,测定其吸光度,即可由上式计算出供试品中该物质的含量。
在可见光区,除某些物质对光有吸收外,很多物质本身并没有吸收,但可在一定条件下加入显色试剂或经过处理使其显色后再测定,故又称比色分析。
附录Ⅴ A 紫外-可见分光光度法仪器的校正和检定1.波长 由于环境因素对机械部分的影响,仪器的波长经常会略有变动、因此除应定期对所用的仪器进行全面校正检定外,还应于测定前校正测定波长。
常用汞灯中的较强谱线237.83nm,253.65nm,275.28nm,296.73nm,313.l6nm,334.15nm,365.02nm,404.66nm,435.83nm,546. 07nm与576.96nm;或用仪器中氘灯的486.02nrn与656.10nm谱线进行校正;钬玻璃在波长279.4nm,287.5nm,333.7nm,360.9nm,418.5nm,460.0nm,484.5nm,536.2nm与637.5nm 处有尖锐吸收峰,也可作波长校正用,但因来源不同或随着时间的推移会有微小的变化,使用时应注意;近年来,常使用高氯酸钬溶液校正双光束仪器,以10%高氯酸溶液为溶剂,配制含氧化钬(Ho2O3) 4%的溶液,该溶液的吸收峰波长为241.13nm,278.10nm,287.18nm,333.44nm,345.47nm,361.31nm,416.28nm,451.30nm,485.29nm,536.64nm和640.52nm。
中华人民共和国药典 2010年版 二部 乙醇

乙醇YichunEthanolC2H6O46.07【性状】本品为无色澄清液体;微有特臭,味灼烈;易挥发,易燃烧,燃烧时显淡蓝色火焰;加热至约78℃即沸腾。
本品与水、甘油、三氯甲烷或乙醚能任意混溶。
相对密度本品的相对密度(附录ⅥA)不大于0.8129,相当于含C2H6O不少于95.0%(ml/ml)。
【鉴别】(1)取本品1ml,加水5ml与氢氧化钠试液1ml后,缓缓滴加碘试液2ml,即发生碘仿的臭气,并生成黄色沉淀。
(2)本品的红外光吸收图谱应与对照品的图谱一致(附录ⅣC)。
【检查】酸碱度取本品20ml,加水20ml,摇匀,滴加酚酞指示液2滴,溶液应为无色;再加0.01mol/L氢氧化钠溶液1.0ml,溶液应显粉红色。
溶液的澄清度与颜色本品应澄清无色。
取本品适量,与同体积的水混合后,溶液应澄清;在10℃放置30分钟,溶液仍应澄清。
吸光度取本品,以水为空白,照紫外-可见分光光度法(附录ⅣA)测定吸光度,在240nm的波长处不得过0.08;250~260nm的波长范围内不得过0.06;270~340nm的波长范围内不得过0.02。
挥发性杂质照气相色谱法测定(附录ⅤE)。
色谱条件与系统适用性试验以6%的氰丙基苯基-94%二甲基聚硅氧烷为固定液;起始温度40℃,维持12分钟,以每分钟10℃的速率升温至240℃,维持10分钟;进样口温度为200℃;检测器温度为280℃。
对照溶液(b)中乙醛峰与甲醇峰之间的分离度应符合要求。
测定法精密量取无水甲醇100μl,置50ml量瓶中,用供试品稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,用供试品稀释至刻度,摇匀,作为对照溶液(a);精密量取无水甲醇50μl,乙醛50μl,置50ml量瓶中,用供试品稀释至刻度,摇匀,精密量取100μl,置10ml量瓶中,用供试品稀释至刻度,摇匀,作为对照溶液(b);精密量取乙缩醛150μl,置50ml量瓶中,用供试品稀释至刻度,摇匀,精密量取100μl,置10ml量瓶中,用供试品稀释至刻度,摇匀,作为对照溶液(c);精密量取苯100μl,置100ml量瓶中,用供试品稀释至刻度,摇匀,精密量取100μl,置50ml量瓶中,用供试品稀释至刻度,摇匀,作为对照溶液(d);取供试品作为供试品溶液(a);精密量取4-甲基-2-戊醇150μl,置500ml量瓶中,加供试品稀释至刻度,摇匀,作为供试品溶液(b)。
药用乙醇出厂检验鉴定书
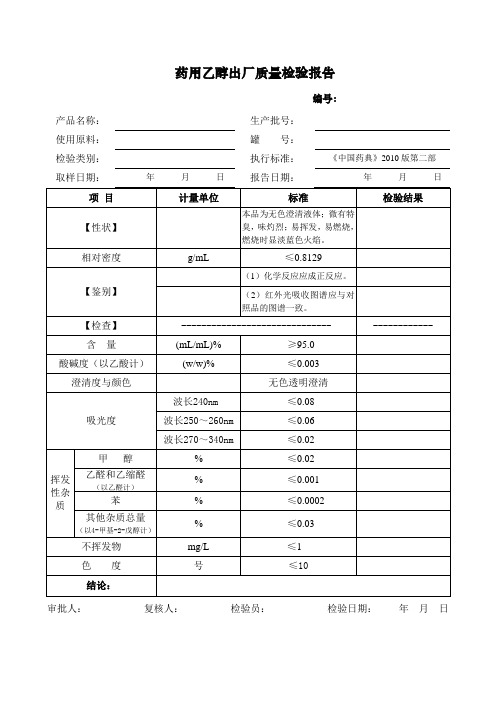
挥发性杂质
甲醇
%
≤0.02
乙醛和乙缩醛
(以乙醛计)
%
≤0.001
苯
%
≤0.0002
其他杂质总量(以4-甲基-2-戊醇计)
%
≤0.03
不挥发物
mg/L≤1色度ຫໍສະໝຸດ 号≤10结论:
审批人:复核人:检验员:检验日期:年月日
药用乙醇出厂质量检验报告
编号:
产品名称:
生产批号:
使用原料:
罐号:
检验类别:
执行标准:
《中国药典》2010版第二部
取样日期:
年月日
报告日期:
年月日
项目
计量单位
标准
检验结果
【性状】
本品为无色澄清液体;微有特臭,味灼烈;易挥发,易燃烧,燃烧时显淡蓝色火焰。
相对密度
g/mL
≤0.8129
【鉴别】
(1)化学反应应成正反应。
(2)红外光吸收图谱应与对照品的图谱一致。
【检查】
------------------------------
------------
含量
(mL/mL)%
≥95.0
酸碱度(以乙酸计)
(w/w)%
≤0.003
澄清度与颜色
无色透明澄清
吸光度
波长240nm
≤0.08
波长250~260nm
≤0.06
波长270~340nm
【一起学药典】四部-辅料变化对比6种(乙醇、明胶空心胶囊_

【一起学药典】四部-辅料变化对比6种(乙醇、明胶
空心胶囊
乙醇、二甲硅油、低取代羟丙纤维素、明胶空心胶囊、氢氧化钠、活性炭(供注射用),未完待续……
乙醇
标准正文内容基本等同于二部,与二部相比,有几点思考:
性状:删除了溶解性的描述,挺好;部分内容转至“注”中(注:本品易挥发,易燃烧,燃烧时显淡蓝色火焰。
)。
酸碱度:要求使用“新沸放冷的水”,明确就明确了吧,也没啥(本部药典凡例二十九、已经明确要求了)。
挥发性杂质:公式修正了,但是体例上反而不如二部的清晰明了。
不挥发物:与二部的量取样品的方法不同,
“精密量取本品40ml”,怎么才能精密量取40ml呢?百思不得解。
二甲硅油
性状:删除了臭味判断;溶解度中删除了“乙醚”中的溶解能力要求。
鉴别(3)增加了“750cm-1~850cm-1范围内的吸收峰可忽略不计”的要求。
重金属:……立即强力振摇供试品溶液和对照溶液1分钟,照紫外-可见分光光度法(通则0401),在523nm处测定吸光度,供试品溶液的吸光度不得大于对照溶液的吸光度(0.0005%)。
学习:此项检查使用了仪器法判定吸光度的大小,更客观减少人为误差,同时需要建立方法、管理好电子数据。
食品标准中这么玩儿的比较多。
含量测定:
讨论:这是一个绕不过去的坎儿。
Du为样品在25°C时的相对密度;Ds为对照品在25°C时的相对密度。
样品的密度测定好解决,。
中国药典2010年版word版exe电子书及pdf版

中国药典2010年版(word版+exe版+pdf版)为了方便大家使用2010版中国药典,现在整理出各种格式的2010版中国药典,包括pdf版,word版和exe版。
2010版中国药典pdf版-正版药典扫描而成,效果堪比原书,三部齐全,复印中国药典的绝佳资料;2010版中国药典word版-可以随意复制粘贴,编制文件不可多得的珍贵资料;2010版中国药典exe版-药圈首发,经勘误本校对而成,可以任你复制粘贴,具有搜索功能。
原文首发地址:最完整、最清晰的2010版中国药典-pdf格式:/forum-viewthread-tid-19984-fromuid-5.html2010版中国药典一部电子书-exe格式:/forum-viewthread-tid-19359-fromuid-5.html2010版中国药典-Word版(中药材):/forum-viewthread-tid-18046-fromuid-5.html以下是2010版中国药典三种版本的截图:中国药典2010年版目录一枝黄花(p3) (17)丁公藤(p3) (18)丁香(p4) (20)八角茴香(p4) (21)人工牛黄 (22)人参 (27)人参叶 (29)儿茶 ........................................................................................................... 错误!未定义书签。
九里香 ............................................................................................................... 错误!未定义书签。
九香虫 ............................................................................................................... 错误!未定义书签。
2010年版药典与2005年的区别

《中华人民共和国药典》2010年版与2005年版对比汇总2005年版2010年版共9项28条共12项38条(增加【总则】、【正文】、【附录】3项)/明确了中国药典为依据《中华人民共和国药品管理法》组织制定和颁布的。
/明确正文所设各项规定是针对符合GMP的产品而言。
任何违反GMP或有未经批准添加物质所生产物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。
/正文系根据药物自身的理化与生物学特性,按照批准的处方来源、生产工艺、贮藏运输条件等所制定的用、用以检测药品质量能否达到用药要求并衡量其质量是否稳定均一的技术规定。
/制剂通则系按照药物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种进行相同检查项目的检测时所应采用的统一的设备、程序、方法及限度等;指导原则系指为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性原则。
/《项目与要求》项增加了制法项(主要记载药品的重要工艺要求和质量管理要求)1.所有药品的工艺应经验证,并经国务院药品监督管理部门批准,生产过程均应符合GMP的要求;2.来源于动物组织提取的药品,其所用动物种属要明确,所用脏器均应来自经检疫的健康动物,涉及牛源的应取自无牛海绵状脑病的健康牛群;来源于人尿提取的药品,均应取自健康人群。
上述药品均应有明确的病毒灭活工艺要求以及质量管理要求。
3.直接用于生产的菌种、毒种、来自人和动物的细胞、DNA重组工程菌及工程细胞,来源途径均应经国务院药品监督管理部门批准并应符合国家相关的管理规范。
/对于生产过程中引入的有机溶剂,应在后续的生产环节中予以有效去除。
除正文已明确列有“残留溶剂”检查的品种必须依法进行该项检查外,其他未在“残留溶剂”项下明确列出的有机溶剂与未在正文中列有此项检查的各品种,如生产过程中引入或产品中残留有有机溶剂,均应按附录“残留溶剂测定法”检查并应符合相应溶剂的限度规定。
药典法测乙醇

6附录ⅦE 乙醇量测定法本法系采用气相色谱法(2010年版药典二部附录Ⅴ E)测定制剂中在20℃时乙醇(C2H5OH)的含量(%,ml/ml)。
除另有规定外,按下列方法测定。
6.1第一法(毛细管柱法)6.1.1色谱条件与系统适用性试验用键合交联聚乙二醇为固定液的毛细管柱;起始温度为50℃,维持7分钟,再以每分钟10℃的速率升温至110℃;进样口温度190℃;检测器温度220℃。
理论板数按正丙醇峰计算应不低于8000,乙醇峰与正丙醇峰的分离度应大于2.0。
6.1.2校正因子测定精密量取恒温至20℃的无水乙醇4ml、5ml、6ml,分别置100ml量瓶中,分别精密加入恒温至20℃的正丙醇(内标物质)5ml,用水稀释至刻度,摇匀,精密量取上述各溶液1ml,分别置100ml量瓶中,用水稀释至刻度,摇匀(必要时可进一步稀释),作为对照品溶液。
取上述三种溶液各适量,注入气相色谱仪,分别连续进样3次,测定峰面积,计算校正因子,所得校正因子的相对标准偏差不得大于2.0%。
6.1.3测定法精密量取恒温至20℃的供试品适量(相当于乙醇约5ml),置100ml量瓶中,精密加入恒温至20℃的正丙醇5ml,用水稀释至刻度,摇匀,精密量取该溶液1ml,置100 ml量瓶中,用水稀释至刻度,摇匀(必要时可进一步稀释),作为供试品溶液。
取1μl 注入气相色谱仪,测定,即得。
6.2第二法(填充柱法)6.2.1色谱条件与系统适用性试验用直径为0.18~0.25mm的二乙烯苯-乙基乙烯苯型高分子多孔小球作为载体;柱温为120~150℃。
理论板数按正丙醇峰计算应不低于700,乙醇峰与正丙醇峰的分离度应大于2.0。
6.2.2校正因子测定精密量取恒温至20℃的无水乙醇4ml、5ml、6ml,分别置100ml量瓶中,分别精密加入恒温至20℃的正丙醇(内标物质)5ml,用水稀释至刻度,摇匀(必要时可进一步稀释)。
取上述三种溶液适量,注入气相色谱仪,分别连续进样3次,测定峰面积,计算校正因子,所得校正因子的相对标准偏差不得大于2.0%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乙醇
Yichun
Ethanol
[修订]
【检查】酸碱度取本品20ml,加水20ml,摇匀,滴加酚酞指示液2滴,溶液应为无色;再加0.01mol/L氢氧化钠溶液1.0ml,溶液应显粉红色(0.003%,以醋酸计)。
溶液的澄清度与颜色本品应澄清无色。
取本品适量,与同体积的水混合后,溶液应澄清;在10℃放置30分钟,溶液仍应澄清。
挥发性杂质照气相色谱法测定(中国药典2005年版二部附录ⅤE)。
色谱条件与系统适用性试验采用6%氰丙基苯基-94%二甲基聚硅氧烷毛细管柱;氢火焰离子化检测器(FID);分流进样,采用程序升温方式,40℃保持12min,然后以每分钟10℃的速度升温至240℃,保持10min,进样口温度200℃,检测器温度280℃。
对照溶液(b)中乙醛峰与甲醇峰之间的分离度应大于1.5。
对照溶液(a):精密量取无水甲醇100μl,用供试品稀释至50ml,摇匀,精密量取5.0ml,用供试品稀释至50ml,摇匀,作为对照溶液(a)。
对照溶液(b):精密量取无水甲醇50μl,乙醛50μl,用供试品稀释至50ml,摇匀,精密量取100μl,用供试品稀释至10ml,摇匀,作为对照溶液(b)。
对照溶液(c):精密量取乙缩醛150μl,用供试品稀释至50ml,摇匀,精密量取100μl,用供试品稀释至10ml,摇匀,作为对照溶液(c)。
对照溶液(d):精密量取苯100μl,用供试品稀释至100ml,摇匀,精密量取100μl,用供试品稀释至50ml,摇匀,作为对照溶液(d)。
供试品溶液(a):取供试品作为供试品溶液(a)。
供试品溶液(b):精密量取4-甲基-2-戊醇150μl,加供试品稀释至500ml,摇匀,作为供试品溶液(b)。
测定法分别取对照溶液(a)、(b)、(c)、(d)和供试品溶液(a)、(b)各1μl,分别注入气相色谱仪,记录色谱图,供试品溶液如出现杂质峰,应符合下列要求。
①甲醇供试品中甲醇峰面积不得大于对照溶液(a)主峰面积的1/2(0.02%);
②乙醛和乙缩醛供试品中乙醛和乙缩醛的总量按下式计算,总量不得过0.001%(以乙醛计);
[(10⨯A E)/(A T-A E)]+[(30⨯C E)/(C T-C E)]
A E=供试品溶液(a)中乙醛的峰面积
A T=对照溶液(b)中乙醛的峰面积
C E=供试品溶液(a)中乙缩醛的峰面积
C T=对照溶液(c)中乙缩醛的峰面积
③苯供试品中苯的量按下式计算,不得过0.0002%;
(2B E)/(B T-B E)
B E=供试品溶液中苯的峰面积
B T=对照溶液中苯的峰面积
④其他杂质总量供试品溶液(b)中其他各杂质峰面积的总和不得大于4-甲基-2-戊醇的峰面积(0.03%,以4-甲基-2-戊醇计)。
吸光度取本品,采用5cm吸收池,以水为空白,照紫外-可见分光光度法(附录IV A)测定吸光度,在240nm的波长处不得过0.4;250~260nm的波长范围内不得过0.3;270~340nm的波长范围内不得过0.1。
[增订]
【鉴别】(2)本品的红外光吸收图谱应与对照品的图谱一致(附录Ⅳ C)。
