阳离子开环聚合包括环醚
第七章开环聚合(ring-openingpolymerization)
SiR2
水解-缩合聚合难以生成高分子线形聚硅氧烷;需通过环单体聚合得到;
D4:八烃基环四硅氧烷;D3:六烃基环三硅氧烷
高分子化学第七章
14
聚硅氧烷(polysiloxane)
开环聚合 可进行阴离子、阳离子聚合;
RR R O Si
以丁基锂或萘钠引发的
R
阴离子聚合具有“活性”聚合特征;
Si O
Si
O
O Si
R R
RR
物理特性:低的表面张力和界面张力、 低的玻璃化转变温度;生物相容性
烯烃的开环聚合
R
O Si n R
n CH CH n
高分子化学第七章
n CH CH n n
15
水解-缩合聚合:单体为氯硅氧烷(SiRnCln-4)
CH3
CH3
CH3
Cl Si Cl H2O HO Si Cl + Cl Si OH
CH3 Si O n
CH3
CH3
CH3
CH3
CH3
SiR2 OH + CH3Si(OH)3
SiR2 O Si O SiR2
O
水解-缩合聚合过程中 生成环单体
R = 烷基、苯基、 乙烯基、氢原子
聚磷酸酯(polyphosphoester) biodegradable
高分子化学第七章
13
聚硅氧烷(polysiloxane)
R
O Si
类型:
R
硅 油(低分子量线形聚硅氧烷); SiR2Cl2水解、缩合; 硅树脂(高度交联的聚硅氧烷); SiR2Cl2、SiRCl3与SiCl4水解、缩合; 硅橡胶(轻度交联的聚硅氧烷); 环单体(D4或D3)聚合;
环氧丙烷与环氧氯丙烷的共聚

2013 届毕业(设计)论文题目环氧丙烷和环氧氯丙烷共聚物的合成专业班级学号学生姓名指导教师指导教师职称学院名称材料科学与工程完成日期: 2013年月日环氧丙烷和环氧氯丙烷共聚物的合成Synthesis of theCopolymer of EpoxyPropane andEpichlorohydrin学生姓名指导教师摘要环氧氯丙烷和环氧丙烷开环共聚合成氯醚橡胶,共聚型的聚环氧氯丙烷是耐油,耐寒,耐臭氧,耐气候性和耐燃性良好的橡胶。
但其合成产物中常常含有大量的低分子量齐聚物,而它们的存在则会大大影响氯醚橡胶的平均官能度及其使用性能。
本论文针对上述问题,以3-氯-1-三氟氧硼-2-丙氧基三苯基氧化膦/ 三氟化硼为催化引发体系,控制反应条件,使环氧氯丙烷,环氧丙烷进行阳离子开环聚合。
并对合成的环氧氯丙烷和环氧丙烷共聚物的结构和性能通过黏度和红外光谱进行测定,根据上述的测试结果,有利地说明了以上催化引发体系能有效地引发环氧氯丙烷的阳离子开环聚合,并且所得的聚合物中的低分子量的产物较少。
关键词:环氧氯丙烷和环氧丙烷共聚物;阳离子聚合;3-氯-1-三氟氧硼-2-丙氧基三苯基氧化膦/三氟化硼引发体系AbstractEpichlorohydrin and propylene oxide ring opening copolymerization of epichlorohydrin rubber, epichlorohydrin copolymer of poly is oil based, cold, ozone resistance, weather resistance and good flame resistance of rubber. But the synthetic products often contain large quantities of low molecular weight oligomers, and their presence will greatly affect the average epichlorohydrin functionality andperformance. According to the above problem in the present paper ,3-Chloro-1-boron trifluoride oxide-2-propanoxytriphenylphosphonium salt/boron trifluoride as catalyst initiator system, controlling the reaction conditions, so that epichlorohydrin, propylene oxide for cationic ring-opening polymerization. And the synthesis of epichlorohydrin and propylene oxide copolymer structure and properties by viscosity and infrared spectra were measured, according to the above test results, a favorable description of the above catalyst initiator system could lead to ethylene chloride cationic ring-opening polymerization of propane, and from low molecular weight polymer in the product low.Keywords:Epichlorohydrin and epoxy propane copolymers;Cationic polymerization;3-Chloro-1-boron trifluoride oxide-2-propanoxytriphenylphosphonium salt/boron trifluoride initiator system目录摘要 (I)Abstract (II)前言 (1)第一章文献综述 (2)1.1 环氧氯丙烷开环聚合机理 (4)1.1.1环氧氯丙烷的阳离子开环聚合 (5)1.1.2 环氧氯丙烷的配位聚合 (7)1.2 环氧氯丙烷聚合体系的研究 (8)1.3 聚环氧氯丙烷的结构与特性 (12)1.4 聚环氧氯丙烷(共聚型)的应用 (14)1.5 本实验主要研究内容 (15)第二章实验部分 (16)2.1 实验试剂及仪器 (16)2.1.1 实验试剂 (16)2.1.2 实验设备 (16)2.1.3 单体精制 (17)2.2 合成反应 (17)2.2.1 共聚物的合成: (17)2.3 环氧氯丙烷共聚物表征方法 (19)2.3.1 红外光谱 (19)2.3.2 黏度法 (19)第三章结果与讨论 (22)3.1 聚合反应的实验现象及结果 (22)3.1.1 实验现象 (22)3.1.2 实验结果与讨论 (22)3.2 红外光谱分析 (24)3.3分子量的测试 (25)第四章结论 (34)参考文献 (35)致谢 (37)前言氯醚橡胶(环氧氯丙烷和环氧丙烷共聚物),经环氧氯丙烷,环氧丙烷开环聚合而成,是一种重要的化工产品。
高分子化学-11(开环聚合)

聚合机理动力学
引发: R-Z + C
增长:
M* +
n
R-Z
M*
Z: 单体的功能基 C: 离子型或分子型引发剂
(RO-, OH-, H+, BF3, H2O)
M-(R-Z)*n-
开环聚合归连锁聚合还是逐步聚合有两方面:
a. 聚合动力学方程 b. 聚合物分子量随时间分布
环醚的开环聚合--- 聚醚的制备
rz离子型或分子型引发剂ro聚合物分子量随时间分布环醚的开环聚合聚醚的制备一般用阳离子引发剂引发clch33?二氯亚甲基丁氧环四氢呋喃二氧五环但三元环醚用阴离子阳离子配位聚合均可
Chapter 7 开环聚合反应 ( Ring opening polymerization )
一、概述-开环聚合的单体及特点
一般用阳离子引发剂引发
CH3
CH2Cl
CH2CH3
O
环氧乙烷
能开环:o
丁氧环
O
环氧乙烷
o
O
环氧氯丙烷
CH2Cl CH2Cl 3,3'-二(氯亚甲基)丁氧环
O
环氧丁烷
o
四氢呋喃
oo
二氧五环
o
不能开环:
o
o
四氢砒喃 二氧六环
环醚的活性次序为:环氧乙烷>丁氧环>四氢呋喃 但三元环醚用阴离子、阳离子、配位聚合均可。
(CH2)5
H2O
+ O
C
NH
HO2C(CH2)5NH2
(2) 氨基酸本身逐步缩聚
COOH H 2 N CO NH H 2O
(3) 氨基上氮向己内酰胺亲核进攻,增长相同。
..
第八章 开环聚合

第八章开环聚合8.1 开环聚合概述1、开环聚合的特点2、环状单体的种类及其聚合能力8.2 阳离子开环聚合反应1、环醚2、环硅氧烷8.3 阴离子开环聚合反应1、环氧化物2、内酰胺8.4 开环易位聚合反应8.1.1 开环聚合的特征开环聚合既不同于连锁聚合,也不同于逐步聚合,其特征为:⒈聚合过程中只发生环的破裂,基团或者杂原子由分子内连接变为分子间连接,并没有新的化学键和新的基团产生。
⒉与连锁聚合相比较连锁聚合的推动力是化学键键型的改变,虽然大多数环状单体是按离子型聚合机理进行的,但开环聚合的推动力是单体的环张力,这一点与连锁聚合不同。
开环聚合所得的聚合物其结构单元的化学组成与单体的化学组成完全相同,这一点与连锁聚合相同。
⒊与逐步聚合反应相比较开环聚合虽然也是制备杂链聚合物的一种方法,但聚合过程中并无小分子缩出。
开环聚合的推动力是单体的环张力,聚合条件比较温和,而逐步聚合的推动力是官能团性质的改变,聚合条件比较苛刻。
所以,用缩聚难以合成的聚合物,用开环聚合较易合成。
开环聚合所得的聚合物中,其基团是单体分子中固有的;而逐步聚合所得到的聚合物中,其基团是在聚合反应中,单体分子间官能团的相互作用而形成的。
除此之外,开环聚合可自动地保持着官能团等物质的量,容易制得高相对分子质量的聚合物。
而缩聚反应只有在两种单体的官能团等物质的量时,才能制得高相对分子质量的聚合物。
开环聚合所得的聚合物的相对分子质量随时间的延长而增加,与逐步聚合反应相同。
8.1.2 环状单体的种类及其聚合能力环状单体的聚合能力与其结构有关。
环烷烃的聚合能力较低。
环烷烃中的碳原子被杂原子如O、S、N取代后,则这些杂环化合物的聚合能力变大。
它们在适当的引发剂作用下可形成高分子化合物。
(3)链转移反应向高分子的链转移反应是环醚阳离子开环聚合中常见的链转移反应。
链转移反应的结果:高分子链发生交换O(CH 2)4OA -+(CH 2)4O(CH 2)4(CH 2)4O(CH 2)4O(CH 2)4O(CH 2)4A -OO (CH 2)4O(CH 2)4O(CH 2)4+O(CH 2)4OA -由于高分子中所含醚基的亲核性更强,有利于向高分子的链转移,生成环状低聚物。
第七章开环聚合(ring-openingpolymerization)

高分子化学第七章
12
四、其它杂环单体
合成多肽阴离子开环聚合
单体:N-羧基-a-氨基酸酐(N-carboxy-a-amino-anhydride, NCA); 引发剂:胺类(伯胺、仲胺和叔胺)
CO HN O
CH CO R
-CO 2
R NHCHCO m
CO RNH2 + HN O
CH CO R
R COOH RNHCOCHNH
A CH2CH2O nCH2CH2O- M+ + ROH
A CH2CH2O nCH2CH2OH + RO- M+
环氧丙烷聚合的单体链转移反应:甲醇钠引发环氧丙烷聚合,
CM为0.013(70 °C)、0.027(93 °C)。
高分子化学第七章
3
2.2 (环氧化物的)阴离子聚合
CH3
O
CH2CHO- Na+ + CH3CH CH2 ktr,M
开环聚合应该 归类于
何种聚合方式 ???
O
O
R
CH3CH CH2 CH2 CH2 O
R
O
O
O
O
OO
O
高分子化学第七章
2
二、环醚(杂氧原为子什)么环醚中只有
环氧化物才能进行
2.1 环醚单体
阴离子聚合?
3, 4, 5元环醚(); 6元环如四氢吡喃、1,4-二氧六环();1,3,5-三
氧六环( )
聚合过程(活化单体链增长机理)
引发剂和单体反应生成活化单体; 活化单体与内酰胺反应形成N-酰基化内酰胺,进一步还原出活化单体; 活化单体不断与增长链末端的内酰胺单元反应; 聚合存在诱导期:以使N-酰基化内酰胺浓度达到足够大;
高分子化学讲义开环聚合-第七章

第六章 开环聚合开环聚合属于链式聚合,单体为环化合物,包括环醚、环缩醛、内酯、内酰胺、环硅氧烷等。
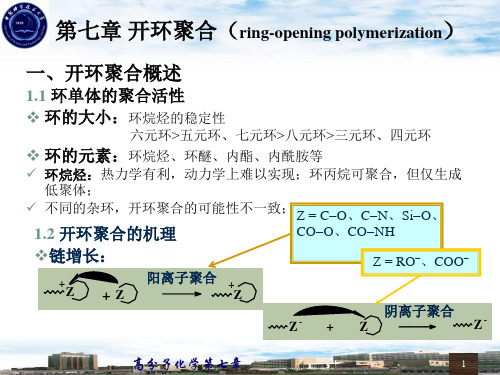
7.1 总论7.1.1 环单体的聚合活性环单体的聚合活性由热力学因素和动力学因素共同决定。
1. 热力学因素即环单体和相应的线形聚合物的相对稳定性,它与环大小、成环原子和环的取代基相关。
1) 环烷烃的稳定性:环烷烃进行开环聚合的热力学可行性顺序为:三元环、四元环>八元环>五元环,七元环>六元环。
2) 环的取代基:取代基的引入使聚合热增加、熵变增加,总体使开环聚合可能性降低。
3) 单环单体和多环单体:多环单体的环张力会有所增加,使开环聚合可能性增加。
如8-氧杂[4,3,0]环壬烷,反式的可开环聚合。
4) 成环原子:对于内酯而言,六元、七元环内酯可聚合,而五元环内酯则不可;环三硅氧烷的聚合活性高于环四硅氧烷。
2. 动力学因素环烷烃没有易受活性种攻击的键,因此动力学上仅环丙烷衍生物可进行开环聚合,并且仅能得到低聚物。
环醚、内酯、内酰胺等环单体,因有亲核或亲电子部位,易开环聚合。
7.1.2 开环聚合机理和特征 1. 聚合机理开环聚合的引发剂为烯烃聚合进行离子型聚合所用的引发剂,引发反应包括初级活性种的形成和单体活性种的形成。
大多数阳离子开环聚合的链增长是通过单体对增长链末端的环状阳离子的亲核反应来进行的,其中的Z 基团为C-O (环醚)、C-N (环氮化合物)、Si-O (环硅氧烷)、酯键和酰胺键;而阴离子聚合的链增长则是增长链末端的阴离子对单体的亲核反应,Z 基团为RO -(环醚)、COO -(内酯)和Si-O -(环硅氧烷)。
;一般情况下,开环聚合的增长链末端带电荷,进行链增长的单体是中性的。
但是,开环聚合还有另一种链增长方式,即所谓的活化单体机理,增长链末端不带电荷,而单体是离子化的,如己内酰胺的阴离子聚合。
2. 开环聚合的基本特征Z-++Z单体加到增长链上进行高分子链的生长;聚合度随转化率增加缓慢,但是在许多场合下呈线性关系;溶剂对聚合反应影响同烯烃的离子聚合;动力学表达式通常类似于链式聚合,特别是活性聚合;许多开环聚合的单体平衡浓度较高,即临界聚合温度较低。
2017年华南理工大学研究生入学考试专业课真题838_高分子化学

838华南理工大学2017 年攻读硕士学位研究生入学考试试卷(试卷上做答无效,请在答题纸上做答,试后本卷必须与答题纸一同交回)科目名称:高分子化学适用专业:高分子化学与物理;材料加工工程四. 问答题(40 分,每题 5 分)1. 简述高分子学科中曾获得诺贝尔奖的科学家及其主要贡献。
2. 写出用逐步聚合和开环聚合制备聚二甲基硅氧烷的反应方程式及反应条件。
3. 简述传统自由基聚合的聚合方法。
4. 举例说明立构规整性对聚合物性能的影响。
5. 简要描述聚合物化学反应的特征。
6. 画出自由基聚合、阴离子聚合和缩合聚合的典型分子量—转化率关系图,分别给予一定的解释。
7. 以BPO 为引发剂,试写出苯乙烯聚合的链引发、链增长和链终止基元反应的一般式。
8. 环氧乙烷阴离子开环聚合产物的分子量可达数万,而环氧丙烷阴离子开环聚合却只能得到三到四千,这是为什么?试以简单的反应方程式和文字描述加以说明。
五. 综合计算题(20 分,每题10 分)1. 用仲丁基锂引发200 mL 异戊二烯进行阴离子聚合,已知仲丁基锂溶液的初始浓度为 1.4 mol/L,目标聚合度(单体完全反应时)为1000,需加入仲丁基锂溶液的体积是多少?假设上午9 点加入引发剂开始反应,下午3 点经测试发现异戊二烯的转化率为50%,欲获得分子量为50 kg/mol 的聚合物,需要在何时中止反应?(已知异戊二烯的分子量为68 g/mol,密度为0.68 g/m L)。
2. 写出对苯二甲酸与乙二醇聚合时所有可能的聚合产物(包括重复单元和端基),并计算等摩尔的对苯二甲酸与乙二醇的反应体系,在下列反应程度时的平均聚合度和分子量:0.500;0.750;0.950;0.995。
第八章开环聚合

A CH2 CH2O B
CH2 CH2 O
A CH2 CH2O
CH2 CH2O B
CH2 CH2 O A CH2 CH2O nCH2 CH2O B
难终止。
人为终止:加入质子酸。
A EO n EO B H A EO n EOH B
动力学:
Rp d[M ]/ dt kp[C ][M ]
[ M ]0 [ M ] Xn [C ]0
单体消失速率为增长速率和转移速率之和,即 d[M] (kp ktr ,M )[M ][C ] dt
将上两式相除并积分,则有 CM [N]=[N]0 ([ M ]0 [ M ]) 1 CM 其中,[N]0是无链转移时聚合物的浓度。
有、无链转移时的平均聚合度分别为 [ M ]0 [ M ] Xn = [N ]
A A B B B A A B B A A B B A
B A
A B
影响环张力的因素
用环张力初步判断开环能力,进一步则用自由焓来量化。 影响环张力的三大因素: (1)环大小
(2)环上取代基
(3)构成环的元素
1.环大小的影响
环大小影响键的变形程度。键的变形程度愈大,环的张 力能和聚合热也愈大,聚合自由焓负的愈甚,环的稳定 性愈低,愈易开环聚合。 基本概念: 碳键的变形程度:环烷烃键角与正常键角 ( 10928' )之差的一半。 亚甲基的张力:环烷烃中亚甲基的燃烧热与直链烷烃 中亚甲基燃烧热(659.0kJ/mol)的差值。 环的张力能:每一亚甲基的张力与环中亚甲基数的乘 积。以内能的形式存在,开环聚合时张力消失,内能 以聚合热的形式释放出来。聚合热相当于张力能。
§8-1 环烷烃开环聚合热力学
从热力学因素考虑,环的张力越大,则环的稳定性越低, 容易开环聚合。 三、四元环易开环聚合 不能开环聚合的六元环(能否开环与环中杂原子有关) R
第6章 高分子化学— 开环聚合(全)

起始剂浓度
环氧化合物开环聚合过程中,由于起始剂的酸性、引发 环氧化合物开环聚合过程中,由于起始剂的酸性、 剂的活性不同,引发、增长、交换反应的相对速率不同; 剂的活性不同,引发、增长、交换反应的相对速率不同;使 聚合物的分子量、分子量分布各不相同,情况十分复杂。 聚合物的分子量、分子量分布各不相同,情况十分复杂。
14
(3)向单体链转移 )
环氧丙烷阴离子聚合,存在着向单体链转移, 环氧丙烷阴离子聚合,存在着向单体链转移,结果使聚合物分子 量降低。 量降低。
转移反应首先 夺取与环相连 的甲基上的H, 的甲基上的 , 生成单阴离子: 生成单阴离子:
单阴离子
单阴离子迅速 开环, 开环,生成烯 丙基醚阴离子: 丙基醚阴离子:
9
1——自由基聚合 2——阴离子聚合 3——逐步聚合
聚合物分子量和转化率之间的关系 是区别链式和逐步聚合的主要标志。 。
开环聚合反应的聚合上限温度较低,聚合过 程中常有 聚合-解聚 平衡,使过程复杂化。 以工业上几种重要的开环聚合为例进行说明
[ 环氧乙烷、环氧丙烷、三聚甲醛、3,3‘-二(氯亚甲基)环丁醚、已内酰胺 ] 环醚、内酰胺、 环醚、内酰胺、环缩醛
2
如:直链烷烃中CH2的燃烧热=659.0 kJ/mol。 环丙烷中CH2的燃烧热=697.6 kJ/mol。 则:环丙烷中每一个亚甲基的张力=697.6-659.0=38.6 kJ/mol。 所以,环丙烷的张力能=38.6×3=115.8 kJ/mol 。
4.3 开环聚合

(4)链终止反应
阳离子开环聚合的链终止反应主要为增长链氧鎓离子与抗衡 阴离子结合,如:
另一个环醚-环缩醛阳离子开环聚合产物带有末端半缩醛结构, 如三聚甲醛(三氧六环)的阳离子开环聚合:
H+ +
O
O O
O 三聚甲醛 HO + O H OCH2OCH2OCH2 O O O O O H2O H ( OCH2OCH2OCH2 )nO H(OCH2OCH2OCH2) OH n +1 终止 O O
O
所得聚合物分子链的末端半缩醛结构很不稳定,加热时易发生 解聚反应分解成甲醛,不具有实用价值。解决方法之一是把产 物和乙酐一起加热进行封端反应,使末端的羟基酯化,生成热 稳定性的酯基。工业上已用这种方法生产性能优良的工程塑料 聚甲醛。
4.1.2 环硅氧烷 最常见的环硅氧烷单体八甲基环四硅氧烷(D4):
C[M]0 Xn [I]0 [ROH]
环氧丙烷的阴离子开环聚合通常只能得到分子量较低的聚合物 (<6000),主要原因是聚合反应过程中向单体的链转移反应:
CH3 CH2 CH O- Na+ + CH3 O CH CH2 O CH3 + CH2 CH OH + H2C CH CH2 Na
H2C
早期使用的 ROMP 引发剂为双组分体系,由稀土金属(如
W、Mo、Rh、Ru等)的卤化物等和烷基化试剂(如R4Sn或 RAlCl2等烷基金属)组成,两组分原位生成金属-碳烯。
高分子化学8-开环聚合

中心,所以可用阳离子引发开环聚合。
• 烯类单体的阳离子聚合活性种为碳正离子,其
活性高,在低温下,反应速率很快,还伴随有
许多副反应。
• 阳离子开环聚合的活性种常为氧鎓离子、氮正、
硫正及硅正离子等,其稳定性远大于碳正离子, 使阳离子开环聚合具有许多特点。
1.3,3’-双(氯亚甲基)丁氧环和THF的阳离子聚合
(3) 终止和转移反应
① 转移反应
聚合链的氧原子亲核进攻增长链活性中心 -碳原子:
(CH2)4
+O
(CH2)4O
(CH2)4 O(CH2)4 O(CH2)4 O+ A (CH2)4
+
O (CH2)4
A O
O(CH2)4O(CH2)4O(CH2)4
例:甲醇钠引发环氧乙烷聚合反应:
聚合速率表达式:
Rp k
app p
[ M ][ M ] k
app p
[CH 3ONa][ M ]
1. 环氧乙烷(EO)和环氧丙烷(PO)的阴离子聚合 (1) 聚合反应
例:甲醇钠引发环氧乙烷聚合反应:
在反应时间 t 时,聚合物的聚合度可由已经反 应的单体浓度除以引发剂的起始浓度[I]0得到:
高分子化学
Polymer Chemistry
第八章 开 环 聚 合
8.1 离子开环聚合
一、概
述
开环聚合:环状单体在某种引发剂作用下 开环,形成线形聚合物的过程。 环状单体:环烷烃、环醚、环缩醛、环酰 胺、环硅氧烷等。
已工业化的开环聚合:环氧乙烷、环氧 丙烷、三聚甲醛(POM)、己内酰胺(PA6)、3,3’-二(氯甲基)环丁醚(PCE)、 八甲基环四硅氧烷(SI)等。
潘祖仁《高分子化学》笔记和课后习题(含考研真题)详解(开环聚合)【圣才出品】

第8章开环聚合8.1 复习笔记一、概述1.开环聚合环状单体σ-键断裂而后开环、形成线形聚合物的反应,称为开环聚合。
2.开环聚合单体的种类绝大多数的开环聚合单体都是杂环化合物,包括环醚、环缩醛、环酯、环酰胺(内酰胺)、环硅氧烷、环硫醚等。
许多半无机和无机高分子也由开环聚合来合成。
3.开环聚合的特点(1)链式聚合反应:包括链引发、链增长、链终止等基元反应;(2)可在高分子主链结构中引入多种功能基:酯、醚、酰胺等;(3)聚合反应前后的体积收缩比乙烯基单体聚合小。
4.环状单体开环聚合的热力学和动力学因素(1)热力学因素①环大小对环张力的影响键的变形程度愈大,环的张力能和聚合热也愈大,环的稳定性愈低,愈易开环聚合。
不同大小环烷烃的热力学稳定性次序大致如下3、4<<5、7~11<12以上、6环烷烃在热力学上容易开环的程度可简化为3、4>8>7、5。
②取代基对开环聚合能力的影响环上取代基的存在不利于开环聚合。
原因是环上侧基间距大,而线形大分子的侧基间距小,斥力或内能较大。
(2)动力学因素环烷烃的键极性小,不易受引发活性种进攻而开环。
杂环化合物环中的杂原子容易被亲核或亲电活性种进攻,只要热力学上有利于开环,动力学上就比环烷烃更易开环聚合。
5.聚合机理多数开环聚合属于连锁离子聚合机理,但阴离子活性种往往是氧阴离子、硫阴离子、胺阴离子,阳离子活性种是三级氧鎓离子或锍离子。
二、阴离子开环聚合1.三元环醚(1)三元环醚易开环的原因三元环醚张力大,热力学上很有开环倾向。
加上C-O键是极性键,富电子的氧原子易受阳离子进攻,缺电子的碳原子易受阴离子进攻,因此,酸(阳离子)、碱(阴离子)甚至中性(水)条件均可使C-O键断裂开环。
在动力学上,三元环醚也极易聚合。
(2)引发剂环氧烷烃开环聚合常用的阴离子引发剂有碱金属的烷氧化物(如醇钠)、氢氧化物、氨基化物、有机金属化合物、碱土金属氧化物等。
(3)开环聚合分子量差异性原因环氧乙烷阴离子开环聚合产物的分子量可达(3~4)×106,而环氧丙烷开环聚合物的分子量仅3000~4000,原因是环氧丙烷分子中甲基上的氢原子容易被夺取而转移,转移后形成的单体活性种很快转变成烯丙醇钠离子对,可继续引发聚合,但使分子量降低。
第四章 (更新)开环聚合

活性开环聚合是正在发展的一个研究领域, 活性开环聚合是正在发展的一个研究领域, 和烯类活性聚合一样具有重要的意义。 和烯类活性聚合一样具有重要的意义。
1
1、阳离子开环聚合反应
(环醚的开环聚合 环醚的开环聚合) 环醚的开环聚合
环醚主要是指环氧乙烷、环氧丙烷、 环醚主要是指环氧乙烷、环氧丙烷、四氢呋 环氧乙烷 喃等。它们的聚合物都是制备聚氨酯的重要 原料。 原料。 环氧乙烷和环氧丙烷都是三元环, 环氧乙烷和环氧丙烷都是三元环,可进行阴 三元环 离子聚合和阳离子聚合。四苯基卟啉/烷基 离子聚合和阳离子聚合。四苯基卟啉 烷基 氯化铝可引发他们进行阴离子活性开环聚合。 氯化铝可引发他们进行阴离子活性开环聚合。
(CH2)4 OC (CH2)4
Na
HO S
OC OC O
S
OH
Na
O CO (CH2)4 CO (CH2)4 O S S OH OH
(13-32b)
OC O
12
与ATRP结合,制备嵌段共聚物
13
用 碳阳离子引发环醚或环缩醛进行阳离子开环聚合,可以制备分子量 分布窄、分子量可控的聚醚,再与ATRP结合,得到星形嵌段共聚物。
14
15
16
2、自由基开ห้องสมุดไป่ตู้聚合反应
17
b处打开
a处打开
18
活性自由基 开环聚合
C2H5CHBr
COOC2H5
CuBr
C2H5CH
COOC2H5
CuBr2
(13-40a)
O Ph
O
Ph C2H5 CH2CH2
C2H5CH
COOC2H5
H2C O
O COOC2H5
阳离子聚合物的聚合度

离子聚合的特点 单体选择性高; 聚合条件苛刻; 聚合速率快,需在低温下进行; 引发体系为非均相; 反应介质对聚合有很大影响。
一些重要的聚合物,如丁基橡胶、异戊橡胶、 聚甲醛、聚氯醚等只能通过离子聚合得到。
一. 阳离子聚合的单体
原则上:取代基为供电基团(如烷基、苯基、乙烯基 等)的烯类单体原则上有利于阳离子聚合
阴离子聚合应用比阳离子多,应用广泛。由于具有活性无 終止的特点,可以制备嵌段共聚物。
一. 阴离子聚合的单体
对的比例都有增加,结果使聚合速率与聚合度增大。
溶剂选择原则: 在阳离子聚合中选低极性的卤代烃为溶剂 (氯甲烷、二氯乙烷、三氯甲烷、四氯化碳)。
芳烃与碳阳离子亲电取代 含氧化合物与阳离子反应终止(THF、醚、酮等) 烷烃非极性,离子对紧密,聚合速率低
因此,上述三种溶剂都不可以作为阳离子聚合溶剂
2. 反离子的影响
链转移的结果,动力学链不终止。
向单体转移终止
ktr,m
HMnM (CR) + M
Mn+1 + HM (CR)
增长活性中心向单体转移,生成含有不饱和端基的聚合 物,同时生成离子对再增长
阳离子聚合的CM(10-2)>>自由基聚合的CM (10-4)
向反离子转移终止-自发終止
kt HMnM (CR)
中心阳离子与反离子形成离子对。其紧密程度与溶剂、反离 子性质、温度等有关,并影响聚合速率与分子量;
增长过程中伴有分子内重排反应。
3. 链转移和链终止
增长活性中心带有相同电荷,不能双分子终止,往往通过链转 移或单基终止。
1)动力学链未终止
增长的碳阳离子活性中心易与亲核物质(如单体、溶剂、杂质 及反离子等)发生电荷转移反应,即链转移反应。
第七章 开环聚合

第七章开环聚合一、课程主要内容开环聚合概述;开环聚合的特征;环状单体的种类及其聚合能力;环醚的开环聚合。
对第七章内容作一般了解。
二、习题与答案本章试题有基本概念题、填空题和简答题。
㈠基本概念题⒈开环聚合:开环聚合是指具有环状结构的单体经引发聚合后将环打开形成高分子化合物的一类聚合反应。
⒉环醚:环中含有醚键-O-的环状化合物称为环醚。
⒊环氧化合物:三节环醚又称为环氧化合物或氧化烯,如环氧乙烷又称为氧化乙烯,环氧丙烷又称为氧化丙烯。
⒋环缩醛:在环中含有-CH2O-基团的环状化合物。
⒌内酯:环中含有酯基-COO-的环状化合物,称为内酯或环酯。
⒍内酰胺:环中含有酰胺基-CONH-的环状化合物,称为内酰胺或环酰胺。
㈡填空题⒈环状类单体主要有环醚类、环酰胺类、环酯类和环烯烃等几类。
⒉环醚单体主要有环氧乙烷、环氧丙烷、氧杂环丁烷、3,3’-二氯甲基氧杂环丁烷、和四氢呋喃等。
⒊环氧化合物有环氧乙烷、环氧丙烷和环氧氯丙烷等。
⒋环缩醛有三聚甲醛和四聚甲醛。
⒌含硅的环状化合物有1,1’,3,3’,-四甲基-1.3-二硅环丁烷和2,2’,4,4’,6,6’,8,8’-八甲基-2,4,6,8-四硅氧杂环辛烷(D4) 。
㈢简答题⒈写出开环聚合反应简式、聚合机理,并写出环氧丙烷开环聚合的聚合反应简式?答案:开环聚合反应简式可表示如下[ R Z ]nn RZ在环状单体中,R为烷基,Z为杂原子:O,S,N,P,Si或-CONH-,-COO-,-CH=CH-基团等。
绝大多数环状单体的开环聚合是按离子型聚合机理进行的,有少数环状单体的开环聚合是按水解聚合机理进行的。
环氧丙烷进行开环聚合的聚合反应简式为141142CH 3CH 2 CH O n CH 2CH CH 3[]nO⒉ 简述环状单体的种类及其聚合能力答案:环状单体的聚合能力与其结构有关。
环烷烃的聚合能力较低,环烷烃中的碳原子被杂原子如O 、S 、N 取代后,则这些杂环化合物的聚合能力变大,它们在适当的引发剂作用下可形成高分子化合物。
第八章-开环聚合

8.4 环醚的阳离子开环聚合
1)丁氧环(四元环醚)
在0º C或较低温度下,丁氧环经Lewis酸引发,易开环聚 合成聚氧化三亚甲基。但有应用价值的单体却是 3,3’-二氯亚 甲基丁氧环(丁氧环的衍生物,聚合产物俗称氯化聚醚), 机械强度比氟树脂好,可用作工程塑料。
2)四氢呋喃(Tetrahydrofuran)的阳离子开环聚合 四氢呋喃为五元环,环张力较小,对引发剂选择和单体 精制要求高。PF5为催化剂,分子量在30万左右。
两式相除:
[N]:聚合物链的浓度
k tr,M CM d[N] = = d[M] k p + k tr,M 1+ CM
CM:向单体转移常数
上式积分,得:
CM [N] = [N]0 + ([M]0 -[M]) 1+ CM
[N]0:无向单体转移时的聚合物链浓度
CM d[N] = d[M] 1+ CM
有、无向单体链转移时的平均聚合度分别为:
以 OP-10 [C8H17C6H4O(EO)10H] 为例,辛基酚起始剂提 供端基分子量为 189,10单元的环氧乙烷分子量 440,属于低 聚物,端基不能忽略。
Example
RX(EO)nH
改变疏水基 R、连接元素X、环氧烷烃种类及聚合度 n, 可衍生出上万种聚醚产品。起始剂有脂肪醇、烷基酚、脂肪 酸、胺类等,可形成多种聚醚型表面活性剂。 起始剂RXH
剂亲核或亲电进攻的位置,通常比环烷烃聚聚合。
聚合能力与环中杂原子性质有关。 如五元环中的四氢呋喃能够聚合,而 γ-丁氧内酯却不能 聚合。六元环醚不能聚合,如 1,4- 二氧六环,但相应的环酯 却都能聚合,如环戊内酯。
2)引发剂和动力学因素
杂环开环聚合的引发剂有离子型和分子型两类。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
链碳阳离子与抗衡阴离子间的相互作用:链碳阳离子与抗 衡阴离子的相互作用越弱,两者越易离解,链增长活性越高。
溶剂极性或溶剂化能力:极性大或溶剂化能力强的溶剂有利 于链增长活性中心与抗衡阴离子的离解,有利于聚合反应速率 的增大,如果溶剂极性太弱以致不能使两者离解而形成不具有 链增长活性的共价化合物,则聚合反应不能顺利进行。
6.1 阳 离 子 聚 合 反 应
(3)链增长碳阳离子与与亲核性杂质的链终止
在聚合体系中,若存在亲核性杂质,如水、醇、酸、酐、 酯、醚等,它们虽然可以作为质子或碳阳离子源在Lewis酸 活化下引发阳离子聚合。但它们的含量过高时,则可导致转 移性链终止反应,以水为例:
(2)向反离子链转移 增长链碳阳离子上的β-质子也可向反离子转移,这种转移
方式又称自发终止:
(3)向高分子的链转移反应: 如在苯乙烯以及衍生物的阳离子聚合中,可通过分子内亲
电芳香取代机理发生链转移:
6.1 阳 离 子 聚 合 反 应
(4)向引发剂的链转移,如:
该反应中
既是引发剂又是链转移剂,通常叫做
此外,凡是容易与碳阳离子反应使之失去活性的溶剂都不 宜选做阳离子聚合溶剂。
因此,适合于用做阳离子聚合的溶剂并不多,常用的有 芳香烃(如甲苯、苯、硝基苯)、卤代烃(如CH2Cl2)等。
6.1 阳 离 子 聚 合 反 应
(2)链增长过程中单体单元链接方式: 与自由基聚合相似,通常乙烯基单体阳离子聚合一般得到能使链增
聚合反应。如:
6.1 阳 离 子 聚 合 反 应
两种Lewis酸复合时,酸性较强的起受体作用,从 酸性较弱的一方夺取负离子而产生离子化,如:
(3)碳阳离子引发剂:碳阳离子源/Lewis酸复合引发体系 碳阳离子源是指一些在Lewis酸的活化下能产生碳
阳离子的化合物:三级(或苄基)卤代烃、醚、醇、酯等, 在Lewis酸的活化下产生碳阳离子引发聚合反应,如:
6.1 阳 离 子 聚 合 反 应
在这类引发体系中,通常把碳阳离子源称为引发剂(initiator), 而把Lewis酸称为活化剂(activator)。
6.1 阳 离 子 聚 合 反 应
6.1.3 链增长反应
(1)链增长活性中心与抗衡阴离子的离解平衡:
离解程度增加 反应活性增加
6.1 阳 离 子 聚 合 反 应
易发生在抗衡阴离子亲核性较强或溶剂极性不利于抗衡 阴离子与链增长碳阳离子离解的聚合体系中。
6.1 阳 离 子 聚 合 反 应
(2)链增长碳阳离子与抗衡阴离子团中某阴离子结合生成 稳定的共价键
如H2O/BCl3引发的异丁烯聚合
抗衡阴离子团中B-OH键比B-Cl键强,更易脱去Cl-与增长链碳 阳离子结合生成较稳定的C-Cl键,而新形成的Lewis酸BCl2OH 不足以活化C-Cl键产生碳阳离子,从而导致反应终止。
共轭烯烃,如:
(π+n)给电子取代乙烯,如:
该类单体由于N和O原子上的未成对电子能与双键形成pπ共轭,使双键电子云密度增大,因而特别活泼。
6.1 阳 离 子 聚 合 反 应
(2)异核不饱和单体R2C=Z,Z为杂原子或杂原子基团; 如醛RHC=O,酮RR’C=O(丙酮除外,因其最高聚合温
度为-273 oC),硫酮RR’C=S等。 (3)杂环化合物:阳离子开环聚合
6.1 阳 离 子 聚 合 反 应
一般质子酸(如H2SO4,HCl等)由于生成的抗衡阴离子 SO42-、Cl-等的亲核性较强,易与碳阳离子生成稳定的共价键, 使增长链失去活性,因而通常难以获得高分子量产物;
超强酸由于酸性极强,离解常数大,活性高,引发速率快, 且生成的抗衡阴离子亲核性弱,难以与增长链活性中心成共价 键而使反应终止。
种形式: (1)向单体链转移:增长链碳阳离子以H+形式脱去β-氢给 单体,这是阳离子聚合中最主要普遍存在的也是难以抑制的 内在副反应(built-in side-reaction):
链转移与链增长是一对竞争反应,降低温度、提高反应介质 的极性,有利于链增长反应,从而可提高产物分子量 。
6.1 阳 离Leabharlann 子 聚 合 反 应(2)Lewis酸:主要为金属卤化物、有机金属化合物以及它们 的复合物。
其引发反应可分两种情况: (i)不能“自离子化”的单独Lewis酸
与体系中微量的水发生水解生成H+引发聚合反应,如:
6.1 阳 离 子 聚 合 反 应
(ii)能“自离子化”的Lewis酸或不同Lewis酸的复合物 通过自离子化或不同Lewis酸相互离子化产生阳离子引发
链转移引发剂(inifer),如果聚合反应中不存在向单体等其它 的链转移反应,就可获得末端含-Cl的聚合产物。
6.1 阳 离 子 聚 合 反 应
6.1.4 链终止反应 阳离子聚合中除链转移反应会导致增长链失活外,还可发
生以下的终止反应: (1)链增长碳阳离子与抗衡阴离子结合:
如Cl3CCOOH/TiCl4引发的异丁烯聚合
长碳阳离子稳定化的首-尾加成结构,即阳离子活性中心与双键加成时总 是进攻不带取代基的C,生成的碳阳离子可被取代基共振稳定化:
(3)阳离子聚合反应过程中的异构化反应: 碳阳离子可进行重排形成更稳定的碳阳离子,在阳离子聚合中也存在
这种重排反应,如:
6.1 阳 离 子 聚 合 反 应
6.1.4 链转移反应 链转移反应是阳离子聚合中常见的副反应,可有以下几
高分子科学基础
第六章 离子聚合与配位聚合反应
6.1 阳 离 子 聚 合 反 应
6.1.1 单体
具有阳离子聚合活性的单体主要包括以下几类: (1)带给电子取代基的烯烃: 取代基的给电子能力越强, 双键上电子云密度越高,单体聚合活性越高。 偏二烷基取代乙烯,如:
6.1 阳 离 子 聚 合 反 应
包括环醚、环亚胺、环缩醛、环硫醚、内酯和内酰 胺等。如:
引发阳离子与单体加成时总是进攻其中亲核性最强的基团。
6.1 阳 离 子 聚 合 反 应
6.1.2 引发剂
阳离子聚合引发剂都是亲电试剂,主要包括以下几类: (1)质子酸,包括
无机酸:H2SO4, H3PO4等 有机酸:CF3CO2H, CCl3CO2H等 超强酸: HClO4 , CF3SO3H, ClSO3H等 其引发阳离子为离解生成的H+,而离解生成的酸根离子则作 为碳阳离子活性中心的抗衡阴离子(反离子),如:
