EDTA标准溶液的配制和标定(氧化锌标液)
乙二胺四乙酸二钠标准溶液的配制与标定

乙二胺四乙酸二钠(E D T A)标准溶液的配制与标定(总1页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--乙二胺四乙酸二钠(EDTA)标准溶液的配制与标定1 试剂乙二胺四乙酸二钠(EDTA)氧化锌(基准试剂)。
盐酸溶液(1+1)。
10%氨水。
氨-氯化铵缓冲溶液:配制方法见“SS-14-1-84”。
%铬黑T指示剂(乙醇溶液):配制方法见“SS-14-1-84”。
2 操作步骤、 EDTA标准溶液的配制与标定:EDTA标准溶液的配制:1) EDTA溶液:称取20g乙二胺四乙酸二钠溶于1 L蒸馏水中,摇匀。
2)标准溶液:称取8g乙二胺四乙酸二钠溶于1 L高纯水中,摇匀。
EDTA标准溶液的标定:1)标准溶液的标定:称取于800℃灼烧至恒重的基准氧化锌1g(称准至),用少许蒸馏水湿润,加盐酸溶液(1+1)至样品溶解,移入250ml容量瓶中,稀释至刻度,摇匀。
取上述溶液,加80ml水,用10%氨水中和至PH 为7~8,加5ml氨-氯化铵缓冲溶液(PH=10),加5滴%铬黑T指示剂,用 EDTA溶液滴定至溶液由紫色变为纯兰色。
2) EDTA标准溶液的标定:称取(称准至)于800℃灼烧至恒重的基准氧化锌用少许蒸馏水湿润,加盐酸溶液(1+1)至样品溶解,移入250ml容量瓶中,稀释至刻度,摇匀。
取上述溶液,加80ml水,用10%氨水中和至PH为7~8,加5ml氨-氯化铵缓冲溶液(PH=10),加5滴%铬黑T指示剂,用 EDTA溶液滴定至溶液由紫色变为纯兰色。
EDTA标准溶液的摩尔浓度(M)按下式计算:G 20⊿V = —————×———— = —————V× 250 V×式中 G——氧化锌之重,g;V——滴定时消耗EDTA溶液的体积,ml;——250ml中取20ml滴定,相当于G的倍;——每毫摩尔氧化锌(ZnO)的重量,g。
EDTA 标准溶液饿配制和标定:配制:取 EDTA 标准溶液,准确地稀释至50倍制得。
EDTA标定

EDTA溶液标定
1、标准锌溶液配制
基准氧化锌于高温马弗炉中800度恒温3h,于干燥器中冷却,称取0.2000g氧化锌于200ml烧杯中,加入少量纯水润湿,再加3ml(1+1)盐酸,待氧化锌彻底溶解,将其定容于200ml容量瓶中。
2、0.01mol/LEDTA溶液配制
0.01 mol/mL EDTA标准溶液:称取基准EDTA 3.7224 g于50 ml烧杯中,加
适量水加热溶解,冷却后移入1000 mL容量瓶中,定容,摇匀,此标准溶液浓度为0.01 mol/L
3、移取25ml锌标准溶液于250ml锥形瓶中,加入50ml纯水,加入1滴二甲酚橙指示剂,用氨水(1+10)和盐酸9(1+1)调节至溶液刚好变黄,加入10ml 六次甲基四氨溶液,再加入2滴二甲酚橙,用EDTA溶液滴定至溶液由变黄为终点。
平行滴定3次,所耗的EDTA溶液体积的极差不应超过0.10ml,取计算结果的平均值。
试验九EDTA标准溶液的配制与标定试验目的掌握EDTA标准

实验九EDTA标准溶液的配制与标定一、实验目的1.掌握EDTA标准溶液的配制和标定方法;2.了解金属指示剂的变化原理及注意事项,学会使用铬黑T指示剂判断终点;3.了解配合滴定的特点。
二、实验原理EDTA标准溶液常用乙二胺四乙酸的二钠盐(EDTA-2N a·2H2O)配制。
乙二胺四乙酸二钠是白色结晶粉末,因不易制得纯品,标准溶液用间接法配制。
以氧化锌基准物质标定其浓度,在pH=10的条件下,用铬黑T指示剂,溶液由紫色变为纯蓝色为终点。
滴定前Zn2++HIn2-→ZnIn-+H+纯蓝色紫红色滴定中Zn2++H2Y2-→ZnY2-+2H+终点时ZnIn-+H2Y2-→ZnY2-+HIn2-+H+紫红色纯蓝色三、实验仪器及试剂1.仪器分析天平、水浴锅、称量瓶、烧杯、量筒、锥形瓶、试剂瓶、酸式滴定管。
2.试剂乙二胺四乙酸二钠盐(AR)、氯化铵、氨水3.试液铬黑T指示剂:取铬黑0.1g与研细的干燥NaCl 10g混匀,将固体混合物保存于干燥器中,用时挑取少许即可。
ZnO基准试剂:800℃灼烧至恒重。
氨-氯化胺缓冲溶液(pH=10):取5.4g NH4Cl溶于少量水中,加入35mL浓氨水,用水稀释至100mL。
氨试液:取浓氨水4mL加水稀释至100mL。
四、实验内容与步骤1.0.05mol/LEDTA溶液的配制取EDTA-2N a·2H2O 9.5g,加100mL蒸馏水温热溶解,稀释至500mL,摇匀,贮存于硬质玻璃瓶中。
2.EDTA 溶液的标定称取已在800℃灼烧至恒重的基准ZnO 约0.12g ,精密称定,加稀HCl (1︰1)3mL 溶解,加蒸馏水25mL ,甲基红指示剂(0.2%的乙醇溶液)1滴,滴加氨试液使溶液呈微黄色,再加蒸馏水25mL ,NH 3·H 2O -NH 4Cl 缓冲液10mL 和铬黑T 指示剂少取。
用EDTA 标准溶液滴定至溶液由紫红色变为蓝色为终点。
五、数据处理C EDTA =1000m ZnO ⨯⋅ZnOEDTA M V (ZnO M =81.38 g/mol ) m ZnO :ZnO 的质量(g )。
EDTA标准溶液的配制和标定(氧化锌标液)

EDTA标准溶液的配制和标定(氧化锌标液)
EDTA(乙二胺四乙酸盐)标准溶液的配制及标定主要是为了用于表面活性剂的检测,以及氧化锌、铁、铜、钙、镁量的测定等。
以下是EDTA标准溶液的配制及标定方法:
1、EDTA标准溶液配制:
(1)按照估算量放入500ml容量的滴定瓶中,加入DI水调解成悬浮液;
(2)抓取试剂加入滴定瓶中,煮沸20分钟,放置24小时过夜后,均匀搅拌,再加入DI水调解成50000ppm的标准EDTA溶液;
(1)测定氧化锌标准溶液。
按称取容量精密称取200 ml氧化锌标液,加入EDTA溶液,再经过25分钟搅拌,产生标定溶液;
(2)测定质量浓度。
用原子吸收仪测定标定溶液中铋残留量,通过计算计算得到EDTA溶液质量浓度;
(3)校正配方。
根据量测得出的质量浓度大小,调节EDTA标准溶液的配比,使其达到试剂要求的质量浓度,即完成EDTA标液的标定。
EDTA标准溶液的配制和标定是一项比较复杂的实验过程,实验过程中既需要按照规定的试剂质量浓度和配比完成配制,也需要在标定过程中准确精确的测定和计算,才能得出准确可靠的EDTA标准溶液。
EDTA标准溶液的配制与标定

溶解后,定量转移 至250 mL容量瓶中 不再产生 微小气泡
稀释至刻度,摇பைடு நூலகம் 反应激烈,防 止试样溅出
3.
0.02 mol · L-1 EDTA溶液的标定
滴加1:1氨水
准确吸取25.00 mLZn2+标液 加水20 mL 于250 mL锥型瓶中 摇匀
至恰好产生白色沉淀*
加入氨水—氯化铵 缓冲液10 mL 终点
沉淀溶解 (pH = 10)
EBT少许* EDTA滴定*
至纯蓝色
滴定一份加一份指示 剂,加入量必须适当, 若色太浅,近终点时 可补加。
滴定至红光 消失,呈纯 蓝色。
Zn(OH)2
[Zn(NH3)4]2+
四、数据记录与处理:
Ⅰ
WZn / g EDTA体积(终) EDTA体积(初) EDTA体积/mL 计算式 CEDTA(mol/L) CEDTA平均值 相对平均偏差(%) (要求≤ 0.2% ) CEDTA = WZn × 100 MZn × VEDTA ( MZn = 65.39)
3
三、实验方法:
1. 0.02 mol · L-1 EDTA溶液的配制
300 ~ 400 mL H2O
3.7 g EDTA
△
溶解,冷却
转移至溶液瓶中
稀释至1 L,摇匀
2. 0.01mol · L-1锌标准溶液的配制
准确称取氧化锌 (0.4xxxg)
于150 mL 小烧杯中 沿杯嘴加入 盖上表面皿 浓盐酸 HCl 3 mL
EDTA标准溶液的配制与标定
一、实验目的和要求:
1. 掌握用锌作基准物标定EDTA溶液的原
理及方法。 2. 正确判断配位滴定的终点。 3. 三次测定相对平均偏差 ≤ 0.2%。 4. 掌握电子天平称量,定量转移,容量
以氧化锌为基准物标定edta实验原理

以氧化锌为基准物标定edta实验原理1.引言1.1 概述概述在分析化学中,常常需要对化合物进行定量分析,而准确确定物质的含量是非常重要的。
然而,由于化学物质的特性和复杂性,直接测量其含量是非常困难的。
因此,我们需要利用标定方法来确定化合物的含量。
本文将以氧化锌为基准物,使用EDTA(乙二胺四乙酸)作为标定剂,通过实验来探究EDTA的标定原理。
首先,我们将介绍氧化锌的性质和应用,以及EDTA的性质和应用。
随后,我们将总结实验的原理,并对实验结果进行分析。
通过了解氧化锌和EDTA的性质及应用,我们能够更好地理解实验的背景和目的。
在实验中,我们将使用氧化锌作为基准物,通过加入已知浓度的EDTA溶液和指示剂,反应生成蓝色络合物,并通过比色法测定其吸光度,从而计算出EDTA的浓度。
这样一来,我们就可以通过EDTA标定其他化合物的含量。
本实验的目的是通过实践掌握EDTA标定的原理和方法,提高我们的分析能力和实验操作技巧。
同时,我们也可以通过实验结果的分析,了解EDTA标定的误差来源,并探讨如何提高实验的准确性和可靠性。
通过这篇长文的阅读,读者将对以氧化锌为基准物标定EDTA的实验原理有一个全面的了解,并能够更好地理解和应用这一标定方法。
希望本文对读者在分析化学领域的学习和研究有所帮助。
文章结构部分的内容可以如下编写:1.2 文章结构本文分为引言、正文和结论三个部分,具体组织如下:引言部分包括概述、文章结构和目的。
在概述中将简要介绍实验的背景和意义,引发读者对该实验的兴趣。
文章结构部分将介绍本文的整体组织,明确每个部分所涵盖的内容。
目的部分将明确本实验的目标和意义。
正文部分包括2.1小节和2.2小节。
在2.1小节中将重点介绍氧化锌的性质和应用,包括其化学性质、物理性质以及在工业和生活中的应用领域。
在2.2小节中将详细介绍EDTA的性质和应用,包括其化学结构、络合反应特性以及在分析化学中的重要作用。
结论部分包括3.1小节和3.2小节。
实验十一0.02M EDTA标准溶液的配制与标定

实验十一乙二胺四乙酸二钠(E D T A)标准溶液的配制与标定[C EDTA=0.02mol/L]一、配制:称取乙二胺四乙酸二钠8g,加1000毫升水,加热溶解,冷却,摇匀,备用。
二、标定:(一)以基准氧化锌(ZnO)标定(指示剂:0.5%铬黑T指示剂)标定流程:准称于800±500C度高温炉中灼烧至恒重的工作基准试剂氧化锌(0.3~0.4g)于100mL烧杯中↓←少量水湿润,盖上表面皿滴加盐酸溶液(20%)使之刚好完全溶解↓转移入250毫升容量瓶中,加水至刻度,混匀↓准确移取25.00毫升(含Zn2+溶液)于锥形瓶↓←加甲基红指示剂一滴滴加氨水(10%)至微黄色(此时PH=7~8)↓←加蒸溜水25mL加10毫升氨~氯化铵缓冲溶液(PH≈10)↓←加5滴铬黑T指示液(0.5%)用EDTA溶液滴定至溶液由紫红色变为纯蓝色,即为终点。
记录EDTA溶液消耗的体积↓同时做空白实验计算:C EDTA=[m X(V1/250)X1000]/[(V2-V0)X M ZnO]式中:m--------氧化锌的质量,gV1---------含Zn2+标准溶液所取的体积V2----------------滴定时,EDTA标准溶液所消耗的体积,mLV0-----------------空白滴定时,EDTA标准溶液所消耗的体积,mL M------------------氧化锌的摩尔质量,g/mol,即M ZnO=81.39g/mol(二)以基准碳酸钙(CaCO3)标定(指示剂:钙指示剂)标定流程:准称工作基准试剂碳酸钙(0.35~0.4g)于100mL烧杯中↓←少量水湿润,盖上表面皿滴加盐酸溶液(20%)使之刚好完全溶解(可加热助溶)↓冷却转移入250毫升容量瓶中,加水至刻度,混匀↓准确移取25.00毫升(含Ca2+溶液)于锥形瓶↓←加甲基红指示剂一滴滴加氨水(10%)至微黄色加20毫升氨~氯化铵缓冲溶液(PH=10)↓←加一米粒大的钙指示剂用EDTA溶液滴定至溶液由紫红色变为纯蓝色,即为终点。
EDTA标准溶液的配制和标定

一、目的:1、学习EDTA标准溶液的配制和标定方法。
2、学习配位滴定法的原理,了解该滴定法的特点。
二、原理:标定EDTA的基准物质有Zn、CaCO3、Bi、Cu、MgSO4·7H2O等。
(MEDTA=mol)指示剂:EBT 1%(称取1克EBT加入三乙醇胺75ml、无水乙醇25ml)。
在PH=的缓冲溶液中:Zn2++In3- ZnIn-(酒红色)ZnIn-+HY3-←→ ZnY2-+HIn2-(蓝色)三、用ZnO作为基准物质时所需试剂:EDTA ZnO(烘干) NH3—NH4Cl缓冲液(PH=) 1+1氨水EBT 1% 6mol·L-1的HCl (MZnO=)四、实验步骤:1、配制·L-1EDTA500mL在台称上称取EDTA二钠盐—溶入150—200mL温水中,稀释至500mL,装入试剂瓶中、待标定。
2、配制ZnO标准溶液250mL在分析天平上准确称取ZnO —于小烧杯中。
滴加6mol·L-1的HCl至全部溶解(约5~10mL),转移至250mL的容量瓶中。
3、准确取三份各+25mL蒸馏水入三角锥瓶中。
慢慢滴加NH3水,至刚好出现白色浑浊,加入10mL缓冲液,滴加3—4滴铬黑T。
4、·L-1EDTA滴定,由酒红色→蓝色为终点。
五、数据及计算:公式:CEDTA =(mZnO/MZnO×25/250)/ (VEDTA/1000)1 2 3 ZnO的质量(g)ZnO基准溶液用量(mL)EDTA终读数(mL)EDTA初读数(mL)VEDTA(mL)CEDTA(mol·L-1)CEDTA平均值(mol·L-1)绝对偏差相对平均偏差(%)二、思考题:1、配位滴定中为什么需要采用缓冲溶液?2、为什么在ZnO中加入HCl?3、通过计算说明为什么称取— ZnO?怎么标定L的EDTA标准溶液基准物是氧化锌指示剂是铬黑T固体?准确称取已于900℃温度下灼烧至恒重的基准氧化锌,溶于盛有10mL 1+1盐酸中,溶解较慢时可适当加热使其溶解,冷却后转移至250mL容量瓶中并稀释至刻度,摇匀。
EDTA标准溶液的配制和标定

EDTA标准溶液的配制和标定一、目的要求1.了解EDTA标准溶液标定的原理。
2.掌握配制和标定EDTAB标准溶液的方法。
二、原理乙二胺四乙酸二钠盐(习惯上称EDTA)是一种有机络合剂,能与大多数金属离子形成稳定的1∶1螯合物,常用作配位滴定的标准溶液。
EDTA在水中的溶解度为120g/L,可以配成浓度为0.3mol/L以下的溶液。
EDTA标准溶液一般不用直接法配制,而是先配制成大致浓度的溶液,然后标定。
用于标定EDTA标准溶液的基准试剂较多,例如Zn、ZnO、CaCO3、Bi、Cu、MgSO4·7H2O、Ni、Pb等。
用氧化锌作基准物质标定EDTA溶液浓度时,以铬黑T作指示剂,用pH=10的氨缓冲溶液控制滴定时的酸度,滴定到溶液由紫色转变为纯蓝色,即为终点。
三、试剂1.乙二胺四乙酸二钠盐(EDTA)。
2.氨水-氯化铵缓冲液(pH=10):称取5.4g氯化铵,加适量水溶解后,加入35mL氨水,再加水稀释至100mL。
3.铬黑T指示剂:称取0.1g铬黑T,加入10g氯化钠,研磨混合。
4.40%氨水溶液:量取40mL氨水,加水稀释至100mL。
5.氧化锌、碳酸钙(基准试剂)。
6.盐酸四、操作步骤(一)以氧化锌作基准物质进行标定1.0.01mol·L-1EDTA溶液的配制称取乙二胺四乙酸二钠盐(Na2H2Y·2H2O)4g,加入1000mL水,加热使之溶解,冷却后摇匀,如混浊应过滤后使用。
置于玻璃瓶中,避免与橡皮塞、橡皮管接触。
贴上标签。
2.锌标准溶液的配制准确称取约0.16g于800℃灼烧至恒量的基准ZnO,置于小烧杯中,加入0.4mL盐酸,溶解后移入200mL容量瓶,加水稀释至刻度,混匀。
3.EDTA溶液浓度的标定吸取30.00--35.00mL锌标准溶液于250mL锥形瓶中,加入70mL水,用40%氨水中和至pH为7~8,再加10mL氨水-氯化铵缓冲液(pH=10),加入少许铬黑T指示剂,用配好的EDTA溶液滴定至溶液自紫色转变为纯蓝色。
EDTA溶液的配制与标定

8-1 EDTA 溶液的配制与标定实验8-1 EDTA 溶液的配制与标定一、仪器与试剂酸式滴定管、锥形瓶、烧杯、移液管、分析天平20%盐酸、10%氨水、氨—氯化铵缓冲液(PH=10)、铬黑T 混合指示剂,乙二胺四乙酸二钠,基准ZnO 二、EDTA 标准溶液的配制乙二胺四乙酸简称EDTA ,难溶于水,通常用乙二胺四乙酸二钠盐(Na 2H 2Y·H 2O )进行配制。
称取40g 的乙二胺四乙酸二钠,加热溶于1000ml 水中,冷却,摇匀。
三、基本原理乙二胺四乙酸二钠标准溶液主要采用间接法制备,国标规定以氧化锌基准试剂标定。
标定以氨—氯化铵缓冲液控制PH=10,采用铬黑T (EBT )做指示剂:22Zn HIn ZnIn H +--++→+当滴加EDTA 时,溶液中游离的Zn 2+首先与EDTA 阴离子进行配位反应:2222Zn H Y ZnY 2H +--++→+溶液仍为ZnIn -酒红色,到达计量点时,稍过量的EDTA 便夺取ZnIn -中的Zn 2+,释放出指示剂呈兰色,为滴定终点。
2222ZnIn H Y ZnY HIn H ----++→++(酒红色) (兰色)四、标定步骤称取0.25g 于800℃灼烧至恒重的基准氧化锌,称准至0.0001g 。
用少量水湿润,加2mL20%的盐酸溶液使样品溶解,加10mL 水,用10%氨水溶液中和至PH7~8(出现白色浑浊),加10mL氨—氯化铵缓冲液(PH=10)及少量铬黑T指示剂(固体),溶液呈酒红色。
用配制好的乙二胺四乙酸二钠[c(EDTA)=0.1mol/L]滴定至溶液经紫色变为纯蓝色。
同时作空白试验。
五、数据记录六、计算乙二胺四乙酸二钠标准溶液浓度按下式计算c(EDTA)=m/(V1-V2)×0.08138式中:c(EDTA)——乙二胺四乙酸二钠标准溶液之物质的量的浓度,mol/L;m——氧化锌之质量,g;V1——乙二胺四乙酸二钠溶液之用量,mL;V2——空白试验用乙二胺四酸二钠之用量,mL;0.08138——与1.00mL乙二胺四乙酸二钠标准溶液[C(EDTA)=1.000mol/L]相当的以克表示的氧化锌的质量。
EDTA标准溶液的配制与标定.

EDTA标准溶液的配制与标定
学习目标:
1.掌握EDTA滴定液的配制、标定的方法
2.熟悉金属指示剂的变色原理
3.了解金属指示剂具备的条件
一、EDTA标准溶液的配制
用托盘天平称取EDTA9.5g,置500ml烧杯中,加纯化水300ml,加热搅拌使之溶解,冷却至室温,稀释至500ml,摇匀,移入试剂瓶中,贴好标签待标定。
二、EDTA标准溶液的标定
在分析天平上,用减重称量法精密称取在800℃灼烧至恒重的基准氧化锌约0.12g,置于锥形瓶中,加稀盐酸使其溶解,加纯化水25ml和甲基红指示剂1滴,滴加氨试液至溶液微黄色。
再加纯化水25ml,加NH3.H2O-NH4Cl缓冲液(PH=10)10ml,铬黑T指示剂少许,用待标定的EDTA滴定液滴定至溶液由紫红色变为纯蓝色。
三、金属指示剂
金属指示剂:一种能与金属离子生成有色配合物的显色剂,以它的颜色改变来确定滴定过程中金属离子浓度的变化,这种显色剂称为金属指示剂。
金属指示剂一般为有机染料In,与被测金属离子M反应,生成一种与指示剂本身颜色不同的配合物MIn。
四、金属指示剂具备下列条件 :
1.金属指示剂配合物MIn与指示剂In的颜色应显著区别。
2.对金属指示剂与金属离子的显色反应要求,显色反应要迅速灵敏,且有良好的可逆性,同时还应有一定的选择性。
3.金属指示剂配合物MIn有一定的稳定性,一般要求MIn 的K,MIn ≥104,并且其稳定性又小于MY配合物的稳定性,即 K,MY/ K,MIn≥102。
4.金属指示剂In和与金属形成的配合物MIn应可溶于水,指示剂性质稳定,便于储存和使用。
重庆医药高等专科学校 牛晓东。
乙二胺四乙酸二钠(EDTA)标准溶液的配制与标定

乙二胺四乙酸二钠(EDTA)标准溶液的配制与标定1 试剂乙二胺四乙酸二钠(EDTA)氧化锌(基准试剂)。
盐酸溶液(1+1)。
10%氨水。
氨-氯化铵缓冲溶液:配制方法见“SS-14-1-84”。
%铬黑T指示剂(乙醇溶液):配制方法见“SS-14-1-84”。
2 操作步骤0.05M、0.02M EDTA标准溶液的配制与标定:2.1.1 EDTA标准溶液的配制:1) 0.05M EDTA溶液:称取20g乙二胺四乙酸二钠溶于1 L蒸馏水中,摇匀。
2) 0.02M标准溶液:称取8g乙二胺四乙酸二钠溶于1 L高纯水中,摇匀。
2.1.2 EDTA标准溶液的标定:1)标准溶液的标定:称取于800℃灼烧至恒重的基准氧化锌1g(称准至),用少许蒸馏水湿润,加盐酸溶液(1+1)至样品溶解,移入250ml容量瓶中,稀释至刻度,摇匀。
取上述溶液,加80ml水,用10%氨水中和至PH为7~8,加5ml氨-氯化铵缓冲溶液(PH=10),加5滴%铬黑T指示剂,用0.05M EDTA溶液滴定至溶液由紫色变为纯兰色。
2)0.02M EDTA标准溶液的标定:称取0.4g(称准至)于800℃灼烧至恒重的基准氧化锌用少许蒸馏水湿润,加盐酸溶液(1+1)至样品溶解,移入250ml 容量瓶中,稀释至刻度,摇匀。
取上述溶液,加80ml水,用10%氨水中和至PH为7~8,加5ml氨-氯化铵缓冲溶液(PH=10),加5滴%铬黑T指示剂,用0.02M EDTA溶液滴定至溶液由紫色变为纯兰色。
EDTA标准溶液的摩尔浓度(M)按下式计算:G 20 0.08G⊿V = —————×———— = —————V× 250 V×式中 G——氧化锌之重,g;V——滴定时消耗EDTA溶液的体积,ml;——250ml中取20ml滴定,相当于G的倍;——每毫摩尔氧化锌(ZnO)的重量,g。
0.001M EDTA 标准溶液饿配制和标定:2.2.1 配制:取0.05M EDTA 标准溶液,准确地稀释至50倍制得。
EDTA标准溶液的配制和标定

EDTA标准溶液的标定一、实验目的1.学习EDTA标准溶液的配制和标定方法。
2.掌握配位滴定的原理,了解配位滴定的特点。
二、实验原理EDTA标准溶液的配制一般用间接法先配成近似浓度的溶液,再用基准物质标定。
标定EDTA溶液的基准物质有Zn、Cu、ZnO、CaC03、MgS04·7H20、ZnS04·7H2O等。
如用CaCO3作基准物质标定EDTA溶液浓度时,调节溶液pH≥12.0,采用钙指示剂,滴定到溶液由酒红色变为纯蓝色为终点。
如有Mg2+共存,变色更敏锐。
用钙指示剂(H3Ind)确定终点,在pH≥12时,HInd2-离子(纯蓝色)与Ca2+形成较稳定的CaInd-配离子(酒红色),所以在钙标准溶液中加入钙指示剂时,溶液呈酒红色。
当用EDTA溶液滴定时,EDTA与Ca2+形成比CaInd-配离子更稳定的CaY2-配离子,所以在滴定终点附近CaInd-不断转化为CaY2-,而该指示剂被游离出,反应如下:滴定前:HInd2-+ Ca CaInd-+ H+化学计量点前:Ca2+ + Y CaY2-终点:CaInd- + H2Y2- + OH-CaY2- + HInd2-+ H2O酒红色无色纯蓝色所以终点时溶液由酒红色转变为纯蓝色。
三、仪器和药品酸式滴定管,锥形瓶(250 mL),容量瓶(250 mL),移液管(25 mL),FA/JA1004型电子天平,称量瓶;EDTA(0.01 mol/L 左右,待标定),NaOH(2mol/L),HCl(1:1),CaCO3(固体,AR),钙指示剂。
四、实验步骤1、EDTA标准溶液的配制:在台秤上称取3.8g 左右乙二胺四乙酸钠,溶于300~400 mL温水中后稀释至1L。
(已配制)2、标准溶液的配制:准确称取在110℃干燥至恒重的基准物质CaCO3 0.2~0.3g 于烧杯中,加水数滴润湿,盖以表面皿,从烧杯嘴慢慢加入1:1HCl至CaCO 3完全溶解,加热至沸,用蒸馏水把可能溅到表面皿上的溶液洗入杯中,待冷却后移入250mL 容量瓶中,用纯水稀至刻度后摇匀。
乙二胺四乙酸二钠(EDTA)标准溶液的配制与标定

乙二胺四乙酸二钠(EDTA)标准溶液的配制与标定1 试剂乙二胺四乙酸二钠(EDTA)氧化锌(基准试剂)。
盐酸溶液(1+1)。
10%氨水。
氨-氯化铵缓冲溶液:配制方法见“SS-14-1-84”。
%铬黑T指示剂(乙醇溶液):配制方法见“SS-14-1-84”。
2 操作步骤0.05M、0.02M EDTA标准溶液的配制与标定:2.1.1 EDTA标准溶液的配制:1) 0.05M EDTA溶液:称取20g乙二胺四乙酸二钠溶于1 L蒸馏水中,摇匀。
2) 0.02M标准溶液:称取8g乙二胺四乙酸二钠溶于1 L高纯水中,摇匀。
2.1.2 EDTA标准溶液的标定:1)标准溶液的标定:称取于800℃灼烧至恒重的基准氧化锌1g(称准至),用少许蒸馏水湿润,加盐酸溶液(1+1)至样品溶解,移入250ml容量瓶中,稀释至刻度,摇匀。
取上述溶液,加80ml水,用10%氨水中和至PH为7~8,加5ml氨-氯化铵缓冲溶液(PH=10),加5滴%铬黑T指示剂,用0.05M EDTA溶液滴定至溶液由紫色变为纯兰色。
2)0.02M EDTA标准溶液的标定:称取0.4g(称准至)于800℃灼烧至恒重的基准氧化锌用少许蒸馏水湿润,加盐酸溶液(1+1)至样品溶解,移入250ml 容量瓶中,稀释至刻度,摇匀。
取上述溶液,加80ml水,用10%氨水中和至PH为7~8,加5ml氨-氯化铵缓冲溶液(PH=10),加5滴%铬黑T指示剂,用0.02M EDTA溶液滴定至溶液由紫色变为纯兰色。
EDTA标准溶液的摩尔浓度(M)按下式计算:G 20 0.08G⊿V = —————×———— = —————V× 250 V×式中 G——氧化锌之重,g;V——滴定时消耗EDTA溶液的体积,ml;——250ml中取20ml滴定,相当于G的倍;——每毫摩尔氧化锌(ZnO)的重量,g。
0.001M EDTA 标准溶液饿配制和标定:2.2.1 配制:取0.05M EDTA 标准溶液,准确地稀释至50倍制得。
EDTA标准溶液的配置与标定.

(3)标定EDTA溶液:吸取25.00 mL已知浓度锌标液于150 mL锥形瓶中加
入25 mL水,加入氨水调节溶液至近中性,再加5mL缓冲溶液和5滴铬黑T指 示剂,用EDTA溶液滴定至蓝色。 (4)计算EDTA溶液精确浓度。
8
国家职业教育水环境监测与治理专业教学资源库
水环境监测
谢 谢!
国家职业教育水环境监测与治理专业教学资源库
水环境监测
EDTA标准溶液的配置与标定
王 虎 副教授
国家职业教育水环境监测与治理专业教学资源库
EDTA标准溶液的配置与标定
1.EDTA标准溶液配置方法
(1)EDTA:乙二胺四乙酸或者其二钠盐简称,常以其二钠盐配制
标准溶液。 (2)配制方法:一般用间接配制(标定配制)法获得,即先将 EDTA二钠盐配制成近似所需浓度的溶液(粗配),再用基准物质标定 其准确浓度。 (3)标定物质:一般以金属锌、氧化锌及碳酸钙可作为标定EDTA 溶液浓度的基准物质。
2
国家职业教育水环境监测与治理专业教学资源库
EDTA标准溶液的配置与标定
2. 标定原理
• 用金属锌或氧化锌配置确定浓度的锌标准溶液;
• 在pH=10.0的NH3-NH4Cl缓冲溶液中,以铬黑T(EBT)为指 示剂,用粗配的EDTA溶液滴定一定体积已知浓度锌标准溶液 ,溶液由紫红色变为纯蓝色即为滴定终点。 • 根据消耗的EDTA溶液体积即可计算其准确浓度。
3
国家职业教育水环境监测与治理专业教学资源库
EDTA标准溶液的配置与标定
3. 粗配EDTA溶液
(1)称取3.72 g的分析纯EDTA二钠盐(Na2C10H14N2O8· 2H2O) ,溶于400 mL水中,加热使其安全溶解; (2)冷却后转移至1 L的容量瓶中,用水定容至标线,摇匀后 转入试剂瓶,其浓度约为0.01 mol/L,精确浓度待标定。
EDTA标准溶液浓度的配制与标定

EDTA 标准溶液的配制与标定一、实验目的1.掌握EDTA 标准溶液的配制和标定方法。
2.学会判断配位滴定的终点。
3.了解缓冲溶液的应用。
4.掌握配位滴定的基本原理、方法和计算。
二、实验原理乙二胺四乙酸难溶于水,常温下其溶解度为0.2g/L ,在分析中通常使用其二钠盐配制成标准溶液,乙二胺四乙酸二钠盐的溶解度为120g/L 。
EDTA 制成溶液后,可用氧化锌基准物标定。
当用缓冲溶液控制溶液酸度为PH=10,EDTA 可与Zn2+反应生成稳定的配合物。
铬黑T 为指示剂,终点由酒红色变为纯蓝色。
反应如下:+-+-+=+H ZnIn Zn HIn 22+--++=+H ZnY Y H Zn 22222+----++=+H HIn ZnY Y H ZnIn 2222三、仪器与试剂1.仪器:50mL 酸式滴定管、250mL 锥形瓶、100mL 量筒、分析天平、烘箱、玻璃棒、10mL 量筒、250mL 容量瓶、25mL 移液管、50mL 烧杯2.试剂:氧化锌、盐酸、氨水、乙二胺四乙酸二钠盐NH3-NH4CL缓冲溶液(PH=10):称取54.0g氯化铵,溶于200mL 水中,加350mL氨水,用水稀释至1000mL,摇匀。
铬黑T指示液:称取0.5g铬黑T和2.0g盐酸羟胺,溶于乙醇,用乙醇稀释至100mL,摇匀(使用前新配)。
四、实验步骤1.0.02mol/L EDTA标准溶液的配制称取EDTA二钠盐7.5g,溶于200mL水中,加热促其溶解,冷却至室温用水稀释至1000mL,摇匀备用。
2.0.02mol/L EDTA标准溶液的标定以减量法准确称取于105-110℃干燥至恒重的氧化锌0.4000g ,置于50mL小烧杯中,用少量水润湿,滴加浓盐酸至氧化锌全部溶解(约1-2mL)。
定量转移至250mL容量瓶中,用水稀释至刻度,摇匀。
精密移取上述溶液25mL置于250mL锥形瓶中,加入50mL水,滴加(1+1)氨水至刚出现白色浑浊(此时溶液的PH值应为7-8),再加10mLNH3-NH4CL缓冲溶液及4滴铬黑T指示液,用欲标定的0.02mol/L EDTA标准溶液进行滴定,直至溶液由酒红色变为纯蓝色为终点。
实验十一0.02medta标准溶液的配制与标定

[C EDTA=L]一、配制:称取乙二胺四乙酸二钠8g,加1000毫升水,加热溶解,冷却,摇匀,备用。
二、标定:(一)以基准氧化锌(ZnO)标定(指示剂:%铬黑T指示剂)标定流程:准称于800±500C度高温炉中灼烧至恒重的工作基准试剂氧化锌(~)于100mL烧杯中↓←少量水湿润,盖上表面皿滴加盐酸溶液(20%)使之刚好完全溶解↓转移入250毫升容量瓶中,加水至刻度,混匀↓准确移取毫升(含Zn2+溶液)于锥形瓶↓←加甲基红指示剂一滴滴加氨水(10%)至微黄色(此时PH=7~8)↓←加蒸溜水25mL加10毫升氨~氯化铵缓冲溶液(PH≈10)↓←加5滴铬黑T指示液(%)用EDTA溶液滴定至溶液由紫红色变为纯蓝色,即为终点。
↓记录EDTA溶液消耗的体积↓同时做空白实验计算:C EDTA=[m X(V1/250)X1000]/[(V2-V0)X M ZnO]式中:m--------氧化锌的质量,gV1---------含Zn2+标准溶液所取的体积V2----------------滴定时,EDTA标准溶液所消耗的体积,mLV0-----------------空白滴定时,EDTA标准溶液所消耗的体积,mL M------------------氧化锌的摩尔质量,g/mol,即M ZnO=mol(二)以基准碳酸钙(CaCO3)标定(指示剂:钙指示剂)标定流程:准称工作基准试剂碳酸钙(~)于100mL烧杯中↓←少量水湿润,盖上表面皿滴加盐酸溶液(20%)使之刚好完全溶解(可加热助溶)↓冷却转移入250毫升容量瓶中,加水至刻度,混匀↓准确移取毫升(含Ca2+溶液)于锥形瓶↓←加甲基红指示剂一滴滴加氨水(10%)至微黄色↓加20毫升氨~氯化铵缓冲溶液(PH=10)↓←加一米粒大的钙指示剂用EDTA溶液滴定至溶液由紫红色变为纯蓝色,即为终点。
记录EDTA溶液消耗的体积↓同时做空白实验三、计算:C EDTA=[m X(V1/250)X1000]/[(V2-V0)X M CaCO3]式中:m--------CaCO3的质量,gV1---------含Ca2+标准溶液所取的体积V2----------------滴定时,EDTA标准溶液所消耗的体积,mLV0-----------------空白滴定时,EDTA标准溶液所消耗的体积,mL M------------------CaCO3的摩尔质量,g/mol,即M CaCO3=mol四、实验数据记录:自己绘制表格(参考实验四)。
EDTA标准溶液的配制和标定(氧化锌标液)[参照材料]
![EDTA标准溶液的配制和标定(氧化锌标液)[参照材料]](https://img.taocdn.com/s3/m/59bab0d14afe04a1b171de31.png)
EDTA标准溶液的配制和标定(氧化锌标液)一、目的:1、学习EDTA标准溶液的配制和标定方法。
2、学习配位滴定法的原理,了解该滴定法的特点。
二、原理:标定EDTA的基准物质有Zn、CaCO3、Bi、Cu、MgSO4·7H2O等。
(MEDTA=372.2g/mol)指示剂:EBT 1%(称取1克EBT加入三乙醇胺75ml、无水乙醇25ml)。
在PH=10.0的缓冲溶液中:Zn2++In3- ZnIn-(酒红色)ZnIn-+HY3-←→ ZnY2-+HIn2-(蓝色)三、用ZnO作为基准物质时所需试剂:EDTA ZnO(烘干) NH3—NH4Cl缓冲液(PH=10.0) 1+1氨水EBT 1% 6mol·L-1的HCl (MZnO=81.37)四、实验步骤:1、配制0.02mol·L-1EDTA500mL在台称上称取EDTA二钠盐3.5—3.8g溶入150—200mL温水中,稀释至500mL,装入试剂瓶中、待标定。
2、配制ZnO标准溶液250mL在分析天平上准确称取ZnO 0.3—0.4g于小烧杯中。
滴加6mol·L-1的HCl至全部溶解(约5~10mL),转移至250mL的容量瓶中。
3、准确取三份各25.00mL+25mL蒸馏水入三角锥瓶中。
慢慢滴加NH3水,至刚好出现白色浑浊,加入10mL缓冲液,滴加3—4滴铬黑T。
4、0.02mol·L-1EDTA滴定,由酒红色→蓝色为终点。
五、数据及计算:公式:CEDTA =(mZnO/MZnO×25/250)/ (VEDTA/1000)样品号 1 2 3ZnO的质量(g)ZnO基准溶液用量(mL)EDTA终读数(mL)EDTA初读数(mL)VEDTA(mL)CEDTA(mol·L-1)CEDTA平均值(mol·L-1)绝对偏差相对平均偏差(%)二、思考题:1、配位滴定中为什么需要采用缓冲溶液?2、为什么在ZnO中加入HCl?3、通过计算说明为什么称取0.32—0.4g ZnO?怎么标定0.05mol/L的EDTA标准溶液基准物是氧化锌指示剂是铬黑T固体?准确称取1.0g已于900℃温度下灼烧至恒重的基准氧化锌,溶于盛有10mL 1+1盐酸中,溶解较慢时可适当加热使其溶解,冷却后转移至250mL容量瓶中并稀释至刻度,摇匀。
氧化锌标的EDTA
浓度的平均 值(mol/L) 标准溶液浓 度结果 (mol/L) 有效期至: 校核人及校 核时间: 存放条件: 审核人及审 核时间:
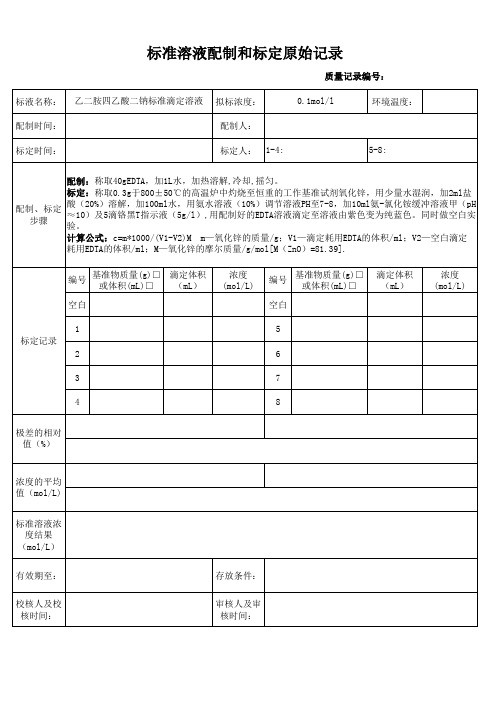
标准溶液配制和标定原始记录
质量记录编号: 标液名称: 配制时间: 标定时间: 乙二胺四乙酸二钠标准滴定溶液 拟标浓度: 配制人: 标定人: 1-4: 5-8: 1L水,加热溶解,冷却,摇匀。 标定:称取0.3g于800±50℃的高温炉中灼烧至恒重的工作基准试剂氧化锌,用少量水湿润,加2ml盐 酸(20%)溶解,加100ml水,用氨水溶液(10%)调节溶液PH至7-8,加10ml氨-氯化铵缓冲溶液甲(pH 配制、标定 ≈10)及5滴铬黑T指示液(5g/l),用配制好的EDTA溶液滴定至溶液由紫色变为纯蓝色。同时做空白实 步骤 验。 计算公式:c=m*1000/(V1-V2)M m—氧化锌的质量/g;V1—滴定耗用EDTA的体积/ml;V2—空白滴定 耗用EDTA的体积/ml;M—氧化锌的摩尔质量/g/mol[M(ZnO)=81.39]. 编号 空白 1 标定记录 2 3 4 极差的相对 值(%) 6 7 8 基准物质量(g)□ 滴定体积 或体积(mL)□ (mL) 浓度 (mol/L) 编号 空白 5 基准物质量(g)□ 或体积(mL)□ 滴定体积 (mL) 浓度 (mol/L)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
EDTA标准溶液的配制和标定(氧化锌标液)
一、目的:1、学习EDTA标准溶液的配制和标定方法。
2、学习配位滴定法的原理,了解该滴定法的特点。
二、原理:
标定EDTA的基准物质有Zn、CaCO
3、Bi、Cu、MgSO
4
·7H
2
O等。
(M
EDTA
=372.2g/mol)
指示剂:EBT 1%(称取1克EBT加入三乙醇胺75ml、无水乙醇25ml)。
在PH=10.0的缓冲溶液中:Zn2++In3- ZnIn-
(酒红色)
ZnIn-+HY3-←→ ZnY2-+HIn2-
(蓝色)
三、用ZnO作为基准物质时所需试剂:
EDTA ZnO(烘干) NH
3—NH
4
Cl缓冲液(PH=10.0) 1+1
氨水EBT 1% 6mol·L-1的HCl (M
ZnO
=81.37)
四、实验步骤:
1、配制0.02mol·L-1EDTA500mL
在台称上称取EDTA二钠盐3.5—3.8g溶入150—200mL温水中,稀释至500mL,装入试剂瓶中、待标定。
2、配制ZnO标准溶液250mL
在分析天平上准确称取ZnO 0.3—0.4g于小烧杯中。
滴加6mol·L-1的HCl至全部溶解(约5~10mL),转移至250mL的容量瓶中。
3、准确取三份各25.00mL+25mL蒸馏水入三角锥瓶中。
慢慢滴加NH
3
水,至刚好出现白色浑浊,加入10mL缓冲液,滴加3—4
滴铬黑T。
4、0.02mol·L-1EDTA滴定,由酒红色→蓝色为终点。
五、数据及计算:
公式:C
EDTA =(m
ZnO
/M
ZnO
×25/250)/ (V
EDTA
/1000)
样品号 1 2 3
ZnO的质量(g)
ZnO基准溶液用量
(mL)
EDTA终读数
(mL)
EDTA初读数
(mL)
V
EDTA
(mL)
C
EDTA
(mol·L-1)
C
EDTA
平均值
(mol·L-1)
绝对偏差
相对平均偏差
(%)
二、思考题:
1、配位滴定中为什么需要采用缓冲溶液?
2、为什么在ZnO中加入HCl?
3、通过计算说明为什么称取0.32—0.4g ZnO?
怎么标定0.05mol/L的EDTA标准溶液基准物是氧化锌指示剂是铬黑T固体?
准确称取1.0g已于900℃温度下灼烧至恒重的基准氧化锌,溶于盛有10mL 1+1盐酸中,溶解较慢时可适当加热
使其溶解,冷却后转移至250mL容量瓶中并稀释至刻度,摇匀。
用移液管吸取25.00mL上述Zn2+离子标准溶液于
250mL锥形瓶中,加约25mL水,滴加(1+1)氨水至刚出现浑浊(产生白色氢氧化锌沉淀,此时pH约为8),然
后加入10mLNH3-NH4Cl缓冲溶液,4滴铬黑T指示液,用EDTA标准溶液滴定至溶液由酒红色刚好变为纯蓝色为终
点。
记录消耗的EDTA标准溶液的体积。
同时作空白试验.
以25mL蒸馏水代替25mL Zn2+离子标准溶液-空白试验。
