北师大《无机化学》第四版习题答案
北师大《无机化学》第四版习题答案5

第五章化学热力学基础5-1从手册中查出常用试剂浓硫酸、浓盐酸、浓硝酸、浓氨水的密度和质量分数计算它们的(体积)物质的量浓度和质量摩尔浓度。
解:经查阅:p(HCl)=1.19g/mlw(HCl)=37.23%p(H2SO4)=1.83g/mlw(H2SO4)=98%p(HNO3)=1.42g/mlw(HNO3)=69.80%p(NH3.H2O)=0.9g/mlw(NH3.H2O)=26%由公式c=pw/M可得:c(HCl)=12mol·L–1c(H2SO4)=18.3mol·L–1c(HNO3)=15.7mol·L–1c(NH3.H2O)=13.8mol·L–1设1㎏水中含溶质nmol,则由w=m/(m+1000)(m为溶质质量)可得:m(HCl)=16.2mol/㎏m(H2SO4)=500mol/㎏m(HNO3)=36.69mol/㎏m(NH3.H2O)=20.67mol/㎏5-2从手册查出常温下的饱和水蒸气压,计算当时相对湿度为40%时,水蒸气压多大。
解:在298K下,P(饱和水蒸气压)=3.167Kpa,P(不饱和)/P (饱和)=40%,则P(不饱和)/P(饱和)=40%×P(饱和)=0.4×3.167=1.2668Kpa 答:水蒸气压为1.2668Kpa.5-3化学实验中经常用蒸馏水冲洗已用自来水洗净的烧杯。
设洗净烧杯内残留“水”为1mL,试计算,用30mL蒸馏水洗1次和2次,烧杯中残留的“自来水的浓度”分别多大?解:再用自来水洗之后,烧杯中自来水为1ml之后,加入30ml 蒸馏水,一共为31ml水,自来水占1/31,倒掉后又倒1ml,故自来水浓度为1/31。
若第一次加入的蒸馏水倒掉之后,1ml中含1/31ml的自来水;再加入30ml蒸馏水,一共为31ml水,自来水占1/312=1/963所以倒掉后自来水占1/312=1/9635-4计算15℃,97kPa下15g氯气的体积。
北师大《无机化学》第四版习题参考答案

精心整理第十一章电化学基础11-1用氧化数法配平下列方程式(1)KClO 3→KClO 4+KCl(2)Ca 5(PO 4)3F+C+SiO 2→CaSiO3+CaF 2+P 4+CO(3)NaNO 2+NH 4Cl →N 2+NaCl+H 2O(4)K 2Cr 2O 7+FeSO 4+H 2SO 4→Cr 2(SO 4)3+Fe 2(SO 4)3+K 2SO 4+H 2O(5)CsCl+Ca →CaCl 2+Cs解:(((((11-2(1(2(3(4(5解:(2(3(4(511-3.用半反应法(离子-电子法)配平下列方程式(1)K 2Cr 2O 7+H 2S+H 2SO 4——K 2SO 4+Cr 2(SO 4)3+H 2O(2)MnO 42-+H 2O 2———O 2+Mn 2+(酸性溶液)(3)Zn+NO 3-+OH -——NH 3+Zn (OH )42-(4)Cr (OH )4-+H 2O 2——CrO 42-(5)Hg+NO 3-+H +——Hg 22++NO解:(1)K 2Cr 2O 7+3H 2S+4H 2SO 4==K 2SO 4+Cr 2(SO 4)3+7H 2O+3S(2)MnO 42-+2H 2O 2+4H +==2O 2+Mn 2++4H 2O(3)Zn+NO 3-+3H 2O+OH -==NH 3+Zn (OH )42-(4)2Cr(OH)4-+3H2O2+2OH==-2CrO42-+8H2O(5)6Hg+2NO3-+8H+==3Hg22++2NO+4H2O11-4将下列反应设计成原电池,用标准电极电势判断标准态下电池的正极和负极,电子传递的方向,正极和负极的电极反应,电池的电动势,写出电池符号.(1)Zn+2Ag+=Zn2++2Ag(2)2Fe3++Fe=3Fe2+(3)Zn+2H+=Zn2++H2(4)H2+Cl2=2HCl(5)3I2+6KOH=KIO3+5KI+3H2O11-5写出下列各对半反应组成的原电池的电池反应、电池符号,并计算标准电动势。
北师大无机化学四版习题答案5章化学动力学基础
解:(1) HBr + O2→HOOBr
HOOBr+HBr→2HOBr
+ 2HOBr+2HBr→2H2O+2Br2
4HBr+O2→H2O+Br2
(2)
(3)中间体是HOOBr和HBr
(4)a、若第一步是速控步,则
b、若第二步是速控步,则 ………①
根据稳态近似假设则
即 - .
代入①,得 。
根据 由上图可解出斜率 ,所以 =232.71kJ∙mol-1:
截距 ,所以
5.9测得某反应在273K和313K下的速率常数分别为1.06×10-5s-1和2.93×10-3s-1.求该反应在298K下的速率常数。
解:
故
解得,k3=4.25×10-4s-1
答:该反应在298K下的速率常数为4.25×10-4s-1
I 30 55
II 70 20
III 16 35
(1)哪个反应的正反应速率最大?
(2)反应I的反应焓多大?
(3)哪个反应的正反应是吸热反应?
解:( 1 )反应III的正反应速率最大·因为 ,Ea越小,k越大:
( 2 )ΔrHm= Ea-Ea’= (30-50) kJ∙mol-1=-25 kJ∙mol-1,
第5章化学动力学基础
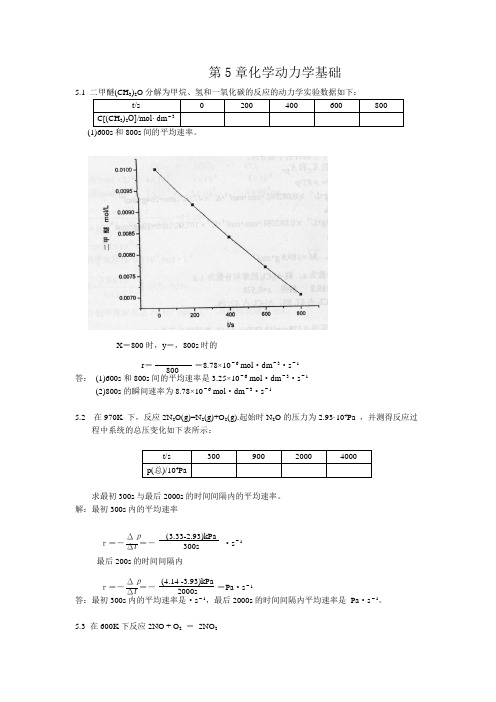
5.1二甲醚(CH3)2O分解为甲烷、氢和一氧化碳的反应的动力学实验数据如下:
t/s
0
200
400
600
800
C[(CH3)2O]/mol∙dm-3
(1)600s和800s间的平均速率。
X=800时,y=,800s时的
r= =8.78×10-6mol·dm-3·s-1
北师大《无机化学》第四版习题答案

第九章 酸碱平衡9-1 以下哪些物种是酸碱质子理论的酸,哪些是碱,哪些具有酸碱两性?请分别写出它们的共轭碱或酸。
SO -24, S-2, H 2PO -4, NH 3, HSO -4, [Al(H 2O)5OH]+2, CO -23, NH +4, H 2S, H 2O,OH -,H 3O +, HS -, HPO -24。
解: 质子酸 — 共轭碱H 2PO -4 — HPO -24 HSO -4 — SO -24 [Al(H 2O)5OH]+2—[Al(H 2O)4(OH)2]+NH +4 —NH 3 H 2S — HS -H 2O — OH -H 3O +— H 2O HS -— S-2 HPO -24 — PO -34质子碱 — 共轭酸SO -24 — HSO -4 S-2 — HS -NH 3 — NH +4 HSO -4— H 2SO 4[Al(H 2O)5OH]+2—[Al(H 2O)6]+3 CO -23 — HCO -3 H 2O — H 3O +OH -— H 2O HS -— H 2S HPO -24 — H 2PO -4酸碱两性:H 2PO -4, HSO -4, [Al(H 2O)5OH]+2, H 2O , HS -, HPO -24。
9-2 为什么pH=7并不总表明水溶液是中性的。
解: 因为水的解离是一个明显的吸热过程,因此水的离子积是温度的函数,只有在常温下K w =1.0×1014-,即[H +]=[OH -]=1.0×107-,所以pH =7,其他温度下则不然。
9-3 本章表示电解质及其电离产物的浓度有两种,一种如c(HAc)、c(NH +4),另一种如[HAc],[NH +4]等,它们的意义有何不同?什么情况下电离平衡常数的表达式中可以用诸如c(HAc)、c(NH +4)等代替诸如[HAc],[NH +4]等?有的书上没有诸如c(HAc)、c(NH +4)这样的浓度符号,遇到浓度时一律用诸如[HAc],[ NH +4]等来表示,这样做有可能出现什么混乱?解:c(HAc)、c(NH +4)用来表示初始状态的浓度,而[HAc],[ NH +4]用来表示平衡状态下的浓度。
北师大无机化学第四版下册答案

北师大无机化学第四版下册答案1. 下列关于氢原子结构叙述不正确的是: [单选题] *A. 电子在r<53pm的区域出现的概率密度大B. 电子在r=53pm处出现的概率最大C. 电子在r=53pm处出现的概率密度最大(正确答案)D. 电子在r>53pm的空间出现的概率和概率密度随r的增大都减小2. 下列说法错误的是: [单选题] *A. │Y│2表示电子出现的概率密度B. │Y│2图形与Y图形相比, 形状相同, 但│Y│2图略“瘦”些C. │Y│2在空间分布的图形称为电子云D. │Y│2值一定大于Y值(正确答案)3. 描述一确定的原子轨道(即一个空间运动状态),需用的参数是 [单选题] *A. n,lB. n,l,m(正确答案)C. n,l,m,msD. 只需n4. 下列关于p轨道电子云形状叙述正确的是: [单选题] *A. 球形对称B. 8字形平面C. 极大值在x.y.z轴上的双梨形(正确答案)D. 互相垂直的梅花瓣形5. n=4时m的最大取值为: [单选题] *A. 4B. ±4C. 3(正确答案)D. 06. 对于原子中的电子,下面量子数组容许的是: [单选题] *A. n=3, l=1, m=-1(正确答案)B. n=3, l=1, m=2C. n=2, l=2, m=-1D. n=4, l=-2, m=17. 下列对四个量子数的说法正确的是: [单选题] *A. 电子的自旋量子数是½,在某一个轨道中有两个电子,所以总自旋量子数是1或是0B. 磁量子数m=0的轨道都是球形的轨道C. 角量子数l的可能取值是从0到n的正整数D. 多电子原子中,电子的能量决定于主量子数n和角量子数l(正确答案)8. 下列多电子原子中,能量最高的为: [单选题] *A. 3, 2,-2,-1/2(正确答案)B. 2, 0, 0,-1/2C. 2, 1, 1,-1/2D. 3, 1, 1,-1/29. 下列说法错误的是: [单选题] *A. 电子所受屏蔽效应越强,电子能量越低(正确答案)B. 电子的钻穿效应越强,电子能量越低C. 屏蔽效应和钻穿效应的结果引起能级交错D. n值相同,l越小,则钻穿效应越强10. 下面按电离能增加的顺序排列的是: [单选题] *A. C,P,SeB. O,F,Ne(正确答案)C. B,Be,LiD. Li,Na,K11. 第一电子亲和能最大的元素是: [单选题] *A. FB. Cl(正确答案)C. NaD. H12. 为表示一个原子在第三电子层上有10个电子可以写成: [单选题] *A. 310B. 3d10C. 3s23p63d2(正确答案)D. 3s23p64s213. 有A、B和C三种主族元素,若A元素阴离子与B、C元素的阳离子具有相同的电子层结构,且B的阳离子半径大于C,则这三种元素的原子序数大小次序是: [单选题] *A. B<C<AB. A<B<C(正确答案)C. C<B<AD. B>C>A14. 下列分子中心原子是sp2杂化的是: [单选题] *A. PBr3B. CH4C. BF3(正确答案)D. H2O15. 下列各组物质沸点高低顺序中正确的是: [单选题] *A. HI>HBr>HCl>HFB. H2Te>H2Se>H2S>H2OC. CH4>GeH4>SiH4D. NH3>AsH3>PH3(正确答案)16. 下列分子中偶极矩为零的是: [单选题] *A. NF3B. NO2C. PCl3D. BCl3(正确答案)17. 已知某元素的序号小于36,此元素失去三个电子后,它的角量子数为2的轨道内电子恰好半充满,此元素序号为:[单选题] *A. 25B. 26(正确答案)C. 27D. 2818. 下列物质熔沸点高低顺序正确的是: [单选题] *A. K2O>CaO>PH3>NH3B. CaO>K2O>PH3>NH3C. K2O>CaO>NH3>PH3D. CaO>K2O>NH3>PH3(正确答案)19. 加热熔化时需要打开共价键的物质是: [单选题] *A. SiO2(正确答案)B. CO2(s)C. MgCl2D. H2O20. 下列各物质化学键中同时存在键和键的是: [单选题] *A. SiO2B. H2SC. H2D. C2H4(正确答案)21. 某元素的+2氧化态离子的核外电子结构为1s22s22p63s23p63d5,此元素在周期表中的位置是: [单选题] *A. d区第四周期ⅦB族(正确答案)B. d区第四周期ⅤB族C. d区第四周期Ⅷ族D. p区第三周期ⅤA族22. 铁原子的价电子构型是: [单选题] *A. 4s2B. 4s24d6C. 3d64s2(正确答案)D. 3s23p63d623. 从中性原子Li、Be、B原子中去掉一个电子,需要大约相同的能量,而去掉第二个电子时,最难的是: [单选题] *A. Li(正确答案)B. BeC. BD. 都一样24. 电子构型相同的阳离子,其极化力最强的是: [单选题] *A.高电荷和半径大的离子B.低电荷和半径大的离子C.高电荷和半径小的离子(正确答案)D.低电荷和半径小的离子25. 在多电子原子中,决定电子能量的量子数为: [单选题] *A.nB. n和l(正确答案)C. n, l, mD. l26. 下列有关元素核外电子排布错误的是: [单选题] *A. Fe(Z = 26):1s2 2s2 2p6 3s2 3p6 3d6 4s2B. Cr (Z=24) :1s2 2s2 2p6 3s2 3p6 3d5 4s1C. Cu (Z=29) :1s2 2s2 2p6 3s2 3p6 3d9 4s2(正确答案)D. Ca(Z = 20):1s2 2s2 2p6 3s2 3p6 4s227. 由分子轨道理论可推断,在下列四种阳离子中最稳定的是: [单选题] *A、N2+B、NO+C、O2+(正确答案)D、Be2+28. 在水分子之间存在的各种相互作用力由强到弱的顺序正确的是: [单选题] *A、氢键>取向力>色散力>诱导力B、取向力>色散力>诱导力>氢键C、氢键>色散力>取向力>诱导力(正确答案)D、氢键>诱导力>取向力>色散力29. 下列离子的电子结构中,未成对电子数等于零的是: [单选题] *A、Cu2+B、Mn2+(正确答案)C、Cd2+D、Fe2+30. 在下列分子或离子中,不含有孤对电子的是: [单选题] *A、H2OB、NH3C、NH4+(正确答案)D、H2S31. 同核双原子分子中,能级相近的两个原子的p轨道可组成的分子轨道数是: [单选题] *A、4B、6(正确答案)C、8D、232. 根据分子轨道理论,下列解释正确的是: [单选题] *A、F2分子中 E (π2 p ) < E (σ2 p )B、O2+离子中不存在双键,键级为2C、N2 分子的稳定性略低于O2+离子的稳定性D、CO+离子中有一个σ单电子键(正确答案)33. 第二周期元素双原子分子中有未成对电子的分子有: [单选题] *A、Be2 ,O2 两种B、N2 ,C2 两种C、B2 ,O2 两种(正确答案)D、Be2 ,C2 两种34. ClO3F分子的几何构型属于: [单选题] *A、直线形B、平面正方形C、四面体形(正确答案)D、平面三角形35. 下列各物质的摩尔质量近乎相等,其中沸点最高的可能是: [单选题] *A、C2H5OC2H5B、CH3CH2CH2SHC、(CH3)2NC2H5D、CH3CH2CH2CH2OH(正确答案)36. 按分子轨道理论,O2分子中最高能量的电子所处的分子轨道是: [单选题] *A、π2 pB、π*2 p(正确答案)C、σ 2 pD、σ *2 p37. 下列分子中属于极性分子的是 : [单选题] *A、CCl4B、CH3OCH3(正确答案)C、BCl3D、PCl538. CH3OCH3和HF分子之间存在的作用力有: [单选题] *A、取向力、诱导力、色散力、氢键B、取向力、诱导力、色散力(正确答案)C、诱导力、色散力D、色散力39. 在Br-CH=CH-Br分子中,C-Br键的轨道重叠方式是: [单选题] *A、s p-pB、s p2-sC、s p2-p(正确答案)D、s p3-p40. 原子轨道之所以要发生杂化是因为: [单选题] *A、进行电子重排B、增加配对的电子数(正确答案)C、增加成键能力D、保持共价键的方向性41. 一个稳定的分子没有价电子在反键轨道上。
无机化学第四版(北京师范大学大学等)答案下册

无机化学第四版(北京师范大学大学等)答案下册碳的还原性1.与氧气反应(燃烧)2.与石英砂高温反应(工业应用:制硅单质)3.与金属氧化物反应如氧化铜、氧化铁(冶炼铁用焦炭,实际的还原剂主要是什么?)4.被热的浓硫酸氧化5.被热的浓硝酸氧化6.高温下被二氧化碳氧化。
*高温下被水氧化生成水煤气。
碳酸盐小结1.一些碳酸盐的存在、俗称或用途。
大理石、石灰石、白垩、方解石、蛋壳、贝壳、钟乳石—CaCO3;纯碱、苏打—Na2CO3;小苏打—NaHCO3 (可用于食品发泡,治疗胃酸过多症)菱镁矿—MgCO3(制MgO);菱铁矿—FeCO3 ;碳铵—NH4HCO3;(氮肥)草木灰的主要成分—K2CO3;(钾肥)暂时硬水的成分—Ca(HCO3)2和Mg(HCO3)2 ;锅垢的主要成分—CaCO3和Mg(OH)2;炼铁的“熔剂”—CaCO3 (炼钢的造渣剂是生石灰)制普通玻璃原料—石灰石、纯碱、石英;制水泥的原料—石灰石、粘土2.碳酸的正盐和酸式盐(1)相互转化: 碳酸钙和碳酸氢钙的转化(实验现象; 石灰岩洞和钟乳石形成)碳酸钠和碳酸氢钠的转化(碳酸钠溶液跟盐酸反应不如碳酸氢钠剧烈; 除去碳酸氢钠溶液中的碳酸钠杂质; 除去碳酸钠中碳酸氢钠杂质; 除去二氧化碳中的氯化氢杂质为什么不用碳酸钠溶液而用碳酸氢钠溶液等问题)(2)共同性质: 都能跟酸(比碳酸强的酸)反应生成二氧化碳气体. (碳酸盐的检验)(3)稳定性比较: 正盐比酸式盐稳定[稳定性: 酸<酸式盐<正盐,是一个比较普遍的现象如HClO<Ca(ClO)2; H2SO3<Na2SO3等](碳酸氢钠受热的实验现象; 碳酸氢钙溶液受热的实验现象)(4)溶解性比较碱金属碳酸盐: 酸式盐的溶解性弱于正盐. 如NaHCO3<Na2CO3碱土金属碳酸盐: 酸式盐的溶解性强于正盐如Ca(HCO3)2>CaCO3(5)碳酸氢钠与碳酸钠某些反应的异同? 都有碳酸盐的通性—-与盐酸反应生成二氧化碳(要注意熟悉反应时耗酸量及生成气体量的各种情况下的比较.)? 跟石灰水或氢氧化钡溶液都生成白色沉淀? 碳酸氢钠能跟氢氧化钠等碱反应而碳酸钠不反应;? 碳酸钠跟氯化钙或氯化钡溶液易生成碳酸盐沉淀,而碳酸氢钠跟盐类稀溶液不易生成沉淀.钠及其化合物的重要性质(一)钠的反应1. 钠跟氧气常温下一般认为生成氧化钠,加热(燃烧)生成过氧化钠. (钠的保存)2. 钠跟硫能剧烈反应,甚至爆炸3. 钠跟水反应(现象?)4.*钠跟硫酸铜溶液反应(现象?)5. 钠跟乙醇反应(与跟水的反应比较;)(有机物中的醇羟基、酚羟基、羧基都跟钠反应生成氢气。
北师大《无机化学》第四版习题答案

北师⼤《⽆机化学》第四版习题答案第五章化学热⼒学基础5-1从⼿册中查出常⽤试剂浓硫酸、浓盐酸、浓硝酸、浓氨⽔的密度和质量分数计算它们的(体积)物质的量浓度和质量摩尔浓度。
解:经查阅:p(HCl)=1.19g/mlw(HCl)=37.23%p(H2SO4)=1.83g/mlw(H2SO4)=98%p(HNO3)=1.42g/mlw(HNO3)=69.80%p(NH3.H2O)=0.9g/mlw(NH3.H2O)=26%由公式c=pw/M可得:c(HCl)=12mol·L–1c(H2SO4)=18.3mol·L–1c(HNO3)=15.7mol·L–1c(NH3.H2O)=13.8mol·L–1设1㎏⽔中含溶质nmol,则由w=m/(m+1000)(m为溶质质量)可得:m(HCl)=16.2mol/㎏m(H2SO4)=500mol/㎏m(HNO3)=36.69mol/㎏m(NH3.H2O)=20.67mol/㎏5-2从⼿册查出常温下的饱和⽔蒸⽓压,计算当时相对湿度为40%时,⽔蒸⽓压多⼤。
解:在298K下,P(饱和⽔蒸⽓压)=3.167Kpa,P(不饱和)/P (饱和)=40%,则P(不饱和)/P(饱和)=40%×P(饱和)=0.4×3.167=1.2668Kpa 答:⽔蒸⽓压为1.2668Kpa.5-3化学实验中经常⽤蒸馏⽔冲洗已⽤⾃来⽔洗净的烧杯。
设洗净烧杯内残留“⽔”为1mL,试计算,⽤30mL蒸馏⽔洗1次和2次,烧杯中残留的“⾃来⽔的浓度”分别多⼤?解:再⽤⾃来⽔洗之后,烧杯中⾃来⽔为1ml之后,加⼊30ml 蒸馏⽔,⼀共为31ml⽔,⾃来⽔占1/31,倒掉后⼜倒1ml,故⾃来⽔浓度为1/31。
若第⼀次加⼊的蒸馏⽔倒掉之后,1ml中含1/31ml的⾃来⽔;再加⼊30ml蒸馏⽔,⼀共为31ml⽔,⾃来⽔占1/312=1/963所以倒掉后⾃来⽔占1/312=1/9635-4计算15℃,97kPa下15g氯⽓的体积。
无机化学(北师大等三校编,第四版,高教版, 2003)习题答案

面向二十一世纪教材北京师范大学、华中师范大学、南京师范大学编无 机 化 学(第四版,北京: 高等教育出版社, 2003) 习 题 答 案第一章 原子结构和原子周期系1-1根据原子序数给出下列元素的基态原子的核外电子组态:(a)K (b)Al (c)Cl (d)Ti(Z=22) (e)Zn(Z=30) (f)As(Z=33) 答:(a)[Ar]4s1(b)[Ne]3s23p1(c)[Ne]3s23p5(d)[Ar]3d54s2(e)[Ar] 3d104s1(f)[Ar]4s24p31-2给出下列原子或离子的价电子层电子组态,并用方框图表示轨道,填入轨道的电子用箭头表示。
(a)Be (b)N (c)F (d)Cl- (e)Ne+ (f)Fe3+ (g)As3+1-3 Li+、Na+、K+、Rb+、Cs+的基态的最外层电子组态与次外层电子组态分别如何?1-4以下+3价离子那些具有8电子外壳?Al3+、Ga3+、Bi3+、Mn3+、Sc3+答:Al3+和Sc3+具有8电子外壳。
1-5已知电中性的基态原子的价电子层电子组态分别为:(a)3s23p5(b)3d64s2(c)5s2(d)4f96s2(e)5d106s1试根据这个信息确定它们在周期表中属于那个区、哪个族、哪个周期。
答:(a)p区,ⅦA族,第三周期 (b)d区,Ⅷ族,第四周期 (c)s区,ⅡA族,第五周期 (d)f区,ⅢB族,第六周期 (e)ds区,ⅠB族,第六周期1-6根据Ti、Ge、Ag、Rb、Ne在周期表中的位置,推出它们的基态原子的电子组态。
答:Ti位于第四周期ⅣB族,它的基态原子的电子组态为[Ar]3d24s2;Ge位于第四周期ⅣA族,它的基态原子的电子组态为[Ar]3d104s24p2;Ag位于第五周期ⅠB族,它的基态原子的电子组态为[Kr] 4d105s1;Rb位于第五周期ⅠA族,它的基态原子的电子组态为[Kr] 5s1;Ne位于第二周期0族,它的基态原子的电子组态为[He] 2s22p6。
北师大《无机化学》第四版习题答案——下册

第 13 章氢和稀有气体13-1 氢作为能源,其优点是什么?目前开发中的困难是什么?1、解:氢作为能源,具有以下特点:(1)原料来源于地球上储量丰富的水,因而资源不受限制;(2)氢气燃烧时放出的热量很大;(3)作为燃料的最大优点是燃烧后的产物为水,不会污染环境;(4)有可能实现能量的储存,也有可能实现经济高效的输送。
发展氢能源需要解决三个方面的问题:氢气的发生,氢气的储备和氢气的利用13-2 按室温和常压下的状态(气态液态固态)将下列化合物分类,哪一种固体可能是电的良导体?BaH 2;SiH 4;NH3;AsH3;PdH0.9 ;HI13-3 试述从空气中分离稀有气体和从混合气体中分离各组分的根据和方法。
3、解:从空气中分离稀有气体和从混合稀有气体中分离各组分,主要是利用它们不同的物理性质如:原子间不同的作用力、熔点沸点的高低以及被吸附的难易等差异达到分离的目的。
13-4 试说明稀有气体的熔点、沸点、密度等性质的变化趋势和原因?4、解:氦、氖、氩、氪、氙,这几种稀有气体熔点、沸点、密度逐渐增大。
这主要是由于惰性气体都是单原子分子,分子间相互作用力主要决定于分子量。
分子量越大,分子间相互作用力越大,熔点沸点越来越高。
密度逐渐增大是由于其原子量逐渐增大,而单位体积中原子个数相同。
13-5 你会选择哪种稀有气体作为:( a)温度最低的液体冷冻剂;( b)电离能最低安全的放电光源;( c)最廉价的惰性气氛。
+ +13-6 用价键理论和分子轨道理论解释HeH、HeH、He2 粒子存在的可能性。
为什么氦没有双原子分子存在?13-7 给出与下列物种具有相同结构的稀有气体化合物的化学式并指出其空间构型:(a) ICl - - -4(b)IBr2(c)BrO3(d)ClF7、解:XeF4平面四边形XeF2直线形XeO3三角锥XeO 直线形13-8 用 VSEPR理论判断XeF2 、 XeF4、 XeF6、 XeOF4 及 ClF 3 的空间构型。
无机化学_第四版_北师大版_课后答案(补充:1-11章)_khdaw

无机化学_第四版_北师大版_课后答案(补充:1-11章)_khdaw第一章原子结构与元素周期系1-14Br2分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解离需要吸收的最低能量子的波长与频率。
答:∵E=190kJ/mol∴每个分子解离所需要的能量为190×10-3/6.02×1023=3.156×10-19(J)所需吸收光子能量为E=hν=3.156×10-19J∴λ=c/ν=c·h/E=3×108×6.63×10-34/3.156×10-19=6.3×10-7(m)=630(nm)ν=4.76×10141-19氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁?答:氢原子莱曼系的跃迁吸收光子的波数公式为ǔ=1/λ=R H·(1/12-1/n2)已知波长λ=103nm=1.03×10-7m∴1/1.03×10-7=R H·(1/12-1/n2),R H=1.09677×10-7∴n=2.95≈3∴相应于氢原子电子从n=1的轨道向n=3的轨道跃迁的过程,即从K 层→M层轨道的跃迁1-21当电子的速度达到光速的20.0%时,该电子的德布罗意波长多大?当锂原子(质量7.02amu)以相同速度飞行时,其德布罗意波长多大?答:对电子,λ=h/mv=6.63×10-34×(9.11×10-31×3×108×20%)-1=1.21×10-11m=12.1(pm)对锂原子,其m=7.02×1.660×10-24×10-3=1.165×10-26(kg)∴λ=h/mv=6.63×10-34×(1.165×10-26×3×108×20%)-1 =9.48×10-16m=9.48×10-4(pm)1-23处于K、L、M层的电子最大可能数目各为多少?答:处于K层,即n=1,而每个能层能容纳的最大电子数目为2n2∴第K层:2×12=2(个)第L层:2×22=8(个)第M层:2×32=18(个)1-24以下哪些符号是错误的?(a)6s(b)1p(c)4d(d)2d(e)3p(f)3f答:(a)6s对;(b)1p错(因为n=1,则l只能是0,即s);(c)4d对;(d)2d错(因为n=2,则l可能是0,1,即s,p轨道);(e)3p对;(f)3f错(因为n=3,则l可能是0,1,3即s,p,d轨道)。
无机化学第四版(北京师范大学大学等)答案——下册

(a) ICl 4- (b)IBr 2- (c)BrO 3- (d)ClF7、 解: 4XeF 平面四边形 2XeF 直线形3XeO 三角锥 XeO 直线形13-8用 VSEPR 理论判断XeF 2 、XeF 4、XeF 6、XeOF 4及ClF 3的空间构型。
8、解: 2XeF 直线形 4XeF 平面四边形 6XeF 八面体 4XeOF 四方锥 4ClF 三角锥13-9用化学方程式表达下列化合物的合成方法(包括反应条件): (a) XeF 2 (b) XeF 6 (c) XeO 39、解: )()()(21.0,4002g XeF g F g Xe MPaC −−−−→−+︒ )()(3)(66,3002g XeF g F g Xe MPa C −−−−→−+︒ HF XeO O H XeF 63326+=+13-10 完成下列反应方程式: (1) XeF 2 + H 2O → (2) XeF 4 + H 2O → (3) XeF 6 + H 2O → (4) XeF 2 + H 2 → (5) XeF 4 + Hg → (6) XeF 4 + Xe → 10、解:2424224263262324222222226312232632212XeF Xe XeF HgF Xe XeF Hg HF Xe H XeF HF XeOF O H XeF HF XeO O H XeF HFO Xe XeO O H XeF OH F O Xe OH XeF =++=++=++=++=++++=++++=+--14-5 三氟化氮NF 3(沸点-129℃)不显Lewis 碱性,而相对分子质量较低的化合物NH 3 (沸点-33℃)却是个人所共知的Lewis 碱。
(a )说明它们挥发性差别如此之大的原因;(b )说明它们碱性不同的原因。
5、解:(1)NH 3有较高的沸点,是因为它分子间存在氢键。
(2)NF 3分子中,F 原子半径较大,由于空间位阻作用,使它很难再配合Lewis 酸。
北师大《无机化学》第四版习题参考答案

精心整理第八章水溶液8-1现需1200克80%(质量分数)的酒精作溶剂。
实验室存有浓度为70%的回收酒精和95%的酒精,应各取多少进行配置?解:令用浓度为70%的酒精X 克,95%的酒精Y 克。
(70%X+95%Y )/(X+Y )=80%①X+Y =1200②由①②得,X =720Y =4808-2(1(2(3(4解:(1所以c (2(3)(4)同理c(NH 3)=)()(233O H n NH n +=18/)28100()17/28(-+×100%=29.17% 8-3如何将25克NaCl 配制成质量分数为0.25的食盐水溶液?解:令加水X 克,依题意得0.25=25/(25+X),所以X =75克所以加水75克,使25克NaCl 配成25%的食盐水。
8-4现有100.00mLNa 2CrO 4饱和溶液119.40g ,将它蒸干后得固体23.88g ,试计算:(1)Na 2CrO 4溶解度;(2)溶质的质量分数;(3)溶液的物质的量浓度;(4)Na2CrO4的摩尔分数。
解:(1)令Na2CrO4溶解度为S所以S/(S+100)=23.88g/119.40g 所以S=25g(2)ω(Na2CrO4)=23.88g/119.40g×100%=20%(3)M(Na2CrO4)=162g/mol;molgg3)/162/(88.23--1(4)8-5在-1H2SO4g/100g (H2O8-6纯甲解:m8-7解:由解得:8-8⑴胰岛素的摩尔质量;⑵溶液蒸气压下降Δp(已知在25℃时水的饱和蒸气压为3.17kPa)。
解:(1)C=Π/RT=4.34KP a/8.314P a·L·mol-1×(273+25)K=0.00175mol·L-1摩尔质量=0.101g/0.00175mol·L-1×0.01L=5771.43g/mol(2)△P=P B*×X A=3170P a×n1/(n1+n2)≈3170P a×n1/n2=3170P a×(0.101g/5771.43g/mol)×(18g/mol)/(10×1g)=0.0998P a8-9烟草的有害成分尼古丁的实验式为C5H7N,今有496mg尼古丁溶于10.0g水中,所得溶液在101kPa下的沸点为100.17°C,求尼古丁的相对分子质量。
北师大《无机化学》第四版习题答案9

北师大《无机化学》第四版习题答案9第九章酸碱平衡9-1 以下哪些物种是酸碱质子理论的酸,哪些是碱,哪些具有酸碱两性请分别写出它们的共轭碱或酸。
SO -24, S -2, H 2PO -4, NH 3, HSO -4, [Al(H 2O)5OH]+2, CO -23, NH +4, H 2S, H 2O, OH -,H 3O +, HS -, HPO -24。
解:质子酸—共轭碱H 2PO -4 — HPO -24 HSO -4 — SO -24 [Al(H 2O)5OH]+2—[Al(H 2O)4(OH)2]+ NH +4 —NH 3 H 2S — HS - H 2O — OH - H 3O +— H 2O HS -—S -2 HPO -24 — PO -34质子碱—共轭酸 SO -24 — HSO -4 S -2 — HS - NH3 — NH +4 HSO -4— H 2SO 4[Al(H 2O)5OH]+2—[Al(H 2O)6]+3 CO -23 — HCO -3 H 2O — H 3O +OH -— H 2O HS -— H 2S HPO -24 — H 2PO -4酸碱两性:H 2PO -4, HSO -4, [Al(H 2O)5OH]+2, H 2O , HS -, HPO -24。
9-2 为什么pH=7并不总表明水溶液是中性的。
解:因为水的解离是一个明显的吸热过程,因此水的离子积是温度的函数,只有在常温下K w =×1014-,即[H +]=[OH -]=×107-,所以pH =7,其他温度下则不然。
9-3 本章表示电解质及其电离产物的浓度有两种,一种如c(HAc)、c(NH +4),另一种如[HAc],[NH +4]等,它们的意义有何不同什么情况下电离平衡常数的表达式中可以用诸如c(HAc)、c(NH +4)等代替诸如[HAc],[NH +4]等有的书上没有诸如c(HAc)、c(NH +4)这样的浓度符号,遇到浓度时一律用诸如[HAc],[ NH +4]等来表示,这样做有可能出现什么混乱解:c(HAc)、c(NH +4)用来表示初始状态的浓度,而[HAc],[ NH +4]用来表示平衡状态下的浓度。
北师大无机化学四版习题答案18章ds区金属

第18章d s 区金属18.l 为什么C u(II)在水溶液中比Cu(I)更稳定,Ag(I)比Ag(II)稳定,Au 易形成+III 氧化态化合物? 解:(1)Cu 2+离子半径比Cu +离子的小,而电荷又多一倍,所以Cu 2+的溶剂化作用要比Cu +的强得多;Cu 2+的水化能(-2121kJ ·mol -1)已超过铜的第二电离能。
所以Cu 2+在水溶液中比C u +稳足。
(2)Ag 2+和Ag +的离子半径都较大,其水化能相应就小,而且银的第二电离能又比铜的第二电离能大,因此Ag +比较稳定。
(3)金的离子半径明显比银的大,金的第3个电子比较容易失去,再加上d 8离子的平面正方形结构具有较高的晶体场稳定化能,这就使得金容易形成+Ⅲ氧化态。
18.2 简述:(1)怎样从闪锌矿冶炼金属锌?(2)怎样从辰砂制金属汞?解:(1)闪锌矿通过浮选法得到含有40%~60%ZnS 的精矿石,焙烧使其转化为ZnO ,再将ZnO 和焦炭混合在鼓风炉中加热至1373~1573K ,使Zn 以蒸气逸出,冷凝得到纯度为99%的锌粉:2ZnS+3O 2========= 2ZnO+2SO 2 2 C+O 2=======2COZnO+CO =======Zn(g)+CO 2↓(2)辰砂中制金属汞辰砂碎石经粉碎,浮选富集之后,在空气在中焙烧或与石灰共热,然后使汞蒸馏出来。
HgS+ O 2=======Hg+ SO 2↑ 4HgS+4CaO ====== 4Hg+3CaS+CaSO 418.3电解法精炼铜的过程中,粗铜(阳极)中的铜溶解,纯铜在阴极上沉积出来,但粗铜中的A g 、Au 、Pt 等杂质则不溶解而沉于电解槽底部形成阳极泥,Ni 、Fe 、Zn 等杂质与铜一起溶解,但并不在阴极上沉积出来,为什么?解:因电解过程是一个氧化还原的过程,从下面各金属离子电对的电极电势可以看出:Cu 2+的氧化能力大于Ni 2+、Fe 2+、Zn 2+而小于A g +、Au 3+、Pt 2+,所以在电解过程中,Ni 、Fe 、Zn 失去电子转入溶液中,而Ag 、Au 、Pt 沉入阳极底部。
北师大《无机化学》第四版习题答案6

第六章化学平衡常数6.1写出下列各反应的标准平衡常数表达式和实验平衡常数表达式:(1)2SO 2(g)+O 2(g)=2SO 3(g)(2)NH 4HCO(s)=NH 3(g)+CO 2(g)+H 2O(g)(3)CaCO 3(s)=CO 2(g)+CaO(S)(4)AgO=2Ag(s)+l/2O 2(g)(5)CO 2(g)=CO 2(aq)(6)Cl 2(g)+H 2O(l)=H +(aq)+Cl -(aq)+HClO(aq)(7)HCN(aq)=H +(aq)+CN -(aq)(8)Ag 2CrO 4(s)=2Ag +(aq)+CrO 42-(aq)(9)BaSO 4(s)+CO 32--(aq)=CaCO 3(s)+SO 42-(aq)(10)Fe 2+(aq)+1/4O 2(g)+2H +(aq)=Fe 3+(aq)+H 2O(l)解:(1)K ()()()2223/SO SO O p p p p p p θθθ⎡⎤⎡⎤⎡⎤=⋅⎢⎢⎢⎥⎢⎥⎢⎥⎢⎥⎣⎦⎣⎦⎣⎦排版注意:请将符号Θ改为θ下同。
()2222()()/p SO SO O K p p p =⋅(2)K322()()()NH CO H O p p p p p pθθθ=⋅⋅322()()()p NH CO H O K p p p =⋅⋅(3)K2()CO p p θ=2()p CO K p =(4)K 21/2()O p p θ⎡⎤=⎢⎥⎣⎦2()p O K p =(5)K 22()()/CO CO c p c pθθ=22()()/CO CO K c p =(6)K 2()()()/ClH Cl HClO c c p c c c c p θθθθ+-=⋅⋅2()()()/HClO Cl H Cl K c c c p +-=⋅⋅(7)K ()()()/CN H HCN c c cc c c θθθ-+⎡⎤=⋅⎢⎥⎢⎥⎣⎦()()()/c HCN H CN K c c c +-=⋅(8)K 242()()CrO Ag c c c c θθ-+⎡⎤=⋅⎢⎥⎢⎥⎣⎦242()()c Ag CrO K c c +-=⋅(9)K2234()()/CO SO c c c cθθ--=2243()()/c SO CO K c c --=(10)K32221/2()()()()/O Fe Fe H c c c p c c p c θθθθ+++⎡⎤⎡⎤=⋅⋅⎢⎥⎢⎥⎢⎥⎣⎦⎣⎦K实验3221/22()()()()/O Fe Fe H c c p c +++=⋅⋅评注:除非固体为混合物而且活度系数不等于1,在化学平衡中又会发生变化,否则在平衡常数表达式中没有固体。
北师大无机化学习题解答]_《无机化学》(第四版,吴国庆,高等教育出版社)习题答案
![北师大无机化学习题解答]_《无机化学》(第四版,吴国庆,高等教育出版社)习题答案](https://img.taocdn.com/s3/m/7c4cbdf00b4c2e3f5627631c.png)
第一章物质的结构1-1 在自然界中氢有三种同位素,氧也有三种同位素,问:总共有种含不同核素的水分子?由于3H太少,可以忽略不计,问:不计3H时天然水中共有多少种同位素异构水分子?1-2 天然氟是单核素(19F)元素,而天然碳有两种稳定同位素(12C和13C),在质谱仪中,每一质量数的微粒出现一个峰,氢预言在质谱仪中能出现几个相应于CF4+的峰?1-3 用质谱仪测得溴得两种天然同位素的相对原子质量和同位素丰度分别为79Br 789183占50。
54%,81Br 80。
9163占49。
46%,求溴的相对原子质量(原子量)。
1-4 铊的天然同位素203Tl和205Tl的核素质量分别为202。
97u和204。
97u,已知铊的相对原子质量(原子量)为204。
39,求铊的同位素丰度。
1-5 等质量的银制成氯化银和碘化银,测得质量比m(AgCl):m(AgBr)=1。
63810:1,又测得银和氯得相对原子质量(原子量)分别为107。
868和35。
453,求碘得相对原子质量(原子量)。
1-6 表1-1中贝采里乌斯1826年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大差别?1-7 设全球有50亿人,设每人每秒数2个金原子,需要多少年全球的人才能数完1mol金原子(1年按365天计)?1-8 试讨论,为什么有的元素的相对质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-9 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应的产物只有氢,应怎样理解这个事实?1-10 中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万物”,请对比元素诞生说与这种古代哲学。
1-11 “金木水火土”是中国古代的元素论,至今仍有许多人对它们的“相生相克”深信不疑。
与化学元素论相比,它出发点最致命的错误是什么?1-12 请用计算机编一个小程序,按1.3式计算氢光谱各谱系的谱线的波长(本练习为开放式习题,并不需要所有学生都会做)。
北师大《无机化学》第四版习题答案

第十二章 配位平衡12-1 在1L 6 mol ·L -1的NH 3水中加入0.01 mol 固体CuSO 4,溶解后加入0.01 mol 固体NaOH ,铜氨络离子能否被破坏(K 稳[Cu(NH 3)42+]=2.09×1013,K SP [Cu(OH)2]=2.2×10-20) 解:CuSO 4在过量的氨水溶液中几乎完全形成[Cu(NH 3)4]2+,则[Cu(NH 3)4]2+ === Cu 2+ + 4NH 3平衡时: 0.01-x x (6-0.04)+4x铜氨络离子不能被破坏。
12-2 在少量N H 4S C N 和少量Fe 3+同存于溶液中达到平衡时,加入NH 4F 使[F -]=[SCN -]= 1 mol ·L-1,问此时溶液中[FeF 63-]和 [Fe(SCN)3]浓度比为多少(K 稳[Fe(SCN)3]=2.0×103,K 稳[FeF 63-]= 1×1016) 解: ---+=+SCN FeF F SCN Fe 3][6])([36312-3 在理论上,欲使1×10-5 mol 的AgI 溶于1 cm 3氨水,氨水的最低浓度应达到多少事实上是否可能达到这种浓度(K 稳[Ag(NH 3)2+]=1.12×107,K SP [AgI]=9.3×10-17) 解: -++=+I NH Ag NH AgI ])([2233起始浓度 a 0 0达到平衡时 a-2x x x (全部溶解时:101.0-⋅=L mol x )此反应的平衡常数:9177231004.1103.91012.1)(})({--+⨯=⨯⨯⨯=⨯=AgI Ksp NH Ag K K 稳因此: 9221004.1]2[(-⨯=-=x a x K 1310-⋅=L mol a 事实上不可能达到这种浓度。
12-4 通过配离子稳定常数和Zn 2+/Zn 和Au +/Au 的标准电极电势计算出Zn(CN)42-/Zn 和Au(CN)2-/Au 的标准电极电势,说明提炼金的反应:Zn + 2Au(CN)2-===Zn(CN)42-+ 2Au 在热力学上是自发的。
北师大无机化学四版习题答案19章d区金属一

第19章d区金属(一)第四周期d区金属19.1 试以原子结构理论说明:(1)第四周期过渡金属元素在性质上的基本共同点;(2)讨论第一过渡系元素的金属性、氧化态、氧化还原稳定性以及酸碱稳定性变化规律;(3)阐述第一过渡系金属水合离子颜色及含氧酸根颜色产生的原因。
答:(1)①第四周期过渡金属元素都具有未充满的3d轨道,特征电子构型为(n-1)d1~10ns1~2,具有可变的氧化态。
电离能和电负性都比较小,易失去电子呈金属性,故具有较强的还原性。
②与同周围主族元素的金属相比,第一过渡系金属原子一般具有较小的原子半径和较大的密度。
③由于过渡金属的d电子和s电子均可作为价电子参与金属键的形成,金属键较强,因此它们有较大的硬度,有较高的熔、沸点。
(2)第一过渡系元素为Sc、Ti、V、C r、Mn、F e、C o、N i、C u、Zn从Sc→Zn,金属性:逐渐减弱;最高氧化态:先逐渐升高,到锰为最高,再逐渐降低;氧化还原性:金属的还原性逐渐减弱,最高氧化态含氧酸(盐)的氧化性逐渐增强;酸碱稳定性:从钪到锰最高氧化态氧化物及其水合物酸性增强、碱性减弱,同一元素不同氧化态氧化物及水合物一般是低氧化态的呈碱性,最高氧化态的呈酸性。
(3)①由于过渡金属离子具有未成对d电子,易吸收可见光而发生d-d跃迁,故过渡系金属水合离子常具有颜色。
②第一过渡系金属含氧酸根离子VO3-、CrO42-、MnO4-,呈现颜色是因为化合物吸收可见光后电子从一个原子转移到另一个原子而产生了荷移跃迁,即电子从主要是定域在配体上的轨道跃迁到主要是定域在金属上的轨道(M←L),对于含氧酸根离子则是发生O22-→M n+的荷移跃迁。
19.2 Sc2O3在哪些性质上与Al2O3相似,为什么?答:(1)都为碱性氧化物。
在Sc3+、Al3+溶液中加碱得水合氧化物M2O3·nH2O(M=Sc、Al)。
(2)其水合氧化物都是两性的,溶于浓碱NaOH得Na3[M(OH)6],溶于酸得到M3+盐,其水溶液易水解。
《无机化学》(北师大等校第四版)答案

由斥力顺序可知,∠l-O-O>∠O-O-O即∠O-O-O<109o28’ ∠l-O-O>109o28’,但∠O-O-O>90o,因为∠O-O-O<90o时,斥力变大不利于分子的稳定,故O3-的键角应为100o,属于以上范围,很符合VSEPR模型。
1-47.解:氟的电负性最大。铯的电负性最小
1-50 答:ⅣB族,铜,银,金和稀有气体。
1-52答:从上到下,同族元素氧化态稳定性增强,但第五周期非金属的氧化态很不稳定,第六周期的汞,铊,铅,铋的最稳定氧化态不是族序数,而是0,+1,+2,+3,第Ⅷ族从左到右最高氧化态的稳定性下降,从上到下最高正氧化态稳定性增强。
(4)XeF2:由VSEPR模型知,XeF2分子属于AY5型分子,AY5的空间构型为三角双锥体,为保证两个Xe不能垂直。略去电子后,XeF2分子应为角形分子,但夹角一定不为90o,其夹角为120o>∠Xe-F-Xe>90o范围内。
(5)SF6:由VSEPR模型知,SF6属AY6型分子,空间构型为正八面体,即其键角为90o。
第二章分子结构
2-1解:O2:.. .. H2O2: .. ..
: O=O: H—O—O—H
共12e共14e
CO: .. CO2: .. ..
:C=O: :O=C=O:
共10e共16e
NCl3.. SF4
F
Cl|
F—S—F
N ..|
FCl Cl共3来自e共26e2-3答:LiH: Li的电子排布:1s22s1H的电子排布:1s1
当λ=320nm时,则此时光的能量E=5.64×10-19>E最低,所以会解离
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十二章 配位平衡12-1 在1L 6 mol ·L -1的NH 3水中加入0.01 mol 固体CuSO 4,溶解后加入0.01 mol 固体NaOH ,铜氨络离子能否被破坏?(K 稳[Cu(NH 3)42+]=2.09×1013,K SP [Cu(OH)2]=2.2×10-20) 解:CuSO 4在过量的氨水溶液中几乎完全形成[Cu(NH 3)4]2+,则[Cu(NH 3)4]2+ === Cu 2+ + 4NH 3平衡时: 0.01-x x (6-0.04)+4x1342431009.2)496.5()01.0(])([⨯=+⋅-=+x x x NH Cu K 稳 11910792.3--⋅⨯=L mol x ])([108.3)01.0(10792.3]][[22321922OH Cu K OH Cu sp <⨯=⨯⨯=---+铜氨络离子不能被破坏。
12-2 在少量N H 4S C N 和少量Fe 3+同存于溶液中达到平衡时,加入NH 4F 使[F -]=[SCN -]= 1 mol ·L -1,问此时溶液中[FeF 63-]和 [Fe(SCN)3]浓度比为多少?(K 稳[Fe(SCN)3]=2.0×103,K 稳[FeF 63-]= 1×1016)解: ---+=+SCN FeF F SCN Fe 3][6])([363 123163633663336105102101)]([][])([][]][)([]][[⨯=⨯⨯====-----SCN Fe K FeF K SCN Fe FeF F SCN Fe SCN FeF K 稳稳12-3 在理论上,欲使1×10-5 mol 的AgI 溶于1 cm 3氨水,氨水的最低浓度应达到多少?事实上是否可能达到这种浓度?(K 稳[Ag(NH 3)2+]=1.12×107,K SP [AgI]=9.3×10-17) 解: -++=+I NH Ag NH AgI ])([2233 起始浓度 a 0 0达到平衡时 a-2x x x (全部溶解时:101.0-⋅=L mol x )此反应的平衡常数:9177231004.1103.91012.1)(})({--+⨯=⨯⨯⨯=⨯=AgI Ksp NH Ag K K 稳 因此: 9221004.1]2[(-⨯=-=x a x K 1310-⋅=L mol a 事实上不可能达到这种浓度。
12-4 通过配离子稳定常数和Zn 2+/Zn 和Au +/Au 的标准电极电势计算出Zn(CN)42-/Zn 和Au(CN)2-/Au 的标准电极电势,说明提炼金的反应:Zn + 2Au(CN)2-===Zn(CN)42-+ 2Au 在热力学上是自发的。
解: Au CN Zn CN Au Zn 2)()(2242+=+--V Zn Zn 7618.0)/(2-=+θφ V Au Au 692.1)/(=+θφ1624100.5]])(([⨯=-CN Zn K 稳 332100.2]])(([⨯=-CN Au K 稳VCN Zn K Zn Zn Zn CN Zn 26.1)100.5lg(20592.07618.0 ])((lg[20592.0)/()/)((1624224-=⨯--=-=-+-稳θθφφVCN Au K n Au Au Au CN Au 28.0)100.2lg(10592.0692.1 ])([lg[0592.0)/()/)((3322-=⨯-=-=-+-稳θθφφAu CN Zn CN Au Zn 2)()(2242+=+--将反应Au CN Zn CN Au Zn 2)()(2242+=+--设计成原电池正极: ---+=+CN Au e CN Au 2)(2 负极:---=-+24)(24CN Zn e CN Zn098.0)26.1(28.0)/)(()/)((242>=---=-=--V Zn CN Zn Au CN Au E θθθφφ反应能正向自发。
12-5 为什么在水溶液中Co 3+(aq)离子是不稳定的,会被水还原而放出氧气,而3+氧化态的钴配合物,例如Co(NH 3)63+,却能在水中稳定存在,不发生与水的氧化还原反应?通过标准电极电势作出解释。
(稳定常数:[Co(NH 3)62+] 1.38×105;[Co(NH 3)63+] 1.58×1035, 标准电极电势Co 3+/Co 2+ 1.808V ;O 2/H 2O 1.229V ;O 2/OH - 0.401V , K b (NH 3)=1.8×10-5) 解:(1)+++++=+H O Co O H Co 44242223设计成原电池:正极: )()(23aq Co e aq Co +-+=+ V Co Co 808.1)/(23=++θφ负极:+-+=-H O e O H 44222V O H O 229.1)/(22=θφ0579.0229.1808.1)/()/(2223>=-=-=++V O H O Co Co E θθθφφ(2)φӨ[Co(NH 3)63+/Co(NH 3)62+]= φӨ (Co 3+/Co 2+)-0.0592lg{K 稳[Co(NH 3)63+]/K 稳[Co(NH 3)62+]}= 1.808-0.0592lg[(1.58×1035)/(1.38×105)]=0.028VO H O NH Co OH NH Co 222633632])([44])([4++=++-+设计成原电池:正极:+-+=+263363])([])([NH Co e NH Co φӨ=0.028V 负极:--=++OH e O O H 44222-++=+OH NH O H NH 4231 0 01-x x x52108.11-⨯=-=xx K b131024.4--⋅⨯≈L mol xV OH OH O OH O 54.0]lg[40592.0)/()/(422=+=----θφφ -<+φφ 反应不能正向进行。
12-6 欲在1L 水中溶解0.10 mol Zn(OH)2,需加入多少克固体NaOH ?(K 稳[Zn(OH)42-]=4.6×1017,K SP [Zn(OH)2]=1.2×10-17) 解: --=+242])([2)(OH Zn OH OH Zn52.5102.1106.4)(171724=⨯⨯⨯==--Ksp OH Zn K K 稳--=+242])([2)(OH Zn OH OH Zn平衡浓度 (a -0.2)+2x 0.10-x52.5]2)2.0[(10.02=+--=x a x K 完全溶解时,x=0, g 13L 0.33mol a -1=⋅=12-7 在pH=10的溶液中需加入多少NaF 才能阻止0.10 mol ·L -1的Al 3+溶液不发生A l (O H )3沉淀?(K 稳[AlF 63-]=6.9×1019,K SP [Al(OH)3]=1.3×10-20) 解:---+=+OH AlF F OH Al 3][6)(363897.0103.1109.6]][[][]][[2019633336=⨯⨯⨯=⋅==--++--Ksp K F Al Al OH AlF K 稳 设加入NaF 的浓度为a -1L mol ⋅,---+=+OH AlF F OH Al 3][6)(363平衡浓度 (a -0.60)+6x 0.10-x 10-4 x 很小时,平衡常数表达式可近似为:897.0]6.0[]10[10.0][]][[6346336=-⨯==----a F OH AlF Ka=0.607 mol ·L -112-8 测得Cu| Cu(NH 3)42+(1.00 mol ·L -1),NH 3(1.00 mol ·L -1) || H +(1.00 mol ·L -1) |H 2 (1bar),Pt 的电动势为0.03V ,试计算Cu(NH 3)42+的稳定常数。
解:电池反应式:正极:222H e H =+-+ 负极:-++=+e NH Cu NH Cu 2])([42433)/)((003.0243Cu NH Cu E +-==θφV Cu NH Cu 03.0)/)((243-=+θφ03.0)(lg 0296.034.0)(lg 20592.0)/()/)((2432432243-=-=-=++++NH Cu K NH Cu K Cu Cu Cu NH Cu 稳稳θθφφ122431016.3)(⨯=+NH Cu K 稳12-9 硫代硫酸钠是银剂摄影术的定影液,其功能是溶解未经曝光分解的AgBr 。
试计算,1.5 L 1.0mol ·L -1的Na 2S 2O 3溶液最多能溶解多少克AgBr ?(K 稳[Ag(S 2O 3)23-]=2.8×1013;K SP [AgBr]= 5.0 ×10-13)解: ---+=+Br O S Ag O S AgBr 3232232])([2 设能溶解a -1L mol ⋅平衡浓度 1.0-2a a a14108.2100.5)(1313=⨯⨯⨯=⋅=-稳K AgBr K K sp14)]20.1[(22=-=a a K 144.0-⋅=L mol a 1.5L 溶液中溶解的量=1.5×0.44×187.77=124 g12-10 定性地解释以下现象:(1)铜粉和浓氨水的混合物可用来测定空气中的含氧量。
答: 反应方程式为:-++=+++OH NH Cu NH O H O Cu 4)(2822243322可根据生成的Cu(NH 3)42+的量,得到空气中氧的含量。
(2)向Hg(NO 3)2滴加KI ,反过来,向KI 滴加Hg(NO 3)2,滴入一滴时,都能见很快消失的红色沉淀,分别写出沉淀消失的反应。
答: Hg 2+ + 2I - == HgI 2↓(红色)向Hg(NO 3)2滴加一滴KI 时,HgI 2(红色) + Hg 2+ === 2[HgI]+向KI 滴加一滴Hg(NO 3)2时,HgI 2(红色) + I - === [HgI 3]-(3)用乙醇还原K 2Cr 2O 7和硫酸的混合溶液得到的含Cr 3+的溶液的颜色是深暗蓝紫色的,放置蒸发水分后能结晶出KCr(SO 4)2·12H 2O 紫色八面体晶体,若为加快蒸发水分,将该溶液加热,溶液颜色变为绿色,冷却后不再产生紫色的铬矾晶体。
