铂系元素及其化合物
铂系元素析氢反应催化剂

铂系元素析氢反应催化剂铂系元素析氢反应催化剂是指含有铂(Pt)、铑(Rh)、钯(Pd)等化学元素的催化剂,广泛应用于化学、汽车等行业中。
在化学反应中,析氢反应催化剂能够促进反应的速率,提高反应的效率。
下面,我们将分步骤地阐述铂系元素析氢反应催化剂的相关知识。
一、铂系元素的基本介绍铂系元素是指位于第八族周期表中的铂族元素,包括铂、铑、钯、钌、铱和锇。
这些元素的共同特点是具有良好的化学稳定性和催化活性,尤其是铂、铑、钯在化学反应中表现出色,因此被广泛应用于化学、汽车等领域。
二、铂系元素的析氢反应催化作用催化是指通过添加小量的某种物质,使化学反应快速进行的过程。
铂系元素是典型的催化剂,其中铂、铑、钯在析氢反应中表现尤为突出。
析氢反应是指将水分子经过一系列的化学反应,分解为氢气和氧气的过程。
铂系元素在反应中起到的作用是提高反应的速率和效率,使氢气分解更加彻底。
铂和铑的催化活性最强,它们的活性中心都是空缺的金属电子,因此容易吸附氢气分子,促进反应的进行。
钯的催化活性稍弱,但其成本较低,在一些实际应用中仍具有重要作用。
三、铂系元素析氢反应催化剂的应用铂系元素析氢反应催化剂具有广泛的应用前景,尤其是在化学、汽车领域中。
例如,在化学工业中,催化剂广泛用于合成氢气、甲醇等有机化合物;在汽车工业中,催化剂用于催化废气中的氧化反应,减少对环境的污染。
除此之外,铂系元素还被广泛用于金属制品的表面处理和电子设备领域,包括飞机部件、电子电路、硬盘驱动器等。
可以说,铂系元素的析氢反应催化剂已经成为现代工业中不可或缺的重要材料。
总之,铂系元素析氢反应催化剂是一种高效、广泛应用的催化剂,其在化学、汽车等领域中具有重要的应用前景。
通过加强对其作用机理的研究,不断提高其催化活性和稳定性,铂系元素将在未来的应用中发挥更为重要的作用。
钌

制备方法
钌衍生自铂金属矿石。生产方法取决于矿石类型。但是,萃取过程与其他贵金属(参见铂,铑和铱)相似。 像铑一样,钌可以从某些类型的矿石电解精炼镍或铜时,从累积的阳极污泥中获得。钌元素存在于铱和的天然合 金(铱,亚硫酸盐)中,硫化物和其他矿石(戊铁矿,月桂石等)中也有少量商业上可回收的 。
通过与王水处理(分离不溶的铑,钌和铱),与硫酸氢钠(与铑起反应)融合以及与过氧化钠融合(与硅酸 钠溶解)的顺序将元素与其他铂金属分离。用乙醇处理所得的钌酸和渗透酸溶液,以沉淀出二氧化钌 。
研究简史
钌的发现过程 :钌是铂系元素中在地壳中含量最少的一个,也是铂系元素中最后被发现的一个。它在铂被 发现100多年后,比其余铂系元素晚40年才被发现。不过,它的名字早在1828年就被提出来了。当时俄国人在乌 拉尔发现了铂的矿藏,塔尔图大学化学教授奥桑首先研究了它,认为其中除了铂外,还有三个新元素。奥桑把他 分离出的新元素样品寄给了贝齐里乌斯,贝齐里乌斯认为其中只有pluranium一个是新金属元素,其余的分别是 硅石和钛、锆以及铱的氧化物的混合物。
2、钌系电阻浆料:电导电材料(二氧化钌、钌酸铋、钌酸铅等)玻璃粘结剂、有机载体等组成的使用最广泛 的一种电阻浆料,具有阻值范围宽、电阻温度系数低、阻值重现性好、环境稳定的性好等优点,用于制作高性能 电阻和高可靠精密电阻络 。
3、超细水合二氧化钌粉:有于生产厚膜电阻浆料或催化剂用的黑色或蓝黑色超细粉未,其中钌的质量分数为 60%~71%。粉未的平均粒度<1.0um,松装密度为0.5~0.9g/cm,振实密度为1.0~1.4g/cm-3。
4、钌基厚膜电阻浆料:由二氧化钌粉、钌酸盐、无机添加物和有机载体组成的一种满足于印制或涂敷的膏状 物,用于厚膜混合集成电路、电阻络。钌电阻浆料的烧成条件为烧成峰值温度840~860℃,峰值温度保温时间 8~10min,烧结周期30~60min。
铑(Rh)

铑的溶解
水溶液化学溶解法
水溶液化学溶解法是指用 HCl + 氧化剂溶解,常用的氧化剂有 HNO3、 H2O2、 Cl2、 NaClO3 等。由 于铑的化学性质极其惰性,有时需要改变溶解条件, 以加速溶解。
中温熔融法
含铑量较高的粉状物料及纯铑粉的溶解比铂钯物料更加困难,目前国内生产中应用较多的方法 有:KHSO4 熔融法、 现时间1803年 核电荷数45 外文名:rhodium
铂族元素 包括:铂(Pt)、钯(Pd)、锇 (Os)、铱(Ir)、钌(Ru)、铑 (Rh)六种金属元素
•
银
3.4 元/克
•
铱
131.5 元/克
• 铂
229.57 元/克
• 金
235.7元/克
•铑
267.5 元/克
铑的性质
其他方面的的应用
主要用于电镀业,将其电镀在其它金属表面, 镀层色泽坚固,不易磨损,反光效果好 铂铑合金热电偶,用于测温
铑的分离提纯
溶液中的铂族元素比较稳定的价态分别为: Pt( Ⅳ) 、 Ir( Ⅳ) 、 Rh( Ⅲ) 、 Pd( Ⅱ) 、 Ru( Ⅲ) , 由于亚硝酸钠是弱还原剂,能将高价 的 Pt( Ⅳ) 、 Ir( Ⅳ) 还原为Pt( Ⅱ) 、 Ir( Ⅲ) ,生 成稳定性很好的亚硝酸盐络合物。由于亚硝酸 盐络合物很稳定,在 pH =8 -10 时不发生水解, 而贱金属都水解生成氢氧化物沉淀,实现铂族 元素与贱金属的分离。 分离了贱金属的溶液中加入氯化铵,Rh生 成铵钠六亚硝酸盐沉淀;而 Pt、 Pd、 Ru 生成 可溶性的铵硝基络合物,达到 Rh、 Ir 与 Pt、 Pd 分离的目的。用亚硝酸钠络合法分离 Rh 与 Pt、 Pd,反复络合 2 - 3 次,就得到合格的铑 溶液。
锇元素矿物

锇元素矿物锇元素的性质锇元素是一种铂系元素,原子序数为76,化学符号为Os。
它是一种重金属,密度非常大,比铂元素还要大。
锇元素的硬度非常高,它具有良好的耐磨性和耐腐蚀性,因此在一些特殊的工业领域中有着重要的用途。
锇元素的矿物由于锇元素非常罕见,因此很少有锇矿物被发现。
目前已知的锇矿物主要有锇铂矿、铅锇矿和其他少量的含锇矿物。
这些矿物通常与其他铂系元素矿物一起存在,它们通常形成的矿床也非常罕见。
在地质学家和矿物学家的长期努力下,一些锇矿物的新种类也不断被发现。
锇元素的用途锇元素在工业和科学研究中有着广泛的用途。
由于其良好的耐磨性和耐腐蚀性,锇元素被用于制造一些特殊的工业材料,如高温合金、化工设备、工具等。
此外,锇元素还被用于一些特殊的电子元件和材料,如传感器、电子触头等。
锇元素还被用于制造贵金属催化剂,它在一些化工反应中具有良好的催化活性。
除了工业应用外,锇元素在医学和科学研究中也有着重要的用途。
锇元素的同位素被用于放射治疗和医学诊断。
锇元素还可以被用于标记化合物、追踪化学反应和研究环境中的污染物等。
锇元素的研究进展随着工业和科学技术的迅速发展,对锇元素的研究也在不断进行。
地质学家和矿物学家们通过对锇矿物的采集、分离和分析,不断了解锇元素在地壳中的分布规律和矿床成因。
化学家和材料科学家们通过合成新型锇化合物和合金,不断探索锇元素在材料科学和工程中的应用。
放射化学家和医学科学家们通过对锇元素同位素的研究,不断开发新的放射治疗和医学诊断方法。
另外,随着对锇元素的认识不断深入,人们对锇元素的环境影响和生物学效应也越来越关注。
一些研究表明,锇元素在环境中的聚集和生物富集现象可能会对人类健康和生态系统产生潜在的影响,因此需要进一步加强对锇元素的环境和生物学研究。
结论总的来说,锇元素是一种非常罕见但具有重要用途的元素。
它在工业、医学和科学研究中都有着广泛的应用前景。
随着对锇元素的研究不断深入,人们不仅可以更好地利用锇元素的优良性质,还可以更好地保护环境和人类健康。
铂及铂族金属

十七、鉑及鉑族金屬(一)鉑族金屬的性質、用途及礦產資源概況鉑族金屬(platinum group elements,簡稱PGE)包括釕(Ru)、銠(Rh)、鈀(Pd)、鋨(Os)、銥(Ir)、鉑(Pt)六個元素。
其中釕、銠、鈀為輕鉑族金屬(比重11~12),鋨、銥、鉑稱為重鉑族金屬(比重21.4~22)。
鉑族金屬的合金具有耐高溫、耐磨擦的特性。
在高溫下強度大,具有高延展性和低膨脹系數,熱電的穩定性好。
全世界鉑的儲量,主要分布在南非、蘇聯、加拿大、哥倫比亞、美國和澳大利亞等國。
南非鉑產量占全世界的三分之二。
鈀的主要產地是蘇聯,其次是南非。
(二)鉑族金屬的地球化學特徵鉑族元素具有親鐵性,鈀、鉑、銠還具有親硫性,尤以鈀最明顯,因此易與鐵、鎳、鉛、銅、錫形成金屬鍵的化合物。
Os4+、Ru4+、Ir4+、Ir3+高價離子易與硫、砷、銻、鉍、碲、硒等形成離子鍵化合物。
在自然界鉑族元素獨立礦物較少,常見的有自然鉑和鉑族元素互化物。
鉑族元素在地函中含量較高,隕石內的含量平均為:Pt 2.0g/t,Pd 1.3g/t,Os 1.0g/t,Ir 0.7g/t,Rh 0.5g/t,Ru 1.3g/t。
在地殼中,鉑族元素多富集於基性、超基性岩石中。
在岩漿結晶分化作用過程中,鉑族金屬主要富集於鎂鐵質橄欖岩及純橄欖岩中,與鉻鐵礦共生;在蘇長岩、輝長岩中則與銅鎳硫化物緊密伴生。
在熱液作用中,鉑族元素表現出親硫性,常伴隨銅、鉬、鐵、鎳等元素遷移,在一定條件下以自然鉑型式包含於磁黃鐵礦、黃銅礦、輝鉬礦、鎳黃鐵礦、砷鎳礦等硫化物和硫砷化物中,但一般不具工業意義。
表生作用過程中,鉑族元素礦物較穩定,在有利條件下可富集成砂礦,有時也可形成鈀華(Palladinite, PdO)和銻鈀華(Stibiopalladinite, Pd5Sb2)等次生礦物。
不同的鉑族金屬元素其地球化學特徵亦有差異:鉑:是較穩定的化學元素,為鉑族元素中分布最廣的元素之一,在純橄欖岩中含量最高。
铂族——铂与钯

铂金的六大特点
1.Βιβλιοθήκη 度最高铂的合金里有95%的纯铂而18K金为75%的黄金。一件铂金首饰比黄金首饰有更高的纯度。
2.最稀有性
每年世界上产140吨铂金,而黄金年产3300吨。
3.只有技艺熟练的工匠才能制作,铂金的熔点较之黄金更高,因此对
工人的技术要求也就更加熟练。
4.最稳定性
铂族—铂&钯(ba)
铂族金属既具有相似的物理化学性质,又有各自的 特性。它们的共同特性是:除了锇和钌为钢灰色外, 其余均为银白色;熔点高、强度大、电热性稳定、 抗电火花蚀耗性高、抗腐蚀性优良、高温抗氧化性 能强、催化活性良好。各自的特性又决定了不同的 用途。例如铂还有良好的塑性和稳定的电阻与电阻 温度系数,可锻造成铂丝、铂箔等;它不与氧直接 化合,不被酸、碱侵蚀,只溶于热的王水中;钯可 溶于浓硝酸,室温下能吸收其体积350~850倍的氢 气。铑和铱不溶于王水,能与熔融氢氧化钠和过氧 化钠反应,生成溶解于酸的化合物;锇与钌不溶于 王水,却易氧化成四氧化物。
1、色泽 铂金呈银白色或灰白色,界于白银与镍的颜色之间。白银光泽洁白,容易被氧化带黑点或 呈黑色;质地细腻光滑;硬度比铂金低一些。 2、比重 铂金比重大,为15~19或21.4。白银的比重为10.49。用手掂量同等大小的铂金和白银饰 品,就会发现它们的差别。 3、火烧 纯铂金加热或火烧冷却以后,其颜色不变。白银火烧以后,其表面会呈现润红色或黑红色 调。 4、折弯 纯净的铂金容易折弯和掰直还原;成色较低的,性硬且脆,弯折费力。 5、听音 敲击时,若发出“托托”声音而无韵者,则是较纯的铂金;若发出“叮叮”尖声,有声有韵者, 则是成色较低的铂金。
pd是什么化学元素

pd是什么化学元素钯(Palladium),是第五周期Ⅷ族铂系元素,元素符号Pd,单质为银白色过渡金属,质软,有良好的延展性和可塑性,能锻造、压延和拉丝。
块状金属钯能吸收大量氢气,使体积显著胀大,变脆乃至破裂成碎片。
钯在1803年由英国化学家武拉斯顿从铂矿中发现,是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。
发现过程编辑播报1803年,英国化学家武拉斯顿从铂矿中又发现了一个新元素。
他将天然铂矿溶解在王水中,除去酸后,滴加氰化汞(Hg(CN)2)溶液,获得黄色沉淀。
将硫磺、硼砂和这个沉淀物共同加热,得到光亮的金属颗粒。
他称它为palladium(钯),元素符号定为Pd。
这一词来自当时发现的小行星Pallas,源自希腊神话中司智慧的女神巴拉斯Pallas。
武拉斯顿发现钯重要的一步是选用氰化汞。
尽管氰化汞溶液中几乎不含有氰离子(CN-),但是当钯的离子(Pd2+)与它相遇时,却立即生成淡黄色的氰化钯(Pd(CN)2)沉淀,而其他铂系元素是不会形成这种氰化物沉淀的。
物理性质编辑播报钯是银白色过渡金属,较软,有良好的延展性和可塑性,能锻造、压延和拉丝。
块状金属钯能吸收大量氢气,使体积显著胀大,变脆乃至破裂成碎片。
常温下,1体积海绵钯可吸收900体积氢气,1体积胶体钯可吸收1200体积氢气。
加热到40~50℃,吸收的氢气即大部释出,广泛地用作气体反应,特别是氢化或脱氢催化剂,还可制作电阻线、钟表用合金等。
第五周期Ⅷ族铂系元素元素类型:金属元素原子序数:46质子数:46原子量:106.42熔点:1554℃沸点:2970℃密度:12.02g/cm3(20℃)莫氏硬度:4.75声音在其中的传播速率:3070m/s元素含量:在太阳中的含量:0.003ppm、太平洋表面:0.000000019ppm、地壳中含量:0.0006ppm化学性质编辑播报主要化合物二氯化钯(PdCl2)、四氯钯酸钠(Na2PdCl4)和二氯四氨合钯。
首饰贵金属材料及工艺学:铂1

奥沙利铂(Oxaliplatin)为第三代铂类抗癌药物,是第一个显现对结肠癌有效的络铂 类烷化剂及在体内外均有广谱抗肿瘤活性的铂类抗癌药。它对耐顺铂的肿瘤细胞亦 有作用。 奥沙利铂对大肠癌、非小细胞肺癌、卵巢癌及乳腺癌等多种肿瘤细胞株,包括对顺 铂和卡铂耐药株均有显著的抑制作用。同时,奥沙利铂对胃肠道、肝、肾和骨髓毒 性较第一代的顺铂和第二代的卡铂明显减轻,耐受性良好。因此,国际临床肿瘤学 专家普遍认为,奥沙利铂可能是治疗大肠癌最有希望的一种新药。此外,它对非小 细胞肺癌、卵巢癌、恶性淋巴瘤及头颈部肿瘤等也有较好的疗效。
PtF6
铂(IV)的氯化物的分子模型
铂的晶型
铂(IV)的氧化物的分子模型
铂的应用
铂有许多优良性质,如高度的催化活性,良好的高温抗氧化,抗腐蚀作用,以及熔点 高,蒸气压小,延展性好,热稳定性高等性能,因此在石油,化工,国防和科研等部门具 有广泛用途.从其应用领域来看,铂主要用于汽车尾气净化剂及首饰业.
2Pt+3Cl2 400.C 2PtCl3
2Pt+Cl2
581~583.C
2PtCl
Pt+2X2 127.C PtX4(X=Br,I)
Pt(粉)+S(粉)
PtS
Pt的价电子构型为4f145d96s1,由于5d和6s轨道能量相近,6s电 子和5d上的部分 电子均可参加成键,导致Pt有+2,+3,+4,+5和+6等多种氧化态, 但+2, +4以为 主.
它是最经典的无机配合物,早在19世纪末就被化学家合成出来,但其抗癌作 用则是在1965年才偶然发现的。当时美国生理学家B.Rosenberg 等在研究 电磁场作用下微生物的生长情况时,发现在氯化氨介质下铂电极周围的大肠 杆菌停止分裂繁殖。
金属铱配合物

金属铱配合物介绍金属铱配合物是由金属铱离子与配体形成的化合物。
铱是一种重金属元素,属于铂金系元素,具有很高的密度和熔点。
金属铱配合物在化学、医药和材料科学领域具有广泛的应用。
本文将从合成方法、结构特点、性质和应用等方面深入探讨金属铱配合物的相关内容。
合成方法金属铱配合物的合成方法多种多样,常见的有以下几种:配体置换法这是一种常用的合成方法,即通过将金属铱离子与已有的配合物发生置换反应得到目标配合物。
置换反应可以利用不同配合物的亲合性来实现。
例如,可以通过将铱氯配合物与配体进行反应,从而获得相应的金属铱配合物。
氧化还原法在氧化还原反应中,配体中的一个或多个电子被转移给金属铱离子,形成配位键。
这种反应可以通过添加还原剂或氧化剂来实现。
例如,可以通过添加还原剂将铱离子还原为低价态,与配体形成配合物。
水解法金属铱配合物可以通过水解反应合成。
水解是一种将金属离子与水分子反应生成金属配离子的反应。
在水解反应中,金属铱离子与水反应生成金属铱配离子,然后与配体形成配合物。
气相法金属铱配合物可以通过气相反应合成。
在气相反应中,金属铱离子与气体分子进行反应,形成金属铱配合物。
这种方法可以通过调节气体压强和温度来控制反应的进行。
结构特点金属铱配合物的结构特点主要取决于金属铱离子的电荷和配体的性质。
以下是一些常见的金属铱配合物的结构特点:配位数金属铱离子可以形成不同配位数的配合物,常见的配位数有4、6、8等。
配位数取决于金属铱离子的电荷和配体的性质。
一般来说,正电荷的金属铱离子配位数较小,而负电荷的金属铱离子配位数较大。
配位结构金属铱配合物的配位结构可以是线性的、平面的或立体的。
线性配位结构是指配体沿一条直线排列,形成一条线。
平面配位结构是指配体在一个平面内排列。
立体配位结构是指配体在三维空间内排列。
配位键金属铱配合物中的配位键可以是离子键、共价键或金属键。
离子键是指金属离子与配体之间的电荷转移作用形成的键。
共价键是指金属离子与配体之间的电子共享形成的键。
第8章 铂族金属合金材料及其工艺性能

5.铂金首饰的纯度标识 在国外,铂金首饰一般都刻有Pt或Plat或 Platinum字样和表示纯度的千分数。如市场 上比较常见的Pt950,其含铂金成色为950‰。 欧洲发达国家如英国、法国和德国等国 家基本上都规定,铂金饰物的纯度应达到 950‰以上。在美国,铂金饰物上一般只刻有 Plat或Platinum字样,而没有表示纯度的千分 数值。
(3)铑:由自然铑矿物提炼而成,银白 色,摩氏硬度4~4.5,相对密度12.4g/cm3,熔 点1955oC,化学性质稳定。由于铑的耐腐蚀 性和抗磨损能力较强,铑对光的反射能力与 银相当,因此,铑被广泛应用于表面电镀材 料,如用于白银首饰或钯铂合金首饰的表面 电镀等。
(4)铱:由自然铱和锇铱矿等矿物提炼 而成,颜色银白,摩氏硬度高达7,相对密度 22.4g/cm3,性脆不易加工,只能在高温下压 成箔片或拉成细丝,熔点高达2454oC,化学 性质稳定。主要用于制造科学仪器、热电偶、 热电阻等。高硬度的铁-铱和铱-铂合金常用来 制造笔尖,也可用于制作首饰。
(2)铱-铂合金 通常为提高铂金硬度和韧性而在纯铂金 中掺加铂族元素铱,这样一起熔炼成的合金 就是铱-铂合金。铱-铂合金颜色亦为银白色, 金属光泽,硬度较高,相对密度亦大,化学 性质稳定,是极好的贵金属首饰材料。
(3)钯-铂合金 钯-铂合金即铂金与钯金的合金,这种合 金主要由意大利和日本生产。目前日本市场 上所谓的白金首饰就是钯-铂合金。通常这种 钯-铂合金的含铂量都在75%以上。
2.铂族元素的发展历史 早在公元前700年,古埃及人用铂金铸成 的华美象形文字装饰其神匣;公元前100年, 南美的印第安人制成不同款式的铂金首饰; 18世纪末,法国国王路易十六特别偏爱铂金, 称之为“唯一与国王称号相匹配的贵金属”; 举世闻名的希望钻石,也被永远地镶嵌在铂 金上。
pt的化学元素名称

pt的化学元素名称
摘要:
1.Pt是什么的化学元素名称
2.Pt的元素符号是什么
3.Pt在元素周期表中的位置
4.Pt的物理性质
5.Pt的化学性质
6.Pt在工业中的应用
正文:
Pt是铂(Platinum)的化学元素名称。
它的元素符号是Pt,源自于拉丁文的“Platinum”,意为“白银”。
Pt属于过渡金属元素,原子序数为78,位于元素周期表的第六周期第Ⅷ族。
Pt是一种白色金属,具有很高的延展性和抗腐蚀性。
它的密度为21.45克/立方厘米,熔点为1768.3摄氏度,沸点为3827摄氏度。
Pt在室温和高温下都具有很高的化学稳定性,不与氧气反应。
Pt的化学性质表现为亲电性较弱,不容易失去电子。
它在化合物中通常呈+2和+4价态。
Pt可以与许多金属形成金属间化合物,例如与金、银、铜等。
此外,Pt还可以与非金属元素形成共价化合物,例如与氧、氮、硫等。
Pt在工业中具有广泛的应用,主要包括以下几个方面:
1.电子工业:Pt具有优良的电接触性能,常用于制造电极、触点等电子元件。
2.化工催化剂:Pt具有很高的催化活性,可用于生产氨、脱氢、氧化等化学反应。
3.汽车尾气净化器:Pt和钯等贵金属可以有效地降低汽车尾气中的有害物质,被广泛应用于汽车尾气净化器。
4.医疗领域:Pt-based合金具有良好的生物相容性和催化活性,被用于制造人工器官、医疗设备等。
5.珠宝首饰:Pt作为贵金属,因其抗氧化性和美观性而被用于制造珠宝首饰。
大学无机化学第二十章试题及答案

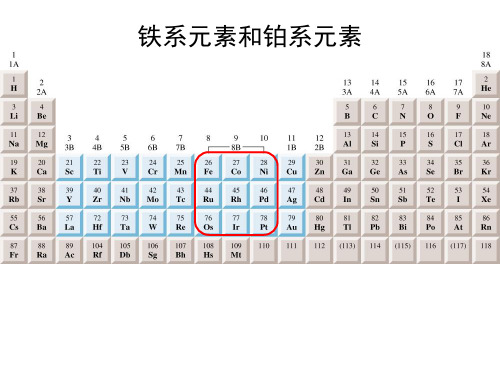
大学无机化学第二十章试题及答案第21章铁系元素和铂系元素总体目标:1. 掌握铁系元素单质及其重要化合物的性质、结构和用途2?了解铂系元素单质及其化合物的性质和用途各节目标:第一节铁系元素的单质掌握铁、钻、镍单质的性质和用途第二节铁系元素的化合物1. 掌握铁、钻、镍化合物的溶解性和颜色2. 掌握铁、钻、镍的+2、+3氧化态稳定性变化规律、这些氧化态化合物在反应上的差异以及化合物的水解性第三节铁系元素的配位化合物了解铁、钻、镍的重要配位化合物的性质第四节铂系元素1. 了解铂系元素单质的性质和用途2. 了解铂系元素含氧化合物和卤化物的主要性质3. 了解铂系元素主要配位化合物的性质A. Fe (NH 3)63+B.Fe (OH ) CI 2C.Fe(OH )2CID.Fe (OH ) 34.酸性条件下,H 2O 2与FeT 作用的组要产物是 ()A.Fe , O 2和 H +;B.Fe 3+ft H 2O;C.Fe 和 H 2O DFe3+和 O 2习题一.选择题1?下列金属中,最活泼的是 ( )A.FeB.CoC.NiD.Pd2.下列金属中,吸收H2能力最强的是( A.FeB.NiC.PdD.Pt3.向FeC 3溶液中加入氨水生成的产物主要是(吉林大学《无机化学例题与习题》))(吉林大学《无机化学例题与习题》)()(吉林大学《无机化学例题与习题》)5. 形成六配位的水合离子时,磁矩为4.90B.M.(理论值)的离子是()(吉林大学《无机化学例题与习题》)A.Cr3+B.M n2+C.Fe2+D.Co2+6. 下列化合物中,与浓盐酸作用没有氯气放出的是()(吉林大学《无机化学例题与习题》)A.Pb2O3B.Fe2O3C.Co2O3 DN2O37. 下列配离子中,还原能力最强的是()(吉林大学《无机化学例题与习题》)A.Fe(H2O)62+B.Fe(CN)64-C.Co(NH3)62+D.Co(H2O)62+8. 下列化合物中,颜色不为黄色的是()(吉林大学《无机化学例题与习题》)A.K4[Fe(CN)6].3出0B.BaCrO4C.K3[Co (NO2)6]D.K3[Fe(CN)6]9?能用NaOH溶液分离的离子对是()(吉林大学《无机化学例题与习题》)A.Cr3+和AI3+B.Cu2+ft Zn2+C.Cr3+和Fe3+D.Cu2+和Fe3+10. 某金属离子在八面体弱场中磁矩为5.9B.M.,在八面体强场中的磁矩不为零,则该离子可能是(A.Fe2+)(吉林大学《无机化学例题与习题》)B.Fe3+C.Co2+D.Co3+11.可以制得无水FeCl a是下列中的(川师大《无机化学学习指导》)A.Fe+HCI —B.FeCI 2 + CI2TC.Fe+Cl12.Ni 2Q和盐酸反应的主要产物是(川师大《无机化学学习指导》)A.NiCI 3B.NiCIC.NiCI 3+CI213.铂系元素中对酸最活泼的金属是(川师大《无机化学学习指导》)A.OsB.RuC.Pd14.用氢氧化钠熔融法分解某矿石时,最合适的坩埚是()(川师大《无机化学学习指导》)A.铂坩埚B. 镍坩埚C. 瓷坩埚16. 不能在水溶液中由Fe 3+盐加KI 来制取Feb ,是因为学习指导》)A.Fel 3易溶B.Fe3+离子易水解C.生成的产物不纯,是Feb 和Fel 2的混合物D.Fe 3+Y 有氧化I-有还原性,得不到Feb 17. 铁系元素和铂系元素,形成配合物倾向更强的是()(吴成鉴《无机化学学习指导》)A.铁系元素B.铂系元素C.两者均是D. 两者均否、18. 铁在潮湿空气中会生锈,铁锈是松脆多孔的物质,它的成分通常表示为()(吴成鉴《无机化学学习指导》)A.Fe 2QB.Fe 3QC.FeO.H 2OD.Fe 2Q .XH 2O19. 下列关于FeCl 3性质的叙述,正确的是()(吴成鉴《无机化学学习指导》)A. FeCb 是离子化合物B. 高温气态时,以FeCb 单分子存在C. 可用加热FeCl 3.6H 2O 的方法制取无水FeCbD. 在FeCl 3中,铁的氧化态是+川,是铁的最高氧化态 20. 下列物质与&Cr 2O 溶液反应没有沉淀生成的是()(大连理工大学《无机化学习题详解》)A.H 2SB.KIC.H 2QD.AgNO 321. 在下列条件中,KMnO 发生反应时产物中没有气体的是()(大连理工大学《无机化学习题详解》)A.受热B. 在酸性条件下放置C.在浓碱溶液中D.酸性条件下与HS 反应22. 下列物质不易被空气中的Q 氧化的是()(大连理工大学《无机化学习题详解》)A.Mn (OH ) 2B.Ni (OH ) 2C.Fe 2+D.Co (NH 3) 62+二?填空题15.Co 2+M 子在水溶液中和在氨水溶液中的还原性是)(吴成鉴《无机化学学习指导》)A.前者大于后者B.二者相同C.后者大于前者D. 都无还原性()(吴成鉴《无机化学1. FeCl3的蒸汽中含有_______ 分子,其结构类似于 _______ 蒸汽,其中Fe3+的杂化方式为___________ F eCb易溶于有机溶剂,原因是____________ . (吉林大学《无机化学例题与习题》)2. 现有四瓶绿色溶液,分别含有Ni (H),Cu (H),Cr (m),MnO42-.(1)加水稀释后,溶液变蓝的是_________ .(2)加入过量酸性N&SO3溶液后,变为无色的是___________ .(3)加入适量NaOH溶液由沉淀生成,NaOH过量时沉淀溶解,又得到绿色溶液的是 ___________ .(吉林大学《无机化学例题与习题》)(4)加入适量氨水有绿色沉淀生成,氨水过量时得到蓝色溶液的是___________ .吉(吉林大学《无机化学例题与习题》)3.______________________________________________________________ 在Cr 3+, Mn 2+,Fe 2+, Fe 3+, Co 2+, Ni 2+中,易溶于过量氨水的是____________________ .(吉林大学《无机化学例题与习题》)4?向CoSO 4溶液中加入过量 KCN 溶液,则有 _____________ ?生成,放置后逐渐转化为 _____________ .(吉林大学《无机化学例题与习题》)5. _______________________________________ 具有抗癌作用的顺铂,其分子构型为_____________________________________________ .化学组成为 ________ .Ni (CN )42- 的构型为 __________ .中心离子的未成对电子数为___________ ,而NiCl 42-构型为未成对电子数为_____________ .(吉林大学《无机化学例题与习题》 )而在自然界中往往以一一态形式共生在一起。
铂系元素

铂族元素
二、The simple substances
1. Physical properties
(1).颜色:除Os为蓝灰色外,其余都是银白色 (2).熔点高,这六种元素中,Os熔点最高,Pd熔点最低 (3).硬度 Ru Rh Pd Os Ir Pt 6.5 – 4.8 7.0 6.5 4.3 (4).延展性:铂的延展性最好,冷轧可制0.0025mm的箔
(1) oxides, hydroxide Fe2O3(砖红)中等氧化剂 Co2O3(黑)强氧化剂 Ni2O3(黑)强氧化剂
Fe 3 3H 2O Fe(OH) 3 3H
3.5 2Co 2 Cl 2 6H 2O pH 2Co(OH) 3 6H 2Cl
2.[+2]O.S.
(1)Oxides (MO), Hydroxides M(OH)2 FeO(黑色) CoO(灰绿色) NiO(暗绿色) Fe(OH)2 (白色) Co(OH)2(粉红色) Ni(OH)2 (苹果绿色) 微弱两性(主要碱性) 两性 碱性 O2迅速 O2缓慢 NaOCl强氧化剂 Fe2O3∙nH2O(红棕) Co2O3∙ nH2O(棕色) Ni2O3∙nH2O(黑色)
2Ni(OH) 2 Br2 2OH 2Ni(OH) 3 2Br 氢氧化铁有微弱的两性,只有新沉淀的才能溶于浓碱中
250 C
(2)FeCl3∙6H2O :低熔沸点,易溶于有机溶剂,明显地具 有共价性,它可以使蛋白质沉淀,故可作为止血剂。 24.[+6]O.S : FeO4 ,其颜色与MnO4 颜色相同 (1)Preparation: Fe2O3+3KNO3+4KOH= 2K2FeO4+3KNO2+2H2O (加热共融) 22Fe(OH)3+3ClO +4OH =2FeO4 +3Cl +5H2O 3+ 2+ (2)Properties: 2FeO4 +10 H →2Fe +3/2O2↑+5H2O a.在酸性介质中,它是强氧化剂,其电极电位介于MnO4和 O3 之间:2K2FeO4+2NH3+2H2O=2Fe(OH)3+4KOH+N2 2+ + 2FeO4+NH4 +8H =2Fe3++N2 +8H2O
第VIII族元素简介

2Fe(OH)3+3ClO-+4OH- = 2FeO42- +3Cl-+ 5H2O
Fe2O3+3KNO3+4KOH = 2K2FeO4 + 3KNO2+ 2H2O
紫红色
三、铁系元素的配合物
一、氨基配合物
Co(NH3)62+ Co(NH3)62+ Ni(NH3)62+
思考:铁为 什么不能形 成氨合物? 如何解释?
M3+盐的氧 化性 无水 FeCl3 的制备
三氯化铁
Fe3+
Co3+
Ni3+
氧化性增强,稳定性减弱
2Fe + 3Cl2 == 2FeCl3 (棕黑色) Fe+2HCl =FeCl2 + H2↑ 2FeCl2 +Cl2+12H2O = 2FeCl3· 2O 6H
FeCl3
溶液中结 晶出的氯 化铁为结 晶水合物
硫酸亚铁 硫酸亚铁铵 硫酸镍 Ni2FeSO4
重要的还原剂,分析 上用它标定高锰 酸钾的浓度
硫酸镍大量用于 电镀和作催化剂
6FeSO4+K2Cr2O7+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3 +K2SO4+7H2O 10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+2MnSO4 + K2SO4+8H2O
一、通性
Fe +2,+3 Ru +4 Os +8 Co +2 Rh +3 Ir +3 ,+4 Ni +2 Pd +2 Pe +2,+4
无机化学:铁系元素和铂系元素
2 有配体存在时,低价金属离子的还原性增强
2 Fe(CN)64- + I2 = 2 Fe(CN)63- + 2 I- 2 Fe2+ + I2 + 12 F- = 2 FeF63- + 2 I- 2 Co(NH3)62+ + I2 = 2 Co(NH3)63+ + 2 I-
[Co(H2O)6]2+,粉红色 简单的Co3+ 不可能存在于水溶液中。
-PdCl2
三、六氟化铂 (PtF6)
强氧化剂
为
“
惰
性
O2 Xe
气
电离能/(kJmol-1) 1177 1171
体 ”
正
名
!
1962年,Bartlett
四、配合物 1、Pt(II)-氨配合物 (PtCl2(NH3)2)
反式-PtCl2(NH3)2)
顺式-PtCl2(NH3)2)
(1)顺式-PtCl2(NH3)2)的合成(佩内罗反应) (2)反式-PtCl2(NH3)2)的合成(耶尔根森)
铂的延展性最好冷轧可制00025mm化学稳定性特别高rurhpdosirpt0450600850851012与酸反应pdpt溶于王水pd也可溶于浓hnopt4hno18hcl与碱反应所有铂系金属在有氧化剂存在时与碱一起熔融成为可溶性化合物所以白金坩埚不能用于naoh大多数的铂系金属能吸收气体特别是吸收氢气
1 物理性质
(1) 颜色:除 Os为蓝灰色外,其余都是银白色;
(2) 熔点高:这六种元素中,Os 熔点最高,Pd 熔点最低;
(3) 硬度: Ru Rh Pd Os Ir Pt
6.5 –
4.8 7.0 6.5 4.3
(4) 延展性:铂的延展性最好,冷轧可制 0.0025 mm 的铂
各种化合物的颜色

卤族(英VIIA):固体:I2 紫黑;ICl 暗红;IBr 暗灰;IF3 黄色;ICl3 橙;I2O5 白;I2O4黄(离子晶体);I4O9 黄(离子晶体).液体:Br2 红棕;BrF3 浅黄绿;IBr3 棕;Cl2O6暗红;Cl2O7 无色油状;HClO4 无色粘稠状;(SCN)2 黄色油状.气体:F2 浅黄;(CN)2无色;Cl2 黄绿;I2(g) 紫;BrF 红棕;BrCl 红;Cl2O 黄红;ClO2 黄色;Br2O 深棕;(SCN)n 砖红色固体.氧族(英VIA):固体:S 淡黄;Se 灰,褐;Te 无色金属光泽;Na2S,(NH4)2S,K2S,BaS 白,可溶;ZnS 白↓;MnS 肉红↓;FeS 黑↓;PbS 黑↓;CdS 黄↓;Ag2S 黑↓;CuS 黑↓;Na2S2O3 白;Na2S2O4 白;SeO2 白,易挥发;SeBr2 红;SeBr4 黄;TeO2 白(加热变黄);H2TeO3 白;TeBr2 棕;TeBr4 橙;TeI4 灰黑;PoO2 低温黄(面心立方),高温红(四方);SO3 无色;SeO3 无色易潮解;TeO3 橙色;H6TeO6 无色.液体:H2O 无色;纯H2O2 淡蓝色粘稠;CrO(O2)2(aq) 蓝;纯H2SO4 无色油状;SO32-(aq) 无色;SO42-(aq) 无色;SeO2(l) 橙;TeO2(l) 深红.气体:O2 无色;O3 低浓度无色,高浓度淡蓝(鱼腥味);S2(g) 黄,上浅下深;H2S 无色;SO2 无色;H2Se 无色;H2Te 无色.卤化硫(未注明者均为无色):液体:SF6,S2F10,SCl4 淡黄;SCl2 红;S2Cl2 无色;S2Br2 红.气体:SF4 ;SF2 ;S2F2 .液体:SOCl2 白色透明;SO2Cl2 无色发烟. 氮族(英V A):固体:铵盐无色晶体;氮化金属白;N2O3 蓝色(低温);N2O5 白;P 白,红,黑;P2O3 白;P2O5 白;PBr3 黄;PI3 红;PCl5 无色;P4Sx 黄;P2S3 灰黄;P2S5 淡黄;H4P2O7 无色玻璃状;H3PO2 白;As 灰;As2O3 白;As2O5 白;As2S5 淡黄;Sb 银白;Sb(OH)3 白↓;Sb2O3 白(锑白,颜料);Sb2O5 淡黄;SbX3(X≠I) 白;SbI3 红;Sb2S3 橘红↓;Sb2S5 橙黄;Bi 银白略显红;Bi2O3 淡黄;Bi2O5 红棕;BiF3 灰白;BiCl3 白;BiBr3 黄;BiI3 黑↓;Bi2S3 棕黑.液体:N2H4 无色;HN3 无色;NH2OH 无色;发烟硝酸红棕;NO3-(l)无色;王水浅黄,氯气味;硝基苯黄色油状;PX3 无色;纯H3PO4 无色粘稠状;AsX3(X≠I) 无色;.气体:N2 无色;NH3 无色;N2O 无色甜味;NO 无色;NO2 红棕;PH3 无色;P2H6 无色;AsH3 无色;SbH3 无色;BiH3 无色.卤化氮(未注明者均为无色):固体:NBr3•(NH3)6 紫,爆炸性;NI3•(NH3)6 黑,爆炸性;液体:NCl3;无色气体:NF3;无色碳族(英IV A):Solid:C(金刚石) 无色透明;C(石墨) 黑色金属光泽;Si 灰黑色金属光泽;Ge 灰白;Sn 银白;Pb 暗灰;SiO2 无色透明;H2SiO3 无色透明胶状↓;Na2SiF6 白晶;GeO 黑;GeO2 白;SnO 黑;SnO2 白;Sn(OH)2 白↓;PbO黄或黄红;Pb2O3 橙;Pb3O4 红;PbO2 棕;CBr4 淡黄;CI4 淡红;GeI2 橙;GeBr2 黄;GeF4 白;GeBr4 灰白;GeI4 黄;SnF2 白;SnCl2 白;SnBr2 淡黄;SnI2 橙;SnF4 白;SnBr4 无色;SnI4 红;PbF2 无色↓;PbCl2 白↓;PbF4 无色;GeS 红;GeS2 白;PbS 黑↓;PbS2 红褐;Pb(NO3)2 无色;Pb(Ac)2•3H2O 无色晶体;PbSO4 白↓;PbCO3 白↓;Liquid:CCl4 无色;CS2 无色;GeCl4 无色;SnCl4 无色;PbCl4 无色.Gas:CO CO2 CH4 CF4 SiF4 SiH4 均为无色. 硼族(英IIIA):Solid:B(无定型) 棕色粉末;B(晶体) 黑灰;Al 银白;Ga 银白(易液化);In 银灰;Tl 银灰;B2O3 玻璃状;H3BO3 无色片状;BN 白;NaBO2•4H2O 无色晶体;无水NaBO2 黄晶;Al2O3 白晶;AlF3 无色;AlCl3 白;AlBr3 白;AlI3 棕;Al(OH)3 白↓;Ga2O3 白↓;Ga(OH)3 白↓;GaBr3 白;GaI3 黄;In2O3 黄;InBr3 白;InI3 黄;TlOH 黄;Tl2O 黑;Tl2O3 棕黑;TlCl 白↓;TlBr 浅黄↓;TlI 黄↓(与银相似);TlBr3 黄;TlI3 黑.Liquid:BCl3 无色发烟.Gas:硼烷无色;BF3 无色(有窒息气味).碱土金属(英IIA):单质:银白氧化物:均为白色固体.氢氧化物:白色固体Be(OH)2↓,Mg(OH)2↓. 盐:多为无色或白色晶体;BeCl2 浅黄;BaCrO4 黄↓;CaF2 白↓.碱金属(英IA):单质:银白焰色:Li 红;Na 黄;K 紫;Rb 紫红;Cs 紫红. 氧化物、过氧化物、超氧化物、臭氧化物:Li2O 白;Na2O 白;K2O 淡黄;Rb2O 亮黄;Cs2O 橙红;Na2O2 淡黄;KO2橙黄;RbO2深棕;CsO2 深黄;KO3 橘红.氢氧化物:白色,LiOH白↓.盐:多为无色或白色晶体且易溶于水.不溶盐↓(未注明者皆为白色晶体):LiF Li2CO3 Li3PO4LiKFeIO6 Na[Sb(OH)6]NaZn(UO2)3(Ac)9•6H2O 黄绿;M3[Co(NO2)6] 亮黄;MBPh4 MClO4 M2PtCl6 淡黄;(M=K,Rb,Cs)CsAuCl4.铜副族(英IB):单质:Cu 紫红或暗红;Ag 银白;Au 金黄.铜化合物:焰色绿;CuF 红;CuCl 白↓;CuBr黄↓;CuI 棕黄↓;CuCN 白↓;Cu2O 暗红;Cu2S 黑;CuF2 白;CuCl2 棕黄(溶液黄绿);CuBr2 棕;Cu(CN)2 棕黄;CuO 黑↓;CuS黑↓;CuSO4 无色;CuSO4•5H2O 蓝;[Cu(H2O)4]2+ 蓝;[Cu(OH)4]2- 蓝紫;深蓝;炔铜红↓.银化合物:AgOH 白(常温分解);Ag2O 黑;新制AgOH 棕黄(混有Ag2O);蛋白银(AgNO3滴手上) 黑↓;AgF 白;AgCl 白↓;AgBr 淡黄↓;AgI 黄↓(胶体);Ag2S 黑↓;Ag4[Fe(CN)6] 白↓; Ag3[Fe(CN)6] 白↓; Ag+ ,[Ag(NH3)2]+ ,无色[Ag(S2O3)2]3- ,[Ag(CN)2]- 无色.金化合物:HAuCl4•3H2O 亮黄晶体;KAuCl4•1.5H2O 无色片状晶体; Au2O3 黑;H[Au(NO3)4]•3H2O 黄色晶体; AuBr 灰黄↓; AuI 柠檬黄↓.锌副族(I 英IB):单质:均为银白,Hg 在水溶液中的沉淀为黑色.ZnI2 无色; ZnS 白↓;ZnCl2 白色晶体(溶解度极大,水溶液酸性);K3Zn3[Fe(CN)6] 白; Zn3[Fe(CN)6]2 黄褐.镉化合物:CdO 棕灰↓;汞化合物:HgO 红(大晶粒)或黄(小晶粒)↓;HgI2 红或黄(微溶);(奈斯勒试剂产物)Hg2(NO3)2 无色晶体.ZnS 荧光粉:Ag 蓝;Cu 黄绿;Mn 橙.钛副族(英IVB):钛化合物:Ti3+ 紫红;[TiO(H2O2)2]2+ 橘黄;(NH4)2TiCl6 黄色晶体; [Ti(H2O)6]Cl3 紫色晶体;[Ti(H2O)5Cl]Cl2•H2O 绿色晶体; TiCl4 无色发烟液体.锆、铪:MO2,MCl4 白.钒副族(英VB):钒化合物:V2+ 紫;V3+ 绿; VO2+ 蓝; V(OH)4- 黄; VO43- 黄; VO 黑;V2O3 灰黑; V2S3 棕黑; VO2 蓝色固体; VF4 绿色固体; VCl4 暗棕色液体; VBr4 洋红色液体; V2O5 黄或砖红; 水合V2O5 棕红;饱和V2O5溶液(微溶) 淡黄; [VO2(O2)2]3- 黄; [V(O2)3]3- 红棕.铬副族(英VIB):[CrO(O2)2]OEt2 蓝; CrO2Cl2 深红色液体; Na2Cr2O7,K2CrO7 橙红;Ag2CrO4 砖红↓; BaCrO4 黄↓; PbCrO4 黄↓.紫红Cr2(SO4)3•18H2O ; 绿色Cr2(SO4)3•6H2O ; 桃红Cr2(SO4)3;暗绿[Cr(H2O)4Cl2]Cl ; 紫色[Cr(H2O)6]Cl3; 淡绿[Cr(H2O)5Cl]Cl2; [Cr(H2O)6]3+ 紫;[Cr(H2O)4(NH3)2]3+ 紫红; [Cr(H2O)3(NH3)3]3+ 浅红; [Cr(H2O)2(NH3)4]3+ 橙红; [Cr(NH3)5H2O]3+ 橙黄; [Cr(NH3)6]3+ 黄.钼、钨:MoO3 白;棕色MoCl3; 绿色MoCl5; MoS3 棕色↓;•6H2O 黄色晶状↓;H2WO4•xH2O 白色胶体.锰副族(英VIIB):无水锰盐(MnSO4) 白色晶体;六水合锰盐(MnX2•6H2O, X=卤素,NO3,ClO4) 粉红;MnCO3 白↓; Mn3(PO4)2 白↓; KMnO4 紫红;铁系(第四周期VIII 族):黄;FeO 黑; Fe2O3 暗红; Fe(OH)2 白↓; Fe(OH)3 棕红↓; FeCl3 棕红晶体; 无水FeSO4 白; FeSO4•7H2O 绿;K4[Fe(CN)6](黄血盐) 黄色晶体; K3[Fe(CN)6](赤血盐) 红色晶体; Fe4[Fe(CN)6] 普鲁士蓝↓;M2Fe6(SO4)4(OH)12(黄铁矾,M=NH4,Na,K) 浅黄色晶体;CoO 灰绿; Co3O4 黑; Co(OH)3 棕↓; Co(OH)2 粉红↓; Co(CN)2 红;K4[Co(CN)6] 紫色晶体; Co2(CO)8 黄色晶体; [Co(SCN)6]4- 紫;氯化钴脱水变色:粉红CoCl2•6H2O(325K) ;紫红CoCl2•2H2O(3l3K) ; 蓝紫CoCl2•H2O(393K) ; 蓝CoCl2.[Ni(NH3)6]2+ 紫; Ni(OH)2 绿↓; Ni(OH)3 黑↓; 无水Ni(II)盐 黄; Na2[Ni(CN)4] 黄;K2[Ni(CN)4] 橙;Ni(CO)4 无色液体.铂系元素(第五、六周期VIII族):Os 蓝灰色易挥发固体;Pd↓(aq) 黑;Na2PtCl6 橙黄色晶体;M2PtCl6(M=K,Rb,Cs,NH4) 黄色↓.。
铂金化学元素符号

铂金化学元素符号铂金的化学元素符号是Pt,它是十六族元素的第78个元素。
铂金(Platinum)是一种稀有金属,因其优异的化学稳定性和对腐蚀非常低而被人们熟知,所以它非常适合用来制造各种贵重金属器物。
化学方面,铂金是原子量为195.08的金属元素,可用满味格系统的左四面体来描述其晶体结构,由于其可以被非常容易分解,所以在实践中很难将其分解到原子态,更常见的是以各种化合物(如氧化铂、铂酸铜等)的形式存在。
从物理性质来看,铂金是黑色的金属,极具光泽,在室温下变性很慢,耐腐蚀性能很强、耐高温、耐久性强,有一定的硬度和弹性,焊接性也很强,但它容易受到酸性介质(如柠檬酸)的侵蚀。
铂金在空气中已知的最高温度是1400℃,在液氨最高温度可达到1800℃。
同时,铂金的熔点也很高,约为1768℃。
在医学领域,铂金也有着极其重要的作用,由于它的安全性好,所以常用于人体内做各种手术,比如眼科和耳鼻喉科手术,以及心脏手术。
此外,铂金也被用于制作植入体系件,如:脊椎植入物,太空椅,创伤夹板,以及关节假体等。
由于铂金的化学稳定性极好,使其能够维持固定的形状,因此它成为实现精密植入物的首选材料之一。
再次,铂金的强大的电性能也使它成为一种重要的电子元件,它常被用于制作电子配件,如抗扰电容器,调整器,复位器,光电二极管,放大器,电容和继电器等,也被广泛用于贴片电容器和贴片电感器,以及勾音器中。
另外,由于铂金的可焊性好,也用于电子产品的焊接上,更可确保焊接的可靠性。
最后,铂金在化学工业中也有着很多的应用,最常见的应用是新技术制作催化剂,由于铂金的化学稳定高,它也被广泛用于石油加工和制药,以及水处理之中。
总而言之,铂金(Pt)是一种重要的金属元素,由于其稀有及优异的物理和化学性能,它被用于制造各种贵重金属器物、制作植入物和电子配件,以及石油加工和制药等行业中。
铂系元素单质和化合物

铂系元素单质和化合物1. 铂系元素的单质系元素在地壳上的含量均较低,都是稀少元素,与金、银一起统称为贵金属。
除饿为蓝灰色外,其余的铂系金属均为银白色。
和硬度大而脆,其余四种铂系金属都有延展性。
铂系金属均为高熔点金属。
铂系元素中高周期的三种金属的密度都很大,在20g·cm-3以上。
铂系元素的性质见表16-3。
表16-3 铂系元素的一些性质铂俗称白金,因为化学稳定性、极好的延展性和可加工性,使其成为首饰加工的良好材料。
铂坩锅可用来处理含SiO2样品与HF的反应。
铂可做电极,铂铑合金可做热电偶材料。
铂系元素的单质均为惰性金属,最活泼的Pd也不与非氧化性酸作用,Pd缓慢溶于硝酸和热的浓硫酸。
Pt 不溶于,溶于王水生成协作酸H3[PtC16]。
Ru、Rh、Os和Ir与王水作用极其缓慢。
在与碱和氧化剂KNO3、KCIO3、Na2O2共熔时,铂系金属都能被氧化。
2. 铂系元素的化合物铂系金属的氧化物主要有RuO2、RuO4、Rh2O3、RhO2、PdO、OsO2、OsO4、IrO2、PiO2等。
RuO4和OsO4为共价化合物,易挥发,剧毒。
铂系金属中,Os的卤化物最丰盛,氧化态从+2~+7的卤化物都有。
Ru、Rh、Ir稳定氧化态为+3,能与全部卤素形成三卤化物。
Pt稳定氧化态为+4和+2,能与全部卤素形成四卤化物。
Pd稳定氧化态为+2,能与全部卤素形成二卤化物。
高价金属的卤化物不稳定,氧化能力强。
PtF6是已知的最强的氧化剂,能将O2氧化生成O2+[PtF6]-,将Xe氧化生成Xe[PtF6]。
将CO通入PdCl2 溶液立刻生成黑色单质Pd沉淀,可以用来鉴定CO的存在。
3.铂系元素协作物铂系元素的化合物多数都以配位化合物形式存在,H2[PtCl6]·6H2O为棕红色晶体,K[Pt(C2H4)Cl3]·H2O(Zeise盐,第一个有机金属化合物)为橙黄色晶体,结构16-9所示。
铂元素的化学符号

铂元素的化学符号
铂是化学元素周期表第78号元素,其化学符号为Pt。
它是一种常见的金属元素,重量大约位于96.5-104.5克拉,并且
在元素周期表中属于一组称为“金属亲烷”,具有球状结构且密度相对较高。
与大多数金属不同,铂不易溶于极端酸性或碱性溶液中,也不易溶于水中。
由于具有化学稳定性,非常高的高熔点和较大的原子量,铂被广泛用于多种用途,包括工业,汽车,消费电子和医疗等领域。
一般来说,铂分为纯铂和合金,其他金属元素共同组成的化合物。
广泛的金属合金可以通过加入不同类型的元素,比如钛,锆,锡,硅等来调节其物理和力学性能,使它们具有抗磨损性,耐温和耐腐蚀性。
作为一种高层次的可编程金属,铂可用于制造高精度的精密零件,这种复杂的零部件在医疗,宇航,航空,军事和科学领域发挥重要作用。
它还在彩色金属印刷行业获得了成功,用于制造用于艺术装饰的复印件,彩色标签,纪念章和金属表面图案,例如硬币和文物上的像素和标记。
此外,铂还广泛用于润滑油中的金属粉末,其非常低的摩擦系数有助于将锯木材的磨损降至最低,从而使锯片的使用寿命最长,使木材切削和加工速度最快。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Pd 是所有金属中吸附 H2 能力 最强的。
金属钯吸收氢的过程中导电性能 下降,直到组成约为 PdH0.5时变成半 导体为止。
氢首先在 钯的 表面 化学 吸附,压力大时进入金属晶格。 钯吸收大量的氢,并不降低其 延展性,这是与其他金属完全 不同的。
铂系单质中与氧气反应活 性最高的是 Os
粉末状的 Os 在室温下即可 以被空气中的氧气所氧化生成黄 色的OsO4
Os d6 s2 4 个端羰基 1 个酮式羰基 1 个 Os-Os 电子总数
8 电子 8 电子 1 电子 1 电子 共 18 电子
每个 Os 周围均有 18 个电子,满足 18 电子规则,故 [ Os(2 CO)9 ] 可以稳定 存在,其中的 Os 被稳定在零氧化态。
更为罕见的是,形成羰基配位化 合物可以将金属稳定在负氧化态。
Pt(IV)有一定的氧化性
K2 [ PtCl6 ] + K2C2O4 —— K2 [ PtCl4 ] + 2 KCl + 2 CO2
K2 [ PtCl6 ],K2C2O4, K2 [ PtCl4 ], CO2
氧化数 IV
III
II
IV
2. 乙烯基配位化合物
K [ P(t C2H4)Cl3 ] · H2O称为蔡斯(Zeise)盐 1830年前后,丹麦人蔡斯成功分离出
2. 卤化物
铂系元素中,除 Pd 外,均有 六氟化物,如浅黄色的 IrF6
六氟化铱可以有单质直接化合制得 Ir + 3 F2 —△— IrF6
黑色的RhF6 也可以由类似的反应 制得:
Rh + 3 F2 —△ — RhF6
RhF6 是铂系元素六氟化物中稳 定性最差的一个,干燥的RhF6可以 与玻璃作用 。
21. 7. 2 铂系元素的配位化合物
1. 卤素配位化合物 铂系元素单质与碱金属卤化物, 在 Cl2 气流中加热可制得卤素配位 化合物,如
2 Rh + 6 NaCl + 3 Cl2 —△— 2 Na3 [ RhCl6 ]
配体多为 F- 和 Cl-,中心多为 Pd 和 Pt 。
这类络酸、络酸盐是铂系重要化合 物。
21. 6 铂系元素的单质 除 Os 呈蓝-白色外,其余 铂系单质均为银白色金属。 Pd,Pt 延展性好,便于机 械加工。
从左向右熔点逐渐下降 与 Fe,Co,Ni 的规律一致 Fe 1538 ℃ Co 1495 ℃ Ni 1455 ℃ Ru 2333 ℃ Rh 1963 ℃ Pd 1554 ℃ Os 3033 ℃ Ir 2446 ℃ Pt 1768 ℃
如 [ Ru(CO)4 ]2- 它是稳定的配离子,其中 Ru 被 羰基稳定在 -2 氧化态。
[ Ru(CO)4 ]2- 中 Ru 周围电子总数 Ru 的电子构型为 4d7 5s1
Ru2-
7+1+2
10 电子
端羰基
24
8 电子
电子总数
共 18 电子
Os(粉状) + 2 O2 ——— OsO4
与氧气反应活性较低的块 状 Ir 在空气中加热时,只能生 成氧化膜 ,而反应活性最低的 Pt 连氧化膜也不生成。
铂系单质与酸反应化学活性极差
其中 Pd 最活泼,尚需硝酸才能 溶解。
其次是 Pt,要王水才能溶解。
Pt 不溶于氢氟酸,加上延展性 好,可以制成坩埚、蒸发皿,用于处 理氢氟酸参与的反应。
再制备 RuO4
3 Na2RuO4 + NaClO3 + 3 H2SO4 —△—— 3 RuO4 + NaCl + 3 Na2SO4 + 3 H2O RuO4 在 25℃ 以下为黄色
针状晶体,易挥发,极毒。
Pd 只有二价氧化物,PdO 为 黑色,可以直接氧化制得
2 Pd + O2 —— 2 PdO 其余铂系元素均有 MO2(IV) 氧化物。
例如,在铂坩埚中进行 SiO2 和 HF(aq) 的反应。
但熔融状态的 NaOH 对 Pt 有 腐蚀作用,高温时硫与铂有一定的化 合作用。
铂器皿十分贵重,使用时要认真 阅读说明书,不可违章操作。
有的铂系单质与碱共熔融,并 在氧化剂存在时,可以成盐。
钌与过氧化钠共熔融,将生成 橙色的钌酸钠。
熔融
Ru + 3 Na2O2 ——— Na2RuO4 + 2 Na2O
1. 氧化物
Ru 和 Os 有 MO4 四氧化物, 其中 M 的氧化数为 8。
OsO4 可以由单质 Os 在 空气中直接与 O2 化合制得
Os
+
2 O2—5—00— ℃Os源自4OsO4 浅黄色晶体,极毒,
易挥发。
RuO4 不能由单质直接化合制 得,要先制得橙色的钌酸盐
Ru + 3 Na2O2 —熔—融— Na2RuO4 + 2 Na2O
其中最重要的是氯铂酸 H2 [ PtCl6 ], 即用王水溶解金属 Pt 的产物。
PtCl4 溶于盐酸也得 H2 [ PtCl6 ] PtCl4 + 2 HCl —— H2 [ PtCl6 ]
用类似的方法也可以制得氯铂酸 的盐类,如氯铂酸铵
PtCl4 + 2 NH4Cl ——(NH4)2 [ PtCl6 ]
[ P(t C2H4)Cl3 ]- 离子的盐类。
[ P(t C2H4)Cl3 ]-的中心 Pt 经 dsp2 杂 化形成 4 条杂化轨道,指向平面正方形的 4 个顶点
3 个 Cl- 配体处于正方形的 3 个顶 点,其 3p 轨道的电子对配入 Pt 的 dsp2 杂 化轨道形成 3 个配位键。
正方形的第 4 个顶点为乙烯分子 占据,乙烯中 C-C 连线垂直于正方 形所在平面,4 个 H 向外伸展。
1 Pt 的 dsp2 杂化轨道 2 Pt 的 d 轨道
3 乙烯的空 * 反键分子轨道 4 乙烯的 成键分子轨道
K [ P(t C2H4)Cl3 ] 应命名为三 氯·(-乙烯)合铂(II)酸钾
3. 羰基配位化合物
[ Os(2 CO)9 ] 中 Os 为零氧化态。 以 Os 为中心形成六配位八面体构型。
锇也有类似的反应
熔融
Os + 3 Na2O2 ——— Na2OsO4 + 2 Na2O 锇与氢氧化钠共熔融,在空
气参与下将生成黄红色的锇酸钠 2 Os + 4 NaOH + 3 O2 —熔融——
2 Na2OsO4 + 2 H2O
21. 7 铂系元素的化合物 21. 7. 1 铂系元素的简单化合物
[ Os(2 CO)9 ] 中的 Os,其价电 子构型为 5d6 6s2
6p 6s 5d
在配体 CO 的作用下,Os 的 价层电子重排成 5d8 6s0
6p 6s 5d
形成 6 条 d2sp3 不等性杂化轨道
5d
6s 6p
6 条 d2sp3 不等性杂化轨道
M-M 酮式羰基
端羰基
Os 周围电子总数
MF6 是强氧化剂。 第一个稀有气体化合物,就是 用 PtF6 作氧化剂制备的
Xe + PtF6 —— Xe [ PtF6 ] Xe [ PtF6 ] 属于离子化合物, 可以表示成 Xe+ [ PtF6 ]-
Pt 和王水反应,得到 H2 [ PtCl6 ], H2 [ PtCl6 ] 分解得 PtCl4
H2 [ PtCl6 ] —△— PtCl4 + 2 HCl
Ru和Os也有四氯化物,但是 Pd只有二氯化物。
PdCl2 溶液可用于鉴定 CO CO + PdCl2 + H2O —— Pd + CO2 + 2 HCl
溴化物和碘化物的氧化数较 低,一般只有 MX2,MX3。
这是因为 Br-,I- 的半径 较大,空间效应不利。
