一氧化碳与二氧化碳的异同点
一氧化碳与二氧化碳的比较

人造舞台云雾
CuO CO
澄清的幻灯片 5石灰水
加热前: 氧化铜
一氧化碳
+
+
一氧化碳
氧化铜
加热幻灯 片氧5时化:铜 一氧化碳
+
+
铜
二氧化碳
与石灰水幻灯片 5反应
鉴定二氧化碳
CO2 + Ca(OH)2 = CaCO3 ↓+ H2O 碳酸钙
2CO + O2
CO2
溶于水,与水反应
难溶于水,也不与水反应
CO2 + H2O
H2CO3
使石灰水变浑浊
不能使石灰水变浑浊
CO2+Ca(OH)2 CaCO3 +H2O
具有氧化性 CO2 + C 点燃 2CO
具有还原性幻灯片 6
加热
CO + CuO Cu + CO2
没有毒性
具有毒性(与血红蛋白结合)
四、一氧化碳的用途 1.作气体燃料(可燃性) 2.冶炼金属(还原性)
物理性质
性 质
化学性质
CO与CO2的物理性质的比较:
气体 物理性质
CO2
CO
色、态、味 溶解性
无色无气味
气体 能溶于水 (1:1)
无色无气味
气体 难溶于水 (1: 0.02)
密度
比空气大
比空气略小
(1.977克/升) (1.250克/升)
化学性质
CO2
不能燃烧,也不支持燃烧
CO
具有可燃性
点燃
二氧化碳和一氧化碳的比较
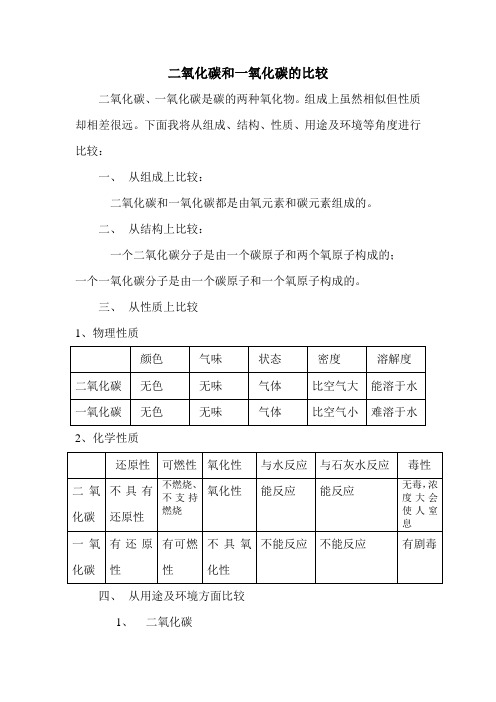
二氧化碳和一氧化碳的比较
二氧化碳、一氧化碳是碳的两种氧化物。
组成上虽然相似但性质却相差很远。
下面我将从组成、结构、性质、用途及环境等角度进行比较:
一、从组成上比较:
二氧化碳和一氧化碳都是由氧元素和碳元素组成的。
二、从结构上比较:
一个二氧化碳分子是由一个碳原子和两个氧原子构成的;
一个一氧化碳分子是由一个碳原子和一个氧原子构成的。
三、从性质上比较
1、物理性质
2、化学性质
四、从用途及环境方面比较
1、二氧化碳
(1)促进植物的光合作用
(2)由于其不燃烧,也不支持燃烧且密度比空气大,可用于灭火(3)生产化肥及作气体肥料
(4)固体二氧化碳叫干冰,升华时会吸收大量的热,可作人工降雨、制冷剂
(5)制作碳酸饮料
(6)对环境的影响——产生温室效应
2、一氧化碳
(1)燃烧能产生大量的热因此可作为能源。
(2)具有还原性,可用于冶炼工业。
以上就是二氧化碳和一氧化碳的比较。
二氧化碳和一氧化碳及其比较

二氧化碳和一氧化碳及其比较1.二氧化碳的物理性质在通常状况下,二氧化碳是一种无色气体,能溶于水,在标准状况下,二氧化碳的密度是 1.977 g/L,约是空气的 1.5 倍。
固体二氧化碳又叫做干冰,它可以升华。
2.二氧化碳的化学性质(1)本身不能燃烧,一般也不支持可燃物燃烧,不能供给呼吸。
在一般情况下,CO2既不能燃烧,也不能支持可燃物燃烧。
但在一定条件下,某些物质也可以在CO2中燃烧,如点燃的镁条,伸入盛有CO2的集气瓶中能继续燃烧:(2)跟水反应生成碳酸:CO2+H2O=H2CO3,生成的碳酸可使紫色的石蕊试液变红色。
①CO2能溶解于水,通常1体积的水可以溶解1体积的CO2,增大压强时,还会溶解得更多些。
CO2溶于水的同时还与水发生反应,但水中溶解的CO2只有1%跟水结合成H2CO3,其余仍以分子形式溶解在水中。
②能使紫色石蕊试液变红色的是H2CO3,而不是CO2。
(3)跟石灰水反应产生碳酸钙(白色)沉淀,此反应可用来检验二氧化碳。
CO2+Ca(OH)2=CaCO3↓+H2O3.二氧化碳对生活和环境的影响(1)用途①用于灭火;②用作制冷剂,用来保存食品和用于人工降雨;③作肥料,制纯碱、汽水等。
(2)影响近几十年来,由于人类消耗的能源急剧增加,森林遭到破坏,大气中二氧化碳的含量不断上升,造成“温室效应”。
4.一氧化碳的物理性质通常状况下,一氧化碳是一种无色、无味的气体,它的密度比空气的略小,难溶于水。
5.一氧化碳的化学性质(1)可燃性现象:燃烧时发出蓝色火焰,放出热量。
(2)还原性现象:黑色的氧化铜变红色,同时有使澄清的石灰水变浑浊的气体生成。
(3)毒性正常的血液呈深红色,当通入一氧化碳后,血液由深红色变成鲜红色,原因是一氧化碳能与血液里的血红蛋白结合,使血红蛋白不能很好地跟氧气结合,严重时会危及生命。
6.一氧化碳与二氧化碳的比较从CO和CO2的化学式可看出,CO比CO2少1个氧原子。
由于分子结构不同,就使得 CO和CO2的性质有很大差别。
高三化学总复习 二氧化碳和一氧化碳的对比(提高) 知识讲解

中考总复习:二氧化碳和一氧化碳的对比(提高)【考纲要求】1.掌握二氧化碳的物理性质和化学性质,知道二氧化碳的用途及温室效应。
2.掌握一氧化碳的化学性质:可燃性、还原性、毒性等。
【知识网络】【考点梳理】考点一、CO2和CO性质及用途的比较(高清课堂《二氧化碳和一氧化碳》一)对比项目CO2CO物理性质无色无味气体,能溶于水,密度比空气大,干冰易升华无色无味气体,难溶于水,密度比空气略小化学性质可燃性一般情况下既不能燃烧,也不支持燃烧有可燃性2CO+O22CO2还原性没有还原性,有较弱的氧化性C+CO22CO有还原性CO+CuO Cu+CO2与水反应与水反应CO2+H2O=H2CO3不能与水反应与石灰水的反应(碱)与石灰水反应CO2+Ca(OH)2=CaCO3↓+H2O不能与石灰水反应毒性无毒有剧毒主要用途可制汽水,作制冷剂,灭火,气体肥料气体燃料、高炉炼铁对环境的影响造成温室效应污染空气要点诠释:1.由于CO和CO2的分子构成不同,决定了二者性质的不同。
2.CO和CO2的鉴别方法:根据CO和CO2的不同特性,可以设计多种方法进行鉴别。
鉴别时现象越明显,差异越多,区分越容易。
物理方法:可以根据它们的密度和溶解性不同设计实验来鉴别。
化学方法:可以利用CO的可燃性和还原性来鉴别,也可以利用CO2能与水、石灰水反应的现象来鉴别。
3.CO2和CO的相互转化除杂:除杂原则:不增加新杂质,不减少被提纯的物质,杂质与所需物质要易于分离。
除杂不仅原理要正确,而且操作要切实可行。
如要除去CO2中的CO,一般用还原CuO的方法,不能用点燃(少量CO不能点燃)或石灰水(可除去CO2)来除去CO。
若要除去CO中少量的CO2,一般用氢氧化钠溶液来除去,不能用倾倒的方法(密度虽然有差异,但气体混合后一般是均匀分散的),也不能用水或紫色石蕊试液来除去(不易除尽)。
考点二:一氧化碳和单质碳性质的比较(高清课堂《二氧化碳和一氧化碳》二)对比项目 C CO相同点可燃性有可燃性C+O2CO2 2C+O22CO有可燃性2CO+O22CO2还原性有还原性C+2CuO2Cu+CO2↑有还原性CO+CuO Cu+CO23CO+Fe2O32Fe+3CO2用途常用作燃料和作还原剂冶炼金属常用作燃料和作还原剂冶炼金属不同点属于固体单质,常温下化学性质属于气体化合物,具有毒性稳定要点诠释:1.碳单质的可燃性反应中值得注意的是条件不同,燃烧产物不同(CO、CO2)。
一氧化碳与二氧化碳的异同点

一氧化碳与二氧化碳的异同点相同点:都是由碳、氧两种元素组成的氧化物,同属无机化合物。
不同点:一、结构:1、一氧化碳:碳的最外层有4个电子,氧的最外层有6个电子,碳的2个单电子进入到氧的p轨道和氧的2个单电子配对成键,形成两个键,然后氧的孤电子对进入到碳空的P轨道中形成一个配键,氧和碳之间就形成了三个键。
一氧化碳分子为极性分子,但分子的极性很弱。
分子形状为直线形。
2、二氧化碳:在二氧化碳分子中,碳原子采用sp杂化轨道与氧原子成键。
碳原子的2个sp杂化轨道分别与2个氧原子生成2个σ键。
碳原子上2个未参加杂化的p轨道与sp杂化轨道成直角,并且从侧面同氧原子的p轨道分别肩并肩地发生重叠,缩短了碳—氧原子间地距离,使二氧化碳中碳氧键具有一定程度的叁键特征。
决定分子形状的是sp杂化轨道,二氧化碳为非极性分子,分子形状为直线形。
二、物理性质:1、一氧化碳:在通常状况下,一氧化碳是无色、无臭、无味、难溶于水的气体,熔点-207℃,沸点-191.5℃。
标准状况下气体密度为1.25g/L,和空气密度(标准状况下 1.293g/L)相差很小,在水中的溶解度甚低,但易溶于氨水。
2、二氧化碳:在通常状况下是一种无色、无臭、无味的气体,能溶于水,溶解度为0.144g/100g水(25℃)。
在20℃时,将二氧化碳加压到5.73×106 Pa即可变成无色液体,常压缩在钢瓶中存,在-56.6℃、5.27×105 Pa时变为固体。
液态二氧化碳碱压迅速蒸发时,一部分气化吸热,二另一部分骤冷变成雪状固体,将雪状固体压缩,成为冰状固体,即俗你“干冰”。
“干冰”在1.013×105 Pa、-78.5℃时可直接升华变成气体。
二氧化碳比空气重,在标准状况下密度为1.977g/L,约是空气的1.5倍。
二氧化碳无毒,但不能供给动物呼吸,是一种窒息性气体。
三、化学性质:1、一氧化碳:a、可燃性:一氧化碳能够在空气中或氧气中燃烧,生成二氧化碳:2CO+O2=点燃=2CO2燃烧时发出蓝色的火焰,放出大量的热。
二氧化碳和一氧化碳及其比较

二氧化碳和一氧化碳及其比较1.二氧化碳的物理性质在通常状况下,二氧化碳是一种无色气体,能溶于水,在标准状况下,二氧化碳的密度是 1.977 g/L,约是空气的 1.5 倍。
固体二氧化碳又叫做干冰,它可以升华。
2.二氧化碳的化学性质(1)本身不能燃烧,一般也不支持可燃物燃烧,不能供给呼吸。
在一般情况下,CO2既不能燃烧,也不能支持可燃物燃烧。
但在一定条件下,某些物质也可以在CO2中燃烧,如点燃的镁条,伸入盛有CO2的集气瓶中能继续燃烧:(2)跟水反应生成碳酸:CO2+H2O=H2CO3,生成的碳酸可使紫色的石蕊试液变红色。
①CO2能溶解于水,通常1体积的水可以溶解1体积的CO2,增大压强时,还会溶解得更多些。
CO2溶于水的同时还与水发生反应,但水中溶解的CO2只有1%跟水结合成H2CO3,其余仍以分子形式溶解在水中。
②能使紫色石蕊试液变红色的是H2CO3,而不是CO2。
(3)跟石灰水反应产生碳酸钙(白色)沉淀,此反应可用来检验二氧化碳。
CO2+Ca(OH)2=CaCO3↓+H2O3.二氧化碳对生活和环境的影响(1)用途①用于灭火;②用作制冷剂,用来保存食品和用于人工降雨;③作肥料,制纯碱、汽水等。
(2)影响近几十年来,由于人类消耗的能源急剧增加,森林遭到破坏,大气中二氧化碳的含量不断上升,造成“温室效应”。
4.一氧化碳的物理性质通常状况下,一氧化碳是一种无色、无味的气体,它的密度比空气的略小,难溶于水。
5.一氧化碳的化学性质(1)可燃性现象:燃烧时发出蓝色火焰,放出热量。
(2)还原性现象:黑色的氧化铜变红色,同时有使澄清的石灰水变浑浊的气体生成。
(3)毒性正常的血液呈深红色,当通入一氧化碳后,血液由深红色变成鲜红色,原因是一氧化碳能与血液里的血红蛋白结合,使血红蛋白不能很好地跟氧气结合,严重时会危及生命。
6.一氧化碳与二氧化碳的比较从CO和CO2的化学式可看出,CO比CO2少1个氧原子。
由于分子结构不同,就使得 CO和CO2的性质有很大差别。
一氧化碳和二氧化碳的区别的原因

一氧化碳和二氧化碳的区别的原因二氧化碳是由一个氧原子和两个氧分子组成的,其化学式为CO2。
它是一种无色无味的气体。
两者的结构不同。
1、成分不同:一氧化碳是由一个氧原子和两个氧分子构成的,二氧化碳是由两个氧原子构成的。
2、用途不同:一氧化碳是一种非常重要的化工原料和化工产品,主要用于冶炼和钢铁工业;二氧化碳是一种温室气体,可以用作致冷剂、灭火剂、干冰、光气的原料、人造冰晶石等。
3、性质不同:①一氧化碳是一种无色无味的气体。
②二氧化碳有毒,易溶于水。
4、运输方式不同:一氧化碳是液态的,通常盛放在液态化石燃料的钢瓶里。
而二氧化碳是气体,通常储存在钢瓶中。
5、固态与液态不同:①一氧化碳在气态时会生成液态二氧化碳。
②二氧化碳只有在加压条件下才能从固态变成液态。
③一氧化碳的沸点很低,不到-191 ℃,在常温下可以支持燃烧。
④二氧化碳的沸点很高,常温下很难汽化。
2、性质不同:①两种物质的相对分子质量不同。
一氧化碳的相对分子质量为28,而二氧化碳的相对分子质量为44。
②两种物质的沸点不同。
一氧化碳的沸点为-191 ℃,比二氧化碳的沸点-56 ℃低。
③一氧化碳是一种无色无味的气体。
二氧化碳是一种常见的气体,我们经常将呼出的气体通过手帕、毛巾或其他东西去除其中的二氧化碳,然后再把这些带有二氧化碳的气体通过鼓风机吹入房间内,因此人们常常会感到鼻子和喉咙有刺激感。
④一氧化碳是有毒的,一旦接触到人体,就会使人窒息。
二氧化碳却没有毒,也不具有任何令人窒息的特性。
⑤一氧化碳是助燃剂,在常温下和二氧化碳一样会支持燃烧。
⑥二氧化碳也是一种中药,它有清热、镇静、降温的作用。
⑦二氧化碳还是碳水化合物、蛋白质、脂肪、甲醇、氨基酸、葡萄糖等的成分之一。
3、密度不同:一氧化碳密度比空气小,比空气轻。
二氧化碳密度比空气大,比空气重。
4、用途不同:①一氧化碳可以冶炼和钢铁工业,也是人造冰晶石、干冰、光气的原料。
②二氧化碳是一种温室气体,可以用作致冷剂、灭火剂、干冰、光气的原料、人造冰晶石等。
一氧化碳与二氧化碳的比较

CO2
CO
色、态、味 溶解性
无色无气味
气体 能溶于水 (1: 0.02)
密度
比空气大
比空气略小
(1.977克/升) (1.250克/升)
四、一氧化碳的用途 1.作气体燃料(可燃性) 2.冶炼金属(还原性)
干冰
大型冷库
贮存食品
人工降雨
人造舞台云雾
CuO CO
一氧化碳与二氧化碳的性质
从前偶一对双胞胎王子一氧化碳和 二氧化碳,他们都是无色无味的, 表面都一样,无法分开,他们同时 喜欢一位美丽的平凡女孩,她叫氢 氧化钙,开始时女孩无法分辨,但 是经过一段相处她就喜欢上了二氧 化碳,那你猜猜为什么?
物理性质
性 质
化学性质
CO与CO2的物理性质的比较:
气体 物理性质
澄清的幻灯片 5石灰水
加热前: 氧化铜
一氧化碳
+
+
一氧化碳
氧化铜
加热幻灯 片氧5时化:铜 一氧化碳
+
+
铜
二氧化碳
与石灰水幻灯片 5反应
鉴定二氧化碳
CO2 + Ca(OH)2 = CaCO3 ↓+ H2O 碳酸钙
一氧化碳和二氧化碳的化学性质不同的原因

一氧化碳和二氧化碳的化学性质不同的原因一氧化碳(CO)和二氧化碳(CO2)是两种不同的化学物质,它们的化学性质不同的原因主要由它们的分子结构以及化学键的性质所决定。
首先,一氧化碳和二氧化碳的分子结构有所不同。
一氧化碳由一个碳原子和一个氧原子构成,而二氧化碳由一个碳原子和两个氧原子构成。
由于二氧化碳有两个氧原子,因此它的氧化态为+4、而一氧化碳只有一个氧原子,因此它的氧化态为+2其次,一氧化碳和二氧化碳的化学键性质不同。
一氧化碳分子中的碳与氧原子之间有一个三重键,而二氧化碳分子中的碳与氧原子之间有两组双键。
由于三重键比双键更容易断裂,一氧化碳的化学性质更为活泼。
当一氧化碳与其他物质反应时,它的碳氧键会断裂,产生一氧化碳和其他产物。
再次,一氧化碳和二氧化碳的相对稳定性也不相同。
由于碳-氧键的特殊性质,二氧化碳的分子比较稳定,不容易发生化学反应。
相比之下,一氧化碳的分子相对不稳定,容易与其他物质发生反应。
一氧化碳在一些常见的燃烧反应中可以被氧气氧化为二氧化碳,并释放大量的能量。
此外,一氧化碳和二氧化碳的毒性也不同。
一氧化碳是一种有毒气体,无色,无味,无臭。
它可以与血红蛋白结合,形成一氧化碳血红蛋白,阻断红细胞携氧能力,导致缺氧和中毒。
而二氧化碳相对安全,它在适当的浓度下是无害的,但当浓度过高时,会导致窒息和缺氧。
综上所述,一氧化碳和二氧化碳的化学性质不同的原因主要有:分子结构的不同、化学键性质的不同、相对稳定性的不同、毒性的不同等。
这些差异使得一氧化碳和二氧化碳在很多方面表现出截然不同的特性和反应行为。
区分二氧化碳和一氧化碳的方法

区分二氧化碳和一氧化碳的方法1、澄清石灰水将澄清的石灰水分别滴入两个气瓶中,可使石灰水变浑浊。
是二氧化碳,但没有明显反应的是一氧化碳。
2、燃烧的木条将燃烧的木棒分别放入两瓶不明气体中。
如果瓶内气体燃烧,气体为一氧化碳;如果木棒的火焰熄灭,气体就是二氧化碳。
3、还原金属氧化物两种气体分别通入热的氧化铜中。
如果氧化铜由黑色变为红色,则为一氧化碳;如果不变色,就是二氧化碳。
4、紫色石蕊溶液在紫色石蕊溶液中通入气体,能使紫色石蕊溶液变红的是二氧化碳,没有明显现象的是一氧化碳。
扩展资料:二氧化碳的特性可燃性:2CO+O₂点燃2CO₂(可燃性气体点燃前一定要检验纯度)H₂和O₂的燃烧火焰是:发出淡蓝色的火焰。
CO和O₂的燃烧火焰是:发出蓝色的火焰。
CH₄和O₂的燃烧火焰是:发出明亮的蓝色火焰。
鉴别:H₂、CO、CH₄可燃性的气体:看燃烧产物(不可根据火焰颜色)(水煤气:H₂与CO的混合气体C+H₂O高温H₂+CO)②还原性:CO+CuO△Cu+CO₂(非置换反应)应用:冶金工业现象:黑色氧化铜逐渐变成鲜红色,石灰水变浑浊。
Fe₂O₃+3CO高温2Fe+3CO₂(现象:红棕色粉末逐渐变成黑色,石灰水变浑浊。
)除杂:CO[CO₂]通入石灰水或氢氧化钠溶液:CO2+2NaOH==Na₂CO₃+H₂OCO₂[CO]通过灼热的氧化铜CO+CuO△Cu+CO₂CaO[CaCO₃]只能煅烧(不可加盐酸)CaCO₃高温CaO+CO₂↑注意:检验CaO是否含CaCO3加盐酸:CaCO₃+2HCl==CaCl₂+H₂O+CO₂↑参考资料来源:百度百科-二氧化碳。
一氧化碳与二氧化碳的比较

血管系統損害及肢體末端壞疽等。診斷急 性一氧化碳中毒並不困難,根據病人所 處環境的特點及相應的症狀即能作出診斷。 為此, 某種情況下需借助於化驗, 測 定血中的碳氧血紅蛋白來診斷。 一氧化碳對人體傷害性
三、如何對煤氣中毒的病人進行搶救? 煤氣中毒在寒冷的冬季時有發生,如遇有煤氣中 毒的病人, 千萬不要驚慌失措, 用冷靜的頭腦搶救中毒病人﹒ 急救治療的方法如 下: 1﹒迅速脫離中毒環境, 如一時不便搬動,可盡 速將門窗打開,把煤爐抬出。 1、對癥處理:煩躁不安者可肌肉注射苯巴比妥鈉 0﹒1–0﹒2 克,如無血壓下降者, 也可肌肉注射鼕眠靈(氯丙)25–50 毫克。
等情況, 感染機會較多, 習慣上多給予青黴素40 萬單位, 一日2 次, 如已有 感染者, 則藥物用量酌情加大, 加用其他抗生素。【註 二】 一氧化碳對人體傷害性 -4瓦斯熱水器應定期檢修保養,避免因老舊而造成燃燒不 完全而產生過量的一氧 化碳。 瓦中熱水器檢修時應以經校正之儀器檢查一氧化碳產生 量,注意是否有過量一 氧化碳產生。
6.小孩子或有心臟血管疾病者,一氧化碳濃 大於15%。 7.神經學檢查異常者。 8.出現缺氧,肌球蛋白尿症,腎功能異常者。 9.胸部X光異常者。
參●結論
一氧化碳是可以避免的,可是依然很多人 疏忽,我們每個人會忘記事情,但是一定 要記得要隨時關瓦斯,部要疏忽掉了,以 免造成重大的新聞報告,
註:ppm是百萬分之一的意思,35ppm=0.0035%!
Q:空氣污染這麼嚴重 好像到處是一氧化碳和 二氧化碳....有辦法預防嗎? ”到處是一氧化碳和二氧化碳”,是很正常的! 但是,只要濃碳排放量在 近幾年是很重要的議題! 除了使用替代能源(太陽能、生質柴油、 燃料電池...等)之外, 以個人的行動去減低空氣污染的方法有很 多,這裡列出幾種:
一氧化碳的用途和二氧化碳

一氧化碳的用途和二氧化碳一氧化碳(CO)和二氧化碳(CO2)是两种常见的含碳气体,具有不同的用途和性质。
首先,让我们来了解一氧化碳的用途。
一氧化碳是一种无色、无臭的气体。
它是通过不完全燃烧有机物(如木材、石油和天然气)产生的。
尽管一氧化碳有毒,但它在工业和生活中仍有一些重要用途。
首先,一氧化碳在工业生产中广泛应用。
它可以用作合成化学品的原料,如聚合物、溶剂和杀虫剂等。
此外,一氧化碳还被用于生产金属,例如铁和钢。
在一氧化碳的存在下,金属与氧气反应形成金属氧化物,从而减少了金属与氧气的接触,延长了金属的使用寿命。
一氧化碳也被广泛应用于燃料电池技术中。
燃料电池将一氧化碳与氢气反应产生电能和二氧化碳,从而实现能源的转化。
这种技术被广泛应用于交通工具、电力站和便携式电子设备等领域。
此外,一氧化碳还被用于医疗领域。
一氧化碳可以与血红蛋白结合,形成一氧化碳血红蛋白,从而提高氧气在体内的输送效率。
因此,一氧化碳治疗法被用于一些与缺氧有关的疾病,如睡眠呼吸暂停综合征和肺动脉高压等。
接下来,让我们来了解一下二氧化碳的用途。
二氧化碳是一种无色、无臭的气体,主要由动植物的新陈代谢和燃烧过程产生。
尽管二氧化碳被认为是温室气体之一,导致全球变暖,但也有一些重要的应用。
首先,二氧化碳被广泛用作工业气体。
在许多工业过程中,二氧化碳被用作溶剂和冷却剂。
例如,二氧化碳可以用于清洗和去污,如干洗和半导体制造等。
此外,二氧化碳还被用于食品和饮料行业,用于制造碳酸饮料、啤酒和气泡酒等。
二氧化碳也被用作消防灭火剂。
由于二氧化碳具有较高的密度,可以迅速覆盖燃烧物表面并阻止氧气供应,从而扑灭火焰。
这种扑灭火焰的方式不会留下残留物和对环境造成污染,因此广泛应用于计算机机房、船舶和飞机等需要特殊灭火剂的场所。
此外,二氧化碳还被用于个人和家庭使用。
例如,二氧化碳气体可以用于制作汽水机、气枪和消防器材等。
在家庭中,一些人还选择使用二氧化碳气体灭虫。
此外,二氧化碳是一种重要的植物营养源。
〈探讨〉CO和CO2的物理性质不同的原因

〈探讨〉CO和CO2的物理性质不同的原因一、引言一氧化碳(CO)和二氧化碳(CO2)是两种常见的无机气体,它们在自然界中广泛存在,并在许多工业和生物过程中起着重要的作用。
虽然它们都是碳的氧化产物,但CO和CO2之间存在着明显的物理性质差异。
本文将探讨这些差异的原因。
二、物理性质的概述CO和CO2的物理性质主要包括密度、沸点、熔点以及溶解性等方面的差异。
1.密度:在相同的条件下,CO2的密度比CO要高。
CO2的分子量为44 g/mol,而CO的分子量为28 g/mol。
因此,CO2分子比CO分子更重,使得CO2在相同体积条件下所占用的空间更大,导致密度较高。
2.沸点和熔点:CO的沸点和熔点分别为-191.5°C和-205°C,而CO2的沸点和熔点分别为-78.5°C和-56.6°C。
这说明CO的沸点和熔点较低,而CO2的沸点和熔点较高。
这是因为CO2的分子中包含有两个较强的双键,使得分子之间的相互作用力增强,从而需要更高的能量才能分离分子。
与此相比,CO的熔点和沸点较低,因为它具有较弱的键能。
3.溶解性:CO2溶解性比CO要高。
这是因为CO2分子中包含有两个极性的氧原子,使得其与水分子之间有更强的相互作用力。
而CO虽然也有一个氧原子,但它仅以三键连接碳原子,使得分子之间的相互作用力较弱,因此其溶解性较低。
三、原因分析CO和CO2具有不同的物理性质的原因主要可以从分子结构、分子之间的相互作用力以及分子量大小等方面进行分析。
1.分子结构:CO的分子结构是线性的,其分子中只包含碳-氧三键。
而CO2的分子结构是线性的,其中包含一个碳-氧双键和一个碳-氧单键。
CO2的分子结构中的双键使得其分子极性较大,而CO的分子结构中只有一个较弱的三键连接,使得分子极性较小。
分子极性的差异导致分子间的相互作用力不同,从而引发了物理性质的差异。
2.分子间的相互作用力:由于CO2的分子结构中存在两个双键,使得分子间的相互作用力增强。
CO2和CO地比较

CO2和CO地比较一. 组成和结构的异同CO和CO2 都是氧化物,由碳和氧元素组成,但一氧化碳比二氧化少一个氧原子,即一氧化碳中的碳还可以与一个氧结合,这种分子结构的不同,使得CO和CO2的性质有很大的不同.二.性质的差异1.密度:CO的密度比空气略小,CO2的密度比空气大得多。
2.水溶性:CO 难溶于水,CO2易溶于水。
3.可燃性:CO 具有可燃性,CO2不支持燃烧,一般也不能燃烧。
4.还原性:CO具有还原性,如:CO+CuO 加热生成Cu+CO2,而CO2无还原性。
5.氧化性:CO不具有氧化性,而CO2具有一定的氧化性,如:CO2+C在高温的条件下生成CO。
6.与水反应:CO 不与水反应,CO2与水反应生成碳酸,而碳酸能使紫色石磊试液变红。
7.与碱溶液反应:CO 不与碱溶液反应,CO2与碱溶液反应,如:CO2与NaOH反应生成Na2CO3。
8.毒性:CO有毒性,CO2无毒性,但空气中含量大时,会使人窒息。
三.CO和CO2的收集由CO 难溶于水,所以用排水法收集,但不能用向下排空气法,原因是:CO 的密度与空气的密度相接近,很难收集到纯净的气体.同时,CO有剧毒。
CO2用向上排空气法,不能用排水法。
原因是:CO2的密度比空气大而且易溶于水。
四.CO和CO2的鉴别方法一将气体分别在空气中点燃,能燃烧的是CO,不能燃烧的是CO2.方法二将气体通入澄清的石灰水中,变浑浊的是CO2,无现象的石CO.方法三将气体通过灼热的CuO,出现黑色粉末变红的石CO,无现象的是CO2。
五.CO 和CO2互除1.除去CO2中含有少量的CO将混合气体通入灼热的CuO中,便可除去CO。
2.除去CO中含有少量的CO2将混合气体通入过量的碱溶液中,便可除去CO2。
一氧化碳及二氧化碳的特性

一氧化碳及二氧化碳的特性一氧化碳(CO)和二氧化碳(CO2)是大气中常见的两种气体,它们在许多方面具有不同的特性。
本文将探讨一氧化碳和二氧化碳的特点及其在环境和人类健康方面的影响。
一氧化碳是一种无色、无味的气体,由一份碳原子和一份氧原子组成。
它是燃烧不完全的产物,可由燃烧煤、油、天然气和木材等有机物所释放。
一氧化碳是一种强大的毒素,因其无色无味的特性而被称为“无声杀手”。
当人们在不良通风的室内使用燃烧设备时,一氧化碳的积累可能会导致中毒甚至死亡。
一氧化碳与血红蛋白结合,使其无法运输氧气到身体各部位,导致组织缺氧。
然而,二氧化碳在大气中的角色却截然不同。
它是一种无色、无味的气体,由一份碳原子和两份氧原子组成。
二氧化碳主要由人类活动产生,如燃烧化石燃料、森林砍伐和土地利用变化。
它也是自然界中的一个循环过程的一部分,例如通过植物吸收二氧化碳、光合作用和地球大气系统的调节。
然而,随着人类活动的增加和工业发展,二氧化碳排放量显著增加,进一步加剧了全球气候变化。
二氧化碳在地球大气中的增加是引起气候变化的主要原因之一。
二氧化碳是一种温室气体,它能够吸收和重新辐射地球表面的红外辐射,从而导致地球温度上升。
这种现象被称为温室效应,长期以来一直是全球变暖的核心问题。
科学家普遍认为,全球变暖将导致海平面上升、极端天气事件的增加和生态系统的失衡,对人类和地球的健康造成巨大威胁。
为减少对气候变化的贡献,国际社会努力限制二氧化碳的排放。
例如,通过使用可再生能源和提高能效来减少化石燃料的使用,推动国际合作以达成减排协议。
同时,技术创新和碳捕捉技术的发展,也为减少大气中二氧化碳含量提供了新的途径。
总结起来,一氧化碳是一种有毒气体,对人体健康产生严重影响。
而二氧化碳是一个温室气体,加剧了全球气候变化的问题。
减少一氧化碳和二氧化碳的排放量,对于环境保护和人类健康至关重要。
我们需要共同努力,采取行动来降低对气候的不良影响,保护我们的地球家园。
二氧化碳和一氧化碳

二氧化碳和一氧化碳
二氧化碳和一氧化碳的性质 相同吗?为什么? 虽然二氧化碳和一氧化碳都是由碳 元素和氢元素组成的,但是在一个二氧 化碳分子中有一个碳原子和两个氧原子, 而在一个一氧化碳分子中含有一个碳原 子和一个氧原子,正是由于分子中氧原 子数目不同,使两者的性质产生了不同.
一、二氧化碳 1、二氧化碳的性质 (1)无色、无味的气体 (2)密度比空气大 (在通常状况下, (3)二氧化碳能溶于水
二、一氧化碳 1 、物理性质: 无色、无味的气体
2、化学性质: (1)一氧化碳的可燃性
(2)一氧化碳的还原性
使氧化铜还原成铜,同时生成二氧化碳
一氧化碳的还原性
从实验 可以看到黑色 的氧化铜变成 了红色的铜, 澄清的石灰水 变浑浊。
CO+CuO
△
Cu+CO2
一氧化碳 ,炭还原氧化铜的比较
尾气处理装置
易散失,从而使全球变暖
除了CO2外、甲烷,臭氧、氟氯代烷 等都可以引起“温室效应”。
海水温度 上升
2、二氧化碳的用途
干冰
结合自己的生活常识,试举例说出 (1)可做致冷剂,保存食品和人工降雨 二氧化碳有哪些用途 (2)可用于灭火
(3)可做气体肥料,促进光合作用 (4)可做化工原料,制纯碱、汽水
CO2 的 用 途
2、日常生活中,为了装饰我们的房子,我们给 墙壁扫石灰水,当石灰水变干时墙壁会被一白色 的物质覆盖,变得很白。在这过程中,为了使效 果更好,人们常在房中放 一盆炭火,这是为什 么呢?利用你所学到的知识解释一下。
答:因为二氧化碳可以与石灰水反应生成 白色沉淀碳酸钙,放一盆炭火可以使 室内的二氧化碳的浓度增大,而且室
1、预防CO中毒的方法: 不要在密闭的房间内生煤炉取暖,如果 一定要用煤炉取暖,需加一个烟囱把废气 通向室外;不能把燃气热水器安装在浴室 内,使用燃气热水器需打开窗户,防止缺 氧燃烧产生CO等等。 2、因为煤气是无色无味的气体,泄漏不易被 察觉,所以家用煤气中搀入了少量的“甲 硫醇”——具有特殊臭味的气体,以提醒 人们。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一氧化碳与二氧化碳的异同点相同点:都是由碳、氧两种元素组成的氧化物,同属无机化合物。
不同点:一、化合价:一氧化碳:碳元素的化合价;二氧化碳:碳元素的化合价。
含氧元素质量分数不同:一氧化碳中含氧质量分数为,二氧化碳中含氧质量分数为二、物理性质:1、一氧化碳:在通常状况下,一氧化碳是色、味、溶于水的气体,熔点-207℃,沸点-191.5℃。
密度空气密度。
2、二氧化碳:在通常状况下是一种色、味的气体,溶于水,通常状况下,一体积水可溶解,压强增大溶解能力;二氧化碳密度比空气,在标准状况下密度为1.977g/L,约是空气的1.5倍。
二氧化碳毒,但不能供给动物呼吸,是一种窒息性气体。
三、化学性质:1、一氧化碳:a、可燃性:一氧化碳能够在空气中或氧气中燃烧,生成二氧化碳:方程式为燃烧时发出色的,放出大量的热。
因此一氧化碳可以作为气体燃料。
与空气混合遇火极易,点燃前必需。
b、还原性:高温时能将许多还原成金属单质,因此常用于的冶炼。
如:将色的氧化铜还原成色的金属铜。
化学方程式在炼铁炉炼铁原料为焦炭、铁矿石(Fe2O3)、含氧较多的空气等,条件是高温。
你认为可能发生的反应有⑴⑵⑶⑷⑸⑹c、毒性:吸入一氧化碳对人体有十分大的伤害。
使人中毒的机理是:2、二氧化碳:a、不能燃烧,不能支持燃烧。
b、不能供给呼吸。
c、能溶于水。
二氧化碳能溶于水并与水反应生成,方程式是使紫色石蕊试液变成红色的物质是;碳酸易分解重新释放出二氧化碳,方程式是,d、二氧化碳可使澄清的石灰水变浑浊,此反应常用于检验二氧化碳的存在:方程式是e、绿色植物的光合作用,把二氧化碳和水合成碳水化合物。
方程式是3、炉火里的反应:在炉火中由下至上可能发生的化学反应有:⑴⑵⑶⑷其它小知识1、关于干冰在20℃时,将二氧化碳加压到50个大气压即可变成无色液体,常压缩在钢瓶中存,在-56.6℃、5个大气压时变为固体。
液态二氧化碳碱压迅速蒸发时,一部分气化吸热,使另一部分骤冷变成雪状固体,将雪状固体压缩,成为冰状固体,即俗你“干冰”。
“干冰”在1标准大气压、-78.5℃时可直接升华变成气体。
干冰可用来2、解释:⑴二氧化碳能灭火是利用它的:、、性质。
⑵新买的汽水饮料捏瓶子会感到很硬,打开瓶盖后会冒出大量气体,瓶子变软。
解释这些现象:⑶一氧化碳和二氧化碳混在一起怎么办?物质性质决定物质用途,同样物质性质也决定着方法的选择。
若一氧化碳中混有二氧化碳怎么办?二氧化碳中混有一氧化碳怎么办?怎样分离一氧化碳和二氧化碳的混合气体呢?比较一氧化碳和二氧化碳的化学性质可以看出,它们的性质有着明显的差异。
(1)可燃性差异。
一氧化碳燃烧,而二氧化碳不燃烧。
(2)还原性差异。
一氧化碳具有还原性,而二氧化碳只具有一定的氧化性。
(3)水溶性差异。
二氧化碳能溶于水,且能与水化合,而一氧化碳不溶于水。
(4)氧化物性质差异。
二氧化碳是酸性氧化物,能与碱溶液反应,而一氧化碳不能与碱溶液反应。
因此,要解决以上问题就变得有法可循。
1、除去一氧化碳中少量的二氧化碳的可能方法:(1)通过大量水。
(2)通过适量碱溶液,如烧碱溶液。
(3)将混合气通过红热的木炭。
最合适的是:2、除去二氧化碳中少量一氧化碳的可能方法:(1)燃烧的方法。
(2)让混合气通过灼热的氧化铜。
最合适的是:3、一氧化碳和二氧化碳混合气的分离。
见如图装置:将混合气从A端通入,通过石灰水后(二氧化碳被足量石灰水吸收),在B端收集一氧化碳;然后打开分液漏斗(盛有盐酸),往石灰水中滴加稀盐酸直到无气体产生,在B端收集二氧化碳。
练习:请写出上述有关反应的化学方程式。
二氧化碳和一氧化碳练习一、选择题(C—12 O—16 Cu—64 S----32)1、下列物质具有可燃性、还原性,且在空气中充分燃烧后产物相同的是()A H2和CB H2和COC CO和CO2D CO和C2、分别用足量的炭粉和一氧化碳还原相同质量的氧化铜,最终生成铜的质量()A炭粉的多 B一氧化碳的多 C一样多 D无法确定3、实验室用一氧化碳还原氧化铜,现有下列各步操作:①点燃酒精灯,加热氧化铜②撤去酒精灯,停止加热③通入CO气体④停止通入CO气体⑤让铜冷却A①②③④⑤ B③①②⑤④ C③②①④⑤ D③①④⑤②4、下列有关二氧化碳的叙述中,错误的是()A自然界的二氧化碳处于循环状态 B二氧化碳可以生产碳酸饮料C干冰用于储存食物和人工降雨 D可用氢氧化钠溶液检验二氧化碳5、大气中,二氧化碳产生的途径有()①人、动植物呼吸②光合作用③燃料燃烧A ①②③B ①③C ②③D ①②6、下列过程中发只生物理变化的是()A二氧化碳通入水中B将二氧化碳加压、降温制成干冰 C刷过石灰浆的墙变硬D绿色植物光合作用7、二氧化碳能使紫色石蕊溶液变红是因为()A 、CO2溶于水形成CO2溶液B、 CO2与水反应生成碳酸C 、CO2能与石蕊反应,使其变红D、 CO2把石蕊氧化成红色8、有关二氧化碳的说法正确的是()A实验室里二氧化碳可由甲烷(CH4)在空气中充分燃烧得到B二氧化碳可用燃着的木条检验C二氧化碳在实验室可用块状石灰石和稀硫酸反应制备 D干冰用于制造舞台烟雾是因为二氧化碳能溶于水9、化学物质是一柄“双刃剑”。
对于二氧化碳利弊评价不正确的是()A干冰可用于人工降雨 B二氧化碳过多会造成“温室效应” C温室中施用二氧化碳对植物生长有利 D二氧化碳越多,抵御紫外线能力越强10、碳酸饮料中含有较多的二氧化碳气体,小星星同学将2—3滴紫色石蕊溶液滴入饮料中,然后加热,可观察到饮料颜色的变化是()A先变蓝后变紫 B先变无色后变红 C先变红后变紫 D变红后颜色不再改变11、香烟烟雾中含有的有毒物质是() A H2 B O2 C CO2 D CO12、下列防止一氧化碳中毒的方法中,正确的是()A在室内放一盆水或经常洒水 B在室内点燃蜡烛,使一氧化碳燃烧 C观察颜色,闻气味 D通入澄清石灰水13、要区分CO和CO2 ,不能使用的方法()A分别通入紫色石蕊溶液B分别通过灼热的氧化铜C观察颜色,闻气味D通入澄清石灰水14、某无色气体是CO、H2 、CO2中的一种或几种,将气体依次通过灼热的氧化铜和澄清石灰水,观察到黑色CuO逐渐变红,澄清石灰水无变化,该气体是()A H2和COB CO 和CO2C H2D CO15、下列化学反应与CO2+Ca(OH)2===CaCO3 +H2O无关的是()A CO2使澄清石灰水变浑浊 B用石灰浆抹的墙日久变硬C盛放石灰水的试剂瓶内形成一层膜D高温煅烧石灰石二、填空题1、除去CO 中少量的CO 2,可将气体通过__________,反应方程式________________________;除去CO 2中少量CO ,应选用试剂为______________________________,发生反应的化学方程式为______________________________________________。
2、金刚石、石墨物理性质不同是因为___________________________,CO 和CO 2化学性质存在很大差异是因为_____________________________________。
3、造成“温室效应”的原因是________________________________,可采用的措施是_______________________________________________________,低碳生活我们可以_________________________________________、___________________________________。
三、简答1、CO 和CO 2都能致人死亡,其原因是。
2、H 2、O 2、CO 2、CO 四种气体中:(1)密度比空气大的是______;(2)能在空气中燃烧的气体是______;(3)能使氧化铜还原的气体是_______;(4)能支持燃烧的气体是_______(5)有毒的气体是_______(6)只能用向上排空气法收集的气体是________(7)能使澄清石灰水变浑浊的气体是______,(8)在空气中燃烧,火焰呈淡蓝色的是_____________,呈蓝色的是________________。
3、用石灰浆刷过的墙,先会出汗,后变坚固,为什么?四、推断题1、为鉴别空气、氮气、氧气、氢气、一氧化碳和二氧化碳六种无色无味的气体,进行如下实验,根据实验现象判断ABCDEF 分别为何种气体,并写出相关方程式A_______B_______C______D______E_______F_______相关方程式:___________________________________________________________________ ______________________________________________________________________________________________________________________________________________________________ 空气 氮气 氧气氢气COCO 2燃着木条 无水珠生成,气体B 使火焰熄灭的气体分别倒入 澄清石灰水 石灰水变浑浊,气体C 石灰水不浑浊,气体D 使木条燃烧更旺,气体E木条燃烧火焰如初,气体F能燃烧的气体 有水珠生成,气体A 干冷烧杯。
