蛋白质杂交技术
蛋白质杂交技术

(三)转膜缓冲液
39mmol/L 甘氨酸 48mmol/L Tris碱 0.037% SDS
20% 甲醇
(四)染色液与脱色液 1.考马斯亮蓝R250染液 100mg考马斯亮 蓝R250溶于40ml 乙醇,加10ml冰醋酸,补 水至100ml。 2.考马斯亮蓝脱色液 40ml 乙醇,加10ml 冰醋酸,补水至100ml。 3.丽春红S贮存液 2g丽春红S,30g三氯乙 酸,30g磺基水杨酸,加水至100ml。
经双丙烯酰胺交联后丙烯酰胺凝胶的 刚性和抗张强度都有所增加,形成的小 孔必须能够允许SDS蛋白复合物通过
这些小孔的孔径随双丙烯酰胺、丙烯 酰胺比率的增加而变小,比率接近1:20 时孔径达到最小值。一般按双丙稀酰胺、 丙烯酰胺为1:29配制
表1 SDS聚丙烯酰胺凝胶的有效分离范围
丙烯酰胺浓度 (%)
2×蛋白上样缓冲液 100mmol/L Tris·Cl(pH 6.8) 200mmol/L二硫苏糖醇(DTT) 4% SDS(十二烷基硫酸钠) 0.2% 溴酚蓝 20%甘油
(二)SDS-PAGE试剂 1.30%丙烯酰胺溶液 丙烯酰胺30g、双
丙烯酰胺0.8g,溶于100ml水中,过滤后贮
于褐色瓶中低温保存,可用一个月。
溶液成分 (ml)
5%积 层胶
水
3.4
30%丙稀酰胺 0.83
1.5mol/L
-
Tris(pH8.8)
1.0mol/L Tris(pH6.8)
0.63
10%SDS
0.05
10%过硫酸胺 0.05
TEMED
0.005
总体积(ml) 5
不同浓度的分离胶 6% 8% 10% 12% 5.3 4.6 4.0 3.3 2.0 2.7 3.3 4.0
蛋白质互作方法总结

研究蛋白质与蛋白质相互作用方法总结-实验步骤蛋白质与蛋白质之间相互作用构成了细胞生化反应网络的一个主要组成部分,蛋白-蛋白互作网络与转录调控网络对调控细胞及其信号有重要意义。
把原来spaces空间上的一篇蛋白质与蛋白质间相互作用研究方法转来,算是实验技巧分类目录的首篇。
一、酵母双杂交系统酵母双杂交系统是当前广泛用于蛋白质相互作用组学研究的一种重要方法。
其原理是当靶蛋白和诱饵蛋白特异结合后,诱饵蛋白结合于报道基因的启动子,启动报道基因在酵母细胞内的表达,如果检测到报道基因的表达产物,则说明两者之间有相互作用,反之则两者之间没有相互作用。
将这种技术微量化、阵列化后则可用于大规模蛋白质之间相互作用的研究。
在实际工作中,人们根据需要发展了单杂交系统、三杂交系统和反向杂交系统等。
Angermayr等设计了一个SOS蛋白介导的双杂交系统。
可以研究膜蛋白的功能,丰富了酵母双杂交系统的功能。
此外,酵母双杂交系统的作用也已扩展至对蛋白质的鉴定。
二、噬茵体展示技术在编码噬菌体外壳蛋白基因上连接一单克隆抗体的DNA序列,当噬菌体生长时,表面就表达出相应的单抗,再将噬菌体过柱,柱上若含目的蛋白,就会与相应抗体特异性结合,这被称为噬菌体展示技术。
此技术也主要用于研究蛋白质之间的相互作用,不仅有高通量及简便的特点,还具有直接得到基因、高选择性的筛选复杂混合物、在筛选过程中通过适当改变条件可以直接评价相互结合的特异性等优点。
目前,用优化的噬菌体展示技术,已经展示了人和鼠的两种特殊细胞系的cDNA文库,并分离出了人上皮生长因子信号传导途径中的信号分子。
三、等离子共振技术表面等离子共振技术(Surface Plasmon Resonance,SPR)已成为蛋白质相互作用研究中的新手段。
它的原理是利用一种纳米级的薄膜吸附上“诱饵蛋白”,当待测蛋白与诱饵蛋白结合后,薄膜的共振性质会发生改变,通过检测便可知这两种蛋白的结合情况。
SPR技术的优点是不需标记物或染料,反应过程可实时监控。
Western杂交

操作步骤:
编辑本段
原理
Western杂交是将蛋白质电泳、印迹、免疫测定融为一体的特异性蛋白质的检测方法。其原理是:生物中含有一定量的目的蛋白。先从生物细胞中提取总蛋白或目的蛋白,将蛋白质样品溶解于含有去污剂和还原剂的溶液中,经SDS-PAGE电泳将蛋白质按分子量大小分离,再把分离的各蛋白质条带原位转移到固相膜(硝酸纤维素膜或尼龙膜)上,接着将膜浸泡在高浓度的蛋白质溶液中温育,以封闭其非特异性位点。然后加入特异抗性体(一抗),膜上的目的蛋白(抗原)与一抗结合后,再加入能与一抗专一性结合的带标记的二抗(通常一抗用兔来源的抗体时,二抗常用羊抗兔免疫球蛋白抗体),最后通过二抗上带标记化合物(一般为辣根过氧化物酶或碱性磷酸酶)的特异性反应进行检测。根据检测结果,从而可得知被检生物(植物)细胞内目的蛋白的表达与否、表达量及分子量等情况。
Western Blot编辑本段回目录此项技术是一种蛋白质的固定和分析技术,是将已用聚丙烯酰胺凝胶或其它凝胶或电泳分离的蛋白质转移到硝酸纤维滤膜上,固定在滤膜上的蛋白质成分仍保留抗原活性及与其它大分子特异性结合的能力,所以能与特异性抗体或核酸结合,其程序Sonthern Blot相似,故称为Western Blot,第一抗体与膜上特异抗原结合后,再用标记的二抗(同位素或非同位素的酶)来检测,此方法可检测1ng抗原蛋白。Western杂交方法灵敏度高,通常可从植物总蛋白中检测出50ng的特异性的目的蛋白。
(2)用一张滤纸,剪成与胶同样大小,在转移电泳缓冲液中预湿,放在Scotch-Brit Pad上,在胶的阴性端放上滤纸,胶的表面用该缓冲液浸湿,排出所有气泡。
(3)在胶的阳极面放置同样大小浸湿的硝酸纤维素膜,排出气泡,再在滤膜的阳极端放置一张滤纸,排出气泡,再放一个Scotch-Brit Pad。
分子杂交名词解释细胞生物学

分子杂交名词解释细胞生物学
分子杂交指的是不同的DNA片段之间,DNA片段与RNA片段之间,如果彼此问的核苷酸排列顺序互补也可以复性,形成新的双螺旋结构。
这种按照互补碱基配对而使不完全互补的两条多核苷酸链相互结合的过程称为分子杂交。
分子杂交是利用分子间特异性结合的原理对核酸或蛋白质进行定性、定量分析的一项技术,主要包括核酸杂交和蛋白质杂交。
核酸分子杂交是在核酸变性及复性基础上建立起来的实验技术,是具有一定同源序列的两条单核苷酸链按碱基互补配对原则在退火条件下形成异质双链的过程。
蛋白质杂交则是一种以抗原—抗体特异性结合为基础的生物技术。
蛋白质杂交技术的原理和应用

蛋白质杂交技术的原理和应用1. 蛋白质杂交技术简介蛋白质杂交技术是一种常用的生物学实验方法,用于研究蛋白质的相互作用及其功能。
通过将两个不同的蛋白质片段或融合蛋白合并在一起,可以检测它们之间是否存在相互作用,并进一步研究这种相互作用的功能和机制。
2. 蛋白质杂交技术的原理蛋白质杂交技术基于DNA分子的互补性原理进行设计。
通过将目标蛋白质的DNA序列与另一个蛋白质的DNA序列连接在一起,形成一个新的杂交DNA,然后将这个杂交DNA转化到宿主细胞中,使宿主细胞表达出杂交蛋白。
通过检测该杂交蛋白的功能或相互作用,可以研究目标蛋白质的功能和相互作用机制。
2.1 DNA互补性原理DNA序列是由四种碱基(腺嘌呤、鸟嘌呤、胸腺嘧啶和胞嘧啶)组成的,碱基之间存在对应关系,即腺嘌呤与胸腺嘧啶之间形成两个氢键,鸟嘌呤与胞嘧啶之间形成三个氢键。
根据这种互补原理,我们可以将两段DNA序列通过相互配对形成一个完整的DNA。
2.2 蛋白质片段连接将两个蛋白质的DNA片段连接在一起时,通常会使用DNA重组技术,通过PCR扩增目标DNA片段并使用限制性内切酶进行切割,之后通过连接酶将两个片段连接在一起,形成杂交DNA序列。
2.3 转染宿主细胞将合成的杂交DNA导入宿主细胞中,可通过多种方式实现,例如利用病毒载体将DNA导入细胞内,或通过电穿孔等物理方法使DNA直接进入细胞。
2.4 杂交蛋白表达和检测转染后,宿主细胞会开始表达杂交DNA中的融合蛋白。
通过特定的检测方法,如免疫印迹、荧光染色、酶活性测定等技术,可以确定杂交蛋白是否成功表达,并进一步研究其功能和相互作用。
3. 蛋白质杂交技术的应用蛋白质杂交技术被广泛应用于生物医学研究和药物开发领域,并取得了重要的成果。
3.1 蛋白质相互作用研究蛋白质杂交技术可用于研究蛋白质间的相互作用关系,从而揭示细胞内的信号传导途径、蛋白质结构和功能等方面的信息。
通过构建杂交蛋白库以及筛选和鉴定具有特定相互作用的蛋白质,可以进一步了解蛋白质的功能和作用机制。
蛋白互作常用的研究方法
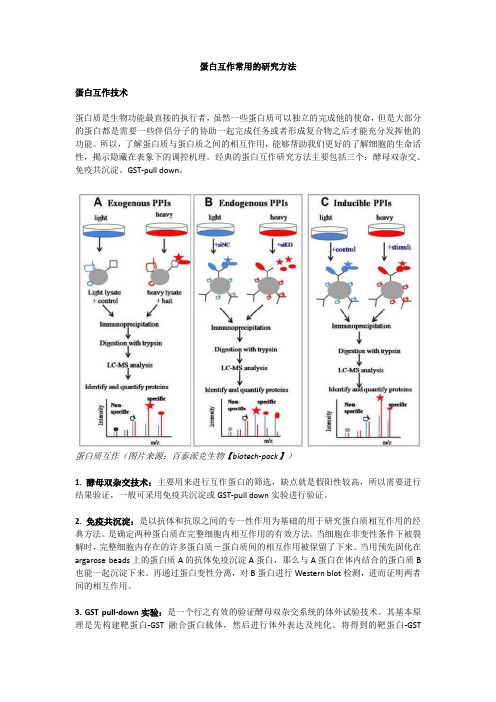
蛋白互作常用的研究方法蛋白互作技术蛋白质是生物功能最直接的执行者,虽然一些蛋白质可以独立的完成他的使命,但是大部分的蛋白都是需要一些伴侣分子的协助一起完成任务或者形成复合物之后才能充分发挥他的功能。
所以,了解蛋白质与蛋白质之间的相互作用,能够帮助我们更好的了解细胞的生命活性,揭示隐藏在表象下的调控机理。
经典的蛋白互作研究方法主要包括三个:酵母双杂交、免疫共沉淀、GST-pull down。
蛋白质互作(图片来源:百泰派克生物【biotech-pack】)1. 酵母双杂交技术:主要用来进行互作蛋白的筛选,缺点就是假阳性较高,所以需要进行结果验证,一般可采用免疫共沉淀或GST-pull down实验进行验证。
2. 免疫共沉淀:是以抗体和抗原之间的专一性作用为基础的用于研究蛋白质相互作用的经典方法。
是确定两种蛋白质在完整细胞内相互作用的有效方法。
当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来。
当用预先固化在argarose beads上的蛋白质A的抗体免疫沉淀A蛋白,那么与A蛋白在体内结合的蛋白质B 也能一起沉淀下来。
再通过蛋白变性分离,对B蛋白进行Western blot检测,进而证明两者间的相互作用。
3. GST pull-down实验:是一个行之有效的验证酵母双杂交系统的体外试验技术。
其基本原理是先构建靶蛋白-GST融合蛋白载体,然后进行体外表达及纯化。
将得到的靶蛋白-GST(Glutathione-S-transferase谷胱苷肽巯基转移酶)融合蛋白亲和固化在谷胱甘肽亲和树脂上,充当一种“诱饵蛋白”,然后将目的蛋白溶液过柱,可从中捕获与之相互作用的蛋白,将目的蛋白洗脱下来,通过SDS-PAGE电泳及western blot分析证实两种蛋白间的相互作用。
以上三种方法是比较经典的研究筛选和验证蛋白互作关系的方法。
但是也存在一定局限性。
酵母双杂交可以大规模的筛选未知的互作蛋白,但是假阳性高,免疫共沉淀及pull down只是对已知的蛋白互作关系进行验证,不能发现新的未知蛋白。
蛋白互作常用的研究方法

蛋白互作常用的研究方法
蛋白质互作常用的研究方法包括酵母双杂交技术、免疫共沉淀和GST pull-down实验。
1. 酵母双杂交技术:主要用来进行互作蛋白的筛选,缺点就是假阳性较高,所以需要进行结果验证,一般可采用免疫共沉淀或GST-pull down实验进
行验证。
2. 免疫共沉淀:是以抗体和抗原之间的专一性作用为基础的用于研究蛋白质相互作用的经典方法。
是确定两种蛋白质在完整细胞内相互作用的有效方法。
当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来。
当用预先固化在argarose beads上的蛋白质A 的抗体免疫沉淀A蛋白,那么与A蛋白在体内结合的蛋白质B也能一起沉
淀下来。
再通过蛋白变性分离,对B蛋白进行Western blot检测,进而证明两者间的相互作用。
3. GST pull-down实验:是一个行之有效的验证酵母双杂交系统的体外试
验技术。
其基本原理是先构建靶蛋白-GST融合蛋白载体,然后进行体外表
达及纯化。
但是也存在一定局限性。
这些方法各有优缺点,应根据研究目的和具体情况选择合适的方法。
蛋白质杂交技术PPT课件

线性分离范围
36~94
5
57~212
1.SDS聚丙烯酰胺凝胶的灌制
(1)安装玻璃板
(2)确定凝胶溶液体积,按所需丙烯酰 胺浓度配制一定体积的分离胶溶液。
依次混合各成分(见下表) 一旦加入TEMED,马上开始聚合,故 应立即快速旋动混合物并进入下步操作
表2 积层胶、分离胶所需溶液成分的配比
(二)SDS聚丙烯酰胺凝胶电泳
✓原理是根据大多数蛋白质都能与阳离子 表面活性剂SDS按重量比结合成复合物
✓使蛋白质复合物所带的负电荷远远超过 天然蛋白质分子所带的负电荷,消除了 不同蛋白质分子的电荷效应
✓蛋白质分子的迁移速率完全取决于分子 量的大小,从而达到了分离不同分子量 大小蛋白质的目的
胶有效分离范围取决于用于灌胶的聚 丙烯酰胺的浓度和交联度。
由于蛋白质的电泳分离几乎总是在变性 的条件下进行,因此,不存在溶解、聚集 以及靶蛋白与外来蛋白的共沉淀等问题。
还具有简便、标本可长期保存、结果便 于比较等优点。
二、试剂
(一)蛋白提取试剂 1.细胞裂解液
20mmol/L Tris(pH 7.5) 150mmol/L NaCl 1% Triton X-100 焦磷酸钠,β-磷酸甘油,EDTA,正钒酸钠 (Na3VO4)亮抑肽素等多种蛋白酶抑制剂
5.TEMED(N,N,N′,N′-四甲基乙二胺) 通过催化过硫酸胺形成自由基而加速丙烯 酰胺与双丙烯酰胺的聚合。 6.Tris-甘氨酸电泳缓冲液 配成10×贮存液备用,在900ml去离子水 中溶解30g Tris碱和144g甘氨酸,然后加入 10g SDS,用HCl调pH至8.3,用去离子水 补至1000ml。 使用前用去离子水稀释成1×应用液。
使用时,将1份上述贮存液加9份去离子 水即为丽春红S应用液,使用后应废弃。
蛋白互作实验方法

蛋白互作实验方法蛋白互作是指蛋白质之间通过物理或化学相互作用形成复合物的过程。
了解蛋白互作的机制对于揭示细胞内不同蛋白之间的功能关系和信号传递网络具有重要意义。
本文将介绍几种常用的蛋白互作实验方法。
1. 免疫共沉淀法(Co-Immunoprecipitation, Co-IP)免疫共沉淀法是一种常用的检测蛋白互作的方法。
其基本步骤为首先选择目标蛋白A,通过特异性抗体结合于固相支持上(如Protein A/G琼脂糖),形成免疫寡聚体;然后用该寡聚体与细胞提取物混合,使抗体与目标蛋白A结合;接下来通过离心将复合物沉淀下来,洗脱杂质,最后将沉淀复合物进行热解、电泳分离和Western blot进行检测。
如结果显示目标蛋白B出现在沉淀物中,则可以判定蛋白A与蛋白B存在互作关系。
2. 酵母双杂交实验(Yeast Two-Hybrid, Y2H)酵母双杂交实验是一种常用的高通量筛选蛋白互作的方法。
其基本原理是将目标蛋白A与一个转录因子的DNA结合域(DBD)融合,形成A-DNA融合蛋白;同时将潜在互作蛋白B与一个激活因子的激活域(AD)融合,形成B-AD融合蛋白。
当A-DNA与B-AD融合蛋白发生互作后,激活域和DNA结合域相互接触,促使报告基因的表达,从而在选择培养基上形成特定的生长。
通过这种方式,可以大规模筛选蛋白互作。
3. 荧光共定位实验荧光共定位实验是一种直观、快速的检测蛋白互作的方法。
通过融合兴趣蛋白A 与绿色荧光蛋白(GFP)或红色荧光蛋白(mCherry)等荧光标记蛋白,将其表达于细胞中。
如果蛋白A与蛋白B发生互作,并且它们定位于细胞的相同或相邻位置,那么在显微镜下观察到的荧光信号将重叠出现。
通过这种方法,可以直观地观察蛋白互作的情况。
4. 基于亲和柱的互作分析基于亲和柱的互作分析是一种高效的检测蛋白互作的方法。
亲和柱是一种包含特定亲和配体(如金属离子、抗原-抗体、蛋白A/G等)的柱状介质。
首先将一个潜在的互作蛋白A融合到亲和配体上,使其固定在亲和柱上;然后将细胞提取物加载到亲和柱上,使蛋白A能与目标蛋白B结合;接下来通过洗脱步骤将非特异性结合的蛋白去除,最后用适当的方法检测目标蛋白B的存在。
蛋白互作技术

蛋白互作技术蛋白互作技术是一组用于研究蛋白质之间相互作用的实验和分析方法。
这些方法可以帮助科学家们了解蛋白质在细胞中的功能、信号传导、代谢途径等方面的机制。
以下是一些常见的蛋白互作技术:1. 酵母双杂交法(Yeast Two-Hybrid, Y2H):这是一种常用的高通量蛋白互作筛选方法。
该技术利用酵母细胞内的转录激活域(activation domain)和DNA结合域(DNA-binding domain)的相互作用来检测蛋白质蛋白质相互作用。
2. 免疫共沉淀法(Co-Immunoprecipitation, Co-IP):这种方法利用抗体将目标蛋白质与其相互作用的蛋白质一起沉淀下来,以研究它们之间的相互作用。
3. 质谱法(Mass Spectrometry, MS):MS技术可以用于鉴定蛋白质复合物中的成员。
典型的方法包括液相色谱串联质谱(LC-MS/MS)。
4. 表面等离子体共振法(Surface Plasmon Resonance, SPR):SPR技术可以实时监测生物分子之间的相互作用,包括蛋白质与蛋白质之间的相互作用。
5. 蛋白质片段互作法(Protein Fragment Complementation Assay, PCA):这种方法通过将蛋白质分割成两个片段,然后将这些片段连接到蛋白质感兴趣的两个互补位置上,观察是否形成功能性蛋白质复合物。
1/ 26. 拉曼光谱法(Raman Spectroscopy):这是一种基于散射光的技术,可用于研究蛋白质之间的相互作用以及蛋白质结构的变化。
这些技术的选择通常取决于研究者的具体研究问题、目标蛋白质的性质以及实验室可用的设备和资源。
多种方法的综合应用有助于全面理解蛋白质相互作用网络。
2/ 2。
10实验四五(三)蛋白质原位杂交

附:Ehrich苏木精中染色 Ehrich苏木精中染色
1、前面片经95%、各级的酒精中入水洗后。 、前面片经95%、各级的酒精中入水洗后。 2、Ehrich苏木精中染色10分钟。 Ehrich苏木精中染色10分钟。 3、在清水中冲洗10min。材料由红色变为兰色, 、在清水中冲洗10min。材料由红色变为兰色, 4、1%伊红Y滴液得2-3分钟。 %伊红Y滴液得2 5、流水冲洗10-30min。 、流水冲洗10-30min。 6、30%、50%、70%、80%、90%、95%、 30%、50%、70%、80%、90%、95%、 100%的酒精中顺次脱水,每级3 5min。 100%的酒精中顺次脱水,每级3-5min。 7、纯酒精和松节油的混合液(1:1)中5min。 、纯酒精和松节油 松节油的混合液(1 )中5min。 8、入松节油5min。 、入松节油 松节油5min。 9、用加拿大树胶封藏。
四、显色: 显色: 加显色液反应20 30分钟避光 20- 分钟避光)。 加显色液反应20-30分钟避光)。
五、封片 1、脱水 蒸馏水,50%乙醇 乙醇, 乙醇, PBS ,蒸馏水,50%乙醇, 70% 乙醇, 80%乙醇 乙醇, 90%乙醇 95%乙醇 乙醇, 乙醇, 80%乙醇, 90%乙醇,95%乙醇, 100%乙醇,100%乙醇各10分钟。 100%乙醇,100%乙醇各10分钟。 乙醇 乙醇各10分钟 透明½无水乙醇) 1/2松节油 松节油, 2、透明½ 无水乙醇) 1/2松节油, 松节油I 松节油II 10分钟 封片。 II各 分钟, 松节油I,松节油II各10分钟,封片。 4、镜检
6、Solution A洗四次,15分钟/次。 A洗四次 15分钟 洗四次, 分钟/ 加二抗2小时。 7、加二抗2小时。 A洗四次 洗四次, 15分钟 分钟/ 8、Solution A洗四次, 15分钟/次。
蛋白质种类检测

蛋白质种类检测
蛋白质种类检测的方法主要包括以下几种:
1.免疫印迹法(Western Blot):这是一种将高分辨率凝胶电泳和免疫化学分析
技术相结合的杂交技术。
其基本原理是通过特异性抗体对凝胶电泳处理过的细胞或生物组织样品进行着色,并通过分析着色的位置和着色深度获得特定蛋白质在所分析的细胞或组织中的表达情况的信息。
2.质谱法(Mass Spectrometry,MS):这是一种通过将样品分子转化为带电
离子并测量这些离子质量与电荷比(质荷比)来进行分析的方法。
在蛋白质组学研究中,质谱技术主要用于蛋白质的鉴定。
3.高效液相色谱法(High Performance Liquid Chromatography,HPLC):
这是一种色谱法,其固定相是液体,流动相也是液体,流动相带着待测样品(溶解在流动相中)流过固定相,两者发生作用,从而实现对待测样品的分离。
4.荧光光谱法:这是一种基于物质荧光现象的分析方法,通过测量物质的荧光强
度、波长位置、荧光寿命、荧光偏振等与荧光物质的光物理特性密切相关的参数,从而进行物质的定性或定量分析。
5.酶联免疫吸附测定法(Enzyme-Linked Immunosorbent Assay,ELISA):
这是一种将抗原与抗体的特异性反应与酶对底物的高效催化作用相结合起来的敏感方法。
可用于检测大分子抗原和特异性抗体等,具有快速、灵敏、简便、载体易于标准化等优点。
请注意,以上只是蛋白质种类检测的部分方法,还有其他方法如凝胶电泳、X射线晶体学等,具体选择哪种方法取决于研究目标、样品特性以及实验室条件等因素。
蛋白免疫印迹杂交实验方法

Western Blot(蛋白质免疫印迹技术)一、实验原理:与Southern或Northern杂交方法类似,但Western Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。
经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。
以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。
该技术也广泛应用于检测蛋白水平的表达。
Western Blot(WB)是通过聚丙烯酰胺电泳根据分子量大小分离蛋白后,将蛋白转移至固相支持物—NC膜上,根据抗原和抗体之间的反应特性,通过特异性试剂(抗体)作为探针(一抗/二抗),对靶物质(抗原)进行检测。
蛋白质的Western印迹技术结合了凝胶电泳的高分辨率和固相免疫测定的特异敏感等多种特点,可检测到低至1~5ng(最低可到10-100pg)中等大小的靶蛋白。
Western Blot 流程图:样品聚丙烯酰胺凝胶电泳(SDS-PAGE)转膜封闭洗膜(3×5mins)孵育一抗(4度过夜或室温4-6小时)洗膜(3×10mins)孵育二抗(室温2小时)洗膜(3×10mins)显影SDS-PAGE分离蛋白的原理和操作:1. SDS-PAGE作用原理聚丙烯酰胺凝胶是网状结构,具有分子筛效应,它有两种形式,一种是非变性聚丙烯酰胺凝胶,蛋白质在电泳中保持完整的状态,蛋白在其中依三种因素分开:蛋白大小,形状和电荷。
另外一种是SDS-PAGE,SDS-PAGE仅根据蛋白分子量亚基的不同而分离蛋白。
这个技术首先是1967年由shapiro建立,他们发现在样品介质和丙烯酰胺凝胶中加入离子去污剂和强还原剂后,蛋白质亚基的电泳迁移率主要取决于亚基分子量的大小,电荷因素可以忽视。
分子杂交技术

分子杂交技术分子杂交技术是基因工程中使用频率很高的一项技术,主要用于检测和鉴定,可以分为核酸分子之间的杂交和蛋白质分子之间的杂交。
常用的技术有下列三种。
杂交——DNA和DNA分子之间的杂交。
目的基因是否整合到受体生物的染色体DNA 中,这在真核生物中是目的基因可否稳定存在和遗传的关键。
如何证明这一点,就需要通过Southern杂交技术。
基本做法:第一步,将受体生物DNA提取出来,经过适当的酶切后,走琼脂糖凝胶电泳,将不同大小的片段分开;第二步,将凝胶上的DNA片段转移到硝酸纤维素膜上;第三步,用标记了放射性同位素(或生物素)的目的DNA片段作为探针与硝酸纤维素膜上的DNA进行杂交;第四步,将X光底片压在硝酸纤维素膜上,在暗处使底片感光;第五步,将X光底片冲洗,如果在底片上出现黑色条带,则表明受体植物染色体DNA上有目的基因。
杂交——DNA和RNA分子之间的杂交。
它是检测目的基因是否转录出mRNA的方法,具体做法与Southern杂交相同,只是第一步从受体生物中提取的是mRNA而不是DNA,杂交带的显现也与Southern杂交相同。
杂交——蛋白质分子(抗原—抗体)之间的杂交。
它是检测目的基因是否表达出蛋白质的一种方法。
具体做法:第一步,目的基因在大肠杆菌中表达出蛋白质;第二步,将表达出的蛋白质注射入动物体内进行免疫,产生相应的抗体,并提取出抗体(一抗);第三步,从转基因生物中提取蛋白质,凝胶电泳;第四步,将凝胶中的蛋白转移到硝酸纤维素膜上;第五步,将抗体(一抗)与硝酸纤维素膜上的蛋白杂交,这时抗体(一抗)与目的基因表达的蛋白(抗原)会特异性结合。
由于这种抗原—抗体的结合显示不出条带,所以加入一种称为二抗的抗体,它可以与一抗结合,二抗抗体上带有特殊的标记。
如果目的基因表达出了蛋白质,则结果为阳性。
蛋白斑点杂交操作流程

蛋白斑点杂交操作流程英文回答:Protein blotting is a widely used technique in molecular biology to detect and analyze proteins. One common method is the Western blot, which involves transferring proteins from a gel to a membrane and then detecting specific proteins using antibodies. The process typically involves several steps, including sample preparation, gel electrophoresis, transfer to a membrane, blocking, antibody incubation, and detection.First, the protein sample needs to be prepared. This involves extracting proteins from cells or tissues and then separating them by size using gel electrophoresis. The proteins are loaded onto a polyacrylamide gel, and an electric current is applied to separate them based on their molecular weight.After gel electrophoresis, the proteins need to betransferred from the gel to a membrane. This is typically done using a technique called electroblotting or Western blotting. The gel is placed on top of a membrane, and an electric current is applied to transfer the proteins onto the membrane. This ensures that the proteins are in a more accessible position for antibody detection.Once the proteins are transferred to the membrane, the next step is blocking. This involves incubating the membrane in a blocking solution, such as nonfat milk or bovine serum albumin, to prevent nonspecific binding of antibodies. Blocking helps to reduce background noise and improve the specificity of the antibody detection.After blocking, the membrane is incubated with primary antibodies. These antibodies recognize and bindspecifically to the target protein of interest. The primary antibodies are typically produced in animals, such as rabbits or mice, and can be purchased commercially. The membrane is incubated with the primary antibodies overnight or for a few hours to allow for specific binding.After incubation with primary antibodies, the membrane is washed to remove any unbound antibodies. This step helps to remove nonspecific binding and reduce background noise. The membrane is then incubated with secondary antibodies, which are antibodies that recognize and bind to the primary antibodies. The secondary antibodies are conjugated to a detection molecule, such as an enzyme or a fluorescent dye, which allows for the visualization of the target protein.Finally, the target protein is detected using a detection method appropriate for the secondary antibody. For example, if the secondary antibody is conjugated to an enzyme, a substrate is added that produces a visible signal upon enzymatic reaction. This signal can be visualized using various imaging techniques, such as chemiluminescence or colorimetry.中文回答:蛋白斑点杂交是分子生物学中广泛使用的一种技术,用于检测和分析蛋白质。
蛋白质与蛋白质相互作用的技术

蛋白质与蛋白质相互作用的技术
蛋白质与蛋白质相互作用的技术主要包括酵母双杂交技术、免疫共沉淀技术、荧光能量转移技术、噬菌体展示技术等。
这些技术可用于研究蛋白质之间的相互作用,从而深入了解生命活动的机制。
1.酵母双杂交技术:这是一种有效的筛选蛋白质相互作用的方法,尤其适用
于大规模蛋白质之间相互作用的研究。
通过将目标蛋白与报告基因连接,在酵母细胞中检测报告基因的表达,可以确定目标蛋白与其他蛋白的相互作用。
2.免疫共沉淀技术:利用抗体与抗原之间的特异性结合,将目标蛋白与其他
相关蛋白一起沉淀下来,然后通过Western blot等技术对沉淀的蛋白质进行分析。
通过这种方法可以检测到目标蛋白与其他蛋白质的直接相互作用或者间接相互作用。
3.荧光能量转移技术:一种高灵敏度的检测蛋白质相互作用的方法。
该技术
利用荧光物质标记目标蛋白,通过检测荧光物质之间的能量转移,来间接检测蛋白质之间的相互作用。
4.噬菌体展示技术:将外源基因插入噬菌体外壳蛋白基因的技术,使外源基
因编码的蛋白质与噬菌体外壳蛋白融合,并在噬菌体表面展示出来。
通过该技术可以筛选与目标蛋白相互作用的蛋白质,并对相互作用进行定量分析。
蛋白质互作的主要方法及原理

蛋白质互作的主要方法及原理1. 蛋白质互作的基础知识1.1 什么是蛋白质互作大家知道,蛋白质是我们身体里的“小工人”,负责各种各样的任务。
蛋白质互作就是这些“小工人”之间的合作。
简单说,就是一种蛋白质和另一种蛋白质“牵手”,一起完成工作。
这种合作关系在生物体内至关重要,像是你跟朋友一起完成一个大项目,单打独斗可不行。
1.2 蛋白质互作的意义这“牵手”不仅是为了完成某个任务,还能调节各种生理过程。
比如,细胞里的信号传递、免疫反应,甚至某些疾病的发生,都是通过这些蛋白质之间的互动来实现的。
就好比一个团队里,有的人负责计划,有的人负责执行,大家一起才能达成目标。
2. 主要的蛋白质互作方法2.1 酵母双杂交技术这是一种用来研究蛋白质互作的经典方法。
想象一下,你在实验室里建了一个小小的“蛋白质社交圈”,看看哪些蛋白质愿意“握手”。
这种方法就像是在“社交聚会”中找朋友,看看谁和谁有缘分。
具体来说,它是通过在酵母细胞中引入两个不同的蛋白质,并观察它们是否能结合在一起,从而确定它们是否存在互作。
2.2 免疫共沉淀另一种方法是免疫共沉淀,听起来有点复杂,但其实就是通过抗体来“抓住”我们感兴趣的蛋白质。
这个过程就像是在海里捞鱼,我们用一个“网”(抗体)去捞那些我们想知道的蛋白质,再看它们有没有带其他“伙伴”(互作蛋白质)一起上来。
这样,就能确定这些蛋白质之间是否有互动了。
2.3 表面等离子共振(SPR)表面等离子共振是一种高科技的方法,能够实时监测蛋白质互作。
可以把它想象成一种“高科技监控”,能够在蛋白质互作的过程中实时“录像”,记录下每一个细节。
这种技术非常精确,可以让我们看到蛋白质之间的微小变化,就像是细致入微地观察一个人的每一个动作和表情。
3. 蛋白质互作的应用3.1 药物开发通过了解蛋白质互作,我们可以在药物开发上大显身手。
比如,某些疾病的发生是由于蛋白质互作的异常,我们可以设计药物去干预这些异常的互作,从而治疗疾病。
蛋白斑点杂交操作流程

蛋白斑点杂交操作流程英文回答:Protein Dot Blot Procedure:Materials:Protein sample.Dot blot apparatus (e.g., Bio-Dot® Microfiltration Apparatus)。
Nitrocellulose membrane.Phosphate-buffered saline (PBS)。
Blocking buffer (e.g., 5% non-fat milk in PBS)。
Primary antibody.Secondary antibody conjugated to an enzyme (e.g., horseradish peroxidase)。
Substrate (e.g., DAB)。
Procedure:1. Sample Preparation: Dilute the protein sample in PBS to an appropriate concentration.2. Membrane Preparation: Cut a piece of nitrocellulose membrane to fit the dot blot apparatus. Wet the membrane with PBS for 1-2 minutes.3. Dotting: Apply aliquots of the protein sample (e.g., 1 µL) to the membrane using the dot blot apparatus. Allow the samples to air dry.4. Blocking: Incubate the membrane with blocking buffer for 1-2 hours at room temperature to prevent non-specific binding.5. Antibody Binding: Incubate the membrane with the primary antibody diluted in blocking buffer for 1-2 hours at room temperature or overnight at 4°C.6. Washing: Rinse the membrane with PBS 3 times for 10 minutes each to remove unbound primary antibody.7. Secondary Antibody Binding: Incubate the membrane with the secondary antibody conjugated to an enzyme diluted in blocking buffer for 1-2 hours at room temperature.8. Washing: Rinse the membrane with PBS 3 times for 10 minutes each to remove unbound secondary antibody.9. Detection: Incubate the membrane with a substrate solution (e.g., DAB) for 5-15 minutes. The reaction will produce a colored precipitate at the locations where the protein of interest is bound.10. Image Acquisition: Allow the reaction to stop by rinsing the membrane with water. Capture an image of the membrane to visualize the protein spots.中文回答:蛋白质斑点杂交操作步骤:材料:蛋白质样品。
蛋白质杂交

洗去未结合的二抗:倒掉二抗溶液,用PBS漂洗液滤膜3 次,每次10min。
回收一抗溶液?
在Western或免疫荧光染色等操作后,请注意回收稀释的 抗体。回收的抗体在进行Western或免疫荧光染色时至少 可以重复使用10次。稀释后的抗体,包括已经使用过的稀 释抗体,4℃保存。 回收后重复使用的抗体,使用方法同新鲜稀释的抗体。 如果在重复使用过程中发现抗体出现轻微混浊现象,可以 10000g离心1-3分钟,取上清用于后续检测。如果回收的 抗体出现明显的絮状物或长霉长菌等情况,则可以考虑废 弃该抗体。
1)电压,小的电压会使胶的分子筛效应得到充分发挥, 电压越小,条带越漂亮。
转膜
价格便宜 硝酸纤 维素膜
简单快速封闭非特异性抗体结合 封闭非特异性抗体结合麻烦
膜的选择 尼龙膜 价格昂贵
需要更高的蛋白结合率
(尼龙膜: 480µ g/cm2 ;硝酸纤维素膜:80µ g/cm2 )
特殊要求下的选择 目的蛋白与硝酸纤维膜的结合能力弱 需要更大的机械强度
一抗选择
免疫组化时抗体识别的是未经变性处理的抗原决定簇(又称表位), 有些表位是线性的,而有的属于构象型;线性表位不受蛋白变性的影 响,天然蛋白和煮后的蛋白都含有;构象型表位由于受蛋白空间结构 限制,煮后变性会消失。如果你所用的抗体识别的是蛋白上连续的几 个氨基酸,也就是线性表位,那么这种抗体可同时用于免疫组化和 Western,而如果抗体识别构象形表位,则只能用于免疫组化。一般 抗体说明书上都有注明此种抗体识别的氨基酸区间。 单抗:识别单个抗原表位,所以特异性高。但如果所识别的抗原表位 被破坏,则会影响实验结果,这也是单抗的缺点之一; 多抗:虽然存在交叉反应的问题,但由于识别多个抗原表位,所以即 使有少数几个抗原表位被破坏,仍然不会影响实验结果,这是多抗的 优点之一。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•被转移到固相支持物上,固相支持物以非 共价键的形式吸附蛋白质
•以固相支持物上的蛋白质为抗原,与对应 的抗体发生特异性的抗原抗体结合反应
•与酶或同位素标记的第二抗体发生反应
•经过底物显色或放射自显影,以检测电泳 分离的靶蛋白。
20mmol/L Tris(pH 7.5) 150mmol/L NaCl 1% Triton X-100 焦磷酸钠,β-磷酸甘油,EDTA,正钒酸钠 (Na3VO4)亮抑肽素等多种蛋白酶抑制剂
2×蛋白上样缓冲液 100mmol/L Tris·Cl(pH 6.8) 200mmol/L二硫苏糖醇(DTT) 4% SDS(十二烷基硫酸钠) 0.2% 溴酚蓝 20%甘油
15
线性分离范围 (kD)
12~43
10
16~68
7.5
36~94
5
57~212
1.SDS聚丙烯酰胺凝胶的灌制
(1)安装玻璃板
(2)确定凝胶溶液体积,按所需丙烯酰 胺浓度配制一定体积的分离胶溶液。
依次混合各成分(见下表) 一旦加入TEMED,马上开始聚合,故 应立即快速旋动混合物并进入下步操作
表2 积层胶、分离胶所需溶液成分的配比
第四节 蛋白质杂交技术
•检测DNA可用Southern印迹法
•检测RNA可用Northern印迹法
•检 测 蛋 白 质 同 样 有 蛋 白 质 印 迹 法 (Western印迹法)
•蛋白质印迹是将蛋白质转移到固相支持 物上,然后利用抗体与附着于固相支持 物上的靶蛋白发生特异性的抗原抗体结 合反应
一、原理
2.5 2.5 2.5 2.5
- --
-
0.1 0.1 0.1 0.1
0.1 0.1 0.1 0.1
0.008 0.006 0.004 0.004
10 10 10
10
15% 2.3 5.0 2.5
- 0.1 0.1 0.004 10
(3)迅速在两板的间隙灌注丙烯酰胺溶 液,留出积层胶所需空间(梳子的齿长 再加1cm)。然后小心的在丙烯酰胺溶液 上加一层去离子水。凝胶垂直放置于室 温下。 (4)分离胶聚合完全后(约30min), 倾斜倒出覆盖的去离子水。 (5)配制5%积层胶。
(二)SDS聚丙烯酰胺凝胶电泳
•原理是根据大多数蛋白质都能与阳离子 表面活性剂SDS按重量比结合成复合物
•使蛋白质复合物所带的负电荷远远超过 天然蛋白质分子所带的负电荷,消除了 不同蛋白质分子的电荷效应
•蛋白质分子的迁移速率完全取决于分子 量的大小,从而达到了分离不同分子量 大小蛋白质的目的
•胶有效分离范围取决于用于灌胶的聚丙 烯酰胺的浓度和交联度。
•Western印迹有SDS-PAGE的高分辨力
•固相免疫测定的高特异性和敏感性,可测 出1ng~5ng中等大小的蛋白质。
•由于蛋白质的电泳分离几乎总是在变性的 条件下进行,因此,不存在溶解、聚集以 及靶蛋白与外来蛋白的共沉淀等问题。
•还具有简便、标本可长期保存、结果便于 比较等优点。
二、试剂
(一)蛋白提取试剂 1.细胞裂解液
溶液成分 (ml)
5%积 层胶
水
3.4
30%丙稀酰胺 0.83
1.5mol/L
-
Tris(pH8.8)
1.0mol/L Tris(pH6.8)
0.63
10%SDS
0.05
10%过硫酸胺 0.05
TEMED
0.005
总体积(ml) 5
不同浓度的分离胶 6% 8% 10% 12% 5.3 4.6 4.0 3.3 2.0 2.7 3.3 4.0
•经双丙烯酰胺交联后丙烯酰胺凝胶的刚 性和抗张强度都有所增加,形成的小孔 必须能够允许SDS蛋白复合物通过
•这些小孔的孔径随双丙烯酰胺、丙烯酰 胺比率的增加而变小,比率接近1:20时 孔径达到最小值。一般按双丙稀酰胺、 丙烯酰胺为1:29配制
表1 SDS聚丙烯酰胺凝胶的有效分离范围
丙烯酰胺浓度 (%)
3.10% SDS 可用去离子水配成贮存液 保存于室温。 4.10%过硫酸胺 •过硫酸胺提供丙烯酰胺和双丙烯酰胺聚 合所必需的自由基。 •可用去离子水配制小量的贮存液并保存 于4℃冰箱中。 •由于过硫酸胺会缓慢分解,故应隔周重 新配制。
5.TEMED(N,N,N′,N′-四甲基乙二胺) 通过催化过硫酸胺形成自由基而加速丙烯 酰胺与双丙烯酰胺的聚合。 6.Tris-甘氨酸电泳缓冲液 •配成10×贮存液备用,在900ml去离子水 中溶解30g Tris碱和144g甘氨酸,然后加入 10g SDS,用HCl调pH至8.3,用去离子水 补至1000ml。 •使用前用去离子水稀释成1×应用液。
使用时,将1份上述贮存液加9份去离子 水即为丽春红S应用液,使用后应废弃。
(五)封闭液
5%脱脂奶粉 0.01% 防沫剂A 0.02%叠氮钠 溶于磷酸盐缓冲液(PBS)
三、实验方法
(一)样品前处理 •细菌一般直接用蛋白上样缓冲液裂解; •真核细胞或哺乳动物组织通常加细胞裂解 液,机械或超声波室温匀浆0.5min~1min。 •4℃ 10,000g~13,000g离心5min,取上清 •按照每4μl蛋白样品加入1μl 5×蛋白上样缓 冲液的比例混合。100℃水浴加热3min~ 5min,以充分变性蛋白。 •冷却到室温SDS-PAGE试剂 1.30%丙烯酰胺溶液 丙烯酰胺30g、双
丙烯酰胺0.8g,溶于100ml水中,过滤后贮
于褐色瓶中低温保存,可用一个月。
2.Tris缓冲液 (1)1.5mol/L Tris(pH8.8)/积层胶缓冲液: Tris碱 18.17g,用HCl调pH8.8,加水至 100ml。 (2)1.0mol/L Tris(pH6.8)分离胶缓冲液: Tris碱 12.11g,用HCl调pH6.8,加水至 100ml。
(三)转膜缓冲液
39mmol/L 甘氨酸 48mmol/L Tris碱 0.037% SDS
20% 甲醇
(四)染色液与脱色液 1.考马斯亮蓝R250染液 100mg考马斯亮 蓝R250溶于40ml 乙醇,加10ml冰醋酸,补 水至100ml。 2.考马斯亮蓝脱色液 40ml 乙醇,加10ml 冰醋酸,补水至100ml。 3.丽春红S贮存液 2g丽春红S,30g三氯乙 酸,30g磺基水杨酸,加水至100ml。
