固体表面能的简单讨论
表面能计算原理说明

表面能計算原理說明表面能為固體與氣體間之界面張力的一般定義,如同液體的表面張力為液體與氣體間之界面張力以表示,同樣的固-氣間的界面張力以表示,然而表面能雖然可明確被定義,然而卻無法如液體一樣被直接測量.由楊氏熱力平衡方程式如下:=+:固體表面能, :液體表面張力, :固-液間界面張力, :接觸角上述方程式右邊及可由儀器測量而得,然而尚有兩個未知數,因此無法直接算出表面能,因此表面能並無所謂正確或標準值,只能由一些模型中提供另一組方程式以便求出 ,這些模型皆有假設條件,因此所算出的結果只能算是表面能近似值.目前常用的模型如下:1.Zisman Plot (critical wetting tension)2.Fowkes3.Owens-Wendt-Rabel-Kaelble (OWRK)4.Extended Fowkes5.Wu harmonic mean6.Equation-of-state7.Lewis acid/base theory使用上述方法各別計算,可能得到之結果彼此有高達25%的差異,然而每種方法皆有其適用的表面固體,然而卻無所謂正確或標準值,雖然如此,表面能仍具有原理的基礎性,可如液體表面張力般具備客觀性,同時對於一般所適用的模式,其誤差還是在可接受的範圍內.臨界表面張力- Zisman Plot由楊氏熱力平衡方程式如下:=+其中::接觸角,:固體表面能, :液體表面張力, :固-液間界面張力適用: 表面能< 100 mN/m(低能表面)的固體表面,液滴在表面形成的接觸角主要是液體表面張力的函數,對於給定的固體表面和同系列的相關液體(如烷? 二烷基脂和烷基鹵化物), 與有近似線性關係.對於非極性液體,關係十分相符,然對於高表面張力的極性液體,關係並不十分符合,直線開始彎曲.從對的曲線中,在=1時,可以得到固體的表面張力,稱為潤濕臨界表面張力,它的定義是指液體剛好鋪展到固體表面產生完全潤濕時的表面張力,即時,液體將鋪展,當時,液體將形成液滴,具有非零接觸角.Fowkes方法假定: 液體及固體表面張力可分為色散力和極性作用力,若固液兩相中有一相是非極性,則固液之間只有色散力相互作用,無極性作用力:; 無極性作用力,則Ip = 0.即或式中和分別表示固體和液體表面張力的色散力部份.根據(1.4), 對作圖得一直線,其斜率為, 從直線斜率可得到固體的值.對於非極性固體, , 故用Fowkes方法,可得到非極性固體的表面能.對於非極性液體,也有, 根據(1-4)式, 可得出下式:當時,用Zisman方法得到的非極性固體臨界表面張力可表徵其固體的表面能.Owens-Wendt-Rabel-Kaelble (OWRK) Method 假定: 分子色散力(disperse)和極性力(polar)為各自獨立作用且合力可加總測試液體數量: n >= 2Extended Fowkes Method假定: 分子色散力(disperse),極性力(polar)及氫鍵力(hydrogen-bond)為各自獨立作用且合力可加總測試液體數量: n >= 3Wu (harmonic mean)方法1. 使用倒數平均法計算不同分子間的作用力2. 不僅考慮色散力,也同時考慮分子間極性作用力的影響.得到下列公式:式中表示表面張力的極性影響力, 和分別表式固體表面能和液體的表面張力,故只要測兩種或兩種以上極性不同的液體在固體表面的接觸角,解聯立方程式,即可得出固體表面能和值.Equation-of-State (Neumann)假定: 固體,液體表面張力和固液界面張力間存在某種關係,且表面張力及界面張力並非各種作用力之加總結果∙[1]∙[2]∙Young’s Eq.: In combination with Eq. [2], the following equation-of-state was derived :∙[3]∙The value of is determined using the Newton's routine from Eq. [3].∙測試液體數量: n = 1Acid-Base method假定固體表面自由能藉由三大項所組成:非極性項(分散力項)、路義士酸(Lewis acid)項、。
2-第二章-固体表面

第二章固体表面§2-1 固体表面特征及类型§2-2 固体表面能§2-3 固体表面分析技术固体表面:一般指固气界面,它实际上是由凝聚态物质靠近气体或真空的一个或几个原子层(0.5~10nm)组成。
界面是相与相之间的交界所形成的物理区域。
若其中一相为气体,这种界面通常称为表面。
界面是一个区域,在该区域中从一相之性质变为邻相之性质。
此种转变至少在分子大小的距离才能表现出来。
故界面/表面有厚度,而非简单的几何面。
①绝大多数晶体是各向异性,因而同一晶体可以有许多性能不同的表面。
(1)不均匀固体表面两大特征(2)存在力场ZnO微米棒②晶格缺陷、空位或位错可造成表面不均匀。
(1)不均匀性固体表面两大特征肖特基缺陷弗伦克尔缺陷线缺陷(刃型位错线缺陷(螺旋位错)③在空气中暴露,表面被外来物质所污染,吸附外来原子,外来原子可占据不同的表面位置,形成有序或无序排列,也引起表面不均匀。
(1)不均匀性固体表面两大特征④固体表面无论怎么光滑,从原子尺度衡量,实际上也是凹凸不平的。
(1)不均匀性固体表面两大特征硅片外观硅片绒面结构⑤不论表面进行多么严格的清洁处理,总有一些杂质由固体内部偏析到表面上来,从而使固体表面组成与内部不同(表面偏析)。
(1)不均匀性固体表面两大特征问题2:合金中有两种组份,表面的组成与体相的组成往往有差别,为什么?铝合金铸锭宽面锰偏析⑥同一种物质,制备和加工条件不同也会有不同的表面性质。
(1)不均匀性固体表面两大特征剪开的纸与撕开的纸晶体中每个质点周围都存在着一个力场,在晶体内部,质点力场是对称的。
但在固体表面,质点排列的周期重复性中断,使处于表面边界上的质点力场对称性破坏,表现出剩余的键力,称之为固体表面力。
固体表面两大特征(2)存在力场固体表面力的产生示意图超市的卷状购物袋在揭开的时候有一种互相拉扯的感觉,为什么?新拉出来的玻璃丝可粘住很多碎玻璃丝,就像磁铁吸引铁钉一样,给个解释。
表面能的测试原理、方法、步骤

外表能的测试原理、方法、步骤界面能可分为固气界面能(也称固体外表能,以下皆称为固体外表能)、气液界面能(也称液体外表能,以下皆称为液体外表能)和固液界面能。
其中固体外表能的测定对多孔材料、焊接、涂料、分子筛等领域的理论研究和生产实践具有重要指导作用;液体外表能的测定则与清洁剂的制造、泡沫别离、润湿、脱色、乳化、催化等技术密切相关;而固液界面能主要在涉及固液接触的领域,如油漆、润滑、清洁、石油开采等领域应用广泛。
一、外表能的测试方法就测量方式而言,液体外表能可以直接通过仪器设备测得,而固体外表能和固液界面能却只能通过其他方法间接地计算获得。
而又因为固液界面能、固体外表能、液体外表能三者之间存在某种关系,所以求得固体外表能后,固液界面能的计算问题会迎刃而解。
目前测量固体外表能的方法主要有劈裂功法、颗粒沉降法、熔融外推法、溶解热法、薄膜浮选、vander Waals Lifshitz理论以及接触角法等。
其中,劈裂功法是用力学装置测量固体劈裂时形成单位新外表所做的功(即该材料的外表能#的方法)。
溶解热法是指固体溶解时一些外表消失,消失外表的外表能以热的形式释放,测量同一物质不同比外表的溶解热,由它们的差值估算出其外表能的方法。
薄膜浮选法、颗粒沉降法均用于固体颗粒物质外表能的测量,而不适用于片状固体外表能的测量。
熔融外推法是针对熔点较低的固体的测量方法,具体方法是加热熔化后测量液态的外表能与温度的关系,然后外推至熔点以下其固态时的外表能。
此法假设固态时物质的外表性质与液态时相同,这显然是不合理的。
Vander Waals Lifshitz理论在固体外表能计算方面虽有应用,但不够精确。
接触角法被认为是所有固体外表能测定方法中最直接、最有效的方法,这种方法本质上是基于描述固液气界面体系的杨氏方程的计算方法。
二、固体外表能测试原理在非真空条件下液体与固体接触时,整个界面体系会同时受到固体外表能γsv液体外表能γlv和固液界面能γsl作用,使得液体在固体外表呈现特定的接触角θ〔见图1〕。
纳米技术基础_第九讲固体表面能

宏观驱动力:总表面能降低
•团聚 - 纳米结构通过界面的化学键或范德华力相互结合在一起 - 单个纳米结构越小,结合得越强,越难分离 - 一旦形成,很难破坏
•由单个纳米结构结合成更大的结构(需要外界提供一定的激活能): - 烧结(sintering):单个结构合并到一起,固固界面代替固气界面 - Ostwald 熟化:大结构的生长以小结构的消耗为代价
D RT 6N A r
X RTZ 3N A r
2
D X 2Z
纳米微粒悬浮液
沉降和沉降平衡
溶胶高度分散 胶粒受到重力吸引而下降 胶粒由于Brown运动促使浓度趋 于均一 当这两种效应相反的力相等时, 粒子的分布达到平衡,粒子的浓 度随高度不同有一定的梯度 这种平衡称为沉降平衡
纳米微粒的化学性质
物理吸附以范德华力等微弱的物理力结合化学吸附以化学键结合作用力强纳米微粒的分散不团聚流变学典型胶体悬浮液的黏性具有大的表面积和表面原子配位数丌足具有较强的吸附性吸附特点不被吸附的物质的性质溶剂的性质以及溶液的性质有关丌同种类的纳米微粒吸附性质有很大差异电解质不非电解质溶液ph值等对吸附有很大影响1非电解质的吸附非电解质是指电中性的分子常以氢键范德华力偶极子的弱静电引力等吸附在粒子表面主要以氢键形成而吸附在其他相上1非电解质的吸附如氧化硅粒子对醇酰胺醚的吸附过程与有机溶剂接触的为硅烷醇层硅烷醇对吸附起重要作用作用机理
27
看法。
述评(Review)
论述文献时
引述文献时,只介绍主要研究成果和结论性意见,对 于研究的材料、方法和过程则不必详述,但成就性综 述在介绍创新点时则应多加论述。 对于尚无定论和存在分歧的观点,只需归纳提出 以有叙有议的方式体现述评的功能,叙前人研究,议 其结果、探其原因、究其不足。 分析评论,特别是表达作者自己的观点时,要客观、 谨慎,因此多使用模糊性语言和表推测的语言形式。
材料表面与界面 第7章 固体表面能计算

Ns 2
1 3r 2
U HS 8 3NAr2
Ns 2
1 3r 2
2 3r
4r
则有:
U(100) 1.154 U (111)
U(110) 1.021 U (111)
各晶面表面能的大小顺序:U(100)> U(110)> U(111) 表面U(100)的活性最好。 U(111)的稳定性最好
1) 固体表面能的表达式
假设:
dA1和dA2是相互垂直方 向上的新增加的表面积。
dA1
A
dA2
则沿着相互垂直的两个 表面上的表面应力与表面张 力有如下关系:
γ= (τ1+ τ2)/2
τ为单位长度上的表面应力
表面积增加dA1和dA2时,新增加的表面能等于 抵抗表面应力做的功。
设Gs是单位表面积的自由能
3) 固体表面能的计算 (表面与界面,崔国文著)
① 共价键固体表面能计算
0K时的表面能等于将1cm2表面所有共价键打断 需要的能量的 一半。
usBiblioteka 1 2ubub 为破坏化学键所需能量 us 为表面能
金刚石的键能为376.2kJ/mol
金
刚
对于(100)面, 1cm2表面
石
晶
所有共价键打断需要的能量Ec为
表面能系数级图 垂直于矢径的平面族 平衡多面体
习题1: 体心立方结构的共价键晶体,求以 {111}、{100}和{110}作表面的表面能大小
习题2:MgO的(100)面的表面能
NsH S
Ns 4
1 2r 2
U 5HS 48 2N Ar2
Ns 4
1 2r 2
若形成(111)表面,则每个表面原子丧失n=3 个结合键, 即存在3 个“悬挂键”。(111)面相应的表面能ΔU(111)和单 位表面上的原子数
固体表面

目录
概述 固体表面的几何性质 固体表面的原子排列和结构缺陷 表面张力和表面能 固体表面的接触 摩擦状态下的表面
概述
• 工程材料中,大部分材料属于晶体,如金属、陶瓷和许多 工程材料中,大部分材料属于晶体,如金属、 高分子材料。一般的将固相和气相之间的分界面称为表面, 高分子材料。一般的将固相和气相之间的分界面称为表面, 把固相之间的分界面称为界面。 把固相之间的分界面称为界面。 • 表面的定义:在物理学中,把两种物质的界面称为表面 表面的定义:在物理学中, 在弹性力学中,表面应该满足以下边界条件: (在弹性力学中,表面应该满足以下边界条件:其上各点 的法向应力σn和切向应力τn均为零)。 的法向应力σn和切向应力τn均为零)。 σn和切向应力τn均为零 • 通常,这个表面层的状态是复杂的。宏观上具有一定的几 通常,这个表面层的状态是复杂的。 何形状,微观上存在各种晶格缺陷, 何形状,微观上存在各种晶格缺陷,在一定的环境下还存 在各种吸附膜、反应膜和污染膜。 在各种吸附膜、反应膜和污染膜。 • 典型的固体表面: 1.理想表面 2.清洁表面 3.机械加 典型的固体表面: 1.理想表面 2.清洁表面 3.机械加 4.一般表面 工过的表面 4.一般表面
N
塑性流动压力分布
赫兹分布
图1.12 赫兹接触和实际接触
两表面间的接触
N
二、赫兹(Hertz)接触 赫兹(Hertz)
可以根据弹性理论来计算微凸 柱或锥) 体(球、柱或锥)接触时的压 力分布。 力分布。 • a.椭球与椭球接触:在法向压 a.椭球与椭球接触: 椭球与椭球接触 的作用下相互压紧( 力N的作用下相互压紧(见图 1.13), ),在接触部分产生弹性 1.13),在接触部分产生弹性 变形。形成的接触面积, 变形。形成的接触面积,假定 为以a 为半径的椭圆形。 为以a和b为半径的椭圆形。 • 在应力椭圆上积分,求σ的总 在应力椭圆上积分, 和得接触面上的正压力和最大 赫兹压力分别为
第二章 固体的界面性质

§2-3 Langmuir单分子层吸附理论 单分子层吸附理论 与Freundlich经验方程 经验方程
一、Laugmuir单分子层吸附理论 Laugmuir单分子层吸附理论
1916年 augrmuir根据分子间作用力随距离上升而 1916年,Laugrmuir根据分子间作用力随距离上升而 迅速下降的事实,提出了他的吸附理论,他假设: 迅速下降的事实,提出了他的吸附理论,他假设:
二、吸附量与吸附曲线
吸附量( ):单位质量吸附剂所吸附的吸附质 单位质量吸附剂所吸附的吸附质( 吸附量(Γ):单位质量吸附剂所吸附的吸附质(气 体)在标准状态下的体积(mL/g),亦有用物质的量表 在标准状态下的体积( ),亦有用物质的量表 ), 示的 Γ =V/m 或 Γ =n/m 吸附达平衡时,对于给定的一对吸附剂和吸附质,其 吸附达平衡时,对于给定的一对吸附剂和吸附质, 吸附量与温度及气体压力有关,即 吸附量与温度及气体压力有关,
σ = (τ 1 + τ 2 ) / 2
τ 1、 2为两个新表面的表面应力,通常τ 1=τ 2=σ。 τ 为两个新表面的表面应力, =σ。
恒温、恒压条件下新形成表面而增加的固体Gibbs 恒温、恒压条件下新形成表面而增加的固体Gibbs 函数为: 函数为: d(AGs)=σdA ∴ σ=Gs+A( ∂ Gs/ ∂ A) 式2-2 该式表明固体的表面张力包括两部分: 该式表明固体的表面张力包括两部分:一部分是表面能 的贡献(Gs)。一部分是由于表面积改变引起表面能改变的 的贡献(Gs)。一部分是由于表面积改变引起表面能改变的 )。 贡献( A), 贡献(A( ∂ Gs/ ∂ A),可理解为分子间距离的改变而引起的 Gs的变化 从而产生对Gibbs函数的贡献。 的变化, Gibbs函数的贡献 Gs的变化,从而产生对Gibbs函数的贡献。 对液体而言,分子移动到平衡位置很快, 对液体而言,分子移动到平衡位置很快,所以 =0, =σ。 ∂ Gs/ ∂ A =0, Gl=σ。 对固体而言,表面分子移动到平衡位置时间很长, 对固体而言,表面分子移动到平衡位置时间很长, A≠0,即达到平衡之前Gs≠σ ∂ Gs/ ∂ A≠0,即达到平衡之前Gs≠σ
固体的表面

Ls N A z( / 2)
(3-4-3)
要产生两个表面,需要断开其上的原子键。设形成一个表面
原子所需断开的键数为zo,原子间距为a,则有:ຫໍສະໝຸດ a2 0 z0 ( / 2)
(3-4-4)
因摩尔体积Vm = NA a3,则根据上两式得出:
2
Ls 1 0Vm3
(3-4-5)
1
其中 1
z
z0
式中:E为弹性模量,γ是表面能。
(3-4-12)
3.表面行为
(1) 表面吸附与偏析
吸附:异相原子或分子附着在固体表面上的现象。
偏析:固溶体(或液体)中的溶质原子富集在表面或界面层。
①吸附等温方程
根据热力学第一和第二定律,引入表面能 s,表面相内能的变
量可表示为:
dES TdSS isdxiS S dA
原因:表面质点受力出现不对称。可以波及几个质点层, 越接近表层,变化越显著。
图3-4-1 驰豫表面示意图
②表面结构重构 表面晶体结构和体内出现了本质的不同。重构常表现为表 面超结构的出现,即两维晶胞的基矢按整数倍扩大。
图3-4-2 重构表面示意图
③表面双电层 概念:在离子晶体表面上,作用力较大、极化率小的正离
nib、nis 为第i个离子在晶内和表面上最近离子的配位数。 则晶内取走一个离子所需能量为uib·nib/2,表面为nis·uis/2 。 若设uib=uis ,得第i个离子两个位置下内能差为:
(u) s,v
[ nibuib 2
nisuis ] 2
nibuib 2
[1
nis ] nib
U0 N
[1
nis ] nib
式中 U0 为晶格能,N 为阿伏加德罗常数。
材料表面与界面 第7章 固体表面能计算

对于某个特定表面,若表面原子与体内原子相比少了n 个结合键,则这n 个键就属于表面,其表面结合能ΔU(即表面能)可估计如下:
式中:NS 为单位表面上的原子数。
若形成(100)表面,则每个表面原子丧失n=4 个结合键,即存在4 个“悬挂键”。(100)面相应的表面能ΔU(100)和单位表面上的原子数
d(A1GS)=τ1dA1
d(A2GS)=τ2dA2
全微分
A1dGs+ GSdA1=τ1dA1
A2dGs+ GSdA2=τ1dA1
改写
讨论:
τ=Gs=γ
各向同性固体表面: τ1=τ2
液体和新增加表面,而表面构态始终保持平衡态的固体:
与时间有关
差值
在表面非平衡态时 τ≠Gs
4r
若形成(110)表面,则表面原子丧失n=5 个结合键,即存在5个“悬挂键”。(110)面相应的表面能ΔU(110)和单位表面上的原子数
若形成(111)表面,则每个表面原子丧失n=3 个结合键,即存在3 个“悬挂键”。(111)面相应的表面能ΔU(111)和单位表面上的原子数
晶体的不同晶面具有不同的自由能,原子最密堆积的表面,其表面自由能最低。
下面为某晶体的二维晶面
(10)面
(10)与(11)面的结合
(11)面
最佳外形,表面能最小
2 )晶体表面自由能特征
① 共价键固体表面能计算
(表面与界面,崔国文著)
0K时的表面能等于将1cm2表面所有共价键打断需要的能量的 一半。
③ 金属固体表面的表面能计算
有多种计算模型
Hamaker常数法 如面心立方金属晶体,其表面能为 Es(100)=0.09184H/a2 Es(110)=0.09632H/a2 a-最邻近原子间的距离,H-hamaker常数
第四章_固体的表面现象

第四章_固体的表⾯现象第四章固体的表⾯现象材料制备及使⽤过程发⽣的种种物理化学变化,都是由材料表⾯向材料内部逐渐进⾏的,这些过程的进⾏都依赖于材料的表⾯结构与性质。
⼈们平时遇到和使⽤的各种材料其体积⼤⼩都是有限的,即材料总有表⾯暴露在与其接触的介质内。
相互接触的界⾯上或快或慢的发⽣⼀系列物理化学作⽤。
产⽣表⾯现象的根本原因在于材料表⾯质点排列不同于材料内部,材料表⾯处于⾼能量状态。
第四章固体的表⾯与界⾯固体的界⾯可⼀般可分为表⾯、界⾯和相界⾯:1)表⾯:表⾯是指固体与真空的界⾯。
2)界⾯:相邻两个结晶空间的交界⾯称为“界⾯”(晶界)。
3)相界⾯:相邻相之间的交界⾯称为相界⾯。
相界⾯有三类,如固相与固相的相界⾯(s/B);固相与⽓相之间的相界⾯(s /V);固相与液相之间的相界⾯(s/L)。
本章主要从物理化学的⾓度对有关固体界⾯及其⼀些问题作简要介绍。
§4.1 固体的表⾯⼀、固体表⾯特征1. 固体表⾯的不均⼀性由于制备、加⼯条件、晶格缺陷、空位或位错造成固体表⾯的不均⼀性。
2. 固体表⾯⼒场固体表⾯上的吸引作⽤,是固体的表⾯⼒场和被吸引质点的⼒场相互作⽤所产⽣的,这种相互作⽤⼒称为固体表⾯⼒。
依性质不同,表⾯⼒可分为:1)化学⼒2)分⼦引⼒(1)化学⼒:本质上是静电⼒。
当固体吸附剂利⽤表⾯质点的不饱和价键将吸附物吸附到表⾯之后,吸附剂可能把它的电⼦完全给予吸附物,使吸附物变成负离⼦(如吸附于⼤多数⾦属表⾯上的氧⽓);或,吸附物把其电⼦完全给予吸附剂,⽽变成吸附在固体表⾯上的正离⼦(如吸附在钨上的钠蒸⽓)。
多数情况下吸附是介于上述⼆者之间,即在固体吸附剂和吸附物之间共有电⼦,并且经常是不对称的。
对于离⼦晶体,表⾯主要取决于晶格能和极化作⽤。
(2)分⼦引⼒,也称范德华(van der Walls)⼒,⼀般是指固体表⾯与被吸附质点(例如⽓体分⼦)之间相互作⽤⼒。
主要来源于三种不同效应:1)定向作⽤。
表面能——精选推荐

表面能是创造物质表面时对分子间化学键破坏的度量。
在固体物理理论中,表面原子比物质内部的原子具有更多的能量,因此,根据能量最低原理,原子会自发的趋于物质内部而不是表面。
表面能的另一种定义是,材料表面相对于材料内部所多出的能量。
定义:产生单位面积新表面所作的功。
一、表面能可以通过滴形分析仪(DSA)进行测定测量固体表面能所需的必要参量:至少需要两种液体这些液体在此固体上的接触角液体的表面张力液体表面张力的极性和色散部分测量固体表面能的方法:Zisman和Equation of state(不常用,因为只有色散相互作用存在,或占主要时可用)Fowkes, Owens,Wendt, Rabel,Kaelble等(几何平均的方法)Wu(调和平均方法,精度相对较高,尤其是较高能量的表面)Schultz 1,2(适合高能表面)二、OVEN二液法测定固体表面能利用界面张力测量仪,γs=γsD+γsP γL=γ LD +γ L P式中:γs为固体表面能,可以分解为色散力γsD项和极性力γsP项;γL 为液体表面能,也可以分解为色散力γLD 和极性力γLP。
那么:γL(1+cosθ)=2(γ D γ L D)1/2 +2(γsPγLP)1/2 (1)在公式1中,如果已知液体的表面能x和其分项x,x并测出液体在固体表面上的接触角θ,则公式中还有两个未知数x和x。
为了求得这两个未知数,就需要两个方程,因此必须采用两种测试液体,获得如下的方程组:γL1(1+cosθ1)=2(γsDγL1D)1/2+2(γsPγL1P)1/2γ L2(1+cosθ2) =2(γsDγL2D)1/2+2(γsPγL2P) 1/2γs=γ sD+γs P目前常用的测试液体如下表常用测试液体的表面能液体γLP γLD γLγ LP/γLD 极性水 51 21.8 72.8 2.36 极性甘油 26.4 37 63.4 0.71甲酰胺18.7 39.5 58.2 0.47二碘甲烷 2.3 48.5 50.8 0.05 非极性α-溴萘 0 44. 6 44.6 0正十六烷 0 27.6 27.6 0用Owens法计算表面能时,所选的两种测试液必须满足如下的条件:(1)两种液体的γLP /γ L D 值不能接近,而且两者的差距越大越好;(2)两种液体必须有不同的极性,即必须从极性液体中和非极性液体中各选一种液体。
第二章 固体界面性质
毛细凝聚现象
根据Kelvin公式,凹面上的 蒸汽压比平面上小,所以在小于 饱和蒸汽压时,凹面上已达饱和 而发生凝聚,这就是毛细凝聚现 象。在测量固体比表面时,采用 低压,因为发生毛细凝聚后会使 结果偏高。 继续增加压力,凝聚液体增 多,当达到图(b)中的b线处,液 面成平面,这时的吸附等温线如 CD线所示。
(3)吸附树脂(树脂吸附剂)
• 吸附树脂是一种不含离子交换基团的高交联度体型高分子 珠粒,其内部具有许多分子水平的孔道,提供扩散通道和 吸附场所,具有吸附作用。 • 特点:(1)容易再生,可反复使用;(2)吸附树脂的化 学结构和物理结构较容易人为控制,可根据不同需要合成 结构和性能不同的树脂,因此应用范围广。 • 应用领域:废水处理;药物提纯、化学试剂的提纯、医学 分析、急性药物中毒处理,特殊载体等,特殊高性能的吸 附树脂在废水有效处理的同时,实现了废物的资源化。 • 例:(1)含酚废水的处理(2)染料中间体生产中的废水 处理
1.固体吸附的本质 吸附:固体表面气体的富集,表面浓度高于 本体浓度。 吸收:气体吸入固体内。 吸着:吸附+吸收 反应:气体与固体化学反应。
2.2 固体对气体的吸附
当气体或蒸汽在固体表面被吸附时,固体称为
吸附剂,被吸附的气体称为吸附质。 常用的吸附剂有:硅胶、分子筛、活性炭等。
为了测定固体的比表面,常用的吸附质有:氮
物理吸附向化学吸附的转变
脱氢作用沿化学吸附的逆过程进行,所提供的活化 能等于Qc+Ea,使稳定吸附的氢原子越过这个能量达到P 点,然后变成H2分子沿Pa P’线离开表面。
物理吸附与化学吸附的比较
吸附性质 吸附力 吸附热 选择性 吸附层 吸附速度 可逆性 物理吸附 化学吸附 范德华力 化学键力 近于液化热,约0-20kJ/mol 近于液化热,大于40kJ/mol 无 有 单或多分子层 单分子层 快、不需活化能,且易平衡 慢、需活化能、且难平衡 可逆 不可逆
第三章 固体界面性质
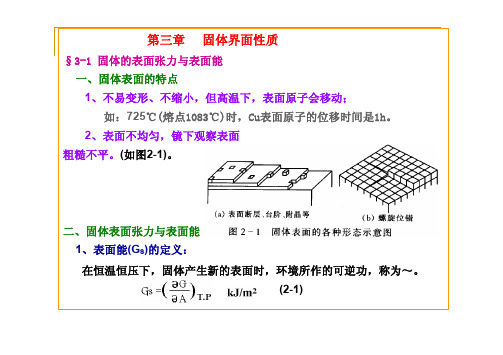
、表面不均匀,镜下观察表面在恒温恒压下,固体产生新的表面时,环境所作的可逆功,称为~。
(2-1)4·H2O低压下,呈直线;高压下,呈曲线。
有球全部为汞充满为止,就可以获得在各个压力下的样品对氮的吸附量。
2、动态法点时,吸附质有凝聚现象发生。
低压,形成单分子层吸附;随P↗,产生多分子低压,形成多分子层吸附;随P↗,产生多分子根据上述分类,可以从吸附等温线的形状大致了解吸附剂与吸附质之间的关系,用量热法测定的吸附总热。
等量吸附热(Q a):中可得:关系图(右下图),得一直线,式得:K= –Q a/R = –4.32x103X8.314 = 35.9 kJ/mol可见,开始阶段吸附热最高,随着式中:-吸附速率常数;-脱附速率常数-单位时间内碰撞在单位表面上的分子数从分子热运动推导得:-气体分子质量; -常数(1.38x10-23 将z代入2-15式,化简即得:(2-16)式中:于是(2-19分布原理,脱附速率常数可用下式表示:(比例常数;q -吸附热b的定义式得:(的函数。
通常吸附是放热反应,∴所示。
bP«1(P作图可得到一条直线,说明吸附符合可从直线的斜率k 和截距N A= 6.02X1023(个分子3、吸附分子表面密度(D)的计算计算公式:(个/m2)式中:M-吸附气体的分子量。
呈指数递进关系,没有饱和吸附值。
从图2-14曲线中可见,温度越低,吸附量越大。
k值(截距)随温度升高而减小,1/n 值(斜率)则相反。
P/V 483.7 692.7 824.6 991.9 1078.8 1221.0 1422.6 1409.5 1539.5 1653.9 P 1185 4925 10142 18847 27725 40782 50645 62158 83747 1005571.4904.925.00吸附平衡时,被占据和未被占据的面积不变,各高度分子层覆盖的面积不吸附等温式,并通过直线的斜率和截距计算出常数上式适用的相对压力范围:X=0. 05~ 0. 35;时,型曲线;此时,以多层吸附或物理吸附为主;:没有考虑到固体表面的不均匀性和分子之间的相互作用,孔到大孔逐渐吸附,因而有不同的吸附层数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
谢 谢!
精选课件
12
精选课件
4
奇异表面的表面能计算
奇异表面:
对于奇异表面上的每个原子,将其拉回初始位置的能 量等于断裂键的数量(Nb)与键强(ε)的一半的乘积。
精选课件
5
奇异表面的表面能计算
(100)
(110)
(111)
低晶面指数的晶体表面能较低
精选课件
6
伍尔夫图介绍及应用
ห้องสมุดไป่ตู้
确定Wulff图步骤: (1)对于不同的晶面给出相应的表面能,从一个点画出一系列 矢量使其长度正比于表面能,其方向垂直于晶面。
固体表面能的简单讨论
精选课件
1
精选课件
2
• 表面能基本知识 • 奇异表面的表面能计算 • 伍尔夫图介绍及应用
精选课件
3
表面能基本知识
广义的表面自由能定义:
保持相应的特征变量不变,每增加单位表面积时,相应 热力学函数的增值。
狭义的表面自由能定义:
保持温度、压力和组成不变,每增加单位表面积时, Gibbs自由能的增加值称为表面Gibbs自由能,或简称表 面自由能或表面能
(2)画出一系列晶面使其垂直于每个矢量并处在矢量的末端。 (3)构成的几何图形的面完全由相互独立的一系列晶面所组成。
精选课件
7
伍尔夫图介绍及应用
physical vapor transport (PVT) technique(物理气相传输方法)
精选课件
8
伍尔夫图介绍及应用
• Table1:using a method developed by Marcon and Raos • Figure :Equilibrium crystal shapes predicted by the Gibbs–
精选课件
10
伍尔夫图介绍及应用
精选课件
11
参考资料
1.曹国忠、王颖著.纳米结构和纳米材料:合成、性能及应用(第二版). 高等教育出版社.2013年 2. Rongjin Li .et. al .Gibbs–Curie–Wulff Theorem in Organic Materials: A Case Study on the Relationship between Surface Energy and Crystal Growth . Adv. Mater. 2016, 28, 1697–1702 3.中国数字科技馆:晶体材料科普专栏 /AMuseum/crystal/index.html
精选课件
9
伍尔夫图介绍及应用
a:≈11.5 cm away from the source, temperature at ≈100 °C b:≈12.5 cm away from the source, temperature at ≈85 °C c: 13.5 cm away from the source, temperature at ≈70 °C
