不对称aldol 反应
不对称有机合成反应简述

不对称有机合成反应简述摘要:手性,是用来表达化合物构型的不对称性的术语,它是指化合物分子或者分子中某些基团的构型可以排列成互为镜像但是不能重叠的两种形式。
合成单一手性对映体的有效方法就是不对称合成。
这种合成往往要在催化剂作用下进行,因此称为“不对称催化反应”。
关键词:手性分子催化剂合成重要反应正文手性分子以其特殊的性能在有机合成的前沿地带经久不衰,在材料多样化的21世纪,手性分子的发展定会进入一个新的时代。
瑞典时间2001年10月10日11∶45分,瑞典皇家科学院宣布,将2001年度诺贝尔化学奖授予美国化学家诺尔斯(W. S. Knowles)、日本化学家野依良治(R. Noyori)和美国化学家夏普雷斯(K. B. Sharpless),以表彰他们在手性催化氢化反应和手性催化氧化反应研究方面所做出的卓越贡献。
自引入手性的概念以来,有机化学及其相关领域取得了迅猛的发展。
不对称合成作为有机化学的一个分支学科,在手性起源的研究和光学活性化合物的合成等方面的重要性日趋明显。
鉴于手性合成在现代合成业的“明星”地位,我将从以下几个方面简述它。
(一)实际应用一说不对称合成的实际应用,我们会立马想到手性药物。
当前,手性药物的研究与开发已成为世界新药发展的方向和热点领域。
据统计,世界上销售的药物总数为1850种,天然及半合成药物523种,其中手性药物为517种;合成药物1327种,其中手性药物528种。
但是,纯净的手性物质在大自然中的含量是极少的,工业合成的对映体,得到的是外消旋体,我们需要的仅仅是其中一种,一种只能浪费掉,别是另一种若有毒,比如说:从这可以看出,合成纯净单一的对映体已成为一种迫切的必要。
随着现代信息社会的发展,其合成技术日趋多样化以及高效化。
(二)手性合成技术上面已经说到,寻求优化合成方法是现代手性合成永恒不变的主题,那么,究竟有哪些技术呢?1.手性拆分是相对快捷合成手性化合物的方法外消旋体拆分法需要选择适当的溶剂,而找出一个合适的拆分剂是是十分困难的。
脯氨酰胺功能化介孔材料催化不对称aldol反应的反应条件优化

脯氨酰胺功能化介孔材料催化不对称aldol反应的反应条件优化摘要:本文制备了甲基修饰的脯氨酰胺功能化的介孔材料,研究结果表明:通过对反应条件的筛选,发现在水溶液中材料显示了对不对称aldol反应的最好的催化性能,催化剂可以循环使用5次,并且手性选择性基本保持不变。
关键词:介孔材料功能化脯氨酰胺不对称aldol反应自2000年,Barbas等人报道了L-proline催化的不对称aldol反应以来,不对称有机催化有了蓬勃的发展,已被人们认为是继过渡金属不对称催化和酶催化之后的第三种重要的不对称催化方法[1,2]。
相对于过渡金属催化剂,有机催化剂不需要使用价格高昂并且具有毒性的过渡金属,并且有机催化剂相对于过渡金属催化剂和酶催化剂不仅价格便宜,而且催化反应操作简单,因此,很多重要的不对称碳-碳键、碳-氮键形成反应的有机催化剂被开发出来。
基于文献中有报道L-脯氨酰胺是直接不对称aldol反应的高效催化剂[3],本文中,我们合成了含有L-脯氨酰胺功能团的介孔材料,另外有报道,甲基修饰可以提高脯氨酰胺功能化介孔材料的催化性能[4],我们制备了甲基修饰的脯氨酰胺功能化的介孔材料,并详细研究了反应条件(温度、溶剂、添加剂等)对催化性能的影响,并研究了催化剂的循环使用性能。
一、实验部分1.材料制备脯氨酰胺功能化的SBA-15型介孔材料参照文献制备[5]。
具体合成过程如下:28 mL HOAc-NaOAc 缓冲溶液中(pH=4.4,HOAc:0.52 mol/L,NaOAc :0.27 mol/L)加入1.0 g P123溶解,在25 oC 搅拌20 小时。
然后,向上述溶液中加入2.03 mL硅酸钠水溶液(20% SiO2,6% Na2O),10分钟后,将TEOS (6.8 mmol)与(2S,1’R,2’R)-N-t-butyloxycarbonylpyrrolidine-2-carboxylic acid [2’-(4-trimethoxysilylbenzylamide)-cyclohexyl]amide (PCA,1.7 mmol)与1.69g 乙醇超声混匀,加入到上述溶液中,然后在40oC 搅拌24 小时。
手性伯胺催化的不对称Aldol反应

Alo d l反 应被 认 为是现 代有 机合 成 中最有 效 的形成 碳碳键 的方法 之一 L,应 用 此反应 可 1 J 以合 成含 有两 个立 体 中心 的 B羟 基 羰基 化合 物 。自从 2 0 一 0 0年 L s 教授 发现 脯氨 酸 可 以催 化 i t
分 子 间 的不对 称 A dl lo 反应 以来 [,越 来 越 多 的科 学 家开 始致 力于 寻找 高效 的有 机催 化剂 。 2 】 鉴 于 此 ,我们 设计 合成 了一 系列 新型 的双 官 能 团控 制 的伯胺催 化 剂 , 化环 己酮 与对 硝基 苯 催
中 国 .成 都 2 1 00年 9月 全 国第 1 6届有 机 和精 细化 工 中 间体 学术 交流 会
手性伯胺催 化 的不对 称 A d l反应 lo
李慧 ,徐大震 ,刘英 俊 ,王永梅
南开大学元素有机国家重 点实 验室,3 0 7 ,天津 00 1 Emaly — i mw@nn ae u a : a k id . . c
【】 Ls R A. e r n . . ab ,l JA C e S c, 0 0 12 2 9 . 2 B. i, . L me d F B ra I ,= m. h m. o . 0 , 2 , 3 5 t a C s l 2
Die t y m ercAl o a t n t l z d b ia r c As m ti d l Re c i sCa ay e y Ch r l o P i a yAm i e t l ss rm r n sCa ay t
T eAl o e c in i e o n z da n f h s o ru t o sf r h o ma i n o c r o - a b nb n s n h d l a t r c g ie o eo t emo t wef l r o s s o o d t o i
离子对负载L-脯氨酸阴离子催化下的不对称Aldol反应

离子对负载L-脯氨酸阴离子催化下的不对称Aldol反应刘蝶丽;郭国长;赵晓伟;崔元臣【摘要】在水相中,通过阴阳离子结合使L-脯氨酸阴离子负载在基于Merrifield树脂的季铵根阳离子上,制备出功能性高分子离子液体.将该体系作为一种高效、可回收的催化剂用于催化醛与酮的不对称Aldol反应.结果表明:该催化体系在微量水中有很好的催化活性和立体选择性,相应的Aldol反应产物获得了6 : 94的dr值以及高达98%的ee值,且该催化体系有较好的重复使用性能.%L-Proline was loaded on the basis of quaternary ammonium cation based on Merrifield resin by ion pair in aqueous solution. The obtained heterogeneous catalyst was used to successfully catalyze direct asymmetric aldol reaction between aldehyde and ketone. The results show that the catalytic sys-tem has good catalytic activity and stereoselectivity in trace water,affording good enantioselectivity(up to 98%) and diastereoselectivity (up to 6 : 94),and the catalyst system has good reusability.【期刊名称】《化学研究》【年(卷),期】2018(029)002【总页数】6页(P146-151)【关键词】Merrifield树脂;季铵根阳离子;L-脯氨酸;离子液体;Aldol反应【作者】刘蝶丽;郭国长;赵晓伟;崔元臣【作者单位】河南大学化学化工学院,河南开封475000;河南大学纳米材料工程研究中心,河南开封475000;河南大学化学化工学院,河南开封475000;河南大学化学化工学院,河南开封475000;河南大学纳米材料工程研究中心,河南开封475000【正文语种】中文【中图分类】O621;O635直接不对称Aldol反应是形成C-C键的重要方法之一,它被广泛应用于有机合成、医药、农药和精细化工行业中. 自2000年,LIST等发现脯氨酸可作为一种高效催化剂催化酮和苯甲醛分子间的直接不对称Aldol反应以来,脯氨酸作为一种重要的手性小分子催化剂一直备受关注[1]. 虽然脯氨酸有机小分子催化剂具有催化活性高、反应操作简单、环保安全的优势,但在均相催化过程中,脯氨酸也存在一些缺陷,如稳定性差、使用量较大、分离和回收困难等不足[2-4]. 因此,近年来,L-脯氨酸的固载化和重复回收利用受到广泛关注. 负载型脯氨酸催化剂,克服了脯氨酸在均相催化过程中不能回收和重复使用的缺点. 聚合物、二氧化硅、离子液体等常被用作载体来负载脯氨酸及其衍生物[5-8].室温离子液体是熔点低于100 ℃、由阴阳离子构成的有机盐,具有易溶解、化学稳定性好、热稳定性高、无味、可重复使用、易功能化等特点,也称为低温熔融盐. 离子液体的阴阳离子结构可被设计和修饰,以达到所需的性能. 通过相对绿色方法如离子交换和酸碱中和反应,很多天然产物可被转化成离子液体[9-12]. 国内外有关离子液体的报道很多, 1997年,HOWARTH等首次合成了手性离子液体,合成后的手性离子液体作为Lewis酸来催化不对称Diels-Alder反应[13]. 2006 年, ZLOTIN小组报道了自负载离子液体,脯氨酸等催化中心可通过离子对作用负载到离子液体上, 同时达到回收离子液体和催化剂的目的[14]. 2010年王永梅合成了离子液体/脯氨酸催化剂,并系统地测试了其催化性能[15]. 由于手性离子液体同时具有离子液体和手性的特征,既可以作为手性溶剂,又可以作为手性诱导剂,从而引起了化学家的重视.本文拟用酸碱离子对对有机小分子催化剂脯氨酸进行负载,用聚合物阳离子负载L-脯氨酸阴离子,生成以L-脯氨酸为阴离子、基于Merrifield负载的季铵根为阳离子的功能高分子离子液体,将制备的催化剂用于催化醛、酮分子间的直接不对称Aldol反应,并探讨了溶剂、催化剂用量等不同条件对其催化性能的影响.1 实验部分1.1 试剂与仪器1)主要仪器傅立叶变换红外光谱仪(FI-IR):美国尼高力公司(AVATAR360型);凝胶渗色谱(GPC):美国Wyatt Technology公司(DAMN EOS);高效液相色谱仪(HPLC):美国安捷伦公司(Agilent 1100型); PE 2400-II. CHNS/O型元素分析仪.2)主要试剂与药品L-脯氨酸:吉尔生化(上海)有限公司;Merrifield树脂:日本吴羽株式会社(type#2051-2);三甲胺、三乙胺:阿拉丁试剂公司;对氟苯甲醛:AR 阿拉丁试剂公司;对溴苯甲醛、邻溴苯甲醛:AR Alfa Aesar试剂公司;对氰基苯甲醛、邻硝基苯甲醛、对氯苯甲醛:CP Alfa Aesar试剂公司.1.2 Merrifield树脂负载脯氨酸的合成取3.0 g Merrifield树脂,加入10 mL DMF,4 mL三乙胺/三甲胺,80 ℃反应24 h,降温,加入乙醇,静置后过滤,洗涤,真空干燥. 所得产物经元素分析表明三乙胺、三甲胺的负载量分别为0.62 mmol/g、0.83 mmol/g (以氮计). 然后将合成的季铵盐类化合物与脯氨酸在一定条件下发生反应,使脯氨酸以离子对的形式负载到高分子载体上.Scheme 1 脯氨酸负载催化剂的合成Scheme 1 Preparation of supportedproline catalyst2 结果与讨论2.1 季铵盐的红外表征图1为Merrifield树脂、负载的催化剂Ⅰ、Ⅱ的红外谱图,从图1中可以看出Merrifield树脂在670、1 262 cm-1有强的吸收峰,它们分别是苯环上氯甲基C-Cl键的伸缩振动吸收峰及氯甲基中—CH2键的摇摆振动吸收峰. 而负载催化剂Ⅰ、Ⅱ的红外谱带中在670、1 262 cm-1处,没有出现氯甲基中C-Cl键、—CH2的振动吸收峰,说明氯甲基中氯原子被取代.2.2 催化剂在不同溶剂中对Aldol反应的催化性能将所合成的季铵盐类化合物与L-脯氨酸形成的负载催化体系来催化不对称Aldol反应,探讨了溶剂、催化剂用量等条件对其催化性能的影响.图1 Merrifield树脂,a(Merrifield树脂与三乙胺合成的季铵盐)和b(Merrifield树脂与三甲胺合成的季铵盐)的红外表征Fig.1 FT-IR spectra of a (Merrifield-TEA),b (Merrifield-TMA) and Merrifield通过Aldol反应考察了不同催化体系及不同溶剂对反应的影响,结果见表1. 从表1可以看出,催化剂Ⅰ、Ⅱ在溶剂中的催化性能要优于无溶剂加入时的催化性能,且催化剂Ⅰ的催化性能要稍优于催化剂Ⅱ(Entry1,dr值20∶80,ee值90%;Entry2,dr值19∶81,ee值88). 以催化剂Ⅰ为代表,考察了不同溶剂对催化性能的影响. 从表1中可以看出催化剂Ⅰ在有机溶液中的ee值要比在水中的ee值高,但dr值相对较低,且在有机溶剂甲苯、石油醚中反应时,产物的ee值和dr值最高(Entry6,11). 但考虑到有机溶剂有一定毒性且会污染环境,选取绿色溶剂水作为后续研究的实验溶剂.表1 催化剂的筛选及不同溶剂对反应的影响Table 1 Screening of solvent for the organocatalytic asymmetric Aldol reaction of cyclohexanone and p-nitrobenzaldehydeEntryCat.Solventt/dYield/%dr(syn/anti)ee/%(anti)1L⁃ProlineH2O36812∶8 8882e[Choline][Pro]H2O1/697.9----1ⅠH2O36419∶81902ⅡH2O35520∶80883ⅠNeat35030∶70844ⅡNeat348 40∶60855ⅠDMSO46043∶57966Ⅰ正己烷46246∶54907Ⅰ甲苯42015∶85948ⅠDMF46246∶54909Ⅰ乙腈45029∶719810ⅠTHF44523∶779211Ⅰ异丙醇43025∶759212Ⅰ石油醚45922∶7894a Reaction was performed at 0.22 mmol scale of aldehyde, 10 equiv of cyclohexanone in the presence of 3% of amination resin and 12% of L-Proline and 500 μL solvent;b Isolated yield;c Determined by chiral HPLC analysis (Chiralpak AD-H); d I and II were respectively merrifield-tea/L-proline, merrifield-tma/L-proline; e. The catalyst synthesized see reference [10].表2探讨了水的用量对反应的影响. 结果表明,当体系中水的加入量从10 μL增加到300 μL时,产物的dr值和ee值没有明显变化(Entry1-5,dr值10∶90~6∶94,ee值96%~98%). 当水的用量增加至400 μL时,Aldol产物的ee 值和dr 值稍有降低(Entry6),继续增加水的用量产物的dr值和ee值明显的降低. (Entry6-10). 这可能是因为微量的水添加到催化体系中,通过氢键、离子键的作用促进了L-脯氨酸与离子液体功能化聚合物之间的作用,而大量的水加入不利于离子液体与脯氨酸间离子键的稳定,且大量水的加入会使脯氨酸溶解在水中而脱离反应底物,最终导致催化作用消失. 从产率、dr值和ee值三个方面考虑,接下来的实验中选取300 μL水为实验用量.表3考察了催化剂用量对反应的影响. 结果显示,当脯氨酸用量保持不变,若降低季铵盐的用量,发现产物的dr值和ee值均有所增加(Entry1-3,dr值10∶90~6∶94,ee值94%~96%). 当季铵盐用量保持不变,增加脯氨酸用量,产物的dr 值和ee值降低(Entry3-5,dr值12∶88~6∶94,ee值94%~98%). 从表3中可以看出季铵盐用量为6%、脯氨酸用量为12%为最佳催化剂用量.从表4可以得出,带有硝基和氰基等强吸电子基团的苯甲醛与环己酮反应时,相应的Aldol反应产物获得了较高的催化活性和立体选择性,得到了25%~70%的产率和20∶80~10∶90的dr 值,94%~95%的ee值(Entry1-3). 然而,当苯甲醛的取代基为弱吸电子基团如卤原子或给电子基团甲氧基时,反应活性较低,反应时间较长,相关Aldol产物的对映和非对映选择性较低(Entry4-7). 造成这种现象的原因可能是取代芳香醛中的吸电子基团增强了醛基中的碳原子的正电性,从而有利于作为亲核试剂的酮进攻醛中羰基上的碳原子,发生亲核加成反应. 相反,弱吸电子基或供电子基减弱了醛中羰基碳原子的正电性,从而不利于反应的进行. 此外,对位取代的芳香醛要优于邻位或间位取代的芳香醛,这是因为邻位或间位取代的芳香醛空间位阻大于对位取代的芳香醛,不利于亲核试剂的进攻.表2 水的用量对反应的影响Table 2 Amount of water for the asymmetric aldol reaction between cyclohexanone and p-nitrobenzaldehydeaEntryH2Ot/dYield/%dr(syn/anti)ee/%(anti)110μL36410∶9098220μL35610∶9096350μL3216∶94984100μL3508∶92985300μL3686∶94966400μL32715∶85967500μL35619∶81908600μL32015∶85889800μL36560∶4020101000μL35055∶4520a Reaction was performed at 0.22 mmol scale of aldehyde, 10 equiv of ketone in the presence of 6% of amination resin and 12% of L-Proline; bIsolated yield; c Determined by chiral HPLC analysis (Chiralpak AD-H).表3 催化剂用量对反应的影响Table 3 Amount of water for the asymmetric aldol reaction between cyclohexanone and p-nitrobenzaldehydeaEntryMerrifield⁃TEA/%L⁃proline/%t/dYield/%dr(syn/anti)ee/%(anti)118123 5510∶90942121236010∶909636123686∶9496461833210∶909456253501 2∶8894a Reaction was performed at 0.22 mmol scale of aldehyde, 10 equiv of ketone in the presence of 300 μL H2O;b Isolated yield;c Determined by chiral HPLC analysis (Chiralpak AD-H).表4 催化剂的底物适用性Table 4 Asymmetric aldol reaction between cyclohexanone and various benzaldehydes catalyzed by catalyst 1 under the optimal conditionsaEntryRt/dYield/%dr(syn/anti)ee/%(anti)14⁃NO23686∶949623⁃NO245815∶859532,4⁃dinitro42520∶809444⁃CN57010∶909554⁃F56060∶406064⁃Cl55035∶658 074⁃Br52050∶506084⁃CH3O72920∶8078a Reaction was performed at 0.22 mmol scale of aldehyde, 10 equiv of ketone in the presence of 6% of amination resin and 12% of L-proline and 300 μL sol vent;b Isolated yield;c Determined by chiral HPLC analysis (Chiralpak AD-H).为了优化反应条件,我们还探讨了环己酮用量对Aldol反应的影响,从表5可以看出,随着环己酮用量的减少,产物的dr值和ee值都明显的降低,可能是催化体系环境改变的原因.表5 环己酮用量对反应的影响Table 5 Effect of the amount of cyclohexanone on the aldol reaction between cyclohexanone and p-nitrobenzaldehydeaEntryTheamountofcyclohexanone(Equiv)Yield/%dr(syn/anti)ee/%(anti)1106 88∶9296286270∶3076346030∶7078425528∶7273a Reaction was performed at 0.22 mmol scale of aldehyde, 10 equiv of ketone in the presence of 6% of amination resin and 12% of L-proline and 300 μL solvent;b Isolated yield;c Determined by chiral HPLC analysis (Chiralpak AD-H).表6对催化剂的重复使用性进行了研究. 可以看出,催化剂可以重复使用5次,重复使用三次后dr值和ee值有所降低. 说明以非共价键形式制备的Merrifield树脂负载的L-脯氨酸催化剂具有一定的重复使用性能.表6 催化剂的回收重复使用性能Table 6 Reusability of catalyst in the reaction between cyclohexanone and p-nitrobenzaldehydeaEntryt/dYield/%dr(syn/anti)ee/%(syn)036810∶9096135510∶9094233614∶8692344022∶7880453046∶5460a Reaction was performed at 0.22 mmol scale of aldehyde, 10 equiv of ketone in the presence of 6% of amination resin and 12% of L-proline and 300 μL solvent;b Isolated yield;c Determined by chiral HPLC analysis (Chiralpak AD-H).3 结论本文制备了Merrifield树脂L-脯氨酸催化剂,并将其用于催化醛和酮的不对称Aldol反应. 结果表明,该催化剂催化下的反应产物获得了很好的对映选择性(ee 值90%~98%)和非对映选择性(dr值 10∶90~4∶96),且催化剂可以回收重复使用5次.参考文献:[1] LIST B, LERNER R A, BARBAS C F. Proline-catalyzed direct asymmetric aldol reactions [J]. Journal of the Ame-rican Chemical Society, 2000,122(10): 2395-2396.[2] TAN R, LI C, LUO J, et al. An effective heterogeneous L-proline catalyst for the direct asymmetric aldol reaction using graphene oxide as support [J]. Journal of Catalysis, 2013, 298: 138-147.[3] ZHANG X, ZHAO W, QU C, et al. Efficient asymmetric aldol reaction catalyzed by polyvinylidene chloride-supported ionic liquid/L-proline catalyst system [J]. Tetrahe-dron: Asymmetry, 2012, 23(6): 468-473. [4] LOU L L, ZHANG J, DU H, et al. Cinchona-derived pro-linamide inBrønsted acidic ionic liquids: A novel and recyclable catalytic system for asymmetric aldol reaction [J]. Catalysis Today, 2016, 264: 109-114.[5] GRUTTADAURIA M, GIACALONE F, MARCULESCU A M, et al. Novel prolinamide-supported polystyrene as highly stereoselective and recyclable organocatalyst for the Aldol reaction [J]. Advanced Synthesis & Catalysis, 2008, 350(9): 1397-1405.[6] GRUTTADAURIA M, SALVO A M P, GIACALONE F, et al. Enhanced activity and stereoselectivity of polystyrene-supported proline-based organic catalysts for direct asy-mmetric aldol reaction in water [J]. European Journal of Organic Chemistry, 2009, 2009(31): 5437-5444.[7] CALOGERO S, LANARI D, ORR M, et al. Supported L-proline on zirconium phosphates methyl and/or phenyl phosphonates as heterogeneous organocatalysts for direct asymmetric aldol addition [J]. Journal of Catalysis, 2011, 282(1): 112-119.[8] ZOU J, ZHAO W, LI R, et al. Synthesis of PVC-TEPA-supported proline derivative and its catalytic behavior in the direct asymmetric aldol reaction [J]. Journal of Applied Polymer Science, 2010, 118(2): 1020-1026.[9] XU D Z, LIU Y, SHI S, et al. Chiral quaternary alkyl-ammonium ionic liquid [Pro-dabco][BF4]: as a re-cyclable and highly efficient organocatalyst for asymmetric Michael addition reactions [J]. Tetrahedron: Asymmetry, 2010, 21(20): 2530-2534.[10] HU S, JIANG T, ZHANG Z, et al. Functional ionic liquid from biorenewable materials: synthesis and application as a catalyst in direct aldol reactions [J]. Tetrahedron Letters, 2007, 48(32): 5613-5617.[11] WANG W H, WANG X B, KODAMA K, et al. Novel chiral ammonium ionic liquids as efficient organocatalysts for asymmetric Michael addition of aldehydes to nitroolefins [J]. Tetrahedron, 2010, 66(27): 4970-4976. [12] 曹金, 周婵, 张龙, 等. 新型手性离子液体在不对称直接 Aldol 反应中的应用[C]. 中国化学会第十二届全国应用化学年会论文集, 2011.CAO J, ZHOU C, ZHANG L, et al. Novel chiral ionic liquids additive for asymmetric synselective direct Aldol reaction [C]. Proceedings of the Twelfth National Confe-rence on Applied Chemistry, Chinese Chemical Society, 2011.[13] HOWARTH J, HANLON K, FAYNE D, et al. Moisture stable dialkylimidazoliacim salts as heterogeneous and homogeneous lewis acid in the Diels-Alder reaction [J]. Tetrahedron Letters, 1999, 38(17): 3097-3100.[14] KUCHERENKO A S, STRUCHKOVA M I, ZLOTIN S G. The (S)-proline/polyelectrolyte system: an efficient, heterogeneous, reusable catalyst for direct asymmetric Aldol reactions [J]. European Journal of Organic Chemistry, 2006, 2006(8): 2000-2004.[15] ZHENG X, QIAN Y, WANG Y. Direct asymmetric aza Diels-Alder reaction catalyzed by chiral 2-pyrrolidinecarboxylic acid ionic liquid [J]. Catalysis Communications, 2010, 11(6): 567-570.。
联二萘酚衍生手性二胺催化的不对称Aldol反应

以手 性 胺 2 a~2 ( hr 1 和 手 性 磷 酸 3 j C a ) t a一3 i
的手 性胺 能有 效 催 化 醛 与 酮 之 间 的 Adl 应 ; lo 反 20 0 8年冯小 明等 发 展 了一 类 新 的手性 二 胺 催 化剂 , 化 Ad1 具 有 非 常好 的反 应 活 性 和 在催 lo 种
( hr2 为催化 剂 , C a ) t 考察芳基 甲基酮 (a f与三 1 —l) 氟 甲基 酮酸酯 的不对称 Adl lo反应 (ce e1 。 Shm )
1 实验 部分
1 1 仪 器与试 剂 .
立体选择性。在此基础 了, 我们 以联二萘酚为
原料合成 了一类性 能优 良的手 性二胺 催化剂 。 Adl l 反应尽 管取得 了极大 的成 功 , 其底 物 o 但 仅 限于 丙 酮 等脂 肪 酮 , 酮 如 苯 乙酮 作 为 Adl 芳 l o
受 到 广 泛 关 注 , 取 得 了 令 人 瞩 目 的进 展 。 并 20 0 7年程津 培等 发 现 具 有 一 级 一三 级胺然具有重要的意 义。我们设想手性二胺催化剂也许能催化苯乙酮
的不对 称 Adl 应 。 lo反
有机化合物中氟原子取代后其物理化学性质
Ab t a t s r c :A e iso n n ime i x e sp o u t n 8 % y ed wih 7 % e r y t e ie y te s re fe a t o rc e c s r d csi 0 il t 3 ewe e s n h sz d b h
As m m e rc Al o a t n y t i d lRe c i o
多相双功能催化剂上的不对称直接Aldol反应

硅酯 3嫁 接到 二 氧 化 硅 表 面后 , 吸收 峰消 失 .表 该 明 3中三 乙氧基 硅酯 与二 氧化硅 表面上 的羟基进行 缩 合 反应 生 成 了前 体 4 .另 外 ,4的 I R谱 在 29 7 2 c 处 出现 了 C H 弯 曲振 动 吸 收 峰 , 进 一 步 证 m — 这 实 了硅 酯 3已经 成 功 地 嫁 接 到二 氧 化 硅 表 面 . C
多相 双 功 能催 化 剂 上 的不 对 称直 接 Alo 反 应 dl
钟 琳 肖建 良1 , 李 灿 , , 2
( 中国 科 学 院 大 连 化 学 物 理 研 究 所 催 化 基 础 国家 重 点 实 验 室 ,辽 宁大 连 1 6 2 1 10 3
2利 物浦 大 学 化 学 系 ,利 物 浦 L 97 D, 国) 6 Z 英
0
NMR谱 在化 学位移 9 8处 的信 号 归 属 于与 硅 原 子 .
相 连 的碳 的共 振峰 _ . 基碳 和环状 链 上 的碳 的共 8 烷
r 。 H
、 N H
NH ( H 3i E) 2 S( t C O 3
P , y N2
Li H4 THF A1 .
N,
用红 外光 谱 (R) I 、固体 核 磁 ( P AsNMR) c c 、
热重分 析 和元 素 分 析对 前 体 4进 行 表 征 .固载 前 ,
载体 二氧 化 硅 ( 岛 海 洋 化 工 厂 , 9 / ) I 青 3 6m g 的 R 谱在 37 0c 5 m 处有 一个 很尖 锐 的吸 收 峰 , 属 于 归 二氧 化硅表 面上 的孤 立羟基 的 伸缩 振动 吸 收l ;当
不对称催化

新颖有机催化剂的合成及催化不对称直接Aldol反应研究张怀胜102200835摘要:以N-苄氧羰基-(S)-脯氨酸和5-(1-氨基烷基)四氮唑(烷基:甲基、乙基、2-苯基乙基)为原料,经两步反应合成了3个新颖的有机催化剂:(S)-5-脯氨酰胺基甲基四氮唑(3a),(S,S)-5-(1-脯氨酰胺基乙基)四氮唑(3b)和(S,S)-5-(1-脯氨酰胺基-2-苯基乙基)四氮唑(3c),并首次将其用于催化丙酮和含吸电子基芳香醛的不对称直接aldol反应.在室温条件下,催化剂3b表现出较好的催化活性,产物的ee值最高可达96%.关键词:有机催化剂;不对称催化;直接aldol反应;脯氨酰胺衍生物Studies on Synthesis of Novel Chiral Organocatalysts and Its Evaluations for Asymmetric Direct Aldol ReactionsAbstract: Three novel organocatalysts(S)-5-prolylaminomethyltetrazole(3a),(S,S)-5-(1-prolyl aminoethyl)tetrazole(3b)and(S,S)-5-(1-prolylamino-2-phenylethyl)tetrazole(3c)were readily prepared fromN-benzyloxycarbonyl-(S)-proline and corresponding 5-(1-aminoalkyl)tetrazol(alkyl: methyl,ethyl and2-phenylethyl)by the known reaction sequences in just two steps.Their catalytic performances were firstevaluated in the asymmetric direct aldol reactions of acetone with electron -deficient aromatic aldehydes.Atroom temperature,the catalyst 3b displayed the efficient reactivity and the enantiomeric excess(ee)value ofthe products was up to 96%.Keywords: organocatalyst;asymmetric catalysis;direct aldol reaction;prolinamide derivative 自List等[1]使用S-脯氨酸作为催化剂进行分子间直接aldol反应以来,越来越多的有机小分子被直接用作有机反应的催化剂[2].由于有机小分子催化剂不含金属离子,对环境友好,且在反应过程中不需要对反应底物进行修饰,符合原子经济性,因而引起了人们的极大关注,并成为现代有机合成化学的前沿领域之一[3].Aldol反应是有机合成中形成碳碳键的重要反应,可以用来合成β-羟基醛酮、α,β-不饱和羰基化合物及1,2-二醇等有机化合物.近年来对其研究较为活跃[4],尤其是在不对称直接aldol反应方面获得了令人瞩目的进展[5,6],许多关于脯氨酸[1,7]及其类似物[8~19]催化不对称直接aldol反应的研究被相继报道.Arvidsson等[16,17]用四氮唑替代S-脯氨酸中的羧基得到S-脯氨酸四氮唑,从而提高了催化剂的活性,扩展了反应的溶剂范围,但将其用于催化丙酮与取代芳香醛的不对称直接aldol反应时,对映选择性与脯氨酸催化相比并没有较大改善;Gong等[18,19]将S-脯氨酸通过酰胺键与一系列手性氨基醇相连,得到了末端带羟基的脯氨酰胺衍生物,并将其用于催化aldol反应,不仅打破了前人认为脯氨酰胺不能催化aldol反应的传统观念,而且在催化某些底物时得到了光学纯的产物,但是此类催化剂通常在低温反应条件下才表现出良好的对映选择性.在上述脯氨酸类似物的结构中,不仅脯氨酸的四氢吡咯环和仲氨的结构被保留下来,而且在多数情况下还体现出一个重要特征:催化剂中的酸性质子与底物受体原子之间形成一个或多个氢键.氢键的形成不仅活化了羰基,降低了反应的活化能,而且也使得aldol供体在进攻时具有面的选择性.Houk,Wu等[18,20,21]还通过理论计算研究了氢键在aldol反应的立体选择控制步骤中所起的重要作用.这些都为有机小分子催化剂的结构设计提供了依据.我们设计并合成了三个新颖的有机小分子催化剂3a~3c(Scheme 1),它们不仅保留了脯氨酸的吡咯环和仲氨的结构,而且在末端引入四氮唑结构以改善催化剂的溶解性和催化活性.室温条件下,首次将其用于催化丙酮与含吸电子基芳香醛的不对称直接aldol反应,取得了较好的催化效果,产率最高达75%,ee值最高达96%.1 实验部分1.1试剂与仪器对硝基苯甲醛、对溴苯甲醛(Lancaster公司);邻硝基苯甲醛、对氰基苯甲醛、对氯苯甲醛、邻氯苯甲醛(Acros公司);层析硅胶(青岛海洋化工厂);实验所用其它药品均为国产分析纯试剂.X-4系列数字显微熔点测定仪(北京第三光学仪器厂);WZZ-1S型数字式旋光仪(上海索光光电技术有限公司);Perkin-Elmer 240 C型元素分析仪,Mercury-300BB型核磁共振仪(美国Varian公司);Trace MS型气-质联用仪(美国Finnigan公司);AgilentTM 1100型高效液相色谱仪(Daicel Chiralpack AS-H色谱柱,流动相为正己烷-异丙醇).1.2催化剂3a~3c的合成N-苄氧羰基-(S)-脯氨酸参照文献[17]合成;5-氨基甲基四氮唑(1a),(S)-5-(1-氨基乙基)四氮唑(1b)和(S)-5-(1-氨基2-苯基乙基)四氮唑(1c)参照文献[22]合成.1.2.1(S,S)-5-[1-(N-苄氧羰基脯氨酰胺基)乙基]四氮唑(2b)向50 mL三颈圆底瓶中加入20 mL吡啶和化合物1b(1.13 g,10 mmol),冰浴冷却至0℃.氮气保护下,向体系内缓慢滴加N-苄氧羰基-(S)-脯氨酰氯[23](2.70 g,10 mmol),滴加完毕后于同一温度下反应1 h后升至室温,继续搅拌8 h.TLC检测至原料反应完毕,减压浓缩,粗品用乙醇重结晶,得到2.24 g白色固体2b.产率65%,m.p.200~202℃,15D[α]-81.8(c 1.0,C2H5OH);1HNMR(DMSO-d6,300 MHz)δ:1.43(dd,J=7.5,7.2 Hz,3H),1.78~1.90(m,3H),2.08~2.13(m,1H), 3.31~3.45(m,2H),4.18~4.24(m,1H),4.94~5.07(m,2H),5.20(q,J=7.8,4.5 Hz,1H),7.28~7.37 (m,5H),8.67(m,1H);13C NMR(DMSO-d6,75 MHz)δ:24.31*,28.65*,35.06,36.16,52.00*,64.55*, 71.07,132.30,132.65,132.80,132.97,133.44,133.60,142.14*,159.09*,163.42,176.96*(*Doublet due to existence of rotamers);MS m/z(%):344.2(M+,12),90.9(82),203.8(100).Anal.calcd forC16H20N6O3:C 55.80,H 5.85,N 24.40;found C 55.64,H5.98,N 24.57.1.2.2(S,S)-5-(1-脯氨酰胺基乙基)四氮唑(3b)将化合物2b(1.89 g,5.5 mmol)和0.10 g 5%钯碳加入到50 mL甲醇中,50℃催化氢化至反应结束(TLC检测),滤除钯碳,浓缩溶剂.产物用乙醇重结晶,得0.93g白色固体3b,产率80%,m.p. 238~240℃,15D[α]-116.7(c 0.15,H2O);1H NMR(D2O,300 MHz)δ:1.41(d,J=6.9 Hz,3H),1.86~1.90(m,3H),2.25~2.28(m,1H),3.19~3.27(m,2H),4.22(t,J=7.5 Hz,1H),5.13(q,J=6.9 Hz 1H);13C NMR(D2O,75 MHz)δ:19.25,23.89,29.69,42.60,46.60,59.94,168.76;MS m/z(%):210.9([M+1]+,1),68.0(5),70.0(100).Anal.calcd for C8H14N6O:C 45.40,H 6.71,N 39.97;found C 45.29,H 6.89, N 40.16.1.2.3(S)-5-脯氨酰胺基甲基四氮唑(3a)。
不对称羟醛缩合aldol反应
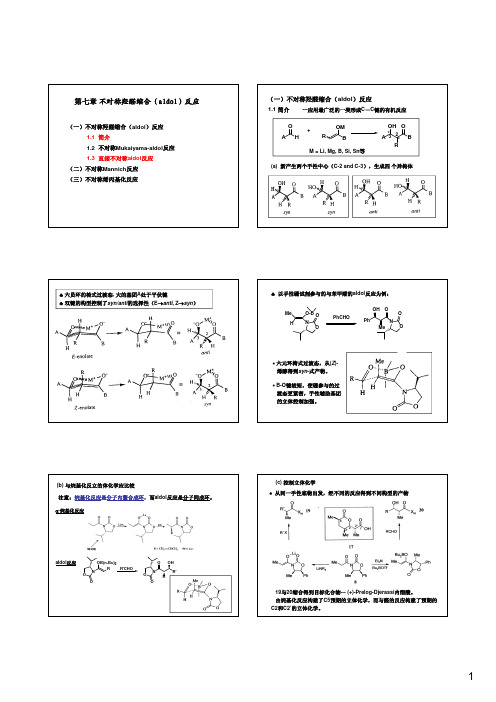
♣以手性硼试剂参与的与苯甲醛的aldol 反应为例:Me O-B NOHPhCHONOPhO Me OHO O ∙六元环椅式过渡态,从(Z )-(b)与烷基化反立的体化学应比较注意:烷基化反应是分子内螯合成环,而aldol 反应是分子间成环。
α-烷基化反应ON R OB(n-Bu)2OR'CHOONO OR'R OH aldol 反应∙从同一手性底物出发,经不同的反应得到不同构型的产物19与20缩合得到目标化合物---(+)-Prelog-Djerassi 内酯酸。
由烷基化反应构建了C5预期的立体化学,而与醛的反应构建了预期的C2和C2’的立体化学。
选择性。
Lewis 酸参与,环状中间体与醛反应,给出syn 构型产物。
Lewis 酸,形成开链(非环)结构,给出anti 构型产物。
醛羰基更易与Lewis 酸配位两类羟醛缩合试剂分别控制syn 和anti 选择性从4得到anti -aldol 产物,而从5得到syn -aldol 产物(2) Mukaiyama-aldol 反应R 1HO +R2R 3OSiMe 31)Lewis acid or R 1R 3OH R 2O Lewis base R 1R3OH R 2O+syn -anti -2)H 2O(a) 硅试剂的种类和特点:anti 构型(syn/anti:5:95)的产物,ee:99%产物的构型与烯醇双键的构型无关。
+RCHO PhOR O MeOH Zr cat.有机铜和锡催化剂(Evans )中心金属(铜或锡)和配体对产物立体化S-t-Bu OTMS MeOMe -78o C (S MeO O HO (2R)-anti-syn /anti (R Sn(OTf)2-11a (10 mol%)Sn(OTf)2-11b(10 mol%)-78o CMeOMeOO Me Cu(OTf)2-11c (10 mol%)NNO O MeMeRR 11b: R=Bn, 11c: R=t -Bu(S -78o C(2S)-anti-syn /anti (2S)-syn-syn /anti 发现了配体的加速作用,配体的加入极大地减小了水解反应PhPhO OH PhPh O OH +chiral cat.H 2O/C 2H 5OH(1:9)(a)手性有机金属催化剂催化直接aldol 反应的历程Trost试剂Up to 99%ee催化剂,一个Lewis酸的作一个Zn起碱的作用。
第七章aldol反应-1

H SPh
+
OTMS OEt
SnCl4 -78oC, CH2Cl2, 78%
OH O Pri SPh syn/anti = 2 : >98 OEt
non-chelation model导致 导致anti-选择性 导致 选择性
c) 两类羟醛缩合试剂控制 两类羟醛缩合试剂控制 控制syn和anti选择性 和 选择性
六员环的椅式过渡态, 大的基团A处于平伏键 ♣ 六员环的椅式过渡态 大的基团 处于平伏键 双键的构型控制了syn/anti的选择性(E→anti, Z→syn) 的选择性( → ♣ 双键的构型控制了 的选择性 → )
以手性硼试剂参与的与苯甲醛的aldol反应为例: 反应为例: 以手性硼试剂参与的与苯甲醛的 反应为例
L2 L2 X H R
氢键 π-π堆积 π 螯合作用
X M H R O
L1
R O M H O L2
M L1 O
L1
通过以上的作用来稳定催化剂与醛之间所形成的配合物, 通过以上的作用来稳定催化剂与醛之间所形成的配合物,从而使得 亲核试剂对醛的潜手性面的进攻更具选择性。 亲核试剂对醛的潜手性面的进攻更具选择性。
催 化 不 对 称 aldol 反 应 , 产物的ee值达 产物的 值达99%。 。 值达
Shibasaki试剂 试剂
兼具Lewis酸(La原子) 酸 原 和Bronsted碱(KOH) 碱 ) 的 双 重 性 质 。在 反 应 中 同 时 活 化 底 物和 亲 核 试剂 。 是直接aldol反应的理 反 想 催 化 剂 之 一。
催化剂的类型可包括: • 催化剂的类型可包括: a)有机锡试剂 ) c)有机钛试剂 ) e) 有机银试剂 b)有机铜试剂 ) d)有机锆试剂 ) f)有机烯土试剂 )
手性伯胺催化的不对称逆Aldol反应及其相关反应研究

南开大学博士学位论文手性伯胺催化的不对称逆-Aldol反应及其相关反应研究姓名:***申请学位级别:博士专业:有机化学指导教师:程津培;罗三中201105摘要摘要不对称灿dol反应是最重要的立体选择性地生成C.C键的反应之一,在天然产物和药物分子合成中具有广泛的应用。
在自然界中,aldolase酶可以高效地催化直接Aldol反应。
相关机理研究表明,其中I型aldolase利用赖氨酸残基的伯胺基团作为催化活性单元催化Aldol反应。
我们课题组发现基于手性环己二胺骨架的手性伯胺.叔胺协同布朗斯特酸在功能上可以很好地模拟I型aldolase酶,高度立体选择性地实现了一系列底物的不对称直接Aldol反应。
众所周知,Aldol反应具有可逆性,然而,化学催化的立体选择性的逆.Aldol反应却很少有人研究。
本文在前人的研究工作基础之上,围绕伯胺催化的逆.Aldol及其相关反应开展研究,主要研究成果包括以下几个方面的内容:(1)我们发现伯胺.叔胺协同布朗斯特酸可以高度立体选择性地催化逆.Aldol反应,首次实现了有机小分子催化的不对称逆.Aldol反应,实现了对C.c键的立体选择性切断,可以对消旋aldol进行有效动力学拆分。
(2)实现了直接Aldol反应中挑战性底物aldol的对映选择性合成。
例如,通常富电子芳香醛在直接Aldol反应中非常惰性,它与环己酮的消旋anti.aldol可以很好地利用逆-Aldol反应进行动力学拆分,最高可以达到99/1的anti/syn和99%ee,动力学拆分系数(s)高达115。
类似的,环己酮的syn.aldol进行动力学拆分,最高可以达到99/1的syn/anti和98%ee的对映选择性,J一般大于20。
通过这种方法可以用两个不同构型催化剂实现环己酮与芳香醛aldol反应的全部四个异构体的光学纯合成。
手性伯胺还可以催化消旋叔.aldol的逆.Aldol反应,进行动力学拆分最高可以达到87%ee,s只有2左右。
脯氨酸催化的不对称Aldol反应的研究进展

第17卷第4期化 学 研 究Vol .17 No .42006年12月CHE M I CAL RESE ARCH Dec .2006脯氨酸催化的不对称Aldol 反应的研究进展柯 桢,马 楠,王筱平3,韩 超(同济大学化学系,上海200092)收稿日期:2006-06-23.作者简介:柯桢(1982-),男,硕士生,主要从事不对称合成研究,E Οmail:kezhen_mm19@.3通讯联系人.摘 要:不对称合成是手性药物制备的核心环节,A ldol 反应是重要的形成C —C 键的反应之一,在全合成中有广泛应用.脯氨酸的两个异构体均价廉易得,作为一个非金属不对称催化试剂,它催化的不对称A ldol 反应立体选择性高,有很好的应用前景.本文就近二十年来脯氨酸催化A ldol 反应的机理,溶剂效应,最新进展三方面进行了介绍.关键词:脯氨酸;不对称催化剂;A ldol 反应中图分类号:O 621.3文献标识码:A 文章编号:1008-1011(2006)04-0096-06Advance of Asy mmetri c Aldol Reacti ons Cat alyzed by Proli n eKE Zhen,MA Nan,WANG Xiao 2p ing 3,HAN Chao(D epart m ent of Che m istry,Tongji U niversity,Shanghai 200092,China )Abstract:The A ldol reacti on is an excep ti onally useful strategic C —C bond 2f or m ing reacti on f or thestereoselective constructi on of cyclic and acyclic molecules .The synthetic value of the A ldol reacti onshas been p r oven by their app licati on in the t otal synthesis of natural p r oducts .The advantages of p r o 2line based aldolisati on reacti on are that the methodol ogy is metal free and that both enanti omers of thecatalyst are cheap and easily available .Pr oline catalysed aldolisati on reacti on shows both high yieldsand stereoselectivity .The catalytic enanti oselective versi on of this reacti on has received considerableattenti on in recent years .Keywords:p r oline;unsy mmetric catalysts;A ldol reacti on 近年来,脯氨酸(p r oline )催化的不对称A ldol 反应在不对称合成中应用广泛,不仅在于它是廉价易得的手性原料,而且与其结构也有很大关系.首先,它含有羧基、氨基双官能团,既能起酸催化剂又能起碱催化剂的作用,或者起协同作用,在这一点上类似于酶的作用.另外,作为一个双齿配体,它可与金属形成金属配合物.与其它氨基酸不同的是,脯氨酸中的氨基为吡咯环二级胺,可与金属形成双环[3,3,0]辛烷类物质,它的氨基易于形成亚胺,烯胺中间体.1 分子内不对称A ldol 反应20世纪70年代,Haj os 和Parrish 首次报道了脯氨酸催化的分子内不对称A ldol 反应[1].随后Eder,Sau 2er 和W iecher 等人报道了在脯氨酸和HCl O 4共同催化下,高选择性地得到A ldol 缩和产物(Sche me 1).因此,脯氨酸催化的分子内不对称A ldol 环化反应被命名为Haj os 2Parrish ΟEder ΟSauer 2W iechert 反应.继而,该反应被人们用来合成许多有用的化合物,如类固醇和许多天然产物. 第4期柯桢等:脯氨酸催化的不对称A ldol反应的研究进展97Sche me1 2003年,Chandrakala等人首次发现了不对称enolex o2A ldol反应[2].作者认为Haj os2Parrish2Eder2Sauer2 W iechert反应的过渡态对应于本文机理部分的过渡态E,属于enolendo类型的分子内A ldol反应.作者发现反应(Sche me2),属于enolex o类型,对应于本文机理部分的过渡态F.同时,Douglas M将p r oline催化的enolex o2A ldol反应应用到(+)ΟCocaine的合成中,用以形成基本骨架[3](Sche me3).Sche me2Sche me32 分子间不对称A ldol反应2.1 醛酮间的A ldol反应2000年,L ist小组[4]报道了脯氨酸催化的分子间不对称A ldol反应.文中提到,用大大过量的丙酮与醛反应,才能实现分子间的不对称A ldol反应(Sche me4).Figure1中列出的是在相同条件下,醛与酮反应的A ldol产物(结构、产率和ee值).从Figure1中可以看出,反应的对映选择性与醛的结构密切相关,当丙酮与芳香醛反应,ee值在70%左右,产率在54%~94%之间;丙酮与α位有支链的脂肪醛反应,选择性和产率普遍较高;而丙酮与三级醛反应,ee值甚至超过99%.2001年,L ist小组[5]又报道了丙酮与α位没有支链的脂肪醛反应的研究.结果发现,当用丙酮或者氯仿代替DMS O时,减少脯氨酸用量(10%~20%),则以30%的收率和70%左右的ee值得到交叉Adl ol反应产物.同时可以看出,当醛的β位较大时,如叔丁基,选择性和产率将明显下降.Sche me4由于酮要过量,使得脯氨酸催化的不对称A ldol反应只适合使用廉价的小分子酮,如丙酮、丁酮、环戊酮和羟基丙酮等.在报道了脯氨酸催化下的丙酮与醛的不对称A ldol反应后不久,L ist小组[6]又考察了羟基丙 化 学 研 究2006年98酮与醛的不对称A ldol反应,以较高的收率和选择性得到了anti二醇.Figure1从Figure2中(dr:非对映异构体比例,本文特指anti:syn;ee值:主要产物的对映体过量)可以看出,用邻氯苯甲醛时,反应的dr和ee值均比较低;用α位有支链的环己醛和异丁醛时,反应产率中等,但反应的dr 和ee值较高;用α位有支链的(R)2甘油醛时,反应的对映选择性比较高(97%ee),但非对映选择性和反应收率不是很好.Figure2Thomas B[7]利用羟胺类物质和p r oline催化的A ldol产物进行原位反应,以高产率和高ee值得到N2alkyl2 C2hydr oxy2nitr ones(Sche me5).Jesús Casas将此反应发展了醛酮的α2羟甲基化反应[8],其它研究小组相继报道了脯氨酸作为催化剂在不对称A ldol反应中的应用,该反应被广泛的应用到合成中.Sche me52.2 醛醛间不对称A ldol反应2002年,Mac M illan小组[9]报道了醛与醛在脯氨酸催化下发生交叉A ldol反应,以较好的收率和较高的选择性得到了交叉A ldol反应产物(Sche me6).Figure3中列出的是醛与醛在脯氨酸催化下发生交叉A ldol 反应得到的产物(结构、产率、dr和ee值).可以看出,产物的ee值普遍较高,但反应的非对映选择性受作为电子受体的醛的影响较大,用异丁醛作为电子受体时,反应的非对映选择性明显要比其它醛作为电子受体高.Sche me6A lan首次报道了α2氧代醛之间的A ldol反应[10],且产物可作为合成糖类化合物的前体(Sche me7). Rajes wari[11]等人用α2氨基醛与其它醛反应制得β2羟基氨基醛,可方便地制备β羟基氨基酸类衍生物. 第4期柯桢等:脯氨酸催化的不对称A ldol反应的研究进展99Figure3Sche me73 溶剂效应Pr oline催化的A ldol反应常采用干燥的DMS O作为溶剂,不利于后处理.近年来,逐渐考察了其它溶剂. Peter Kotrusz[12],Teck2Peng[13]等考察了质子性溶剂[bm i m]PF6(12n2butyl23Οmethy2l2i m idaz olium hexafluor o phos phate)对A ldol反应的影响,[b m i m]PF6可减少p r oline的用量.此外,可以将p r oline负载在其它载体上进行非均相催化,催化剂可重复利用,简化后处理.A r mando Córdova[14]首次报道了在此溶剂中进行的两分子醛间的A ldol缩合反应(Sche me8).T omoya Kitazume[15]讨论了在[e m i m][OTf]类质子性溶剂中进行的α2卤代酮和醛的A ldol反应,并进一步得到光学活性的环氧丙烷类单元.Sche me8Annika等人发现加入适量水可提高反应速度和对映选择性[16].A r mando Córdova[17]报道了在BPS(0.01 mol・L-1磷酸盐缓冲液,2.7mmol・L-1KCl,137mmol・L-1NaCl,pH=7.4)缓冲溶液中进行的p r oline 催化的A ldol反应,并发现加入十二烷基硫酸钠(S DS)有利于反应进行.Maurizi o[18]将(2S,4R)242羟基脯氨酸负载在poly(ethyleneglycol)(M5000)上实现非均相A ldol反应.w4 机理研究目前对脯氨酸催化的A ldol反应机理共提出了如下几种过渡态(Figure4).A,B,C,D,E为分子内A ldol反应的过渡态,F,G为分子间反应的过渡态.A由Haj os[1]提出,在这个过渡态中,环上羰基被活化为Carbinola m ine,进而发生亲核取代反应生成C—C键,这个机理很快遭到Jung[19]的反对,因为机理中涉及到一个S2反应,但是构象仍然保留.随后Jung和Eschenmoser讨论了侧链烯胺的N单分子p r oline催化的机理[20].Aga m i提出侧链烯胺的双分子p r oline催化机理(B),其中一个p r oline参与侧链形成烯胺,另一个作为质子转移的中介[21].动力学研究和所观察到的非线性效应支持了双分子p r oline参与的非对映选择的决定性步骤[22].Benja m in L ist研究认为,非线性效应是由测量手段的不精确导致,采用较精确的HP LC得到很好的线性效应[23].由于p r oline在很多有机溶剂中的溶解度不是很好,S wa m inathan提 化 学 研 究2006年100出在晶体表面进行协同催化的过渡态(C),然而很多p r oline催化的A ldol反应是在均相条件下进行的.通过密度泛函分析计算,Houk[24]提出了D模型.E模型是Chandrakala Pidathala等人根据D模型提出的enolexoΟA ldol反应模型.F模型跟D有相似之处,是根据金属烯醇化物反应Zi m mer mannΟTraxler模型提出的.然而根据量子化学计算表明N—H键并不能降低过渡态能量[25],进而提出G模型,G模型由密度泛函分析计算得出,并得到实验证实[26].L inh Hoang通过对逆向A ldol反应的动力学测定间接证实了一分子p r oline参与过渡态的机理.Figure45 结束语脯氨酸的两个异构体来源广泛、廉价、稳定,结构简单,由它催化的A ldol反应立体选择性高,无须金属参与,有酶催化的特点,显示了优良的催化性能,有很好的应用前景,同时其催化机理也有重要的理论研究价值.总之,脯氨酸作为天然手性分子中的一员,必将为不对称催化开拓一个新的领域.参考文献:[1](a)Haj os Z G,Parrish D R.A sy mmetric synthesis of op tically active polycyclic organic compounds[J].Ger O ffen,1971,DE2102623.(b)Haj os Z G,Parrish D R.A sy mmetric synthesis of bicyclic inter mediates of natural p r oduct chem istry[J].J O rg Che m,1974,39(12):1615-1621.[2]Chandrakala P,L inh H,Benja m in L.D irect catalytic asy mmetric enolexo aldolizati ons[J].A nge w Che m Int Ed,2003,42(24):2785-2788.[3]DouglasM M,W illiam H P.T otal synthesis of(+)Οcocaine via desy mmetrizati on of a mes oΟdialdehyde[J].O rg L ett,2004,6(19):3305-3308.[4]L ist B,Lerner R A,Barbas C F.Pr olineΟcatalyzed direct asy mmetric aldol reacti ons[J].J Am Che m Soc,2000,122(10):2395-2396.[5]L ist B,Pojarliev P,Castell o C.Pr olineΟcatalyzed asy mmetric aldol reacti ons bet w een ket ones and unsubstituted aldehydes[J].O rg L ett,2001,3(4):573-575.[6]L ist B.Pr olineΟcatalyzed asy mmetric reacti ons[J].Tetrahedron,2002,58(28):5573-5590.[7]Anders B,Thomas P,W ei Z,et al.For mati on of op tically active functi onalizedΟhydr oxy nitr ones using a p r oline catalyzed A ldolreacti on of aldehydes withcarbonyl compounds and hydr oxyla m ines[J].Synlett,2003,12:1915-1918.[8]Jesús C,Henrik S.D irect organocatalytic asy mmetricΟhydr oxy methylati on of ket ones and aldehydes[J].Tetrahedron L ett,2004,45(32):6117-6119.[9]Northrup A B,Mac M illan D W C.The first direct and enanti oselective cr ossΟaldol reacti on of aldehydes[J].J Am Che m Soc,第4期柯桢等:脯氨酸催化的不对称A ldol反应的研究进展101 2002,124(24):6798-6799.[10]A lan B,I an K M.Enanti oselective organoΟcatalytic direct aldol reacti ons of oxy aldehydes:Step one in a t w oΟstep synthesis ofcarbohydrates[J].A nge w Che m Int Ed,2004,43(16):2152-2154.[11]Rajes wari T,Fujie T,Carl os F B.D irect organocatalytic asy mmetric aldol reacti ons of am ino aldehydes:expedient syntheses ofhighly enanti omerically enriched antihydr oxyl a m ino acids[J].O rg L ett,2004,6(20):3541-3544.[12]Peter K,I veta K.Pr olineΟcatalyzed asy mmetric aldol reacti on in the r oom temperature i onic liquid[b m i m]PF6[J].Che m Co m2m un,2002,21:2510-2511.[13]TeckΟPeng Loh.LΟPr oline in an i onic liquid as an efficient and reusable catalyst f or direct asy mmetric aldol reacti ons[J].Tetra2hedron L ett,2002,43(48):8741-8743.[14]A r mando C.D irect catalytic asy mmetric cr ossΟaldol reacti ons in i onic liquid media[J].Tetrahedron L ett,2004,45(20):3949-3952.[15]Tomoya K.Synthesis of fluorinated materials catalyzed by p r oline or antibody38C2in i onic liquid[J].J Fluor Che m,2003,121(2):205-212.[16]Annika IN,Annina U,Petri M P.Pr olineΟcatalyzed ket oneΟaldehyde A ldol reacti ons are accelerated by water[J].Synlett,2004,11:1891-1896.[17]A r mando C,Wolfgang N,Carl os F B.D irect organocatalytic aldol reacti ons in buffered aqueous media[J].Che m Co mm un,2002,24:3024-3025.[18]Maurizi o B.Poly(ethylene glycol)Οsupported p r oline:A versatile catalyst f or the enanti oselective aldol and i m inoaldol reacti ons[J].A dv Synth Catal,2002,344(5):533-542.[19]JungM E.A revie w of annulati on[J].Tetrahedron,197632:3-31.[20]B r own K L,Dunitz J D,Eschen moser A,et al.Structural studies on crystalline ena m ines[J].Helv Chi m A cta,1978,61(8):3108-3135.[21]Agam i C,M eynier F,Puchot C,et al.Stereoche m istryΟ59.Ne w insights int o the mechanis m of the p r olineΟcatalyzed asy mmet2ric Robins on cyclizati on;structure of t w o inter mediates.A sy mmetric dehydrati on[J].Tetrahedron,1984,40:1031-1038.[22]Puchot S O,Dunach Z S,S wa m inathan S.Pr oline mediated asy mmetric ket ol cyclizati on:a te mp late reacti on[J].Tetrahedron:A symm etry,1999,10:1631-1634[23]Benja m in L,L inh H,Harry J M.Ne w mechanistic studies on the p r olineΟcatalyzed aldol reacti on[J].PNAS,2004,101(16):5841.[24](a)Bah manyar S,Houk K N.The origin of stereoselectivity in p r olineΟcatalyzed intra molecular aldol reacti ons[J].J Am Che mS oc,2001,123:12911-12912.(b)Bah manyar S,L ist B.Quantu m mechanical p redicti ons of the stereoselectivities of p r oline Οcatalyzed asy mmetric inter molecular aldol reacti ons[J].J Am Che m S oc,2003,125(9):2475-2479.[25]L ist B.A sy mmetric a m inocatalysis[J].S yn lett,2001,11:1675-1686.[26]Cle mente F R,Houk K N.Density functi onal calculati ons:Computati onal evidence for the ena m ine mechanis m of intra molecularaldol reacti ons catalyzed by p r oline[J].A nge w Che m In t Ed,2004,43(43):5766-5768.。
催化不对称脱羧_aldol反应的研究进展_高杭

键的有效方法。通过相对廉价以及稳定的羧酸化合物离去二氧化碳分子,生成新的碳-碳键,是一种环
境友好型的方法。不对称催化脱羧 aldol 反应,逐渐取代传统的方法用于构建新的碳-碳键。本文对催
化不对脱羧 aldol 反应的发展进行简要的介绍。
关 键 词:催化;不对称;脱羧 aldol 反应
中图分类号:TQ 028
最近,从自然界在生物合成聚酮类化合物及脂 肪酸的过程中便涉及到了活性酯亲核中间体的生成 中得到启发[3],丙二酸单硫酯(MAHTs)参与的不对称 脱羧反应已经受到越来越多的关注。反应过程中, 聚酮合酶通过组氨酸(His),天冬酰胺酸(Asn),半胱 氨酸(Cys)残基有效活化丙二酸单硫酯(MAHTs)生成 亲核性的酯中间体从而顺利的参与能很容易的催化 这些脱羧反应,碳碳键的生成。通过组氨酸(His), 天冬酰胺酸(Asn),半胱氨酸(Cys) 而没有金属来活 化其反应位点,构建新的碳-碳键(Fig.1-1)。该类反 应这种类型的反应近乎在中性条件下进行。因此, 生成相应的烯醇化烯醇酯中间体的过程是可以通过 羧酸脱去二氧化碳的这种方法来实现的来代替的, 因此可在近乎在中性条件下进行,反应条件温和;。 此外,这种方法不需要预先将酯制备成烯醇硅醚, 避免了使用化学计量的碱,操作简便。因此在构建 合成碳-碳键的过程中的能力上,显示出了巨大的 潜力,也因而它将吸引了大量化学工作者的关注。
CO2H
dolapmine
NH2
CO2H OH AHMPC
NH2
CO2H OH AHPPC
O
N
N HO CO2Me
Phaitanthrin B
Fig. 1-2
随后,2005 年 Shair 教授课题组通过筛选不同 的手性双噁唑啉配体,发现镍和配体 Ligand 2 的配 合物可以有效催化单甲基取代丙二酸单硫酯与醛的 不对称脱羧-aldol 反应,并以良好的收率和高对映 选择性得到了α-甲基-β-羟基羧酸酯 (70%-83%,89-96% ee)[7](Scheme 1-4)。
不对称aldol 反应

配位催化
DMF, -20℃, 100h 62(14)% yield 87% ee X = 10 Calculated pKa value of hydrogen was 12.3. Experimentally determined pKa of 2-methoxyphenol is reported as 9.90 (calculated as 9.62), thus lithium salt of 2,2,5,7,8 pentamethylchromanol is much stronger base than lithium salt of 2-methoxyphenol
17
18
19
水 相 反 应
20
syn-1,2-Diol 结构特征——水溶性
21
寻求能够高效高选择性地催化不对称直 接aldol反应的催化体系正日渐成为有机化 学的一项新课题。
22
参考文献: [1] Yamaoka, M,; Nakazaki, A.; Kobayashi, S. Rate enhancement by water in a TiCl4-mediated stereoselective vinylogous Mukaiyama aldol reaction. Tetrahedron Lett. 51 (2010) 287–289. [2] Yamaoka, M.; Fukatsu, Y.; Nakazaki, A.; Kobayashi, S. Synthetic study of fomitellic acids:construction of the AB ring moiety. Tetrahedron Lett. 2009, 50,3849– 3852. [3] Mitsutaka Iwata, Ryo Yazaki, Yuta Suzuki, Naoya Kumagai, Masakatsu Shibasaki. Direct Catalytic Asymmetric Aldol Reactions of Thioamides: Toward a Stereocontrolled Synthesis of 1,3-Polyols. J. AM. CHEM. SOC. 9 VOL. 131, NO. 51, 2009 18245. [4] Scott D. Pegan, Kamolchanok Rukseree, Scott G. Franzblau and Andrew D. Mesecar. Structural Basis for Catalysis of a Tetrameric Class IIa Fructose 1,6Bisphosphate Aldolase from Mycobacterium tuberculosis. J. Mol. Biol. (2009) 386, 1038–1053. [5] S. S. V. Ramasastry, Klaus Albertshofer, Naoto Utsumi, and Carlos F. Barbas III. Water-Compatible Organocatalysts for Direct Asymmetric syn-Aldol Reactions of Dihydroxyacetone and Aldehydes. Org. Lett., Vol. 10, No. 8, 2008。1621-1624 [6] Evaggelia Tsandi, Christoforos G. Kokotos, Sofia Kousidou, Valentine Ragoussis, George Kokotos. Sulfonamides of homoproline and dipeptides as organocatalysts for Michael and aldol reactions Tetrahedron 65 (2009) 1444–1449. 23
新型脯氨酸类催化剂在不对称Aldol反应中的应用

新型脯氨酸类催化剂在不对称Aldol反应中的应用吴小佳(河北农业大学理工学院, 河北 黄骅 061100)摘要:新型脯氨酸类催化剂能够有效的催化不对称Aldol反应,通过文献得知其催化产物具有高产率,高对映选择性的特点。
本文综述了四种无论是在制备工艺还是反应条件方面都比较完善的新型脯氨酸类催化剂,并从结构特性和在Aldol反应中实际应用等方面展开介绍。
关键词:新型脯氨酸;催化剂;Aldol反应有机小分子催化不对称合成反应在医药生产、材料合成和生命科学等领域占有举足轻重的地位,不对称Aldol反应是该反应类型中比较常见的一种,其催化剂具有化学性质稳定、反应操作要求简单和对环境影响较小等优点。
在催化剂的研究方面,国内外的研究学者曾对多种氨基酸及其他化合物进行探究,发现其中脯氨酸类催化剂在不对称 Aldol反应中表现出的效果最好,也是目前有机合成领域重点研究方向。
1 L-脯氨酸为反应催化剂脯氨酸分子结构中具有吡咯环、羧基、仲胺基团,这些基团正是催化剂分子在反应中不可缺少的五元四氢吡咯环和活泼氢。
[1]早在20世纪70年代,已有研究者对脯氨酸催化不对称Aldol反应进行了研究,发现其产物具有较高的对映选择性,但仍存在产率较低的问题,由于当时实验条件的有限性,脯氨酸在不对称Aldol反应中的研究没有进一步深入研究。
在21世纪初,List和Barbas[2]等人对L-脯氨酸催化不对称Aldol反应展开了深入研究,将脯氨酸作为催化剂分别用于丙酮和芳醛、α-取代醛、三级醛的不对称Aldol反应中,MDSO作溶剂,得到了不同的对映选择性值和产率,但发现两者不能同时达到较高值,仍存在很大的改进空间。
之后很多研究者以L-脯氨酸为载体,在其基础上加以修饰得到了不同催化效果的脯氨酸类催化剂。
2 (4S)-苯氧基-(S)-脯氨酸为反应催化剂脯氨酸是一种小分子化合物,水中溶解度比其他任何氨基酸都大,在25℃时100g水中可大约溶解162 g脯氨酸,在一些有机溶剂中溶解度不高,虽然在被誉为“万能溶剂”的DMSO 中表现出了很好的催化性能,但后期的催化剂回收利用还存在很大问题。
一种不对称杂环酮Aldol反应催化剂及其反应方法[发明专利]
![一种不对称杂环酮Aldol反应催化剂及其反应方法[发明专利]](https://img.taocdn.com/s3/m/30a7f82d58f5f61fb6366632.png)
专利名称:一种不对称杂环酮Aldol反应催化剂及其反应方法专利类型:发明专利
发明人:付建平,胡居吾,熊伟,王慧宾,朱仁果,胡银
申请号:CN201410743248.7
申请日:20141203
公开号:CN104531799A
公开日:
20150422
专利内容由知识产权出版社提供
摘要:本发明公开了一种不对称杂环酮Aldol反应的催化剂,含有番木瓜蛋白酶。
本发明还公开了一种不对称杂环酮Aldol反应的催化剂的反应方法。
本发明首次发现番木瓜蛋白酶能够作为不对称杂环酮Aldol反应的催化剂,特别是适用于芳香醛或杂芳醛与杂环酮之间的不对称杂环酮Aldol反应,具有催化活性好、对映选择性高、经济、环保等优点,不仅拓宽了番木瓜蛋白酶的应用范围,而且为不对称杂环酮Aldol反应提供了一种优良的生物酶催化剂,在有机合成领域中具有广阔的应用前景。
申请人:江西省科学院应用化学研究所
地址:330096 江西省南昌高新区昌东大道7777号
国籍:CN
更多信息请下载全文后查看。
不对称Diels-Alder反应

O O O
Me, H
Single product
O
Hale Waihona Puke 双不对称加成O S O O S BF3.OEt2 Selectivity>130:1 匹配对 O O O S
Diels-Alder反应的规律:
1、区域选择性: 反应产物往往以“假邻对位”产物为主。 即若把六元环比作苯环,那么环上官能团 (假设有两个官能团)之间的相对位置以 邻对位为主!
O OH H 2
O OH H
H NCO2CH2Ph ZnCl2
HNCO2CH2Ph O OH de>98% H
手性双烯体
Ph H OMe OH O O >97% d.e B(OAc)3, 98% OH O O H
H
OR*
EtO2C
N
O O
EtO2C O O C6H6, ref. 3h Me, H
N
R1 R3
R1
R3
+
R4
=
R4 R2 R2
带有吸电子取代基的亲双烯体和带有给电子取代基的 双烯体对反应有利!
常用的亲双烯体有:
O
O
O
O
(Z)
O
OR
(Z)
C6H5
O
顺丁烯二酸酐
丙烯醛
丙烯酸酯
O
肉桂醛
C
O
COOH
OR
N
C
(Z) (Z)
N C OR
C COOH
0
O
对苯醌
丁炔二羧酸
偶氮二羧酸酯
下列基团也能作为亲双烯体发生反应:
Ph
OR' OR' O N O Ph O + CH2Cl2 ,-78℃
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Andrew D. Mesecar et al. J. Mol. Biol. (2009) 386, 1038–1053.
15
有机催化
有机小分子作为不对称催化剂,还具有许多特殊的优点。 直接不对称羟醛缩合反应具有操作简单和原子经济性的显著优点。
16
二肽磺酰胺11a 在产率和ee 值方面表现出最好的结果。
17
18
19
水 相 反 应
20
syn-1,2-Diol 结构特征——水溶性
21
寻求能够高效高选择性地催化不对称直 接aldol反应的催化体系正日渐成为有机化 学的一项新课题。
22
参考文献: [1] Yamaoka, M,; Nakazaki, A.; Kobayashi, S. Rate enhancement by water in a TiCl4-mediated stereoselective vinylogous Mukaiyama aldol reaction. Tetrahedron Lett. 51 (2010) 287–289. [2] Yamaoka, M.; Fukatsu, Y.; Nakazaki, A.; Kobayashi, S. Synthetic study of fomitellic acids:construction of the AB ring moiety. Tetrahedron Lett. 2009, 50,3849– 3852. [3] Mitsutaka Iwata, Ryo Yazaki, Yuta Suzuki, Naoya Kumagai, Masakatsu Shibasaki. Direct Catalytic Asymmetric Aldol Reactions of Thioamides: Toward a Stereocontrolled Synthesis of 1,3-Polyols. J. AM. CHEM. SOC. 9 VOL. 131, NO. 51, 2009 18245. [4] Scott D. Pegan, Kamolchanok Rukseree, Scott G. Franzblau and Andrew D. Mesecar. Structural Basis for Catalysis of a Tetrameric Class IIa Fructose 1,6Bisphosphate Aldolase from Mycobacterium tuberculosis. J. Mol. Biol. (2009) 386, 1038–1053. [5] S. S. V. Ramasastry, Klaus Albertshofer, Naoto Utsumi, and Carlos F. Barbas III. Water-Compatible Organocatalysts for Direct Asymmetric syn-Aldol Reactions of Dihydroxyacetone and Aldehydes. Org. Lett., Vol. 10, No. 8, 2008。1621-1624 [6] Evaggelia Tsandi, Christoforos G. Kokotos, Sofia Kousidou, Valentine Ragoussis, George Kokotos. Sulfonamides of homoproline and dipeptides as organocatalysts for Michael and aldol reactions Tetrahedron 65 (2009) 1444–1449. 23
谢谢!
24
Kobayashi et al. Tetrahedron Letters 51 (2010) 287–289.5在天然产物全合成中的 Nhomakorabea用6
Yamaoka, M.; Fukatsu, Y.; Nakazaki, A.; Kobayashi, S. Tetrahedron Lett. 2009, 50, 3849–3852
13
模拟Ⅱ类醛缩酶催化不对称直接Aldol反应
The class IIa fructose 1,6-bisphosphate aldolase (FBA) enzyme from M. tuberculosis (MtFBA) has been proposed as one such target since it is upregulated in latent TB.
11
生物催化
• 在生物体内广泛存在的醛缩酶是不对称直 接Aldol反应的高效催化剂。迄今为止已有 30余种醛缩酶被鉴别,根据催化机理的不 同,它们被分为两大类:I类醛缩酶,II类醛 缩酶。 • List等认为可以把L-脯氨酸看作是一类“微 型醛缩酶”(micro-aldolase)
12
模拟Ⅰ类醛缩酶催化不对称直接Aldol反应
Tol: 77 h, 77% yield Tol+5 mol% H2O: 55 h,76% yield Tol+10 mol% H2O: 40 h,74% yield Tol+20 mol% H2O: 26 h,69% yield
3
是否是此类反应的特征?
4
Although the specific role of water in the VMAR remains unclear, they tentatively propose the following two possibilities: (i)water might coordinate to TiCl4 and result in partial dissociation of TiCl4 aggregates, and (ii) both the proton and TiCl4 of a plausible hydrated TiCl4 might coordinate to the carbonyl oxygen, resulting in double activation.
7
配位催化
DMF, -20℃, 100h 62(14)% yield 87% ee X = 10 Calculated pKa value of hydrogen was 12.3. Experimentally determined pKa of 2-methoxyphenol is reported as 9.90 (calculated as 9.62), thus lithium salt of 2,2,5,7,8 pentamethylchromanol is much stronger base than lithium salt of 2-methoxyphenol
X=3 DMF, -60℃, 40h 91(trace) % yield
91% ee
x = 10 , 95% ee
8
底物范围
9
合成应用
10
• Future work will be dedicated to applying the present protocol to the asymmetric synthesis of natural products bearing a 1,3-polyol motif.
不对称aldol 反应
黄海 有机化学 200920102003
1
Aldol反应被认为是最有效的形成C—C键的反应之一。
• • • • •
手性辅基 金属配合物催化 生物催化 有机分子催化 参考文献
2
手性辅基举例
Vinylogous Mukaiyama aldol reaction 二氯甲烷:产率低;甲苯:反应极慢,无法反复生产。
