不对称mbh反应
不对称氢化反应 碱活化催化剂

不对称氢化反应碱活化催化剂English Answer:Asymmetric hydrogenation is a powerful tool for the synthesis of chiral compounds, which are essential in many fields such as pharmaceuticals and agrochemicals. In recent years, there has been a growing interest in the development of碱活化 catalysts for asymmetric hydrogenation.碱活化 catalysts are typically composed of a metal complex and a chiral ligand. The metal complex is responsible for the catalytic activity, while the chiral ligand provides the chirality to the catalyst. 碱活化catalysts can be used to hydrogenate a variety of substrates, including ketones, alkenes, and imines.The mechanism of asymmetric hydrogenation involves the coordination of the substrate to the metal complex, followed by the transfer of hydrogen from the chiral ligand to the substrate. The chirality of the ligand controls thestereochemistry of the hydrogenation reaction, resulting in the formation of a chiral product.碱活化 catalysts have several advantages over传统asymmetric hydrogenation catalysts. First, they are typically more active and selective than traditional catalysts. Second, they can be used to hydrogenate a wider range of substrates. Third, they are often more stable and reusable than traditional catalysts.As a result of these advantages,碱活化 catalysts are becoming increasingly popular for the synthesis of chiral compounds. They are expected to play a major role in the development of new and improved pharmaceuticals and agrochemicals.中文回答:不对称氢化反应是一种合成手性化合物的有力工具,手性化合物在制药和农用化学品等许多领域中至关重要。
有机合成中的不对称催化反应

有机合成中的不对称催化反应不对称催化反应是有机合成领域中一种重要的方法,能够有效地构建手性化合物。
手性化合物在药物、农药和材料科学等领域有着广泛的应用前景。
本文将介绍不对称催化反应的原理、机制以及在有机合成中的应用。
一、不对称催化反应的原理不对称催化反应是利用手性催化剂促进反应的进行,使得产物中手性部分的生成有选择性。
手性催化剂能够将底物的立体信息转移到产物中,从而实现手性化合物的合成。
二、不对称催化反应的机制不对称催化反应的机制主要分为两类:手性诱导和手性酸碱催化。
手性诱导的反应是通过手性配体与催化剂形成配位键来实现对底物的立体选择性,而手性酸碱催化则是通过手性催化剂与底物形成氢键或离子键来实现选择性。
三、不对称催化反应的应用1. 不对称氢化反应不对称氢化反应是一种常见的不对称催化反应,通过手性催化剂催化底物的不对称氢化,实现手性化合物的合成。
该反应在制药领域中得到广泛应用,能够高效地合成具有药理活性的手性分子。
2. 不对称环加成反应不对称环加成反应是一种重要的不对称催化反应,通过手性催化剂催化底物的环加成反应,实现手性环化合物的合成。
这种反应在天然产物合成和有机小分子合成中具有重要的地位。
3. 不对称亲核取代反应不对称亲核取代反应是一种常见的不对称催化反应,通过手性催化剂催化底物的亲核取代反应,实现手性化合物的合成。
该反应在合成有机分子中起着重要的作用,能够高效地构建手性碳-碳和碳-杂原子键。
四、不对称催化反应的发展趋势随着有机合成领域的不断发展,不对称催化反应也在不断改进和创新。
未来的研究方向主要集中在发展新型高效的手性催化剂、寻找更加环境友好和可持续的反应体系、以及应用机器学习和人工智能等技术加速合成方法的发现和优化。
总结:不对称催化反应作为一种重要的有机合成方法,在合成手性化合物方面发挥着重要的作用。
通过探索不对称催化反应的原理和机制,并结合实际应用,能够推动有机化学领域的发展,为合成更多种类的手性化合物提供新的思路和方法。
有机化学中的不对称催化反应

有机化学中的不对称催化反应不对称催化反应是有机化学领域中的一个热点研究方向,因为它是合成手段中极为重要的一环,能够制备出高度选择性的化合物。
本文将从不对称催化反应的原理、应用和发展三个方面探讨这个研究方向的现状和趋势。
一、不对称催化反应的原理不对称催化反应的原理是利用非对称的催化剂对不对称的衍生物进行催化转化。
其中,非对称催化剂可以分为手性配体和手性环境两类。
手性配体是以金属离子为中心,通过挂接在离子周围的配体上来控制反应性质,例如钯、铑等催化剂。
手性环境是通过非对称的环境来实现手性控制,例如蛋白质等。
不对称催化反应的原理基于手性诱导的原理,即手性物质与非手性物质在相互作用时会导致选择性反应,所以通过选择性诱导的方法可以进行有机化合物的手性控制。
二、不对称催化反应的应用不对称催化反应在有机合成中有广泛的应用,例如:1. 合成手性分子:手性分子在生命体系中具有重要作用,通过不对称催化反应可以合成出具有高度手性的分子,以供生命体系中的应用。
2. 制备药物:药物分子通常是手性分子,因此不对称催化反应在药物合成中得到了广泛的应用。
3. 制备农药:农药分子同样需要手性,不对称催化反应在农药合成中也起到了重要作用。
4. 制备高分子材料:高分子材料中往往存在手性,不对称催化反应也可以用于这一领域。
三、不对称催化反应的发展不对称催化反应在近年来得到了快速发展,主要集中在以下几个方面:1. 开发新的手性催化剂:开发新的手性催化剂是不对称催化反应的重要方向之一,因为催化剂的种类越多,反应选择性就会越高。
2. 提高反应效果:提高反应效果是不对称催化反应的重要目标之一,也是改进反应条件和催化剂设计的中心。
3. 组合催化反应:组合催化反应可以同时利用多个催化剂或催化剂与其他催化反应进行协同反应,以提高反应效率和选择性。
4. 催化剂的可重复使用:催化剂的可重复使用可以降低反应成本,也是不对称催化反应的重要研究方向之一。
总之,不对称催化反应是一个有着广泛应用前景的领域,随着催化剂和反应设计的不断发展,相信不对称催化反应将在有机合成和化学领域中发挥着越来越重要的作用。
MBH碳酸酯烯丙基化反应

摘要:MBH碳酸酯是一种重要的烯丙基试剂,本文探讨MBH碳酸酯作为烯丙基试剂与α-胺基腈及氰醇、吡唑酮的反应过程及机理。
MBH碳酸酯可在Lewis碱催化作用下和氰醇和α-胺基反应在氰基的α位上引入烯丙基,并且在不同的反应条件下α-胺基烯丙基化表现出了区域选择性。
MBH碳酸酯在不同催化剂的催化下变现出在β或者γ位的反应差异。
关键字:MBH碳酸酯烯丙基化区域选择性1.MBH碳酸酯Morita-Baylis-Hillman (MBH)反应是一类重要的C—C 键形成反应[1](图1),其反应产物的碳酸酯——MBH 碳酸酯由于具有较高的反应活性和丰富的转化途径,近年来成为有机合成研究的热点之一。
图1 Morita-Baylis-Hillman反应3-乙烯基取代的3-羟基氧化吲哚(Ⅱ)是有机合成中的一个重要砌块,其中的乙烯基还可以方便地进一步衍生化,合成一些重要的并环骨架。
这一手性砌块目前可通过金属催化的烯基硅试剂对靛红的不对称加成反应和有机催化的不对称Morita-Baylis-Hillmann (MBH)反应来构建(图2)[2-4]。
图2 3-乙烯基取代的3-羟基氧化吲哚的合成2.Lewis碱催化的α-胺基腈及氰醇的烯丙基官能团化反应具有氰基结构单元的化合物在有机合成化学、生物化学、药物化学、农业化学以及光电材料等领域有着重要的用途并受到了广泛的关注[5]。
其中,具有α-位季碳中心(含杂原子ON)的α-胺基腈类及氰醇类衍生物,作为一类重要的腈类化合物,由于其在有机合成以及药物化学等研究领域扮演的重要角色因而受到广泛重视[6]。
例如该类高度官能团化的腈类结构单元能够进行多种化学反应。
因此作为一类非常重要的合成砌块广泛用于含有多官能团季碳中心的天然产物及具有生物活性的化合物的全合成[7][8]。
由于具有α-位季碳中心(含杂原子O,N)的腈类衍生物的重要应用价值以及构建该结构单元的挑战性,发展高效、多样化、原子经济性的催化合成方法构建官能团化的上述结构单元一直是有机化学家关注的热点。
在水介质中催化的不对称曼尼希反应
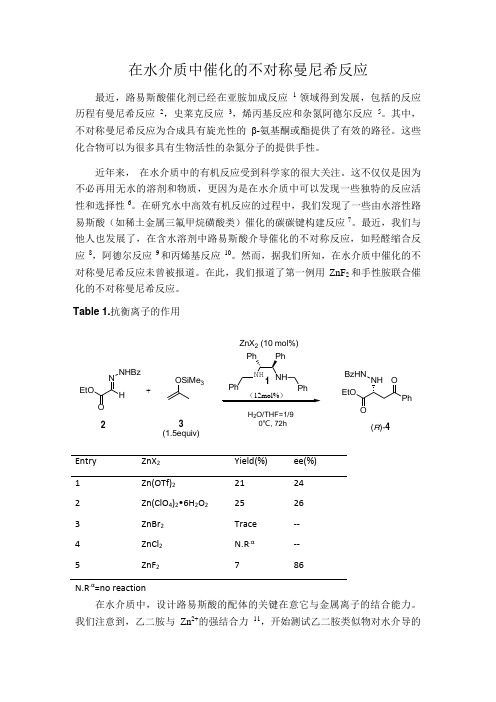
在水介质中催化的不对称曼尼希反应最近,路易斯酸催化剂已经在亚胺加成反应1领域得到发展,包括的反应历程有曼尼希反应2,史莱克反应3,烯丙基反应和杂氮阿德尔反应5。
其中,不对称曼尼希反应为合成具有旋光性的β-氨基酮或酯提供了有效的路径。
这些化合物可以为很多具有生物活性的杂氮分子的提供手性。
近年来, 在水介质中的有机反应受到科学家的很大关注。
这不仅仅是因为不必再用无水的溶剂和物质,更因为是在水介质中可以发现一些独特的反应活性和选择性6。
在研究水中高效有机反应的过程中,我们发现了一些由水溶性路易斯酸(如稀土金属三氟甲烷磺酸类)催化的碳碳键构建反应7。
最近,我们与他人也发展了,在含水溶剂中路易斯酸介导催化的不对称反应,如羟醛缩合反应8,阿德尔反应9和丙烯基反应10。
然而,据我们所知,在水介质中催化的不对称曼尼希反应未曾被报道。
在此,我们报道了第一例用ZnF 2和手性胺联合催化的不对称曼尼希反应。
Entry ZnX 2 Yield(%) ee(%) 1 2 3 4 5Zn(OTf)2 Zn(ClO 4)2•6H 2O 2 ZnBr 2 ZnCl 2 ZnF 221 25 Trace N.R .α 724 26 -- --86N.R .α=no reaction在水介质中,设计路易斯酸的配体的关键在意它与金属离子的结合能力。
我们注意到,乙二胺与Zn 2+的强结合力11,开始测试乙二胺类似物对水介导的O E tO N H N H B z+O SiM e 3(12m ol%)H 2O /T H F =1/9 0℃, 72hPhNHP h Ph N HP hEtOPhOON HBzH N23(1.5equiv)(R )-4ZnX 2 (10 m ol%)1Tab le 1.抗衡离子的作用不对称曼尼希反应的催化活性。
对于反应物,我们选择酰基腙,因为它是胺的代替物并且在水中稳定存在13。
通过多种途径,发现在以水/四氢呋喃(1/9)溶液为介导的亚肼酯2与烯醇硅醚3反应中,二胺配体和Zn(OTf)2的使用表征出 ee 值(24% ee )比较低,但是却有重要的意义。
不对称催化反应的原理

不对称催化反应的原理
不对称催化反应是指催化剂能够使反应物以两种不对称的方式发生反应,产生对映异构体。
其原理可以归结为手性诱导和对映选择性两个主要因素。
1. 手性诱导:手性催化剂在反应中能够有效地诱导反应物中的手性中心发生不对称转化。
这是因为手性催化剂分子本身具有手性结构,与反应物形成具有一定立体排列的中间体,从而使得反应物在催化剂作用下选择性地发生不对称反应。
2. 对映选择性:手性催化剂在反应中对不对称产物的对映异构体进行选择性催化,使得特定的对映异构体优先生成。
这是因为手性催化剂与反应物之间的相互作用会导致反应中间体具有不同的构象,从而使得不同的对映异构体在反应中的能量差异不同,从而选择性地生成某种对映异构体。
总而言之,不对称催化反应的原理可以归结为手性诱导和对映选择性两个主要因素,通过催化剂的手性结构作用,使反应物以特定的立体排列发生不对称转化,并选择性地生成特定的对映异构体。
不对称合成酶催化经典例子

不对称合成酶催化是有机合成领域中的一个重要分支,它利用酶作为催化剂进行手性分子的合成。
不对称合成通常是指合成手性分子的过程,其中反应生成的产物具有手性结构,而且合成过程中保持了不对称性。
不对称合成酶催化是一种高效、选择性高、环境友好的合成方法,已经在制备药物、农药、香料等有机分子中取得了显著的成就。
下面将介绍一些不对称合成酶催化的经典例子。
### **1. 不对称羟基化反应(Asymmetric Hydroxylation):**这是一种通过酶催化实现的手性醇的制备方法。
在这个过程中,酶催化可以实现对底物的选择性氧化,从而生成手性的醇。
例如,Cytochrome P450是一类在生物体内广泛存在的酶,能够催化对底物的高度选择性氧化反应,生成手性醇。
这种方法在制备药物中得到了广泛应用。
### **2. 不对称酮还原反应(Asymmetric Ketone Reduction):**酮还原反应是合成手性醇的经典方法之一。
使用不对称合成酶催化的酮还原反应,可以实现对底物的高度选择性还原,生成手性醇。
例如,使用酮还原酶如Ketoreductase,可以将酮还原为相应手性的醇。
这种方法在制备手性药物中具有重要的应用前景。
### **3. 不对称氨化反应(Asymmetric Amination):**不对称氨化反应是一类通过酶催化实现手性胺的制备方法。
在这个过程中,酶催化可以实现对底物的高度选择性氨化,生成手性胺。
例如,使用脱氢酶(Transaminase)可以催化酮和胺之间的氨化反应,生成相应的手性胺。
这种方法在药物合成和农药合成中有着广泛的应用。
### **4. 不对称酰基化反应(Asymmetric Acylation):**这是一类通过酶催化实现手性酯的制备方法。
在这个过程中,酶催化可以实现对底物的高度选择性酰基化,生成手性酯。
例如,使用酰基转移酶(Acyltransferase)可以催化对底物的选择性酰基化反应,生成手性酯。
中科院药物设计课件不对称反应及其应用

THANKS
感谢观看
02
不Hale Waihona Puke 称反应的原理手性催化剂1
手性催化剂是不对称反应中的关键因素,能够选 择性促进一种手性分子的反应,从而实现不对称 合成。
2
手性催化剂通常由具有手性的有机小分子或金属 络合物组成,通过与底物的相互作用,控制反应 的立体化学过程。
3
手性催化剂的设计和合成是实现不对称反应的关 键技术之一,需要根据具体反应类型和底物结构 进行针对性的研究和优化。
前景
绿色化学的需求
随着绿色化学的发展,不对称反 应作为一种高效、环保的合成方 法,其应用前景越来越广泛。
新技术的应用
随着人工智能、量子计算等新技 术的应用,不对称反应的研究将 更加深入,有望实现更高的选择 性和转化率。
医药和农业领域的
应用
不对称反应在药物和农药的合成 中具有重要意义,随着相关领域 的需求增长,其应用前景将更加 广阔。
对未来研究方向进行了展望,包括新型手性催化剂的设计、不对称反 应机理的深入研究等。
展望
技术创新
强调了技术创新在不对称反应及其应用领域的重要性,如新催化 剂的发现、新反应条件的优化等。
跨学科合作
提倡不同学科之间的合作,如化学、生物学、物理学等,以促进 不对称反应在药物设计领域的应用和发展。
社会影响
讨论了不对称反应在药物设计领域的应用对社会的影响,如提高 药物生产效率、降低生产成本等。
药物研发中的关键技术
在药物研发中,不对称合成能够提供 单一对映体的药物分子,有助于提高 药物疗效和降低副作用。
不对称反应的类型
生物催化不对称反应
利用生物酶作为催化剂,实现手性分子的合成。
有机催化不对称反应
不对称迈克尔加成反应

不对称迈克尔加成反应一、什么是不对称迈克尔加成反应不对称迈克尔加成反应(asymmetric Michael addition reaction)是指一类反应,在单一的锡卤(tin)催化剂的作用下,碳酰胺或羧酸衍生物与各种α,β-不饱和卤素或醛形成α,β-烯酮或剑尾内酯(penultimate diene)中间体时极不对称性大量形成单手性产物。
它是一种重要的有机合成手段,因为它可以在反应温和、相稳定条件下,有效地构建有机分子的非等戊烯的活性键,即构建功能基元的合成。
不对称迈克尔加成反应发生在快速而高度选择性的条件下,因而在有机合成领域中广受赞誉。
二、不对称迈克尔加成反应的原理不对称迈克尔加成反应的原理是借助单一的锡(tin)催化剂,它可以诱导碳活性物质与α,β-不饱和卤或醛形成α,β-烯酮或剑尾内酯中间体,利用这种中间体在催化口球上发生聚合反应一步生成有机产物。
锡(tin)催化剂可与碳碳双键及其衍生物结合在一起,从而活化反应位点,促进不饱和卤或醛与碳活性子中间体的反应,最终形成烯酮产物。
现有的锡(tin)催化剂能够有效地实现不对称迈克尔加成反应,因此该反应处理的速度快、物种的选择性高,可以合成出多种单手性的烯酮类化合物。
三、不对称迈克尔加成反应的应用不对称迈克尔加成反应用于制备有机化合物,近年来在有机合成领域中被广泛应用,用于制备各类有机合成中间体,如药物、抗生素、农药、染料、制剂等。
例如,可以使用不对称迈克尔加成反应来合成特殊结构的各种杂环化合物,如羟基异喹唑烷,具有特殊的生物活性,这些杂环化合物通常作为生物催化剂、工业催化剂、催化剂和抗菌素的重要基础物质。
此外,不对称迈克尔加成反应也在卫生日用品和农药制造领域被广泛使用。
四、不对称迈克尔加成反应存在的问题由于不对称迈克尔加成反应依赖于昂贵和稀有的贵金属化合物催化剂,目前催化剂仍然存在不稳定性、难以操作性和低产率等问题,从而限制其在有机合成中的应用。
化学反应的不对称反应机理

化学反应的不对称反应机理化学反应是物质转变的过程,不对称反应则指的是在反应中产生手性物质的过程。
不对称反应机理是指介导不对称反应的分子间相互作用和反应路径。
本文将探讨不对称反应的机理,并通过案例和实验结果加以说明。
一、不对称反应的定义和应用领域不对称反应是指在反应过程中,产生具有手性的化合物。
手性分子是一类分子,它们的镜像异构体不能通过旋转或平移重合。
手性物质在生物学、药物学、材料科学等领域具有广泛的应用价值。
不对称反应的研究对于合成手性化合物以及开发高效、低成本的不对称合成方法具有重要意义。
二、不对称反应的机理1. 催化剂作用机理不对称反应中最重要的机理是催化剂的作用。
催化剂通过提供具有手性的环境,降低反应能垒,加速反应过程。
催化剂可以分为金属催化剂和有机催化剂两大类。
金属催化剂一般通过与底物形成配合物,改变底物的立体结构和电子环境,从而导致产物手性选择性的改变。
常见的金属催化剂有手性配体与过渡金属络合物。
有机催化剂是近年来兴起的一种新型催化剂。
有机催化剂通过氢键、离子键、范德华力等分子间相互作用,引发底物分子的手性诱导和选择性。
常见的有机催化剂有手性胺、手性碱、手性膦等。
2. 反应底物的手性诱导底物的手性结构也可以影响不对称反应的手性选择性。
对于某些反应而言,底物分子的手性结构可以直接决定产物的手性结构。
在不对称合成中,可以通过选择合适的手性底物来实现手性选择性合成手性化合物。
3. 不对称反应的立体效应不对称反应的机理在很大程度上与反应底物和催化剂之间的立体效应相关。
立体效应包括空间位阻效应、空间手性诱导、空间位迁移等。
这些效应影响着反应的速率和产物的手性选择性。
三、案例分析以不对称的Staudinger反应为例,该反应以手性亚磷酰亚胺为催化剂,将氨基酸酯和亚磷酰氯反应,生成手性的亚磷酰酰胺产物。
在反应底物和催化剂之间的空间位阻效应和空间手性诱导起到了关键作用,从而实现了手性选择性的不对称反应。
不对称催化反应的进展与机理

不对称催化反应的进展与机理引言:不对称催化反应作为有机合成中的重要领域,广泛应用于药物合成、材料科学等领域。
与传统催化反应相比,不对称催化反应具有高效、高选择性和环境友好等优势。
本文将介绍不对称催化反应的最新进展和机理研究。
一、不对称催化反应的定义和意义不对称催化反应是指在催化剂的作用下,通过破坏反应物中的对称性,使得产物具有手性。
在有机合成中,手性是一种重要的性质,直接关系到产物的活性和拆分等性质。
因此,不对称催化反应作为实现手性合成的重要手段,受到了广泛的关注。
二、不对称催化反应的分类不对称催化反应可以按照所用催化剂的类型进行分类,主要有手性配体催化、酶催化和金属催化等。
其中,手性配体催化是目前应用最广泛的一种方法。
手性配体能够通过与催化剂中金属离子形成配位键,使催化剂在反应中具有选择性。
在手性配体催化中,不对称氢化、不对称重排、不对称亲核取代和不对称诱导等反应得到了广泛的研究与应用。
三、不对称催化反应的机理不对称催化反应的机理研究是该领域的重要方面。
了解反应的机理有助于设计新的催化剂和优化反应条件。
根据现有的研究,不对称催化反应的机理主要包括两个方面——以底物为中心的机理和以催化剂为中心的机理。
1. 以底物为中心的机理以底物为中心的机理认为,在反应中底物分子与催化剂发生相互作用,形成催化活性物种。
催化活性物种与底物发生反应,通过过渡态生成手性产物。
这种机理被广泛应用于不对称氢化和不对称亲核取代等反应。
2. 以催化剂为中心的机理以催化剂为中心的机理认为,催化剂通过与底物形成配合物,使底物具有手性,然后与底物发生反应生成产物。
这种机理被广泛应用于手性配体催化的反应中,如不对称重排和不对称诱导反应。
四、不对称催化反应的最新进展不对称催化反应在过去几十年中取得了令人瞩目的进展。
下面列举几个具有代表性的进展:1. 金属有机催化剂的设计和应用近年来,金属有机催化剂的设计和应用成为了研究的热点。
通过合理设计金属有机催化剂的结构,可以实现高效且高选择性的手性合成。
不对称催化反应

不对称催化反应1 对称催化反应对称催化反应是指同等的反应物发生变化,同等的产物产生,即使反应本身发生变化,但最终的结果是对称的。
它的反应机理是在反应物与催化剂的反应中交换原子或分子,使反应物发生变化以用另一个反应物来替换反应性原子或分子,最终形成稳定的产物。
2 非对称催化反应非对称催化反应是指一定物质的反应催化剂在特定反应中对反应立场进行非对称选择,使反应产物具有非对称性。
非对称催化反应的反应机理是在催化剂的共同作用下,使得一定立场的原反应物优先地反应并产生非对称的具有相对结构的立体异构体。
反应的产物就具有显著的非对称性,入射光进入物质时会发生偏振,并显示物质的非对称性。
非对称催化反应通常可以说是一种节能、高效、可控、选择性及环保的产物合成方法,它不仅可以有效减少污染和节能,而且还可以进一步提高产物的纯度和产量,得到较高科学价值的物质。
由于非对称催化反应的反应机理相比对称催化反应更加复杂,有很多不同的部分组成,因此要更加深入地研究它们的反应机理,以有效的控制反应的过程,加速反应的进行,降低生产成本,以及促进其应用。
3 非对称催化反应的应用非对称催化反应非常重要,它在过去几十年里被广泛应用到精细有机合成中,可大大提高有机合成产物的结构多样性及纯度,是一种高效的反应方法,成为生物药物及有机半导体研究的重要手段。
从农药、芳香族分子到金属有机骨架化合物,非对称催化反应的应用已经得到了显著的发展。
非对称催化反应的应用不但可以延长其反应时间,改善反应条件,还可以有效降低生产成本,产高纯度的产物,可见非对称催化反应在工业面前拥有越来越广泛的用途。
4 结语以上就是关于非对称催化反应的内容,可以看出,它除了能够有效的减少污染和节能外,还可以大大提高合成产物的结构多样性及纯度,在很多领域具有巨大的作用,也因此有重要的研究价值和应用价值。
不对称M-B-H反应
PPh2 HO CP5 60
o
PPh2 OH
C P 6 (R , R p ) 3 d , Y ie ld : 4 5 % , ee: 65% , S
C P 7 (S , S p ) 3 d , Y ie ld : 4 4 % , ee: 38% , R
C , 1 2 h , Y ie ld : 7 8 % ,
X
+
EW G R R3
X EW G R3 or o th e r s u b s titu te d g r o u p
R
R1
X = O, NR2
R 3= H
E W G = e le c tro n w ith d r a w in g g r o u p
反应历程
PPh3 I OH O R * OH O R1 * P h 3P + IV
N OH N OH
O OH OH
N
N OMe N OH 8 5 % y ie ld , 7 9 % e e 20
N OH OMe 5 % y ie ld , 2 4 % e e 21
N
OH OH
N OH N OH
O OH OH
N
22 2 2 -2 4 , n o re a c tio n
23
24
Wei wang * Org. Lett. 2005, 7, 4293-4296
S N H N N H CF3 CF3
O + Ar
O H
2 5 , 1 0 m o l%
o
O
OH Ar
C H 3C N , 0
C 6 0 -9 4 % e e 5 5 -8 4 % y ie ld
不对称催化氢化反应

因此硼杂恶唑烷催化剂的作用与酶相似, 有人称这类催化剂为化学酶(chemzyme)。也就 是说,硼杂恶唑烷分子虽然小,但其作用和酶 类似,具有高效和高选择性的特点。
硼杂恶唑烷催化的对映选择性还原在有机合成和药物 合成中的用途举例说明如下:
在前列腺素的合成中,酮内酯化合物 a是合成关键中间体。化合物a在CBS-b 催化下被还原生成(15R)-b,R/S非对 映异构体的比例为91:1,为前列腺素合 成中C-15立体化学控制,提供了一个实 用的方法。
硼烷衍生物 — 硼杂恶唑烷(又称为 CBS 反应试剂, A ),在羰基化合物的 不对称还原中是极为成功的,获得了高 对映选择性的结果。硼杂恶唑烷催化的 对映选择性还原在有机合成中的应用, 可以通过下列实验加以说明。
硼杂恶唑烷(例如:化合物A)与欲被原的酮 和还原剂硼烷结合,将两者拉拢以便反应,在 反应完成后除释放出产物外,硼杂恶唑烷又可 以循环前述的功能。
例如,(S)-奈普生的不对称合成。
再如: Mibefradil 1 是一种新型钙 拮抗剂,用于治疗高血压和心绞痛。为 了引入手性中心合成该化合物的关键中 间体是(S)-2,它可以通过不饱和酸3 的不对称氢化反应一步合成:
具有C2对称性的手性半咕啉 (semicorrins,A)和钴的配合物, 在NaBH4的存在下,是催化α,β-不 饱和羧酸酯和α,β-不饱和酰胺氢化 的有效的对映选择性催化剂。例如:
1、 α-乙酰胺基丙烯酸及其衍生物的不 对称氢化反应:
α- 乙酰胺基丙烯酸 及其衍生物是最早 进行不对称催化氢 化反应并获得成功 R 的烯烃底物。 化学结构见右图:
COOR1
NHAc
不对称有机催化反应文献综述

亲核催化反应 – Nucleophilic Catalysts N Nucleophilic Cat.
P Nucleophilic Cat.
C Nucleophilic Cat.
Others
7
亲核催化反应 – Morita-Baylis-Hillman Reaction
The Morita−Baylis−Hillman reaction is the reaction of electron-deficient alkenes with aldehydes, catalyzed by nucleophilic amines or phosphines.
entry 1 2 3 4 5 6 7 8 9 10 1 2a 2b 2c 2d 2e 2f 3 4 catalyst % yieldb 5 74 73 73 69 9 70 84 43 15 32 48 79 86 31 88 86 3 3 % eec
11
Schaus, S. E. JACS, 03, 125, 12094
Activation of the electrophile
亲核催化反应 – Morita-Baylis-Hillman Reaction (Thiourea)
From enone substrate to simple acrylate derivatives Jacobsen, E. N. ASC 2005, 347, 1701.
12
亲核催化反应 – Morita-Baylis-Hillman Reaction (Proline)
Substrate: MVK+arylaldehydes
Shi 2002
Time 24h,yield 90%,ee (5–10%) Miller 2004 up to 81% ee
不对称硼氢化

不对称硼氢化
不对称硼氢化是一种有机合成中的还原反应,用于将酮、醛等羰基化合物还原成醇。
该反应使用硼烷(如硼氢化钠)作为还原剂,并加入手性配体以实现不对称还原。
在不对称硼氢化反应中,手性配体起着关键作用。
手性配体与硼烷结合,形成具有特定立体构型的硼烷络合物。
这个络合物与羰基化合物发生加成反应,将羰基还原成醇。
由于手性配体的存在,反应只生成一种立体构型的醇,实现了不对称还原。
不对称硼氢化反应在有机合成中具有广泛应用,可以用于合成许多具有光学活性的有机化合物。
通过选择不同的手性配体和硼烷,可以实现对不同类型羰基化合物的选择性还原,为合成复杂有机分子提供了有效手段。
需要注意的是,不对称硼氢化反应的立体选择性受到多种因素的影响,如手性配体的结构、硼烷的种类和浓度、反应温度和时间等。
因此,在实际应用中,需要仔细选择合适的反应条件和手性配体,以确保获得高立体选择性的产物。
绿色化学中的不对称有机催化反应

第 22 卷 第 4 期
刘华晖等:绿色化学中的不对称有机催化反应
43
2.1 2.1.1
亲核试剂对 C
O 双键的加成
醛醇缩合反应 不对称醛醇缩合反应是现代催化合成上最重要的课题之一,产物 β − 羟基羰基化合物有比较广
的应用并在药物生产中起重要作用 [5] . 有机催化的不对称醛醇缩合反应分为间接醛醇缩合反应和直 接醛醇缩合反应,前者是需要修饰的酮的合成,直接使用酮没有活化的形式作为亲核试剂的合成定 义为直接醛醇缩合反应 . List 和 Barbas 通过底物范围的实验研究 打开了 L - 脯氨酸( L - proline )催化直接醛醇 缩合反应的合成应用希望之门
42
五邑大学学报(自然科学版)
2008 年
预期产物的分子量 × 100% . 反应物质的原子量总和 高效的有机合成应最大限度地利用原料分子的每一个原子,使之结合到目标分子中,达到零排 原子利用率 =
放 . 绿色有机合成应该是原子经济性的 . 原子利用率越高,反应产生的废弃物越少,对环境造成的 污染越小 . 1992 年 Sheldon 提出了 E - 因子的概念 [2] , 即 用生产每千克产品所产生的废弃物的量来衡量 化工流程的排放量 . 如表 1 所示,化工产品越精 细复杂,则 E 值越大,这往往是因为化学计量的 试剂的大量使用或多步的分离过程造成的 . 100% 的原子转化为产物, 不需要附加其它试 剂,或只需要添加无损耗的催化剂,从而实现零 排放,这是理想的绿色化学反应 . 要用单一反应 来实现原子经济性十分困难,甚至不可能 . 但可以充分利用相关化学反应的集成,即把每一个反应 排放的废物作为另一个反应的原料,从而通过“封闭循环” ,实现零排放 . 1.2 手性与不对称合成技术 手性指两个具有面对称关系的物体的非重叠性,它广泛存在于分子和晶体中 [3] ,是自然界的本 质属性之一 . 在有机化学工业中,大部分要合成的目标产物均是具有手性的,若我们只需要其中一 种构型的产品,则面临着分离上的极大困难,因为这些物质的物理性质相同,化学性质相似,仅生 物性质可能存在一定的区别 . 而对仅含一个手性中心的产品,若只有其中一半的对映体有用即意味 着最高的原子利用率为 50% ,是相当不合算的,用 E - 因子评价法也能得出一致的结论 . 获得手性化 合物的途径有天然手性化合物的提取与半合成、外消旋体的拆分和不对称合成等 . 简单地说,不对称合成就是采取某些方法,使反应生成的两个对映体中一个过量,甚至全部为 单一的对映体,从而避免和减少拆分过程 . 某单一对映体的过量情况,可以用 ee 即对映体过量率来 衡量, ee 值越高,则不对称合成的效率越高 . 从绿色化学的角度出发,高效的不对称合成有利于节 约资源,提高原子利用率 . 因此,不对称合成是手性技术发展的主流方向 . 不对称合成中催化不对称合成是最有效的方法,它是有机合成化学研究的热点和前沿 . 通过不 对称催化不但可以提供医药、农药、精细化工所需的关键中间体,而且可以提供环境友好的绿色合 成方法 . 催化不对称合成反应主要包括催化不对称氢化反应、氢硅烷化反应、氢甲酰化反应、氢酯 化反应、环丙烷化反应、环氧化反应、不对称酮还原反应、糖类衍生物催化反应和酶催化反应等 .
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
yield: 11-25%; ee: 4-85%
O
H
HO
N
H
N
HO
N
OMe
N
16,35%ee
O H
N
N Ts
O
+
Ar H
N
OH
15 (10 mol%)
TsHN O Ar
N Ts +
Ar H
O
15 (10 mol%)
R
74-99%ee TsHN O
Ar
R=H,OMe,OPh
67-89%ee
N P(O)Ph2 +
OH N
14 OMe 17-45%ee
Hatakeyama, S. * J. Am. Chem. Soc. 1999, 121, 10219-10220
HO N
RCO CF3 15 (10 mol%) OH O CF3
+ OO
O CF3 DMF, -55 oC R
O CF3 R
O
yield: 31-58%; ee: 91-99%
CF3
CF3
O OH Ar
60-94%ee 55-84%yield
S
CF3
NN HH
N
CF3
25 83%yield, 71%ee
S
CF3
NN HH
N
CF3
27 56%yield, 73%ee
CF3 S
NN NHH
CF3
26 21%yield, 39%ee
S
NN
Cl
HH
N
28 18%yield, ee ND
CHO
N OH
15 CH2Cl2, -20 oC
CHO HO R
O
R1
N R2 R3
70-96%yield 90-99%ee
Yixin Lu * Org. Lett. 2011, 13, 82-85
O H
N
N
O
OH COOBn
R1
O+ N R2
HO N
HO N
HO N
N
O
N
N
H NBoc
OH
N
S
CF3
N H
N H
37 Bn -30oC, 86%ee
15 -30oC, 77%ee
39 Rt,30%ee
CF3
Jian Zhou * J. Am. Chem. Soc. 2010, 132, 15176-15178
O R
O+
R1
N R2 R3
HO N
CF3
CF3
S
NN NHH
CF3
30
80%ee
S NN NHH 31
61%ee
OMe N
H
N HN
N
H S
31
65%ee
CF3
CF3 N
N H N HN H
S 33
80%ee
CF3 CF3
Jieping Zhu * J. Am. Chem. Soc. 2008, 130, 12596-12597
O NS
OH N OH
N
N
OH
OMe
5%yield, 24%ee 21
OH N OH
O OH N
OH
22
23
24
22-24, no reaction
Wei wang * Org. Lett. 2005, 7, 4293-4296
O O
+ Ar H
S NN HH N
25, 10 mol%
CH3CN, 0 oC
OH O R1 * Ph3P+
IV
Ph3P+
OII
R1CHO
O- O
R1
Ph3P+ III
主要内容
手性底物控制不对称反应 手性烯 手性亲电试剂
催化不对称反应 单手性催化剂 共催化
手性活化烯
CO2R+* RCHO DABCO
OH R * CO2R*
DABCO
=
N N
yield: 15-95%, de: 2-100%
Ar H
O CF3 O CF3
15 (10 mol%)
TsHN O Ar
R=H,OMe,OPh
67-72%ee
Sasai, H. * J. Am. Chem. Soc. 2005, 127, 3680-3681
O R1
NTs
+
H R2
N OH OH
16(10 mol%)
N
O R1
NHTs R2
yield: 88-96% ee: 87-95%
R* =
SO2NPri2
7-100%de 15-42%de
Ph
SO2N(cyc-C6H11)2
25-70%de
2-70%de
O O
2-48%de
O
N S OO
RCHO DABCO
O O ROR
NEt3 MeOH
MeO2C
*R
OH
yield: 33-98%, ee: >99%
手性亲电试剂
OR1 R CHO
Peng-Fei Xu * Org. Lett. 2009, 11, 3310-3313
NO2
Ts
+
Ph
R
CF3 S
NN NHH
26
CF3 Ph
NO2 R
NHTs
71-91%ee 82-95%yield
NO2
Ts
+
Ph
R
X
NO2
Ph
R
NHTs
CF3 S
NN NHH
CF3
26
86%ee
S NN NHH 29 68%ee
手性叔胺催化剂
O
9, 10, 11
OH O Ar
O2N
N
N
OR
OR
9
HH
N HO 10
11-47%ee
21-72%ee
N N Me
11 44-75%ee
HH
N TBDMSO
12 rate ~26%ee
OH
N
Me
N
13
15-78%ee protic solvent, CH2Cl2, no reaction
PMP O+
O O
RH
HO N
O N
N H NHBoc
PMP
O S
34 (10 mol%)
O NH O
R
O
84-97%ee
O H
N
O H
N
HO N
N 34
O
N
N
H NHBoc
35
ON N H NHTf 36
O
N H HN
H N
O
CF3 CF3
Rt,76%ee
Rt,69%ee
Rt,55%ee
-30oC, 91%ee
Asymmetric Morita-Baylis-Hillman reaction
X
+
R R1
EWG R3
X
R
EWG
R3
X = O, NR2 R 3= H or other substituted group EWG = electron withdrawing group
反应历程
O PPh3
I OH O R1 *
1
O H
N Trt
2
N CHO
p-NO2C6H4 O de: 50% 3
CHO ON
de: 72% 4
PhO O
O N
nR
de > 97%
MeO
NTs
H OMe Cr(CO)3
de > 95%
5
6
O OMeH Cr(CO)3
de > 95% 7
O
O
O
O NR
单一构型的产物 8
催化不对称反应
ArCHO +
N OH N OH
17
N
N
OH
OH
18
N OH OH
19 17-19, ineffective
OH
N
+
OH
N
3%ee
N OMe N OH 85%yield, 79%ee
OH N OH
N
N
OH
OMe
5%yield, 24%ee
OH N OH
O OH N
OH
N OMe N OH
85%yield, 79%ee 20
