原子物理学第五章
合集下载
原子物理学第5章

自旋角动量 pJ 旋进;
两个轨道角动量合成一个总轨道角动量,pl 1 , pl 2 绕
着总的轨道角动量 p L 旋进;
最后, pL与pS 合成总角动量 p J , pL与pS 绕 p J 旋进; 由于最后是 pL与pS 合成 p J ,所以叫L-S耦合。
2.氦的基态 11 S0 与第一激发态 23S1 能量差别很大(相对 氢),有19.77eV;电离能(电离1个电子)达24.58eV。 3.亚稳态:如23S1,21S0都是亚稳态,跃迁选择定则限
制了这些态自发辐射衰变到更低的能态即基态 11S0。
4.主线系:He的单线主线系是诸1P1态到11S0的跃迁,在远 紫外;三线主线系是诸3P2,1,0→23S1的跃迁,红外→紫外
二、一种电子组态构成原子态
同种电子组态,由于电子间的相互作用的不同, 可以形成不同的原子态。
两个电子(n1l1, n2l2) 四种运动(s1, l1, s2, l2) 六种作用 G (s , l )、G (s , l )、G (l , s ) 4 2 2 5 1 2 6 1 2 两种极端(LS, j j耦合)
耦合法则:
(1 )
P S ps1 ps 2
s1 1 / 2 S s1 s2 0,1
p s1 s1 ( s1 1), PS S ( S 1),
ps 2 s2 ( s2 1), s2 1 / 2
PS 0, 2
(2 )
PL p1 p 2
四、L-S耦合 适用条件:
两个电子自旋之间的相互作用和两 个电子的轨道之间的相互作用,比每个 电子自身的旋--轨相互作用强。即: G1(s1 s2), G2(1 2) >> G3(s1 1), G4(s2 2)
两个轨道角动量合成一个总轨道角动量,pl 1 , pl 2 绕
着总的轨道角动量 p L 旋进;
最后, pL与pS 合成总角动量 p J , pL与pS 绕 p J 旋进; 由于最后是 pL与pS 合成 p J ,所以叫L-S耦合。
2.氦的基态 11 S0 与第一激发态 23S1 能量差别很大(相对 氢),有19.77eV;电离能(电离1个电子)达24.58eV。 3.亚稳态:如23S1,21S0都是亚稳态,跃迁选择定则限
制了这些态自发辐射衰变到更低的能态即基态 11S0。
4.主线系:He的单线主线系是诸1P1态到11S0的跃迁,在远 紫外;三线主线系是诸3P2,1,0→23S1的跃迁,红外→紫外
二、一种电子组态构成原子态
同种电子组态,由于电子间的相互作用的不同, 可以形成不同的原子态。
两个电子(n1l1, n2l2) 四种运动(s1, l1, s2, l2) 六种作用 G (s , l )、G (s , l )、G (l , s ) 4 2 2 5 1 2 6 1 2 两种极端(LS, j j耦合)
耦合法则:
(1 )
P S ps1 ps 2
s1 1 / 2 S s1 s2 0,1
p s1 s1 ( s1 1), PS S ( S 1),
ps 2 s2 ( s2 1), s2 1 / 2
PS 0, 2
(2 )
PL p1 p 2
四、L-S耦合 适用条件:
两个电子自旋之间的相互作用和两 个电子的轨道之间的相互作用,比每个 电子自身的旋--轨相互作用强。即: G1(s1 s2), G2(1 2) >> G3(s1 1), G4(s2 2)
原子物理学(第五章)

2、镁的光谱和能级
在镁的光谱中,单一态和三重态之间一般没有跃迁,但 也有个例外,就是从第一激发态中的3P1到基态1S0, λ=4571.15埃那条线。关于这问题,以后再讨论。镁的单线 主线系在紫外,它的三重态主线系在红外和可见区。三重态 的第一、第二辅线系和主线系的谱线都显出三个成分,反映 3P 3 3 2,1,0的三个能级。 D和 F的间隔较小,在光谱中不能分辨 出来。我们注意镁的3P间隔较氦的大,因为这是同Z有关的。 又这里三能级中3P0最低,同氦中的情况相反 。
原子物理学
第五章
多电子原子
前面讨论了单电子原子和具有一个价电子的原子的 光谱,从而推得这些原子的能级的情况,并说明了怎样 出现双层结构。从那些讨论,我们对最简单原子的内部 状况有了一个扼要的了解。这些知识也是进一步研究较 复杂原子结构的基础。 本章将讨论具有两个价电子的原子,并对三个及三 个以上价电子的原子作概括性的论述。
的。从波长的数值可以知道3P0能级高于3P1,后者又高于3P2。
从光谱的情况,知道三重态与单一态之间没有跃迁。有一 条很弱的λ =591.6埃线起初以为是氦的三重态和单一态之 间的跃迁,后来有人认为这是氖的谱线。
9
原子物理学
第五章
多电子原子
5.1 氦及周期系第二族元素的光谱和能级 1、氦的光谱和能级 第一激发态3S1不可能自发跃迁到基态1S0,这是由于三 重态不能跃迁到单一态,而且S态不能跃迁到S态。如果氦
别,一套谱线都是单线,另一套谱线却有复杂的结构。氦
具有两套能级,一套是单层的,另一套是三层的。这两套 能级之间没有相互跃迁的情况,它们各自内部的跃迁就产
生了两套光谱。这样,单层能级间的跃迁当然产生单线的
光谱,而三层能级间的跃迁所产生的光谱线当然有复杂的 结构了。
原子物理第五章

南京航空航天大学
原子物理
磁场中的原子
§6.1、原子的磁矩 电子轨道运动的磁矩
z
iS n
i
e e l l gl l 2me 2me
南京航空航天大学
其中:gl=1 为轨道磁矩 g 因子。
原子物理
磁矩大小:
e l gl l 2me
e gl l (l 1) l (l 1) B 2me
二、单电子原子的总磁矩
总磁矩
南京航空航天大学
原子物理
与j并不正好反向
南京航空航天大学
原子物理
j
l
→
→
s
s
l
s
j
l
南京航空航天大学
原子物理
写成:
e j g j j 2m
南京航空航天大学
原子物理
磁矩大小:
j g j j ( j 1) B
K K
LI LII LIII
2S 1/2
K2
K1
2S 1/2 2P 1/2
2P 3/2
原子的x射线发射谱是线状谱,其频率由原子结构的特 点所决定,所以又叫原子的标识谱。
南京航空航天大学
原子物理
n=5 n=4 n=3 n=2 低能级失去一个电子,高能 级的电子跃迁到低能级放出 电磁波形成了X射线。 n=1
玻尔磁子
he 23 2 B 0.92740 10 A m 4 m
e z z ml B 2m
磁矩空间取向量子化
南京航空航天大学
原子物理
原子物理学5

同一电子组态在j-j耦合中和L-S耦合中形成的原子 态的数目相同,代表原子态的J值也是相同的。
例题:
若某原子的两个价电子处于2s2p组态,利用j-j耦合, 求可得到其原子态的个数。
同一电子组态在j-j耦合中和L-S耦合中形成的原 子态对应的能级间隔不同。
1P 1
( 1 3 , )1 2 2 1 3 , )2 2 2
1P 1 1S 0
三重态 2s3p 2s3s
3P 2 3P 1 3P 0 3S 1
2s2p 2s2s 1 2 3 4
1P 1 1S 0
2s2p 1 3
3P 2 3P 1 3P 0
2s2s在三层结构中没有对应的能级
例题2: 铍(Be)原子共有四个电子,已知其中三个始终处于 基态。 (1)写出铍原子的三个最低能量的电子组态; (2)用L-S耦合模型画出这三个最低能量电子组 态的全部能级; (3)画出上述能级间全部可能发生的跃迁。
1P , 3P 1 2,1,0
Pb:6p7s (j-j)
1 1 3 1 , , , 2 2 1 , 0 2 2 2 ,1
碳族元素在激发态ps的能级比较 C Si Ge Sn Pb
3 1 ( , )1 2 2 3 1 ( , )2 2 2
1P 3P
1 2
3P
3P
倒序排列:
3P > 3P > 3P 0 1 2
能级的形成:
基态:两个电子都处于最低的1s 态 激发态:所有能级都是由一个电子处于基态,另 一个电子被激发到较高能态形成的。 能级图上注明的数码就是第二个电子的主量子 数 试计算一下如果两个电子都处于激发态至少 需要多少能量?
单层结构 n
7.62eV
原子物理学 褚圣麟 第五章

首页
上一页
下一页
1)两个角动量耦合的一般法则:
设有两个角动量 k ,且 K1 1, k2
则 K K1 K 2的大小为
k1 (k1 1) K 2 k2 (k2 1)
K k (k 1)
且这里的 k1, k2 是任意两个角动量。K=k1+k2,
首页
上一页
下一页
这个价电子在原子中所处的状态,n,l,j, m 决定了碱 2 s 1 金属的原子态 n L j,而价电子在不同能级间的跃 迁,便形成了碱金属原子的光谱。
可见,价电子在碱金属原子中起了十分重 要的作用, 它演了一场独角戏 多电子原子是指最外层有不止一个价电子, 换 句话说,舞台上不是一个演员唱独角戏,而是许多 演员共演一台戏, 那么这时情形如何, 原子的能级 和光谱是什么样的呢? 这正是本章所要研究的问题。
l l1 l2 , l1 l2 1, l1 l2 j l s, l s 1, l s
首页
上一页
下一页
4.洪特定则 1)由同一电子组态得到的各种能级中,多重数 大的,亦即S值最大的,能级位置低; 2)由同一组态形成的同一 s内, 具有不同L 的能级中,L 大的能级位置低; 值
s2
与
l2 合成
j2 ,
J
最后 j1 与 j2 合成
称其为 J J 耦合。
首页
上一页
下一页
道耦合作用较强,不同电子之间的耦合作用比 较弱,J J 耦合可以记为:
(s1l1 )(s2l2 )(s3l ) ( j1 j2 j3 ) J
首页
上一页
首页 上一页 下一页
原子物理学第五章
量子力学已经证明:对两个同科电子而言,只 有(L+S)为偶数的原子态才能存在。
同科电子np2的原子态 ∵ ∴ s1=s2=1/2, l1=l2=1 S=1、0, L=2、1、0
则原子态为1D2、3P2,1,0、1S0
npn’p电子组态的原子态 ∵ s1=s2=1/2, l1=l2=1
∴ S=1、0, L=2、1、0 则原子态为3D3,2,1、3P2,1,0、3S1、1D2、1P1、1S0
原子态符号:2S+1LJ,对于总角动量、量子数用大 写L、S、J表示 4p4d 电子组态 ∵ ∵ s1=s2=1/2 l1=1、l2=2 ∴ S=1、0 ∴ L=3、2、1
1P 、1D 1 2
当S=0时,J=L=3、2、1 当S=1、L=1时,J=2、1、0 当S=1、L=2时,J=3、2、1 当S=1、L=3时,J=4、3、2
总轨道角动量L
| L1 | l1 (l1 1) | L | L L1 L2 | L2 | l2 (l2 1) L( L 1)
L l1 l2 , l1 l2 1,......, | l1 l2 |
∴ 总轨道角动量L=l1+l2、l1+l2-1、l1+l2-2、... 、|l1-l2|
同科电子组态能级的简并度
如果有v个同科电子
Y! C v!(Y v)!
v Y
其中Y与电子的l值有关,Y=2(2l+1) 如np2能级的简并度: 2个同科电子,p→l=1,则Y=2(2+1)=6
6! C C 15 2!(6 2)!
v Y 2 6
即共有15个量子态
例:求nf2的能级Байду номын сангаас并度、原子组态和基态原子态?
原子物理学课件--第五章

• 为什么电子组态一定,有两套能级?
–两个电子,给定电子组态 合成的原子态分为两类: 一类为三重态,自旋平行(S=1) 一类为单一态,自旋反平行(S=0)
5.2.5.由电子组态到原子态(5)
• L-S 偶合与 j-j 偶合
– L-S偶合一般适用于较轻的原子和低激发态; – j-j偶合一般适用于较重的原子和高激发态
两种耦合得到的J值相同
两种耦合得到的原子态数相同
5.2.5.由电子组态到原子态(3)
• 例三: L-S 耦合pd 组态
l1 1, l2 2;
s1 s2 1/ 2
J 4,3, 2 3 F4 , 3 F3 , 3 F2 1 J 3 F3 J 3, 2,1 3 D , 3 D , 3 D 3 2 1 1 D2 J 2 J 2,1, 0 3 P , 3 P , 3 P 2 1 0 1 P 1 J 1
ml1 1, 0, 1 ml2 1, 0, 1
ml ml1 ml2
l l1 l2 , l1 l2 1,L ,| l1 l2 |
l1 = 1, l2 = 1 l = 2, 1, 0
5.2.4.选择规则(1)
• L-S 耦合选择规则
S = 0 L = 1 J = 0 , 1 ( 0 0 的跃迁除外)
5.1.3.理解能级图(2)
• 电子组态一定,有两套能级:
–单一态(S = 0),三重态(S = 1) –三重态能级小于单一态能级
• 选择定则: S 0
–单重态和三重态之间无跃迁; –套内跃迁两套线系: 仲氦(单一态), 正氦 (三 重态)
5.1.3.理解能级图(3)
• 三重态中,无 (1s)2 13S1 态 • 存在亚稳态
原子物理学第五章多电子原子
原子序数增加
能级双 分配(2)
j - j 耦合
Em Ee
轻元素,低激发态 重元素,基态
能级差主要是由 于静电作用
原子态: 2S+1LJ
重元素,高激发态
能级差主要是由 于磁效应
原子态: ( j1 j2 )J
第三节:泡利原理
泡利原理
我们知道,电子在原子核外是在不同轨道上 按一定规律排布的,从而形成了元素周期表。中 学阶段我们就知道,某一轨道上能够容纳的最多 电子数为2n2,为什么这样呢?
碳族元素在激发态时,PS电子各能级比较:
C Si Ge Sn Pb
2 p3s
3 p4s
4 p5s
5 p6s
6 p7s
31 ( 2 , 2)1
1 P1 3 P2 LS 耦合 3 P1 3 P0
(
3 2
,
1 2
)
2
j - j 耦合
(
1 2
,
1 2
)1
11
(2 , 2)0
能级单 分配(3)
LS 耦合
Ee Em
Mg 原子光谱和能级结构与He原子相似,也有差异。
5.2 具有两个价电子的原子态
一.电子组态 1.电子组态的表示
处于一定状态的若干个(价)电子的组合 n1 1n2 2n3 3.... Na : 基态电子组态: 1s2 2s22p63s1 简记:3s1
激发态电子组态: 1s2 2s22p63p1 1s2 2s2 2p6 4s1
根据原子的矢量模型 Ps1 , Ps2合成 Ps,Pl1 Pl2合成PL ; 最后Pl与Ps 合成 J,所以称其为 L S耦合。 L S 耦合通常记为:
(s1s2 )(l1l2 ) (PS , PL ) PJ
原子物理学5

同一电子组态在j-j耦合中和L-S耦合中形成的原子 态的数目相同,代表原子态的J值也是相同的。
例题:
若某原子的两个价电子处于2s2p组态,利用j-j耦合, 求可得到其原子态的个数。
同一电子组态在j-j耦合中和L-S耦合中形成的原 子态对应的能级间隔不同。
1P 1
3 1 ( , )1 2 2 3 1 ( , )2 2 2
5
5 4
4 3
4
3 2
4 3
4
3
4
3
2 2
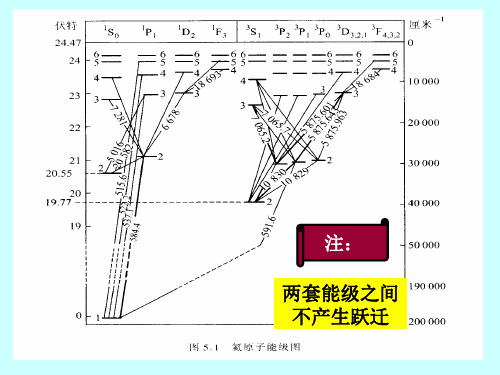
19.77eV
2
主线系 第二辅线系 第一辅线系 柏格曼线系
E 1
He原子能级图
He原子能级结构
两套结构: 单层:S=0,重数为1; 两套能级间不发生跃迁 三层:S=1,重数为3;
两个亚稳态:
21S0 和23S1
电离能和第一激发电势很大 在三层结构中没有(1s)对应的能级(?) 三重态能级低于相应的单一态能级
倒序排列:
3P > 3P > 3P 0 1 2
能级的形成:
基态:两个电子都处于最低的1s态 激发态:所有能级都是由一个电子处于1s态,另一 个电子被激发到较高能态形成的。
试计算一下如果两个电子都处于激发态至少 需要多少能量?
单层结构 n
7.62eV
1S 1P 0 1 1D 2 1F 3 3S 1 3P 2
不同的电子组态具有不同的能量 H: 2s↔2p; 能级间隔小 2s ↔1s 能级间隔大 He: 1s1s ↔1s2s 能级间隔大 Mg: 3s3s ↔3s3p 能级间隔小 原子态 每一种电子组态都对应相应的原子态 H: 基态1s ↔ 2S1/2,激发态3p ↔ 32P1/2, 32P3/2 多电子原子的原子态是怎样的呢?
原子物理学课件_5第五章

7
3、氦的基态11S0与第一激发态23S1之间的能量差相对 于H原子而言要大的多,氦电离能(He+)为24.6eV,是 所有元素中最大的。 4、三层结构能级中没有来自两个电子都处在1s态的 能级。 除此之外,在氦能谱中, 除基态中两个电子都处在 最低的1s态外,其它能级 都是一个电子处在1s态,另 一个电子被激发到2s, 2p, 3s等态形成的,见右图:
把上述情况推广到更多的电子系统:
L-S耦合: ( s1 s 2 )( l 1 l 2 ) ( S , L ) J (25-1)
j-j耦合: ( s1 l1 )( s 2 l 2 )( s 3 l 3 ) ( j1 j 2 j 3 ) J (25-2)
20
例2 pp组态,按L-S 耦合:
s1 s2 1 / 2; l1 l2 1
所以S=0, 1; L=2, 1, 0; L, S 合成 J: S=0, L=0 时,J=0; S=0, L=1 时,J=1; S=0, L=2 时,J=2; S=1, L=2 时,J=3,2,1; S=1, L=1 时, J=2,1,0; S=1, L=0 时,J=1;从而得到的十个原子态分 别为:
12
通过给定的电子组态我们可以确定它的原子态。
在碱金属原子中只有一个价电子,我们曾讨论过这个价电 子的 与 l 合成总角 s与 s l 的相互作用,在那里我们看到 动量 j , j s l ;求得了 j 的可能值,就得到了原子 态的可能形式2Lj 以及能量的可能值Enlj;
21
把L-S耦合得出的原子态与相应的能级图对照,我们又发 现了一个新的问题: 根据L-S耦合,我们可以得出ss组态的原子态为:
3、氦的基态11S0与第一激发态23S1之间的能量差相对 于H原子而言要大的多,氦电离能(He+)为24.6eV,是 所有元素中最大的。 4、三层结构能级中没有来自两个电子都处在1s态的 能级。 除此之外,在氦能谱中, 除基态中两个电子都处在 最低的1s态外,其它能级 都是一个电子处在1s态,另 一个电子被激发到2s, 2p, 3s等态形成的,见右图:
把上述情况推广到更多的电子系统:
L-S耦合: ( s1 s 2 )( l 1 l 2 ) ( S , L ) J (25-1)
j-j耦合: ( s1 l1 )( s 2 l 2 )( s 3 l 3 ) ( j1 j 2 j 3 ) J (25-2)
20
例2 pp组态,按L-S 耦合:
s1 s2 1 / 2; l1 l2 1
所以S=0, 1; L=2, 1, 0; L, S 合成 J: S=0, L=0 时,J=0; S=0, L=1 时,J=1; S=0, L=2 时,J=2; S=1, L=2 时,J=3,2,1; S=1, L=1 时, J=2,1,0; S=1, L=0 时,J=1;从而得到的十个原子态分 别为:
12
通过给定的电子组态我们可以确定它的原子态。
在碱金属原子中只有一个价电子,我们曾讨论过这个价电 子的 与 l 合成总角 s与 s l 的相互作用,在那里我们看到 动量 j , j s l ;求得了 j 的可能值,就得到了原子 态的可能形式2Lj 以及能量的可能值Enlj;
21
把L-S耦合得出的原子态与相应的能级图对照,我们又发 现了一个新的问题: 根据L-S耦合,我们可以得出ss组态的原子态为:
原子物理学_第五章-final
D3 1,2,3
F3 2,3,4
j-j耦合
一个电子的轨道运动和另
G6 (l2s1) 一个电子自旋的相互作用
两个电子自 旋相互作用
G1 (s1s2)
G5 (l1s2)
较弱,可 以忽略
相互作用
两个电子轨 道相互作用
G2 (l1l2)
G4 (l2s2)
G3 (l1s1)
一个电子的轨道运动和它 自己的自旋的相互作用
j-j耦合
j-j耦合 (1)一个电子的自旋角动量和轨道角动量的耦合
j1 s1 l1
| s1 |
s1(s1 1) ,
s1
1 2
| l1 | l1(l1 1) , l1 0,1, (n 1)
| j1 |
j1( j1 1) ,
j1
l1
s1
l1
1 2
j-j耦合 (2)另一个电子的自旋角动量和轨道角动量的耦合
在1868年的一次日食观测时,法国天文学家皮埃尔·詹逊首次在太 阳的光谱中位于钠的谱线附近发现了这种发出黄色谱线的物质。
1895年,美国地质学家希尔布兰德观察到钇铀矿放在硫酸中加热 会产生一种不能自燃、也不能助燃的气体。他认为这种气体可能是氮 气或氩气,但没有继续研究。
拉姆赛(W.Ramsay)得知后,重复了实验,从钇铀矿中分离出 了氦,又请英国光谱专家克鲁克斯帮助检验,首次证明了在地球上也 存在这种元素。1895年3月,拉姆赛在《化学新闻》上首先发表了 在地球上发现氦的简报,同年在英国化学年会上正式宣布这一发现。
,
l1 1
p态电子:s2
1 2
,
l2 1
S= 0
1
L=0 1S0 1 1P1
2
1D2
F3 2,3,4
j-j耦合
一个电子的轨道运动和另
G6 (l2s1) 一个电子自旋的相互作用
两个电子自 旋相互作用
G1 (s1s2)
G5 (l1s2)
较弱,可 以忽略
相互作用
两个电子轨 道相互作用
G2 (l1l2)
G4 (l2s2)
G3 (l1s1)
一个电子的轨道运动和它 自己的自旋的相互作用
j-j耦合
j-j耦合 (1)一个电子的自旋角动量和轨道角动量的耦合
j1 s1 l1
| s1 |
s1(s1 1) ,
s1
1 2
| l1 | l1(l1 1) , l1 0,1, (n 1)
| j1 |
j1( j1 1) ,
j1
l1
s1
l1
1 2
j-j耦合 (2)另一个电子的自旋角动量和轨道角动量的耦合
在1868年的一次日食观测时,法国天文学家皮埃尔·詹逊首次在太 阳的光谱中位于钠的谱线附近发现了这种发出黄色谱线的物质。
1895年,美国地质学家希尔布兰德观察到钇铀矿放在硫酸中加热 会产生一种不能自燃、也不能助燃的气体。他认为这种气体可能是氮 气或氩气,但没有继续研究。
拉姆赛(W.Ramsay)得知后,重复了实验,从钇铀矿中分离出 了氦,又请英国光谱专家克鲁克斯帮助检验,首次证明了在地球上也 存在这种元素。1895年3月,拉姆赛在《化学新闻》上首先发表了 在地球上发现氦的简报,同年在英国化学年会上正式宣布这一发现。
,
l1 1
p态电子:s2
1 2
,
l2 1
S= 0
1
L=0 1S0 1 1P1
2
1D2
原子物理学教学课件5

§5.2
角动量耦合和对He光谱的解释
J L1 L2 S1 S 2
一、电子组态:原子中电子可以处的状态 如1s,1s1s(1s2) 二、一种电子组态构成不同原子态
两个电子的四种运动之间有六种相互作用: G1 ( s1 , s2 ) G2 (l1, l2 ) G3 (l1 , s1 )
J1 j1 ( j1 1)
J2
j2 ( j2 1)
J
j ( j 1)
j j1 j2 , j1 j2 1
j1 j2
例4:利用j-j耦合,求3p4d态的原子态。 1 1 3 l 1 , j s 解: 1 1 1 2 2 2 1 3 5 l2 2 s 2 , j 2 2 2 2 仍有12个态,且
1
j (0,2) 21D2
L=1 2 3
S=0 (1P1) 1D 2 (3F3)
S=1 3P 2,1,0 (3D3,2,1) 3F 4,3,2
2、j-j耦合
G4 (l2 , s2 ) 时, G2 (l1, l2 ) << G3 (l1 , s1 ) 、 当G 1(s1, s2 ) 、 J1 L1 S1 J 2 L2 S 2 J J1 J 2
若核(实)外有两个电子,由两个价电子跃迁而形 成的光谱如何?能级如何?原子态如何? He:Z=2 Be:Z=4=212+2 Mg:Z=12=2(12+22)+2 Ca:Z=20=2(12+22+22)+2 Sr:Z=38=2(12+22+32+22)+2 Ba:Z=56=2(12+22+32+32+22)+2 Ra:Z=88=2(12+22+32+42+32+22)+2 氦原子核外的两个电子处于什么状态?这些状态 有什么性质?
原子物理学第五章

线性组合
ˆ P 12
χ S = 1 [σ + (1)σ − (2) + σ − (1)σ + (2)]
2
+ −
M s = m s1 + m s 2
M S = +1 MS = 0 M S = −1
MS =0
χ A = 1 [σ + (1)σ − (2) − σ − (1)σ + (2)]
2
两电子体系的总自旋波函数:
i =1,2
ˆ ′= H
e2 4πε0r12
薛定谔方程
ˆ u (0) (r , r ) = E (0) u (0) (r , r ) H
0 1 2 1 2
§5.2 泡利不相容原理和交换效应—交换效应
ˆ u (0) (r , r ) = E (0) u (0) (r , r ) H
0 1 2 1 2
§5.2 泡利不相容原理和交换效应—波函数的交换对称性
全同性粒子的交换对称性
任一全同粒子体系的波函数都具有这种交换对 称性,并且不是对称的,就是反对称的。
玻色子 (自旋为0或整数的粒子)
费米子 (自旋为半整数的粒子)
P12ψ (q1, q2 ) =ψ (q1, q2 )
Carriers of interaction (γ, W, Z, g), complex particles with total spin J =0,1,2...
引入总自旋角动量S
S 2 = S (S +1)2 Sz = M S
总自旋角动量S是两个电子的自旋s1和s2的矢量和
S = s1 + s2
单电子的自旋量子数
s1 = s2 =
总自旋量子数S的取值为
ˆ P 12
χ S = 1 [σ + (1)σ − (2) + σ − (1)σ + (2)]
2
+ −
M s = m s1 + m s 2
M S = +1 MS = 0 M S = −1
MS =0
χ A = 1 [σ + (1)σ − (2) − σ − (1)σ + (2)]
2
两电子体系的总自旋波函数:
i =1,2
ˆ ′= H
e2 4πε0r12
薛定谔方程
ˆ u (0) (r , r ) = E (0) u (0) (r , r ) H
0 1 2 1 2
§5.2 泡利不相容原理和交换效应—交换效应
ˆ u (0) (r , r ) = E (0) u (0) (r , r ) H
0 1 2 1 2
§5.2 泡利不相容原理和交换效应—波函数的交换对称性
全同性粒子的交换对称性
任一全同粒子体系的波函数都具有这种交换对 称性,并且不是对称的,就是反对称的。
玻色子 (自旋为0或整数的粒子)
费米子 (自旋为半整数的粒子)
P12ψ (q1, q2 ) =ψ (q1, q2 )
Carriers of interaction (γ, W, Z, g), complex particles with total spin J =0,1,2...
引入总自旋角动量S
S 2 = S (S +1)2 Sz = M S
总自旋角动量S是两个电子的自旋s1和s2的矢量和
S = s1 + s2
单电子的自旋量子数
s1 = s2 =
总自旋量子数S的取值为
第五章:多电子原子 泡利原理 《原子物理学》课堂课件

能级
五
章
多
实验表明,氦原子的光谱也是由这些线系
电 构成的,与碱金属原子光谱不同的是:
子
原
子
氦原子光谱的上述四个线系都出现双份,
:
泡 即两个主线系,两个锐线系等。
利
原
理
首页
上一页
下一页
氦及周期系第二族元素的光谱和能级
➢ 第二族元素:铍、镁、钙、锶、钡、镭、锌、镉、汞。 (都具有两个价电子 光谱和化学性质) ➢ 氦及第二族元素的能级都分成两套,一套是单层的,另 一套是三层的;各自形成两套光谱。
Atomic Physics 原子物理学
第五章:多电子原子 :泡利原理
第一节 氦的光谱和能级 第二节 两个电子的耦合 第三节 泡利原理 第四节 元素周期表
H原子:
Tn
R n2
En
Rhc n2
类H离子:
Tn
Z2
R n2
En
Z 2
Rhc n2
碱金属原子:
Tnl
(n
R l)2
Enl
(n
Rhc l)2
能级
五
章
即
原子实+2个价电子。
多
电
子
原
子 由此可见,能级和光谱的形成都是二个价电子
: 泡
各种相互作用引起的.
利
原
理
首页
上一页
下一页
第二节:两个电子的耦合
电子的组态
1.定义: 两个价电子处在各种状态的组合,
称电子组态。
电子的组 态
比如,氦的两个电子都在1s态,那么氦的电
第 五
子组态是1s1s;
一个电子在1s,
若核(实)外有两个电子,由两个价电子跃迁而形 成的光谱如何?能级如何?原子态如何?
原子物理第五章

上页
下页
返回
结束
主线系: 主线系:
~ ν =11 S 0 −n1P1
基线系
第一辅线系: 第一辅线系: ν = 2 P 第五章 多电子原子 −n D2 1 ~ =31D −n1F ν 2 3 第二辅线系: ~ 第二辅线系: ν = 21P − n1S
1 1
~
1
0
三层能级 主线系(三个成分) 主线系(三个成分)
上页
下页
返回
结束
第五章 多电子原子
电势: =24.47伏特 =7.62伏特 电 离 电势: 氦=24.47伏特 镁=7.62伏特 第一激发态: =19.77伏特 =2.7伏特 第一激发态: 氦=19.77伏特 镁=2.7伏特 足见氦的基态是一个很稳定的结构。 足见氦的基态是一个很稳定的结构。
上页 下页 返回 结束
第五章 多电子原子
小
结:
1、氦和镁的光谱结构基本相同,因为都是二电子体系所产生的。 、氦和镁的光谱结构基本相同,因为都是二电子体系所产生的。
2、它们之间有些差异正反映了原子结构之间的差异。 、它们之间有些差异正反映了原子结构之间的差异。
上页
下页
返回
结束
第五章 多电子原子
§ 5.2 具有两个价电子的原子态
He:Z=2 He:Z=2 Be:Z=4 Be:Z=4=2×12+2 Mg:Z=12 12= )+2 Mg:Z=12=2×(12+22)+2 Ca:Z=20 20= )+2 Ca:Z=20=2×(12+22+22)+2 )+2 Sr:Z=38 38= Sr:Z=38=2×(12+22+32+22)+2 Ba:Z=56=2×(12+22+32+32+22)+2 Ba:Z=56= )+2 56 Ra:Z=88 88= )+2 Ra:Z=88=2×(12+22+32+42+32+22)+2
原子物理学第五章
• 一般来说,主量子数不同,引起的能量差异会更 大,主量子数相同,角量子数不同,引起的能量 差异相对较小一些。
• 同一电子组态可以有多种不同的能量,即一种电 子组态可以与多种原子态相对应。 一种原子态和 能级图上一个实实在在的能级相对应。
电子组态构成原子态的途径
六种相互作用:
G1(s1, s2 )、G2 (l1, l2 )、 G3 (l1, s1)、G4 (l2 , s2 )、 G5 (l1, s2 )、 G6 (l2 , s1)
三四三四三四三四三四 重重重重重重重重重重
五六五六五六五 重重重重重重重
七八七 重重重
注:
两套能级之间 不产生跃迁
5.2 两个价电子的原子态
(1)电子组态
定义: 两个价电子处在各种状态的组 合,称电子组态。
比如,氦的两个电子都在1s态, 那么氦的电子组态是1s1s; 两个电
子都在1s; 2s2p,3s3d …,构成激
发态的电子组态。
电子组态与能级的对应
• 组态的主量子数和角量子数不同,会引起能量的 差异,比如1s1s 与 1s2s对应的能量不同;1s2s 与1s2p对应的能量也不同。
泡 利 – 物理学家
的良心、上帝的皮鞭
Wolfgang Pauli 奥地利人 1900-1958
获1945年诺贝尔 物理学奖
交替的多重态
19 20 21S 22 23 24 25 26 27 28 29 K Ca c Ti V Cr Mn Fe Co Ni Cu
双单双单双单双单双单双 重重重重重重重重重重重
D • 例: 3 1,2,3 2 : 3
电子组态和原子态(jj耦合)
电子组态:( n1l1n2l2 )
如: 1s1s, 1s2s, 1s2p
• 同一电子组态可以有多种不同的能量,即一种电 子组态可以与多种原子态相对应。 一种原子态和 能级图上一个实实在在的能级相对应。
电子组态构成原子态的途径
六种相互作用:
G1(s1, s2 )、G2 (l1, l2 )、 G3 (l1, s1)、G4 (l2 , s2 )、 G5 (l1, s2 )、 G6 (l2 , s1)
三四三四三四三四三四 重重重重重重重重重重
五六五六五六五 重重重重重重重
七八七 重重重
注:
两套能级之间 不产生跃迁
5.2 两个价电子的原子态
(1)电子组态
定义: 两个价电子处在各种状态的组 合,称电子组态。
比如,氦的两个电子都在1s态, 那么氦的电子组态是1s1s; 两个电
子都在1s; 2s2p,3s3d …,构成激
发态的电子组态。
电子组态与能级的对应
• 组态的主量子数和角量子数不同,会引起能量的 差异,比如1s1s 与 1s2s对应的能量不同;1s2s 与1s2p对应的能量也不同。
泡 利 – 物理学家
的良心、上帝的皮鞭
Wolfgang Pauli 奥地利人 1900-1958
获1945年诺贝尔 物理学奖
交替的多重态
19 20 21S 22 23 24 25 26 27 28 29 K Ca c Ti V Cr Mn Fe Co Ni Cu
双单双单双单双单双单双 重重重重重重重重重重重
D • 例: 3 1,2,3 2 : 3
电子组态和原子态(jj耦合)
电子组态:( n1l1n2l2 )
如: 1s1s, 1s2s, 1s2p
原子物理第五章

1
1 0
1
P 1
2
3
2
3
1
D2 F3
3 3 3
1
1
2,1,0 3,2,1 4,3,2
3 3 3
P2
P 1
3 3 3
P0
1
2
D3
D2 F3
D1 F2
3
F4
《原子物理学》(Atomic Physics)
第五章 多电子原子:泡利原理
总之,在LS耦合中,四种相互
作用共同影响。如图所示。两个电
子的自旋相互作用 G1很强,相当于 S=0和1的单一态和三重态没有考虑
电子组态清楚地显示出核外电子的排布状况。
《原子物理学》(Atomic Physics)
第五章 多电子原子:泡利原理
氦原子在基态时,两个电子都在1s态,我们说这个状 态的电子组态为1s1s。再如,镁在第一激发态时,一个电 子留在3s态,一个电子被激发到3p态,那么这时的电子组 态时3s3p。而镁的基态的电子组态是3s3s。 不同的电子组态具有不同的能量,有时差别很大。对
剩下四种运动中,对于比较轻的元素的原子, G1 G2 比 比 G3 G4 强得多;对于比较重的元素的原子, G3 G4比 G1 G2 强得多。因而当电子组态形成原子态时,采用 G1 G2 相互 作用的方式简称LS耦合;采用 G3 G4 相互作用的方式简称 jj耦合。 也就是说,L-S耦合表示每个电子自身的自旋与轨道 运动之间的相互作用比较弱,主要的耦合发生在不同电子 之间;而j-j耦合则表示每个电子自身的自旋与轨道耦合比 较强,不同电子之间的耦合比较弱。
第五章 多电子原子:泡利原理
二、L-S 和j-j 耦合
一种组态中的两个电子由于相互作用可以形成不同的
1 0
1
P 1
2
3
2
3
1
D2 F3
3 3 3
1
1
2,1,0 3,2,1 4,3,2
3 3 3
P2
P 1
3 3 3
P0
1
2
D3
D2 F3
D1 F2
3
F4
《原子物理学》(Atomic Physics)
第五章 多电子原子:泡利原理
总之,在LS耦合中,四种相互
作用共同影响。如图所示。两个电
子的自旋相互作用 G1很强,相当于 S=0和1的单一态和三重态没有考虑
电子组态清楚地显示出核外电子的排布状况。
《原子物理学》(Atomic Physics)
第五章 多电子原子:泡利原理
氦原子在基态时,两个电子都在1s态,我们说这个状 态的电子组态为1s1s。再如,镁在第一激发态时,一个电 子留在3s态,一个电子被激发到3p态,那么这时的电子组 态时3s3p。而镁的基态的电子组态是3s3s。 不同的电子组态具有不同的能量,有时差别很大。对
剩下四种运动中,对于比较轻的元素的原子, G1 G2 比 比 G3 G4 强得多;对于比较重的元素的原子, G3 G4比 G1 G2 强得多。因而当电子组态形成原子态时,采用 G1 G2 相互 作用的方式简称LS耦合;采用 G3 G4 相互作用的方式简称 jj耦合。 也就是说,L-S耦合表示每个电子自身的自旋与轨道 运动之间的相互作用比较弱,主要的耦合发生在不同电子 之间;而j-j耦合则表示每个电子自身的自旋与轨道耦合比 较强,不同电子之间的耦合比较弱。
第五章 多电子原子:泡利原理
二、L-S 和j-j 耦合
一种组态中的两个电子由于相互作用可以形成不同的
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
: 这正是本章所要研究的问题。
泡
利
原
理
首页
上一页
下一页
第一节:氦的光谱和能级
1.谱线的特点
我们知道碱金属原子的光谱分为四个线系:
谱线
主线系:
锐线系:
第 漫线系:
基线系:
能级
五
章
实验表明,氦原子的光谱也是由这些线系
多 构成的,与碱金属原子光谱不同的是:
电
子
原
氦原子光谱的上述四个线系都出现双份,
子
: 即两个主线系,两个锐线系等。
:
泡
利
原
理
首页
上一页
下一页
第一节:氦的光谱和能级
谱线
可见,价电子在碱金属原子中起了十分重
第 要的作用,它几乎演了一场独角戏
能级
五
章
多电子原子是指最外层有不止一个价电
多 子, 换句话说,舞台上不是一个演员唱独角
电 子
戏,而是许多演员共演一台戏, 那么这时情
原 子
形如何,
原子的能级和光谱是什么样的呢?
利
原
理
首页
上一页
下一页
电子的组 态
同一组态 内的相互 作用
选择定则
第二节:两个电子的耦合
电子的组 态
同一组态
第
内的相互
五
作用
章
多
选择定则
电
子
原 子
: 泡
利
原 理
首页
上一页
下一页
第二节:两个电子的耦合
在两个价电子的情形中,每一个价电子都
有它自己的轨道与自旋运动,因此情况比较复
杂。设两个价电子的轨道运动和自旋运动分别 是l1,l2,s1,s2,则在两个电子间可能的相互作用 有六种:
原 子
一种电子组态可以与多种原子态相对应。
我们
: 泡
知道,一种原子态和能级图上一个实实在在的
利 能级相对应。
原
理
首页
上一页
下一页
电子的组 态
同一组态 内的相互 作用
选择定则
第二节:两个电子的耦合
2.电子组态与能级的对应
第 五 章
多
电
子
原 子
: 泡
利
原 理
首页
上一页
电子的组 态 同一组态 内的相互 作用 选择定则
下一页
第一节:氦的光谱和能级
氦原子的光谱由两套谱线构成,一套是单
层的,另一套是三层,这两套能级之间没有相 互跃迁,它们各自内部的跃迁便产生了两套独 谱线 立的光谱。
早先人们以为有两种氦,把具有复杂结 能级
第 五
构的氦称为正氦,而产生单线光谱的称为仲
章 氦;
?
多
电
子
原 子
现在认识到只有一种氦,只是能级结构分为两套。
电
子
原 子
原子处在亚稳态时,必须将其激发到更高能,
:
泡
利 方可脱离此态回到基态)
原
理
首页
上一页
下一页
第一节:氦的光谱和能级
5)一种电子态对应于多种原子态。 不仅氦 的能级和光谱有上述特点,人们发现,元素 周期表中第二族元素:
谱线
Be(4)、Mg(12)、Ca(20)、Sr(38)、 Ba(56)、Ra(88)、Zn(30)、Cd(48)、Hg(80)
下一页
第二节:两个电子的耦合
第
在氦的第二族元素中,考虑自旋后,在一
五 章
种电子组态
n1l1n2l2
中,两个价电子分别有
各自的轨道和自旋运动,因此存在着多种相互
多
电 作用,使得系统具有的能量可以有许多不同的
子 原
可能值。而每一种能量的可能值都与一种原子
子 态,即一个能级相对应。我们说,这些原子态
:
泡 便是该电子组态可能的原子态。
电子的组 态
同一组态
第
G1(s1,s2)G2(l1,l2),G3(l1,s1),
内的相互
五 章
G4(l2,s2),G5(l1,s2),G6(s2,l1)
作用
子
: 泡
迁;氦的基态是1s1s1S0;
利
原
理
首页
上一页
下一页
第一节:氦的光谱和能级
2)状态1s1s3S1不存在,且基态1s1s1S0和
第一激发态1s1s3S1之间能差很大;
谱线
3) 所有的3S1态都是单层的;
能级
第 五
4)1s2s1S0和1s2s3S1是氦的两个亚稳态;(
章
多 不能跃迁到更低能级的状态称为亚稳态,当
第 的光谱都与氦有相同的线系结构。
能级
五
章
即
原子实+2个价电子。
多
电
子
原 由此可见,能级和光谱的形成都是二个价电子
子 :
各种相互作用引起的.
泡
利
原
理
首页
上一页
下一页
第二节:两个电子的耦合
电子的组态
1.定义: 两个价电子处在各种状态的组合,
称电子组态。
电子的组 态
比如,氦的两个电子都在1s态,那么氦的
原子物理学第五章
第一节:氦的光谱和能级
通过前几章的学习,我们已经知道了单
电子和具有一个价电子的原子光谱及其规律,
同时对形成光谱的能级作了比较详细的研究。 谱线 弄清了光谱精细结构以及能级双层结构的根
本原因-电子的自旋。
能级
第
五
通过前面的学习我们知道:碱金属原子
章 的原子模型可以描述为:
多
电
子
原
子
原子实+一个价电子
跃迁产生的;根据氦光谱的上述特点,不难推
测,其能级也分为
能级
第
五 章
单层结构:
1 S,
1
P,
1
D,
1F----仲氦
多
电 两套:
子
原 子
三层结构: 3S, 3P, 3D, 3F----正氦
:
泡
利
原 理
首页
上一页
下一页
第一节:氦的光谱和能级
谱线
能级
第
五
章
3.能级和能级图的特点
多
电
子
原 1)能级分为两套,单层和三层能级间没有跃
电子组态一般表示为n1l1n2l2 ;组态的主 量子数和角量子数不同,会引起能量的差异,
比如1s1s 与 1s2s对应的能量不同;1s2s 与
1s2p对应的能量也不同。
第 一般来说,主量子数不同,引起的能量差
五 章
异会更大,主量子数相同,角量子数不同,引
多 起的能量差异相对较小一些。
电
子
同一电子组态可以有多种不同的能量,即
第 五
电子组态是1s1s;
一个电子在1s,
另一个
章 到 2s 2p 3s 3d…,构成激发态的电子组态。
多
电
子
对于氦, 两个电子的主量子数n都大于1,
原 子
构成高激发态,实验上不容易观测,它需要很
: 泡
高的能量激发。
利
原
理
首页
上一页Βιβλιοθήκη 下一页同一组态 内的相互 作用
选择定则
第二节:两个电子的耦合
2.电子组态与能级的对应
:
泡
利
原
理
首页
上一页
下一页
第一节:氦的光谱和能级
谱线
能级
第 五 章
多
电
子
原 子
: 泡
利
原 理
首页
上一页
下一页
第一节:氦的光谱和能级
谱线
能级
第 五 章
多
电
子
原 子
: 泡
利
原 理
首页
上一页
下一页
第一节:氦的光谱和能级
2.能级和能级图
什么原因使得氦原子的光谱分为两套谱线
呢?我们知道,原子光谱是原子在不同能级间 谱线
泡
利
原
理
首页
上一页
下一页
第一节:氦的光谱和能级
实验中发现这两套谱线的结构有明显的 差异, 一套谱线由单线构成,另一套谱线却 谱线 十分复杂。具体情况是:
第 五
章 光谱:
多 电 子 原 子
: 泡 利 原 理
单线 多线
首页
四个线系均由单
谱线构成主, 锐
能级
线系由三条谱线构成
漫,基线系由六条 谱线构成
上一页
