第四章芳香烃
4第四章 芳香烃
可逆; 可逆; 低温有利α位取代;高温有利β位取代。 低温有利α位取代;高温有利β位取代。
2
加成反应
二 蒽和菲(C14H10) 蒽和菲(
α
8
γ
9
α
1 2β
β β
7
6
3β
蒽
6
α
5
γ α γ γ
9 10
10
4
蒽、菲γ 位C活泼 活泼
7 8
α
β7
8
1
α
2β
5 4
≡
3 2 1 10 9
菲
β α
6
5
α β
NO2 NO2 95oC NO2
+ 浓H2SO4 +发烟HNO3 发
磺化反应
反应可逆
+ H2SO4 (10%SO3) SO3H + H 2O
2H2SO4
苯磺酸 + SO3 + H3O + HSO4
亲电取代反应历程 亲电取代反应历程 sp3杂化 + E+ E+ π-配合物
慢
+
E 快 H
E
-H+
σ-络合物
第四章
芳香烃
芳香烃——芳香族碳氢化合物,性质上易进行取代反应, 芳香烃——芳香族碳氢化合物,性质上易进行取代反应,而不 ——芳香族碳氢化合物 易进行加成反应的一类化合物。 易进行加成反应的一类化合物。
单环芳 烃
多环芳 烃
苯型芳香烃 例: 芳香烃 非苯型芳香烃 例:
第一节 苯及其同系物
...
... O
(一)萘的结构和命名 特殊的大π键 特殊的大 键,电子云 分布不如苯平均, 分布不如苯平均,稳定 性比苯弱, 性比苯弱,比苯容易发 生加成和氧化反应, 生加成和氧化反应,取 代反应也比苯容易。 代反应也比苯容易。
第四章 芳香烃

C 2H 5
+ HBr
此反应中应注意以下几点: ① 常用的催化剂是无水AlCl3,此外 FeCl3、BF3、 无水HF、SnCl4、ZnCl2、H3PO4、H2SO4等都有催化 作用。 ② 当引入的烷基为三个碳以上时,引入的烷基 会发生碳链异构现象。例如:
+ CH3CH2CH2Cl
AlCl3
CH3 N O X N CH3 O
O C CH3
=
c. 与苯环直接相连的基团可与苯环的大 π 键发 生σ ,π –超共轭效应或具有碳碳重键。如:
CH3
C6H5
CH=CH2
(2) 第二类定位基(即间位定位基)
―N+(CH3)3 > ―NO2 > ―CN > ―SO3H > ―CHO > ―COOH > ―COOR > ―CONH2 >―+NH3 等.
氯化苄 (苯氯甲烷)
反应条件不同,产物也不同。因两者反应历程不同,光照卤 代为自由基历程,而前者为离子型取代反应。
侧链较长的芳烃光照卤代主要发生在α碳原子上。
CH2CH3
Cl2, 光 91%
CHCH 3 Cl
+ 9%
CH2CH2 Cl
CH2CH3
Br, 光 100%
CHCH 3 Br
CH2CH2-CH-CH 3 CH3
C-H键长都是0.110nm
所有键角都是120°
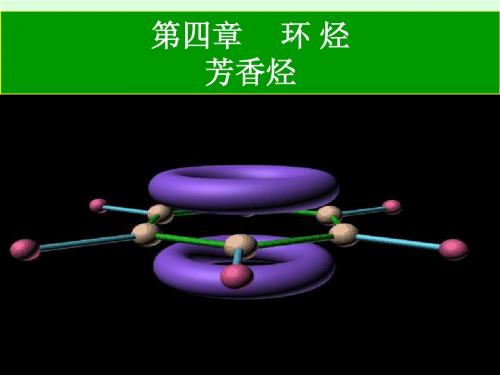
苯的分子模型
1.杂化轨道理论解释
苯分子中的碳原子都是以sp2杂化轨道成键的, 故键角均为120°,所有原子均在同一平面上。
苯中的p轨道
p轨道的重叠
2.从氢化热看苯的稳定性
H2 2 H2 3 H2 H苯理=3x120=360k J / mol
第四章 芳香烃

CH2COOH
1. 萘的结构
萘分子中碳原子和氢原子都在同一平面内,碳-碳键的长度 不全相等,但与苯相近。
142
pm
136
pm
140 pm
123
第四章 芳 香 烃
目录△
萘分子中碳原子和氢原子都在同一平面内,碳-碳 键的长度不全相等,但与苯相近。 萘的共振式为:
共振能为 251.2 kJ/mol
第四章 芳 香 烃
目录△
(二) 多苯代脂烃(见P.69-70)
二、稠环芳烃
(一) 萘 1. 萘及其衍生物的命名
α β β
7 6 8
α
1 2 3
β β
CH2CH3
5
4
Br
α
CH3 CH3
α
1-溴萘 α- 溴萘
2-甲基萘 β- 甲基萘 第四章 芳 香 烃
2-甲基-6-乙基萘
目录△
SO3H OH CH3
α-萘磺酸 β-萘酚 6-甲基-2-萘乙酸
OH
COOH COCH3
第四章 芳 香 烃
目录△
第六节 重要的单环芳烃
一、苯(见课本)
二、烷基苯(甲苯、乙苯、二甲苯等)
第四章 芳 香 烃
目录△
第七节 多环芳烃、稠环芳烃和非苯芳烃
一、多环芳烃
(一) 联苯及连多苯
O2 N
联苯 4,4/-二硝基联苯
NO2
4,4/-二苯基联苯 命名以联苯为母体展开 第四章 芳 香 烃
Br Br Br Br
第四章 芳 香 烃
目录△
但还是存在未能说明的一些现象,例: 氢化热
E
240
231
208
稳定性: 苯 > 1,3—环己二烯 > 1,4—环己二烯
有机化学:第四章芳香烃

治学善质疑,心灵悟真谛
2.稠环芳香烃 分子中无独立苯环,两个或多个苯环稠合。
C C
萘
C
C
C
C
蒽
C
C
C
C
菲
马敬中 华中农业大学理学院
治学善质疑,心灵悟真谛
二、单环芳烃的构造异构和命名
1.苯的同系列,通式是CnH2n-6(4个不饱和度) 具有侧连异构和位置异构。
CH2CH2CH3
H3C
CH3
CH
CH2CH3
马敬中 华中农业大学理学院
治学善质疑,心灵悟真谛
2)付-克烃基化反应的重排
卤代烷具有三个碳以上时,常产生重排产物。
H3C Cl
AlCl 3
CH3
+
CH3
CH3
重排由不稳定碳正离子中间体稳定性引起。
H
CH3 CH CH2
重排
CH3 CH CH3
马敬中 华中农业大学理学院
治学善质疑,心灵悟真谛
没有更稳定的离子中间体产生,就没有重排产物。
5)卤代苯亲电取代生成邻对位两种产物
Br
HNO 3
H2SO 4
Cl Cl Br
FeCl 3
Br H2SO 4
+ Br Br NO 2
+ Br Br Cl
+ Br Br SO 3H
NO 2 Cl SO 3H
马敬中 华中农业大学理学院
治学善质疑,心灵悟真谛
6)硝基苯亲电取代只生成一种间位产物
NO 2
NO 2
HNO 3 H2SO 4
NO 2
Cl Cl FeCl 3
O2N
NO 2 Cl
NO 2
第四章芳香烃-精选文档

CH3
间二甲苯 1,3-二甲苯 m-二甲苯
CH3
对二甲苯 1,4-二甲苯 p-二甲苯
H3C
3.当两种取代基不同时,以其中较小取代基与苯环一起作为母体,并以与其相连的碳原子为第一 位进行编号 (H3C)3C CH3 对叔丁基甲苯(4-叔丁基甲苯)
4 . 当 苯 环 上 连 有 不 饱 和 烃 基 或 较 复 杂 的 烷 基 时 , 常 把 苯 环 作 为 取 代 基 来 命 名 C H = C H 2 苯 乙 烯 C C H 苯 乙 炔 H H C H C H C H C H C 2C 2 3 2 C H C H 3 3
2 , 4 二 甲 基 1 苯 基 己 烷 有 些 一 取 代 苯 , 有 专 门 名 称 取 代 基 与 母 体 一 起 作 为 新 的 母 体
O H N H 2 S O H 3 C O O H
苯 酚 苯 胺 5.苯环上有两个或多个取代基
苯 磺 酸
苯 甲 酸
按下列顺序:COOH > SO3H > COOR > CONH2 > CN > CHO > COR > OH > NH2 > OR > R > X > NO2 先出现的取代基与苯一起作为新的母体,其它取代基依次列出,尽量使取代 基的位次之和最小:
S O H O 3 2
S O H 3
(4)傅-克反应 1)傅-克烷基化反应
H C H C l +C 3 2
无 水 A l C l 3
C H C H 2 3
+H C l
+发 烟 H N O 3 CH3 + HNO3
浓 H 2S O 4 CH3 NO3 NO2 TNT NO2
有机化学第四章 芳香烃

1 价键理论
此时每个碳原子上剩有一 H 个未参与杂化 参与杂化的 轨道, 个未 参与杂化 的 p 轨道 , H120° 其对称轴垂直碳环所在 平面,并彼此平行,于 两侧相互交盖重叠,形 H H 成一个闭合的π 成一个闭合的 π键 , 这样 处于该 π 键中的 π 电子能 高度离域, 够 高度离域 , 使 π 电子云 完全平均化。分子整体 能量降低,分子稳定。 能量降低,分子稳定。
CH3
CH3 甲苯
CH2CH3 乙苯
CH2CH2CH2CH3
CH3
CH3
CH3CH2
对二甲苯
邻甲乙苯
13
苯同系物的命名
• 3 苯环上连有三个相同基团时,用连、偏、均来 表示相对位置。 表示相对位置。 • 要求必须是三个相同基团才能用连、偏、均来表 才能用连 示此三基团的相对位置。
CH3 CH3 CH3
H H
0.110nm
0.140nm
8
• 由于苯形成了一个环状π键,使6个碳-碳键、6 个碳-氢键都相同,其碳-碳键较烷烃中短,比 烯烃中碳-碳双键长,导致其性质与烷烃、烯烃 都有较大区别,苯的这种难加成、难氧化、易取 难加成、难氧化、 代的性质,就被称为芳香性。 现在一般用
表示苯,以示苯中 个碳 个碳- 表示苯,以示苯中6个碳-碳键并无
3 芳烃衍生物的命名
当苯环上连有-OH、-CHO、-COOH、- 当苯环上连有-OH、-CHO、-COOH、- 、-CHO、-COOH 、-NO 、-SO 、-X NH2、-NO2、-SO3H、-X等基团时我们又该 如何命名这样的化合物呢? 如何命名这样的化合物呢? 首先仍然是选择一个母体。 首先仍然是选择一个母体。 一般我们按一定的次序选择一个最优先的基团 选择一个最优先的基团, 一般我们按一定的次序选择一个最优先的基团, 并将它与苯一起作为一个完整的母体。 并将它与苯一起作为一个完整的母体。其它都作 为取代基来看。 为取代基来看。 这一次序我们称为“ 优先次序 ”,它与在烯烃一 完全没有任何关系。 章中介绍的“ 次序规则 ”完全没有任何关系。 一些常见基团的优先次序如下: 一些常见基团的优先次序如下:
第四章 芳香烃

+
(CH 3CO)2O
Al C l 3
+
CH3COOH
=
O O
AlC l 3
=
O
+
C CH =CH
COOH
=
O
六、
苯环上亲电取代反应的定位规律
(一)一元取代苯的定位规律
定位规律:苯环上引入第二个基团时,进入苯环的位置和难
易程度,由原有基团的性质决定,这就是一元取代苯的定位 规律。 定位基:苯环上原有的取代基称为定位基。定位基有两类: 1.邻对位定位基(第一类定位基)
(四)加成反应
+ 3 H2
Ni 。 180 ~ 210 C, 18MPa
Cl + 3 Cl2
紫外光
Cl Cl Cl
Cl Cl
六氯化苯
五、亲电取代反应历程
1.卤代:
Cl2 + FeCl3
[FeCl4]-
+ Cl+
H
+ Cl+
Cl+
+
H Cl
σ-配合物
Cl
π-配合物
H Cl + FeCl4
Cl
+ FeCl3 + HCl
如:硝基苯
这类基团除正离子外,均属表现为–I、–C效
应的基团。如:―NO2、―COR、―COOH 等。
O N O
δ
δ
+
δ δ +
δ+
δ
(四)定位规律的应用
1.比较亲电取代反应的活性顺序
OH > CH3 > > Cl > COOH > NO2
2. 多取代苯的合成——正确选择合成路线:
第四章:芳香烃

Cl2 CH3COOH
NHCOCH3 Cl + CH3
NHCOCH3
CH3
Cl CH3
主要
次要
定位效应的解释: (五) 定位效应的解释:活性和方向
中间体
(1) 甲基 邻位进攻
CH3
CH3 H E
CH3 H E
H E
CH3
H E
最稳定
CH3 CH3 CH3 CH3
对位进攻
H E H E H E H E
H H
H
H
CH2=CH—CH=CH2—CH=CH2
(4) 苯分子结构的表示方法
或 ” :环状共轭大 键,碳碳键无单双键之分,碳 环状共轭大π键 碳碳键无单双键之分,
“
原子的4个化学键的归属不明确。 原子的 个化学键的归属不明确。 个化学键的归属不明确
(5) 共振论的解释
二、苯同系物的命名
C
一烃基苯
付-克烷基化反应 克烷基化反应
H + Cl CHCH2CH3 (0.1 eபைடு நூலகம்uiv.) CH3
AlCl3
CHCH2CH3 + HCl CH3
仲丁基氯
仲丁基苯 (71%)
4. 付-克反应(Friedel-Crafts Reactions) 克反应( 克反应 ) 克酰基化反应* 付-克酰基化反应 克酰基化反应
H H C C H C C H H C C H
或
合理性
+ 3H2
Ni2 200
X
苯的一元取代物只有一种: 苯的一元取代物只有一种:
凯库勒结构式的缺陷
(1) 不能解释其化学特性。 不能解释其化学特性。 (2) 不能解释其邻位二取代物只有一种。 不能解释其邻位二取代物只有一种。 实验证明: 实验证明: X
第四章 环烃-芳香烃
CHCl3
+2
AlCl3
CH2
CH
二苯甲烷
三苯甲烷
+3
AlCl3
Cl CCl4 + (过量)
AlCl3
C
三苯基氯化甲烷
b. 傅氏酰基化反应
芳烃在无水AlCl3催化下可同酰卤或酸酐反应, 生成芳酮。
+ CH3C O Cl
O O O
AlCl3
AlCl3
C O
CH3 + HCl
CH3 +
CH3 C CH3 C
CH3 CH=CH 2 C CH CH2 CH =CH2 CH3 C CH2 CH3
苯乙烯
苯乙炔
3-苯基丙烯
2-甲基-2苯基丁烷
苯的衍生物: 当苯环上连有-NO2,-X等基团时,则以苯环为母体,叫 做” 某某苯”。
CH2CH2CH3 CH3 正丙苯 甲苯
NO2 硝基苯 氯苯
Cl
当苯环上连有 -COOH , -SO3H , -NH2 , -OH , -CHO , -CH=CH2 或较复杂-R等基团时,基团为母体,则把苯环作为 取代基,叫做”苯某某”。 CH3CH2CHCH2CHCH3
120
0
120 0
H
120 0
H
0.1396 nm
H H
H
苯 的 分 子 模 型
H
H
H
H
H
由于六个碳原子 完全等同,所以大π H 键电子云在六个碳原 子之间均匀分布,即 电子云分布完全平均 化,因此碳-碳键长完 全相等,不存在单双 键之分。由于苯环共 轭大π键的高度离域, 使分子能量大大降低, 因此苯环具有高度的 稳定性。
《有机化学(第二版)》第4章:芳香烃

C2H5
19:46
傅-克反应
① 烷基化反应
+ C2H5Br
AlCl3
+ HBr
76%
19:46
傅-克烷基化反应历程
.. CH3CH2—Cl: + AlCl3 C2H5-Cl -AlCl3 ..
CH3CH2+ + AlCl4ˉ H + CH3CH2
α:1、4、5、8—电子云密度次之 β:2、3、6、7—电子云密度最低 γ:9、10—电子云密度最高
19:46
9.10—位电子云密度最高,反应活性最强。
O HNO3
O
O + O O O O O
19:46
3.菲(C14H10)
10 1 2 3 4 5 6 9 8 7
菲的化学性质与蒽相似,反 应主要发生在9、10位。
苯与亲电试剂 E+作用时,生成π- 络合物,
从苯环的π- 体系获得两个π电子,与苯环的
一个碳原子形成σ- 络合物,σ- 络合物不稳 定,容易失去一个质子,重新形成六个π电 子离域的闭合共轭体系。
19:46
2.亲电取代反应
(1) 卤代反应 卤 素:Cl2 、Br2 催化剂:Fe 、 FeX3
CH CH2
②不论有多少支链,氧化都在原支链位置上生成苯甲酸 ③叔丁苯不含α-H的抗氧化能力强,不易被氧化。 苯环在氧化剂 V2O5存在下可被氧化
V2O5
400~500℃
2
CH—C CH—C
O
+ 9O2
O + 4CO2 + 4H2O
O
顺丁烯二酸酐
第四章芳香烃

S O H 3 H O + 2
强酸,极易溶于水
26
(1)有机合成,磺酸基暂占据环某位置,最后水 解除去。
C H 3 C H 3 C l 2 F e C l 3 S O H 3 C l C H 3 l C l C H O 2 S O H 3 C H 3 C l
(2)苯磺酸极易溶于水。分子引入-SO3H,变为 水溶性。
第四章
芳香烃
芳香烃(aromatic hydrocarbon): 通常指含有苯环的碳氢化合物。
1
是否含 芳香烃 苯环
苯型芳香烃 Benzenoid aromatic hydrocarbon
非苯型芳香烃
non-benzenoid aromatic hydrocarbon
单环芳香烃
苯环的 苯型芳香烃 数目
C H3 C H 3- C H - C - C H 2- C H 3 C H3
CH=CH2
3,3-二甲基-2-苯基戊烷
苯乙烯
13
二烃基苯: 邻(o-)、间(m-)、对(p-)
1,2-、1,3-、1,4-表示取代基的位置
CH
3
CH
3
C H
3
CH 邻 -二 甲 苯 ( 1 ,2 - 二 甲 苯 ) o -o x y le n e
16
芳基(Ar-): 芳烃环上去掉一个H后剩下的基团。
CH2
苯基 C6H5(Ph-表示) 苯甲基(苄基) (PhCH2-表示)
17
三、苯及其同系物的物理性质
无色液体,密度: 0.8~0.9 沸点: 随分子量的增加而升高。每一个碳原子 的沸点增值通常为20~30℃ 熔点: 取决于分子量和分子形状 溶解性:不溶于水,易溶于乙醚、四氯化碳 和石油醚等有机溶剂。
4芳香烃

4.4 单环芳烃的化学性质 1 芳烃苯环上的反应 一、亲电取代反应 1.硝化:以浓硫酸为催化剂,加热:
+
HO NO 2
H2SO4 50 60 C
0
NO 2
+ H 2O
NO 2
发 烟 HNO3 H2 SO4 100 0 C
NO 2
NO 2
+
NO 2 93%
NO 2
+
O 2N
NO 2
7%
11
2.卤化:以铁粉或路易斯酸三卤化铁为催化剂,适当加热:
b.与苯环直接相连的原子以重键与其它原子相连,且 重键末端通常为电负性较强的原子。如:
N O = O C O = CH3
28
C N
二、定位规律的理论解释
1. 第一类定位基(即邻对位定位基) (1)表现为+I、+C效应的基团,但这里的+C效应是通 过σ ,π –超共轭效应使苯环致活的。如: ―CH3、―CH2X (X=F、Cl、Br、I)。 以甲苯为例:
CH 3
KMnO4 , OH , K2Cr2O7 - H2SO4 ,
COOH
CH 2R
KMnO4 , OH , K2Cr2O7 - H2SO4 ,
COOH
CH 3 CH 3
O
V2O5 - TiO2 350 400 0C
O O
24
3.聚合反应
CH2 CH2 过氧苯甲酰 80~90oC * CH CH2
依 次 减 少
依 次 增 多
结论:芳环上原有基团的体积增大,对位产物增多。
34
2. 新引入基团的空间效应:
新引入基团进入芳环的位置,不仅与环上原有基团的
第四章 芳香烃

③ 磺化
HOSO2OH/
S O OH O
+ H2O
可逆反应
苯与浓硫酸共热(或10% SO3+ H2SO4常温) 得到苯磺酸,发烟硫酸可吸收生成的水,使反 应易于进行, 将磺化产物放入饱和食盐水,苯 磺酸钠即沉淀出来,可作为鉴别反应。 磺化反应是可逆的, 苯磺酸与水或稀酸共 热可脱去磺酸基, 合成上常利用磺酸基的定位 效应在特定位置引入某些基团。
第四章 芳香烃
4.1 4.2 4.3 4.4 4.5 4.6 分类和来源 苯的结构 命名 性质 稠环芳烃 非苯芳烃(略)
基本内容和重点要求
苯和萘的结构、化学性质; 芳环中亲电取代反应的基本类型及反应机理; 芳环亲电取代反应的定位规律及应用
重点要求掌握芳烃的化学性质,尤 其是亲电取代反应、定位规则及其在有 机合成上的应用。
CH2 CH3
1 6 5 4 2 3
CH3
2-甲基-1-乙基-4-异丙基苯
CH(CH3)2
芳基命名: 苯基(ph-)/芳基(Ar-)
CH3 CCH2
邻甲苯基
OH
苯甲基(苄基)
Cl
苯甲醇(苄醇)
氯化苄(苄氯)
有机
二、复杂基团或不饱基团取代时,则把侧链当 作母体,苯环当作取代基来命名。
CH3 H3C CH2 CH CH CH3
有机
4.2 苯的结构 十九世纪初期发现了苯, 并测定其分 子式为C6H6,这说明它是一个不饱和程度 很高的烃,依分子式很容易就能写出其 不饱和的链烃,但研究发现苯的性质与 不饱和链烃完全不同, 苯不易发生加成 及氧化反应(常态下苯不能使溴的四氯化 碳褪色,亦不被KMnO 4 氧化),故不饱和 的链结构并不是苯的真实结构,另一方 面,苯却易发生取代反应:
第四章-芳香烃

4.6.3 氧化反应
O
+
2 O2 V O5 400℃
H C HC
C C O O +件下, 加热条件下, KMnO4, K2Cr2O7等不能氧化
4.6.4 芳烃侧链反应 氧化反应
CH 3 KM O4 n ∆ CH CH CH 2 2 3
COOH
CH 3 C CH 3 CH 3
练习
H3C OH SO3H NO2
6-甲基 萘磺酸 甲基-1-萘磺酸 甲基 6-methyl-1-naphthene sulfonic acid
8-硝基 萘酚 硝基-2-萘酚 硝基 8- nitro-2-naphthol
4.4 苯的结构
苯的Stuart 模型 苯的
苯的 Kekulé模型 模型
键长: 键角: 键长:0.140nm(CC) 0.108nm(CH) 键角: 120° ° 单键: 单键:0.154nm;双键:0.134nm ;双键:
KM O4 n ∆
COOH
KMnO4 △
不 反应
侧链上无α氢的侧链不氧化 侧链上无 氢的侧链不氧化
KMnO4 H+
考研) (中农大2006考研) 中农大 考研
氯代反应
CH 3 Cl2 hv or∆
CH Cl 2 Cl2 hv or ∆ 苯 氯 化 CH Cl2 2 Cl2 hv or ∆ 苯 苯 苯 苯 苯 CH 3 Cl
定位效应的理论解释- 定位效应的理论解释-邻、对位定位基
H H C H δ
δ
-
-
δ
-
给电子诱导效应与σ-π超共轭效应 超共轭效应 给电子诱导效应与 大部分(除卤素)对苯环起给电子作用, 大部分(除卤素)对苯环起给电子作用, 增加苯环电子云密度, 增加苯环电子云密度,利于亲电取代
第四章 芳香烃

CH CH2
苯乙烯 Phenyl ethylene (Styrene)
㈡ 二取代苯的命名
二 单环芳烃的异构和命名
当化合物分子中含2个以上官能团和取代基时,按下 列顺序确定主官能团
COOH S O3H COOR COX CONH2
CN CHO C O OH NH2 OR R -X -NO2
见教材的P145
25℃
或 浓H2SO4 / 75℃
SO 3H Yield 95%
苯磺酸
Benzenesulfonic acid
SO3H CH3
发烟H2SO4 200℃以上
SO3H
SO3H
CH3
CH3
+ H2SO4浓
室温
SO3H +
+2H2O
注意
SO3H
※1 苯的磺化反应是可逆反应,在有机合成中应用广泛
四 单环芳烃的化学性质
三 单环芳烃的物理性质
㈡ 来源之二:石油的芳构化
Pt, H2 环化
CH3
Pt, H2 环化
Pt,高温 异构化
Pt, 3H2 芳构化
CH3 Pt, 3H2 芳构化
Pt, 3H2 芳构化
CH3
三 单环芳烃的物理性质
单环芳烃一般为无色液体,比水轻,不溶于 水,溶于一般的有机溶剂
芳烃的熔点及沸点变化符合一般规律,在各 异构体中,对称性大者,熔点较高
二 单环芳烃的异构和命名
在-OH之前的基团与苯环相连时,苯环作为取代基命名 在-OH之后的基团与苯环相连时,则以苯环为母体命名 多取代苯确定主官能团后,按最低系列原则编号
选择母体的顺序如下:
-N+R3 、 -COOH、 -SO3H、 -COOR(酯)、 -COX(酰卤)、 -CONH2(酰胺)、 -CN、-CHO、 C=O、 -OH、 -NH2、 -OR、 -R、 -X、 -NO2 等
有机化学 第四章 芳香烃
第四章 芳香烃具有“芳香性”的碳氢化合物称芳香烃。
芳香性:难加成,难氧化,易取代;平面环p;特征光谱单环芳烃苯型芳烃多环芳烃非苯型芳烃芳烃3第一节 苯及其同系物一、苯的结构(一) 苯的 Kekulé 结构式简写为:H HH HHHH H碳为4有人提出质疑: 按照这个结构, 苯的二溴代物应有两种.结构式溴BrBrBr Br和但实际上只得到一种!预期的1,3,5-环己三烯键长数据134pm147pm(二) 苯分子结构的现代解释苯分子中6个C 都是sp 2杂化, 每个C 都以3个sp 2杂化轨道分别与2个相邻的C 和1个H 形成3个σ键,构成平面正六边形碳环结构。
每个C 还有1个未杂化的p 轨道,均垂直于碳环平面而相互平行。
每个p 都可与2个相邻C 的p 侧面重叠,形成一个包含6个原子6个π电子的闭合“大π键”。
o结构及性质特征:所有原子共平面; 形成环状大π键 碳碳键长全相等;环稳定、难加成、 难氧化、易取代虽然苯的结构在今天已得到完全阐明,但苯的结构式仍然采用当初Kekulé提出的式子。
或用圆圈代表环闭大π键的苯结构式。
苯的结构也可以用两个Kekulé 结构式的共振式或共振杂化体表示。
个共振式共振杂化体二、苯及其同系物的命名苯环上的氢原子被烃基取代后,所得产物为苯的同系物。
可分为一烃基苯、二烃基苯和多烃基苯等。
命名时,一般以苯作母体,将其它烃基作为取代基,称“某苯”。
3H 3C 3甲苯(toluene) 异丙苯(isopropylbenzene)二烃基苯有三种异构体,用邻或1,2-;间或1,3-;对或 1,4- 表示;间-二甲苯1,3-二甲苯m -二甲苯m -xylene对-二甲苯1,4-二甲苯p -二甲苯p -xylene 邻-二甲苯1,2-二甲苯o -二甲苯o -xylene CH 3CH 3CH 3CH 3CH 33具有三个相同烃基的取代苯也有三种异构体。
如:连-三甲苯1,2,3-三甲苯偏-三甲苯1,2,4-三甲苯均-三甲苯1,3,5-三甲苯CH 3CH 3CH 3CH 3CH 33CH 3H 3CCH 3(1,2,3-trimethylbenzene)若苯环上连接不同的烷基时,烷基名称的排列顺序按“优先基团”后列出的原则,其位置的编号应将简单的烷基所连的碳原子定为1-位,并以位号总和最小为原则来命名。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3 CH3
CH3 CH3
邻-二甲苯 1,2-二甲苯 o-二甲苯
间-二甲苯 1,3-二甲苯 m-二甲苯
CH3 CH3
CH3 CH3
CH3
CH3
对-二甲苯 1,4-二甲苯
p-二甲苯
CH3
CH3
连-三甲苯 1,2,3-三甲苯
CH3
偏-三甲苯 1,2,第4四-三章芳甲香烃苯
CH3
CH3
均-三甲苯 1,3,5-三甲苯
3-硝基苯甲酸
பைடு நூலகம்
第四章芳香烃
二、苯及其同系物的化学性质
(一)苯的亲电取代反应
1. 卤代反应
Cl
+Cl2
FeCl3 55 60℃
+HCl
氯苯
Br
+ Fe
Br2 55 60℃
+H Br
第四章芳香烃
溴苯
2. 硝化反应
+H O N O 2
H 2SO 4 50~60℃
N O 2
+H 2O
3. 磺化反应
硝基苯
OH
OH
NO2
NO2
第四章芳香烃
② 定位效应不一致时,定位作用取决于效 应强者
OH
OH
CH3
NO2
取决于-OH
取决于邻、对位定位基
指出硝化时硝基进入的主要位置
O CO
(最佳位置)
A
B
第四章芳香烃
指出硝化时硝基进入的主要位置
A
B
√
NO2
A
B
√
CH2
NO2
第四章芳香烃
应用二:选择合理的合成路线
NO2
CH3 CH CH CH3
3-丙烯基甲苯 1-甲基-3-丙烯基苯
(3) 苯环作取代基
CH 2 CHCHCHCH 3 CH 3
4-甲基-1-苯基-2-戊烯
第四章芳香烃
(4) 硝基 (-NO2) 或卤素 (-X) 一般只作 取代基不作母体
-SO3H、-COOH 或 –CHO肯定作 母体,编号为1
COOH NO2
1. 烷基苯的侧链氧化反应
CH3 α-H
KMnO4
COOH
CH2CH2CH3
KMnO4
CH(CH3)2
COOH COOH
C(CH3)3
KMnO4/ H+
C(CH3)3
CH3 第四章芳香烃
COOH
CH3
KMnO4 / H+
(-) KMnO4紫红色褪去
2. 烷基苯的侧链卤代反应
CH2CH3
+ Br2
光照 或加热
习题集不要求做的题目:6.(2)
第四章芳香烃
第四章
芳香烃
第四章芳香烃
化学 性质
结构 和
命名
Hückel 规则
芳香烃
稠环 芳香烃
定位 效应
第四章芳香烃
单环芳香烃
苯型芳香烃
芳香烃分类
多环芳香烃
非苯型芳香烃
第四章芳香烃
一、苯的结构和同系物的命名
1. 苯的结构
sp2
大π键
第四章芳香烃
139pm
2. 苯同系物的命名
3β
10
4
γα
蒽
γγ
9 10
α
α
8
1
4
β
β
3
7
2
β 6 α5
2
α4
3β
菲
1
第四章芳香烃
6
5
7
8
9 10
写出下列芳香烃的名称
CHCH3 + HBr Br
1-苯基-1-溴乙烷(99%)
反应机制:自由基取代反应
苄基自由基> 3°> 2°> 1° 第四章芳香烃
三、苯环亲电取代的定位效应
C H 3
+H N O 3
H 2SO 4 30℃
C H 3
N C O H 2 3+
+
C H 3
N O 2
N O 2
59%
37% 4%
C O O H
4. 烷基化反应(付-克反应)
+ CH3CH2Cl
无水AlCl3 25℃
CH2CH3 + HCl
+ CH3CH2CH2Cl 无水AlCl3
C H (C H 3)2 +
CH2CH2CH3
异丙苯(70%) 丙苯(30%)
NO2
SO3H
付-克反应
芳香性——易取代,难加成,难氧化
第四章芳香烃
(二)烷基苯侧链的反应
NO2
间-硝基苯甲酸
第四章芳香烃
?
CH3
?
C H 2C l
Cl
COOH NO2
Br
第四章芳香烃
四、稠环芳香烃 1. 定义
由两个或两个以上苯环共用两个 邻位碳原子而稠合成的多环芳香烃
萘
蒽
芘
≡
菲
第四章芳香烃
环戊烷并氢化菲
2. 命名
αα
8
1
β7
9
2β
β6
3β
10
α5
α4
萘
α
8
β7
β6
5
α
γα
9
1
2β
作用 ① 使苯环较难发生取代反应 ——钝化基团 ② 使新取代基进入其间位
COOH
+HNO3
H2SO4 95~100℃
COOH
NO2
(只写主要产物)
第四章芳香烃
试比较下列化合物硝化的活泼性
①
②
Br ③
NO2 ④
CH3
④>① >② >③
3. 定位效应的应用
应用一:预测亲电取代反应的主要产物
① 定位效应一致时,定位作用具有加和性
(1) 常见基团
芳基
aryl
Ar-
苯基
phenyl Ph- C6H5 -
苄基 (苯甲基) benzyl
CH2
(2) 苯、甲苯作母体
将连有最简单烷基的C定为第1位 意注
取代基位次总和最小
优先基团后第列四章芳出香烃
如何命名?
CH3(CH2)3
CH3 CH(CH3)2
1-甲基-5-(正)丁基-2-异丙基苯
+SO 3 浓H 2SO 4
SO 3H
+H 2O
SO 3H
+H 2O 180℃
(过热水蒸气)
第四章芳香烃
苯磺酸
+H 2SO 4
你知道吗?
H2N
NH2 NN
SO2NH2
百浪多息 用于治疗败血病 缺点:水溶性小,毒性较大
O
CH3CHN
NN
SO2NH2
NaO3S
SO3Na
可溶性百浪多息 磺胺类药
第四章芳香烃
C O O H
+H N O 3
H 2SO 4 95~ 100℃
C O O H
N O 2 +
C O O H
+
6.4%
N O 2 N O 2
0.3% 93.3%
定位基 定位效应 第四章芳香烃
1. 邻、对位定位基
结构特征 与苯环直接相连的原子多数含有未共用 电子对或带有负电荷 常见基团
-NH2、-NHR、-NR2、-OH(强烈致活的) - OR、-NHCOR (中等致活的) -CH3(-R)、-Ar (弱致活的) -X(Cl、 Br、I)(钝化的)
Cl ?
NO2
?
Cl
Cl
NO2
Fe
HNO3
Cl
Cl2
H2SO4
HNO3 H2SO4
NO2
Fe Cl2
第四章芳香烃
NO2 Cl
怎样用甲苯合成邻-硝基苯甲酸或 间-硝基苯甲酸?
CH3 HNO3
H2SO4
CH3 KMnO4 NO2
COOH NO2
邻-硝基苯甲酸
CH3 KMnO4
COOH
HNO3
COOH
H2SO4
第四章芳香烃
作用 ① 使苯环较易发生取代反应(卤素除外) ——活化基团 ② 使新取代基进入其邻位和对位
CH3
+HNO3
H2SO4 30℃
CH3
CH3 NO2
+
NO2
(只写主要产物)
第四章芳香烃
2. 间位定位基
结构特征 与苯环直接相连的原子一般含有双键或 三键或带有正电荷
常见基团
-NR3+、-NO2(强烈致钝的) -CN、-SO3H(中等致钝的) -COCH3 、 -COOH、-COOCH3、 -CHO (弱致钝的) 第四章芳香烃
