分析化学:第五章 氧化还原滴定法
氧化还原滴定法的原理

氧化还原滴定法的原理氧化还原滴定法是一种常用的分析化学方法,它通过测定被测物质与氧化还原试剂之间的氧化还原反应来确定被测物质的含量。
在实际应用中,氧化还原滴定法被广泛应用于医药、环境监测、食品安全等领域,具有操作简便、准确性高的特点。
氧化还原滴定法的原理基于氧化还原反应。
在这种反应中,氧化剂与还原剂之间发生电子的转移,从而使得氧化剂自身被还原,还原剂自身被氧化。
在滴定过程中,通过加入适量的氧化还原试剂,使得被测物质与试剂发生氧化还原反应,从而确定被测物质的含量。
氧化还原滴定法的关键在于选择适当的氧化还原试剂。
常见的氧化还原试剂包括高锰酸钾、碘量法、过碘酸盐滴定法等。
这些试剂在滴定过程中能够与被测物质发生明显的氧化还原反应,从而实现对被测物质含量的准确测定。
在进行氧化还原滴定法时,需要注意滴定条件的选择。
滴定条件包括溶液的浓度、滴定剂的添加速度、滴定终点的判定等。
这些条件的选择对于滴定结果的准确性有着重要的影响。
通常情况下,滴定条件的选择需要根据被测物质的性质和滴定试剂的特点来确定。
此外,氧化还原滴定法在实际应用中还需要考虑滴定终点的判定。
滴定终点是指滴定反应达到了完全的状态,此时试剂的添加量与被测物质的摩尔量成为化学计量比。
滴定终点的判定通常通过指示剂或者仪器来实现,其中指示剂可以根据颜色的变化来判断滴定终点是否已经达到。
总之,氧化还原滴定法是一种重要的分析化学方法,它通过测定被测物质与氧化还原试剂之间的氧化还原反应来确定被测物质的含量。
在实际应用中,选择适当的氧化还原试剂、滴定条件的合理选择以及滴定终点的准确判定是保证滴定结果准确性的关键。
希望本文的介绍能够帮助读者更深入地了解氧化还原滴定法的原理和应用。
分析化学 第五章 氧化还原滴定法

分析化学
上 页 下 页
通辽职业学院
另一方面,在HCl溶液中除Fe3+、Fe2+外,三价铁还以 Fe(OH)2+、FeCl2+、FeCl2+、FeCl4-、FeCl63-等存在形式, 而二价铁也还有Fe(OH)+、FeCl+、FeCl3-、FeCl42-等存在形 式。若用cFe(Ⅲ)、cFe(Ⅱ)分别表示溶液中三价铁Fe(Ⅲ)和二价 铁Fe(Ⅱ)各种存在形式的总浓度,则:
分析化学
通辽职业学院
式中:EOx/Red——氧化态Ox还原态Red电对的电极电位; Eθ Ox/Red——标准电极电位; aOx、aRed——氧化态Ox及还原态Red的活度,离子的活 度等于浓度c乘以活度系数γ,a=γc; R——摩尔气体常数,8.314 J· mol-1· K-1; T——热力学温度; F——法拉第常数,96 485 C· mol-1; n——半反应中电子的转移数。 将以上数据代入式中,在25℃时可得:
分析化学
通辽职业学院
分析中,要求氧化还原反应必须定量、迅速地进行,所以 对于氧化还原反应除了从平衡观点来了解反应的可能性外, 还应考虑反应的速率。下面具体讨论影响氧化还原反应速 率的因素。 1. 浓度对反应速率的影响 在一般情况下,增加反应物质的浓度可以加快反应速 率。例如,在酸性溶液中重铬酸钾和碘化钾反应:
通辽职业学院
现以在1 mol· L-1H2SO4溶液中,用0.1000 mol· L1 Ce(SO ) 标准溶液滴定20.00 mL 0.1000 mol· L 4 2 1FeSO 为例,讨论滴定过程中标准溶液用量和电极 4 电位之间量的变化情况。
滴定反应式:
两个电对的条件电极电位:
分析化学
分析化学 氧化还原滴定法
a 与 C的关系为:
aOx
Ox
Ox
C Ox Ox Ox
aRed
Red
Re d
C Red Red Red
-活度系数 -副反应系数
Ox / Re d
Ox / Re d
RT ln γOx Red cOx nF γ c Red Ox Red
Ox / Re d
RT ln γOxRed
Red
增大,
0
值增大。
Eg. 2Fe3+ + 2I = I2 + 2Fe2+
Fe3+ + e = Fe2+ φFe3+/Fe2+ =0.771V I2 + 2e = 2I- ΦI2/I- =0.54V
例如,用间接碘量法测定Cu2+时,反应为
2Cu2 4I
2CuI I2
若试液中有Fe3+共存时,Fe3+也可以氧化I-生成I2,
0' 0 0.059lg OxRed
n
Red Ox
从条件电位的定义式知道,影响条件电位的因素 就是影响电对物质的活度系数和副反应系数的因素。
主要包括:盐效应 酸效应 生成沉淀 生成配合物
活度系数 副反应系数
1.盐效应:溶液中的电解质浓度对条件电位 的影响作用。
电解质浓度 离子强度 活度系数
*以标准氢电极为参照电极的相对值。
2、书写Nernst方程式时注意的问题:
(1)固体、溶剂的活度为1mol/L;
(2)气体以大气压为单位;
(3)如果半电池中除了氧化态和还原态外, 还有其他组分如:H+、OH参加, 活度也要包 括到Nernst方程式中;
第五章 分析化学基础原理

测定,由于测定方法不同,溶液中存在的其它离子对
Fe3+测定的干扰情况是不同的。
§3.化学分析过程
1.用重量分析法测定 步骤如下: NH3++NH+ Fe3+ Fe(OH)3 灼烧 Fe2O3 称量
根据Fe2O3称量结果计算试样中Fe2O3的含量。在这样的 条件下,除了Fe3+ 以外,Al3+、Ti4+也生成氢氧化物沉淀, 干扰测定。 2.用氧化还原滴定法测定 步骤如下:
§3.化学分析过程
试样的分析过程,一般包括下列几个环节: 1.取样; 2.试样的分解; 3.测定;
4.计算分析结果,并对测定结果作出评价。
一、取样 在实际工作中,要分析的对象往往是很大量的、 不均匀的。而分析时所取的试样量是很少的。因此,在分 析以前,首先要保证所取的试样具有代表性。
§3.化学分析过程
从反应产物(P)的量来计算待测组分(X)的量。如果 反应产物是沉淀,则称量沉淀重量,从而计算待测组分 的含量。
§2.定量分析法
(二)滴定分析法(容量分析法) 根据某一化学计量反应: X + (待测组分) R = (试剂) P (反应产物)
将已知准确浓度的试剂(R)溶液滴加到待测溶液中,直 到所加的试剂恰好与待测组分按化学计量反应为止,根据 试剂溶液的浓度和体积计算待测组分的含量。
d i x i x (i 1,2, , n)
三、准确度和精密度的关系
准确度高精密度不一定高,反之亦然。实际分析 中,首先要求良好的精密度,精密度越好,得到准确结 果的可能性越大。所以,好的精密度是获得准确结果的 前提和保证。虽然好的精密度不一定能保证好的准确度, 但通过校正可以较准确地反映试样中的真实含量。
分析化学作业及答案

分析化学作业第一章 概述一、选择题1.根据置信度为 95% 对某项分析结果计算后,写出的合理分析结果表达式应为(B )。
a. ( 25.48 ± 0.1) % b. ( 25.48 ± 0.13 ) %c. ( 25.48 ± 0.135 )%d. ( 25.48 ± 0.1348 ) %2.分析测定中的偶然误差,就统计规律来讲,(d )。
a. 数值固定不变b. 数值随机可变c. 无法确定d. 正负误差出现的几率相等3. 某小于1的数精确到万分之一位,此有效数字的位数是( d )。
a.1b.2c.4d.无法确定4. 消除或减小试剂中微量杂质引起的误差常用的方法是( A )。
A.空白实验B.对照实验C.平行实验D.校准仪器5.可用于减小测定过程中偶然误差的方法是( D )。
A .对照实验 B. 空白实验 C .校正仪器 D. 增加平行测定次数6.对某试样进行平行三次测定,得 CaO 平均含量为 30.60% ,而真实含量为 30.30% ,则 30.60%-30.30% = 0.30% 为( B )。
A. 相对误差B. 绝对误差C. 相对偏差D. 绝对偏差二、判断正误1.在分析测定中,测定的精密度越高,则分析结果的准确度越高(x )。
2.有效数字是指所用仪器可以显示的数字( x )。
3.分析结果的置信度要求越高 , 置信区间越小(x )。
4.对某项测定来说,它的系统误差大小是不可测量的(x )。
第二章 滴定分析概论一、选择题1.欲配制 1000ml 0.1mol/L HCl 溶液,应取浓盐酸(B )。
a. 0.84mlb. 8.4mlc. 1.2m ld. 12ml2. .用NaC 2O 4( A )标定KMnO 4( B )时,其反应系数之间的关系为(a )。
a. n A =5/2n B b. n A =2/5n Bc. n A =1/2 n Bd. n A =1/5n B3. .已知1mLKMnO 4相当于0.005682g Fe 2+,则下列表示正确的是( b )。
《氧化还原滴定法》课件

酚酞指示剂
在弱酸性条件下,由无色变为粉红色,常用于 测定氧化剂和还原剂的滴定。
甲基橙指示剂
在酸性条件下,由红色变为黄色,常用于测定 还原剂的滴定。
二溴酚蓝指示剂
在强酸性条件下,由黄色变为蓝色,常用于测 定氧化剂和还原剂的滴定。
邻苯二酚指示剂
在碱性条件下,由无色变为蓝色,常用于测定 氧化剂的滴定。
常用的滴定试剂及其应用
滴定的控制误差和计算结果的 处理
滴定的控制误差主要包括滴定试剂的误差、指示剂的误差和操作误差。
为了减小滴定的误差,可以使用称量精确的试剂、选用敏感的指示剂,并尽 量减小搅拌或振荡时的人为误差。
滴定法在分析化学中的应用
滴定法广泛应用于分析化学中,可用于测定无机化合物、有机化合物、电解 质和非电解质的含量和浓度。
《氧化还原滴定法》PPT 课件
本课件将介绍氧化还原滴定法的基本原理,滴定的步骤和操作要点,常见的 氧化还原指示剂,以及常用的滴定试剂及其应用。
此外,我们还会学习如何计算滴定反应的过量试剂量,控制滴定误差以及处 理计算结果,并深入探讨滴定法在分析化学中的应用。
滴定的基本原理
滴定法是一种常用的定量分析方法,通过滴定试剂与被测物质进行化学反应,确定被测物质的含量。 滴定的速反应达到滴定终点,从而确定被 测物质的浓度。
滴定法具有快速、准确、经济的特点,是定量分析的重要手段,被广泛应用 于实验室和工业生产中。
高锰酸钾溶液
碘溶液
硫代硫酸钠溶液
常用于测定还原剂的浓度和含量。 常用于测定还原剂的浓度和含量。 常用于测定氧化剂的浓度和含量。
计算滴定反应的过量试剂量
滴定反应的过量试剂量是指在滴定终点之后,滴定试剂继续滴定并加入到被滴定溶液中的体积。 计算过量试剂量的方法是基于滴定反应的立方方程式,并考虑到滴定试剂的浓度和滴定反应的摩尔比例。
大学,分析化学第05章,酸碱平衡及酸碱滴定法

质子平衡 溶液中酸失去质子数目等于碱得到质子数目。 质子条件式(PBE)
(1) 先选零水准 (大量存在,参与质子转移的物质), 一般选取投料组分及H2O
(2) 将零水准得质子产物写在等式一边,失质子产物 写在等式另一边 (3) 浓度项前乘上得失质子数
例:Na2HPO4水溶液
零水准:H2O、HPO42[H+] + [H2PO4- ]+2[H3PO4] = [OH-] +[PO43-]
H2O
1 Kt = =10 14.00 Kw
H+ + Ac-
HAc
Kb 1 Kt = = Ka Kw
OH- + HAc
Ka 1 Kt = = Kb Kw H2O + Ac-
3 活度与浓度
活度:在化学反应中表现出来的有效浓度,
通常用a表示
a i = g i ci
溶液无限稀时: g =1 中性分子: g =1
+ -
-
gHB gA
+
K◦
4 质子条件式
物料平衡 (Material (Mass) Balance): 各物种的平衡浓度之和等于其分析浓度。 电荷平衡 (Charge Balance): 溶液中正离子所带正电荷的总数等于负离子所带 负电荷的总数(电中性原则)。 质子平衡 (Proton Balance): 溶液中酸失去质子数目等于碱得到质子数目。
分布分数-多元弱酸
二元弱酸H2A
H2AH++HA- H++A2- c H CO =[H2CO3]+[HCO3-]+[CO32-]
2 3
物料平衡 δH A
2
氧化还原滴定法的原理

氧化还原滴定法的原理氧化还原滴定法是一种常用的分析化学方法,它通过观察物质的氧化还原反应来确定物质的含量。
在这种方法中,通常会使用一种已知浓度的氧化剂或还原剂溶液,通过滴定的方式逐渐加入到待测物质溶液中,直到达到化学计量的终点。
在这个过程中,我们可以根据滴定液的消耗量来确定待测物质的含量。
氧化还原滴定法的原理基于氧化还原反应。
在这种反应中,氧化剂会接受电子,而还原剂会释放电子。
当氧化剂和还原剂发生反应时,电子的转移会导致氧化还原指示剂的颜色发生变化,从而可以确定化学计量的终点。
通过观察滴定过程中指示剂颜色的变化,我们可以准确地确定待测物质的含量。
氧化还原滴定法广泛应用于各种化学分析中。
例如,在生活中,我们可以利用氧化还原滴定法来确定水中氯离子的含量,从而判断水的卫生状况。
在工业生产中,氧化还原滴定法也被用来确定金属离子的含量,以保证产品质量。
此外,氧化还原滴定法还可以用于医学、环境监测等领域。
在进行氧化还原滴定法分析时,我们需要注意一些关键的因素。
首先,选择合适的氧化剂或还原剂溶液非常重要,它们的浓度和滴定过程中的稳定性会直接影响到分析结果的准确性。
其次,选择合适的指示剂也是至关重要的,它应当能够在化学计量终点时准确地显示颜色变化。
此外,滴定过程中的操作技巧和仪器精度也会对结果产生影响,因此需要严格控制实验条件。
总的来说,氧化还原滴定法是一种简单而有效的分析方法,它通过观察氧化还原反应的化学计量终点来确定待测物质的含量。
在实际应用中,我们需要选择合适的试剂和指示剂,并严格控制实验条件,以确保分析结果的准确性和可靠性。
通过对氧化还原滴定法原理的深入理解和实践操作,我们可以更好地应用这种方法进行化学分析,并取得准确的分析结果。
氧化还原滴定法

氧化还原滴定法氧化还原滴定法是一种定量分析方法,常用于测定含氧化还原反应的物质的浓度。
在氧化还原反应中,电子会从被氧化的化合物转移到还原的化合物上,因此被称为氧化还原反应。
该方法通过滴加一种称为滴定剂的溶液来确定待测物质的浓度。
滴定剂与待测物质发生氧化还原反应,当待测物质的化合价发生改变时,滴定剂就不再反应,此时滴定完成。
原理氧化还原滴定法的原理基于以下事实:在氧化还原反应中,电子会从一个原子或分子转移到另一个原子或分子上,这样产生了电子的转移和化学计量量的变化。
因此,滴定剂可以被用来测定待测物质的化学计量量。
氧化还原反应中,电子可以从还原剂转移到氧化剂。
还原剂是一种能够给予电子的物质,它通常是一种容易氧化的物质,其化合价低于其氧化态。
氧化剂则是一种吸收电子的物质,通常是一种含氧化合物,其化合价高于其还原态。
在氧化还原滴定法中,将待测物质溶于适当的溶剂中,加入过量的还原剂,然后再滴加氧化剂,滴定至反应终点。
滴定时应注意滴定剂的选择,其氧化还原电位应当介于待测物质和还原剂之间。
当滴定剂的量与待测物质的量恰好相等时,反应终点即可确定,此时滴定完成。
操作步骤1.准备待测物质溶液,加入适当的溶剂并充分溶解;2.加入过量的还原剂;3.将寻找合适的滴定剂并确定滴定方法;4.开始滴定,滴定至反应终点(反应终点可以通过颜色变化、电位变化、气体产生等特征来确定);5.通过滴定前后的重量差或溶液浓度计算待测物质的化学计量量。
应用氧化还原滴定法广泛应用于分析化学、药学、食品工业、环境检测等领域。
例如,在药学中,可以用过氧化氢作为氧化剂来测定药物中的铁含量,氯亚铁作为还原剂来测定汞含量。
在环境检测中,可以使用铁离子和硫酸根离子来测定自然水样中的硫酸盐含量。
氧化还原滴定法是一种定量分析方法,可以通过滴加滴定剂来确定待测物质的浓度。
该方法基于化学计量量的变化,将还原剂加入待测物质溶液中,并滴加氧化剂,滴定至反应终点。
氧化还原滴定法在分析化学、药学、食品工业和环境检测等领域发挥着重要作用。
分析化学四大滴定总结

分析化学四大滴定总结滴定分析法又称为容量分析法,是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。
这其中又有重要的四大滴定方法。
以下是店铺整理的分析化学四大滴定总结,欢迎查看。
一、酸碱滴定原理:利用酸和碱在水中以质子转移反应为基础的滴定分析方法。
可用于测定酸、碱和两性物质。
其基本反应为H﹢+OH﹣=H2O也称中和法,是一种利用酸碱反应进行容量分析的方法。
用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。
最常用的酸标准溶液是盐酸,有时也用硝酸和硫酸。
标定它们的基准物质是碳酸钠Na2CO3。
方法简介:最常用的碱标准溶液是氢氧化钠,有时也用氢氧化钾或氢氧化钡,标定它们的基准物质是邻苯二甲酸氢钾KHC8H4O6或草酸H2C2O·2H2O:OH+HC8H4O6ˉ→C8H4O6ˉ+H2O如果酸、碱不太弱,就可以在水溶液中用酸、碱标准溶液滴定。
离解常数 A和Kb是酸和碱的强度标志。
当酸或碱的浓度为0.1M,而且A或Kb大于10-7时,就可以准确地滴定,一般可准确至0.2%。
多元酸或多元碱是分步离解的,如果相邻的离解常数相差较大,即大于104,就可以进行分步滴定,这种情况下准精确度不高,误差约为1%。
盐酸滴定碳酸钠分两步进行:﹢ˉCO32-+H→HCO3HCO3ˉ+H﹢→CO2↑+H2O相应的滴定曲线上有两个等当点,因此可用盐酸来测定混合物中碳酸钠和碳酸氢钠的含量,先以酚酞(最好用甲酚红-百里酚蓝混合指示剂)为指示剂,用盐酸滴定碳酸钠至碳酸氢钠,再加入甲基橙指示剂,继续用盐酸滴定碳酸氢钠为二氧化碳,由前后消耗的盐酸的体积差可计算出碳酸氢钠的含量。
某些有机酸或有机碱太弱,或者它们在水中的溶解度小,因而无法确定终点时,可选择有机溶剂为介质,情况就大为改善。
这就是在非水介质中进行的酸碱滴定。
有的非酸或非碱物质经过适当处理可以转化为酸或碱。
然后也可以用酸碱滴定法测定之。
分析化学名词解释(严拯宇)

第一章误差和分析数据处理准确度(accuracy):测量值与真实值接近的程度(用误差来表示)。
精密度(precision):测定条件相同时,一组平行测定值之间相互接近的程度(用偏差来表示)。
绝对误差(absolute error):测量值与真实值之差。
相对误差(relative error):绝对误差与真实值的比值。
系统误差(systematic error):由某种确定原因引起的误差。
偶然误差(accidental error):也叫随机误差,是由于偶然的原因引起的误差。
有效数字(significant figure):指在分析工作中实际能测量到的数字(保留1位欠准数字)。
置信区间:在一定置信水平时,以测量结果为中心,包括总体均值在内的可信范围。
相关系数:描述两个变量间相关性的参数。
第二章酸碱滴定法酸碱:凡能给出质子的物质是酸,能接受质子的物质是碱。
酸的浓度:在一定体积的溶液中含某种酸溶质的量为酸的浓度。
酸度:溶液中氢离子的浓度,严格讲是氢离子活度,用pH表示。
溶剂的质子自递反应(autoprotolysis reaction):在溶剂分子间发生的质子转移反应称为溶剂的质子自递反应。
分布系数:溶液中某种酸碱组分的平衡浓度占其总浓度的分数。
质子条件式(proton balance equation):酸碱反应达到平衡时,酸失去的质子数等于碱得到的质子数。
表达这种酸与碱之间质子得失的关系式为质子条件式。
酸碱指示剂(acid-base indicator):是一些有机弱酸或弱碱,其共轭酸与其共轭碱具有不同的结构,呈现不同的颜色。
指示剂的变色范围(color change interval):酸碱指示剂的变色范围指酸碱指示剂发生颜色突变的pH范围。
酸碱滴定突跃和突跃范围:在酸碱滴定过程中,溶液pH的突变称为滴定突跃;突跃所在的pH范围为突跃范围。
化学计量点(stoichiometric point):当化学反应按计量关系完全作用,即滴入标准溶液物质的量与待测组分物质的量恰好符合化学反应式所表示的计量关系,称反应达到了化学计量点。
武汉大学分析化学第五版上册第五章酸碱滴定

[例1]计算0.10mol/L的HCl和0.20mol/L的 CaCl2混合溶液的离子强度. [解] [Cl-]=0.10+(2×0.20)=0.50mol/L 1 I= — (cH+ZH+2+cCl-ZCl-2+cca2+Zca2+2 ) 2 1 = — (0.10×1+0.50×1+0.20×22 ) 2 =0.70
19
活度常数又叫热力学常数,它的大小 与温度有关
20
2.浓度常数Kac [H+ ][ A- ] Kac =————— [HA] 各项分别为平衡时物质的量浓度
Kac与K0的关系:
HA K0 c 0 Ka K H A H A
浓度常数不仅与温度有关,还与溶液的 离子强度有关。
6
α=γci
γ<1,则α<c
① 浓度极稀的强电解质溶液 (c<10-4mol/L)
中性分子
1, c
② 高浓度溶液中离子的活度系数还没有令人满意 的定量计算的公式
7
③ 稀AB型电解质溶液(c<0.1mol/L) 可根据德拜-休克尔公式求出
o
l g i AZ i
2
I 1 Ba I
0.0200 0.512 1 1 0.00328 400 0.0200 0.605
2
H
2 BO 3
0.870
I lg i 0.512Zi 1 0.00328a I
2
11
I lg i 0.512Zi 1 0.00328a I
2
[例3]0.050mol/L的AlCl3溶液中αCl-和αAl3+ [解]αCl- =γCl-[Cl-] =γCl- ×3×0.050
氧化还原

2 [ H ] H 3 AsO3 0.0592 cH 3 AsO3 0.0592 lg lg 2 HAsO 2 2 cHAsO 2 2 [ H ] H 3 AsO3 0 . 0592 lg 2 HAsO 2
+e
Fe2+
( Fe3 / Fe2) 0.77V
3 [ Fe ] 0.0592lg [ Fe2 ]
0.0592 lg
2 3 3 2
cFe3 Fe2 cFe2 Fe3
Fe cFe 0.0592lg 0.0592 lg Fe cFe
O EO V ,求 pH 1 . 0 和 4 . 0 时的 E 2 1.51 MnO /Mn
4
解:
8 [ MnO ][ H ] 0 . 059 O 4 EE lg 5 [Mn 2 ]
MnO4 + 8H+ + 5e = Mn2+ + 4H2O
-
[ MnO 0 . 059 0 . 059 O 8 4 ] E lg[H ] lg 5 5 [Mn 2 ]
0.0592 ( 3 11 ) 0.35 v 1 1 0.0592 ( 3 2 2) 0.18 v 2 2
0.0592 ( 3 1 2) 0.27 v 1 2
一般认为若两电对的条件电位的差值 大于 0.40v, 反应就能定量完成,符合滴 定分析的要求。
分析化学:氧化还原滴定法
×5) C2O422e→2CO2↑ (+
2MnO4+16H++ 5C2O42 →2Mn2++10CO2↑
碱性条件则最后两边同加OH
+8H2O
二、条件电位及其影响因素
1. 条件电位 对于电极反应 aOx+ne bRed
其Nernst方程:
Ox/ Re θO d x/ R 0.e 0 nd5 lg a a 9 R b O a exd(2ο5 C )
( θO/xRed0.0 n5l9 gO O aa x xR b rbeed )d O x/R (条e件d 电位)
条件电位φ’Ox/Red随离子强度、pH、副反应系数而变。
2. 影响φ’Ox/Red因素
⑴盐效应 仅考虑此影响时:
θ
0.0n59lgRbO aexd
但γOx,γRed精确值难求,又各种副反应的影响 远大于盐效应∴常忽略盐效应,忽略后的计算式:
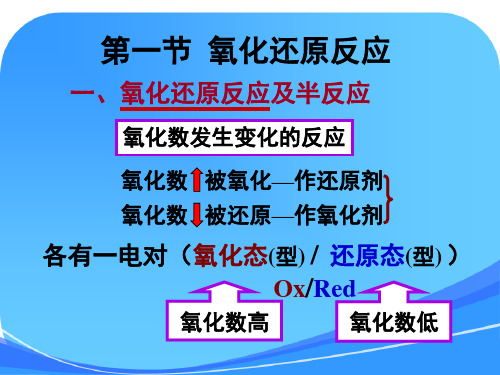
第一节 氧化还原反应
一、氧化还原反应及半反应
氧化数发生变化的反应
氧化数 被氧化—作还原剂
氧化数 被还原—作氧化剂
各有一电对(氧化态(型) / 还原态(型) )
Ox/Red
氧化数高
氧化数低
例: Ce4+ + Fe2+
Ce3+ + Fe3+
OX1 Red2
Red1 OX2
Ce4+的氧化值↓,它被还原,作氧化剂;
θ Cu2+/Cu+
=
0.16V
I2+2e 2I
φθ I2/I
=
0.54V
反应2Cu2++2I 2Cu++I2 似乎不能进行,但由于
分析化学教材(系列一)Word版
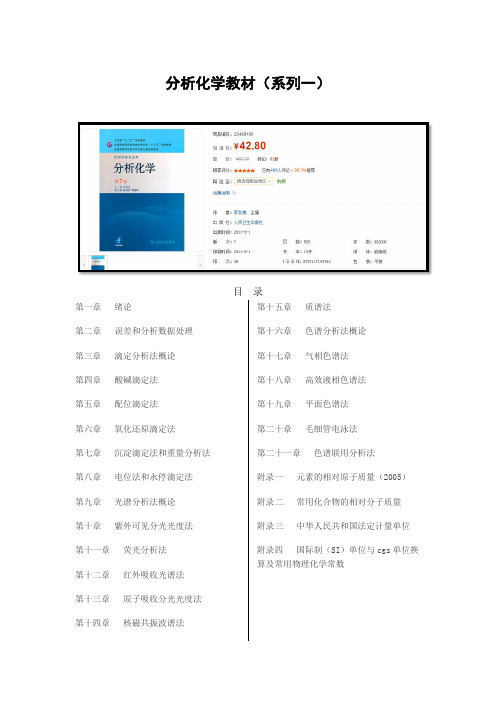
分析化学教材(系列一)目 录第一章 绪论第二章 误差和分析数据处理 第三章 滴定分析法概论 第四章 酸碱滴定法 第五章 配位滴定法 第六章 氧化还原滴定法 第七章 沉淀滴定法和重量分析法 第八章 电位法和永停滴定法 第九章 光谱分析法概论 第十章 紫外可见分光光度法 第十一章 荧光分析法 第十二章 红外吸收光谱法 第十三章 原子吸收分光光度法第十四章核磁共振波谱法第十五章 质谱法 第十六章 色谱分析法概论 第十七章 气相色谱法 第十八章 高效液相色谱法 第十九章 平面色谱法 第二十章 毛细管电泳法 第二十一章 色谱联用分析法 附录一 元素的相对原子质量(2005) 附录二 常用化合物的相对分子质量 附录三 中华人民共和国法定计量单位 附录四 国际制(SI )单位与cgs 单位换算及常用物理化学常数附录五常用酸、碱在水中的离解常数(25℃)附录六配位滴定有关常数附录七常用电极电位附录八难溶化合物的溶度积常数(25℃,I=0)附录九标准缓冲溶液的pH(0—95℃)附录十主要基团的红外特征吸收峰附录十一质子化学位移表附录十二质谱中常见的中性碎片与碎片离子附录十三气相色谱法用表参考文献英文索引中文索引目录第三版前言第二版前言第一版前言第1章绪论第2章误差和分析数据处理第3章重量分析法第4章滴定分析法概论第5章酸碱滴定法第6章络合滴定法第7章沉淀滴定法第8章氧化还原滴定法第9章取样与样品预处理方法附录附录Ⅰ中华人民共和国法定计量单位附录Ⅱ分析化学中常用的物理化学常数及物理量附录Ⅲ国际相对原子质量表附录Ⅳ常用相对分子质量表附录Ⅴ酸、碱在水中的离解常数附录Ⅵ常用标准缓冲溶液的pH(0~60℃)附录Ⅶ络合滴定有关常数附录Ⅷ标准电极电位及条件电位表附录Ⅸ难溶化合物的溶度积(Ksp) 符号表第1章概论1.1 定量分析概述1.1.1 分析化学的任务和作用1.1.2 定量分析过程1.1.3 定量分析方法1.2 滴定分析法概述1.2.1 滴定分析法对反应的要求和滴定方式1.2.2 基准物质和标准溶液1.2.3 滴定分析中的体积测量1.2.4 滴定分析的计算思考题习题第2章误差与分析数据处理2.1 有关误差的一些基本概念2.1.1 误差的表征——准确度与精密度2.1.2 误差的表示——误差与偏差2.1.3 误差的分类——系统误差与随机误差2.2 随机误差的分布2.2.1 频率分布2.2.2 正态分布2.2.3 随机误差的区间概率2.3 有限数据的统计处理2.3.1 数据的集中趋势和分散程度的表示——对μ和σ2.3.2 总体均值的置信区间——对μ的区别间估计2.3.3 显著性检验2.3.4 异常值的检验2.4 测定方法的选择与测定准确度的提高2.5 有效数字思考题习题第3章酸碱平衡与酸碱滴定法3.1 酸碱反应3.1.2 酸碱反应的平衡常数3.1.3 活度与浓度,平衡常数的几种形式3.2 酸度对弱酸(碱)形态分布的影响3.2.1 一元弱酸溶液中各种形态的分布3.2.2 多元酸溶液中各种形态的分布3.2.3 浓度对数图3.3 酸碱溶液的H+浓度计算3.3.1 水溶液中酸碱平衡处理的方法3.3.2 一元弱酸(碱)溶液pH的计算3.3.3 两性物质溶液pH的计算3.3.4 多元弱酸溶液pH的计算3.3.5 一元弱酸及其共轭碱(HA+A)混合溶液pH的计算3.3.6 强酸(碱)溶液pH的计算3.3.7 混合酸和混合碱溶液pH的计算3.4 酸碱缓冲溶液3.4.1 缓冲容量和缓冲范围3.4.2 缓冲溶液的选择3.4.3 标准缓冲溶液3.5 酸碱指示剂3.5.1 酸碱指示剂的作用原理3.5.2 影响指示剂变色间隔的因素3.5.3 混合指示剂3.6 酸碱滴定曲线和指示剂的选择3.6.1 强碱滴定强酸或强酸滴定强碱3.6.2 一元弱酸(碱)的滴定3.6.3 滴定一元弱(弱碱)及其与强酸(强碱)混合物的总结3.6.4 多元酸和多元碱的滴定3.7 终点误差3.7.1 代数法计算终点误差图及其应用3.7.2 终点误差公式和终点误差图及其应用3.8 酸碱滴定法的应用3.8.1 酸碱标准溶液的配制与标定……第4章络合滴定法第5章氧化还原滴定法第6章沉淀重量与沉淀滴定法第7章分光光度法第8章分析化学中常用的分离方法第9章其他常用仪器分析方法附录目录编写说明第1章绪论第1节分析化学的任务与作用第2节分析化学方法的分类第3节试样分析的基本程序第4节分析化学的发展与趋势第2章误差和分析数据的处理第1节误差第2节测量值的准确度和精密度第3节有效数字及其运算法则第4节分析数据的统计处理与分析结果的表示方法第5节相关与回归思考与练习第3章重量分析法第1节挥发法第2节萃取法第3节沉淀法思考与练习第4章滴定分析法概论第1节滴定反应类型与滴定方式第2节基准物质与标准溶液第3节滴定分析的计算思考与练习第5章酸碱滴定法第1节水溶液中的酸碱平衡第2节基本原理第3节滴定终点误差第4节应用与示例第5节非水滴定法思考与练习第6章沉淀滴定法第1节基本原理第2节应用与示例思考与练习第7章配位滴定法第1节配位平衡第2节基本原理第3节滴定条件的选择第4节应用与示例思考与练习第8章氧化还原滴定法第9章电位法和永停滴定法参考资料附录目录符号缩写或简称第一篇概述第1章分析化学的目的及其对社会的重要性1.1 分析化学的目的:对社会的基本重要性1.2 分析化学的目的:作为问题解决者的分析化学家1.3 非常规实验实应用分析化学的目的参考文献第2章分析过程2.1 概述2.2 全分析过程2.3 工作特性2.4 分析化学中的误差参考文献第3章质量保证和质量控制3.1 分析化学的质量和目标3.2 分析方法3.3 如何保证准确度3.4 质是保证和质是控制受规章限制的方面3.5 结论参考文献第二篇化学分析第4章化学分析的基本原理第5章色谱法第6章动力学与催化第7章化学分析的方法及其应用第三篇物理分析第8章元素分析第9章化合物和分子特效分析第10章微束流和表面分析第11章结构分析第四篇基于计算机的分析化学(COBAC)第12章化学计理学第13章计算机软硬件及分析仪器接口第五篇全分析系统第14章联用技术第15章微分析系统第16章过程分析化学VI. 附录汉英索引英汉索引目录总序出版说明第二版前言第一版前言符号表绪论0.1 分析化学的任务与作用0.2 分析方法的分类0.3 发展中的分析化学1 分析质量保证1.1 分析化学中关于误差的一些基本概念 1.2 有效数字及其运算规则1.3 分析数据的统计处理1.4 提高分析结果准确度的方法小结习题分析化学前沿领域简介——化学计量学2 化学分析法2.1 滴定分析概述2.2 滴定分析的基本理论2.3 确定滴定终点的方法2.4 滴定条件选择2.5 滴定分析的应用2.6 重理分析法小结习题化学大师Liebig3 分离分析方法3.1 分析试样的制备和分解3.2 沉淀分离法3.3 溶齐萃取分离法3.4 离子交换分离法3.5 挥发和蒸馏分离法3.6 气相色谱法3.7 高效液相色谱法3.8 色谱分离技术发展简介3.9 膜分离法3.10 激光分离法3.11 复杂试样分析实例3.12 分离技术的发展趋势小结习题科学家及其思维方法简介——色谱学家马丁4 原子光谱分析法4.1 原子吸收分光光度法4.2 原子发射光谱分析法小结习题著名化学家本生对分析化学的贡献5 分子光谱分析法5.1 紫外-可见分光光度法5.2 红外光谱法5.3 分子发光分析法小结习题光分析化学前沿简介——光化学传感器6 核磁共振谱法6.1 基本原理6.2 核磁共振谱仪6.3 化学位移6.4 自旋偶合与自旋裂分6.5 核磁共振谱图解析6.6 13C核磁共振谱小结习题生物分子的革命性分析方法7 质谱法7.1 基本原理7.2 质谱仪7.3 离子的主要类型7.4 有机化合物质谱7.5 质谱图解析7.6 飞行时间质谱简介7.7 UV、IR、NMR和MS四谱综合解析小结习题科学展望——2000年诺贝尔化学奖简介8 电化学分析法8.1 电位分析法8.2 极谱法和伏安法8.3 库仑分析法8.4 电分析化学新进展小结习题2003年诺贝尔化学奖得主阿格雷和麦金农参考文献附录后记目录第1篇分析化学基础第1章分析化学导言1.1 分析化学的定义、任务和作用1.2 分析化学的特点和分类1.3 分析化学的发展趋势1.4 学习分析化学课程的方法思考题第2章试样的采集、制备与分解2.1 试样的采集2.2 固体物料试样的制备2.3 试样的分解思考题第3章定量分析中的误差及数据处理3.1 误差的基本概念3.2 误差的传递3.3 有效数字的表示与运算规则3.4 随机误差的正态分布3.5 少量数据的统计处理3.6 数据的评价——显著性检验、异常值的取舍3.7 回归分析3.8 提高分析结果准确度的方法思考题习题第2篇化学分析法第4章化学分析法概述4.1 化学分析法概述4.2 滴定分析法概述4.3 标准溶液与基准物4.4 化学分析法的计算思考题习题第5章酸碱滴定法第6章配位滴定法第7章氧化还原滴定法第8章沉淀滴定法第9章重量分析法第3篇仪器分析法第10章仪器分析法概述第11章紫外可见吸收光谱法第12章原子吸收光谱法第13章电位分析法第14章气相色谱法第4篇复杂物质分析第15章定量分析中的分离及富集方法第16章复杂物质分析示例附录参考文献目录第1章绪论第1节分析化学的任务和作用第2节分析化学的分类一、化学分析与仪器分析二、定性分析、定量分析和结构分析三、无机分析和有机分析四、常量分析、半微量分析和微量分析五、例行分析和仲裁分析第3节试样分析的基本程序一、取样二、分析试液的制备三、分析测定四、分析结果的计算与评价第4节分析化学的发展与趋势第2章误差和分析数据的处理第1节概述第2节定量分析误差一、系统误差和偶然误差二、绝对误差和相对误差三、准确度与精密度四、提高分析准确度的方法第3节有效数字及其运算法则一、有效数字二、有效数字的运算法则三、有效数字的运算法则在分析化学中的应用第4节分析数据的统计处理与分析结果的表示方法一、偶然误差的正态分布二、实验数据的统计处理三、可疑值的取舍四、分析数据处理与报告第3章重量分析法第1节概述第2节挥发法一、定义二、操作过程三、应用第3节萃取法一、定义及分类二、操作过程三、应用第4节沉淀法一、沉淀重量法二、沉淀的溶解度及影响因素三、沉淀的纯度及其影响因素四、沉淀的类型与沉淀条件五、沉淀法中的计算第5节应用一、药物含量测定二、药物纯度检查第4章滴定分析法概论第1节概述第2节滴定方式一、直接滴定法二、反滴定法三、置换滴定法四、间接滴定法第3节基准物质和标准溶液一、基准物质二、标准溶液三、标准溶液浓度的表示第4节滴定分析中的计算一、计算依据二、计算示例第5章酸碱滴定法第1节概述第2节水溶液中的酸碱平衡一、酸碱质子理论二、溶液中酸碱组分的分布三、酸碱溶液中H+浓度的计算第3节酸碱指示剂一、酸碱指示剂的变色原理二、酸碱指示剂的理论变色点和变色范围三、影响指示剂变色范围的因素四、混合指示剂第4节酸碱滴定法的基本原理……第6章沉淀滴定法第7章配位滴定法第8章氧化还原滴定法第9章电位分析法第10章紫外-可见分光光度法第11章荧光分析法第12章红外分光光度法第13章原子吸收分光光度法第14章经典液相色谱法第15章气相色谱法第16章高效液相色谱法第17章其他分析方法实验部分参考文献附录《分析化学》教学基本要求目录第一章绪论第一节分析化学的任务和作用第二节分析方法的分类一、定性分析、定量分析和结构分析二、无机分析和有机分析三、常量、半微量、微量、超微量分析四、化学分析和仪器分析五、例行分析、仲裁分析和快速分析第三节分析化学的发展趋势一、分析理论与其他学科相互渗透二、分析技术的发展趋势本章小结思考题与习题第二章定量分析误差和分析数据的处理第一节定量分析误差的种类和来源一、系统误差二、随机误差第二节准确度与精密度一、准确度与误差二、精密度与偏差三、准确度与精密度的关系第三节随机误差的正态分布一、频率分布二、正态分布三、随机误差的区间概率第四节有限测定数据的统计处理一、置信度与μ的置信区间二、可疑测定值的取舍三、显著性检验第五节提高分析结果准确度的方法一、选择适当的分析方法二、减小测量的相对误差三、检验和消除系统误差四、减小随机误差第六节有效数字及其运算规则一、有效数字的意义和位数二、数字修约规则三、有效数字的运算规则本章小结思考题与习题第三章滴定分析法概论第一节滴定分析法的分类及滴定方式一、滴定分析法的分类二、滴定分析法对化学反应的要求三、滴定方式第二节滴定分析的标准溶液一、标准溶液浓度的表示方法二、化学试剂的规格与基准物质三、标准溶液的配制第三节滴定分析的有关计算一、滴定分析计算的理论依据二、滴定分析计算示例本章小结思考题与习题第四章酸碱滴定法第一节酸碱反应及其平衡常数一、酸碱反应及其实质二、酸碱反应的平衡常数以及共轭酸碱对Ka与Kb的关系第二节酸碱溶液中各型体的分布系数与分布曲线一、一元弱酸(碱)溶液中各型体的分布系数与分布曲线二、多元酸(碱)溶液中各型体的分布系数与分布曲线第三节酸碱溶液pH的计算一、质子等衡式(质子条件式)二、酸碱溶液pH的计算第四节酸碱指示剂一、酸碱指示剂的作用原理二、影响酸碱指示剂变色范围的因素三、混合酸碱指示剂第五节酸碱滴定原理及指示剂选择一、强碱与强酸的滴定二、强碱(酸)滴定一元弱酸(碱)三、多元酸(碱)的滴定四、酸碱滴定中CO2的影响第六节酸碱滴定法的应用一、酸(碱)标准溶液的配制及标定二、酸碱滴定法应用实例本章小结思考题与习题第五章配位滴定法第一节概述第二节 EDTA及其配合物一、乙二胺四乙酸(EDTA)的结构与性质二、EDTA在水溶液中各存在型体的分布系数三、EDTA与金属离子形成螯合物的特点第三节 EDTA与金属离子的配位平衡一、配合物的稳定常数二、溶液中各级配合物浓度的计算第四节影响配位平衡的主要因素一、酸效应及酸效应系数二、配位效应及配位效应系数三、配合物的条件稳定常数第五节配位滴定原理一、配位滴定曲线二、影响配位滴定突跃范围的主要因素三、准确滴定金属离子的判据四、配位滴定中适宜pH范围第六节金属指示剂一、金属指示剂的作用原理二、金属指示剂应具备的条件三、金属指示剂的选择四、金属指示剂的封闭、僵化和氧化变质现象五、常用的金属指示剂第七节提高配位滴定选择性的方法一、控制溶液酸度二、利用掩蔽和解蔽作用三、采用其他配位剂四、分离干扰离子第八节配位滴定法的应用一、EDTA标准溶液的配制、标定二、各种配位滴定方式三、配位滴定法应用实例本章小结思考题与习题第六章氧化还原滴定法第一节氧化还原反应的特点一、标准电极电势和条件电极电势二、氧化还原反应进行的方向三、氧化还原反应进行的程度四、氧化还原反应速率第二节氧化还原滴定原理一、氧化还原滴定曲线二、化学计量点时溶液电势的计算三、影响氧化还原滴定突跃范围的因素第三节氧化还原滴定的指示剂一、自身指示剂二、特殊指示剂三、氧化还原指示剂第四节常见氧化还原滴定法及其应用一、高锰酸钾法二、重铬酸钾法三、碘量法本章小结思考题与习题第七章沉淀滴定法第一节沉淀滴定法基本原理第二节银量法一、莫尔法二、佛尔哈德法三、法扬司法第三节沉淀滴定法的应用一、标准溶液的配制与标定二、应用示例本章小结思考题与习题第八章分析化学中的常用分离方法第一节沉淀分离法一、无机沉淀剂分离二、有机沉淀剂分离三、共沉淀分离第二节液?液萃取分离法一、萃取分离法的基本原理二、萃取体系的分类和萃取条件的选择三、萃取分离技术四、溶剂萃取在分析化学中的应用第三节离子交换分离法一、离子交换剂的种类和性质二、离子交换树脂的亲和力三、离子交换分离操作技术四、离子交换分离法的应用第四节常规色谱法一、柱色谱法二、纸色谱法三、薄层色谱法本章小结思考题与习题第九章电势分析法第一节电势分析法基本原理一、直接电势法二、电势滴定法三、电池电动势的测量第二节参比电极和指示电极一、参比电极二、指示电极第三节直接电势法及应用一、溶液pH值的测定二、离子活度(浓度)的测定三、直接电势法的应用第四节电势滴定法一、电势滴定法的原理二、电势滴定终点的确定三、电势滴定法的应用本章小结思考题与习题第十章吸光光度分析法第一节吸光光度法的基础知识一、光的基本性质二、光的互补作用与溶液的颜色三、光的吸收曲线第二节光的吸收定律一、朗伯?比耳定律二、朗伯?比耳定律的推导三、吸光度与透光度四、吸光系数、摩尔吸光系数及桑德尔灵敏度第三节显色反应及影响因素一、吸光光度法对显色反应的要求二、影响显色反应的主要因素三、显色剂第四节吸光光度分析法及仪器一、吸光光度分析的类型二、吸光光度分析的定量分析方法三、分光光度计的构造四、分光光度计的类型第五节吸光光度法测量误差及测量条件的选择一、吸光光度法的测量误差二、测量条件的选择第六节吸光光度法的应用一、示差吸光光度法二、多组分的分析三、配合物组成的测定本章小结思考题与习题第十一章原子吸收分光光度法第一节基本原理一、共振发射线与吸收线二、基态原子与激发态原子的关系三、原子吸收线的宽度四、原子吸收的测量五、灵敏度和检出限第二节原子吸收分光光度计一、光源二、原子化器三、分光系统四、检测系统五、读数装置六、原子吸收分光光度计的类型第三节仪器测量条件的选择一、分析线的选择二、灯电流的选择三、原子化条件的选择四、燃烧器高度的选择五、进样量六、单色器狭缝宽度与光谱通带的选择第四节定量分析方法一、标准工作曲线法二、标准加入法第五节干扰及消除方法一、光谱干扰二、化学干扰、物理干扰及电离干扰第六节原子吸收分光光度法的应用一、测定生物样品中的化学元素二、有机物分析本章小结思考题与习题第十二章气相色谱分析法第一节色谱法概述一、色谱法原理介绍二、色谱法的分类第二节气相色谱法的特点及基本原理一、气相色谱法的特点二、气相色谱法的基本原理第三节气相色谱的实验技术一、色谱系统二、实验技术要点三、程序升温和衍生物制备第四节气相色谱法的应用一、定性分析二、定量分析三、气相色谱分析误差产生的原因第五节气相色谱法的新进展一、顶空气相色谱二、气相色谱?质谱联用技术三、气相色谱?红外光谱联用技术本章小结思考题与习题第十三章高效液相色谱法第一节高效液相色谱法的技术参数一、速率理论二、柱外效应三、分离度四、系统适应性实验第二节高效液相色谱法的色谱系统一、高压泵二、梯度洗脱装置三、进样器四、色谱柱五、检测器六、数据处理系统和结果处理第三节高效液相色谱法的分离方式一、吸附色谱法二、分配色谱法三、离子色谱法四、尺寸排阻色谱法五、亲和色谱法第四节样品预处理与色谱柱的保护一、样品预处理二、色谱柱的保护第五节液相色谱分析技术的新进展一、液相色谱?质谱联用技术概述二、超临界流体色谱法概述三、高效毛细管液相色谱法概述本章小结思考题与习题第十四章现代仪器分析简介第一节光分析法导论一、电磁波的辐射能特性二、光分析法的分类第二节原子发射光谱法一、基本原理二、原子发射光谱仪三、应用第三节原子荧光光谱法一、基本原理二、原子荧光光谱仪三、应用第四节分子荧光和磷光分析法一、荧光和磷光的产生二、荧光和磷光强度的影响因素三、荧光/磷光分析仪器四、荧光/磷光分析法应用第五节红外分光光度法一、分子的红外吸收二、红外光谱解析程序第六节核磁共振波谱法一、基本原理二、1HNMR谱的解析三、13CNMR谱的特点与解析第七节流动注射分析本章小结思考题与习题第十五章样品分析的一般过程第一节试样采集和制备一、试样的采集二、试样的制备第二节试样的分解与处理一、无机试样的分解处理二、有机试样的分解处理三、试样分解处理方法的选择四、干扰组分的处理第三节测定方法的选择一、测定的具体要求二、被测组分的性质三、被测组分的含量四、共存组分的影响五、实验室条件第四节分析结果的计算和数据评价一、分析结果的计算及表示方法二、分析结果的报告与评价本章小结思考题与习题附录附录一相对原子质量表(2001年国际原子量)附录二化合物的相对分子质量表附录三弱酸在水中的离解常数(25℃)附录四弱碱在水中的离解常数(25℃)附录五常用浓酸浓碱的密度和浓度附录六几种常用缓冲溶液的配制附录七常用标准缓冲溶液不同温度下的pH值附录八金属离子与EDTA配合物的lgKf(25℃)附录九标准电极电势表(25℃)附录十部分氧化还原电对的条件电极电势(25℃)附录十一难溶化合物的溶度积常数(25℃)参考文献目录绪论0.1 分析化学的任务和作用0.2 分析方法的分类0.2.1 无机分析和有机分析0.2.2 化学分析和仪器分析0.2.3 常量分析、半微量分析和微量分析。
分析化学习题带答案

分析化学习题集初小宇编学部:班级:姓名:黑龙江东方学院第一章分析化学中的误差与数据处理一、基础题1、下列论述中正确的是:( A )A、准确度高,一定需要精密度高;B、精密度高,准确度一定高;C、精密度高,系统误差一定小;D、分析工作中,要求分析误差为零2、在分析过程中,通过( A )可以减少随机误差对分析结果的影响。
A、增加平行测定次数B、作空白试验C、对照试验D、校准仪器3、下列情况所引起的误差中,不属于系统误差的是( A )A、移液管转移溶液之后残留量稍有不同B、称量时使用的砝码锈蚀C、滴定管刻度未经校正D、以失去部分结晶水的硼砂作为基准物质标定盐酸4、下列有关随机误差的论述中不正确的是( B )A、随机误差是随机的;B、随机误差的数值大小,正负出现的机会是均等的;C、随机误差在分析中是无法避免的;D、随机误差是由一些不确定的偶然因素造成的5、随机误差是由一些不确定的偶然因素造成的、2.050×10-2是几位有效数字( D )。
A、一位B、二位C、三位D、四位6、用25ml移液管移出的溶液体积应记录为( C )ml。
A、25.0B、25C、25.00D、25.0007、以下关于偏差的叙述正确的是( B )。
A、测量值与真实值之差B、测量值与平均值之差C、操作不符合要求所造成的误差D、由于不恰当分析方法造成的误差8、分析测定中出现的下列情况,何种属于随机误差?( A )A、某学生几次读取同一滴定管的读数不能取得一致B、某学生读取滴定管读数时总是偏高或偏低;C、甲乙学生用同样的方法测定,但结果总不能一致;D、滴定时发现有少量溶液溅出。
9、下列各数中,有效数字位数为四位的是( C )A、10003.0-⋅=+LmolcH B、pH=10.42C、=)(MgOW19.96% D、0. 040010、下列情况引起的误差不是系统误差的是(C )A、砝码被腐蚀;B、试剂里含有微量的被测组分;C、重量法测定SiO2含量是,试液中硅酸沉淀不完全;D、天平的零点突然有变动二、提高题1、滴定分析法要求相对误差为±0.1%,若使用灵敏度为0.0001g的天平称取试样时,至少应称取( B )A、0.1gB、0.2gC、0.05gD、1.0g2、由计算器算得(2.236×1.1124)/(1.03590×0.2000)的结果为12.00562989,按有效数字运算规则应将结果修约为:( C )A、12.006B、12.00C、12.01D、12.03、有关提高分析准确度的方法,以下描述正确的是( B )。
分析化学-学习情境二项目5 双氧水中过氧化氢含量的测定——氧化还原滴定法(高锰酸钾法)

一、学习目标
❖ 知识目标 ❖ 1. 了解氧化还原滴定法的滴定原理; ❖ 2. 掌握高锰酸钾法测定过氧化氢含量的原理和方法; ❖ 3. 掌握高锰酸钾标准溶液的配制方法和保存条件; ❖ 4. 掌握用Na2C2O4基准试剂标定高锰酸钾溶液浓度的原
理、方法及滴定条件。 ❖ 能力目标 ❖ 1. 能配制和标定高锰酸钾标准溶液; ❖ 2. 能测定双氧水中过氧化氢含量; ❖ 3. 能根据高锰酸钾自身的颜色判断滴定终点; ❖ 4. 能正确表示实验结果。
Na2C2O4 基准试剂的质量,g Na2C2O4基准试剂的摩尔质量,g·mol-1 KMnO4溶液的用量,mL。
②数据记录与处理(见表2-5-2)
四、实践操作
表2-5-2 KMnO4标准溶液标定
四、实践操作
任务2 KMnO4标准溶液的标定
操作步骤
(1)准确称取预先干燥过的Na2C2O4基准物质 0.15~0.20g左右于250mL锥形瓶中; (2)加40mL蒸馏水和10mL3 mol·L-1的硫酸溶液 于锥形瓶中;
(3)加热至75℃~85℃,趁热自滴定管中逐滴加 人待标定的高锰酸钾溶液(开始时速度要慢,待第 一滴KMnO4溶液滴入紫红色退去后再滴入第二 滴),滴定至溶液恰变微红色并保持30秒不褪色为 终点。当滴定完成时,溶液温度应不低于55℃。
4
实验数据记录与整 理
1.将实验结果填写在实验数据表格中,给出结论 并对结果进行评价; 2.写出检验报告
实验记录本、实验报告
三、知识准备
❖ 高锰酸钾法是以KMnO4为标准滴定溶液进行滴定分析的氧化 还原法。在强酸性介质中,KMnO4获得5个电子被还原成 Mn2+。其基本反应为:
❖
MnO4-+8H++5e
分析化学 第五章_氧化还原滴定法

Ø 氧化还原平衡 Ø 氧化还原滴定原理 Ø 氧化还原滴定中的预处理 Ø 常用的氧化还原滴定法 Ø 氧化还原滴定结果的计算
2016-4-12
氧化还原滴定法: 以氧化还原反应为基础的滴定分析方法。
实质:电子的转移 特点:机理复杂、多步反应 分类:高锰酸钾法、重铬酸钾法、碘量法、
可以用Nernst方程式来计算各电对的理论电势:
E Ox/Red
Eo Ox/Red
RT lg a Ox nF a Red
在25℃时,Nernst方程式为:
E Ox/Red
Eo Ox/Red
0.059 lg aOx
n
a Red
E Ox/Red
Eo Ox/Red
0.059 lg aOx
n
a Red
电对电势的大小表示氧化剂或还原剂的氧化 或还原能力的强弱。 Ø 电对电势越大,其氧化型的氧化能力越强
(还原型的还原能力越弱)——氧化剂 Ø 电对电势越小,其还原型的还原能力越强
(氧化型的氧化能力越弱)——还原剂
附表15 标准电极电势(18-25℃ )
1
氧化还原电对
电极电势
例
Ox 1 n1e Red 1 Ox 2 n2e Red 2
影响氧化还原反应速率的因素,除了参加反应的 氧化还原电对本身性质外,还与反应条件(例如,反 应物浓度、温度、催化剂(催化反应)、诱导反应等) 有关。
1.反应物浓度 增加反应物浓度可以加速反应的进行。
Cr2O72
2.反应温度 对大多数反应,升高温度可以提高反应的速度。 一般,温度每升高10℃,反应速度可提高2-3倍。
已知E0 Fe3 /Fe2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
E E 0.059 lg O R 0.059 lg CO
n
RO
n
CR
当 CO = CR = 1 mol / L 时, E ' E 0.059 lg O R
E°´— 条件电位
n
ROConditional源自potential (formal potential )
它是氧化态与还原态物质的分析浓度式1 mol / L 的实际电位
设氧化还原反应为
Conditional equilibrium constant
n2O1 n1R2 n2R1 n1O2
有关氧化还原电对的半反应
lg K ' lg( CO2 )n1 ( CR1 )n2
CR2
CO1
redox half-reaction
O1 n1e R1
E1
E1'
0.059 n1
E E' 0.059 lg CO n CR
查条件电位表 1 mol/L HCl 溶液中, E°´=1.28
E E' 0.059 lg CCe(IV)
1
CCe (III)
1.0 102 1.28 0.059lg 1.0 103
E 1.34v
2005-11
GXQ 分析化学 2009-2010学年
为负极),将待测电极列于右侧(假定为正极)。
电位计测定该原电池的标准电动势 Eφ,则有
Eφ=
- 右
左=
侍测-
H+/H2
2005-11
GXQ 分析化学 2009-2010学年
5
化学化工学院
Analytical Chemistry 分析化学
几个术语
可逆电对 不可逆电对
Fe3 / Fe2, I2 / I,Fe(CN)63 / Fe(CN)64
化学化工学院
Analytical Chemistry 分析化学
第五章
氧化还原滴定法
Oxidation-Reduction Titration Redox titration
2005-11
GXQ 分析化学 2009-2010学年
1
化学化工学院
Analytical Chemistry 分析化学
7.1 氧化还原反应的方向和程度
7.1.1 7.1.2 7.1.3 7.1.4
能斯特方程 条件电位 影响条件电位的因素 氧化还原反应进行的程度
7.2 氧化还原反应的速度
7.2.1 氧化还原反应速度的差异 7.2.2 影响反应速度的因素(自学)
催化作用
诱导作用
2005-11
GXQ 分析化学 2009-2010学年
2
化学化工学院
7.3 氧化还原滴定 7.3.1 氧化还原滴定曲线 7.3.2 氧化还原指示剂 7.3.3 终点误差
lg
CO1 CR1
R2 n2e O2
反应达到平衡时,
E2
E1 - E2 = 0
E2'
推导
0.059 lg CO2
n2
CR2
E' 0.059 lg K ' n2n1
lg K '
E 'n2 n1 0.059
E ' n 0.059
n1 = n2 = 1, n = 1
n1 = 2, n2 = 3, n = 6
2005-11
GXQ 分析化学 2009-2010学年
4
化学化工学院
标准金属电极电势的来源
Analytical Chemistry 分析化学
参与电极反应的各有关物质均为标准状态(离子浓度为1mol·L-
1,气体物质的分压为101.325 kPa)
该电极与标准氢电极组成原电池,标准氢电极列于左侧(假定
E1'
E2'
0.059 lg n2
CO2 CR2
0.059 lg CO1
n1
CR1
E1'
E2'
0.059n1 n2n1
lg CO2 CR2
0.059n2 n1n2
7.4 氧化还原滴定的计算
7.5 常用的氧化还原滴定法
Analytical Chemistry 分析化学
2005-11
GXQ 分析化学 2009-2010学年
3
化学化工学院
Analytical Chemistry 分析化学
7.1.1 能斯特方程 Nernst Equation 氧化剂或还原剂的氧化或还原能力的强弱可以用有关电对的
8
化学化工学院
7.1.4 氧化还原反应进行的程度 基本思路
Analytical Chemistry 分析化学
反应的程度
K’
CO、CR
E
2005-11
GXQ 分析化学 2009-2010学年
9
化学化工学院
Analytical Chemistry 分析化学
平衡常数、条件平衡常数
Equilibrium constant
2005-11
GXQ 分析化学 2009-2010学年
7
例题 解
化学化工学院
Analytical Chemistry 分析化学
计算1 mol/L HCl 溶液中,C(Ce4+) = 1.0010-2 mol/L, C(Ce3+) = 1.0010-3 mol/L时, Ce4+ / Ce3+电对的电位。
同理:lg
K
E n 0.059
2005-11
GXQ 分析化学 2009-2010学年
10
化学化工学院
Analytical Chemistry 分析化学
推导
O1 n1e R1
E1
E1'
0.059 n1
lg
CO1 CR1
O2 n2e R2
E2
E2'
0.059 n2
lg
CO 2 CR2
反应达到平衡时, E1 - E2 = 0
M
nO4
/
M
n2,Cr2O7
2
/
Cr
3,S4O
2 6
/
S2O32
•可逆电对:可迅速建立起氧化还原平衡,其电势基本符 合Nernst公式计算的理论电势.
对称电对
Fe3
/
Fe2,Fe(CN)
3 6
/
Fe(CN)
64,M
nO4
/
M
n2,
不对称电对 I2 / I,Cr2O72 / Cr3,S4O62 / S2O32
电极电位(电极电势)来表示。 Electrode potential
氧化还原电对
O1 n1e R1
电极电位
E1
例
Fe3 e Fe2 E 0.777v
O2 n2e R2
如果, E1 < E2
E2
Ce4 e Ce3
E 1.61v
n2O1 n1R2 n2R1 n1O2
Ce4 Fe2 Ce 3 Fe3
2005-11
GXQ 分析化学 2009-2010学年
6
化学化工学院
Analytical Chemistry 分析化学
7.1.2 条件电位
E E 0.059 lg a(Ox) n a(Re)
( 25C )
a(Ox) O[O] OCO / O
a(Re) R[R] RCR /R
代入,得
