4重组表达质粒的构建——基因的克隆
重组质粒的构建

重组质粒的构建重组质粒的构建是基因工程的核心步骤之一,其目的是将目的基因插入到质粒载体中,以实现目的基因的稳定表达和克隆化。
以下是重组质粒构建的主要步骤:1.目的基因获取首先需要获取目的基因。
目的基因可以从基因文库、PCR、基因组测序等方法中获取。
根据需要选择合适的方法,将目的基因克隆到质粒载体中。
2.载体质粒选择选择适合的质粒载体是重组质粒构建的关键步骤之一。
根据目的基因的特点和表达要求,选择适合的质粒载体。
常见的质粒载体有pET、pUC、pBluescript等。
3.限制性酶切限制性酶切是重组质粒构建的重要步骤之一。
通过限制性酶切,将目的基因和质粒载体分别切开,露出粘性末端,以便于连接反应。
4.连接反应将切好的目的基因和质粒载体的粘性末端连接在一起,形成重组质粒。
连接反应需要使用T4DNA连接酶或其它连接酶进行催化。
连接反应需要在适宜的温度和pH 条件下进行一定时间,以确保重组质粒的正确构建。
5.转化宿主细胞将连接反应得到的重组质粒转化到宿主细胞中。
常见的宿主细胞有细菌、酵母、昆虫等。
转化方法有多种,如电穿孔法、化学转化法等。
转化后需要在适宜的培养条件下进行培养,以获得大量的重组质粒。
6.克隆筛选克隆筛选是重组质粒构建的重要步骤之一。
通过克隆筛选,可以确定重组质粒是否正确构建。
常见的克隆筛选方法有蓝白斑筛选、酶切法等。
7.序列验证最后需要对重组质粒进行序列验证,以确保目的基因的正确插入和序列的准确性。
序列验证可以通过Sanger测序等方法进行。
DNA重组质粒的构建概述

DNA重组质粒的构建概述引言DNA重组质粒是现代生物学研究中常用的工具,它可以用来携带外源基因并在目标生物体中表达,从而实现对基因功能的研究和利用。
本文将概述DNA重组质粒的构建过程,包括选择质粒载体、外源基因的克隆插入以及构建质粒的鉴定等内容。
选择质粒载体质粒是细胞内独立存在的环状DNA分子,广泛存在于细菌和酵母等单细胞生物中。
在构建DNA重组质粒时,选择一个适合的质粒载体非常关键。
常用的质粒载体有pUC19、pET28a、pET-DEST42等,在选择时可以根据实验需求考虑载体大小、选择标记物和基因表达系统等因素。
外源基因的克隆插入1. DNA片段的获取首先,需要获取外源基因的DNA片段。
这可以通过PCR扩增、基因合成或其他方法来获得。
在PCR扩增时,需要设计一对引物,使其能够特异性地扩增目标基因。
合成基因片段时,可以利用现代合成生物学的技术,将目标基因序列按照设计的引物进行人工合成。
2. 酶切和连接接下来,使用限制酶将质粒载体和外源基因片段酶切开。
酶切的目的是产生互补的黏性末端,使得质粒载体和外源基因片段可以互相连接。
选择适当的限制酶在切割时产生互补的黏性末端,使得连接更加有效。
然后,将质粒载体和外源基因片段连接在一起。
这可以使用DNA连接酶和连接试剂,在适当的条件下进行连接。
连接后的质粒称为重组质粒。
3. 转化宿主细胞将构建好的重组质粒转化到适当的宿主细胞中,使其能够在细胞内进行复制和表达。
常用的宿主细胞有大肠杆菌和酵母等。
构建质粒的鉴定通过一系列实验,对构建好的质粒进行鉴定,以确保其正确性和完整性。
常用的鉴定方法有限制酶切鉴定、测序验证、PCR扩增鉴定等。
1. 限制酶切鉴定利用正确的限制酶将质粒进行切割,然后经过琼脂糖凝胶电泳进行分析。
根据不同的切割模式,可以判断质粒是否正确构建。
2. 测序验证通过测序技术对质粒进行测序分析,确保质粒中的外源基因片段的完整性和准确性。
3. PCR扩增鉴定使用特异性引物对质粒进行PCR扩增,在琼脂糖凝胶电泳分析扩增产物的大小,判断质粒中的目标基因是否存在。
重组表达质粒的构建——原核表达载体选择
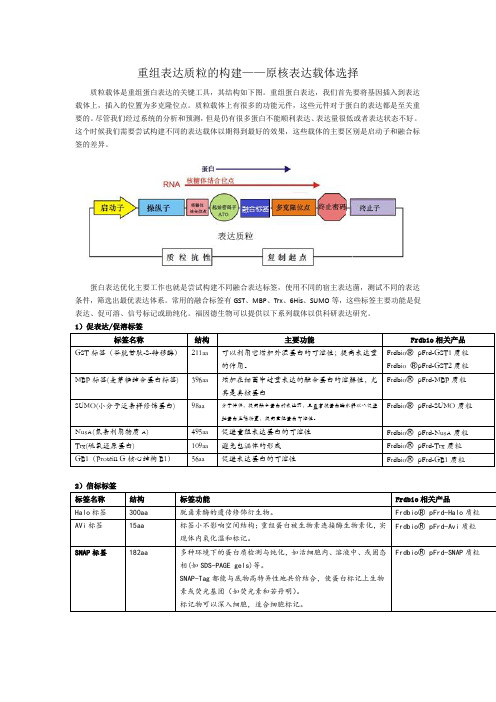
重组表达质粒的构建——原核表达载体选择质粒载体是重组蛋白表达的关键工具,其结构如下图。
重组蛋白表达,我们首先要将基因插入到表达载体上,插入的位置为多克隆位点。
质粒载体上有很多的功能元件,这些元件对于蛋白的表达都是至关重要的。
尽管我们经过系统的分析和预测,但是仍有很多蛋白不能顺利表达、表达量很低或者表达状态不好。
这个时候我们需要尝试构建不同的表达载体以期得到最好的效果,这些载体的主要区别是启动子和融合标签的差异。
蛋白表达优化主要工作也就是尝试构建不同融合表达标签,使用不同的宿主表达菌,测试不同的表达条件,筛选出最优表达体系。
常用的融合标签有GST、MBP、Trx、6His、SUMO等,这些标签主要功能是促表达、促可溶、信号标记或助纯化。
福因德生物可以提供以下系列载体以供科研表达研究。
1)促表达/促溶标签2)信标标签3)纯化标签我们选择表达载体的时候不但要考虑蛋白怎么表达成功,更要考虑蛋白怎么纯化出来,纯化的问题主要是考虑纯化标签和酶切位点的选择,下表我们列举了常见的纯化标签和酶切位点。
4)酶切位点以上为原核表达常用的标签和酶切位点,其性质也都作了简要的介绍,各专业网站或专业书籍已对此做详尽解释,科研工作者可根据具体实验设计方案,组合设计以上标签和酶切位点的使用。
特别值得注意的是,选用和设计蛋白酶切位点的时候首要考虑的是序列内部有没有蛋白酶位点,同时要考虑酶切的效率和蛋白酶试剂成本。
一般商业化载体,在标签蛋白与载体多克隆位点之间都设计有酶切位点。
标签可设计在N-端也可在C-端,设计在N-端的优势是,可通过标签高效翻译起始位点带动插入蛋白的表达,可溶性标签的高效表达更可促进蛋白的可溶性表达;同时,大部分的蛋白内切酶的切割位点在C-端,所以标签设计在N-端可将标签切割完全。
在设计标签序列与酶切位点的时候还要考虑N-端稳定性原则,也就是所谓宿主细胞的N-端规则(N-end rule),这个要避免;同时,还应该检查是否引入了可与别的蛋白相互作用的序列或者蛋白酶切位点。
简述基因工程的含义和基本操作步骤

简述基因工程的含义和基本操作步骤基因工程是通过对生物体的遗传物质进行人为改变和调控,以获得新的性状或功能的一种技术。
基因工程是现代生物技术的重要组成部分,利用DNA重组技术和基因编辑技术,可以在基因水平上改变生物体的遗传性状,进而实现种种应用。
基因工程的基本操作步骤如下:1.目标基因的克隆:首先,需要确定需要改变的目标基因,并将其从原有的生物体中克隆出来。
常用的克隆方法包括PCR技术、限制酶切和连接、质粒克隆等。
2.重组质粒构建:将目标基因插入载体中,形成重组质粒。
常用的载体包括质粒、噬菌体和人工染色体等。
3.质粒转化:将重组质粒导入宿主细胞中,使宿主细胞获得目标基因。
常用的转化方法包括化学转化、电穿孔和嗜热菌转化等。
4.选择与筛选:利用特定标记或抗性基因,对转化细胞进行筛选,筛选出带有目标基因的细胞进行进一步培养和研究。
5.培养与表达:对获得目标基因的细胞进行培养,利用适当的诱导条件(如添加特定诱导剂、调节培养温度等),使目标基因在细胞中表达出来。
6.分离与纯化:通过适当的分离和纯化技术,将目标基因表达产物纯化出来。
常用的方法包括离心、凝胶过滤、层析等。
7.特性鉴定与功能分析:对目标基因表达产物进行特性鉴定和功能分析,确认其结构和功能。
常用的方法包括Western blot、PCR、酶活性测定、功能性实验等。
8.应用与开发:在确认目标基因的结构和功能后,可以根据需要进行应用和开发。
基因工程的应用领域非常广泛,包括生物农业、医药、环境保护等。
基因工程的应用非常广泛,以下列举几个常见的应用领域:1.农业领域:利用基因工程技术改良作物,使其具有抗病虫害、耐逆境和提高产量等优点。
常见的基因工程作物包括转基因水稻、玉米和大豆等。
2.医学领域:基因工程技术可以用于生产重组蛋白药物、疫苗和基因治疗等。
同时,也有助于研究和发现与疾病相关的基因。
3.环境保护:基因工程技术可以用于修复污染物、处理有害废物,提高生物降解能力等。
4第四章 基因克隆的载体-1质粒

4、载体分子中有一段不影响它们扩增的非必须区域, 插入其中的外源基因可以象载体的正常组分一样进行 复制和扩增; 5、具有较好的安全性,不能任意转移,避免基因非控 制性扩增。
载体的种类和特征
(二)根据质粒自身传递的性质分为两大类: 1、结合型质粒:能自我复制,含转移基 因组,可自我控制质粒从一个寄主细胞传到 另一个寄主细胞。 如:F质粒,部分R质粒、Col质粒。 2、非结合型质粒:能自我复制,不含转 移基因组,不能自主在细胞间传递。 如:R质粒、Col质粒
(三)根据质粒的复制特性分为两大类: 1、严紧型质粒:是一类低拷贝数的质粒, 每个细胞中仅含有一个或几个质粒; 拷贝(数)是指一种质粒在一个寄主细 胞中存在的数目。 2、松弛型质粒:是高拷贝数的质粒, >20拷贝/细胞。该类基因工程中常用。
Example: a. 在pBR322质粒的BamHⅠ或SalⅠ位点 插入外源DNA片断,切断了tetr基因编码 序列的连续性,使之失去活性,产生出 AmprTets表型的重组pBR322质粒,转化 入AmpsTets的大肠杆菌细胞。先涂布在 含氨苄青霉素的选择培养基上,筛选出 具Ampr菌落,再将它们涂布于含四环素 的选择性培养基上。插入外源片断的重 组质粒不能在这种培养基上生长。
它的分子量为4363bp。克隆载体的大小不要超 过10kb。 2、具有两种抗菌素抗性基因可供作转化子的
选择记号。
共有24种核酸内切酶识别位点(单一的)。其中7种 内切酶的识别位点在四环素抗性基因内部,2种识 别位点在于这个基因的启动区内,所以9个限制酶 切位点插入外源片断可以导致Tetr 基因的失活; 另外有3种限制酶在氨苄青霉素抗性基因Ampr有单一 的识别位点,
基因工程综合性实验

酶切鉴定确定存在后回收
• 回收鉴定结果: 结果暗示我们应 该选择2和3条带。 我们无法改变历 史。
• 取2和3的条带质粒进行连接 • 把连接好的质粒转化到大肠杆菌中进行扩 增 • 扩增后从中提取出来,电泳鉴定,结果如 下:
抽提鉴定结果
• 表达质粒的大小为7100左右,符合结果, 但这只是大小上的符合,还得确定其是否 为我们所需的两个质粒连接所得的,故我 们得进行下面的鉴定实验。没办法,实验 有时就是这样重复的。
• 第二次实验在此告一段 • 以下是本实验历时最长,实验最多的一次, 不过其实验内容是不简单的重复操作。
第三次实验报告 ——表达质粒的构建
• 快抽鉴定
电泳-->酶切 电泳) (快抽 -->电泳 酶切 电泳) 电泳 酶切-->电泳
方法: 试剂盒法 • T-phoA EcoR I 单酶切鉴定 • 表达质粒构建 实验顺序:碱抽-->酶切 电泳-->回收 酶切-->电泳 回收-实验顺序:碱抽 酶切 电泳 回收 >电泳 连接 电泳-->连接 电泳
基因工程综合性实验
大肠杆菌碱性磷酸单酯酶单脂酶基因在染色体DNA上的 杂交定位――Southern Blotting • 2、碱性磷酸单脂酶基因的体外扩增 ――PCR扩增 扩增 • 3、PCR体外扩增片段的克隆连接于T-载体 ――连接 连接 • 4、连接产物转化大肠杆菌受体菌――转化 转化 • 5、转化子质粒DNA的抽提――快速法制备 质粒
快抽电泳结果
• 碱抽质粒PET11-A ,phoa由老师提供 • 结果如下: • 目的产物中含 5000到7000的 质粒,可进行 酶切。
双酶切电泳鉴定
• 1 PHOA • (大小为4100) • 酶切后含有 两条带,基本 符合条件。
NK4基因重组慢病毒载体的构建及在肝癌细胞中的表达_李霏

NK4基因重组慢病毒载体的构建及在肝癌细胞中的表达李霏,李松林,尹元琴(中国医科大学附属第一医院肿瘤研究所,沈阳110001)摘要目的构建共表达人NK4基因和增强型绿色荧光蛋白(EGFP )基因的重组慢病毒载体,转染人高侵袭转移肝癌细胞LM3(HCCLM3),观察其转染效率及表达情况。
方法采用DNA 重组技术,将NK4基因克隆至带EGFP 的慢病毒表达载体pLenti6.3-内部核糖体进入位点序列(IRES )-EGFP 中,并用脂质体介导法将慢病毒包装系统和带NK4基因的质粒pLenti6.3-NK4-IRES -EGFP 共转染293T 细胞,包装慢病毒并测定滴度。
以不同感染复数(MOI )的重组慢病毒感染293T 细胞,筛选最适MOI ,以最适MOI 重组慢病毒感染HCCLM3细胞,观察转染效率。
Western blot 法测定细胞中NK4蛋白表达水平。
结果成功构建共表达NK4基因和EGFP 基因的慢病毒载体pLenti6.3-NK4-IRES -EGFP ,并对其包装、纯化及浓缩后测定病毒滴度为1.08×108TU/mL 。
重组慢病毒感染HCCLM3细胞筛选其最适MOI 为7。
转染后HCCLM3细胞中可见明显的NK4蛋白表达,而未转染细胞中无NK4蛋白的表达。
结论成功构建了NK4基因的重组慢病毒载体,有效地转染HCCLM3细胞后可高表达NK4蛋白。
关键词NK4;慢病毒载体;人高侵袭转移肝癌细胞LM3;基因转染中图分类号R73文献标志码A文章编号0258-4646(2011)12-1081-04doiCNKI:21-1227/R.20111226.1615.028网络出版地址/kcms/detail/21.1227.R.20111226.1615.028.htmlConstruction of NK4Recombinant Lentiviral Vector and Its Expression in HCCLM3Cells 肝细胞肝癌(hepatocellular carcinoma ,HCC )是世界上常见的恶性肿瘤之一,位居全球恶性肿瘤发病率的第5位[1]。
周氏啮小蜂CcGSTS1基因的克隆·蛋白表达纯化及酶学特征分析

(大连)有限公司;引物合成及测序由苏州金唯智生物科技有
限公司完成;其他如氯仿、异丙醇等试剂均为国产或进口分
析纯试剂。
菌种及质粒:大肠杆菌 Transetta (DE3) Chemically Com⁃
petent Cell、Trans1 - T1 Phage Resistant Chemically Competent
Key words Chouioia cunea Yang;Glutathione S⁃transferases;Phylogenetic analysis;Enzyme activity
昆虫的宿主适应性及杀虫剂抗性与解毒代谢相关蛋白
1-十二烯对小蜂已交配雌性具有较强的引诱性,但其诱发周
transporters, ABC )、 细 胞 色 素 p450 ( cytochrome P450s,
和线粒体 GSTs。 迄今为止,在昆虫中只发现了胞质 GSTs 与
silon、Omega、Sigma、Theta 和 Zeta
[5]
。 普遍存在于原核生物和
真核生物中谷胱甘肽 S-转移酶,除对内源性和外源性化合
物的解毒作用以外,还参与多种细胞生理生化反应,如胞内
1.1 材料 供试昆虫:周氏啮小蜂,由河南省漯河市豫中南
340 nm 处的吸光值,分别于 1 min 和 6 min 各测定 1 次,按照
100 mg,用液氮研磨后,按照 RNA isolater Total RNA Extraction
2 结果与分析
据反转录试剂盒说明书进行反转录反应获得单链 cDNA。
CcGSTS1 基因,该基因全长 474 bp,编码 157 个氨基酸。 应用
目的基因T载体克隆实验步骤

目的基因T载体克隆实验步骤pcr产物的t载体克隆一.重组质粒的构建:重组的dna分子就是在dna连接酶的促进作用下,存有mg切的载体分子与外源dna分子进行连接。
dna连接酶存有两种:t4噬菌体dna连接酶和大肠杆菌dna连接酶。
两种dna连接酶都存有将两个具有相同粘性末端的dna分子连在一起的功能,而且t4噬菌体dna连接酶除了一种大肠杆菌dna连接酶没的特性,即为能够并使两个平末端的双链dna分子连接起来。
但这种相连接的效率比粘性末端的相连接率为高,通常可以通过提升t4噬菌体dna 连接酶浓度或减少dna浓度去提升平末端的相连接效率。
t4噬菌体dna连接酶催化剂dna 连接反应分成3步:首先,t4dna连接酶与辅因子atp构成酶-atp复合物;然后,酶-atp 复合物再融合至具备5’磷酸基和3’羟基切口的dna上,并使dna腺苷化;最后产生一个代莱磷酸二酯键,把切口封出来。
连接反应通常将两个相同大小的片断相连。
很多dna聚合酶在进行pcr扩增时会在pcr产物双链dna每条链的3’端加上一个突出的碱基a。
pucm-t载体是一种已经线性化的载体,载体每条链的3’端带有一个突出的t。
这样,pucm-t载体的两端就可以和pcr产物的两端进行正确的at配对,在连接酶的催化下,就可以把pcr产物连接到pucm-t载体中,形成含有目的片断的重组载体。
连接反应的温度在37℃时有助于连接酶的活性。
但是在这个温度下黏末端的氢键融合就是不稳定的。
因此实行折衷的温度,即12-16℃,相连接12-16h(过夜),这样既可以最大限度地充分发挥连接酶的活性,又兼具至较长时间接合结构的平衡。
2、atp存有的相连接缓冲器系统中,将分别经酶二.感受态制备原理细菌在0ccacl2低渗溶液中胀变成球形,遗失部分膜蛋白,沦为难稀释外源dna的状态。
三.β-半乳糖甘酶显色反应选择法(蓝白筛选)原理lacz基因是大肠杆菌乳糖操纵子中的一个基因,可以编码β—半乳糖核苷酶。
重组质粒的PCR实验

重组质粒的PCR实验李笃财 201200140048 生科一班一.实验目的1.学习利用PCR产物回收试剂盒回收PCR产物;2.掌握基因克隆的基本操作过程3.了解利用T载体进行PCR产物克隆的基本原理4.进一步巩固PCR扩增及电泳检测技术二.实验原理(一)重组质粒酶切鉴定将含有外源DNA的转化子的E.coliDH5α菌株进行培养,并用试剂盒提取其质粒DNA,将所提取的DNA用切pUC19质粒的同一种限制性内切酶进行切割以验证所插入的外源DNA的大小。
(二)PCRPCR(Polymerase Chain Reaction)即聚合酶链式反应是1986 年由Kallis Mullis 发现。
这项技术已广泛地应用于分子生物学各个领域,它不仅可用于基因分离克隆和核酸序列分析,还可用于突变体和重组体的构建,基因表达调控的研究,基因多态性的分析等方面。
本次实验旨在通过学习和掌握PCR反应的基本原理和实验技术,以验证重组质粒插入片段大小。
1.聚合酶链式反应原理PCR是一种利用两种与相反链杂交并附着于靶DNA两侧的寡核苷酸引物,经酶促合成特异的DNA 片段的体外方法。
反应过程由高温变性,低温退火和适温延伸等几步反应组成一个循环,然后反复进行,使目的的DNA 得以迅速扩增。
置待扩增DNA 于高温下解链成为单链DNA 模板,人工合成的两个寡核苷酸引物在低温条件下分别与目的片段两侧的两条链互补结合,DNA聚合酶在72℃将单核苷酸从引物3'端开始掺入,沿模板5'—3'方向延伸,合成DNA 新链。
由于每一循环所产生的DNA均能成为下一次循环的模板,所以PCR 产物以指数方式增加,经25—30次周期之后,理论上可增加109倍,实际上可增加107倍。
PCR 技术具有操作简便、省时、灵敏度高特异性强和对原始材料质量要求低等优点,但由于所用的TaqDNA 聚合酶缺乏5'—3'核酶外切酶活性,不能纠正反应中发生的错误核苷酸掺入,估计每9000个核苷酸会导致一个掺入错误,但是错误掺入的碱基有终止链延伸的作用倾向,使得错误不会扩大。
重组质粒的概念

重组质粒的概念重组质粒是指通过DNA技术,将外源基因或DNA片段插入到质粒中,并使其在宿主细胞中复制和表达的过程。
重组质粒常用于基因工程研究、基因克隆及蛋白表达等领域,具有广泛的应用价值。
重组质粒通常由一个或多个外源DNA序列插入到质粒的多个位点上,插入的DNA序列可以来自同一种生物体,也可以来自不同种生物体。
质粒是一种环状的DNA分子,可以自由地在细胞内复制和传递。
在细胞复制过程中,质粒会被复制成多个复制体,并将其传递给子细胞。
质粒通常由多个重要元素组成,其中最重要的是载体序列和选择标记。
载体序列是质粒中的DNA序列,在质粒复制和传递过程中起到重要的作用。
载体序列通常包括起始位点、终止位点和复制起始区域等,这些序列协助控制质粒的复制和分离过程。
选择标记是质粒中的DNA序列,可以帮助鉴别哪些细胞获得了重组质粒。
选择标记常用于筛选具有重组质粒的细胞,例如抗生素抗性基因。
只有带有选择标记的细胞可以生存和繁殖,从而筛选出带有重组质粒的细胞。
重组质粒的构建通常包括以下步骤:1.选择合适的质粒:根据实验需要和目标生物体,选择合适的质粒作为载体。
常用的质粒有pUC19、pBR322等。
2.选择合适的外源DNA序列:根据实验目的,选择合适的外源DNA序列。
这些DNA序列可以来自某个生物体的基因,或者是重组技术合成的特定DNA片段。
3.设计引物和酶切位点:设计引物,可以通过PCR扩增外源DNA序列,并设计酶切位点,以便将外源DNA插入到质粒上。
4.酶切和连接:通过限制性内切酶酶切质粒和外源DNA,生成具有互补末端的DNA片段。
然后使用DNA连接酶将外源DNA和质粒连接起来。
5.转化:将重组质粒转化到宿主细胞中。
常用的宿主细胞有大肠杆菌、酵母菌等。
可以通过热激转化、化学转化或电转化等方法将重组质粒引入到宿主细胞内。
6.筛选:通过选择标记,筛选出带有重组质粒的细胞。
通常使用抗生素筛选法,将带有抗生素抗性基因的重组质粒引入到宿主细胞中,只有带有重组质粒的细胞能够在富含抗生素的培养基中生长。
分子生物学:基因克隆及克隆基因的表达

Bam HⅠ GGATCC CCTAGG
Bg lⅡ AGATCT TCTAGA
互连后?
GCCTAG+
GATCC G
ATCTAG+GATCTA
Ⅱ型限制性内切酶具有一些共性和特性:
5. 不同的酶可以识别同一个序列 同工异源酶(isoschizomer)或同裂酶 能识别同一序列(切割位点可同或不同)但来源不同的两种酶。
6. 水浴槽
8. 电泳系统
分子克隆常用的有毒试剂
1. 溴化乙锭: (Ethidium bromide,EB)用来染DNA和RNA的染料, 是一种致癌物 质;它是DNA突变的诱变剂,可以嵌入DNA,使DNA发生突变,致癌。 有累积 效应,不要直接接触,但是要注意通过呼吸摄入,故此环境要通风。EB可以被 皮肤吸收。做实验的时候一定要带手套。但是,只要按照标准的操作使不会有问 题的。严禁随便丢弃。因为EB是强致癌性,而且易挥发,挥发至空气中,危害 很大。
2. DEPC:DEPC即二乙基焦碳酸酯(diethylprocarbonate),可灭活各种蛋白质, 是RNA酶的强抑制剂;DEPC是一种潜在的致癌物质,在操作中应尽量在通风的 条件下进行,并避免接触皮肤。DEPC毒性并不是很强,但吸入的毒性是最强的, 使用时戴口罩。不小心占到手上注意立即冲洗。
3.苯酚:苯酚又名酚或石碳酸,为高毒类原浆毒物,对人体危害严重。它的浓溶液 对皮肤有强烈的腐蚀性,苯酚所致的急性中毒常常造成死亡。 4. 氯仿:三氯甲烷,侵入途径:吸入、食入、经皮吸收。健康危害:主要作用 于中枢神经系统,具有麻醉作用,对心、肝、肾有损害。吸入或经皮肤吸收引起 急性中毒,初期有头痛、头晕、恶心、呕吐、兴奋、皮肤粘膜有刺激症状,以后 呈现精神紊乱、呼吸表浅、反向消失、昏迷等,重者发生呼吸麻痹、心室纤维性 颤动、并可有肝、肾损害。误服中毒时,胃有烧灼感、伴恶心、呕吐、腹痛、腹 泻以后出现麻醉症状。慢性中毒:主要引起肝脏损害,此外还有消化不良、乏力、 头痛、失眠等症状,少数有肾损害。 5. 十二烷基硫酸钠(SDS):提取质粒使用的溶液II中含有SDS,对粘膜和上呼 吸道有刺激作用,对眼和皮肤有刺激作用。可引起呼吸系统过敏性反应。。 6. 其它常用的试剂如强酸强碱都有很强的腐蚀性。
基因克隆

基因克隆的方法基因克隆是指在体外将含有目的基因或其它有意义DNA段同能够自我复制的载DNA连接,然后将其转入宿主细胞或受体生物进行表达或进一步研究的分子操作的过程,因此基因克隆又称分子克隆,基因操作或重组DNA 技术。
根据这个定义,于是选择和使用不同的方法,最后得到含有目的基因片段的菌株。
针对目的基因的来源不同,可以选择多种克隆方法,但并没有放之四海而皆准的方法,要针对自己的目的基因的特点采取相应的且合适准确的方法来获得目的基因的克隆。
1当目的基因的序列完全已知时。
则可以根据文献上所查到的基因的注册序列号到相应的网上数据库去查找该基因的全序列结构信息,例如最常用的美国NCBI网站上的Genbank数据库。
然后查找到相应的目的基因的核苷酸序列信息和其来源。
然后使用生物信息学软件对基因的序列进行分析,设计通过PCR反应来扩增目的基因的核苷酸引物,并将设计的引物序列发给生物技术公司合成,最后得到引物核苷酸并用纯水进行合理的稀释。
接下来将采集含有目的基因的生物标本材料,使用合理的方法提取生物标本的基因组并进核酸浓度与纯度的测定,由于生物体的核酸从化学性质上来讲主要分为DNA和RNA两种,所以提取基因组后针对基因组的选择要尽可能去除另一种核酸的干扰与污染。
然后根据基因组的质量,浓度,PCR扩增设计引物的结构,目的基因的长度等因素设计PCR反应的条件,反复试验以找到能够通过PCR方法来准确扩增目的基因的最佳反应条件。
在目前的PCR反应中所采用工具酶为Taq DNA聚合酶,通常所用的Taq DNA聚合酶具有一个生物反应特性,在其扩增的PCR产物上,其3’末端总是会带有一个非模板依赖性的突出碱基,而且这个碱基几乎总是A( dATP), 因为Taq DNA聚合酶对dATP具有优先聚合活性,故可以针对这一点采取两种克隆策略。
其一,可以采取TdT末端加同聚尾的方法与载体拼接;其二,可直接与一些T载体(切口处含有一个突出T碱基的克隆载体)连接并克隆。
基因克隆实验流程

基因克隆实验流程基因克隆技术,又称重组 DNA 技术,是将目的基因与具有自主复制能力的载体DNA 进行体外重组,获得新的重组DNA后导入受体细胞中表达相应蛋白,以研究蛋白结构与功能及其与其他分子的相互作用。
一、获取目的基因目的基因就是需要研究的特定基因或DNA片段。
获取目的基因的主要方法: 1、用限制性内切酶解染色体DNA,构建基因组文库,再从基因组文库中筛选目的基因。
该法的优点是获得的目的基因的组织结构与天然基因完全相同,在结构基因中也含有内含子序列,但是也正因为这一点构成了该法最大缺点,即含有内含子的基因在原核细胞中不能表达。
原因是原核细胞不能识别并剪切插入顺序(内含子),因而也不能表达出正确的基因产物。
2、分离纯化细胞中的mRNA,以mRNA为模板,在反转录酶作用下生成cDNA第一链,再以cDNA第一链为模板在DNA聚合酶作用下生成双链cDNA,构建cDNA文库,从中筛选所需的目的基因。
此法仅用于筛选为蛋白质编码的结构基因。
因成熟的mRNA分子中已经切除了内含子序列,具有完整的阅读框架,可在原核细胞中正确表达。
3、人工体外合成基因:由于当前人工体外合成DNA的长度有限,此法仅用于制备小分子生物活性多肽基因和小分子量蛋白基因。
在基因较大情况下,常需先合成多个DNA片段,然后拼接成完整的基因,此法还要求目的基因的全部碱基顺序已被阐明。
4、PCR法扩增基因:PCR(聚合酶链式反应)技术的出现和发展,为目的基因的寻找提供了有力技术工具。
用PCR法可选择性扩增基因组中所要研究的个别基因或DNA片段,或用反向PCR技术,先将特定mRNA反转录为cDNA第一链,然后再进行扩增。
用PCR法筛选基因,需要对目的基因的DNA序列至少有部分了解。
二、选择适当的载体按上述方法制备的目的基因如果没有合适的载体协助,很难进入受体细胞,即使能进入,往往也不能进行复制和表达,因为这些外源性DNA一般不带有复制调控系统。
为了保证目的基因或外源DNA片段能在细胞内克隆,必须将它们与适当的载体连接。
igg抗体制备质粒构建

igg抗体制备质粒构建摘要:1.引言2.IgG 抗体制备方法3.质粒构建的基本原理4.质粒构建的具体步骤5.质粒构建的应用领域6.结论正文:【引言】IgG 抗体是免疫球蛋白G(Immunoglobulin G)的一种,主要存在于血液和淋巴系统中,是机体抗感染和抗肿瘤免疫反应中最重要的抗体类别。
近年来,随着生物技术的发展,IgG 抗体在疾病治疗、药物传递和生物传感器等领域的应用越来越广泛。
为了获得特定功能的IgG 抗体,研究者需要通过基因工程技术将相应的抗体基因克隆到表达载体中,进而实现抗体的大量表达。
本文将介绍一种常见的抗体制备方法——质粒构建,并详细阐述其基本原理和具体步骤。
【IgG 抗体制备方法】制备IgG 抗体的方法有多种,如杂交瘤技术、基因工程技术和磷酸化抗体技术等。
其中,基因工程技术是一种通过基因克隆和重组实现抗体制备的方法,主要包括质粒构建和病毒载体构建等。
质粒构建技术因其操作简便、成本低廉以及表达效率较高等优点,成为研究者制备IgG 抗体的优选方法。
【质粒构建的基本原理】质粒构建的基本原理是将目的基因(即抗体基因)与表达载体(质粒)结合,使目的基因在受体细胞中得到表达。
表达载体通常包含启动子、增强子、目的基因、标记基因和终止子等元件。
启动子是RNA 聚合酶识别和结合的部位,增强子可以提高目的基因的表达水平,标记基因用于筛选和鉴定成功转化的细胞,终止子使转录过程终止。
通过将目的基因插入表达载体的适当位置,研究者可以实现对目的基因的表达调控。
【质粒构建的具体步骤】1.获取目的基因:从已知抗体的B 细胞或杂交瘤细胞中获取抗体基因。
2.选择表达载体:根据实验需求选择适合的质粒表达载体。
3.基因克隆:将目的基因与表达载体结合,构建重组质粒。
4.转化细胞:将重组质粒转化到受体细胞中,让目的基因在细胞内得到表达。
5.筛选和鉴定:通过筛选标记基因和检测目的基因的表达水平,鉴定成功转化的细胞。
6.抗体表达:在成功转化的细胞中进行抗体的大量表达。
高中生物选修三“基因工程”综合练习(20题含答案)

高中生物选修三“基因工程”综合练习(20题含答案)请回答下列有关克隆技术和基因编辑的问题:1)克隆技术是指通过人工手段复制出与原体完全一样的生物体。
目前,克隆技术主要分为三种:体细胞核移植克隆、胚胎分裂克隆和基因克隆。
其中,最常见的克隆方法是。
2)基因编辑技术是指通过改变生物体的基因序列来实现对其性状的调控。
CRISPR/Cas9系统是目前最常用的基因编辑技术之一,其中CRISPR指的是,Cas9则是。
3)基因编辑技术的应用非常广泛,其中包括疾病基因治疗、农业生产、生物安全等领域。
以疾病基因治疗为例,基因编辑技术可以通过修复或替换患者体内的有缺陷基因,从而达到治疗疾病的目的。
目前,基因编辑技术已经被用于治疗包括血友病在内的多种疾病。
答案:(1)体细胞核移植克隆(1分)(2)“类细菌重复间隔簇”、“CRISPR相关蛋白9”(1分)(3)血友病(1分)逆转录病毒载体是目前应用较多的动物基因工程载体之一。
它可以将外源基因插入到受体细胞染色体中,使外源基因随染色体DNA一起复制和表达。
研究发现逆转录病毒基因组(RNA)的核心部分包括三个基因:gag基因(编码病毒的核心蛋白)、pol基因(编码逆转录酶)、env基因(编码病毒的表面糖蛋白)。
位于这些基因的两端有LTR序列(含有启动子、调节基因等),控制着逆转录基因组核心基因的表达及转移。
下图展示了构建逆转录病毒载体及用于培育转基因小鼠的过程。
1)逆转录病毒的遗传信息储存在RNA中,其中包含四种核苷酸排列顺序中的四种脱氧核苷酸。
2)过程②中,外源基因一定要插入到病毒DNA的LTR序列中的启动子后,其主要目的是控制外源基因的表达。
3)过程③中,导入病毒蛋白编码基因(gag,pol和env)的目的是合成组成病毒的蛋白质。
4)过程④中,逆转录病毒载体感染的细胞一般选择内细胞团细胞,因为这类细胞能发育成新个体的各种组织器官(具有发育的全能性),处于囊胚期。
5)在胚胎移植前,需要对母鼠进行处理,才能使其生殖器官(子宫)适于早期胚胎的植入和正常发育。
分子生物学 基因克隆及克隆基因的表达

Bam HⅠ GGATCC CCTAGG
Bg lⅡ AGATCT TCTAGA
互连后?
GCCTAG+
GATCC G
A
+GATCT
TCTAG
ALOGO
Ⅱ型限制性内切酶具有一些共性和特性:
5. 不同的酶可以识别同一个序列 同工异源酶(isoschizomer)或同裂酶 能识别同一序列(切割位点可同或不同)但来源不同的两种酶。
LOGO
聚合酶链式反应
Polymerase Chain Reaction, PCR
体外高效特异性的扩增目的DNA片段
LOGO
LOGO
LOGO
LOGO
LOGO
PCR的基本原理
• PCR反应条件 • PCR过程 • PCR的特点
1
2
3
高温变性 低温退火 适温延伸
94
温
度 72
(℃)
55
22
DNA 2
3’
3’
5’
上游引物、5’ 引物、Sense primer
PCR反应扩增的就是一对引物之间的DNA片段,PCR反应 成功扩增的关键在于引物的正确设计。
引物设计的总原则——提高引物与模板结合的特异性。
LOGO
PCR引物设计的基本原则: 1.引物与模板的序列要紧密互补。 2.引物自身、引物之间不应存在互补序列。 3.引物不能在模板的非目的位点引发PCR。
LOGO
分子生物学关键的技术突破: DNA重组技术
1972年, 世界上第一个重组DNA分子诞生
1980年, 获诺贝尔化学奖
猿猴病毒DNA
噬菌体DNA
限制性内切酶
限制性内切酶
DNA连接酶 重组DNA分子
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
重组表达质粒的构建——基因的克隆
长片段基因在大肠杆菌中表达往往比较困难,作为抗原使用的重组蛋白可以考虑选择抗原性好的区段原核表达,前文已作阐述。
对整个蛋白结构研究,必须全长表达该蛋白,此时最好考虑真核表达系统,特别是含有跨膜区的蛋白。
选定要克隆的区段,需先富集纯化之后才方便插入载体,常用的富集方法是PCR或者质粒繁殖复制。
为了防止在PCR扩增过程中引入碱基错误或者碱基缺失,PCR扩增基因时候必须使用高保真Taq酶。
为了满足科研工作者不同实验需求,福因德生物将高保真Taq酶优化为即用型Mix,使用时直接加引物和模板就可以扩增。
除此之外,福因德生物还开发出LA Taq、S-Taq Mix以及SYBR荧光定量PCR Mix(需要更高品质的可选用SYBR PCR SuperMix)。
原核重组表达常用克隆技术主要有以下几种:
1)酶切连接
这个是目前应用最为广泛的的克隆技术,主要优点是技术稳定;缺点是周期长、步骤多,任何一个环节产生的误差都会影响克隆构建的成败。
如用酶切连接的策略进行载体批量构建,不同载体和不同外源基因尽可能选用相同的上下游酶切位点,比如,批量克隆基因到某个载体上,可一次性大量双酶切将载体线性化后保存备用,每次构建载体只需酶切外源基因片段,载体可直接取用,不必每次都酶切,省时省力(此处需特别留意的是基因内部不能有与上述所用冲突的酶切位点)。
2)TA克隆
TA克隆必须使用商业的线性化载体,线性载体3´末端有一个T碱基,与PCR扩增产物3´末端A正好匹配。
这种克隆策略最大的优点是载体使用方便,扩增产物可以直接克隆到载体上,不需要酶切位点等冗余序列;缺点是:必须依赖商业化载体,载体选择受限;扩增外源片段所使用的Taq酶也必须是可以在3´末端加A,这种Taq酶的保真度不高;外源片段插入之后还必须鉴定方向。
目前,这种构建表达载体的策略已经逐渐被淘汰。
3)TOPO克隆
TOPO克隆载体利用DNA拓扑异构酶I识别序列中的CCCTT松弛双螺旋并重新连接,同时兼具限制性内切酶和连接酶的功能。
主要原理是在T载体的T碱基上共价偶联一个DNA拓扑异构酶I分子,其克隆效率提高数倍,并且操作极其简单,整个反应体系不需要在添加连接酶成分。
如果在线性化平端载体上共价偶联一个DNA拓扑异构酶I分子,平端连接将不再是难题,如果再配合一个致死基因ccdB (Control of cell death)使用,凡是没有插入外源核酸序列的空载体自连,转入大肠杆菌可以正常表达ccdB蛋白,破坏细菌DNA gyrase(促旋酶),造成细菌染色体降解而死亡;而插入外源核酸序列的会干扰ccdB蛋白的正常表达,细菌可以正常存活,平端克隆高背景问题这样得以完美解决。
4)Gateway技术
该技术所依赖的基础是lambda噬菌体的位点特异性重组反应。
需要限制酶切回收、T4 Ligase连接;该方法一步就可以完成,只需要将基因克隆到入门载体(Entry Vector),依赖载体上的特定的重组序列和重组酶,将外源基因克隆到具有相同重组序列的载体上;入门载体一般包含两个attL1和attL2,中间夹杂一个ccdB自杀基因,自连的空载体在转入大肠杆菌中都不会存活。
入门载体构建成功之后,就可以轻松地将入门载体和目的载体质粒混合加入重组酶即可发生重组,生成所需要的融合质粒,当然还有一个副产品质粒。
这种克隆方法适合于将一个基因批量化构建到不同载体系列中进行功能测试。
这种技术也适合于大批量的文库构建,具体细节在此就不做赘述。
该技术主要的缺点是:该技术系统使用的酶非常昂贵,而且酶非常不稳定;其次,适合于gateway技术的载体非常少,只有一个厂家生产而且昂贵,来源受限;对于大片度(>10Kb)的效率很低,与传统的酶切-T4连接技术相比没有优势。
5)Infusion技术
这个是目前比较流行的克隆技术,可以任意载体任意基因片段快速实现多片段、长片段定点定向克隆,
最大的优点在于不依赖于酶切位点进行克隆,操作时间也非常短,只需要10~15min;缺点是:载体和外源片段连接处的重叠15bp必须坚持末端原则,不能“甩出”,这也限制了定点克隆的“任意发挥”。
6)Frdbio SimpleClone技术
本克隆技术是在福因德生物基础团队在Infusion技术上的升级,除了兼具Infusion技术的全部优势外,还具有以下特点:克隆片段重叠区可以少于15bp,最短可以至10bp,反应温度50℃,载体线性化之后,重叠区可不必末端对齐,可以“允许末端甩出”,实现真正意义上的任意位点克隆。
下面介绍两种比较常用的构建方式:
A 酶切连接法构建载体
1)50 μl酶切体系: PCR回收产物/载体~2μg,限制性内切酶A 1μl (10U), 限制性内切酶B 1μl (10U),双酶切Buffer 5μl,H2O补充至50μl;37℃连接4~6h。
2)10 μl连接体系:酶切PCR回收产物与酶切线性化载体摩尔比为10:1,Ligase 0.5μl,10*Ligase Buffer 1μl, H2O补足至10μl(体系中线性化载体浓度不低于10ng/μl),16℃连接过夜。
连接产物可用于转化大肠杆菌。
B Simpleclone重组酶法构建载体
1)载体线性化:
载体线性化同上文“SOP3酶切连接法构建载体”。
2)外源片段的获得:参照Simpleclone重组酶说明书设计引物并扩增获得,保证两端分别与线性化载体末端有15nt重叠区。
3)反应体系的配制(10μl):
实验组:线性化载体50ng,外源插入片段50ng,5×Simpleclone重组连接反应液2μl,补足水至10μl;
阴性对照组:线性化载体50ng,外源插入片段50ng,补足水至10μl;
阳性对照组:线性化载体pUC19 Control Vector20 ng,外源插入片段2 kb Control Insert fragment 50ng,5×Simpleclone重组连接反应液2μl,补足水至10 μl ;
4)将以上体系配置好在PCR管底部(阴性对照和阳性对照实验可选做),配好后放在PCR仪上或水浴锅中50℃ 15min。
