第三章 水环境化学(&4)
环境化学-第三章-水环境化学-第二节-水中无机污染物的迁移转化知识交流

之,pE越大,电子浓度越低,体系接受电子的倾向就越强。
(2)氧化还原电位E和pE的关系
Ox +ne→Red
(1)
根据Nernst方程
E=E0-(2.303RT/nF)lg[Red]/[Ox] (2) 当反应达平衡时,定义
E0=(2.303RT/nF) lgK
(3)
从上述化学方程式(1),可写出
K= [Red]/{[Ox][e]n }
如果考虑到羟基配合作用,那么金属氧化物或氢氧化物的 溶解度(MeT)表征为:
MeT = [ Mez+ ] +∑[ Me(OH)nz-n ]
固体的氧化物和氢氧化物具有两性的特征,它们和质子或 羟基离子都发生反应,存在一个pH值,在该值下溶解度为最 小值。在碱性或酸性更强的pH值区域内,溶解度都会变得更 大。
因此,在 H2S 和硫化物均达到饱和的溶液中,溶液重金属离子 的饱和浓度为: [Me2+]=Ksp/[S2-]=Ksp [H+]2/Ksp´ =Ksp [H+]2/(0.1K1K2)
3、碳酸盐
——多相平衡,pH通过控制碳酸根浓度影响沉淀平衡
封闭体系: 只考虑固相和液相,把 H2CO3* 当作不挥发酸类处理。
吸附量随粒度增大而减少,并且当溶质浓度范围固定 时,吸附量随颗粒物浓度增大而减少。
温度变化、几种离子共存(竞争作用)等。
3、沉积物中重金属的释放——属于二次污染问题
诱发释放的主要因素有: (1)盐浓度升高:碱金属和碱土金属阳离子可将被吸附在固体颗
粒上的金属离子交换出来。
(2)氧化还原条件的变化:有机物增多,产生厌氧环境、铁锰氧 化物还原溶解,使结合在其中的金属释放出来。
2、它在中性表面甚至在与吸附离子带相同电荷符号的表面 也能进行吸附作用。
第三章 水环境化学水中无机污染物的迁移转化汇总

20
1. 胶体颗粒凝聚的基本原理和方式
1) 带电胶粒稳定性的经典理论--DLVO理论 带电胶粒的两种相互作用力
双电层重叠时的静电排斥力 粒子间的长程范德华吸引力
DLVO理论认为,当吸引力占优势时,溶胶发生聚 沉; 当排斥力占优势,并大到足以阻碍胶粒由于 布朗运动而发生聚沉时,则胶体处于稳定状态。 颗粒在相互接近时两种力相互作用的总位能随相 隔距离的变化而变化: 总位能 VT=VR+VA 式中:VA——由范德华力所产生的位能; VR——由静电排斥力所产生的位能。
4
一 、 颗粒物与水之间的迁移
2、水环境中颗粒物的吸附作用
专属吸附是指吸附过程中,除了化学键的作
用外,尚有加强的憎水键和范德华力或氢键在 起作用。
专属吸附作用不但可使表面电荷改变符号, 而且可使离子化合物吸附在同号电荷的表面上。
5
表3-8水合氧化物对金属离子的专属吸附 与非专属吸附的区别
项目 非专属吸附 专属吸附 发生吸附的表面净电荷的符号 - -、0、+ 金属离子所起的作用 反离子 配位离子 吸附时发生的反应 阳离子交换 配位体交换 发生吸附时体系的PH值 >零电位点 任意值 吸附发生的位置 扩散层 内层 对表面电荷的影响 无 负电荷减少, 正电荷增多 注:本表摘自陈静生主编,1987。
(4)水体悬浮沉积物
悬浮沉积物是以矿物微粒,特别是粘土矿物 为核心骨架,有机物和金属水合氧化物结合在矿 物微粒表面上,成为各微粒间的粘附架桥物质, 把若干微粒组合成絮状聚集体(聚集体在水体中 的悬浮颗粒粒度一般在数十微米以下),经絮凝 成为较粗颗粒而沉积到水体底部。
(5)其他
3
一、 颗粒物与水之间的迁移
环境化学第三章水

二节 气体在水中的溶解性
水的质量特征:
• 酸度和碱度
第一节 概述
• 盐度和氯度:1千克水中碳酸盐转变为氧化物、溴化物 和碘化物转变为氯化物、有机物完全氧化后所含固体 的总克数。
• 硬度 • 溶氧量:25℃时的饱和浓度
[O2 (aq)] = 2.6×10-3 mol/L = 8.32 mg/L
• 清度和色度
化合物直接与 pH值有关,实际涉及到水解和羟基配合物的平
衡过程,该过程往往复杂多变,这里用强电解质的最简单关 系式表述: Me(OH)n(s) → Men+ + nOH根据溶度积表达式 可导出金属离子浓度 等号两边取负对数: Ksp = [Men+][OH-]n [Men+] = Ksp/[OH-]n = Ksp[H+]n/Kwn -lg[Men+] =-lgKsp-nlg[H+] + nlgKw (3-21)
HS- → H+ + S2则总反应: H2S →2 H+ + S2-
K2= 1.3×10-15
K1,2=K1K2=1.16×10-22
三、溶解沉淀平衡
在饱和水溶液中,H2S浓度总是保持在0.1mol/L,则 [H+]2[S2-] = K1,2×[H2S] = 1.16×10-22×0.1 = 1.16×10-23 由于在水溶液中 H 2 S 的二级电离甚微,故可近似认为 [H+] = [HS-],因此可求得溶液中[S2-]浓度:
三、溶解沉淀平衡
第二节 天然水中的平衡
溶解和沉淀是污染物在水环境中迁移的重要途径,一般金
属化合物在水中迁移能力,直观地可以用溶解度来衡量。
溶解度小者,迁移能力小; 溶解度大者,迁移能力大。 在固—液平衡体系中,需用溶度积来表征溶解度。
(完整版)第三章水环境化学答案

第三章 水环境化学1、 请推导出封闭和开放体系碳酸平衡中[H 2CO 3*]、[HCO 3-]和[CO 32-]的表达式,并讨论这两个体系之间的区别。
解:开放体系,考虑到CO 2在气液相之间的平衡,[H 2CO 3*] 不变 根据亨利定律: [CO 2(aq)] = K H Pco 2 lg[H 2CO 3*] ≈ lg[CO 2(aq)]= lg K H + lg Pco 2 = - 4.9lg[HCO 3-] = lg K 1 + lg [H 2CO 3*] + pH= -11.3 + pHlg[CO 32-] = lgK 1 + lgK 2 + lg[H 2CO 3*] + 2pH= -21.6 + 2pH*][][][*][]][[32133231CO H H KHCO CO H HCO H K +--+==*][][][*][][][32221233223221CO H H KK CO CO H CO H K K +--+⋅==⋅][][][233*32--++=CO HCO CO H C T 是常数。
的总和为各种碳酸化合态浓度假设,T C T C HCO ⎥⎦⎤⎢⎣⎡-=31αT C CO ⎥⎦⎤⎢⎣⎡-=232αT C CO H ⎥⎦⎤⎢⎣⎡*=320α122122)][][1(-+++=K H K K H α1211)][][1(-++++=H K K H α122110)][][1(-++++=H K K H K α*][][][*][]][[32133231CO H H K HCO CO H HCO H K +--+==*][][][*][][][32221233223221CO H H K K CO CO H CO H K K +--+⋅==⋅][][][][21233*32+--H K K CO HCO C CO H T 和含有的表示式,,为变量表示以:,][],[*],[21023332得到,,代入把αααT C CO HCO CO H --2、请导出总酸度、CO2酸度、无机酸度、总碱度、酚酞碱度和苛性碱度的表达式作为总碳酸量和分布系数(α)的函数。
环境化学第三章水环境化学复习知识点

第三章水环境化学1、水中八大离子:K+、Na+、Ca2+、Mg2+、HCO3-、NO3-、Cl-和SO42-为常见八种离子2、溶解气体与Henry定律:溶解于水中的气体与大气中的气体存在平衡关系,气体的大气分压P G与气体的溶解度的比表现为常数关系,称为Henry定律,该常数称为Henry定律常数K H。
[G(aq)] = K H PG K H-气体在一定温度下的亨利定理常数 (mol/L.Pa) PG -各种气体的分压 (Pa)3、水体中可能存在的碳酸组分 CO2、CO32-、HCO3-、H2CO3 ( H2CO3*)4、天然水中的碱度和酸度:碱度:水中能与强酸发生中和作用的全部物质,即能够接受质子H+的物质总量;酸度:凡在水中离解或水解后生成可与强碱(OH-)反应的物质(包括强酸、弱酸和强酸弱碱盐)总量;即水中能与强碱发生中和作用的物质总量。
5、天然水中的总碱度=HCO3-+2CO32-+ OH- —H+6、水体中颗粒物的类别(1)矿物微粒和粘土矿物(铝或镁的硅酸盐)(2)金属水合氧化物(铝、铁、锰、硅等金属)(3)腐殖质 (4)水体悬浮沉积物 (5)其他(藻类、细菌、病毒等)影响水体中颗粒物吸附作用的因素有:颗粒物浓度、温度、PH。
7、水环境中胶体颗粒物的吸附作用有表面吸附、化学吸附、离子交换吸附和专属吸附。
8、天然水的PE随水中溶解氧的减少而降低,因而表层水呈氧化性环境。
9、吸附等温线:在一定温度,处于平衡状态时被吸附的物质和该物质在溶液中的浓度的关系曲线称为吸附等温线;水环境中常见的吸附等温线主要有L-型、F-型和H-型。
10、无机物在水中的迁移转化过程:分配作用、挥发作用、水解作用、光解作用、生物富集、生物降解作用。
11、PE:pE 越小,电子活度越高,提供电子的倾向越强,水体呈还原性。
pE 越大,电子活度越低,接受电子的倾向越强,水体呈氧化性。
pe影响因素:1)天然水的pE随水中溶解氧的减少而降低;2)天然水的pE随其pH减少而增大。
第三章-水环境化学(第一次课)

ii 表示方法
总含盐量(Total Dissolved Solids-TDS),也称总矿化度: 水中所含各种溶解性矿物盐类的总量称为水的总含盐量。
总含盐量=Σ阳离子+Σ阴离子
iii 测定
重量法
总含盐量=溶解固形物
cT
[H
2 CO
* 3
](1
K1 [H
]
K1K 2 [H ]2
)
0
[H2CO*3
]
1
cT
(1
K1 [H ]
K1K 2 [H ]2
) 1
说明pH决定它们的 含量多少
1
[HCO
3
]
cT
[H ] (
K1
1
K2 [H
) ]
1
2
[CO32 ] cT
([H ]2 K1K 2
[H ] 1)1 K2
lg c2 H • ( 1 1 ) 15.59103 ( 1 1 ) c1 2.303R T1 T2 2.3038.314 298.15 273.15
c2 8.289 1.778 14.74mg / L
0 ℃时的含量14.74mg/L 20 ℃时为9.227mg/L
2.在一个标准大气压下,25℃时CO2在水中的溶解度。已知 CO2在干空气中的含量为0.0314%(体积)。
氧气的分压为
0.9813105 20.95% 0.2056105 Pa
[G(O2) ] KH PG 1.26108 0.2056105 2.590104 mol / L
[G(O2) ] 2.590104 32 8.289mg / L
第三章水环境化学

TDS=[K++Na++Ca2++Mg2+]+[HCO3-+NO3-+Cl-+SO42-
2、天然水的性质
(Characteristic of Natural Waters) (1)碳酸平衡(Balance of H2CO3) 水体中存在四种化合态:
CO2、CO32-、HCO3-、H2CO3
第三章 水环境化学
(Water Environmental Chemistry)
本章重点
1、无机污染物在水体中进行沉淀-溶解、氧化-还原、 配合作用、吸附-解吸、絮凝-沉淀的基本原理;
2、计算水体中金属存在形态;
3、pE计算;
4、有机污染物在水体中的迁移转化过程和分配系数、 挥发速率、水解速率、光解速率和生物降解速率的 计算方法。
农药
有机氯 有机磷
多氯联苯 (PCBS) 卤代脂肪烃 醚
单环芳香族化合物 苯酚类和甲酚类 酞酸酯类 多环芳烃(PAH) 亚硝胺和其他化合物
2、金属污染物 (Metal Pollutant)
Cd、 Hg、 Pb、 As、 Cr、 Cu、 Zn、 Tl、 Ni、 Be
第二节 水中无机污染物的迁移转化
强酸 弱酸 强酸弱碱盐
总酸度= [H+]+ [ HCO3-] +2[H2CO3*] - [ OH-] CO2酸度= [H+]+ [H2CO3*] - [CO32-] - [ OH-] 无机酸度= [H+]- [ HCO3-]-2 [CO32-] - [ OH-]
二、水中污染物的分布及存在形态
1、有机污染物 (Organic Pollutant)
环境化学课件第三章 水环境化学

图 水环境体系(水体)
<返回>
水环境化学是研究化学物质在天然水体中的存在形态、反应机制 、迁移转化和归趋的规律及其化学行为对生态环境的影响。水环 境化学是环境化学的重要组成部分,为水污染控制和水资源的保 护提供了科学依据。
水环境化学研究的领域包括河口、海洋、河流、湖泊等。
研究的特点是: (1)体系非常复杂 离子、分子、胶体微粒 (2)界面现象突出、重要 重金属、有机物附着在胶体微粒面
海湾 海
大洋 海洋沉积物间隙水
DP Dg K
P 0
水循环 Water cycle
1.水的自然循环: 特点:①由降雨量自然循环的大致尺度
②水的性质基本不变 2.水的社会循环 特点:①工业与生活污水的产生与排放是主
要的污染源 ②水的性质不断变化
水资源的主要问题
●我国水资源人均和亩均水量少; ●水资源在地区分布上很不均匀,水土资源 组合不平衡 ●水量年内及年际变化大,水旱灾害频繁 ●水土流失严重,许多河流含沙量大; ●我国水资源开发利用各地很不均衡
第三章 水环境化学 Aquatic chemistry
知识点:认识天然水的基本特征和污染物的分布形 态,掌握水中污染物的迁移转化规律,学 会建立水质模型
重 点:水中污染物的迁移和转化规律 难 点:水质模型的建立
水圈:Hydrosphere 1978年.R.A.Horne
环境化学第三章__水环境化学(PPT)

第十二页,共九十页。
代入亨利定律即可求出氧在水中的摩尔(mó ěr)浓度为:
[O2(aq)]= KH·PO2=1.26×10-8×0.2056×105 =2.6×10-4 mol/L
氧的分子量为32,因此其溶解度为8.32 mg/L。
第三章 水环境 化学 (huánjìng)
第一节 天然水的根本特征及污染物的存在形态(xíngtài)
第二节 水中无机污染物的迁移转化 第三节 水中有机污染物的迁移转化
第一页,共九十页。
内容提要: 本章主要介绍天然水的根本特征,水中重要污染物存在形态及分布, 污染物在水环境中的迁移转化(zhuǎnhuà)的根本原理。
第二十三页,共九十页。
❖❖[图CO中3的2p-]H可=以8.3忽可略以不作计为,一水个分中界只点有,[CpOH2<〔8.a3q,〕很]、小[,H22CO3]、
❖[HCO3-],可以只考虑一级电离平衡(pínghéng),即此时:
❖
❖❖❖当溶所液以的ppHH>=8p[.3KH时1-],lg[[KHH122[CC[HHOO23C3C**]OO3]+3可*]l]g以[H忽C略O不3-计]。,水中只存在
P↑↓R
C 1 0 6H 2 6 3 O 1 1 0N 1 6P 1 3 8 O 2
第十七页,共九十页。
〔二〕天然水的性质(xìngzhì)
1、碳酸平衡〔重点〕
对于CO2-H2O系统,水体中存在着CO2〔aq〕、H2CO3、HCO3-和CO32-等 四种化合态,常把CO2(aq)和H2CO3合并为H2CO3*,实际上H2CO3含量 (hánliàng)极低,主要是溶解性气体CO2(aq)。
03-5环境化学第三章__水环境化学

L M
K1
L ML
K2
L ML 2 Kn-1
L
…………….
Kn
MLn
β2
βn
Kn
[MLn ] [MLn1 ][L]
n
[MLn ] [M ][L]n
=K1K2……Kn
➢Kn或βn越大,配合离子愈难离解,配合物也愈 稳定。因此,从稳定常数的值可以算出溶液中各 级配合离子的平衡浓度。
一般而言,配合物的稳定性取决于三个因素: ➢配位体的性质,多齿配位体比单齿配位体稳定 ➢金属离子半径与电荷:
配位体半径越小,越稳定 金属离子的化合价越高,则一般配合物越稳定 ➢金属在元素周期表中的位置:同族元素从上到下 其络合物稳定性增加。
稳定常数是衡量配合物稳定性大小的尺度。 包括:逐级生成常数(K)和累积生成常数(β)
2- 4
K1
[MeOH ] [Me2 ][OH ]
K2
[Me(OH )20 ] [MeOH ][OH ]
K3
[Me(OH )3 ] [Me(OH )20 ][OH
]
K4
[Me(OH)4 2 ] [Me(OH) 3][OH ]
或者也可以写为:Me2++ OH-→Me(OH)+
Me2++
2OH-→Me(OH)
=β1 [Me2+][OH-]/ [Me]T 在一定温=度ψ0下β1,[OβH1、-]β2、…、βn等为定值, ψ仅是pH值的函数。 因此ψ可2 =以[M表e示(OCHd)22+0—] /O[MH-e]配T =合ψ离0子β2在[O不H同-]p2 H值下的分布。
ψ3 =[Me(OH) 3-] / [Me]T = ψ0 β3[OH-]3 ψ4 =[Me(OH) 42-] / [Me]T = ψ0 β4[OH-]4 ψn =[Me(OH) nn-2] / [Me]T = ψ0 βn·[OH-]n
(完整版)第三章水环境化学

分布分数:α0 、α1、α2分别表示化合物在总量中的比 例则:
α0=[H2CO3*]/{[H2CO3*]+[HCO3]+[CO32-] } α1 =[HCO3-]/{[H2CO3*]+[HCO]+[CO32-] } α2=[CO32-]/{[H2CO3*]+[HCO3-]+[CO32-] }
2003年我国万元GDP用水量为465m3,是世界平均水平的4 倍;农业灌溉用水有效利用系数为0.4~0.5,是发达国家 的1/2;水的重复利用率为50%,发达国家已达到了85%; 全国城市供水管网漏损率达20%左右。
水危机的出现
根据水利部《21世纪中国水供求》分析,2010年 我国工业、农业、生活及生态环境总需水量在中 等干旱年为6988亿立方米,供水总量6670亿立方 米,缺水318亿立方米。这表明,2010年后我国 将开始进入严重的缺水期。
CT=[H2CO3*]+[HCO3- ]+[CO32- ]
试计算封闭体系和开放体系中各碳酸形态的表示式? (1)封闭体系
总碳酸量不变 (2)开放体系
[H2CO3*]保持不变
封闭体系:
0
H]
k1k2 [H ]2
)1
1
HCO3 CT
(1
[H k1
]
k2 [H
)1 ]
溶解于水中气体的量可能高于亨利定律表示的量。
氧在25℃ ,1.013X105Pa下溶解度计算:
由亨利定律[G(aq)]=KH*pG
不同温度下,气体在水中溶解度的计算:
CO2在25℃ ,1.013X105Pa下溶解度计算
(4)水体富营养化(eutrophication) 由于水体中氮磷营养物质的富集,引起
环境化学(袁加程)第三章-水环境化学

3. 水体污染及水体污染源
主要的水环境污染物
悬浮物 植物性营养物 酸碱污染 难降解有机物 热污染
总碱度 = [HCO3-] + 2[CO32-] + [OH-] – [H+]
2. 天然水体中的化学平衡
酸度是指水中能与强碱发生中和作用的全部物质,亦即放 出H+或经水解能产生H+的物质总量。包括强酸、弱酸、强酸弱 碱盐等。
总酸度 = [H+] + [HCO3-] + 2[H2CO3] – [OH-]
第三章 水环境化学
第一节 水环境化学基础
天然水的基本特性 天然水体中的化学平衡 水体污染及水体污染源 水体的自净作用与水环境容量
1. 天然水的基本特性
1.1 天然水的组成
(1) 天然水的主要离子组成: K+, Na+, Ca2+, Mg2+, HCO3-, NO3-, Cl-, SO42- 为天然水中常 见的八大离子,占天然水离子总量的95-99%。
[HCO
3
]
K1[H2CO3 ] [H ]
[CO32- ]
K1K2[H2CO3 ] [H ]2
0
[H2CO3 ]
[H2CO3 ]
K1[H 2 CO 3 [H ]
]
K1K2[H2CO3 ] [H ]2
(1
K1 [H
]
K1 K 2 [H ]2
) 1
2. 天然水体中的化学平衡
第三章 水环境化学
pKc1
pKc2
结论:
Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ pH<<pKc1 pH=pKc1 pH=pKc2 pH>>pKc2 pH=1/2(pKc1+pkc2) H2CO3* αH2CO3*=αHCO3αHCO3-=αCO32CO32HCO3-
3:开放碳酸体系
= -21.6 + 2pH
由以上方程式作lgc—pH图可看出
3. 碱度的测定:
(原理: 中和滴定法,根据消耗的酸量求出)
c V 1000 碱度(mmol/L ) Vs 单位:mmol[H ]/L
式中:Vs——水样体积)(mL) c——HCl浓度(mol/L) V——HCl体积(mL)
思考:碱度和碱性的区别
例如:若一个天然水的pH为7.0,碱度为1.4mmo1/l, 求需加多少酸才能把水体的pH降低到6.0。
二、水体中的污染物
病原体污染物
耗氧污染物 植物营养物 石油类污染物 放射性物质
酸、碱、盐无机污染物
热污染
有毒污染物
(1)重金属
(2)无机阴离子 (3)有机农药、多氯联苯 (4)致癌物质 (5)一般有机物质
三、水体中的污染物的运动过程
大气降落物 污水排入
1.稀释、扩散过程
3.转化过程
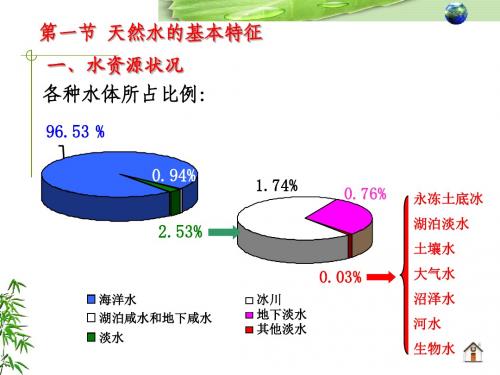
溶解在天然水中的物质
1、主要离子 主要阳离子有: Ca2+、Mg2+、Na+、K+。 主要阴离子有: Cl-、SO42-、HCO3-、CO32-。 这八种离子可占水中溶解固体总量的95%~99%以上。 陆地水中下列成分的含量顺序一般为: HCO3- >SO42- >Cl-,Ca2+ >Na+ >Mg2+ 海水中相应的含量顺序为: Cl- >SO42- >HCO3-,Na+ >Mg2+ >Ca2+。
第三章 水环境化学

6
1、天然水的组成(离子、溶解气体、水生生物) 天然水是含有可溶性物质和悬浮物的一种天 然溶液。可溶性物质非常复杂,主要是岩石风化 过程中,经过水溶解迁移、搬运到水中的地壳矿 物质。
7
(1)天然水中的主要离子组成
天然水中常见的八大离子: K+ 、 Na+ 、 Ca2+ 、 Mg2+ 、 HCO3- 、 NO3- 、 Cl- 、 SO42-。 常见的八大离子占天然水中离子总量的95%-99%。 水中这些主要离子,常用来作为表征水体主要化学特征性指标。 硬 Ca2+ HCO3度 Mg2+ CO32碱 度 酸 H+ OH碱 金 属
1 =0.3086 2.24 1 2.24 =0.6914 2.24 1
[ H 2 CO3 ] [ HCO3 ]
*
所以此时[H2CO3*]=α0CT=0.3086×3×10-3molL-1=0.9258×10-3molL-1 [HCO3-]=α1CT=0.6914×3×10-3molL-1=2.0742×10-3molL-1 加酸性废水到pH=6.7,有0.9258×10-3molL-1的H2CO3*生成,故每升河水中要加入 0.9258×10-3mol的H+才能满足上述要求,这相当于每升河水中加入浓度为1×10-2 molL-1的硫酸废水的量V为: V=0.9258×10-3mol/(2×1×10-2molL-1)=0.0463L=46.3mL。因此相当于每升河水中
100 CO2+H2CO3 HCO3CO32-
80 60 40 20 0
2 4 6 pH 8 10 12
28
碳酸化合态分布图的理解: a、总体分布态势:
环境化学(第三章水环境化学)第三节

生物浓缩因子 (BCF)
如有人测量了生物摄取有机毒物速率常 数 K1与生物释放有机毒物的速率常数K2
BCF = K1 / K2 而且发现一些稳定的化合物在虹鳟鱼 肌肉中累计lg:
lg(BCF) = -0.802 lgSw - 0.497
n = 7 r = 0.977
生物浓缩因子 (BCF)
上述结果是对较高等生物而言, 对占水体生物量大部分的微生物也 可获得类似的相关方程。
二、挥发作用(略)
挥发作用是指有机物质从溶解态转向 气态的过程。挥发速率与有毒物的性 质和水体特征有关
一、分配作用(吸附与解吸)
1 分配理论 吸着(sorption)指有化合物在土壤
(沉积物)中的吸着存在,可以用二种机理 来描述有机污染物和土壤质点表面间物 理化学作用的范围。
分配作用(partition) 吸附作用(adsorption)
吸附作用(adsorption)
在非极性有机溶剂中,土壤矿物质对有机 化合物的表面吸附作用,或干土壤矿物 质对有机化合物的表面吸附作用。
前者靠范德华力,后者是化学键力,如氢 键、离子偶极键、配位键、π键等。
吸附作用(adsorption)
吸附等温线非线性,并存在竞争吸附作 用,有放热现象。
Lambert 研究了农药在土壤-水间的分 配,认为当土壤有机质含量在0.5-40%范
围内其分配系数与有机质的含量成正比
吸附作用(adsorption)
生物浓缩因子 (BCF)
lg(BCF) = 0.542 lgKow + 0.124 n=8 r=0.948
lg(BCF) = 0.980 lgKow - 0.063 n=5 r=0.991
环境化学课后答案(戴树桂)主编_第二版(1-7章)

第三章水环境化学1、什么是表面吸附作用,离子交换吸附作用和专属吸附作用并说明水合氧化物对金属离子的专属吸附和非专属吸附的区别.(1)表面吸附:由于胶体表面具有巨大的比表面和表面能,因此固液界面存在表面吸附作用.胶体表面积越大,吸附作用越强.(2)离子交换吸附:环境中大部分胶体带负电荷,容易吸附各种阳离子.胶体每吸附一部分阳离子,同时也放出等量的其他阳离子,这种作用称为离子交换吸附作用,属于物理化学吸附.该反应是可逆反应,不受温度影响,交换能力与溶质的性质,浓度和吸附剂的性质有关.(3)专属吸附:指在吸附过程中,除了化学键作用外,尚有加强的憎水键和范德化力或氢键作用.该作用不但可以使表面点荷改变符号,还可以使离子化合物吸附在同号电荷的表面上.(4)水合氧化物对金属离子的专属吸附与非金属吸附的区别如下表所示.快速可逆请叙述氧化物表面吸附配合模型的基本原理以及与溶液中配合反应的区别。
2、已知Fe3+与水反应生成的主要配合物及平衡常数如下:Fe3+ + H2OFe(OH)2+ + H+ lgK1= - 2.16Fe3+ + 2H2OFe(OH)2+ + 2H+ lgK2= - 6.74Fe(OH)3(s) Fe3+ + 3OH- lgKso= - 38Fe3+ + 4H2OFe(OH)4- + 4H+ lgK4= - 232Fe3+ + 2H2OFe2(OH)24+ + 2H+ lgK= - 2.91请用pc-pH图表示Fe(OH)3(s)在纯水中的溶解度与pH的关系.解:(1)K1=[Fe(OH)2+][H+]/ [Fe3+]=[Fe(OH)2+]KW3/Kso[H+]2p[Fe(OH)2+]=3 lgKW - lgKso + 2 pH - lgK1=2 pH - 1.84(2)K2=[Fe(OH)2+][H+]2/ [Fe3+]=[Fe(OH)2+]KW3/Kso[H+]p[Fe(OH)2+]=3 lgKW - lgKso + pH - lgK2=pH + 2.74(3)Kso=[Fe3+][OH-]3=[Fe3+]KW3/[H+]3p[Fe3+]=3 lgKW - lgKso + 3 pH=3 pH - 4(4)K4=[Fe(OH)4-][H+]4/ [Fe3+]=[Fe(OH)4-][H+]KW3/ Ksop[Fe(OH)4-]=3 lg KW - lgK4 - lgKso - pH=19 - pH(5)K=[Fe2(OH)24+][H+]2/ [Fe3+]2=[Fe2(OH)24+]KW6/ Kso2[H+]4p[Fe2(OH)24+]=6 lg KW - lgK - 2 lgKso + 4 pH=4 pH - 5.09用pc-pH图表示Fe(OH)3(s)在纯水中的溶解度与pH的关系如下4解释下列名词:分配系数;标化分配系数;辛醇-水分配系数;生物浓缩因子;亨利定律常数;水解速率;直接光解;光量子产率;生长物质代谢和共代谢.(1)分配系数:在土壤-水体系中,土壤对非离子性有机化合物的吸着主要是溶质的分配过程(溶解),即非离子性有机化合物可通过溶解作用分配到土壤有机质中,并经过一定时间达到分配平衡,此时有机化合物在土壤有机质和水中含量的比值称为分配系数.(2)标化分配系数:有机化合物在颗粒物-水中的分配系数与颗粒物中有机碳呈正相关,以固相有机碳为基础的分配系数即标化分配系数.(3)辛醇-水分配系数:有机化合物的正辛醇-水分配系数(KOW)是指平衡状态下化合物在正辛醇和水相中浓度的比值.它反映了化合物在水相和有机相之间的迁移能力,是描述有机化合物在环境中行为的重要物理化学参数.KOW与化合物的水溶性,土壤吸附常数和生物浓缩因子等密切相关.(4)生物浓缩因子:有机毒物在生物体内浓度与水中该有机物浓度之比.(5)亨利定律常数:通常可理解为非电解质稀溶液的气-水分配系数.(6)水解速率:反映某一物质在水中发生水解快慢程度的一个参数.(7)直接光解:化合物本身直接吸收太阳能而进行分解反应.(8)光量子产率:分子被活化后,它可能进行光反应,也可能通过光辐射的形式进行"去活化"再回到基态,进行光化学反应的光子数占吸收光子数之比称为光量子产率.(9)生长物质代谢和共代谢:生物降解过程中,一些有机污染物作为食物源提供能量和提供酶催化反应分解有机物,这称为生长物质代谢.某些有机污染物不能作为微生物的唯一碳源与能源,必须有另外的化合物存在提供微生物碳源或能源时,该有机物才能被降解,这种现象称为共代谢.5请叙述有机物在水环境中的迁移,转化存在哪些重要过程.(1)负载过程:污水排放速率,大气沉降以及地表径流引入有机毒物至天然水体均将直接影响污染物在水中的浓度.(2)形态过程:①酸碱平衡:天然水中pH决定着有机酸或碱以中性态存在的分数,因而影响挥发及其他作用.②吸着作用:疏水有机化合物吸着至悬浮物上,由于悬浮物质的迁移而影响它们以后的归趋.(3)迁移过程:①沉淀-溶解作用:污染物的溶解度范围可限制污染物在迁移,转化过程中的可利用性或者实质上改变其迁移速率.②对流作用:水力流动可迁移溶解的或者被悬浮物吸附的污染物进入或排出特定的水生生态系统.③挥发作用:有机污染物可能从水体进入大气,因而减少其在水中的浓度.④沉积作用:污染物被吸附沉积于水体底部或从底部沉积物中解吸,均可改变污染物的浓度.(4)转化过程:①生物降解作用:微生物代谢污染物并在代谢过程中改变它们的毒性.②光解作用:污染物对光的吸收有可能导致影响它们毒性的化学反应的发生.③水解作用:一个化合物与水作用通常产生较小的,简单的有机产物.④氧化还原作用:涉及减少或增加电子在内的有机污染物以及金属的反应都强烈地影响环境参数.(5)生物累积过程:①生物浓缩作用:通过可能的手段如通过鱼鳃的吸附作用,将有机污染物摄取至生物体.②生物放大作用:高营养级生物以消耗摄取有机毒物进入生物体低营养级生物为食物,使生物体中有机毒物的浓度随营养级的提高而增大.请叙述有机物水环境归趋模式的基本原理。
资源与环境化学 第三章 第一部分(天然水组成与化学平衡)

不同温度下气体在水中的溶解度:Clausius-Clapeyron方程
C2 H 1 1 lg ( ) C1 2.303 R T1 T2 C1 , C2 为绝对温度为T1 , T2时气体在水中的溶解度 H 溶解热, J/mol R 气体常数,8.314 J/mol K
《资源与环境化学》 第三章 水环境化学
第三章 水环境化学
Chapter 3. Aquatic Environmental Chemistry
第一部分 天然水的组成与化学平衡
主讲:刘耀驰
中南大学化学化工学院
第1页
《资源与环境化学》 第三章 水环境化学
本章重点
无机污染物在水体中进行沉淀-溶解、氧化还原、配合作用、吸附-解吸、絮凝-沉淀的基 本原理; 计算水体中金属存在形态;
《资源与环境化学》 第三章 水环境化学
(3) 气体在水中的溶解性
亨利定律:大气中的气体与溶液中同种气体间的平衡为:
kH 是各种气体在一定温度 下的亨利定律常数 (mol/L· Pa),pg为分压
[G(aq)] = kH×pg
亨利定律并不能说明气体在溶液中进一步的化学反应 溶解于水中的实际气体量,可以大大高于亨利定律表示的量
K2
2 ] [H ][CO 3 -] [HCO 3
K1[H 2CO3 ] [HCO 3 ] [H ] 2 ] K 2 K1[H 2CO3 ] [CO3 [H ]
第10页
《资源与环境化学》 第三章 水环境化学
(4) 水生生物
生态系统、食物链中的一个重要环节; 生产者、消费者、分解者; 自养生物、异养生物; 生产率、富营养化、C、N、P
第11页
第3章:水环境化学2-1

一、颗粒物与水之间的迁移
1、水中颗粒物的类别
天然水中颗粒物主要包括五大类:矿物、金属水合氧 化物、腐殖质、悬浮物、其他泡沫、表面活性剂等半胶体 以及藻类、细菌、病毒等生物胶体。
(1)非粘土矿物和粘土矿物:都是原生岩石在风化过程 中形成的。
非 粘 土 矿 物 : 天 然 水 中 常 见 为 石 英 (SiO2) 、 长 石 (KalSi3O8)等,晶体交错,结实、颗粒粗,不易碎裂,缺 乏粘结性(例如沙子主要成分为:SiO2)。
第二节、水中无机污染物的迁移转化
一、颗粒物与水之间的迁移 二、水中胶体颗粒物聚集的基本原理和方式 三、溶解和沉淀 四、氧化—还原
五、配合作用
无机污染物,特别是重金属和准金属等污染物,一旦进入 水环境,不能被生物降解;
主要通过吸附—解吸、沉淀—溶解、氧化—还原、配合作 用、胶体形成等一系列物理化学作用进行迁移转化,参与和 干扰各种环境化学过程和物质循环过程; 最终以一种或多种形式长期存留在环境中,造成永久性的 潜在危害。 重点介绍重金属污染物在水环境中迁移转化的基本原理。
在水环境中,配合离子、有机离子、有机高分子和无机高 分子的专属吸附作用特别强烈。例如,简单的Al3+、Fe3+高 价离子并不能使胶体电荷因吸附而变号,但其水解产物却 可达到这种效果,这就是发生专属吸附的结果。 水合氧化物胶体对重金属离子有较强的专属吸附作用,这 种吸附作用发生在胶体双电层的 Stern层中,被吸附的金属 离子进入Stern层后。不能被通常提取交换性阳离子的提取 剂提取,只能被亲和力更强的金属离子取代,或在强酸性 条件下解吸。
粘土矿物:天然水中常见为云母、蒙脱石、高 岭石,层状结构,易于碎裂,颗粒较细,具有粘 结性,可以生成稳定的聚集体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
饱和溶解氧浓度ρs
氧垂曲线
极限溶解氧: K1 L0 K1 xc ρc = ρs − exp(− ) K2 u K1 L0 K1 xc Dc = exp(− ) K2 u
DO
复氧曲线
耗氧曲线
xc 溶解氧氧垂曲线
距离x
2.Thomas模型(忽略离散作用)
第三章 水环境化学
第三节 水质模型
水质模型原理是根据质量守恒原理,污染物在水环 境中的物理、化学和生物过程的各种模型,大体经 历了三个发展阶段:简单的氧平衡模型阶段、形态 模型阶段和多介质环境结合生态模型阶段。
一、氧平衡模型
1.Streeter—Phelps模型(S—P模型) RL = RT + RD + Ro
有机物的稳态浓度为:
CT = ( RI − Ro − RD )( K p C p + 1) / KT
P262-263 习题
28、29、31、32、33
在S—P模型的基础上,增加固悬浮物的沉淀 和上浮引起的BOD的变化速率(K3L0),则:
二、湖泊富营养化模型
目前常采用的有多元相关模型、输入输出模型、富 营养化预测模型和扩散模型。 前三种模型实际上只能预测未来湖泊水质的平均发 展趋势,而扩散模型可反映湖泊水质的空间变化, 预测污水人湖口附近局部水域可能出现的严重污染 程度。 实际应用时可根据湖泊的污染特征和基础资料等情 况选用相应模型。
有机物的消失速率
有机物由于各种转化过程和挥发过程消失的总 速率(RT)是各消失速率( Ri )的总和。
RT = ∑ Ri = c ∑( K i • Εi )
Ki—第i过程的速率常数; Ei —对于第i过程在动力学上起重要作用的环境参数(例 如,水体pH,光强,细菌总数等)
吸着的影响
当有机物浓度很低时,其在水与颗粒物(沉积物 或生物群)之间的分配,往往可用分配系数 (Kp)来表示。有机物在水中的浓度(Cw)就可 表达为:
有机污染物在水体中先发生氧化反应,消耗水 体中的氧,其速率与其在水中的有机污染物浓 度成正比 大气中的氧不断进入水体,其速率与水中的氧 亏值成正比.
根据质量守衡原理,S-P模型为:
S-P氧垂曲线
极限距离: xc = (ρ − ρ )( K 2 − K1 ) K u ]} ln{ 2 [1− s 0 K 2 − K1 K1 L0 K1
预测模型的基本表达式如下:
1. Vollenweider公式
2. Dillon公式
3. 合田健公式
4. OECD公式
三、有毒有机污染物的归趋模型
有机污染物在水中迁移转化的重要过程:
负载过程(输入过程) 形态过程 迁移过程 转化过程 生物累积过程
用公式叙述归趋模型,可分为三各步 骤:
1. 计算有机物因挥发和转化而从水环境中消失的 速率; 2. 吸着过程对有机物消失过程的影响; 3. 对于一个被研究的水生生态系统、考虑有机物 的输入、稀释及最终从系统中输出的速率,从 而计算在系统中的浓度和半衰期。
Cw = CT / ( K p C p + 1)
KT CT RT = K P CP + 1
除非在颗粒物上有机物转化的速率大于水中的转化速 率,吸着的净效应是降低有机物从水中消失的总速率。
稳态时的浓度
在一定范围内水体内,当有机物的总消失速率RL 是RT,稀释速率RD和输出速率Ro之和,当总消失 速率RL和输入速率Ri时,有机毒物就达到了稳态 浓度.
