生物催化剂讲课课件演示文稿
合集下载
生物催化剂——酶PPT课件

• 酶的催化作用具有___专__一__性_____
第8页/共22页
专一性的实质:
酶的活性中心与底物分子在空间结构上有特 殊的匹配关系,只有当酶活性中心能与底物 结合时,才可启动化学反应的发生。
第9页/共22页
探究实验的一般步骤
• 提出问题 • 作出假设 • 设计实验 • 实施实验 • 得出结论 • 表达交流
第2页/共22页
产生场所
酶是活细胞产生的一类具有
生物催化作用的有机物※ 。又
称为生物催化剂。
作用
化学本质
※ 绝大多数是蛋白质 第3页/共22页
实验1
2滴肝脏研磨液
H2O2溶液2ml
2滴FeCl溶 液
1号试管
2号试管
第4页/共22页
质量分数为20%的新 质量分数为3.5%的氯化 鲜肝脏研磨液1滴 铁溶液1滴
生物催化剂--酶
Enzyme
第1页/共22页
什么是酶? “科技探索”
1920年,德国科学家维尔斯塔特提出酶既不 是 蛋白质 也不是 糖类 。
1926年,美国生化学家萨母纳发现脲酶是一 种 蛋白质 。
1930年,美国生化学家诺索普及同事证明胃蛋白 酶、胰蛋白酶、糜蛋白酶等结晶都是 蛋白质 。
20世纪80年代以来,美国科学家切赫和奥特曼发 现少数 RNA 也具有生物催化作用。
2ml 100℃浴
分别用镊子夹起若干同样大小的滤纸 片浸在处理过的新鲜肝脏提取液中数 秒,取出被用。
分别向滤纸片上滴加H2O2溶液
几乎没有气泡
大量气泡
没有气泡
第12页/共22页
在一定范围内,随着温度的升高,酶的活 性逐渐增强;
达到最适温度时,酶
的活性最高;
《生物催化剂技术》课件
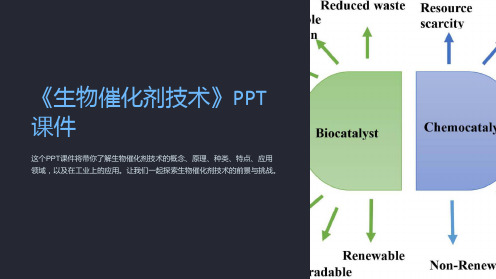
《生物催化剂技术》PPT 课件
这个PPT课件将带你了解生物催化剂技术的概念、原理、种类、特点、应用 领域,以及在工业上的应用。让我们一起探索生物催化剂技术的前景与挑战。
催化剂的概念与原理
催化剂是指能够加速化学反应速率,但本身在反应中不被消耗的物质。催化 剂通过降低反应的活化能,提供新的反应路径来促进反应的进行。
食品加工
酶在食品加工中的应用可以提 高产品质量、改善口感和延长 保质期。
生物催化剂的前景与挑战
1
前景
生物催化剂具有巨大的应用潜力,可以提高反应效率、节约资源,同时也对环境 友好。
2
挑战
生物催化剂在活性、稳定性、特异性等方面仍面临一定的挑战,需要进一步的研 究和发展。
3
研究方向
未来的研究重点包括提高催化剂的催化效率、改善催化剂的特异性以及提高催化 剂的稳定性。
3 组织
组织催化剂是一种利用生物组织中的酶或其他生物大分子来催化化学反应的生物催化剂。
生物催化剂的特点
高效选择性
酶对底物具有高度选择性,可以选择性地催化特定的反应。
温和条件
生物催化剂的反应一般在温和的条件下进行,不需要高温或高压。
可重复使用
生物催化剂可以通过简单的处理方法得到再生并且反复使用,降低了生产成本。
生物催化剂的应用领域
医药制造
• 药物合成 • 酶替代治疗
食品加工
• 酶改善食品质量 • 酶降解食品成分
环境保护
• 废水处理 • 废弃物降解
生物催化剂在工业上的应用
工业生产
生物催化剂在生物燃料生产、 生物塑料制造等工业领域发挥 着重要作用。
制药行业
酶催化技术在制药行业中得到 广泛应用,用于药物合成和药 物转化。
这个PPT课件将带你了解生物催化剂技术的概念、原理、种类、特点、应用 领域,以及在工业上的应用。让我们一起探索生物催化剂技术的前景与挑战。
催化剂的概念与原理
催化剂是指能够加速化学反应速率,但本身在反应中不被消耗的物质。催化 剂通过降低反应的活化能,提供新的反应路径来促进反应的进行。
食品加工
酶在食品加工中的应用可以提 高产品质量、改善口感和延长 保质期。
生物催化剂的前景与挑战
1
前景
生物催化剂具有巨大的应用潜力,可以提高反应效率、节约资源,同时也对环境 友好。
2
挑战
生物催化剂在活性、稳定性、特异性等方面仍面临一定的挑战,需要进一步的研 究和发展。
3
研究方向
未来的研究重点包括提高催化剂的催化效率、改善催化剂的特异性以及提高催化 剂的稳定性。
3 组织
组织催化剂是一种利用生物组织中的酶或其他生物大分子来催化化学反应的生物催化剂。
生物催化剂的特点
高效选择性
酶对底物具有高度选择性,可以选择性地催化特定的反应。
温和条件
生物催化剂的反应一般在温和的条件下进行,不需要高温或高压。
可重复使用
生物催化剂可以通过简单的处理方法得到再生并且反复使用,降低了生产成本。
生物催化剂的应用领域
医药制造
• 药物合成 • 酶替代治疗
食品加工
• 酶改善食品质量 • 酶降解食品成分
环境保护
• 废水处理 • 废弃物降解
生物催化剂在工业上的应用
工业生产
生物催化剂在生物燃料生产、 生物塑料制造等工业领域发挥 着重要作用。
制药行业
酶催化技术在制药行业中得到 广泛应用,用于药物合成和药 物转化。
生物催化剂 ppt课件

ppt课件 12
在食品工业中的应用
在食品工业中可以用来降低粘度、提高抽职效率(或 分离效率)、增香、实现生物转化等。在这些应用方 面也同样推广着固定酶技术, 目前世界上规模最大 的固定酶工艺就是用固定化葡萄糖异构酶以葡萄糖 为原料生产果糖糖浆。具体方法是将葡萄糖异构酶 固定在二乙胺乙基纤维素上,异构化条件是温度为 20℃,PH为6—9。这种固定酶的活力可达90% , 并且如果酶的皤性降低可加入新酶使之再生。
ppt课件 9
生物催化剂的来源
目前,少数生物催化剂是从动物肝脏或植物 中提取的,多数 来自于微生物细胞。除真核生物。 和单细胞酵母(如从南极 假丝酵母中得到了高效脂肪酶CalB)外,原核微生物是生物 催化剂的主要来源。由于原核微生物(细菌和古生菌)是地球 上出现最早和数量最多的生命形态,经历了漫长的演变后, 许多微生物为适应“恶劣”环境而具有了非常高的耐受性, 从而可从中得到大量高性能的生物催化剂。现在,虽然微生 物培养也有其局限性,如很多生物体用当前技术还无法进行 培养,但通过微生物培养来获得生物催化剂仍是最普通和最 有效的方法。这是因为微生物培养能加速生物体的新陈代谢 而增加其数量,为以后的高通量筛选提供了有利条件。
ppt课件 19
生物催化剂应用于酰胺的合成及 水解反应
一
酰胺和肽的合成 酶催化反应在青霉索和头孢菌素的酰胺键生 成中,起着极为重要的作用。例如在酶的作 用下,7一氨基去乙酰氧基头孢菌素酸(7一 ADAc)和D一苯基甘氮酸可以转变为头孢菌素。
ppt课件
20
当底物分子含有多种不同反应能力的官能团 时,若想得到单一的目标产物.选用酶作催 化剂是最佳的,例如天冬门酰胺的合成
ppt课件 17
ppt课件
在食品工业中的应用
在食品工业中可以用来降低粘度、提高抽职效率(或 分离效率)、增香、实现生物转化等。在这些应用方 面也同样推广着固定酶技术, 目前世界上规模最大 的固定酶工艺就是用固定化葡萄糖异构酶以葡萄糖 为原料生产果糖糖浆。具体方法是将葡萄糖异构酶 固定在二乙胺乙基纤维素上,异构化条件是温度为 20℃,PH为6—9。这种固定酶的活力可达90% , 并且如果酶的皤性降低可加入新酶使之再生。
ppt课件 9
生物催化剂的来源
目前,少数生物催化剂是从动物肝脏或植物 中提取的,多数 来自于微生物细胞。除真核生物。 和单细胞酵母(如从南极 假丝酵母中得到了高效脂肪酶CalB)外,原核微生物是生物 催化剂的主要来源。由于原核微生物(细菌和古生菌)是地球 上出现最早和数量最多的生命形态,经历了漫长的演变后, 许多微生物为适应“恶劣”环境而具有了非常高的耐受性, 从而可从中得到大量高性能的生物催化剂。现在,虽然微生 物培养也有其局限性,如很多生物体用当前技术还无法进行 培养,但通过微生物培养来获得生物催化剂仍是最普通和最 有效的方法。这是因为微生物培养能加速生物体的新陈代谢 而增加其数量,为以后的高通量筛选提供了有利条件。
ppt课件 19
生物催化剂应用于酰胺的合成及 水解反应
一
酰胺和肽的合成 酶催化反应在青霉索和头孢菌素的酰胺键生 成中,起着极为重要的作用。例如在酶的作 用下,7一氨基去乙酰氧基头孢菌素酸(7一 ADAc)和D一苯基甘氮酸可以转变为头孢菌素。
ppt课件
20
当底物分子含有多种不同反应能力的官能团 时,若想得到单一的目标产物.选用酶作催 化剂是最佳的,例如天冬门酰胺的合成
ppt课件 17
ppt课件
生物催化剂PowerPointPresentatio(1)
EC. X. X. X. X
例如: 乳酸脱氢酶
生物催化剂 PowerPointPresentatio(1)
1.4 酶活性(enzyme activity)
酶活性的表示方法: 酶活性指的是酶的催化能力, 用反应速度来衡量,即单位
时间里产物的增加或底物的减少。
V= dP / dt = - dS / dt 测定方法: 吸光度测定、气体分析、电化学分析等。
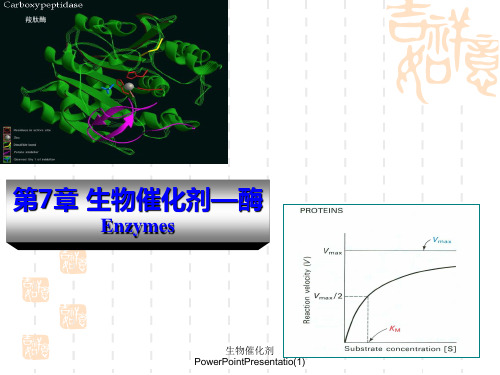
羧肽酶
第7章 生物催化剂—酶
Enzymes
生物催化剂 PowerPointPresentatio(1)
本章主要内容
酶的一般概念 酶的组成与维生素 酶的结构与功能的关系 酶的催化机理 酶反应的动力学 酶活性的调节
生物催化剂 PowerPointPresentatio(1)
1.酶的概述
1.1 定义
生物催化剂 PowerPointPresentatio(1)
酶蛋白的作用:与特定的底物结合,决定反应的专一性。
辅酶、辅基的作用:参与电子的传递、基团的转移等,决定了酶所 催化反应的性质。有十几种.
辅酶与辅基的异同点: 它们都是耐热的有机小分子,结构上常与 维生素和核苷酸有关。但是辅酶与酶蛋白结合不紧,容易经透析除去, 而辅基通常与酶蛋白共价相连。
金属离子的作用:它们是酶和底物联系的“桥梁”;稳定酶蛋白的 构象;酶的“活性中心”的部分。
专一性
即对底物的选择性或特异性。一种酶只催化一种或一类底物转变 成相应的产物。
生物催化剂 PowerPointPresentatio(1)
绝对专一性
一种酶只催化一种底物转变为相应的产物。 例如,脲酶只催化尿素水解成CO2 和NH3。
相对专一性
一种酶作用于一类化合物或一类化学键。 例如,不同的蛋白水解酶对于所水解的肽键两侧的基团有 不同的要 求。
例如: 乳酸脱氢酶
生物催化剂 PowerPointPresentatio(1)
1.4 酶活性(enzyme activity)
酶活性的表示方法: 酶活性指的是酶的催化能力, 用反应速度来衡量,即单位
时间里产物的增加或底物的减少。
V= dP / dt = - dS / dt 测定方法: 吸光度测定、气体分析、电化学分析等。
羧肽酶
第7章 生物催化剂—酶
Enzymes
生物催化剂 PowerPointPresentatio(1)
本章主要内容
酶的一般概念 酶的组成与维生素 酶的结构与功能的关系 酶的催化机理 酶反应的动力学 酶活性的调节
生物催化剂 PowerPointPresentatio(1)
1.酶的概述
1.1 定义
生物催化剂 PowerPointPresentatio(1)
酶蛋白的作用:与特定的底物结合,决定反应的专一性。
辅酶、辅基的作用:参与电子的传递、基团的转移等,决定了酶所 催化反应的性质。有十几种.
辅酶与辅基的异同点: 它们都是耐热的有机小分子,结构上常与 维生素和核苷酸有关。但是辅酶与酶蛋白结合不紧,容易经透析除去, 而辅基通常与酶蛋白共价相连。
金属离子的作用:它们是酶和底物联系的“桥梁”;稳定酶蛋白的 构象;酶的“活性中心”的部分。
专一性
即对底物的选择性或特异性。一种酶只催化一种或一类底物转变 成相应的产物。
生物催化剂 PowerPointPresentatio(1)
绝对专一性
一种酶只催化一种底物转变为相应的产物。 例如,脲酶只催化尿素水解成CO2 和NH3。
相对专一性
一种酶作用于一类化合物或一类化学键。 例如,不同的蛋白水解酶对于所水解的肽键两侧的基团有 不同的要 求。
生物化学--酶-生物催化剂PPT课件

生物素 磷酸吡哆素 辅酶B12 硫辛酸 泛醌(辅酶Q)
B3(泛酸)
B7(生物素) B6(吡哆素) B12(钴维素)
酰基转移
CO2转移 转氨基 异构化
合成酶
羧化酶 转氨酶 变位酶
传递氢和转移乙酰基 丙酮酸脱氢酶系 传递质子和电子 氧化还原酶及脱氢酶
1. NAD (辅酶I)和NADP (辅酶II)
NAD和NADP是许多脱氢酶的辅酶,参与递氢。 维生素B5是NAD和NADP的组成成分。 维生素B5(也称烟酰胺nicotinamide)
COOH
H
+ NAD
+
乳酸脱氢酶
C
O
+ NADH + H+
辅酶I
CH3
丙酮酸
还原性辅酶I
转移酶
A R +B A+ B R
裂合酶(醛缩酶、水化酶、脱氨酶)
AB A+B
从底物移去一个基团而形成双键
例1:
例2:
异构酶
A-B g
A-B g
催化同分异构体的相互转化,即底物分子内 基团或原子的重排过程
例:
思考题?
选择题
1. 酶促反应中决定酶反应专一性的部分是( ) A、酶蛋白 B、底物 C、辅酶或辅基 D、催化基团 2. 全酶是指什么?( ) A、酶的辅助因子以外的部分 B、酶的无活性前体 C、一种酶一抑制剂复合物 D、一种需要辅助因子的酶,具备了酶蛋白、辅 助因子各种成分。
3. 下列关于酶特性的叙述哪个是错误的?( ) A、催化效率高 B、专一性强 C、作用条件温和 D、都有辅因子参与催化反应 4.具有生物催化剂特征的核酶其化学本质是( ) A、蛋白质 B、RNA C、DNA D、糖蛋白 5. NAD+在酶促反应中转移( ) A、氨基 B、氢原子 C、氧原子
B3(泛酸)
B7(生物素) B6(吡哆素) B12(钴维素)
酰基转移
CO2转移 转氨基 异构化
合成酶
羧化酶 转氨酶 变位酶
传递氢和转移乙酰基 丙酮酸脱氢酶系 传递质子和电子 氧化还原酶及脱氢酶
1. NAD (辅酶I)和NADP (辅酶II)
NAD和NADP是许多脱氢酶的辅酶,参与递氢。 维生素B5是NAD和NADP的组成成分。 维生素B5(也称烟酰胺nicotinamide)
COOH
H
+ NAD
+
乳酸脱氢酶
C
O
+ NADH + H+
辅酶I
CH3
丙酮酸
还原性辅酶I
转移酶
A R +B A+ B R
裂合酶(醛缩酶、水化酶、脱氨酶)
AB A+B
从底物移去一个基团而形成双键
例1:
例2:
异构酶
A-B g
A-B g
催化同分异构体的相互转化,即底物分子内 基团或原子的重排过程
例:
思考题?
选择题
1. 酶促反应中决定酶反应专一性的部分是( ) A、酶蛋白 B、底物 C、辅酶或辅基 D、催化基团 2. 全酶是指什么?( ) A、酶的辅助因子以外的部分 B、酶的无活性前体 C、一种酶一抑制剂复合物 D、一种需要辅助因子的酶,具备了酶蛋白、辅 助因子各种成分。
3. 下列关于酶特性的叙述哪个是错误的?( ) A、催化效率高 B、专一性强 C、作用条件温和 D、都有辅因子参与催化反应 4.具有生物催化剂特征的核酶其化学本质是( ) A、蛋白质 B、RNA C、DNA D、糖蛋白 5. NAD+在酶促反应中转移( ) A、氨基 B、氢原子 C、氧原子
生物催化剂PowerPointPresentatio

(习惯名称,葡萄糖激酶)
PPT文档演模板
生物催化剂PowerPointPresentatio
•1.3 酶的分类
氧化还原酶 AH2+B 转移酶 Ax+C
A+BH2 A+Cx
水解酶 裂解酶
AB+H2O
AH+BOH
A
B+C
异构酶 A
B
合成酶 A+B
C, 需要ATP
PPT文档演模板
生物催化剂PowerPointPresentatio
生物催化剂PowerPointPresentatio
•4.2 中间产物学说
S+E
ES
•中间产物
P+E
• 反应过程
• S+E
ES
ES*
EP
•过渡态 •复合物
P+E
PPT文档演模板
生物催化剂PowerPointPresentatio
• 酶介入了反应过程。通过形成不稳定的过渡态中间 •复合物,使原本一步进行的反应分为两步进行,而两步 •反应都只需较少的能量活化,从而使整个反应的活化能 •降低。形成过渡态中间复合物是关键。
PPT文档演模板
生物催化剂PowerPointPresentatio
•3. 酶的分子结构
单体酶 只有三级结构,一条多肽链的酶。如129个氨基酸的 溶菌酶,分 子量14600。
寡聚酶 含2-60 个亚基,有复杂的高级结构。 常通过变构效应在代谢途径中发挥重要的调节作用。 例如,乳酸脱氢酶。
多酶复合体 由多个功能上相关的酶彼此嵌合而形成的复合体。它可以促进某 个阶段的代谢反应高效、定向和有序地进行。 例如,由三个酶组成的丙酮酸脱氢酶系。
《生物催化工程》PPT课件

不对称合成(Asymmetric synthesis),也称手性合成、立体选择性 合成、对映选择性合成,是研究向反应物引入一个或多个具手性元素 的化学反应的有机合成分支。按照Morrison和Mosher的定义,不对称 合成是“一个有机反应,其中底物分子整体中的非手性单元由反应剂 以不等量地生成立体异构产物的途径转化为手性单元”。这里,反应 剂可以是化学试剂、催化剂、溶剂或物理因素。
5
完整版课件ppt
主要内容
设计一种脂肪酶,阐述它的在某一领域的应用,说明如何采用两种酶分子修 饰方法进行修饰,修饰后的优点列举两种,如何采用酶的两种固定化方法做 固定化酶,设计这种脂肪酶在非水相介质中的催化反应过程。
6
完整版课件ppt
1.2 生物催化工程内涵及历史
1.2.1 生物催化工程界定
生物催化与生物转化( biocatalysis & biot ransformation) 是生物学、化学、过程工程科学 的交叉领域, 其核心目标是大规模采用微生物或 酶为催化剂生产化学品、医药、能源、材料等。 以生物催化与生物转化为核心的工业生物技术将 是生物技术革命的第三个浪潮.
手性合成的难点在于:针对不同的手性或潜手性底物,必须使用与之高 度匹配的专一性“手性工具”(例如:手性拆分剂、手性催化剂、手性 溶剂或助剂,等等),首要的任务是制备出对目标反应具有高度立体选 择性的手性生物催化剂。
13
完整版课件ppt
酶催化剂具有高度的对 映体选择性,不对称合 成。生物大分子含有很 多手性中心,故在结构 上形成高度不对称的微 环境空间,而在功能上 则作为一种“手性受 体”,对手性的药物(配 体)或手性的底物具有立 体专一性识别作用。
以2005年全球销售额(美元)统计,以下21种单一对映异构体药物都可被称为“重磅炸弹”。阿托伐 他汀(13.0亿),氯吡格雷(6.3亿),重组人红 细胞生成素(5.8亿),氟替卡松/沙美特罗复方制剂 (5.5亿),利妥昔单抗(5.2亿),埃索美拉唑(4.6亿),辛伐他汀(4.4亿),普伐他汀 (3.8亿) ,缬沙坦(3.7亿),依那西普(3.6亿),英利昔单抗(3.5亿),促红细胞生成素(3.3亿),舍曲林 (3.3亿),孟鲁司特钠 (3.0亿),依诺肝素钠(2.7亿),曲妥珠单抗(2.5亿),乙二醇化非14格司 亭(2.3亿),依地普仑(2.0亿),阿奇霉素(2.0亿),多烯紫杉 醇(2.0亿),奥沙利铂(1.9亿) 。
5
完整版课件ppt
主要内容
设计一种脂肪酶,阐述它的在某一领域的应用,说明如何采用两种酶分子修 饰方法进行修饰,修饰后的优点列举两种,如何采用酶的两种固定化方法做 固定化酶,设计这种脂肪酶在非水相介质中的催化反应过程。
6
完整版课件ppt
1.2 生物催化工程内涵及历史
1.2.1 生物催化工程界定
生物催化与生物转化( biocatalysis & biot ransformation) 是生物学、化学、过程工程科学 的交叉领域, 其核心目标是大规模采用微生物或 酶为催化剂生产化学品、医药、能源、材料等。 以生物催化与生物转化为核心的工业生物技术将 是生物技术革命的第三个浪潮.
手性合成的难点在于:针对不同的手性或潜手性底物,必须使用与之高 度匹配的专一性“手性工具”(例如:手性拆分剂、手性催化剂、手性 溶剂或助剂,等等),首要的任务是制备出对目标反应具有高度立体选 择性的手性生物催化剂。
13
完整版课件ppt
酶催化剂具有高度的对 映体选择性,不对称合 成。生物大分子含有很 多手性中心,故在结构 上形成高度不对称的微 环境空间,而在功能上 则作为一种“手性受 体”,对手性的药物(配 体)或手性的底物具有立 体专一性识别作用。
以2005年全球销售额(美元)统计,以下21种单一对映异构体药物都可被称为“重磅炸弹”。阿托伐 他汀(13.0亿),氯吡格雷(6.3亿),重组人红 细胞生成素(5.8亿),氟替卡松/沙美特罗复方制剂 (5.5亿),利妥昔单抗(5.2亿),埃索美拉唑(4.6亿),辛伐他汀(4.4亿),普伐他汀 (3.8亿) ,缬沙坦(3.7亿),依那西普(3.6亿),英利昔单抗(3.5亿),促红细胞生成素(3.3亿),舍曲林 (3.3亿),孟鲁司特钠 (3.0亿),依诺肝素钠(2.7亿),曲妥珠单抗(2.5亿),乙二醇化非14格司 亭(2.3亿),依地普仑(2.0亿),阿奇霉素(2.0亿),多烯紫杉 醇(2.0亿),奥沙利铂(1.9亿) 。
生物催化剂讲课课件Microsoft PowerPoint 演示文稿

目录
• • • • • • • 1.生物催化剂的概述 2.生物催化剂的特征 3.生物催化剂的作用原理 4.生物催化剂的应用 5.生物催化剂的制备与筛选 6.市场现状及前景 7.结语及展望
1.1 概念 生物催化剂是由生物合成的具有催化作用的物质 总称。广义上讲应包括生物体、细胞器、酶、抗体酶、 模拟酶等。然而,大多情况下生物催化剂主要指酶, 它是活细胞产生的具有催化功能的生物大分子。因此: 生物催化剂就是指生物反指应过程中起催化作用的游 离或固定化细胞各游离或固定化酶的总称。 酶所催化的化学反应称为酶促反应。在酶促反应 中被催化的物质叫底物;催化所产生的物质叫产物。 酶的催化能力称为活力,如果酶丧失催化能力称为酶 失活。酶促反应中底物为非天然有机化合物时通常将 生物催化反应称为生物转化。
(5)青霉素酰化酶在β-2内酰胺类抗生素生产中的应用
Β -2内酰胺类抗生素主要由6-氨基青霉烷酸(6-APA) 或者氨 基去乙酰氧基头孢霉烷酸(7-ADCA) 衍生合成。目前世界上6-APA 和7-ADCA 的年产量分别是8 000吨和600 吨。但直到最近,这两 种中间体一直由青霉素G通过化学脱酰基法制备。在该工艺中,青 霉素G的羧基首先需硅烷化以进行保护,随后进行选择性脱羧,最 后除去保护基团(以6-APA 为例说明, R = H 或OH) 。该方法需 要化学计量的硅烷化试剂,氯化磷, N , N2二甲基苯胺和大量的 二氯甲烷; 而且, 反应在- 40 ℃中进行。 相比之下,青霉素G酰化酶催化的脱酰基反应在室温水溶液中 进行,无须引入保护和去保护步骤。而且,通过反应工程的研究和 酶固定化,青霉素G酰化酶催化6-APA 与氨基酯或氨基酰胺进行酰 化反应可合成众多的半合成β -2内酰胺类抗生素,如青霉素,阿莫 西林,头孢克洛,头孢氨苄和头孢羟氨等。类似的方法也可应用于 7-ADCA 及其衍生抗生素的合成。
酶生物催化剂.pptx

正比;
第33页/共58页
酶浓度对反应速度的影响
• 反应速度与酶浓度成正比:当[S][E],式中Km可
以忽略不计。
k3[E][S] v= Km + [S] =k3[E]
v
o
[S]
第34页/共58页
温度对酶促反应速度的影响
产 物 2.0 麦 芽 1.5 糖 的 1.0 毫 克 0.5 数
0 10 20 30 40 50 60 ℃ 温度对唾液淀粉酶活性的影响
例如:有机磷农药中毒 (敌百虫、敌敌畏、乐果杀虫剂1605、1059等)
RO O
P
+
RO X
有机磷化合物
E-OH 羟基酶
RO O
P
+
RO O E
磷酰化酶 (失活)
CHNOH N CH3
解磷定
RO O
P
+
HX
RO O E
磷酰化酶
(失活)
O OR P
CHNO OR + N
CH3
E-OH
乙酰胆碱酯酶是羟基酶,与有机磷农药共价结合后失活,使兴奋 性神经递质乙酰胆碱不能及时清除降解,而是过量地积累引起中毒。
▪ 活化能:在一定温度下一摩尔底物全部进入活化态所需要的
自由能,单位是KJ/mol. (增加温度、加入催化剂降低反应活化能) • 酶促反应:E + S === ES === ES* EP E + P • 非酶促反应:
催化剂的作用是降低反应活化能,从而起到提高反应速度的作用
第22页/共58页
过渡态
酶的最适温度: 酶活性最高时的温度, 也即酶的催化效率 最高, 酶促反应速度最大时的温度。
第35页/共58页
第33页/共58页
酶浓度对反应速度的影响
• 反应速度与酶浓度成正比:当[S][E],式中Km可
以忽略不计。
k3[E][S] v= Km + [S] =k3[E]
v
o
[S]
第34页/共58页
温度对酶促反应速度的影响
产 物 2.0 麦 芽 1.5 糖 的 1.0 毫 克 0.5 数
0 10 20 30 40 50 60 ℃ 温度对唾液淀粉酶活性的影响
例如:有机磷农药中毒 (敌百虫、敌敌畏、乐果杀虫剂1605、1059等)
RO O
P
+
RO X
有机磷化合物
E-OH 羟基酶
RO O
P
+
RO O E
磷酰化酶 (失活)
CHNOH N CH3
解磷定
RO O
P
+
HX
RO O E
磷酰化酶
(失活)
O OR P
CHNO OR + N
CH3
E-OH
乙酰胆碱酯酶是羟基酶,与有机磷农药共价结合后失活,使兴奋 性神经递质乙酰胆碱不能及时清除降解,而是过量地积累引起中毒。
▪ 活化能:在一定温度下一摩尔底物全部进入活化态所需要的
自由能,单位是KJ/mol. (增加温度、加入催化剂降低反应活化能) • 酶促反应:E + S === ES === ES* EP E + P • 非酶促反应:
催化剂的作用是降低反应活化能,从而起到提高反应速度的作用
第22页/共58页
过渡态
酶的最适温度: 酶活性最高时的温度, 也即酶的催化效率 最高, 酶促反应速度最大时的温度。
第35页/共58页
酶是生物催化剂ppt课件

5.底物浓度
酶量一定的条件下,在一定范
反
应
围内随着底物浓度的增加,反 速 率
应速率也增加,但达到一定浓
底物浓度[s]
度后不再增加,原因是受到酶数量和酶活性的
限制。
6.酶浓度
反
应
在底物充足、其他条件适宜且 速
率
固定的条件下,酶促反应速率
与酶浓度成正比。
酶浓度[E]
7.影响酶活性的曲线(多因素)
支 应 物 乘 剩 余 量 ( 相对 量 )
④在各自所控制的温度下保温一段时间
⑤滴加 碘 液 ,观察颜色变化
步骤顺 序
3%淀粉 液
2%淀粉 酶液
温度预 处理
混合后 摇匀
控制温 度
试管1 试管1’ 2ml
1ml 0℃保温5min
混合 0℃保温5min
试管2 试管2 ’ 试管3 试 管 3 ’
2ml
2ml
1ml
1ml
60℃保温5min 100℃保温5min
3、在上述实验中,自变量是什么?无关变量是 什么?
自变量是不同的温度;无关变量是可溶性淀粉溶 液、新鲜淀粉酶溶液、碘液的量
酶活性受许多因素的影响
(1)本实验不宜选用过氧化氢酶催化H₂O₂分解,因为 过氧化氢酶催化的底物过氧化氢在加热的条件下分解 也会加快。
(2)本实验不宜选用斐林试剂鉴定,温度是干扰
淀粉(非还原糖)淀粉酶 麦芽糖(还原糖) ① 淀粉(非还原糖)蔗糖酶淀粉
②再用本尼迪特试剂鉴定,从而探究酶的专一性。
1、探究淀粉酶对淀粉和蔗糖的作用
第一步:1ml 水 水 水 淀粉酶淀粉酶 第二步:3ml 淀粉 蔗糖 淀粉酶淀粉蔗糖
第三步:各试管充分摇匀后,37℃保温15分钟
生物催化剂PPT课件

H2O2
过氧化氢酶
(或Fe3+)
H2O
+
O2
.
2
材料选择:
1、蒸馏水 2、新鲜猪肝匀浆 3、3.5%FeCl3溶液 4、经高温处理的猪肝匀浆 5、经高温处理的3.5%FeCl3溶液
.
3
新
蒸 馏 水
鲜 猪 肝 匀
浆
3%H2O2
3.5% FeCl3 溶液
经高 温处 理的 猪肝 匀浆
经高 温处 理的 3.5 %Fe Cl3溶
科学实验证实,高温、低温以及过酸和过碱,都影响淀粉 酶的活性,淀粉酶的催化作用需要适宜的温度和pH。科学 家分别在不同的温度和pH条件下测同一种酶的活性,并且 根据所得到的数据绘制成曲线图。
.
14
拓展练习
• 请你设计一个能使“加酶”洗衣粉发挥 最好效果的洗涤方法。
• 可以用怎样的实验方法证明酶的化学 本质是蛋白质?
。
• 需要与辅助因子结合才显示活性的酶,如与氧 化还原有关的酶。
–辅助因子:如金属离子、有机小分子化合物
–有机小分子化合物称为辅酶,如辅酶Ⅰ(NAD)、 辅酶Ⅱ(NADP)等。
.
12
2、生物催化剂——酶
• 酶的特性
– 高效性 – 专一性
• 每一种酶只能催化一种或一类物质的化学 反应。
.
13
P61
火焰 无变化 有火焰燃烧 明亮
无变化
明亮
实验1 实验2
生物酶具有催化作用
实验2
生物酶具有高效性
实验3 过氧化氢酶的催化效率是高于无机催化剂Fe3+
酶的催化效率是无机催化剂的107~1013倍
实验2
实验3 实验4
动物生物化学课件7生物催化剂——酶.pptx

即对底物的选择性或特异性。一种酶只催化一种或 一类底物转变成相应的产物。
①绝对专一性 ② 相对专一性 ③立体专一性
绝对专一性
一种酶只催化一种底物转变为相应的产物。 例如,脲酶只催化尿素水解成 CO2 和NH3。
相对专一性
一种酶作用于一类化合物或一类化学键。 例如,不同的蛋白水解酶对于所水解的肽键两侧的基团有 不同的 要求。
3. 酶的分子结构
功能上相关的几个酶 在空间上组织在一起, 定向有序地催化一系 列反应。
例如,丙酮酸脱氢酶系
由3个酶组成,脂肪酸
合成酶系由6个酶和1个
A
C
P蛋白组成。
大肠杆菌的丙酮酸脱氢酶系模型
3.酶的分子结构
3.1 酶的活性中心
指酶分子中直接和底物结合,并和酶催化作用直接有关 的部位。
(1)酶活性中心的组成:
◆ 都是酶分子表面的一个凹穴,有一定的大小和形状,但 不是刚性的,而具有一定的柔性。
◆ 活性中心为非极性的微环境,有利于与底物结合。
◆ 底物与酶通过形成较弱键力的次级键相互作用并结合到酶 的活性中心。
◆ 酶与底物结合的过程中,底物分子或酶分子或它们两者的构 象同时发生一定变化后才相互契合,这时催化基团的位置也 正好处于所催化底物的敏感化学键部位。
动物和人类生理活动所必需的,从食物中获得的一类有机小分子。它
们并不是机体的能量来源,也不是结构成分,大多数以辅酶、辅基的
形式参与调节代谢活动。
脂溶性维生素: A 原——胡萝卜素)
视黄醇(维生素 A
D
钙化醇
E
生育酚
K
凝血维生素
B族维生素及其辅酶形式
B族维生素
辅酶形式
酶促反应中的主要作用
①绝对专一性 ② 相对专一性 ③立体专一性
绝对专一性
一种酶只催化一种底物转变为相应的产物。 例如,脲酶只催化尿素水解成 CO2 和NH3。
相对专一性
一种酶作用于一类化合物或一类化学键。 例如,不同的蛋白水解酶对于所水解的肽键两侧的基团有 不同的 要求。
3. 酶的分子结构
功能上相关的几个酶 在空间上组织在一起, 定向有序地催化一系 列反应。
例如,丙酮酸脱氢酶系
由3个酶组成,脂肪酸
合成酶系由6个酶和1个
A
C
P蛋白组成。
大肠杆菌的丙酮酸脱氢酶系模型
3.酶的分子结构
3.1 酶的活性中心
指酶分子中直接和底物结合,并和酶催化作用直接有关 的部位。
(1)酶活性中心的组成:
◆ 都是酶分子表面的一个凹穴,有一定的大小和形状,但 不是刚性的,而具有一定的柔性。
◆ 活性中心为非极性的微环境,有利于与底物结合。
◆ 底物与酶通过形成较弱键力的次级键相互作用并结合到酶 的活性中心。
◆ 酶与底物结合的过程中,底物分子或酶分子或它们两者的构 象同时发生一定变化后才相互契合,这时催化基团的位置也 正好处于所催化底物的敏感化学键部位。
动物和人类生理活动所必需的,从食物中获得的一类有机小分子。它
们并不是机体的能量来源,也不是结构成分,大多数以辅酶、辅基的
形式参与调节代谢活动。
脂溶性维生素: A 原——胡萝卜素)
视黄醇(维生素 A
D
钙化醇
E
生育酚
K
凝血维生素
B族维生素及其辅酶形式
B族维生素
辅酶形式
酶促反应中的主要作用
