高中化学有机羧酸和酯
高一化学鲁科版必修2教学教案:第三章第三节3酯和油脂(5)含解析

第三节羧酸酯第二课时——酯一、教材分析本节课选自人教版高中化学选修5《有机化学基础》第三章中的第三节羧酸酯。
本章教材强调从学生生活实际和已有知识出发,尽力渗透结构分析的观点,使学生在必修2第三章《有机化合物》知识的基础上有所提高。
本节课酯的内容是以学生所学的有机化合物常识为基础的,提倡从学生的生活经验出发,在介绍了有机物——乙酸的基础上引入的。
酯是高中有机化学中的重点内容之一,也是高考重要考点,在有机化学中起着承上启下的作用,酯是烃的含氧衍生物知识体系中不可或缺的部分,它建构于醇、酚和酸的知识体系之上,对学生构建一个完整的知识链条“烃——醇——醛——酸——酯”有着举足轻重的作用;同时酯的合成以及水解方法是教材第五章《进入合成有机高分子化合物的时代》中合成有机高分子材料——聚酯纤维的基础方法,对于学生掌握合成新型高分子材料的学习起到了重要的铺垫和推动作用;酯类物质在自然界中有广泛的存在,日常生活中饮料、糖果以及糕点等都含有部分酯类香料,因此,酯类物质对人类的美好生活起到了重要的影响。
二、学情分析学生通过必修2《有机化合物》以及选修5前两章内容的学习,已经基本了解了研究有机化学的方法及有机化合物结构与性质的关系,初步掌握了有机化学的学习方法。
通过对烃、卤代烃、醇、酚、醛知识的探究学习,学生初步构成了以官能团为线索的有机化合物的知识体系。
因此在本节内容的讲授过程中,基于学生目前的知识水平与认知能力,可以有效的开展探究式的教学,在原有的醇、酸的知识体系上建构羧酸酯的相关知识,利于学生的理解和掌握。
本节课的内容由生活中为什么会有那么多口味各异的饮料,不同气味的清新剂引入,从生活角度来让学生体味化学的魅力,以此来激发学生的学习兴趣,学生对本节课的学习必定有所期待。
三、教学目标依据教改精神、新课程标准和学生的实际情况确定了如下教学目标:(一)知识与技能目标(1)了解酯的概念、命名,同分异构体以及物理性质;(2)根据酯的组成与结构的特点,理解酯的水解反应。
高中化学选修五《有机化学基础》《酯》【创新教案】

第三章烃的含氧衍生物第三节羧酸酯第二课时酯教材分析1.教材的知识结构:本节是人教版高中《有机化学基础》第三章第三节《羧酸酯》,从知识结构上看,包含了两部分内容即羧酸和酯,乙酸是羧酸类物质的代表物,酯是羧酸与醇的衍生物。
本节分两课时完成,其中第一课时按教材的编排体系,包含乙酸概述、乙酸的分子结构特点、乙酸的性质研究、乙酸的用途。
第二课时包含酯的结构、性质、存在。
2.教材的地位和作用:从教材整体上看,乙酸乙酯既是很重要的烃的含氧衍生物,又是酯类物质的代表物,它和我们的生活生产实际密切相关,从知识内涵和乙酸乙酯的分子结构特点上看,乙酸乙酯既是乙酸和乙醇的酯化反应知识的巩固、延续和发展,又是学好酯(油脂)类化合物的基础。
3.教学重点:酯的结构和性质是本课的教学重点,特别是酯的水解反应的特点和过程分析探究酯水解实验的观察和有关问题及数据分析、推理又是性质教学中的重点。
4.教材的处理:为了使教学具有更强的逻辑性,突出教学重点内容,充分说明物质的性质决定物质的结构,对教材的内容在教学程序上进行了调整:(1)将酯的定义放在乙酸乙酯的结构之后再讲授,这样有利于学生对结构决定性质这一化学基本学习方法的理解(2)为了突出酯的水解反应的过程分析和加深对酯水解的条件理解和对化学探究实验中固定变量法的应用,添加乙酸乙酯的水解实验,让学生感受酯在不同条件下的水解程度,理解实验条件的控制对实验过程及实验数据的影响,达到了“知其然,知其所以然”的教学效果。
5.教学目标:知识与技能:(1)使学生掌握酯的分子结构特点,主要物理性质、用途。
(2)根据乙酸乙酯的组成和结构特点,认识酯的水解反应。
过程与方法:根据教学任务和学生特征,为了最大限度地调动学生参与课堂教学过程,使其真正成为课堂的主人,成为发现问题和解决问题的高手,本课时主要采用研究探索式教学。
通过实验设计、动手实验,培养学生的观察能力,加强基本操作训练,培养分析、综合的思维能力和求实、创新、合作的优良品质。
烃的含氧衍生物羧酸和酯

一、羧酸 1.羧酸的定义、分类和性质 (1)定义:分子中由羧基与烃基相连的有机物。 通式:R—COOH、饱和一元羧酸通式为 CnH2nO2(n≥1)
(2)羧酸的分类
(3)性质:羧酸分子结构中都有羧基官能团,因此
都有酸性,都能发生酯化反应。
温馨提示:酯化反应中断键规律是:羧脱羟基, 醇脱氢,结合成酯还有水。 在酯化反应的书写中易出现漏写水分子的情 况,请留心关系 催化剂 催化剂的 其他作用
加热方式
RCOOH+ROH 浓硫酸 吸水,提高RCOOH和 ROH的转化率
直接加热
RCOOR+H2O
稀硫酸或NaOH溶 液 NaOH中和酯水解 生成的RCOOH, 提高酯的水解率 热水浴加热 水解反应,取代反 应
反应类型
酯化反应,取代反应
2.常见羧酸的结构和性质
(1)甲酸(俗名蚁酸)
甲酸既具有酸的一般性质,又具有醛的性质。
2HCOOH+CaCO3―→Ca(HCOO)2+H2O+CO2↑
甲酸被氧化成H2CO3。在碱性条件下,甲酸可
发生银镜反应,可跟新制Cu(OH)2作用析出Cu2O砖 红色沉淀,可使KMnO4酸性溶液和溴水褪色(氧化 反应)。
(2)特殊的酯——甲酸酯:HCOOR ①水解;②氧化反应:能被银氨溶液、新制 Cu(OH)2碱性浊液氧化成HOOCOR(碳酸酯)(酯中 只有甲酸酯才能发生银镜反应)。
3.多元羧酸与一元醇之间的酯化反应
二、乙酸
羧酸
1.乙酸的结构与性质 分子式 结构式 C2H4O2 由甲基和羧基组成。羧基是由羰基(C 和羟基组成 O)
结构简式
CH3COOH
饱和一元 CnH2nO2 酸通式 物理性质 无色有强烈刺激性气味的液体,易凝结成 冰一样的晶体,又称冰醋酸,易溶于水和 乙醇
高中有机化学知识点整理教学讲义《酸 酯》

优势教育学科教学目标 1.酸酯授课日期及时段乙酸一. 乙酸的组成和结构分子式:C2H4O2结构式:CHHCH OO H结构简式:CH3COOH或H3C COOH分子比例模型:乙酸的官能团是—COOH,叫做羧基。
二. 乙酸的物理性质乙酸是一种有强烈刺激性气味的无色液体,是调味品食醋的主要成分,俗称醋酸。
当温度低于16.6 ℃时,乙酸就凝结成像冰一样的晶体,所以纯净的乙酸又称冰醋酸,乙酸易溶于水和乙醇。
三. 乙酸的化学性质1.弱酸性乙酸是一种弱酸,其酸性比碳酸强,其水溶液具有酸的通性:-+33CH COOH CH COO+H(1)与酸碱指示剂作用,如可以使紫色石蕊试液变红。
(2)与碱反应,如CH3COOH+NaOH===CH3COONa+H2O。
(3)与碱性氧化物反应,如2CH3COOH+CaO===(CH3COO)2Ca+H2O。
T—课堂同步(4)与活泼金属反应,如2CH3COOH+Zn===(CH3COO)2Zn+H2↑。
(5)与某些盐反应,如2CH3COOH+CaCO3===(CH3COO)2Ca+CO2↑+H2O。
2.酯化反应:酸(包括有机羧酸和无机含氧酸)与醇作用生成酯和水的反应。
CH3COOH+CH3CH2OH 浓H2SO4△CH3COOCH2CH3+H2O酯化反应的历程是:酸脱羟基醇脱氢。
【名师点拨】①加入试剂的顺序为C2H5OH―→浓H2SO4―→CH3COOH。
②用盛饱和Na2CO3溶液的试管收集生成的乙酸乙酯,一方面中和蒸发出来的乙酸、溶解蒸发出来的乙醇;另一方面降低乙酸乙酯的溶解度,有利于酯的分离。
③导管不能插入到Na2CO3溶液中,以防止倒吸回流现象的发生。
④加热时要用小火均匀加热,防止乙醇和乙酸大量挥发、液体剧烈沸腾。
⑤装置中的长导管起导气和冷凝回流作用。
⑥充分振荡试管,然后静置,待液体分层后,分液得到的上层液体即为乙酸乙酯。
四. 羧酸1. 羧酸是由烃基与羧基相连组成的有机化合物。
高中化学_羧酸衍生物-酯教学设计学情分析教材分析课后反思

教学设计【教学目标】1.了解酯的结构特点及化学性质。
2.了解酯的水解的应用(以油脂碱性条件下水解为例)。
3.理解酯化反应中的断键方式,体会酸、酯在物质转化中的作用。
【教学重点难点】酯的同分异构体;酯(油脂)的水解反应;对酯化反应和酯的水解反应的化学反应本质的辩证认识。
【教学方法】多媒体教学【教学过程】[引入]酯是日常生活中常见的,来看一下这幅图。
[投影]图片[提问]图片中是白色的衣服上沾有了油污,如何清洗?[学生]洗衣粉、肥皂.....[提问]为什么这些物质能去油污?而且一般情况下碱性越强去污效果越好,为什么?通过这节课的学习我们一起来探究。
[引导]打开课本84页,寻找总结什么叫羧酸衍生物?[学生]羧酸分子中羧基上的羟基被其他原子或原子团取代所得到的产物。
[媒体加板书]一、概述 1、羧酸衍生物[讲解]羧酸分子中羧基去掉羟基后剩余的基团称为酰基,如:羧酸衍生物也可以看成是酰基与其他基团联结而成的化合物[提问]常见的羧酸衍生物有那些呢?[学生]酰卤、酸酐、酰胺、酯等[媒体]羧酸衍生物[讲解]酰卤:分子由酰基与卤素原子(-X)相连组成的羧酸衍生物。
酸酐:分子由酰基与酰氧基(R-C-O-)相连组成的羧酸衍生物。
酰胺:分子由酰基与氨基(-NH2)相连组成的羧酸衍生物。
酯:分子由酰基与烃氧基(Ro-)相连组成的羧酸衍生物。
[过度]羧酸衍生物通常是有机合成的中间产物。
那么我们这节课就着重讨论其中的一种羧酸衍生物――酯。
[投影加板书]2、酯(1)定义[练习]乙酸与乙醇,硝酸与乙醇[学生]黑板[讲解]酸既可以是有机酸,也可以是无机酸。
为了美观、清晰,醇与无机酸反应把醇写在前面。
这个产物称为硝酸乙酯。
[提问]乙酸与氢溴酸加热能否生成酯?讨论无机酸生成酯的条件是什么?[归纳]归纳出无机酸生成酯需含氧酸[过度]写的过程中实际已经总结了酯的命名,就是“某酸某醇”根据酸和醇来命名,酸命名在前面,醇命名在后面,把某醇说成酯。
高中化学必修课----羧酸 酯知识讲解及巩固练习题(含答案解析)

高中化学必修课----羧酸酯知识讲解及巩固练习题(含答案解析)【学习目标】1、掌握乙酸的组成、结构、性质和用途;2、掌握羧酸的组成、结构、性质及其应用;3、了解酯的结构及主要性质;4、掌握重要的有机物之间的相互转化,学会在有机合成与推断中应用。
【要点梳理】要点一、羧酸的结构、通式和性质【高清课堂:羧酸和酯#羧酸的结构特征、分类及饱和一元酸的通式】1.羧酸的组成和结构。
(1)羧酸是由烃基(或H)与羧基相连组成的有机化合物。
羧基()是羧酸的官能团。
(2)羧酸有不同的分类方法:2.羧酸的分子通式。
一元羧酸的分子通式为R—COOH,饱和一元脂肪羧酸的分子通式为C n H2n O2或C n H2n+1—COOH。
分子式相同的羧酸、羧酸酯、羟基醛、羟基酮等互为同分异构体。
3.羧酸的主要性质。
(1)羧酸的沸点比相应的醇的沸点高;碳原子数在4以下的羧酸能与水互溶,随着分子中碳链的增长,羧酸在水中的溶解度迅速减小,直至与相对分子质量相近的烷烃的溶解度相近。
【高清课堂:羧酸和酯#羧酸的化学性质】(2)羧酸的化学性质。
①弱酸性。
由于—COOH能电离出H+,使羧酸具有弱酸性。
而羧酸具有酸类物质的通性。
如:2RCOOH+Na2CO3—→2RCOONa+CO2↑+H2ORCOOH+NH3—→RCOONH4常见的一元羧酸的酸性强弱顺序为:②酯化反应。
注意:可以用同位素示踪法证实酯化反应过程是羧酸分子中羧基中的羟基与醇分子中羟基的氢原子结合成水,其余部分相互结合成酯。
无机含氧酸与醇作用也能生成酯,如:C2H5OH+HONO2—→C2H5—O—NO2+H2O(硝酸乙酯)③-H被取代的反应。
通过羧酸-H的取代反应,可以合成卤代羧酸,进而制得氨基酸、羟基酸等。
④还原反应。
由于羟基的影响,羧基中的羰基比醛、酮分子中的羰基较难发生加成反应,但在特殊试剂(如LiAlH4)的作用下,可将羧基还原为醇羟基。
RCOOH RCH2OH有机化学上可用此反应实现羧酸向醇的转化。
人教版高中化学选修醛,羧酸,酯教案

⼈教版⾼中化学选修醛,羧酸,酯教案醛⼀、醛1.饱和⼀元醛的通式:___________________ 官能团:_____________________2.分类:饱和醛H 3C CHO脂肪醛按烃基种类不饱和醛H 2C CH CHO芳⾹醛CHO按醛基的数⽬⼀元醛CH 3CH 2CH 2CHO⼆元醛OHC CHO3.命名:普通命名法:与醇相似。
【举例】CH 3CH 2CH 2CHO正丁醛CH 3CHCHO3异丁醛CH 3苯甲醛系统命名法:①脂肪醛:选含有醛基的最长连续碳链为母体,称为某醛;芳⾹醛:以脂肪醛为母体,芳基作为取代基。
②由于醛基总是在碳链的⼀端,所以不⽤编号。
【举例】CH 3CH 2CHCHO CH 3CH2-丁烯醛2-甲基丁醛CH 3CHCHOCH 2CH 2CHO3-苯基丙醛注意:醛基的写法:在右端“—CHO ”,在左端“OHC —”4.物理性质:_____⾊,具有_____________⽓味;状态:甲醛:⽓体,⼄醛:液体;⽔溶性:低级的醛(C1~C3)易溶于⽔。
5、⽤途:⾹料:桂⽪中含⾁桂醛CHCHOCH杏仁中含苯甲醛CHO;⼆、代表:甲醛、⼄醛甲醛:①物性:⽆⾊,刺激性⽓味,⽓体,易溶于⽔②⽤途:有机合成原料;35%-40%的⽔溶液⼜称福尔马林:消毒、杀菌③分⼦组成与结构:分⼦式____________;结构式________________;结构简式_____________ 特点:所有原⼦共平⾯⼄醛:①物性:⽆⾊,刺激性⽓味,液体,密度⼩于⽔,沸点是20.8℃,易挥发,易燃烧,与⽔、⼄醇互溶②分⼦组成与结构:分⼦式____________; 结构式__________________;结构简式________________ 三、化学性质 1、氧化反应:①⼄醛的燃烧,反应⽅程式_________________________________________________ ②银镜反应【实验1】在洁净试管中加⼊1mL2%的AgNO 3溶液,然后边振荡试管边逐滴滴⼊2%的稀氨⽔,⾄最初产⽣的沉淀恰好溶解为⽌,制得银铵溶液。
高中化学——醛 羧酸与酯
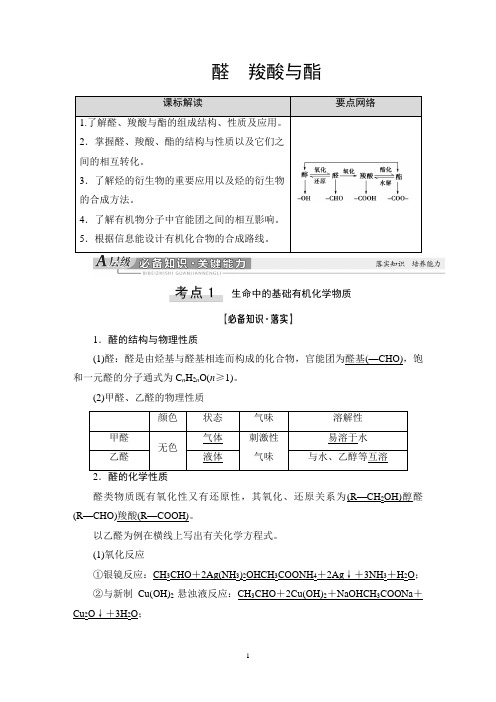
醛羧酸与酯课标解读要点网络1.了解醛、羧酸与酯的组成结构、性质及应用。
2.掌握醛、羧酸、酯的结构与性质以及它们之间的相互转化。
3.了解烃的衍生物的重要应用以及烃的衍生物的合成方法。
4.了解有机物分子中官能团之间的相互影响。
5.根据信息能设计有机化合物的合成路线。
生命中的基础有机化学物质1.醛的结构与物理性质(1)醛:醛是由烃基与醛基相连而构成的化合物,官能团为醛基(—CHO),饱和一元醛的分子通式为C n H2n O(n≥1)。
(2)甲醛、乙醛的物理性质颜色状态气味溶解性甲醛无色气体刺激性气味易溶于水乙醛液体与水、乙醇等互溶醛类物质既有氧化性又有还原性,其氧化、还原关系为(R—CH2OH)醇醛(R—CHO)羧酸(R—COOH)。
以乙醛为例在横线上写出有关化学方程式。
(1)氧化反应①银镜反应:CH3CHO+2Ag(NH3)2OHCH3COONH4+2Ag↓+3NH3+H2O;②与新制Cu(OH)2悬浊液反应:CH3CHO+2Cu(OH)2+NaOHCH3COONa+Cu2O↓+3H2O;③催化氧化反应:2CH 3CHO +O 2――→催化剂△2CH 3COOH ; ④乙醛可被酸性KMnO 4溶液氧化生成乙酸。
(2)还原反应:与氢气的加成反应CH 3CHO +H 2――→催化剂△CH 3CH 2OH 。
注意:①醛基只能写成—CHO 或,不能写成—COH 。
②醛与新制的Cu(OH)2悬浊液反应时碱必须过量且应加热煮沸。
③醛类使酸性KMnO 4溶液或溴水退色,二者均为氧化反应。
(3)醛的应用和对环境、健康产生的影响①醛是重要的化工原料,广泛应用于合成纤维、医药、染料等行业。
②35%~40%的甲醛水溶液俗称福尔马林;具有杀菌(用于种子杀菌)和防腐性能(用于浸制生物标本)。
③劣质的装饰材料中挥发出的甲醛是室内主要污染物之一。
④甲醛与苯酚发生缩聚反应生成酚醛树脂。
3.醛与酮()可以为异类异构体,如CH 3CH 2CHO 与互为同分异构体。
人教版高中化学选修5有机化学基础羧酸酯

羧酸 酯
羧酸
一、羧酸 1、定义:由烃基与羧基相连构成的有机化合物。
脂肪酸
烃基不同
芳香酸
2、分类:
羧基数目
一元羧酸 二元羧酸 多元羧酸
饱和一元羧酸通式:CnH2n+1COOH 、CnH2nO2
羧酸
吸
3、乙酸
收 强
1)物理性质 P60 度 俗名:醋酸、冰醋酸 12
2)结构
△
HCOOH+2Cu(OH)2 → CO2↑+Cu2O↓+2H2O
请用一种试剂鉴别下面四种有机物? 乙醇、乙醛、乙酸、甲酸 新制Cu(OH)2悬浊液
羧酸
乙二酸 HOOC-COOH
俗称“草酸”,无色透明晶体,通常含两个 结晶水。 草酸,是最简单的饱和二元羧酸,是二元羧 酸中酸性最强的,它具有一些特殊的化学性 质。能使酸性高锰酸钾溶液褪色、可作漂白 剂。
羧酸
苯甲酸 C6H5COOH (安息香酸)
酸性: HOOC-COOH > HCOOH > C6H5COOH > CH3COOH 。
COOH +
COOH
CH2OH 浓硫 酸 CH2OH △
O O
O
C
CH2
C O CH2 + 2H2O
羧酸
蚁酸(甲酸)
HCOOH
资料卡片
自然界中的有机酸
安息香酸
草酸
(苯甲酸) (乙二酸)
羧酸
反应原理:
乙酸乙酯 可用什么科学方法来研究?
羧酸
原子示踪法:
酯化反应:酸跟醇起反应脱水后生成酯 和水的反应。
a.反应机理:羧酸脱羟基醇脱氢 b.酯化反应可看作是取代反应,也可看作 是分子间脱水的反应。
人教版高中化学选修五 第三章 第三节 羧酸 酯

■多维思考·自主预习
1.下列物质中,属于饱和一元脂肪酸的是( )
A.乙二酸
B.苯甲酸
C.硬脂酸
D.油酸
答案:C
人教版化学·选修5
返回导航 上页 下页
2.苹果酸的结构简式为
,下列说法正确的是( )
A.苹果酸中能发生酯化反应的官能团有 2 种
B.1 mol 苹果酸可与 3 mol NaOH 发生中和反应
人教版化学·选修5
返回导航 上页 下页
第三节 羧酸 酯
人教版化学·选修5
返回导航 上页 下页
课程目标
素养目标
1.能从羧基、酯基的成键方式等微观视角认识羧 1.掌握乙酸的组成、结构、性
酸、酯的分子结构特点,辨识二者的宏观性质及 质和用途。
其用途的不同。 2.掌握羧酸、酯的组成、结构、
2.羧酸、酯在提高人类生活质量、促进社会发展 性质和应用。
答案:A
人教版化学·选修5
返回导航 上页 下页
3.判断正误 (1)乙酸显酸性,电离出 H+,因此发生酯化反应时断裂 H—O 键。( ) (2)乙酸乙酯和乙酸都能发生取代反应。( ) (3)在浓硫酸、加热条件下酯可发生水解反应。( ) (4)无机含氧酸不能与醇发生酯化反应。( )
答案:(1)× (2)√ (3)× (4)×
(2)羧酸酯的官能团是
。
(3)饱和一元酯的通式为 CnH2nO2(n≥2) 。分子式相同的羧酸、酯、羟基醛是同分异
构体。
人教版化学·选修5
返回导航 上页 下页
2.酯的性质 酯一般难溶于水,主要化学性质是易发生 水解 反应,其条件是酸催化或碱催化, 有关化学方程式:
羧酸与酯的反应

羧酸与酯的反应羧酸与酯的反应是有机化学中的一种重要反应类型。
在这个反应中,羧酸与酯之间发生酯化反应,生成酯化物和水。
这种反应一般需要酸性条件下进行。
酯是由羧酸和醇反应生成的有机化合物。
羧酸分子中含有羧基(-COOH),而醇分子中则含有羟基(-OH)。
在酯化反应中,羧酸中的羧基与醇中的羟基反应,生成酯和水。
这个反应的化学方程式可以写为:RCOOH + R'OH → RCOOR' + H2O其中,RCOOH代表羧酸,R'OH代表醇,RCOOR'代表酯,H2O代表水。
酯化反应可以通过不同的方法进行。
最常用的方法是在酸性条件下进行。
常用的酸催化剂有硫酸、磷酸和硼酸等。
这些酸催化剂可以加速酯化反应的进行,并提高反应的收率。
在酸催化下,酯化反应可以分为两个步骤:酸催化的羧酸脱水和醇的质子化。
首先,酸催化剂会质子化羧酸中的羧基,将其变为更好的离去基,从而促进酯化反应的进行。
其次,醇与质子化羧酸中的离去基发生亲核进攻反应,生成酯和质子化的醇。
最后,质子化的醇可以通过去质子化的过程重新生成中性的醇。
除了酸催化的酯化反应外,还可以利用酯交换反应来合成酯。
酯交换反应是指两个不同的酯分子通过相互交换醇基或羧基来形成新的酯。
这种反应可以在酯酸和醇之间进行,也可以在两个酯分子之间进行。
在酯交换反应中,通常需要过量的醇作为反应物。
过量的醇可以提高酯交换反应的速度,并推动平衡向生成酯的方向移动。
此外,酯交换反应也需要酸催化剂。
酸催化剂可以降低反应的活化能,促进反应的进行。
除了酸催化的酯化反应和酯交换反应外,还可以利用酯加成反应来合成酯化物。
酯加成反应是指双氧水酯与羰基化合物之间发生加成反应,生成酯。
这种反应通常需要碱性条件,并且需要高压。
总之,羧酸与酯之间的反应是有机化学中一种常见的反应类型。
通过酸催化的酯化反应、酯交换反应和酯加成反应,可以合成各种类型的酯化物。
这些酯化物在医药、香料、染料等领域具有广泛的应用。
高中化学选修5第三章羧酸 酯分解

10/25/2018 2:30 AM
三、酯
10/25/2018 2:30 AM
2.酯的性质 酯一般难溶于水,主要化学性质是易发生 碱催化 水解 反应,其条件是 或 酸催化,有关化学方程式: (1)酸性条件
稀硫酸 CH3COOC2H5 + H2O CH3COOH + △ C2H5OH。
10/25/2018 2:30 AM
10/25/2018 2:30 AM
乙酸乙酯的制取:
10/25/2018 2:30 AM
O CH3 C O H+ H
18
O
CH2
CH3
浓H2SO4
△
O
CH3
10/25/2018 2:30 AM
C O
18
CH2
CH3 + H2O
乙酸的酯化反应
O
CH3-C-O-H+H-O-CH2-CH3 O 浓H2SO4 CH3-C-O-CH2-CH3+H2O △
(2)碱性条件
△ CH COONa CH3COOC2H5+ NaOH――→ 3 +C2H5OH。
10/25/2018 2:30 AM
思考
10/25/2018 2:30 AM
课堂互动讲练
要点一 羟基的活性比较
醇、酚、羧酸的结构中均有—OH,可分别称 之为“醇羟基”、“酚羟基”和“羧羟基”。由于这些 与—OH所连的基团不同,—OH受相连基团的影响 就不同。故羟基上的氢原子的活性也就不同,表现 在性质上也相差较大,可比较如下:
∶ ∷ ∶ ∶ ∶
H
结构简式: CH3COOH 电子式: —COOH(羧基) 官能团: 10/25/2018 2:30 AM
H
O∶
H∶C∶C∶O∶H H
人教版高中化学选修5-有机化学基础:羧酸 酯_课件5

补充:三类重要的羧酸
O
1、甲酸 ——俗称蚁酸
H—C—O—H
结构特点:既有羧基又有醛基
醛基 氧化反应(如银镜反应) 化学性质
羧基 酸性,酯化反应
2、乙二酸 ——俗称草酸
OO HO C C OH
COOH +
COOH
CH2OH 浓硫 酸 CH2OH
O O
O
C
CH2
C O CH2 + 2H2O
3、高级脂肪酸
名称 分子式 结构简式 状态 硬脂酸 C18H36O2 C17H35COOH 固态 软脂酸 C16H32O2 C15H31COOH 固态 油 酸 C18H34O2 C17H33COOH 液态 (1)酸性(2)酯化反应(3)油酸加成
练习
1mol有机物 HO
CH-CH2
COOH
OH
CH2OH
最多能消耗下列各物质多少 mol?
酸,使水解程度增大,若碱过量则水解 进行到底
酯化反应与酯水解反应的比较
酯化
水解
反应关系 CH3COOH+C2H5OH
CH3COOC2H5+H2O
催化剂
浓硫酸
稀H2SO4或NaOH
催化剂的 吸水,提高CH3COOH NaOH中和酯水解生成的
其他作用 与C2H5OH的转化率
CH3COOH,提高酯的水 解率
解速率。
(1)酯的水解反应在酸性条件好,
还是碱性条件好?
(碱性)
(2)酯化反应H2SO4和NaOH哪种作催
化剂好?
(浓H2SO4)
(3)酯为什么在中性条件下难水解,
而在酸、碱性条件下易水解?
探究:可以用哪些方法证明乙酸是弱酸? 证明乙酸是弱酸的方法: 1:配制一定浓度的乙酸测定PH值 2:配制一定浓度的乙酸钠溶液测定PH值 3:在相同条件下与同浓度的盐酸比较与金属反 应的速率
高中化学有机物 官能团与有机化学反应、烃的衍生物 第4节羧酸及其衍生物

第4节羧酸氨基酸和蛋白质第1课时羧酸[课标要求]1.了解常见羧酸的结构、特点及主要物理性质。
2.会用系统命名法命名简单的羧酸。
3.掌握羧酸的主要化学性质。
4.了解酯的结构及主要性质。
5.能结合肥皂的制备说明酯在碱性条件下水解的应用。
1.羧基与氢原子或烃基相连形成羧酸。
饱和一元羧酸的通式为C n H2n O2,与饱和一元酯的通式相同,在碳原子数相同时两者互为同分异构体。
2.羧酸具有酸的通性,能发生酯化反应、αH的卤代反应及还原反应。
4.酯在酸或酶催化下,发生水解反应生成相应的酸和醇。
5.油脂在碱性条件下的水解反应又称为皂化反应。
羧酸的概述1.羧酸的含义分子由烃基(或氢原子)和羧基相连而组成的有机化合物。
羧酸的官能团是或—COOH。
饱和一元脂肪酸的通式为C n H2n O2(n≥1)或C n H2n+1COOH(n≥0)。
2.羧酸的分类依据类别举例脂肪酸乙酸:CH3COOH 烃基种类芳香酸苯甲酸:羧基数目一元羧酸甲酸:HCOOH二元羧酸 乙二酸:HOOC—COOH多元羧酸—烃基是否饱和饱和羧酸 丙酸:CH 3CH 2COOH 不饱和羧酸丙烯酸:CH 2==CHCOOH3.羧酸的命名——系统命名法(1)选取含有羧基的最长碳链作为主链,按主链碳原子数称为“某酸”。
(2)从羧基开始给主链碳原子编号。
(3)在“某酸”名称之前加上取代基的位次号和名称。
如:名称为4甲基3乙基戊酸。
4.羧酸的物理性质(1)水溶性:分子中碳原子数在4以下的羧酸能与水互溶;随着分子中碳链的增长,羧酸在水中的溶解度迅速减小,直至与相对分子质量相近的烷烃的溶解度相近。
因为羧基是亲水基团,烃基是憎水基团,随着碳链的增长,烃基的影响逐渐增大,决定了羧酸的水溶性。
(2)沸点:比相对分子质量相近的醇的沸点高。
因为羧酸的羧基中有两个氧原子,既可以通过羟基氧和羟基氢形成氢键,也可以通过羰基氧和羟基氢形成氢键,而至羧酸比相对分子质量相近的醇形成氢键的几率大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.若丙醇中的氧为188O,它与乙酸反应生成的酯的相对分子质量是()A.102 B.104 C.120 D.1222.某有机物X能发生水解反应,水解产物为Y和Z。
同温同压下,相同质量的Y和Z的蒸汽所占体积相同,化合物X可能是()A.乙酸丙酯B甲酸乙酯C.乙酸甲酯D.乙酸乙酯3.(自组)下列物质与NaOH、Na2CO3、Cu(OH)2(新制)、银氨溶液、苯酚钠都能反应的是()A.乙醇B.乙醛C.甲酸D.甲酸乙酯4.下列物质中与巴豆酸CH3-CH=CH-COOH互为同系物的是()①HCOOH ②CH3COOH ③CH2=CHCOOH ④C17H35COOH ⑤C17H33COOH⑥C6H5—COOH ⑦⑧HOOC-CH=CH-CH=CH-COOHA.①②④B.③⑤⑦C.③⑥⑧D.③⑤5、维生素C的结构简式如右图,有关它的叙述错误的是()A.是一个环状的酯类化合物B.易起加成及氧化反应C.可以溶解于水D.在碱性溶液中能稳定地存在6.分子式为C4H8O2的酯,水解后得到醇A和羧酸B,将A氧化最终可得羧酸C,若C可以发生银镜反应,则分子式为C4H8O2的酯的结构简式为()A.HOOCH2CH2CH3B.CH3CH2COOCH3C.CH3COOCH2CH3D.HCOOCH(CH3)2 7.下列有机物中,①CH2OH(CHOH)4CHO ②CH3CH2CH2OH ③CH2=CH-CH2OH④CH2=CH-COOCH3 ⑤CH2=CH-COOH 既能发生加成、酯化、又能发生氧化反应的是()A.③⑤B.①③⑤C.②④D.①③8.胆固醇是人体必需的生物活性物质,分子式为C27H46O.一种胆固醇酯是液晶材料,分子式为C34H50O2.生成这种胆固醇酯的酸是()A.C6H13COOH B.C6H5COOH C.C7H15COOH D.C6H5CH2COOH9.由以下五种基团两两结合而形成的化合物,能与NaOH溶液反应的共有()①—CH3②—OH ③—C6H5④—CHO ⑤—COOHA.3种B.4种C.5种D.6种10.①油酸②甲酸③聚乙烯④苯⑤乙醛中不能使酸性高锰酸钾溶液褪色的是()A.②③④⑤ B.③④⑤ C.③④⑤ D.③④A.与足量NaOH溶液共热,再通入足量CO2 B.与稀硫酸共热后,加入足量的NaHCO3溶液C.加热该物质的溶液,再通入足量的SO2D.与稀硫酸共热后,再加入足量NaOH溶液12.乙酸与2.0g某饱和一元醇A反应,生成乙酸某酯3.7g,并回收到未反应的A 0.4g,则A的相对分子质量为()A.32 B.46 C.60 D.7413.下列实验方案合理的是()A.配制50 g质量分数为5% NaCl溶液:将45 mL水加入到盛有5 g NaCl的烧杯中,搅拌溶解B.制备乙酸乙酯:用如右图所示的实验装置和试剂C.鉴定SO 24:向溶液中加入盐酸酸化的氯化钡溶液D.鉴别环已烯和苯:将溴的四氯化碳溶液分别滴加到少量环已烯和苯中14.已知1mol有机物A(化学式为C6H10O4)经水解得1molB和2molC,C经分子内脱水得D,D可发生加聚反应生成高聚物,由此可知A的结构简式为()A.HOOC(CH2)4COOH B.HOOC(CH2)3COOCH3C.CH3COO(CH2)2COOCH3D.CH3CH2OOCCOOCH2CH315.某有机物溶于NaOH溶液中(滴有酚酞),开始溶液呈红色,煮沸5min后,溶液褪色加入盐酸至酸性时,沉淀白色的结晶,该结晶溶于水加入FeCl3溶液呈紫色,该有机物可能是()16.A、B、C、D都是含碳、氢、氧的单官能团化合物,A水解得B和C,B氧化得D,D氧化也得到C。
若M(X)表示X的摩尔质量,则下式中正确的是()A.M(A)=M(B)+M(C) B.2M(D)=M(B)+M(C) C.M(B)<M(D)+M(C) D.M(D)<M(B)<M(C) 17.右图是某只含有C、H、O元素的有机物简易球棍模型。
下列关于该有机物的说法正确的是A.该物质属于酯类B.分子式为C3H8O2C.该物质在酸性条件下水解生成乙酸D.该物质含有双键,能跟氢气发生加成反应18.环状化合物是一种重要的有机物,它可由有机化工原料R和其他无机原料发生加成、水解、氧化、酯化反应制得,则R是()A.1-丁烯B.乙炔C.1,3-丁二烯D.乙烯19、(2010江苏卷)阿魏酸在食品、医药等方面有着广泛用途。
一种合成阿魏酸的反应可表示为下列说法正确的是()A.可用酸性4KMnO溶液检测上述反应是否有阿魏酸生成B.香兰素、阿魏酸均可与23Na CO、NaOH溶液反应C.通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应D.与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种20、乙烯酮(CH2=C=O)在一定条件下能与含活泼氢的化合物发生如右所示的加成反应:它与下列试剂发生加成反应时所生成的产物不正确的是()A.NH3加成生成B.与H2O加成生成CH3COOHC.与CH3OH加成生成D.与CH3COOH加成生成21.有机物A(C6H8O4)为食品包装纸的常用防腐剂。
A可以使溴水褪色。
A 难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。
通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有(选填序号)①加成反应②酯化反应③加聚反应④氧化反应(2)B分子所含官能团的名称是、。
(3)B分子中没有支链,其结构简式是,B的具有相同官能团的同分异构体的结构简式是。
(4)由B制取A的化学方程式是:。
(54H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取:天门冬氨酸的结构简式是。
22.(07天津)奶油中有一种只含C、H、O的化合物A 。
A可用作香料,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。
已知:⑴.A的分子式为________ ___。
⑵写出与A分子式相同的所有酯的结构简式:A中含有碳氧双键,与A相关的反应如图:⑶写出A → E、E → F的反应类型:A → E ___________、E →F ___________。
⑷写出A、C、F的结构简式:A ___________ __、C ___________ _、 F _______ ____。
⑸写出B → D反应的化学方程式:___________________________ ________ ______。
⑹在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G,G的一氯代物只有一种,写出G的结构简式:________________。
A → G的反应类型为_________。
23、(08全国Ⅰ卷)A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示:(1)化合物C的分子式是C7H8O,C遇FeCl3溶液显紫色,C与溴水反应生成的一溴代物只有两种,则C的结构简式为。
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为,D具有的官能团是。
(3)反应①的化学方程式是。
(4)芳香化合物B是与A具有相同官能团的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是。
(5)E可能的结构简式是。
24、某有机物A的分子式为C X H Y O Z,4.4gA完全燃烧生成8.8gCO2和3.6gH2O(1)该有机物的实验式(最简式)为。
(2)已知有机物分子中碳碳双键上不连羟基,分子量最小的A的结构简式为(3)若A是一种能发生银镜反应且含羟基的有机物,则分子量最小的A的结构简式有种(4)若A 能与碳酸钠溶液反应放出气体,与醇发生酯化反应,则分子量最小的A的结构简式为(有多少种写多少种)(5)能发生水解反应,也能发生银镜反应的分子量最小的A的结构简式为(有多少种写多少种)25、(10分)有机物A的结构简式为:从A出发,可以发生下列图示中一系列反应,其中K的分子式为C12H14O4,L和K互为同分异构体,F的产量可作为衡量一个国家石油化工发展水平的标志。
I可以发生银镜反应。
请回答:NH3HClB C 天门冬氨酸(1) F→H的反应类型是_____________________ 。
(2) 下列物质的结构简式B_______________K________________L _____________________(3) 写出与B互为同分异构体,属于酯类且苯环上只有一个取代基的各有机物的结构简式_______________________________________________26、有机物A仅含有C、H、O三种元素,能与小苏打反应产生CO2,A蒸气对氢气的相对密度是30。
(1)①A 分子中官能团的名称是。
②A与小苏打溶液反应的离子方程式是。
(2)A可以通过下列变化得到环状化合物D:①C→D的化学方程式是。
若用丙烯(其他无机试剂任选)为原料合成乳酸,合成过程中涉及到的反应类型依次是。
(3)在(2)中的B经过以下合成路线可以得到食用香精菠萝酯:①下列叙述不正确的是(填字母代号)。
a. 已知B是一种有毒物质,可用氢氧化钠溶液除去菠萝酯中的残留的Bb. 试剂甲分子中与三个碳原子处于同一平面的原子至少还有三个c. 菠萝酯易溶于水,且能使酸性KmnO4溶液褪色d. 菠萝酯在稀硫酸中能稳定存在②E有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式。
a. 分子内含有羧基b. 是芳香族化合物,具不与FeCl3溶液发生显色反应c. 1 mol物质和足量的金属钠反应产生1 mol 氢气27、(07全国Ⅱ)某有机化合物X(C7H8O)与另一有机化合物Y发生如下反应生成化合物Z(C11H14O2):(1)X是化合物之一,已知X不能与FeCl3溶液发生显色反应,则X是(填字母)。
(2)Y的分子式是(3)Y有多种同分异构体,其中一种同分异构体E发生银镜反应后,其产物经酸化可得到F(C4H8O3)。
F可发生如右反应:该反应的类型是,E的结构简式是(4)若Y与E具有相同的碳链,则Z的结构简式为:滚动提高由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有下图的转化关系,已知C为密度最小的气体,甲非电解质。
根据以上转化关系回答:⑴写出下列物质的化学式:A:、乙:、丁:。
⑵组成部分A的元素在周期表中的位置是:⑶写出下列变化的方程式:①A与NaOH溶液反应的化学方程式:②乙与过量CO2反应的离子方程式:。
羧酸、酯、油脂答案1-5 B AB C D D 6-10 B B B D D 11-15AB A D D A 16-18CD A D BD C21.⑴①③④⑵碳碳双健羧基⑶HOOCCH=CHCOOH CH2=C(COOH)2⑷HOOCCH=CHCOOH + 2CH3OH CH3OOCCH=CHCOOCH3 + 2H2O⑸HOOCCH2CH(NH 2)COOH22、⑴.C4H8O2(2分)⑵.CH3CH2COOCH3CH3COOCH2CH3HCOOCH(CH3)2HCOOCH2CH2CH3(各1分,共4分)⑶.取代反应消去反应(各1分,共2分)⑷.CH3CHO(各2分,共6分)⑸.(2分)⑹.(2分)氧化反应23、24、.(1)C2H4O (2)CH3CHO (3)5种(4)CH3CH2CH2COOH (CH3)2CHCOOH(5)HCOOCH2CH2CH3HCOOCH(CH3)225、加成反应(1分)(1)B: ;K:;L:。
