有机合成 第十章 还原反应 ppt课件
合集下载
《还原反应》PPT课件
CH2 CHCH2Ph + 2
PhCH=CHCO2H + 2
H Ph +2
Ph H
Pd 120h
Pd 64h
CH3CH2CH2Ph 85%
PhCH2CH2CO2H 90%
Pd 17h
PhCH2CH2Ph
100%
PhC CPh + 2
Pd 23h
PhCH2CH2Ph 100%
CH CO2H + 2 CH CO2H
PhCH=CHCHO H2/Raney Ni
PhCH2CH2CH2OH
酮羰基的氢化要比醛羰基的氢化困难。
CH3COCH3 PhCOCH3
H2/ R-Ni, 0.1~0.3MPa 25~30℃, 38min
CH3CH(OH)CH 3
100%
H2/ Ni-NaH,EtOH, 0.1MPa 25℃, 2.5h
多相催化氢化分为催化加氢、催化氢解、催化转移氢化三类。
① 催化加氢反应:碳—碳重键的加氢反应
◆ 碳—碳重键在钯、铂、镍的作用下催化加氢成为饱和键。
CHCO2H CHCO2H
+ H2
CH2CO2H CH2CO2H
亚油酸酯 CH3(CH2)4CH=CHCH2CH=CH(CH2)7CO2R
H2/Ni
CH3(CH2)7CH=CH(CH2)7CO2R + CH3(CH2)4CH=CH(CH2)10CO2R
OH OH
H H
OH
OH 86%
◆催化加氢反应是合成顺式取代乙烯衍生物的重要方法。使用Lindlar催化剂可 使叁键变为双键,不影响其它双键。
RC CR'
H2
Lindlar催化剂
还原—催化加氢反应类型(有机合成课件)

精精细细有有机机合合成技成术技术
烷基还化原反反应应
醛或酮在酸性催化剂存在下,能与一分子醇发生加 成,生成半缩醛(酮)。半缩醛(酮)很不稳定,一般 很难分离出来,它可与另一分子醇继续缩合,脱水形成 缩醛(acetal)或酮。
精精细细有有机机合合成技成术技术
烷基还化原反反应应
醛加氢时生成的醇会与醛缩合成半缩醛及醛缩醇。
此反应的选择性只能达到70%,有大量的副产物饱和醇生成。
精精细细有有机机合合成技成术技术
烷基还化原反反应应
第二节 催化加氢
如果要得到不饱和醇,应选用金属氧化物催化剂,但
是反应时有可能发生氢转移生成饱和醛,因此必须采用较
为缓和的加氢条件。
不饱和双键与羰基同时加氢比较容易实现。可用金属 或金属氧化物催化剂,反应条件可以较为激烈,只要避免 氢解反应即可。
多烯烃的加氢也有类似过程。即每一个双键可吸收一分子氢,直 至饱和。如果选择合适的催化剂和反应条件,就可以对多烯烃进行部 分加氢,保留一部分双键。
精精细细有有机机合合成技成术技术
烷基还化原反反应应
环烯烃与直链烯烃的加氢反应采用相同的催化剂,双 键上有取代基时可减慢加氢反应速度。另外,环烯烃的加 氢有发生开环副反应的可能,因此要得到环状产物则需要 控制反应条件。通常五元环和六元环较稳定。
因此,苯加氢很难形成分步加氢的中间产物,即苯加氢通常只能得 到环己烷。
苯的同系物加氢速度比苯慢,说明含有取代基会对加氢反应产生活 性降低的影响。
精精细细有有机机合合成技成术技术
烷基还化原反反应应
稠环芳烃在加氢时会分步发生反应。如萘加氢时会有多种中间产物。
芳烃加氢时,也有可能发生氢解,产生侧键或芳环断裂。 工业生产中最常用的芳烃加氢是环己烷的生产。生产环己烷的主要工 艺是苯的催化加氢。
还原反应课件

• 影响原因 • 实际操作 • 实例
•
Fe和酸(HCl、H2SO4、CH3COOH)
共存,或在盐类电解质(FeCl2、NH4Cl)
水溶液中,对于硝基是一种强还原剂。
• 用途:将硝基或其他含N基团(如亚硝基、
羟胺基)还原成相应氨基,对卤基、烯基、 羰基等无影响,是一种选择性还原剂。
• 铁屑在电解质溶液中还原硝基是一种 古老旳工艺,是1854年Bechamp发觉旳。
5.2.2.1 被还原物旳构造 环上取代基不同,反应活性不同。 比较:
O2N
COOCH3
O2N
OH
O
O
O
N
C
N
R
O
O-R
O
① 吸电子基? 硝基N上电子云密度降低,亲电能力增
强,还原反应易进行,反应温度可降低。
② 供电子基? 亲电能力降低,还原反应难进行,反应
温度较高,一般在沸腾回流下进行。
O2N
• 优点: 铁屑价格低廉,工艺简朴、合用范围
广,生产较易控制,产品质量好,副反应 少,对设备要求低。
在诸多旳还原措施中占有主要地位。
应用范围? 生产吨位较小旳芳胺,尤其是含水溶
性基团旳芳胺,如二甲苯胺、间氨基苯磺 酸及某些萘系胺类中间体。
• 缺陷: 生成大量含芳胺旳氧化铁铁泥废渣、
含胺废水,必须净化处理,废渣旳处理十 分困难。
• 铁粉是电子旳供给者。 6-2 6-3
• 被还原物旳某个原子→得到电子(铁粉 表面)→负离子自由基→得到质子(质子供 给体H2O)→还原产物。 6-4 6-5 6-6
副反应?
5.2.2 影响原因
影响原因
被 还 原 物 结 构铁Leabharlann 粉 质 量 和 用 量介 质
•
Fe和酸(HCl、H2SO4、CH3COOH)
共存,或在盐类电解质(FeCl2、NH4Cl)
水溶液中,对于硝基是一种强还原剂。
• 用途:将硝基或其他含N基团(如亚硝基、
羟胺基)还原成相应氨基,对卤基、烯基、 羰基等无影响,是一种选择性还原剂。
• 铁屑在电解质溶液中还原硝基是一种 古老旳工艺,是1854年Bechamp发觉旳。
5.2.2.1 被还原物旳构造 环上取代基不同,反应活性不同。 比较:
O2N
COOCH3
O2N
OH
O
O
O
N
C
N
R
O
O-R
O
① 吸电子基? 硝基N上电子云密度降低,亲电能力增
强,还原反应易进行,反应温度可降低。
② 供电子基? 亲电能力降低,还原反应难进行,反应
温度较高,一般在沸腾回流下进行。
O2N
• 优点: 铁屑价格低廉,工艺简朴、合用范围
广,生产较易控制,产品质量好,副反应 少,对设备要求低。
在诸多旳还原措施中占有主要地位。
应用范围? 生产吨位较小旳芳胺,尤其是含水溶
性基团旳芳胺,如二甲苯胺、间氨基苯磺 酸及某些萘系胺类中间体。
• 缺陷: 生成大量含芳胺旳氧化铁铁泥废渣、
含胺废水,必须净化处理,废渣旳处理十 分困难。
• 铁粉是电子旳供给者。 6-2 6-3
• 被还原物旳某个原子→得到电子(铁粉 表面)→负离子自由基→得到质子(质子供 给体H2O)→还原产物。 6-4 6-5 6-6
副反应?
5.2.2 影响原因
影响原因
被 还 原 物 结 构铁Leabharlann 粉 质 量 和 用 量介 质
高等有机第十章-还原

CH2OH
CO2Et CN
Ca(BH4)2
CN
OH
LiBH4
C7H15 O O
C7H15CHCH2CH2CH2OH
用计算量的醇与LiAlH4反应可得一系列四氢铝锂衍生物:
LiAlH4 + 2 ROH
LiAlH2(OR)2 + 2 H2
这些衍生物在有机溶剂中有一定溶解度。在低温下对一些选择 性还原很有用。 烷基化的硼氢化物比硼氢负离子具有更大的空间位阻,在空间因 素控制下具有更高的立体选择性。
61% 20% 6%
39% 80% 94%
极性溶剂与羟基之间的作用减弱羟基与催化剂之间的相互作用, 定位效应也减弱了。
一些过渡金属络合物是有效的氢化均相催化剂,最常用的是 三(三苯基膦〕氯化铑(Ph3P)3RhCl, (Wilkinson 催化剂)。 均相催化剂可减少异构化。反应机理涉及形成金属氢化物中 间体,它与烯烃形成p-络合物,然后将氢原子从铑转移到碳 原子上。
许多其它官能团对催化氢化也很活泼但大多数情况下比烯烃还官能团产物催化剂反应条件pd室温14atmh喹啉室温1atmcucrni200高压nirh50100高压pdnipt室温14atmpdoh催化活性iclptpd室温14atmhrcoclrcoorrcnrnorchorchohrchrhoh二其它氢转移剂催化氢化反应通过一系列络合物和中间体将分子氢转移到不饱和基团上
CH2CH2COOCH3
CH2CH2COOCH3
H2 / Pt
H COOCH3
H
COOCH3
Ni / Pt
H
OH
Pt, H2 + CH3CO2H
95%
OH
H
80%
CO2Et CN
Ca(BH4)2
CN
OH
LiBH4
C7H15 O O
C7H15CHCH2CH2CH2OH
用计算量的醇与LiAlH4反应可得一系列四氢铝锂衍生物:
LiAlH4 + 2 ROH
LiAlH2(OR)2 + 2 H2
这些衍生物在有机溶剂中有一定溶解度。在低温下对一些选择 性还原很有用。 烷基化的硼氢化物比硼氢负离子具有更大的空间位阻,在空间因 素控制下具有更高的立体选择性。
61% 20% 6%
39% 80% 94%
极性溶剂与羟基之间的作用减弱羟基与催化剂之间的相互作用, 定位效应也减弱了。
一些过渡金属络合物是有效的氢化均相催化剂,最常用的是 三(三苯基膦〕氯化铑(Ph3P)3RhCl, (Wilkinson 催化剂)。 均相催化剂可减少异构化。反应机理涉及形成金属氢化物中 间体,它与烯烃形成p-络合物,然后将氢原子从铑转移到碳 原子上。
许多其它官能团对催化氢化也很活泼但大多数情况下比烯烃还官能团产物催化剂反应条件pd室温14atmh喹啉室温1atmcucrni200高压nirh50100高压pdnipt室温14atmpdoh催化活性iclptpd室温14atmhrcoclrcoorrcnrnorchorchohrchrhoh二其它氢转移剂催化氢化反应通过一系列络合物和中间体将分子氢转移到不饱和基团上
CH2CH2COOCH3
CH2CH2COOCH3
H2 / Pt
H COOCH3
H
COOCH3
Ni / Pt
H
OH
Pt, H2 + CH3CO2H
95%
OH
H
80%
《还原反应机理》PPT课件

H2 (g) H2 (adsorb.) 2H (activeH ) 2H 2e (H Ni )
原料和产物 (2) 吸附络合物之间发生化学反应
(2302)1/4/2产4 物的解析和扩散,离开催化剂表面
28
二、催化剂
种类
常用金属 制法概要
举例
还原型 Pt , Pd , 金属氧化物用氢还原 cid hydrolysis 2 H2O ,2 NaHSO4
ArNHNH
2
NO 2 Na 2SO3/NaHSO 3
SO3NaSO3Na
NHSO 3Na SO3Na H3+O
NH2 SO 3Na
HO
OH
2021/4/24
OH
17
(2)连二亚硫酸钠还原
O
HN
O
N
H
NO 2
Na 2S2O4/H2O
HO
H3C CH3
O
LiAlH4
HO
N
CH3
CN O H2
HN S
2021/4/24
KBH4/NaOH/EtOH
H3C CH3
N CH3
H2 CN OH
HN S
22
9.1.4 硼烷还原剂
亲电性氢负离子转移还原剂 易还原羧基 与双键发生硼氢化反应
O2N
O
B2H6/THF
C
N(CH 3)2
,1h
O2N
4
(2)钠和钠汞齐作为还原剂
Birch反应 芳香族化合物
液氨
H3C
OH
非共轭二烯
H3C
OH
Li/NH 3/Et 2O
40C,30 min
H
H3CO
H3CO
有机化学第十章醛酮PPT课件

注意事项
在醇氧化制备醛的过程中,应控制反应条件,如温度、浓度、催化剂 等,以避免过度氧化或其它副反应的发生。
通过醇的氧化制备酮
总结词
醇氧化是制备酮的一种常用方法,常用的氧化剂有高锰酸 钾、硝酸、铬酸等。
详细描述
醇氧化制备酮的反应机理是醇分子中的羟基被氧化成羰基, 同时生成氢离子,常用的氧化剂可以将醇氧化成相应的酮, 同时生成水或其它相应的产物。
醛酮还可以用于合成生物活性分子,如激素、维生素等,对生命过程具有重要影响。
05 醛酮的制备方法
通过醇的氧化制备醛
总结词
醇氧化是制备醛的一种常用方法,常用的氧化剂有高锰酸钾、硝酸、 铬酸等。
详细描述
醇氧化制备醛的反应机理是醇分子中的羟基被氧化成羰基,常用的 氧化剂可以将醇氧化成相应的醛,同时生成水或其它相应的产物。
亲核加成反应
与氢氰酸加成
酮在氢氰酸的作用下,可以发生亲核加成反应, 生成相应的羟基腈。
与水加成
酮在水的作用下,可以发生亲核加成反应,生成 相应的醇。
与醇加成
酮在醇的作用下,可以发生亲核加成反应,生成 相应的酯。
亲电加成反应
与溴加成
01
酮在溴的作用下,可以发生亲电加成反应,生成相应的溴代酮。
与硫酸加成
02 醛的化学性质
还原反应
还原成醇
还原成醇和烃的混合物
在催化剂存在下,醛基可被还原成醇, 如用氢化铝锂(LiAlH4)作为还原剂。
在某些条件下,醛基可被还原成醇和 烃的混合物,如用氢气作为还原剂。
还原成烃
在酸性条件下,醛基可被还原成烃, 如用硫酸铜和亚硫酸氢钠作为还原剂。
氧化反应
氧化成酸
在强氧化剂存在下,醛基可被氧化成羧基,如用高锰酸钾 (KMnO4)作为氧化剂。
在醇氧化制备醛的过程中,应控制反应条件,如温度、浓度、催化剂 等,以避免过度氧化或其它副反应的发生。
通过醇的氧化制备酮
总结词
醇氧化是制备酮的一种常用方法,常用的氧化剂有高锰酸 钾、硝酸、铬酸等。
详细描述
醇氧化制备酮的反应机理是醇分子中的羟基被氧化成羰基, 同时生成氢离子,常用的氧化剂可以将醇氧化成相应的酮, 同时生成水或其它相应的产物。
醛酮还可以用于合成生物活性分子,如激素、维生素等,对生命过程具有重要影响。
05 醛酮的制备方法
通过醇的氧化制备醛
总结词
醇氧化是制备醛的一种常用方法,常用的氧化剂有高锰酸钾、硝酸、 铬酸等。
详细描述
醇氧化制备醛的反应机理是醇分子中的羟基被氧化成羰基,常用的 氧化剂可以将醇氧化成相应的醛,同时生成水或其它相应的产物。
亲核加成反应
与氢氰酸加成
酮在氢氰酸的作用下,可以发生亲核加成反应, 生成相应的羟基腈。
与水加成
酮在水的作用下,可以发生亲核加成反应,生成 相应的醇。
与醇加成
酮在醇的作用下,可以发生亲核加成反应,生成 相应的酯。
亲电加成反应
与溴加成
01
酮在溴的作用下,可以发生亲电加成反应,生成相应的溴代酮。
与硫酸加成
02 醛的化学性质
还原反应
还原成醇
还原成醇和烃的混合物
在催化剂存在下,醛基可被还原成醇, 如用氢化铝锂(LiAlH4)作为还原剂。
在某些条件下,醛基可被还原成醇和 烃的混合物,如用氢气作为还原剂。
还原成烃
在酸性条件下,醛基可被还原成烃, 如用硫酸铜和亚硫酸氢钠作为还原剂。
氧化反应
氧化成酸
在强氧化剂存在下,醛基可被氧化成羧基,如用高锰酸钾 (KMnO4)作为氧化剂。
典型还原反应及机理课件

Me、OH、NH2、OMe、Cl对反应速 率无影响,且不受还原影响
2.8 还原硝基
活性 组分
-C≡N,-C=O,-COOEt,-COOH, Cl,I,CH=CH2不受还原影响
2.9 还原醛和酮
NaBH(OAc)3还 可在酮的存在下
选择性还原醛
NaBH4/SnCl2可实现在芳香族酮存在 下选择性还原芳香族醛
二、NaBH4还原
可还原基团
醛 酮 酰氯
单独使用
复合使用
NaBH4
可还原基团
C=C、C≡C 羧酸、酯、酰氯 酰胺、氨基酸 硝基、氰基、羰基 其它化合物
复合元素:羧酸、MCl2(M=Co,Zn,Ni…)、I2、季铵盐…
复合目的:提高还原活性及选择性
二、NaBH4还原
仅使用NaBH4时还原机理:
机理1
自由基还原历程
三、其它典型还原方法
Wolff L – Kishner-Huang minlon还原法
总结
1、NaBH4复合羧酸、MCl2(Co、Zn、Ni、Al)、I2可提高活性; 2、NaBH4活性提高是因为原位产生硼烷或其络合物; 3、反应溶剂优选THF、醇、CH2Cl2 4、烯烃经还原可产生醇和烷烃; 5、烯烃、炔烃、羧酸、酯、酰胺、腈、硝基等均可被还原; 6、在手性配体存在下,可实现高的立体选择性。
机理2
氢负离子反应机理
少量NaOH时:
过量NaOH时:
水解完体系呈碱性。
2.1、还原烯烃、炔烃
BH3 :强还原活性,易与烯烃发生硼氢化还原反应,极不稳定
乙硼烷
(B2H6-THF, B2H6SMe2, B2H6-NR3)
例:
硼氢化钠原位产生(in-situ) BF3产生硼烷效率更高
2.8 还原硝基
活性 组分
-C≡N,-C=O,-COOEt,-COOH, Cl,I,CH=CH2不受还原影响
2.9 还原醛和酮
NaBH(OAc)3还 可在酮的存在下
选择性还原醛
NaBH4/SnCl2可实现在芳香族酮存在 下选择性还原芳香族醛
二、NaBH4还原
可还原基团
醛 酮 酰氯
单独使用
复合使用
NaBH4
可还原基团
C=C、C≡C 羧酸、酯、酰氯 酰胺、氨基酸 硝基、氰基、羰基 其它化合物
复合元素:羧酸、MCl2(M=Co,Zn,Ni…)、I2、季铵盐…
复合目的:提高还原活性及选择性
二、NaBH4还原
仅使用NaBH4时还原机理:
机理1
自由基还原历程
三、其它典型还原方法
Wolff L – Kishner-Huang minlon还原法
总结
1、NaBH4复合羧酸、MCl2(Co、Zn、Ni、Al)、I2可提高活性; 2、NaBH4活性提高是因为原位产生硼烷或其络合物; 3、反应溶剂优选THF、醇、CH2Cl2 4、烯烃经还原可产生醇和烷烃; 5、烯烃、炔烃、羧酸、酯、酰胺、腈、硝基等均可被还原; 6、在手性配体存在下,可实现高的立体选择性。
机理2
氢负离子反应机理
少量NaOH时:
过量NaOH时:
水解完体系呈碱性。
2.1、还原烯烃、炔烃
BH3 :强还原活性,易与烯烃发生硼氢化还原反应,极不稳定
乙硼烷
(B2H6-THF, B2H6SMe2, B2H6-NR3)
例:
硼氢化钠原位产生(in-situ) BF3产生硼烷效率更高
还原反应

O O O N
LiAlH4 / THF , 1 2h ~
O O
N
(100%)
四、催化氢化
• (一)、催化氢化的概念
• 在催化剂的存在下,有机物(底物)与氢 气反应,使一些C-O,C-X,C-S等键断裂, 生成C-H键的过程称为催化氢化。催化氢化 也包括催化氢解(在氢的作用下发生碳键 断裂的过程),是药物合成的重要手段之 一。常见的有脱卤氢解、脱苄氢解、脱硫 氢解和开环氢解等
1、酰卤的还原
酰卤在适当的条件下反应,用催化氢化 或金属氢化物选择性还原为醛,此反应称 Rosenmund反应。改变反应条件,用上述还 原剂可还原得醇。 金属氢化物中三丁基锡氢(Bu3SnH)、 三(叔丁氧基)氢化铝锂( )为 好的还原剂。在低温下反应,对芳酰卤及 杂环酰卤还原收率较高,并不影响分子中 的硝基、氰基、酯基、双键、醚键。
一、 醛、酮的还原反应
1.还原成烃基的反应
(一)Clemmensen反应
• 在酸性条件下,用锌汞齐或锌粉还原醛基、酮 基为甲基或亚甲基的反应称Clemmensen反应。 锌汞齐是将锌粉或锌粒用5%~10%的二氯化汞 水溶液处理后制得。将锌汞齐与羰基化合物在 约5%盐酸中回流,醛基还原成甲基,酮基则 还原成亚甲基。Clemmensen还原反应,能用 于几乎所有的芳香脂肪酮的还原,反应易于进 行且收率较高。但脂肪酮、醛或脂环酮的 Clemmensen还原容易产生树酯或双分子还原, 生成频哪醇等副产生,因而收率较低。
2、羧酸及酸酐的还原
• 氢化铝锂是还原羧酸为伯醇的最常用试剂, 反应可在十分温和的条件下进行,一般不 会停止在醛的阶段。即使位阻较大的酸, 亦有较好的收率,因而得到广泛的应用。
CH3 CH3 C CO OH CH3
LiAlH4 / THF , 1 2h ~
O O
N
(100%)
四、催化氢化
• (一)、催化氢化的概念
• 在催化剂的存在下,有机物(底物)与氢 气反应,使一些C-O,C-X,C-S等键断裂, 生成C-H键的过程称为催化氢化。催化氢化 也包括催化氢解(在氢的作用下发生碳键 断裂的过程),是药物合成的重要手段之 一。常见的有脱卤氢解、脱苄氢解、脱硫 氢解和开环氢解等
1、酰卤的还原
酰卤在适当的条件下反应,用催化氢化 或金属氢化物选择性还原为醛,此反应称 Rosenmund反应。改变反应条件,用上述还 原剂可还原得醇。 金属氢化物中三丁基锡氢(Bu3SnH)、 三(叔丁氧基)氢化铝锂( )为 好的还原剂。在低温下反应,对芳酰卤及 杂环酰卤还原收率较高,并不影响分子中 的硝基、氰基、酯基、双键、醚键。
一、 醛、酮的还原反应
1.还原成烃基的反应
(一)Clemmensen反应
• 在酸性条件下,用锌汞齐或锌粉还原醛基、酮 基为甲基或亚甲基的反应称Clemmensen反应。 锌汞齐是将锌粉或锌粒用5%~10%的二氯化汞 水溶液处理后制得。将锌汞齐与羰基化合物在 约5%盐酸中回流,醛基还原成甲基,酮基则 还原成亚甲基。Clemmensen还原反应,能用 于几乎所有的芳香脂肪酮的还原,反应易于进 行且收率较高。但脂肪酮、醛或脂环酮的 Clemmensen还原容易产生树酯或双分子还原, 生成频哪醇等副产生,因而收率较低。
2、羧酸及酸酐的还原
• 氢化铝锂是还原羧酸为伯醇的最常用试剂, 反应可在十分温和的条件下进行,一般不 会停止在醛的阶段。即使位阻较大的酸, 亦有较好的收率,因而得到广泛的应用。
CH3 CH3 C CO OH CH3
有机合成 第十章 还原反应

酰胺与次卤酸钠的碱溶液作用生成少一个碳的伯胺, 羰基被消除生成碳酸盐,也称霍夫曼重排
霍夫曼降解:
R-CONH2 + NaOX + 2NaOH
R-NH2 +Na2CO3
山东科技大学 化学与环境工程学院
王鹏
炔烃的溶解金属还原:
非末端炔烃还可通过溶解金属法(Na-NH3(L))还原。 反应主要生成反式构型烯烃,与催化氢化产物相反 反应历程:
目前的研究中,大部分此类反应已经可以
被其他方法代替,但仍具有重要意义
王鹏 山东科技大学 化学与环境工程学院
一、溶解金属还原的原理:
金属溶解于质子性溶剂而将电子直接转移到底
物,随后底物从溶剂中获得质子完成还原 常用的金属有锂、钠、镁、锌、铁等,溶剂有 醇、乙酸、液氨、浓盐酸等 反应的原理决定加氢是分步的,故必为反式
王鹏
山东科技大学 化学与环境工程学院
二、催化氢解
底物分子催化下加氢变为两个或更多分子的还
原过程。 常用于被保护基团的去保护,如苄酯、苄醚等 的苄基可以被Pd-C催化加氢而除去,从而用于 羟基的保护-去保护方案 常用的催化氢解催化剂:
Pd-C和Raney Ni最常使用 卤代烃可以通过催化氢解除去,活性为I>Br>Cl>F
硼氢化钠:氢化钠+硼酸三甲酯 四氢铝锂:氢化锂+无水三氯化铝
王鹏
山东科技大学 化学与环境工程学院
10.3.1 LiAlH4与NaBH4
还原举例
王鹏
山东科技大学 化学与环境工程学院
反应机理:亲核加成-水解
O 机理: R C R + Na BH3 H R OBH2O C H R C R H H2O H
霍夫曼降解:
R-CONH2 + NaOX + 2NaOH
R-NH2 +Na2CO3
山东科技大学 化学与环境工程学院
王鹏
炔烃的溶解金属还原:
非末端炔烃还可通过溶解金属法(Na-NH3(L))还原。 反应主要生成反式构型烯烃,与催化氢化产物相反 反应历程:
目前的研究中,大部分此类反应已经可以
被其他方法代替,但仍具有重要意义
王鹏 山东科技大学 化学与环境工程学院
一、溶解金属还原的原理:
金属溶解于质子性溶剂而将电子直接转移到底
物,随后底物从溶剂中获得质子完成还原 常用的金属有锂、钠、镁、锌、铁等,溶剂有 醇、乙酸、液氨、浓盐酸等 反应的原理决定加氢是分步的,故必为反式
王鹏
山东科技大学 化学与环境工程学院
二、催化氢解
底物分子催化下加氢变为两个或更多分子的还
原过程。 常用于被保护基团的去保护,如苄酯、苄醚等 的苄基可以被Pd-C催化加氢而除去,从而用于 羟基的保护-去保护方案 常用的催化氢解催化剂:
Pd-C和Raney Ni最常使用 卤代烃可以通过催化氢解除去,活性为I>Br>Cl>F
硼氢化钠:氢化钠+硼酸三甲酯 四氢铝锂:氢化锂+无水三氯化铝
王鹏
山东科技大学 化学与环境工程学院
10.3.1 LiAlH4与NaBH4
还原举例
王鹏
山东科技大学 化学与环境工程学院
反应机理:亲核加成-水解
O 机理: R C R + Na BH3 H R OBH2O C H R C R H H2O H
还原反应及其工艺PPT课件

C
O
H N
C
N H
O
C
Zn/HCl C2H5
S
C
C6H5 C
O
H N
CH2
N H
扑痫酮
• 选择性还原C=O成亚甲基,而不影响其它羰基。
O
C2H5
1 Fe/CH3CO2H
C2H5
O 2N
C HC O O H O
N
C HC O O H
O
2
O
O Zn/HCl(g)
N
C2H5 C HC O O H
O 吲哚布芬
冷凝器
第7页/共54页
• 铁粉还原适用范围:
• 硝基还原为氨基:铁粉还原法生产维生素B6,可避免发生氯的
脱落、氰基还原、酯基的水解等副反应,收率达到90%。加氢
还 原 , 收 率 只 有 5 0 % 。CO 2C2H5
O 2N
CN Fe/HCl H2N
CO 2C2H5 CN
H3C
N
Cl CH3CO2H H3C
第21页/共54页
• 碱度的影响:用硫化钠还原硝基苯,反应速度常数随碱的浓度 增加而增加,存在下述评衡。
• 硝基部分还原时,硫化碱用量超过理论值的5-10%,温度为4080℃(不超过100℃),避免完全还原。
• 硝基全部还原时,硫化碱用量超过理论值的10-20%,温度为60110℃,甚至可在高压釜中进行。
第6页/共54页
搅拌的影响:
铁粉比较重,需要良好的搅拌,否则容易沉到反应器底部。 衬有耐酸砖的平底钢槽和铸铁慢速耙式搅拌器。 新式反应器:衬耐酸砖的球底钢槽和不锈钢快速螺旋桨式搅拌器。
耙式搅拌器
耙臂上安装多 组可调节刮板, 搅拌物质可从 弧线形刮板的 间隙通过,搅 拌阻力小,降 低搅拌电机的 功耗。
O
H N
C
N H
O
C
Zn/HCl C2H5
S
C
C6H5 C
O
H N
CH2
N H
扑痫酮
• 选择性还原C=O成亚甲基,而不影响其它羰基。
O
C2H5
1 Fe/CH3CO2H
C2H5
O 2N
C HC O O H O
N
C HC O O H
O
2
O
O Zn/HCl(g)
N
C2H5 C HC O O H
O 吲哚布芬
冷凝器
第7页/共54页
• 铁粉还原适用范围:
• 硝基还原为氨基:铁粉还原法生产维生素B6,可避免发生氯的
脱落、氰基还原、酯基的水解等副反应,收率达到90%。加氢
还 原 , 收 率 只 有 5 0 % 。CO 2C2H5
O 2N
CN Fe/HCl H2N
CO 2C2H5 CN
H3C
N
Cl CH3CO2H H3C
第21页/共54页
• 碱度的影响:用硫化钠还原硝基苯,反应速度常数随碱的浓度 增加而增加,存在下述评衡。
• 硝基部分还原时,硫化碱用量超过理论值的5-10%,温度为4080℃(不超过100℃),避免完全还原。
• 硝基全部还原时,硫化碱用量超过理论值的10-20%,温度为60110℃,甚至可在高压釜中进行。
第6页/共54页
搅拌的影响:
铁粉比较重,需要良好的搅拌,否则容易沉到反应器底部。 衬有耐酸砖的平底钢槽和铸铁慢速耙式搅拌器。 新式反应器:衬耐酸砖的球底钢槽和不锈钢快速螺旋桨式搅拌器。
耙式搅拌器
耙臂上安装多 组可调节刮板, 搅拌物质可从 弧线形刮板的 间隙通过,搅 拌阻力小,降 低搅拌电机的 功耗。
【正式版】还原反应PPT

N COOEt 称为偶姻缩合(Acyloin Condensation), 是合成脂肪族 -羟基酮的重要方法
机理见Page 388
N
一般羧酸的衍生物(如羧酸酯)比羧酸更易于还原,常常将羧酸转换成羧酸酯,再进行还原
C2O HH
机理见Page 388
在低温下反应,芳酰卤及杂环酰卤还原的收率较高,硝基、氰基、酯键、双键、醚键不受影响。
4
R1
RC H2
NR2
C-N断 键[H] 水 解 在低温下反应,芳酰卤及杂环酰卤还原的收率较高,硝基、氰基、酯键、双键、醚键不受影响。
4 羧酸及酸酐的还原 乙硼烷是还原酰胺的良好试剂。
RCHO 与LiAlH4不同,乙硼烷还原酰胺时没有醛副产物生成,不还原硝基、酰卤 p364,p388
Bouveault-Blanc 反应
还原反应
7.4 羧酸及其衍生物的还原
羧酸及其衍生物易被还原成醛,是工业上合成醛的 主要方法之一。醛可进一步还原成醇
7.4.1 酰卤的还原
Rosenmund反应:酰卤用催化氢化或金属氢化物选
择性地还原为醛的反应
O
H 2/P d-B aSO 4/T H F O
C O C l
25 o
M eNM e
C H O
为什么不能用活泼金属与酸的水溶液作为还原体系还原腈类化合物?
LiAlH LiAlH 间R腈机B金ooR 接可理属usevn引 用 见 氢emaO C 入催P化uulantg羧化物-dBe反N 基氢可l3a8应n和化用8c:氨和氢反R R 酰基金化应1 2卤的属铝用方氢锂催法化、化物硼氢还烷化原等4或金属R 氢化O C H 物A 选N l择H 性3地R R L 还1 2i原为醛的反应 RC HNR R1 2
机理见Page 388
N
一般羧酸的衍生物(如羧酸酯)比羧酸更易于还原,常常将羧酸转换成羧酸酯,再进行还原
C2O HH
机理见Page 388
在低温下反应,芳酰卤及杂环酰卤还原的收率较高,硝基、氰基、酯键、双键、醚键不受影响。
4
R1
RC H2
NR2
C-N断 键[H] 水 解 在低温下反应,芳酰卤及杂环酰卤还原的收率较高,硝基、氰基、酯键、双键、醚键不受影响。
4 羧酸及酸酐的还原 乙硼烷是还原酰胺的良好试剂。
RCHO 与LiAlH4不同,乙硼烷还原酰胺时没有醛副产物生成,不还原硝基、酰卤 p364,p388
Bouveault-Blanc 反应
还原反应
7.4 羧酸及其衍生物的还原
羧酸及其衍生物易被还原成醛,是工业上合成醛的 主要方法之一。醛可进一步还原成醇
7.4.1 酰卤的还原
Rosenmund反应:酰卤用催化氢化或金属氢化物选
择性地还原为醛的反应
O
H 2/P d-B aSO 4/T H F O
C O C l
25 o
M eNM e
C H O
为什么不能用活泼金属与酸的水溶液作为还原体系还原腈类化合物?
LiAlH LiAlH 间R腈机B金ooR 接可理属usevn引 用 见 氢emaO C 入催P化uulantg羧化物-dBe反N 基氢可l3a8应n和化用8c:氨和氢反R R 酰基金化应1 2卤的属铝用方氢锂催法化、化物硼氢还烷化原等4或金属R 氢化O C H 物A 选N l择H 性3地R R L 还1 2i原为醛的反应 RC HNR R1 2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
山东科技大学 化学与环境工程8学院
➢ 羰基的催化还原:
不同催化剂得到不同的产物:
羰基和双键的选择性还原需注意条件:
王鹏
有机合成 第十章 还原反应
山东科技大学 化学与环境工程9学院
二、催化氢解
➢ 底物分子催化下加氢变为两个或更多分子的还 原过程。
➢ 常用于被保护基团的去保护,如苄酯、苄醚等 的苄基可以被Pd-C催化加氢而除去,从而用于 羟基的保护-去保护方案
➢ 反应涉及的方面主要包括芳环、羰基、碳碳重 键的还原
目前的研究中,大部分此类反应已经可以 被其他方法代替,但仍具有重要意义
王鹏
有机合成 第十章 还原反应
山东科技大学 化学与环境工程15学院
一、溶解金属还原的原理:
➢ 金属溶解于质子性溶剂而将电子直接转移到底 物,随后底物从溶剂中获得质子完成还原
选择性还原端烯
王鹏
有机合成 第十章 还原反应
避免氢解反应
山东科技大学 化学与环境工程14学院
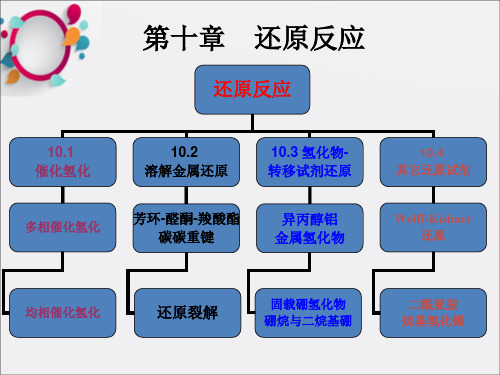
10.2 溶解金属还原
溶解金属还原:
➢ 将活泼金属(如锂、钠、钾等)加到质子性溶 剂(如乙醇、乙酸)中进行还原的方法称作溶 解金属还原,该方法具有良好的化学选择性及 立体选择性
➢ 反应本质是电子对不饱和键的加成
➢ 越活泼选择性越差,具有选择性的催化剂活性都较低 ➢ 催化活性受负载物等外部条件影响 ➢ 催化加氢的关键是了解各催化剂的使用范围
王鹏
有机合成 第十章 还原反应
山东科技大学 化学与环境工程3学院
10.1.1 异相催化氢化
一、常见的催化剂:
➢ Raney Ni:
用NaOH溶去镍铝合金中的Al ,洗涤后的残余物为 Raney Ni催化剂,主要含Ni、Al(1~8%)及少量 NiO和Al2O3水合物。类似海绵状的微粒,总表面积 为50~130 m2/g。
➢ Lindlar Pd:
将单质钯负载于CaCO3上,然后使用醋酸铅毒化, 或者使用BaSO4为负载物,使用喹啉毒化处理
王鹏
有机合成 第十章 还原反应
山东科技大学 化学与环境工程4学院
催化剂的还原
➢ 同样的钯催化剂,活性炭负载时催化活性高, 硫酸钡负载时活性低;一般而言,同一催化剂 的表面积越大,活性越高
➢ 常用的金属有锂、钠、镁、锌、铁等,溶剂有 醇、乙酸、液氨、浓盐酸等
➢ 反应的原理决定加氢是分步的,故必为反式
王鹏
有机合成 第十章 还原反应
山东科技大学 化学与环境工程16学院
二、芳环的还原——Birch (伯奇)还原:
➢ 碱金属-液氨体系可以还原苯环为1,4-二烯 烃,称为Birch还原
➢ 该还原的重要之处在于苯甲醚及苯胺类化合物 还原后水解可得环己烯酮衍生物
➢ 使用金属钙代替碱金属可以得到相同的还原产 物,其安全性和操作性更好
王鹏
有机合成 第十章 还原反应
山东科技大学 化学与环境工程17学院
伯奇还原生成环己二烯,双键以供电子基 团为取代基:
王鹏
有机合成 第十章 还原反应
山东科技大学 化学与环境工程18学院
二、金属催化剂的催化机理
➢ 一般认为:金属催化剂的催化是通过同时吸附 氢气和不饱和键,生成的活泼氢原子从同侧进 攻削弱的不饱和键,因此加氢是顺式的,且从 位阻较小的方向进攻为主
王鹏
有机合成 第十章 还原反应
山东科技大学 化学与环境工程5学院
三、各官能团的还原:
➢ 碳碳重键可通过选择催化剂分别得到烷或烯 ➢ 羰基一般还原为醇,用单质钯催化则能得烃
➢ 常用的催化氢解催化剂:
Pd-C和Raney Ni最常使用 卤代烃可以通过催化氢解除去,活性为I>Br>Cl>F
王鹏
有机合成 第十章 还原反应
山东科技大学 化学与环境工程10学院
➢ 举例:
王鹏
有机合成 第十章 还原反应
山东科技大学 化学与环境工程11学院
10.1.2 均相催化氢化
均相催化氢化:
山东科技大学 化学与环境工程12学院
均相催化氢化的机理
一、均相催化机理:
➢ 氢分子被吸附在金属中心上并加成到底物上 ➢ 与非均相催化不同,金属中心是络合物而非单
质
均相催化四步 循环:加氢、 吸附、加成和 脱离
王鹏
有机合成 第十章 还原反应
山东科技大学 化学与环境工程13学院
➢ RhCl2(PPh3)3的应用:
反式比顺式烯烃稳定,乙炔加氢活性高于乙烯 钯和铑(Pd, Rh)最常用,优先还原碳碳双键
王鹏
有机合成 第十章 还原反应
山东科技大学 化学与环境工程7学院
➢ 炔烃的催化还原:
Pd、Pt、Raney Ni等催化剂都还原得到烷烃
Lindlar Pd等催化剂可还原三键为顺式烯烃,不还 原羰基
王鹏
有机合成 第十章 还原反应
第十章 还原反应
还原,氧化反应的逆过程,降 低官能团氧化度的方法
有机合成 第十章 还原反应
1
还原反应概述
还原反应就是有机分子中除去氧或得到氢的反应, 现在将得到电子的反应通称为还原反应
➢ 还原反应一般分为两类,催化加氢和化学法还原,两 类反应在很多情况下可得相同产物
➢ 还原反应的困难在于选择性还原特定基团
本章主要介绍对不饱和键的还原,如碳碳双键、 羰基等
王鹏
有机合成 第十章 还原反应
山东科技大学 化学与环境工程2学院
10.1 催化加氢
催化加氢是指在催化剂(均相或非均相)存在下 对底物进行的加氢反应
➢ 这是还原反应中最为简便的方法之一 ➢ 选择合适的催化剂是实现选择性加氢的关键
催化剂选择的特点:
同时存在双键和羰基时,需选择特殊催化剂以还原 特定基团,如钯还原双键,锇则还原羰基
通过控制条件可以使α, β-不饱和酮变为饱和酮
➢ 硝基或腈等含氮官能团可以在不同催化剂条件 下得到氨基
王鹏
有机合成 第十章 还原反应
山东科技大学 化学与环境工程6学院
各官能团的还原
➢ 烯烃催化还原的特点为:
取代基越多,越难加氢,其稳定性如下: R2C=CR2 > R2C=CHR > R2C=CH2 > RCH=CH2 > CH2=CH2
➢ 使用可溶性的催化剂(铑、钌、铱等的磷配位 络合物,如RhCl2(PPh3)3),使催化剂和底物 在同一相中进行还原反应
➢ 反应可以在较低温度和较低压力下进行 ➢ 均相催化的好处:
避免烯烃异构化和氢解等副反应 还原的选择性高 利用手性配体催化剂,可以实现手性还原
王鹏
有机合成 第十章 还原反应
