22化学反应的热效应 ppt课件
化学反应中的热效应PPT教学课件

(1)中学化学实验中的中和热的测定所需的玻璃仪器有:_______ _____________。结合日常生活的实际该实验也可改在_________ __中进行效果会更好。 (2)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1的NaOH溶 液各50 mL。NaOH的浓度大于HCl的浓度作用是___________。当 室温低于10℃时进行,对实验结果会造成较大的误差其原因是_____ ______。 (3)用相同浓度和相同体积的氨水代替氢氧化钠溶液进行上述实验 为什么测得中和热的数值偏低? [答案] (1)量热计(烧杯)、温度计、量筒、环形玻璃搅拌棒; 保温杯 (22)020使/12/盐11 酸快速完全反应;温差太大,造成热量损失增大,产生8较 大误差(3)一水合氨电离吸热
CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A①
B④
C ②③④
D ①②③
2020/12/11
7
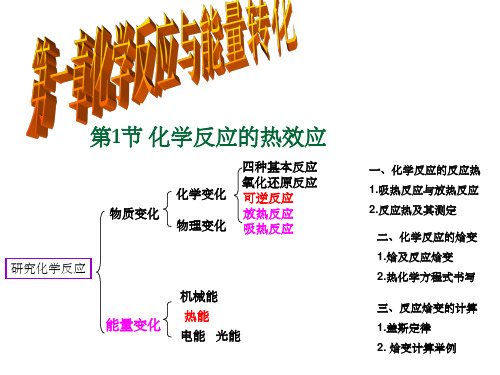
二、反应热的测量:
例3:中和热的测定实验的关键是要比较准确地配制一定的物质的量 浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免
热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答
△H=反应物键能总和-生成物键能总和
2020/12/11
2
5.常见的放热反应:
①所有燃烧反应; ②中和反应; ③大多数化合反应; ④金属与酸反应;
6.常见的吸热反应: ①碳与二氧化碳及水蒸气反应;
②多数持续加热反应;
③多数铵盐与碱的反应 ;
④氢气与氧化铜(金属氧化物)的反应; ⑤大多数分解反应。
2020/12/11
24
22
20 0 10 20 30 40 50 V1/ mL
化学人教版(2023)选择性必修1 1.2.1盖斯定律 课件(共22张ppt)

化学人教版(2023)选择性必修1 1.2.1盖斯定律课件(共22张ppt)(共22张PPT)第一章化学反应的热效应第二节反应热的计算第一课时盖斯定律0102运用盖斯定律进行简单计算理解盖斯定律的概念学习目标回顾旧知【回忆一】有哪些方法可以确定一个反应的反应热?① 实验法(量热计测量)----中和反应反应热的测定②宏观角度焓变计算公式:△H=H(生成物总焓)-H(反应物总焓)③微观角度焓变计算公式:△H=E(反应物断键吸收的总能量)- E(生成物成键释放的总能量)△H>0,吸热反应,焓值增大△H<0,放热反应,焓值减小【回忆二】如何判断一个化学反应是吸热反应或放热反应?方法一回顾旧知方法二:图示法判断放热反应吸热反应导入新知【思考】对于化学反应的反应热是否都可通过实验法测得?判断以下反应是否可通过实验法直接测定其反应热。
C(s)+(g)=CO (g)不能,因为燃料碳固体燃烧不可能完全转化为CO,一定有一部分碳会转化为CO2【思考】我们如何得到该反应的反应热呢?盖斯定律新知讲解1、定义:化学反应是一步完成或分几步完成,其反应热相同。
【思考】什么是盖斯定律?2、多角度理解:(爬山)化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
反应热一:盖斯定律理解3、能量守恒的角度理解始态(S)终态(L)△H1 +△H2 = 0推论:同一个热化学反应方程式,正向反应H1与逆向反应H2大小相等,符号相反,即:H1= – H2对于任何一个反应,无论反应的途径如何,其反应的能量不会凭空消失,也不会凭空产生,只会发生形式的转换。
1.反应原理H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1通过测定一定量的酸、碱溶液在反应前后温度的变化,计算反应放出的热量,由此得中和热。
一:盖斯定律理解4.图例说明从反应途径角度:A→D:ΔH=ΔH1+ΔH2+ΔH3=-(ΔH4+ΔH5+ΔH6);从能量守恒角度:ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0。
化学反应的热效应PPT精品课件

D. S(g)+O2(g)=SO2 (g);△H=-Q1 S(s)+O2(g)=SO2 (g);△H=-Q2
2、已知在1×105Pa,298K条件下,2mol氢气燃烧生 成水蒸气放出484kJ热量,下列热化学方程式正确的是
• (3)宜使用有0.1℃刻度的温度计。读数尽可能 准确,且估读至小数点后二位。同时应注意水 银球部位要完全浸没在溶液中,而且要稳定一 段时间后再读数,以提高所测的精度。
• (4)记录最高温度。 • (5)进行反应热的计算式进行了以下处理: • a、忽略量热记的热容; • b、认为稀溶液与水的比热相同; • c、认为热容不随温度的变化而变化。
[练习] 1、下列变化中,属于放热反应的是( B )
A.Ba(OH)2·8H2O与NH4Cl的反应 B.点燃的镁条在二氧化碳中继续燃烧 C.灼热的碳与二氧化碳的反应 D.氯化铝的水解
2、下列变化中,属于吸热反应的是( D ) A.氮气与氢气合成氨 B.酸碱中和 C.二氧化硫与氧气反应生成三氧化硫 D.焦炭与高温水蒸气反应
1)、概念:能够表示物质变化与焓变的做 化Cl2(g)=2HCl(g); H= -184.6 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l); H= -890.3 kJ/mol
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);H = -57.3 kJ/mol
当∆H为“-”( ∆H<0)时,为放热反应 当∆H为“+”( ∆H>0)时,为吸热反应
二、化学反应的焓变
化学反应中的热效应优质课件PPT

一、化学反应过程中能量变化的分类
1、常见的放热反应
2、常见的吸热反应
⑴多数分解反应,如CaCO3 高温 CaO+CO2↑
⑵2NH4Cl(s)+Ba(OH)2·8H2O (s)== BaCl2+2NH3 ↑+10H2O ⑶C(s)+H2O(g) 高温 CO+H2 ⑷CO2+C 高温 2CO
二、反应热和焓变
1、反应热 化学反应过程中,当反应物和生成物具有相同的温度时, 所吸收或放出的热量
2、焓变 (1)焓变: 在恒温恒压的条件下,化学反应过程中吸收或释放的热量 (2) 符号:ΔH
(3) 单位:kJ/mol
三、化学反应中能量变化的原因
化学反应放出热量还是吸收热量,与反应物和生成的能量有关。请思考: 化学反应的能量变化与反应物和生成物的能量存在什么关系?
则氢气的标准燃烧热为:_-2_8_5._8 _kJ_/_m_ol
2、燃烧热的理解:
① 燃烧的条件是在101kPa; ② 可燃物以1mol作为标准,因此书写热化学方程式时,
其它物质的化学计量数可用分数表示; ③ 物质燃烧都是放热反应,所以表达物质燃烧时的
△H均为负值; ④燃烧要完全,如H2S的标准燃烧热是指生成SO2,而不
六、化学反应中能量变化的本质原因
化学反应本质上是旧的化学键断裂、新的化学键形成的过程,请思考: 1、化学键的断裂、化学键的形成过程中能量如何变化? 2、键能与物质的能量、物质的稳定性有何关系? 3、△H与反应物的键能、生成物的键能存在何关系?
△H E — E = (反应物总键能 )
(生成物总键能)
完成表格(填“>”或“ <”)放热反应吸热反应反应物总能量 生成物总能量
化学反应的热效应完整版本ppt课件
.
例题1 [例1] 下列说法正确的是( CD)
A.需要加热才能发生的反应一定是吸热反应 B.放热反应在常温下一定很容易发生 C.反应是放热的还是吸热的必须看反应物和生成物所具有的
总能量的相对大小 D.吸热反应大一定的条件下也能发生
例2 [例2]下列反应属于放热反应的是( AD)
A.Al+HCl(稀)
(1)反应热的意义: 描述化学反应释放或吸收热量的物理量.
(2)反应热的定义: 化学反应在一定温度下进行时,反应所释放或吸收的热量.
(3)反应热的符号: Q.
吸热反应Q为正值,放热反应Q为负值.
(4)反应热的单位: kJ·mol-1.
2.反应热数据的实验测定 (1)仪器: 量热计 (2)步骤(以测定HCl+NaOH=NaCl+H2O中和反应的反应热为例):
B.Ba(OH)2·8H2O+NH4Cl(s) C.KClO3受热分解 D.CaO+H2O
例1 [例3]50mL 0.5mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装 置中进行中和反应.通过测定反应过程中放出的热量可计算中和热,回答下
列问题:
温度计
硬纸板
碎纸屑
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 环形玻璃搅拌棒 .
当∆H为“-”( ∆H<0)时,为放热反应 当∆H为“+”( ∆H>0)时,为吸热反应
二、化学反应的焓变 (二)热化学方程式
1.热化学方程式的定义: 表示反应热的化学方程式叫做热化学方程式。 2.热化学方程式的意义: 不仅表示反应中物质变化而且表示反应中的能量变化。
示例:C(石墨)+O2(g)= CO2 (g) ; △ H = -393.5kJ/mol 3.书写热化学方程式应注意的问题:
【高考】化学化学反应中的热效应ppt课件

热化学方程式
导学诱思
写出1 mol C(s)与适量水蒸气反应,生成CO(g)和H2(g)吸收131.5
kJ热量的热化学方程式:
。
答案: C(s)+H2O(g)
CO(g)+H2(g)
ΔH=+131.5 kJ·mol-1
-18-
第八单元
考点一
必备知识•自主预诊
考点二
核心素养专项提升
关键能力•考向突破
落实基础
(8)H2(g)的标准燃烧热 ΔH=-285.8 kJ·mol-1,则 2H2O(g)
2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
(× )
第八单元
考点一
必备知识•自主预诊
考点二
核心素养专项提升
关键能力•考向突破
解析:(1)中,汽油、甲醇本身热值不同,错误;(2)中,没有注明完全
燃烧、生成液态水,错误;(3)中,化学反应过程中一定伴随着能量的
第1讲
化学反应中的热效应
第八单元
考点一
考点二
核心素养专项提升
考纲要求:1.了解化学反应中能量转化的原因及常见的能量转化形
式。
2.了解化学能与热能的相互转化。了解吸热反应、放热反应、反
应热等概念。
3.了解热化学方程式的含义,能正确书写热化学方程式。
4.了解能源是人类生存和社会发展的重要基础。了解化学在解决
与酸或水的反应,④大多数化合反应,⑤铝热反应。
常见的吸热反应有:①盐的水解,②Ba(OH)2·8H2O与NH4Cl的反应,
③C与CO2、C与H2O的反应,④大多数分解反应。
第八单元
考点一
必备知识•自主预诊
化学反应的热效应PPT课件

质的量,微观上表示原子分子数目,只能为整数,不 能为分数。
5、若化学方程式中各物质的系数加倍,则△H的数值也 加倍;若反应逆向进行,则△H改变符号,但绝对值不变
1、当1mol气态H2与1mol气态Cl2反 应 生成2mol气态HCl,放出184.6KJ的热
燃料的燃烧 ,中和反应 , 活泼金属与酸、碱 ,大多数化合反应
思考 2、你所知道的化学反应中有哪些是吸热 反应?
大多数分解反应, C+CO2 , H2+CuO, C+H2O , Ba(OH)2.8H2O+NH4Cl ,CaCO3高温分解
我们已经认识了反应热,那么如何在化 学方程式中正确反映其热量的变化?
二、热化学方程式: 1、概念:能够表示反应热的化学方程式叫 做热化学方程式。
H2(g)+Cl2(g)=2HCl(g) H= -184.6 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) H= -890.3 kJ/mol
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) H = -57.3 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3KJ/mol
(2)0.5molCu(固态) 与适量O2(气态) 反应, 生成CuO(固态), 放出78.5 kJ的热量
2Cu(s)+O2(g)=2CuO(s) △H= - 314KJ/mol
250C (1.01×105)Pa下,4g CO在氧气中燃烧生成CO2, 放出 9. 6kJ热量,写出CO燃烧的热化学反应方程式。
化学反应的反应热PPT课件

点睛之笔——常见的吸热反应和放热反应 1.常见的吸热反应 多数分解反应,如石灰石分解;铵盐与碱反应,如:NH4Cl 与 Ba(OH)2 反应。 以 C、H2、CO 作还原剂的氧化还原反应,如:制水煤气。 2.常见的放热反应 多数化合反应,如:CaO 与水反应。 活泼金属与酸反应,如:Mg 与稀 H2SO4 反应。 酸碱中和反应,如:NaOH 与稀盐酸反应。 燃烧反应,如:C、CO、H2 的燃烧。
授课:XXX
(2)计算 ①热容:当物质吸收热量温度升高时,温度每升高 1 K 所吸收 的热量,称为该物质的热容,用符号 C 表示,单位 J·K-1 。 ②比热:单位 质量 的物质的热容,单位是 kJ·K-1·kg-1。常温 下,液态水的比热为:4.18 kJ·K-1·kg-1。 ③计算公式:Q= -C(T2-T1) 。 C 表示溶液及量热计的热容,T1、T2 分别表示反应前后体系的 温度,T 为热力学温度,单位为 K,T(K)=t(℃)+273.15。
授课:XXX
特别提醒:燃烧热和中和热都是反应热的一种类型,单位都是 kJ·mol-1,对以上两个概念要准确掌握其限定条件。
授课:XXX
5.反应热的测定 (1)仪器——量热计 用于测定反应热的仪器称为 量热计 ,如图所示,量热计由内、 外两个筒组成,内筒是 反应容器 ,外筒起 保温 作用。将反 应物加入内筒并使之迅速混合,测量反应后溶液温度的变化值。
授课:XXX
3.“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离 层中的化学物质和水混合后摇动即会制冷。该化学物质是
()
A.氯化钠
B.固体硝酸铵
C.生石灰
D.蔗糖
解析:硝酸铵溶解过程为吸热过程。
答案:B
授课:XXX
反应热、焓变-ppt课件

②焓变:等压条件下,反应热也可称为焓变 符号:△H 单位:kJ/mol
3 . 规定
反应体系的能量降低(即放热反应),则△H为“-” 反应体系的能量升高(即吸热反应),则△H为“+”
规定:当△H为“-”(△H < 0)时,为放热反应 当△H为“+”(△H > 0)时,为吸热反应
【课堂练习】 1. 1.0L 1.0mol/L H2SO4溶液与2.00L 1.0mol/L NaOH溶液完全反应, 放出114.6kJ的热量,该反应的反应热为△H= _-1_1_4_._6_k_J_/m。ol
2. 1molC与1molH2O(g)反应失成lmol CO(g)和1mol H2(g),需要吸收 131.5kJ的热量,该反应的反应热为△H=_+__1_3_1_.5_k__J_/m__o_l 。
反应的ΔH = +183 kJ/mol
总结:反应热、焓、焓变的比较
概念
符号 单位 数值 联系 注意
反应热
焓变
焓
化学反应释放或从吸收的热量 △H=H生成物-H反应物 物质具有的能
量
Q
ΔH
H
kJ/mol
正值表示反应吸热;负值表示反应放热
只有正值
反应热 = 焓变(等压);ΔH=H(生成物)-H(反成物)
➢ 环境:与体系相互影响的其它部分(如试管、空气等)
➢ 热量 : 指因为温度不同而在体系与环境之间交换 或传递等能量。
一、反应热
1.定义:在等温条件下,化学反应过程中释放或吸收的热量 2.符号:Q 3.单位:kJ/mol 或 kJ.mol-1
二、焓变
1.内能(U):体系内物质的各种能量的总和,受温度、压强和物质的聚集 状态等影响。 2.焓与焓变
反应热pp课件

ΔH=反应物的总键能(E吸)-生成物的总键能(E放)
②宏观角度
反应物总能量(焓)大于生成物总能量(焓),反应放热
反应物总能量(焓)小于生成物总能量(焓),反应吸热
放热反应
△H<0
吸热反应
△H>0
ΔH=生成物的总能量(H生)-反应物的总能量(H反)
反应物的总能量>生成物的总能量
放热反应→焓变为负值
反应是吸热反应。由于反应时吸收环境能量(环境降温)而使反应体系的能
量升高,故ΔH>0,即ΔH为+
注意:
①放热反应的∆H为“-””吸热反应的∆H为“+”,即:放热反应的
∆H<0,吸热反应的∆H>0;
②△H表示必须带有“+”“-”,不能省略,比较大小要注意“+”“-”
常见的放热反应
a.所有的燃烧反应
b.所有的酸碱中和反应
第一章 化学反应的热效应
第一节 反应热
1.1.1 反应热
焓变
学习目标
1.掌握烩变与反应热的含义,理解化学反应过程中发生能量变
化的原因
2.掌握测定中和热的实验原理和操作
化学反应的过程,既是物质的转化过程,也是化学能与热、
电等其他形式能量的转化过程。
化学反应既遵守质量守恒定律,
也遵守能量守恒定律。
化学反应中的能量变化是以物
②符号:∆H
③单位:kJ·mol-1(或kJ/mol)
(2)焓变
内能(符号为U):体系内物质的各种能量的总和,受
温度、压强和物质的聚集状态等影响
①焓(H):是与内能有关的物理量
②焓变(∆H):是指在一定条件下,生成物与反应物的焓值差,其数
值等于恒压条件下化学反应热,即:∆H=H(生成物)—H(反应物)
第一节化学反应的热效应(共15张PPT)

“大吸小放"
第四页,共15页。
3.测量方法: (1)仪器:量热计
结构:
作用:
内筒
外筒
反应容器 保温
温度计 测定反应前后溶液温度
简易量热计 示意图
搅拌器 使反应充分进行体系温
度均匀
第五页,共15页。
(2)公式 Q= — C(T2 - T1)
T —热力学温度,也叫开尔文温度,
(2)酸或碱略稍过量 使中和反应进行完全 (3)酸和碱的浓度宜小不宜大
为了使测得的中和热更准确 (4)记录最高温度。
第九页,共15页。
各组按要求实验记录数据计算各反应的反应热
试 实验 验 组
1 NaOH溶液与盐酸
溶液初 溶液最高 反应热/J 始温度T1 温度T2
2 KOH溶液与盐酸
3 NaOH溶液与硝酸
第二页,共15页。
为了定量的描述一个化学反应释放 或吸收的热量我们引入了反应热这
个概念。
一、化学反应的反应热
1.定义:
化学上规定,当化学反应在一定的温度下进行时, 反应所释放或吸收的热量称为该反应在此温度下的
热效应,简称反应热。
第三页,共15页。
2. 符号:Q
规定:
反应放热时,反应体系能量降低,Q<0
第十页,共15页。
结论
三个中和反应的反应热相同
原因 ⑴ 反应的实质相同
H+ + OH- = H2O
⑵溶液的体积相同 ⑶H+和OH-浓度均相同
第十一页,共15页。
补充: 1、中和热:在稀溶液中,强酸和强碱 发生中和反应生成1moL H2O(液)时所
释放的热量。其值为57.3KJ。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
气体混合物 气体的特征。
2. 标准摩尔生成焓和标准摩尔反应焓
定义: 1)由稳定单质生成某化合物的反应称为该化合物的
生成反应。
2)由稳定单质生成1mol某化合物的焓变称为该化合物 的生成焓(生成热)。
例题P17
四、生成热与反应热
1.热力学标准态
目的:建立一套通用的热数据,规定了S、l、g 纯物质 在T时的标准状态(标准态):
纯固体的标准态:压力为 pθ的纯固体, pθ=100Kpa 纯液体的标准态:压力为 pθ的纯液体, 纯气体的标准态:压力为 pθ的纯理想气体。
纯气体
纯物质在标准压为pθ下表现出理想
中间产物 (2) C (3)
反应 A 物
(1)
B 产物
(4)
D (5) E 中间产物
(6)
A B,三条不同的反应途径,由盖斯定律知,不同 途径的反应热效应总值相等。即:
Q1 = Q2 + Q3 = Q4 + Q5 + Q6
重大应用和意义:
求算
从已知热效应的反应
未知热效应的反应
对于进行得太慢的或反应程度不易控制而无法直接 测定反应热的化学反应,可以用赫斯定律,利用容 易测定的反应热来计算不容易测定的反应热。
∵状态(3)为非化学反应,ΔU微不足道,
ΔrUm,1≈ΔrUm,2
若产物为理想气体,热力学能仅是温度的函数,与压力和体积无关 ΔU (ΔH) =0,
ΔrUm,1 = ΔrUm,2 ∴Qp - Qv
aA+bB
恒容反应Qv =ΔrUm,1
(1)
gG + dD
T1 p1V1
T1 p2V1
=ΔrHm,2 - ΔrUm,1 =ΔrUm,2 + Δ(pV) 2 -ΔrUm,1 = (pΔV )2
2)恒压热效应 Qp rH
dQ=dU+pdV=dH-pdV-VdP+pdV =dH-Vdp ====dH dp=0
3)Qp与Qv之间的关系
aA+bB (T1 p1V1)
恒容反应Qv =ΔrUm,1
(1)
gG + dD (T1 p2V1)
(2)等压
Qp=ΔrHm,2
(3) 恒温 gG + dD (T1 p1V2)
单位:mol
=νB-1ΔnB
n B,0 代表任一组分B 在起始时刻的物质的量
n B 分别代表任一组分B 在t 时刻的物质的量。 B 是任一组分B的化学计量数,
对反应物取负值,对生成物取正值。
设某反应
D D E E F F G G
t0,0 n D,0
n E,0
n n F,0
例如:
H2 C2l2HCl
当 都等于1 mol 时,
两个方程所发生反应的物
1 2H 21 2C l2H C l 质的量显然不同。
例题:10 mol N2与20 mol H2混合,多次循环通过 合成氨塔反应,最终有5 mol NH3 生成,试 分别按 (1)N2 + 3H2 = 2NH3 (2)1/2N2 + 3/2H2 = NH3 两种反应计量方程式,计算反应进度各为多大?
即按所给化学反应方程式进行了 =1时的焓变.
引入反应进度的优点:
在反应进行到任意时刻,可以用任一反应物 或生成物来表示反应进行的程度,所得的值都是
相同的,即: dd n D Dd n E Ed n F Fd n G G
反应进度被应用于反应热的计算、化学平衡 和反应速率的定义等方面。
注意:应用反应进度,必须与化学反应计量方程相对应。
G,0
tt, n D n E
nF nG
说明:
1) 当 =0时,反应没有进行;
2) 对于aA + bB = gG + dD 当a mol A和b mol B消耗,
g molG和d mol D生成时, =1
3)恒温恒压下 ΔrH=ΔrHmΔ ΔrHm=ΔrH/Δ = ΔBrH/Δn
ΔrH测量的焓变; ΔrHm摩尔焓变
三、盖斯定律
1840年,根据大量的实验事实盖斯提出了一个定律:
反应的热效应只与起始和终了状态有关,与变化途 径无关。不管反应是一步完成的,还是分几步完成 的,其热效应相同,当然要保持反应条件(如温度、 压力等)不变。
热力学定律对盖斯定律的描述:一个化学反应,若满 足恒容、无其它功或等压、无其它功的条件,则无论 经过怎样不同的具体步骤,其总的反应热效应的值一 定都是相同的。
(2)
等压
Qp=ΔrHm,2
(3)恒温
gG + dD
T1 p1V2
若反应中无气体产生,pΔV ≈0 则 Qp = Qv 或ΔrHm,2 = ΔrUm,1
若反应物中有气体参与,设为理想气体:
(pΔV )2=pΔ(ν(g)RT/p)2 =RTΔν(g) =ΣBνB(g) RT
则 Qp – Qv= ΔrHm,2 - ΔrUm,1 = ΣBνB(g) RT
精品资料
• 你怎么称呼老师?
• 如果老师最后没有总结一节课的重点的难点,你 是否会认为老师的教学方法需要改进?
• 你所经历的课堂,是讲座式还是讨论式? • 教师的教鞭
• “不怕太阳晒,也不怕那风雨狂,只怕先生骂我 笨,没有学问无颜见爹娘 ……”
• “太阳当空照,花儿对我笑,小鸟说早早早……”
∵U为状态函数,ΔrUm,1=ΔrUm,2 -ΔrUm,3
§2.2 化学反应的热效应与标准热力学函数
一、化学反应热效应
1. 定义:当体系的始终态温度相同,且反应过程中 只做体积功时,发生化学反应所吸收或放出 的热称为此过程的反应热效应,或称反应热。
即,T始=T终,
W
=0时,吸收或放出的热。
f
2.反应热的分类
1)(等温)恒容热效应 QV rU
dQ=dU+pdV====dU dV=0 氧弹量热计中测定的是Qv
νB(g)-----气态反应物或产 物在反应方程式中的化学 计量数. 产物 νB取正值 反应物νB取负值 ΣBνB(g)----化学计量
数的代数和
注:已知一个,可计算另一个。 Qv可直接测出。
二、反应进度
20世纪初比利时的Dekonder引进反应进度 ,定义为:
nB nB,0 B
d dnB B
例如:求C(s)和O2 (g)生成CO(g)的反应热。
已知:(1) C(O s2)(g)C2(O g) (2) C O (g ) 1 2 O 2 (g ) C O 2 (g )
r Hm,1 r Hm,2
则 (1)-(2)得(3)
(3) C( s1 2 )O2(g)CO(rHg m,3 )
rH m ,3 rH m ,1 rH m,2
