高中化学常见气体的制取和检验
常见气体的实验室制备

常见气体的实验室制备1.氧气的实验室制备(1)反应原理①高锰酸钾固体加热分解制备:2KMnO4=====△K2MnO4+MnO2 +O2↑。
②常温下,用过氧化氢溶液和二氧化锰反应制备2H2O2=====MnO22H2O+O2↑。
(2)发生装置图1原理①中反应物为固体,且需不断加热,一般选用图1装置。
在本发生装置中,为了防止生成的细小颗粒堵塞导管,在大试管口可放一松软棉花球,以吸附这些细微颗粒。
加热时,一般先均匀加热整个试管,后集中于反应物固体部位加热。
如果使用排水法收集气体,当停止制气时,应先从水槽中把导管撤出,然后再撤走酒精灯,以防止(冷)水倒流进入气体发生装置中,使(热)试管破裂。
原理②中反应物过氧化氢是液体,MnO2 是固体,反应不需加热,一般选用图2中装置。
在本反应原理中的两种反应物一般分开放置,其中固体(也可以是液体)放置在平底烧瓶、广口瓶或锥形瓶等适合反应的容器中,另一种液体可放在分液漏斗或长颈漏斗中。
一般气体发生装置只能有一个导气口,因此用长颈漏斗组装气体发生装置时,长颈漏斗下端要伸到液面以下,用液体封住下端口,从而防止氧气从长颈漏斗逸出。
图2(3)收集方法因为氧气是不溶于水、密度比空气大的气体,实验室既可以用排水法收集氧气,也可以用向上排空气法收集氧气。
当然,有时也可以用气球、氧气袋收集。
为保证尽可能将集气瓶中的空气排净,用向上排空气法收集氧气时,导管口要插到集气瓶底部;而用排水法收集氧气时,不能一有气泡产生就收集(开始排出气体实为装置内的空气),要等到气泡均匀冒出时,再开始收集气体。
(4)验满方法排水法收集气体时,直接观察瓶体中的水是否被排出或瓶口是否有气泡冒出,即可验满。
用排空气法收集O2时,检验O2收集满的方法是把带火星的木条放在集气瓶口,若复燃,证明氧气收集满了。
(5)集气瓶放置存有气体的集气瓶在放置时,应尽量避免气体因本身惯性而逸出,一般比空气轻的气体,容易上升;而密度比空气重的气体,容易下降。
高中化学实验室气体制备总结

高中化学实验室气体制备总结引言气体制备是高中化学实验室中常见的实验操作之一。
通过控制反应条件,可以从化学反应中制备出各种气体。
本文将总结高中化学实验室中常用的气体制备方法及其原理,以供参考。
一、氧气制备氧气是一种无色、无味和可燃的气体,广泛应用于燃烧、氧化等化学反应中。
在高中化学实验室中,常用的氧气制备方法是通过高锰酸钾的分解来制取。
实验步骤如下:1.取适量高锰酸钾固体放入蒸馏烧瓶中;2.加入适量稀硫酸,使高锰酸钾充分溶解;3.使用导管将烧瓶与气体收集瓶连接,将气体收集瓶内的水排空;4.缓慢加热烧瓶,观察气体收集瓶中气体的变化。
原理解释:高锰酸钾的分解反应式为:2KMnO4(s) → K2MnO4(s) + MnO2(s) + O2(g)通过加热高锰酸钾和稀硫酸混合物,高锰酸钾分解产生氧气,并通过导管收集。
二、二氧化碳制备二氧化碳是一种无色、无味的气体,在高中化学实验室中常用于酸碱中和实验和植物光合作用研究中。
常见的二氧化碳制备方法有酸与碳酸盐反应法和酵母发酵法。
1. 酸与碳酸盐反应法实验步骤如下:1.取适量碳酸盐固体(如碳酸氢钠)放入烧杯中;2.缓慢滴加酸(如稀盐酸)至碳酸盐完全反应;3.使用盖有橡皮塞的试管收集气体。
原理解释:碳酸盐与酸反应产生二氧化碳的反应式如下:NaHCO3(s) + HCl(aq) → NaCl(aq) + H2O(l) + CO2(g)通过滴加酸与碳酸盐反应,产生二氧化碳气体,并用试管收集。
2. 酵母发酵法实验步骤如下:1.取适量酵母放入锥形瓶中;2.加入适量葡萄糖溶液,与酵母充分混合;3.盖上透明的气球或用试管堵住瓶口;4.静置一段时间后观察气球的膨胀情况。
原理解释:酵母通过发酵作用将葡萄糖分解生成酒精和二氧化碳。
二氧化碳气体通过瓶口进入气球内,使气球膨胀。
三、氯气制备氯气是一种黄绿色、有刺激性气味的气体,广泛应用于消毒、漂白和制取其他化学品中。
在高中化学实验室中,氯气可以通过盐酸与漂白粉的反应制备。
常见气体制备高中化学教案

常见气体制备高中化学教案
主题:常见气体制备
目标:学生能够描述和解释常见气体的制备方法,并能够进行相关实验操作。
一、引入(5分钟)
让学生回顾常见气体的命名和性质,例如氧气、二氧化碳、氢气等,并引入本节课的主题:常见气体的制备。
二、氧气的制备和实验操作(15分钟)
1. 讲解氧气的制备方法:通过加热过氧化氢、分解过氧化氢或用氯酸钾和二氧化锰反应制
备氧气。
2. 进行实验操作:实验室里进行过氧化氢的分解反应制备氧气。
三、二氧化碳的制备和实验操作(15分钟)
1. 讲解二氧化碳的制备方法:通过酸和碳酸盐反应、通过酵母植物或动物呼吸产生等制备
方法。
2. 进行实验操作:用酢酸和碳酸钠反应制备二氧化碳,并观察实验现象。
四、氢气的制备和实验操作(15分钟)
1. 讲解氢气的制备方法:通过金属和酸反应、通过水电解等制备氢气的方法。
2. 进行实验操作:用锌和硫酸反应制备氢气,并观察实验现象。
五、总结和作业(5分钟)
总结本节课学习到的常见气体的制备方法,并布置相关作业,例如完成相关练习题或写一
份实验报告。
六、拓展学习(10分钟)
介绍其他常见气体的制备方法,例如氯气、氨气等,并鼓励学生进行相关实验操作或研究。
注:本教案可根据具体情况进行调整和补充。
化学实验中的气体制备

化学实验中的气体制备在化学实验中,气体的制备是一个常见的实验项目。
无论是用于实验研究还是应用于工业生产,制备气体都是必不可少的步骤。
本文将介绍几种常见的气体制备方法,包括制备氧气、氢气、二氧化碳和氮气。
一、氧气的制备氧气是一种常用的气体,广泛应用于呼吸、燃烧和氧化反应等领域。
在实验室中,可以使用以下两种方法制备氧气:1. 过氧化氢的分解过氧化氢(H2O2)分解可以制备氧气。
首先,将适量的过氧化氢溶液放入反应瓶中,然后加入少量的催化剂,如锰(MnO2)。
在加热的条件下,过氧化氢分解成水和氧气。
反应方程式如下所示:2H2O2 → 2H2O + O22. 高温分解金属氧化物高温分解金属氧化物也可以制备氧气。
选择适量的金属氧化物,如二氧化锰(MnO2),放入烧杯中,然后加热至较高温度。
金属氧化物分解生成金属和氧气。
反应方程式如下所示:2MnO2 → 2Mn + O2二、氢气的制备氢气是一种重要的气体,在实验室和工业中均具有广泛的应用。
以下是两种常见的氢气制备方法:1. 金属与酸的反应一些金属可以与酸反应产生氢气。
常用的金属有锌(Zn)和铁(Fe),常用的酸有盐酸(HCl)。
将适量的金属放入反应瓶中,然后添加足够的酸。
金属与酸反应生成氢气。
反应方程式如下所示:Zn + 2HCl → ZnCl2 + H22. 水的电解水的电解是制备氢气的另一种方法。
使用电解槽装置,将两个电极(一个是阳极,一个是阴极)浸入水中,然后通电。
在电解的过程中,水分解成氢气和氧气。
反应方程式如下所示:2H2O → 2H2 + O2三、二氧化碳的制备二氧化碳是一种常见的气体,在植物光合作用、饮料制造和灭火等方面具有重要作用。
以下是两种常见的二氧化碳制备方法:1. 一氧化碳和氧气的燃烧将适量的一氧化碳(CO)和氧气(O2)混合,然后点燃混合物。
在燃烧过程中,一氧化碳与氧气反应生成二氧化碳。
反应方程式如下所示:CO + O2 → CO22. 碳酸酸和酸的反应将适量的碳酸酸(如碳酸钠)与酸(如盐酸)反应,生成二氧化碳。
新人教版新教材版高中化学氯气的实验室制法及Cl的检验教案必修第一册

目标与素养:1.了解实验室制取Cl2的原理和实验装置。
(科学探究与创新意识)2.掌握Cl—的检验方法。
(宏观辨识与微观探析)一、氯气的实验室制法1.反应原理:实验室用MnO2和浓盐酸加热反应制取Cl2,反应的化学方程式为MnO2+4HCl (浓)错误!MnCl2+Cl2↑+2H2O,离子方程式为MnO2+4H++2Cl—错误!Mn2++Cl2↑+2H2O。
2.实验装置(1)装置A中饱和食盐水的作用是除去Cl2中的HCl气体。
(2)装置B中浓硫酸的作用是干燥Cl2。
(3)烧杯中NaOH溶液的作用是吸收多余的Cl2、以防污染环境。
(1)含有4mol HCl的浓盐酸与足量的MnO2反应,能生成1mol Cl2吗?[提示] 不能,因为随着反应的进行,盐酸的浓度变小,MnO2与稀盐酸不反应,故生成的Cl2小于1mol。
(2)如何检验氯气已经收集满?[提示] 将湿润的淀粉KI试纸放到瓶口,若淀粉KI试纸变蓝,则已收集满。
二、Cl—的检验1.实验探究实验现象离子方程式加入AgNO3溶液加入稀硝酸稀盐酸产生白色沉淀沉淀不溶解Ag++Cl—===AgCl↓NaCl溶液产生白色沉淀沉淀不溶解Ag++Cl—===AgCl↓Na2CO3溶液产生白色沉淀沉淀溶解,放出无色气体2Ag++CO错误!===Ag2CO3↓Ag2CO3+2H+===2Ag++CO2↑+H2O(1)操作方法:向未知溶液中先加AgNO3溶液,再加稀硝酸。
(2)现象:产生白色沉淀,加稀硝酸时,沉淀不溶解。
(3)原理:Ag++Cl—===AgCl↓。
(4)加入稀硝酸的目的:排除CO错误!等离子的干扰。
1.判断正误(正确的打“√”,错误的打“×”)(1)实验室制取干燥、纯净的氯气,可依次通过浓硫酸、饱和食盐水()(2)检验Cl—时,要加稀硝酸排除其他离子的干扰()(3)溶液中加入AgNO3溶液有沉淀,说明溶液中一定含Cl—()(4)NaClO中含有氯元素,故向NaClO溶液中加入用硝酸酸化的AgNO3溶液,可产生白色沉淀()[答案] (1)×(2)√(3)×(4)×2.在实验室利用浓盐酸和二氧化锰制氯气,制备装置中应使用分液漏斗而不能使用长颈漏斗,下列有关理由叙述错误的是()A.防止氯气扩散到空气中造成污染B.便于控制加入盐酸的量C.长颈漏斗便于添加液体D.尽量避免氯化氢挥发到空气中C [用分液漏斗既可防止氯化氢气体和氯气挥发污染环境,同时又可控制滴加盐酸的量和快慢,从而控制反应速率,提高盐酸的利用率。
高中化学第4章 第24讲 常见气体的实验室制备、净化和收集---2023年高考化学一轮复习(新高考

第24讲 常见气体的实验室制备、净化和收集复习目标 1.了解常见气体制备原理、装置及改进。
2.能根据气体的性质及制备原理设计实验流程。
1.气体制备实验的基本思路2.重要气体的发生装置依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类:(1)固体+固体――→△气体 发生装置如图:制备气体:O 2、NH 3、CH 4等。
(2)固体+液体(或液体+液体)――→△气体 发生装置:制备气体:Cl 2、C 2H 4等。
(3)固体+液体(不加热)―→气体 发生装置:制备气体:选择合适的药品和装置能制取中学化学中常见的气体。
3.常见气体典型制备系统举例(1)Cl2的实验室制备(2)SO2的实验室制备(3)NH3的实验室制备4.气体的除杂方法(1)除杂试剂选择的依据:主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性。
除杂原则:①不损失主体气体;②不引入新的杂质气体;③在密闭装置内进行;④先除易除的杂质气体。
(2)气体干燥净化装置类型液态干燥剂固态干燥剂固体,加热装置图ⅠⅡⅢⅣ常见干燥剂浓H2SO4(酸性、强氧化性)无水氯化钙(中性)、碱石灰(碱性)除杂试剂Cu、CuO、Mg等当CO2中混有O2杂质时,应选用上述Ⅰ~Ⅳ中的Ⅳ装置除O2,除杂试剂是Cu粉。
5.气体的收集方法收集方法收集气体的类型收集装置可收集的气体(举例)排水法难溶于水或微溶于水,且不与水反应的气体O2、H2、NO、CO等排空气法向上排空气法密度大于空气且不与空气中的成分反应Cl2、SO2、NO2、CO2向下排空气法密度小于空气且不与空气中的成分反应H2、NH36.集气装置的创新——排液集气装置装置(Ⅰ)从a管进气b管出水可收集难溶于水的气体,如H2、O2等。
若将广口瓶中的液体更换,还可以收集以下气体。
①饱和食盐水——收集Cl2。
②饱和NaHCO3溶液——收集CO2。
③饱和NaHS溶液——收集H2S。
④四氯化碳——收集HCl或NH3。
(完整版)高中化学气体制备大全
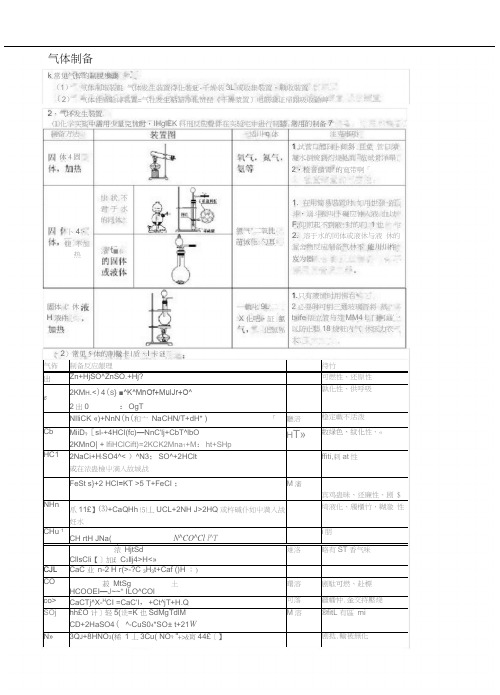
制备方法 适川q 休注克事项 氯气"二氧比 苗诫化:勺耳快状不 君于水 的同体灌t ■水固体( 休H 液件卜4•腹 不加热休4固1.只有液怵时用怫右*2必耍时可用三通玻璃晋将 蒸t»ife 版立管与芬MM4 I. 门柯通’以防止藝18烧粧内气 休压力衣大.軌叱9L 二 X 化吧・証 氯化氢% 1试营口醴向卜倾斜.且免 管口障凝水倒流到灼烧处而 览试骨洋舉.2•检音饋胃'的寬带啊「1. 在用简易裝置时.如用世颈 蹈斗•溺斗颈叫卜礙应伸入液 血以F,仰则起不到液:封的门 1也2. 溶于水的同体或液休与液 休的渥舍物反应制备气林不 能川川杵岌为器气体制备k 常见气悴的制脱歩骤(1) 气体制取装氈 气体发生装置待化装迓-千燥装3L 或收集裝置・戰收裝置(2)气体性质验诽裳置=气牡发生粘笳净化赞琵《干燥漿置)电筋验证帰跟吸收爺艸2、气坏发生装置⑴化学实鲨中需用少量完怵时・IHglEK 料刑反应聲件在实验宅中进行制牆.常用的制备7气佈制备反应龈理待竹出Zn+HjSO^ZnSO.+Hj?可燃性、还原性62KM H .<)4(S } ■^K^MnOf+MulJr+O^2出0:OgT孰化性、供呼吸NIliCK «)+NnN (h (和亠 NaCHN/T+dH* )「 廳涪稳定載不活泼 CbMiiD ?[sl-+4HCI(fc)—NnC'lj+CbT^lbO2KMnO| + lfiHClCift)=2KCK2Mna 1+M :ht+SHpH T»数绿色、紋化性、«HC1 2NaCi+H :SO4^< )^N3;SO^+2HClt或在浓蛊檢屮滴入故城战ffiti,剌at 性FeSt s}+2 HCI =KT >5 T+FeCI ;M 瀋宾鸡蛊昧、还廉性、剧 $NHn 爪11£】⑶+CaQHh ⑸丄UCL+2NH J>2HQ 或杵碱仆如屮満入战妊水埼液化、斶櫃竹,糊激 性CHu 1CH rtH JNa( N^CO^Cl l^Ti 朋1浓 HjtSdCllsCli 【]加£ C 3llj4>H<»难洛略有ST 香气味CJL CaC 业 n-2 H r(>-?C 3H 3t+Caf ()H ;)CO 菽 MtSg土HCOOEI —J ~~* ILO^COl曙溶 剧駄可燃、赴標 co> CaCTj^X-H CI =CaC'l ,+Ct^jT+H.Q 可落疆幡忡.金交持壓烧SOj hh£O 计]轻5(诜=K 也SdMgTdlM CD+2HaSO4( ^-CuS04*SO± t+21W M 溶®fitL 有區 miN»3Q J +8HNO 3(稀 1 丄3Cu( NO ? ”+>&肓44£〔】剧抵.輸被無化,〉常见5体的制儆卡|质、卡谜•验室制备的气体常常幣有恢券和水汽.仃时需要祎化和I•燥.酸雾“川水或物质的水溶液除去・k ;:・计I质选用浓硫酸.无水氯化纵碱石灰等吸收水汽。
高中化学常见气体的制取装置图和方程式
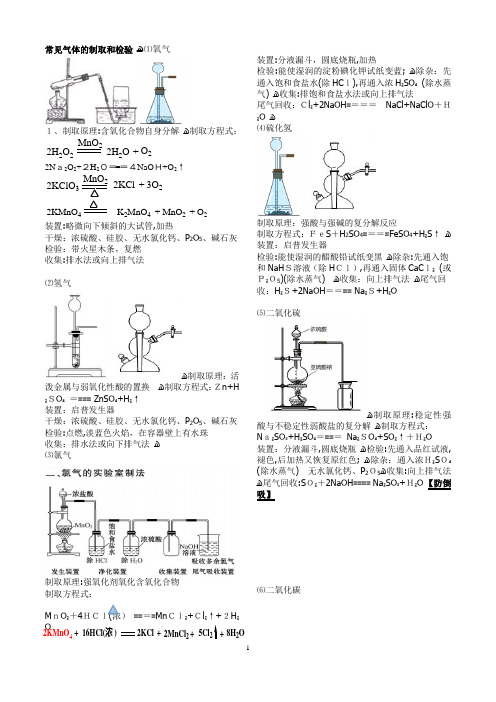
常见气体的制取和检验 ﻫ⑴氧气1、制取原理:含氧化合物自身分解 ﻫ制取方程式: MnO 2O 2+2H 2O 22H 2O2N a2O 2+2H 2O===4NaO H+O 2↑2KClO 3MnO 22KCl +3O 22KMnO 4MnO 2K 2MnO 4+O 2+装置:略微向下倾斜的大试管,加热干燥:浓硫酸、硅胶、无水氯化钙、P 2O 5、碱石灰 检验:带火星木条,复燃 收集:排水法或向上排气法⑵氢气ﻫ制取原理:活泼金属与弱氧化性酸的置换 ﻫ制取方程式:Zn+H ₂SO ₄ ==== ZnSO ₄+H ₂↑ 装置:启普发生器干燥:浓硫酸、硅胶、无水氯化钙、P 2O 5、碱石灰 检验:点燃,淡蓝色火焰,在容器壁上有水珠 收集:排水法或向下排气法 ﻫ ⑶氯气制取原理:强氧化剂氧化含氧化合物 制取方程式:M nO ₂+4HCl(浓) ====Mn Cl₂+Cl ₂↑+2H ₂O装置:分液漏斗,圆底烧瓶,加热检验:能使湿润的淀粉碘化钾试纸变蓝; ﻫ除杂:先通入饱和食盐水(除HC l),再通入浓H ₂SO ₄ (除水蒸气) ﻫ收集:排饱和食盐水法或向上排气法尾气回收:Cl ₂+2NaOH ==== NaCl+NaClO +H₂O ﻫ ⑷硫化氢制取原理:强酸与强碱的复分解反应制取方程式:FeS +H 2SO 4====FeSO 4+H ₂S ↑ ﻫ装置:启普发生器检验:能使湿润的醋酸铅试纸变黑 ﻫ除杂:先通入饱和NaH S溶液(除H Cl),再通入固体CaC l₂ (或P₂O5)(除水蒸气) ﻫ收集:向上排气法 ﻫ尾气回收:H ₂S+2NaOH ==== Na ₂S+H ₂O⑸二氧化硫ﻫ制取原理:稳定性强酸与不稳定性弱酸盐的复分解 ﻫ制取方程式: N a₂SO ₃+H ₂SO ₄==== Na ₂SO ₄+SO ₂↑+H₂O 装置:分液漏斗,圆底烧瓶 ﻫ检验:先通入品红试液,褪色,后加热又恢复原红色; ﻫ除杂:通入浓H₂S O₄ (除水蒸气) 无水氯化钙、P 2O5ﻫ收集:向上排气法 ﻫ尾气回收:S O₂+2NaOH ==== Na ₂SO ₃+H₂O 【防倒吸】⑹二氧化碳+16HCl(浓)2KCl +2MnCl 25Cl 28H 2O ++2KMnO 4ﻫ制取原理;稳定性强酸与不稳定性弱酸盐的复分解ﻫ制取方程式:CaCO₃+2HCl====CaCl₂+CO₂↑+H₂O 装置:启普发生器ﻫ检验:通入澄清石灰水,变浑浊ﻫ除杂:通入饱和NaHCO₃溶液(除HCl),再通入浓H₂SO₄(除水蒸气)收集:排水法或向上排气法ﻫ⑺氨气ﻫ制取原理:固体铵盐与固体强碱的复分解制取方程式:Ca(OH)₂+2NH₄Cl₂+2NH₃↑+2H ₂O①直接加热浓氨水;②浓氨水中加生石灰(或碱石灰)。
高中化学气体实验总结教案

高中化学气体实验总结教案
实验目的:通过本次实验,学生将了解气体的性质和特点,并掌握气体的收集、性质鉴别
和重量确定等基本实验技术。
实验材料及仪器:氢气气源、氧气气源、瓶塞、玻璃注射器、试管、水槽、燃烧棒、天平
等
实验步骤:
1. 氢气的制法:
将锌粉与稀硫酸反应生成氢气,用玻璃注射器收集氢气,然后将氢气用针尖穿破瓶塞释放
出来和火燃烧。
2. 氧气的制法:
将KMnO4和浓硫酸混合后生成氧气,用玻璃注射器收集氧气,然后将氧气注入一根灯芯,看其燃烧情况。
3. 混合气体的制法:
将氢气和氧气混合后生成氨水,用玻璃注射器收集混合气体,然后将其点燃,观察其燃烧
情况。
实验结果及结论:
1. 氢气是一种易燃气体,具有明亮的火焰,可以与氧气反应生成水。
2. 氧气是一种助燃气体,可以使火燃烧更旺,亦可使其他物质燃烧。
3. 混合气体中的氢气和氧气可以发生爆炸反应,故不宜混合存放。
实验总结及教学意义:
本次实验旨在让学生通过实际操作认识气体的性质和特性,掌握基本的气体实验技术,并
培养学生观察、记录和分析实验数据的能力。
同时,本次实验也可以激发学生对化学实验
的兴趣,提高他们对化学知识的理解和掌握程度。
高中化学知识点:高中化学中气体总结

高中化学知识点:高中化学中气体总结高中化学知识点:高中化学中气体总结为了帮助考生们了解高中学习信息,分享了高中化学知识点:高中化学中气体总结,供您参考!1.常见气体的制取和检验:(此处略)大家可以看书,我们只把不好弄得给大家整理出来了.2.常见气体的溶解性:极易溶的:NH3(1∶700)易溶的:HX、HCHO、SO2(1∶40)能溶的或可溶的:CO2(1∶1)、Cl2(1∶2.26)、H2S(1∶2.6)微溶的:C2H2难溶或不溶的:O2、H2、CO、NO、CH4、CH3Cl、C2H6、C2H4与水反应的:F2、NO2。
3.常见气体的制取装置:能用启普发生器制取的:CO2、H2、H2S;能用加热略微向下倾斜的大试管装置制取的:O2、NH3、CH4; 能用分液漏斗、圆底烧瓶的装置制取的:Cl2、HCl、SO2、CO、NO、NO2、C2H4等。
4.有颜色的气体:F2(淡黄绿色)、Cl2(黄绿色)、NO2(红棕色)5.具有刺激性气味的:F2、Cl2、Br2(气)、HX、SO2、NO2、NH3、HCHO。
臭鸡蛋气味的:H2S。
稍有甜味的:C2H4。
6.能用排水法收集的:H2、O2、CO、NO、CH4、C2H4、C2H2。
7.不能用排空气法收集的:CO、N2、C2H4、NO、C2H6。
8.易液化的气体:Cl2、SO2、NH3。
9.有毒的气体:Cl2、F2、H2S、SO2、NO2、CO、NO。
10.用浓H2SO4制取的气体:HF、HCl、CO、C2H4。
11.制备时不需加热的:H2S、CO2、H2、SO2、NO、NO2、C2H2。
12.能使湿润的蓝色石蕊试纸变红的:HX、SO2、H2S、CO2。
13.能使湿润的红色石蕊试纸变蓝的:NH314.能使品红试液褪色的:Cl2、SO2、NO215.能使酸性KMnO4溶液褪色的:H2S、SO2、HBr、HI、C2H4、C2H216.能使湿润的醋酸铅试纸变黑的:H2S17.不能用浓H2SO4干燥的:H2S、HBr、HI、NH318.不能用碱石灰干燥的:Cl2、HX、SO2、H2S、NO2、CO219.不能用氯化钙干燥的:NH3、C2H5OH以上就是的编辑为您准备的高中化学知识点:高中化学中气体总结。
高中化学常见气体的制备省名师优质课赛课获奖课件市赛课一等奖课件

根据要求填写下列空白:
(1)组装氯气发生器时,应选用旳仪器及导管(填写图中编
号)是
。
(2)试验进行中,按气流方向从左到右旳顺序,气体流经旳
各仪器及导管旳编号依次是
。
(3)仪器①旳橡皮塞上应有 个孔,原因是 。
(4)试验时,仪器①中除观察到红光外还有 现象。
(5)试验需用约10%H2O2溶液100mL,现用市售30%(密度 近似为1g/cm3)H2O2来配制,其详细配制措施是 。
(4)若烧杯是干燥旳,不能用此装置来搜集旳 气体是___。
2024/10/1
参照答案
练习:
1、试验室经常利用过氧化氢溶液制取氧气。
其原理为:
MnO2
2H2O2====2H2O+O2
为了得到平稳旳氧气气流,请选择最佳装置。
A
2024/10/1
多孔隔板
B
C
D
E
2、现用浓硫酸、稀盐酸和氢氧化钠溶液及下图装置分
(6)试验时仪器①中ClO-与H2O2反应旳离子方程式
是
。
2024/10/1
9、欲制无水氯化铝并保存备用。既有仪器如下图所示, 并有食盐晶体、水、固体烧碱、铝粉、二氧化锰、浓硫 酸等六种试剂。设计旳制取过程是:制氯气 → 加净化 和干燥氯气 → 制氯化铝
从上列仪器中选用必须旳几种,连接成一种制无水氯化 铝旳连续装置。
2024/10/1
2、除杂装置
①洗气瓶 ②干燥管 ③燃烧管
2024/10/1
3、干燥剂旳选择
液态干燥剂
固态干燥剂
装置
洗气瓶
干燥管(球形、U形)
干燥剂
可干燥气 体
浓硫酸
化学实验中常见气体的制备与收集方法

化学实验中常见气体的制备与收集方法气体是一种常见的物质状态,它在许多化学实验中起到重要的作用。
在实验中,我们常常需要制备和收集各种气体,以便进行进一步的实验操作。
本文将介绍一些化学实验中常见气体的制备与收集方法。
1. 氧气(O2)氧气是一种无色、无臭、无味的气体,广泛应用于多种实验和产业中。
制备氧气的常见方法是通过氧化金属。
例如,将过量的过氧化氢(H2O2)滴加到铁粉中,生成氧气和水蒸气的反应:2H2O2 + Fe → 2H2O + O2↑氧气的收集可以使用水位法。
在水中倒置一个带有漏斗的试管,并用水密封。
在实验过程中,通过试管底部的导管逐渐通入氧气,氧气会聚集在试管中,在水面上形成一个封闭的气泡。
2. 二氧化碳(CO2)二氧化碳是一种常见的气体,也是许多实验中常用的气体之一。
最常见的制备二氧化碳的方法是通过酸和碳酸盐之间的反应。
例如,将酸与碳酸钠进行反应,会产生二氧化碳气体:HCl + Na2CO3 → CO2↑ + H2O + NaCl二氧化碳的收集可以使用水位法或气体收集瓶。
在水位法中,将放有反应溶液的容器倒置在装有水的槽中,二氧化碳气体会逐渐聚集在容器中。
在气体收集瓶中,将反应溶液置于烧杯中,然后用砂浆快速撞击烧杯的边缘,使二氧化碳气体迅速充满瓶中。
3. 氢气(H2)氢气是一种轻、无色、无臭的气体,广泛应用于实验中。
制备氢气最常见的方法是通过酸与金属反应产生氢气。
例如,将稀有氢酸(HCl)与锌(Zn)反应,会产生氢气:Zn + 2HCl → ZnCl2 + H2↑氢气的收集可以使用水位法或氢气收集瓶。
在水位法中,将放有反应溶液的容器倒置在装有水的槽中,氢气会逐渐聚集在容器中。
在氢气收集瓶中,将反应溶液置于烧杯中,然后用砂浆快速撞击烧杯的边缘,使氢气迅速充满瓶中。
4. 氯气(Cl2)氯气是一种绿黄色的有毒气体,在实验中需要特殊的注意。
制备氯气的常见方法是通过酸和次氯酸钠(NaClO)之间的反应。
高中化学常见的实验室制备

高中化学常见的实验室制备
高中化学常见的实验室制备包括:
1. 制备氢气:以锌和稀盐酸为原料,反应生成氢气。
2. 制备氧气:通过电解水或通过过氧化氢分解反应制备氧气。
3. 制备二氧化碳:以碳酸氢钠和稀盐酸为原料,反应生成二氧化碳气体。
4. 制备氨气:以氨水和氯化铵为原料,通过加热反应生成氨气。
5. 制备氯气:以盐酸为原料,通过电解盐水溶液制备氯气。
6. 制备氯化氢气体:以氢气和氯气为原料,反应生成氯化氢气体。
7. 制备硫化氢气体:以铁与硫酸为原料,反应生成硫化氢气体。
8. 制备一氧化二氮气体:以硝酸和亚硝酸钠为原料,反应生成一氧化二氮气体。
9. 制备氢氟酸:以硫酸和氟化钙为原料,反应生成氢氟酸。
这些实验室制备实验可以通过合适的实验条件和操作步骤进行实施。
在进行实验时,必须遵守安全操作规程,佩戴适当的防护装备,确保实验过程安全。
高中化学常见气体的制取装置图和方程式

高中化学常见气体的制取装置图和方程式常见气体的制取和检验氧气氧气的制取原理是含氧化合物自身分解,制取方程式为2KClO₃ → 2KCl+3O₂↑。
制取时使用略微向下倾斜的大试管加热,检验时使用带火星木条,能够复燃。
收集时可以使用排水法或向上排气法。
氢气氢气的制取原理是活泼金属与弱氧化性酸的置换,制取方程式为Zn+H₂SO₄→ ZnSO₄+H₂↑。
制取时使用启普发生器,检验时点燃,能够产生淡蓝色火焰,在壁上有水珠。
收集时可以使用排水法或向下排气法。
氯气氯气的制取原理是强氧化剂氧化含氧化合物,制取方程式为MnO₂+4HCl(浓) → MnCl₂+Cl₂↑+2H₂O。
制取时使用分液漏斗、圆底烧瓶加热,检验时能够使湿润的蓝色石蕊试纸先变红后褪色。
除杂时先通入饱和食盐水除去HCl,再通入浓H₂SO₄除去水蒸气。
收集时可以使用排饱和食盐水法或向上排气法。
尾气回收时使用Cl₂+2NaOH → NaCl+NaClO+H₂O。
硫化氢硫化氢的制取原理是强酸与强碱的复分解反应,制取方程式为FeS+2HCl → FeCl₂+H₂S↑。
制取时使用启普发生器,检验时能够使湿润的醋酸铅试纸变黑。
除杂时先通入饱和NaHS溶液除去HCl,再通入固体CaCl₂或P₂O5除去水蒸气。
收集时可以使用向上排气法。
尾气回收时使用H₂S+2NaOH → Na₂S+H₂O或H₂S+NaOH → NaHS+H₂O。
二氧化硫二氧化硫的制取原理是稳定性强酸与不稳定性弱酸盐的复分解,制取方程式为Na₂SO₃+H₂SO₄ →Na₂SO₄+SO₂↑+H₂O。
制取时使用分液漏斗、圆底烧瓶,检验时先通入品红试液,褪色,后加热又恢复原红色。
除杂时通入浓H₂SO₄除去水蒸气。
收集时可以使用向上排气法。
尾气回收时使用SO₂+2NaOH → Na₂SO₃+H₂O。
二氧化碳二氧化碳的制取原理是稳定性强酸与不稳定性弱酸盐的复分解,制取方程式为CaCO₃+2HCl → CaCl₂+CO₂↑+H₂O。
高中化学实验高考中常见12种气体的制备与收集知识整理梳理

高中化学实验高考中常见12种气体的制备与收集知识整理梳理一.常见气体的制备1.实验原理(1).氧气的制备:①2H2O22H2O+O2②2KClO32KCl+3O2③2KMnO4K2MnO4+MnO2+O2④2Na2O2+2H2O===4NaOH+O2↑(2).氨气的制备:①2NH4Cl+Ca(OH)2CaCl2+2NH3+2H2O②NH3.H2O NH3+H2O③将浓氨水滴入固体CaO、固体NaOH、碱石灰固体中(作用:a.固体吸水有利于NH 3+H2O NH3·H2O NH4++OH-平衡左移b.反应放热有利于氨水分解和逸出)④工业制法:N2+3H22NH3(3).氯气的制备:①实验室制备MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O②若无MnO2可以用强氧化剂KMnO4、KClO3、K2Cr2O7、C a(ClO)2代替,但反应时不需要在加热2KMnO4+16HCl=5Cl2↑+2KCl+2MnCl2+8H2OKClO3+6HCl=3Cl2↑+KCl+3H2OK2Cr2O7+14HCl=3Cl2↑+2KCl+2CrCl3+7H2OCa(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O③工业制备2NaCl+2H2O2NaOH+H2+Cl2(4).CO2的制备:CaCO3+2HCl=CaCl2+H2O+CO2↑(5).H2的制备:Zn+H2SO4(稀)===ZnSO4+H2↑Zn+2HCl===ZnCl2+H2↑(6).SO2的制备:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2OCu+2H2SO4(浓)CuSO4+SO2↑+2H2O(7).NO2的制备:Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O(8).NO的制备:3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O(9)C 2H 4的制备:C 2H 5OH ――→浓硫酸170℃C 2H 4↑+H 2O*(10).HCl 的制备:H 2SO 4(浓)+NaClNaHSO 4+HCl↑(难挥发性酸制易挥发性酸)H 2SO 4(浓)+2NaCl Na 2SO 4+2HCl↑*(11).H 2S 的制备:FeS +H 2SO 4(稀)=FeSO 4+H 2S↑FeS+2HCl=FeCl 2+H 2S↑.Na 2S +H 2SO 4(稀)=Na 2SO 4+H 2S↑(Na 2S 粉末反应太多剧烈一般不用)*(12).N 2的制备:NaNO 2(aq )+NH 4Cl (aq )=NaCl +N 2↑+2H 2O2.实验装置(1)固体+固体−→−∆气体制备气体:O 2、NH 3、CH 4等(2)固体+液体(液体+液体)−→−∆气体制备气体:Cl 2、C 2H 4等(3)固体+液体(不加热)―→气体制备气体:H 2、CO 2、NO 2、SO 2、NO 等(4)装置的优点:①.分液漏斗或者启普发生器类:便于控制反应速率,随制随停。
高中化学--常见气体制备方法(全面版)

1,常见气体的制取和检验⑴氧气制取原理——含氧化合物自身分解制取方程式——2KClO3 2KCl+3O2↑装置——略微向下倾斜的大试管,加热检验——带火星木条,复燃收集——排水法或向上排气法⑵氢气制取原理——活泼金属与弱氧化性酸的置换制取方程式——Zn+H2SO4 === H2SO4+H2↑装置——启普发生器检验——点燃,淡蓝色火焰,在容器壁上有水珠收集——排水法或向下排气法⑶氯气制取原理——强氧化剂氧化含氧化合物制取方程式——MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O装置——分液漏斗,圆底烧瓶,加热检验——能使湿润的蓝色石蕊试纸先变红后褪色;除杂质——先通入饱和食盐水(除HCl),再通入浓H2SO4(除水蒸气)收集——排饱和食盐水法或向上排气法尾气回收——Cl2+2NaOH=== NaCl+NaClO+H2O⑷硫化氢①制取原理——强酸与强碱的复分解反应②制取方程式——FeS+2HCl=== FeCl2+H2S↑③装置——启普发生器④检验——能使湿润的醋酸铅试纸变黑⑤除杂质——先通入饱和NaHS溶液(除HCl),再通入固体CaCl2(或P2O5)(除水蒸气)⑥收集——向上排气法⑦尾气回收——H2S+2NaOH=== Na2S+H2O或H2S+NaOH=== NaHS+H2O⑸二氧化硫①制取原理——稳定性强酸与不稳定性弱酸盐的复分解②制取方程式——Na2SO3+H2SO4=== Na2SO4+SO2↑+H2O③装置——分液漏斗,圆底烧瓶④检验——先通入品红试液,褪色,后加热又恢复原红色;⑤除杂质——通入浓H2SO4(除水蒸气)⑥收集——向上排气法⑦尾气回收——SO2+2NaOH=== Na2SO3+H2O⑹二氧化碳①制取原理——稳定性强酸与不稳定性弱酸盐的复分解②制取方程式——CaCO3+2HClCaCl2+CO2↑+H2O③装置——启普发生器④检验——通入澄清石灰水,变浑浊⑤除杂质——通入饱和NaHCO3溶液(除HCl),再通入浓H2SO4(除水蒸气)⑥收集——排水法或向上排气法⑺氨气①制取原理——固体铵盐与固体强碱的复分解②制取方程式——Ca(OH)2+2NH4ClCaCl2+NH3↑+2H2O③装置——略微向下倾斜的大试管,加热④检验——湿润的红色石蕊试纸,变蓝⑤除杂质——通入碱石灰(除水蒸气)收集——向下排气法⑻氯化氢①制取原理——高沸点酸与金属氯化物的复分解②制取方程式——NaCl+H2SO4Na2SO4+2HCl↑③装置——分液漏斗,圆底烧瓶,加热④检验——通入AgNO3溶液,产生白色沉淀,再加稀HNO3沉淀不溶⑤除杂质——通入浓硫酸(除水蒸气)⑥收集——向上排气法⑼二氧化氮①制取原理——不活泼金属与浓硝酸的氧化—还原;②制取方程式——Cu+4HNO3===Cu(NO3)2+2NO2↑+2H2O③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——红棕色气体,通入AgNO3溶液颜色变浅,但无沉淀生成⑤收集——向上排气法⑥尾气处理——3NO2+H2O===2HNO3+NONO+NO2+2NaOH===2NaNO2+H2O⑩一氧化氮①制取原理——不活泼金属与稀硝酸的氧化—还原;②制取方程式——Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——无色气体,暴露于空气中立即变红棕色⑤收集——排水法⑾一氧化碳①制取原理——浓硫酸对有机物的脱水作用②制取方程式——HCOOHCO↑+H2O③装置——分液漏斗,圆底烧瓶④检验——燃烧,蓝色火焰,无水珠,产生气体能使澄清石灰水变浑浊⑤除杂质——通入浓硫酸(除水蒸气)⑥收集——排水法⑿甲烷①制取方程式——CH3COONa+NaOH CH4↑+Na2CO3②装置——略微向下倾斜的大试管,加热③收集——排水法或向下排空气法⒀乙烯①制取原理——浓硫酸对有机物的脱水作用②制取方程式——CH3CH2OH CH2=CH2↑+H2O③装置——分液漏斗,圆底烧瓶,加热④除杂质——通入NaOH溶液(除SO2,CO2),通入浓硫酸(除水蒸气)收集——排水法⒁乙炔①制取原理——电石强烈吸水作用②制取方程式——CaC2+2H2OCa(OH)2+CH CH↑③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——无色气体,能燃烧,产生明亮的火焰,并冒出浓的黑烟⑤除杂质——通入硫酸铜溶液(除H2S,PH3),通入浓硫酸(除水蒸气)收集——排水法或向下排气法15。
沪科版高中化学《氯气的实验室制法》

问:为什么不用石灰水来吸收多余的 氯气?
因石灰水中含溶质Ca(OH)2太少,吸收 氯气的量不多,吸收效果不好。
实验室制取氯气的装置
浓盐酸
实验室制取Cl2
MnO2
导管只露出少许
NaOH 溶液
导管要接近底部
实验步骤
实验室制氯气的正确操作顺序是 ①连好装置,检查气密性; ①③④②⑥⑤
②缓缓加热;
③在烧瓶中加入少量的MnO2,分液漏斗 中加入浓盐酸。
Na2CO3溶
液
3
白色沉淀 3
现象 沉淀不溶解 沉淀不溶解
沉淀溶解
结论:可以用稀HNO3酸化的AgNO3溶液 来检验Cl-,现象——产生了不溶于稀 HNO3的AgCl白色沉淀。
常见干燥剂 ①酸性干燥剂:如浓硫酸、五氧化二磷。
②碱性干燥剂:如生石灰、碱石灰、固 体NaOH。
③中性干燥剂:如无水氯化钙,可干燥 中性、酸性、碱性气体。
MnO2 (3)制取氯气必须在通风
的地方进行
NaOH
(4)由于浓盐酸容易挥溶液发。
装置必须使用分液漏斗且
盖上玻璃塞;
(2)收集方法
• 向上排空气法 • 排饱和食盐水的方法(因氯气在饱和
食盐水中溶解度比在水中小得多)
(3)尾气吸收
用NaOH溶液吸收 (Cl2+2NaOH→NaCl+NaClO+
H2用O较)浓的碱溶液吸收多余的氯气
气体收集方法或装置——根据其物理性质
密度: 1、小于空气,可用向下排空气法收集;
2、大于空气,可用向上排空气法;
溶解性:3、不易溶于水的气体,可用排水法收集。
(1)、仪器装置—发生装置
固体+液体——加热
浓盐酸
(1)加实热验烧注室瓶意制时事取应项Cl垫2 上石 棉网;
高中常见气体制备

高中常见气体的制备1.常见气体的实验室制法中学化学实验中,应该学会氯气、氯化氢、氧气、硫化氢、二氧化硫、氨气、二氧化氮、一氧化氮、二氧化碳、氢气、甲烷、乙烯、乙炔等气体的实验室制法。
应该掌握的具体内容主要有:会选择适宜的反应物,并能熟练地书写有关气体生成的化学方程式;根据反应物的状态和反应条件等因素,选择适宜的气体发生装置,能判断装置图的正误,会组装气体发生装置;根据气体的密度、在水中的溶解性等性质,选择适宜的集气方法与装置;根据所制气体的性质,会用简便的方法检验或验满。
(一)气体的制备思路,可从下面几个方面来归纳:反应原理气体发生装置除杂提纯干燥收集检验尾气处理→→→→→→(二)组装仪器:自下而上,从左到右;气体净化:先净气装置,后干燥装置;(三)操作顺序:1.检验装置的气密性;2.装药品进行实验操作;3.记录实验现象、数据;1、气体制取装置:A. B. C. D.固/液体 + 液体(不加热)固/液体 + 液体(加热) 固体 + 固体(加热) 适用于收集不跟空气发生反应且密度比空气小的气体(装置见图C);(装置D中B管进A管出)2、气体干燥装置(1)气体干燥装置的基本类型和气体流动方向:注意事项:1、固体干燥剂颗粒大小要适当,颗粒太大气体和干燥剂接触面小,不利于干燥效果不好;颗粒太小,气体不易通过,容易堵塞,一般以黄豆粒大小为宜。
2、液体干燥剂用量要适当,并控制好通入气体的速度,为了防止发生倒吸,在洗气瓶与反应容器之间应连接安全瓶。
(2)、气体的分类1、根据酸碱性,酸性气体:CO2、SO2、NO2、HCl、Cl2、H2S、HBr、HI等碱性气体:只有NH3中性气体:H2、O2、CH4、CO、CH2=CH2、C2H2、N2等2、根据常温氧化还原性强弱,强还原性气体:H2S、HBr、HI、SO2等一般性气体:H2、O2、CH4等(3)、气体干燥剂的类型及选择1、常用气体干燥剂按酸碱性可分为三类:①酸性干燥剂,如浓硫酸、五氧化二磷、硅胶。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1,常见气体的制取和检验⑴氧气制取原理——含氧化合物自身分解制取方程式——23 23O2↑装置——略微向下倾斜的大试管,加热检验——带火星木条,复燃收集——排水法或向上排气法⑵氢气制取原理——活泼金属与弱氧化性酸的置换制取方程式——24 H242↑装置——启普发生器检验——点燃,淡蓝色火焰,在容器壁上有水珠收集——排水法或向下排气法⑶氯气制取原理——强氧化剂氧化含氧化合物制取方程式——2+4(浓)22↑+2H2O装置——分液漏斗,圆底烧瓶,加热检验——能使湿润的蓝色石蕊试纸先变红后褪色;除杂质——先通入饱和食盐水(除),再通入浓H24(除水蒸气)收集——排饱和食盐水法或向上排气法尾气回收——2+2 2O⑷硫化氢①制取原理——强酸与强碱的复分解反应②制取方程式——2 22S↑③装置——启普发生器④检验——能使湿润的醋酸铅试纸变黑⑤除杂质——先通入饱和溶液(除),再通入固体2(或P2O5)(除水蒸气)⑥收集——向上排气法⑦尾气回收——H22 22O或H2 2O⑸二氧化硫①制取原理——稳定性强酸与不稳定性弱酸盐的复分解②制取方程式——2324 242↑2O③装置——分液漏斗,圆底烧瓶④检验——先通入品红试液,褪色,后加热又恢复原红色;⑤除杂质——通入浓H24(除水蒸气)⑥收集——向上排气法⑦尾气回收——2+2 232O⑹二氧化碳①制取原理——稳定性强酸与不稳定性弱酸盐的复分解②制取方程式——3+222↑2O③装置——启普发生器④检验——通入澄清石灰水,变浑浊⑤除杂质——通入饱和3溶液(除),再通入浓H24(除水蒸气)⑥收集——排水法或向上排气法⑺氨气①制取原理——固体铵盐与固体强碱的复分解②制取方程式——()2+2423↑+2H2O③装置——略微向下倾斜的大试管,加热④检验——湿润的红色石蕊试纸,变蓝⑤除杂质——通入碱石灰(除水蒸气)收集——向下排气法⑻氯化氢①制取原理——高沸点酸与金属氯化物的复分解②制取方程式——2424+2↑③装置——分液漏斗,圆底烧瓶,加热④检验——通入3溶液,产生白色沉淀,再加稀3沉淀不溶⑤除杂质——通入浓硫酸(除水蒸气)⑥收集——向上排气法⑼二氧化氮①制取原理——不活泼金属与浓硝酸的氧化—还原;②制取方程式——43(3)2+22↑+2H2O③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——红棕色气体,通入3溶液颜色变浅,但无沉淀生成⑤收集——向上排气法⑥尾气处理——322232+2222O⑩一氧化氮①制取原理——不活泼金属与稀硝酸的氧化—还原;②制取方程式——83(稀)3(3)2+2↑+4H2O③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——无色气体,暴露于空气中立即变红棕色⑤收集——排水法⑾一氧化碳①制取原理——浓硫酸对有机物的脱水作用②制取方程式——↑2O③装置——分液漏斗,圆底烧瓶④检验——燃烧,蓝色火焰,无水珠,产生气体能使澄清石灰水变浑浊⑤除杂质——通入浓硫酸(除水蒸气)⑥收集——排水法⑿甲烷①制取方程式——3 4↑23②装置——略微向下倾斜的大试管,加热③收集——排水法或向下排空气法⒀乙烯①制取原理——浓硫酸对有机物的脱水作用②制取方程式——32 22↑2O③装置——分液漏斗,圆底烧瓶,加热④除杂质——通入溶液(除22),通入浓硫酸(除水蒸气)收集——排水法⒁乙炔①制取原理——电石强烈吸水作用②制取方程式——2+2H2()2 ↑③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——无色气体,能燃烧,产生明亮的火焰,并冒出浓的黑烟⑤除杂质——通入硫酸铜溶液(除H23),通入浓硫酸(除水蒸气)收集——排水法或向下排气法15。
硝酸实验室制法:2324→243↑工业制法:一氧化氮与水反应。
检验硝酸根:棕色环[()(H2O)5]2+16。
三氧化硫。
制取:五氧化二磷夺取浓硫酸中的水分。
使三氧化硫逸出。
再根据三氧化硫的熔点低。
进行冷凝。
得到固体。
高中化学中各种离子或物质的检验方法:焰色反应紫色 :焰色反应黄色2+:加入42-产生不溶于稀硝酸的白色沉淀。
2+:焰色反应砖红色,加入23后产生白色沉淀3+:加入后先产生白色沉淀,后沉淀溶解。
3+:加入变为血红色或加苯酚变为紫色。
2+:先检验原溶解液无3+,先加强氧化剂(K22O7、 3、H2O2酸性4、……)然后检验有没有3+。
2+:一般为蓝色溶液,加入产生蓝色沉淀。
:加入产生不溶于稀3的白色沉淀。
4+:加入,加热产生无色气体,可使紫色石蕊试纸变蓝。
3-:加入、产生红棕色气体,或无色气体与O2反应后显红棕色。
:加入产生不溶于稀3的白色沉淀。
:加入产生不溶于稀3的浅黄色沉淀。
:加入产生不溶于稀3的黄色沉淀。
42-:加入2+产生不溶于稀3的白色沉淀。
32-:加入2+产生白色沉淀,加入产生气体,能使品红褪色。
3-:加入2+产生白色沉淀,加入产生气体,能使品红褪色。
32-:加入2+产生白色沉淀,加入产生气体,不能使品红褪色。
1,常见气体的制取和检验⑴氧气制取原理——含氧化合物自身分解制取方程式——23 23O2↑装置——略微向下倾斜的大试管,加热检验——带火星木条,复燃收集——排水法或向上排气法⑵氢气制取原理——活泼金属与弱氧化性酸的置换制取方程式——24 H242↑装置——启普发生器检验——点燃,淡蓝色火焰,在容器壁上有水珠收集——排水法或向下排气法⑶氯气制取原理——强氧化剂氧化含氧化合物制取方程式——2+4(浓)22↑+2H2O装置——分液漏斗,圆底烧瓶,加热检验——能使湿润的蓝色石蕊试纸先变红后褪色;除杂质——先通入饱和食盐水(除),再通入浓H24(除水蒸气)收集——排饱和食盐水法或向上排气法尾气回收——2+2 2O⑷硫化氢①制取原理——强酸与强碱的复分解反应②制取方程式——2 22S↑③装置——启普发生器④检验——能使湿润的醋酸铅试纸变黑⑤除杂质——先通入饱和溶液(除),再通入固体2(或P2O5)(除水蒸气)⑥收集——向上排气法⑦尾气回收——H22 22O或H2 2O⑸二氧化硫①制取原理——稳定性强酸与不稳定性弱酸盐的复分解②制取方程式——2324 242↑2O③装置——分液漏斗,圆底烧瓶④检验——先通入品红试液,褪色,后加热又恢复原红色;⑤除杂质——通入浓H24(除水蒸气)⑥收集——向上排气法⑦尾气回收——2+2 232O⑹二氧化碳①制取原理——稳定性强酸与不稳定性弱酸盐的复分解②制取方程式——3+222↑2O③装置——启普发生器④检验——通入澄清石灰水,变浑浊⑤除杂质——通入饱和3溶液(除),再通入浓H24(除水蒸气)⑥收集——排水法或向上排气法⑺氨气①制取原理——固体铵盐与固体强碱的复分解②制取方程式——()2+2423↑+2H2O③装置——略微向下倾斜的大试管,加热④检验——湿润的红色石蕊试纸,变蓝⑤除杂质——通入碱石灰(除水蒸气)收集——向下排气法⑻氯化氢①制取原理——高沸点酸与金属氯化物的复分解②制取方程式——2424+2↑③装置——分液漏斗,圆底烧瓶,加热④检验——通入3溶液,产生白色沉淀,再加稀3沉淀不溶⑤除杂质——通入浓硫酸(除水蒸气)⑥收集——向上排气法⑼二氧化氮①制取原理——不活泼金属与浓硝酸的氧化—还原;②制取方程式——43(3)2+22↑+2H2O③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——红棕色气体,通入3溶液颜色变浅,但无沉淀生成⑤收集——向上排气法⑥尾气处理——322232+2222O⑩一氧化氮①制取原理——不活泼金属与稀硝酸的氧化—还原;②制取方程式——83(稀)3(3)2+2↑+4H2O③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——无色气体,暴露于空气中立即变红棕色⑤收集——排水法⑾一氧化碳①制取原理——浓硫酸对有机物的脱水作用②制取方程式——↑2O③装置——分液漏斗,圆底烧瓶④检验——燃烧,蓝色火焰,无水珠,产生气体能使澄清石灰水变浑浊⑤除杂质——通入浓硫酸(除水蒸气)⑥收集——排水法⑿甲烷①制取方程式——3 4↑23②装置——略微向下倾斜的大试管,加热③收集——排水法或向下排空气法⒀乙烯①制取原理——浓硫酸对有机物的脱水作用②制取方程式——32 22↑2O③装置——分液漏斗,圆底烧瓶,加热④除杂质——通入溶液(除22),通入浓硫酸(除水蒸气)收集——排水法⒁乙炔①制取原理——电石强烈吸水作用②制取方程式——2+2H2()2 ↑③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——无色气体,能燃烧,产生明亮的火焰,并冒出浓的黑烟⑤除杂质——通入硫酸铜溶液(除H23),通入浓硫酸(除水蒸气) 收集——排水法或向下排气法。
