电极过程动力学
电极过程动力学 电化学
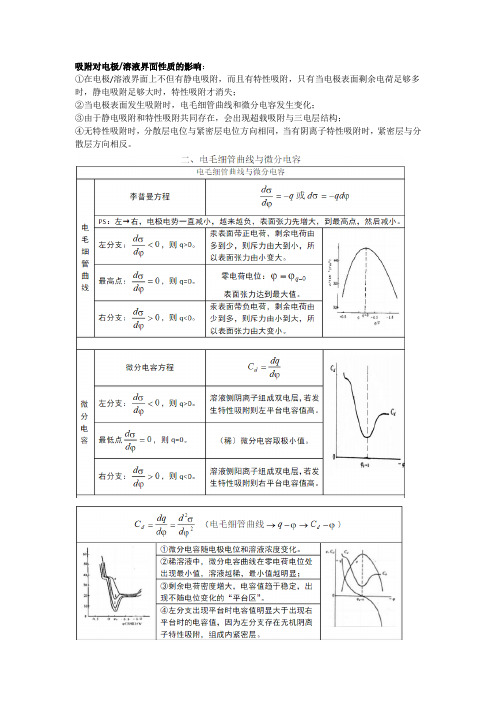
吸附对电极/溶液界面性质的影响:①在电极/溶液界面上不但有静电吸附,而且有特性吸附,只有当电极表面剩余电荷足够多时,静电吸附足够大时,特性吸附才消失;②当电极表面发生吸附时,电毛细管曲线和微分电容发生变化;③由于静电吸附和特性吸附共同存在,会出现超载吸附与三电层结构;④无特性吸附时,分散层电位与紧密层电位方向相同,当有阴离子特性吸附时,紧密层与分散层方向相反。
电极过程——电极表面附近薄液层中进行的过程与电极表面上发生的过程的总称。
电极过程单元步骤:①液相传质——反应粒子向电极表面传递;②表面转化(前置)——反应粒子在电极表面或附近液层发生某些转化;③电化学——反应粒子在电极/溶液界面得到电子或失去电子;④表面转化(后置)——反应产物在电极表面或附近液层发生某些转化;⑤a、新相生成——反应产物不溶时,反应产物生成新相;b、液相传质——反应产物可溶时,产物粒子从电极表面向溶液中或溶液电极内部迁移。
电极极化——电流通过电极时,电极电势偏离平衡电极电势的现象。
过电势——表示某一电流密度下极化电势与平衡电势之差。
①阳极过电势:②阴极过电势:控制步骤——电极过程中最慢的单元步骤。
极化曲线——电极上电势随电流密度变化的关系曲线。
传质过程(溶液):①对流——物质粒子随液体流动而移动。
A、自然对流——液体各部分之间由于存在浓度差或温度差产生的密度差或密度梯度而产生的对流;B、强制对流——通过搅拌而引起的对流。
②扩散——溶液中某一组分由于存在浓度梯度(或化学势梯度)而发生该组分向减少这种梯度的方向转移的过程。
③电迁移——带电粒子在电场梯度或电势梯度的作用下而引起的迁移过程。
扩散层——通过电流时,由于物质迁移缓慢而引起浓度发生扩散的液层。
稳态扩散——溶液中任意一点的浓度不再随时间变化的扩散过程。
(扩散速度与时间无关,反应粒子浓度分布只与空间有关,扩散层厚度一定)非稳态扩散——溶液中任意一点的浓度随时间变化的扩散过程。
电极过程动力学

电极过程动力学
电极过程动力学是一门研究电极表面的化学、物理过程的科学。
它涉及电化学反应的定义、电解池运行的机制以及电极间相互作用的步骤。
它涵盖了催化作用、阴阳极反应和过渡状态等一系列电化学过程,影响着电极表面反应活性、微结构、表面形貌和表面拓扑等,进而影响着电极表面电化学反应机制,比如电子传递机制、还原反应、氧化反应等。
此外,它还涉及电极表面涂层和金属原子的形成、失效及变质等现象。
电极过程动力学的研究在很大程度上受益于先进的检测技术,例如电化学显微镜(ECM)、原子力显微镜(AFM)以及等离子体质谱(ICP)等。
利用这些技术,可以观测电极表面形貌,检测指示电极和硫化物等微生物物质,还可以用于测定电极表面的微结构和电化学反应的机制。
电极过程动力学研究前景广阔,对于新型电极产品的研发尤其重要,它广泛应用于电池、燃料电池、水处理和电子器件的开发等领域。
此外,它还可以被应用于生物传感器的开发,以便检测病毒、细胞和基因。
比如,已有研究表明,电极过程动力学可以用于研究蛋白质和生物标记物的电化学反应特性,以有效地开发新型生物传感器。
电极过程动力学是一个复杂的概念,受多种因素影响,在实践中它不仅为电池、燃料电池、水处理和电子器件的发展奠定基础,还有助于新型生物传感器的开发,以检测细胞、病毒和基因等。
因此,电极过程动力学对研究电池、生物传感器、氧化反应机理以及珠宝等物质的耐久性具有重要的意义。
未来,电极过程动力学的研究将发展出更加先进的技术,以提高生物传感器精度,更好地满足人们的需求。
电极过程动力学(全套课件)

§1.1 电极过程动力学的发展
电化学科学的发展大致可以分为三个阶段:电化学热 力学、电化学动力和现代电化学。 电化学热力学研究的是处在平衡状态的电化学体系, 涉及的主要问题是电能和化学能之间的转换的规律。 从19世纪末到20世纪初,在热力学基本原理被牢固地 确立后,用热力学方法研究电化学现象成了电化学研 究的主流,取得了重大的进展,使“电化学热力学” 这部分内容趋于成熟,成为物理化学课程的经典组成 部分。
3.
电极过程动力学主要形成是从20世纪40年代中期开
始:
前苏联Φ р у м к и н 学派抓住电极和溶液净化对电极反应
动力学数据重现性有重大影响这一关键问题,首先从实验技
术上开辟了新局面。证实了迟缓放电理论,研究了双电层结 构和各类吸附现象对电极反应速度的影响
英国Bockris,Parsons,Conway等人也在同一领域作出了奠基性的
§1.1 电极过程动力学的发展
电化学是在科学研究和生产实践中发展起来的,反过 来它又促进了生产力的发展。在化工、冶金、化学电 源、金属腐蚀和保护、电化学加工和电化学分析等工 业部门占有及其重要的地位。 近30年来,它在高新技术领域,如新能源、新材料、 微电子技术、生物化学等等方面也扮演重要角色。与 此同时,由于电化学理论与方法的发展,在与其他学 科边缘地域形成了融盐电化学、半导体电化学、催化 电化学、腐蚀电化学、金属电化学、生物电化学等新 兴学科。电化学应用已远远超出了化学领域,在国民 经济许多部门发挥了巨大作用。
5.
20世纪60年代以来,电化学实验技术仍然不断发展。
线性电势扫描方法(循环伏安法)成了后起之秀,交流阻 抗方法以及一系列更复杂灵巧的极化程序控制方法在很大 程度上取代了经典极化曲线测量和极谱方法。界面波谱技 术对电化学研究的影响日益显著。许多重要进展通过对新 材料、新体系研究而取得。
电极过程动力学

Grahame 开创了用滴汞电极研究 “电极/溶液” 界面的系统工作。
4.
20世纪50年代是电化学学科的重要成熟期
经典电化学方法蓬勃发展和电化学队伍迅速扩大
各种快速暂态方法,旋转圆盘电极系统,研究许多电化学
测量方法在这一阶段建立。这些方法在当代电化学实验室 中仍然是基本测试手段。
§1.1 电极过程动力学的发展
§1.1 电极过程动力学的发展
电化学科学的发展大致可以分为三个阶段:电化学热 力学、电化学动力和现代电化学。 电化学热力学研究的是处在平衡状态的电化学体系, 涉及的主要问题是电能和化学能之间的转换的规律。 从19世纪末到20世纪初,在热力学基本原理被牢固地 确立后,用热力学方法研究电化学现象成了电化学研 究的主流,取得了重大的进展,使“电化学热力学” 这部分内容趋于成熟,成为物理化学课程的经典组成 部分。
§1.1 电极过程动力学的发展
电化学是在科学研究和生产实践中发展起来的,反过 来它又促进了生产力的发展。在化工、冶金、化学电 源、金属腐蚀和保护、电化学加工和电化学分析等工 业部门占有及其重要的地位。 近30年来,它在高新技术领域,如新能源、新材料、 微电子技术、生物化学等等方面也扮演重要角色。与 此同时,由于电化学理论与方法的发展,在与其他学 科边缘地域形成了融盐电化学、半导体电化学、催化 电化学、腐蚀电化学、金属电化学、生物电化学等新 兴学科。电化学应用已远远超出了化学领域,在国民 经济许多部门发挥了巨大作用。
第六章 交流阻抗方法
§6.1 电解池的等效阻抗 §6.2 表面浓度波动和电极反应完全可逆 时的电解阻抗 §6.3 电化学步骤和表面转化步骤对电解 阻抗的影响 §6.4 电极交流阻抗的复数阻抗图 §6.5 交流阻抗的测量方法 §6.6 电化学阻抗谱数据处理的若干问题
电极过程动力学导论

计时电流法
通过测量电流随时间的变化, 推算电极反应的动力学参数。
电极过程动力学实验结果分析
动力学参数的确定
通过实验数据拟合,确定电极反应的 动力学参数,如反应速率常数、活化 能等。
电极过程的机理分析
根据实验结果,推断电极反应的机理 和中间产物。
THANKS FOR WATCHING
感谢您的观看
电极过程
在电化学反应中,电极与电解质溶液界面上的电子转移和相关化学反应的动态 过程。
涉及内容
电极电位、电流密度、反应速率等。
电极过程分类
可逆电极过程
电极反应速率相对较慢,电极电位与平衡电位相差较小,电极表面附近无显著的物质积累或减少。
不可逆电极过程
电极反应速率相对较快,电极电位与平衡电位相差较大,电极表面附近有显著的物质积累或减少。
电极过程动力学导论
contents
目录
• 引言 • 电极过程动力学基础 • 电极反应速率理论 • 电极过程动力学模型 • 电极过程动力学实验研究 • 电极过程动力学研究展望
01 引言
主题简介
电极过程动力学是研究电化学反应在 电极表面进行的速率和机理的学科, 涉及到电子转移、传质、化学反应等 多个方面。
随着实验技术的不断发展和理论模型的完善,电极过程动力学研究已经取得了许 多重要的成果,为电化学工业、能源存储和转化等领域的发展提供了重要的理论 支撑。
电极过程动力学研究发展趋势
随着新能源和环保技术的需求日益增 长,电极过程动力学研究将更加注重 高效、环保和可持续性,研究领域将 进一步拓展到新型电极材料、电化学 反应新机制和高效能量转化与存储等 方面。
电极过程动力学 基础、技术与应用

电极过程动力学基础、技术与应用电极过程动力学是电化学领域的重要基础理论,它研究了电化学反应中电荷转移和质量传递过程的速率规律。
了解电极过程动力学的基础原理和技术应用对于实现电化学分析、电化学合成和电池材料研究具有重要意义。
首先,电极过程动力学研究的基础是泊松-布尔兹曼方程。
该方程描述了电解液中离子浓度和电势之间的关系,进而揭示了电化学反应速率与电场强度、电荷转移的关系。
这为我们理解电极反应速率的控制机理奠定了基础。
其次,了解电极过程动力学的技术应用有助于优化电化学分析的方法。
通过研究反应速率与电极电位、离子浓度等参数的关系,我们可以确定最佳的测量条件,提高电化学分析的灵敏度和准确性。
例如,在电化学传感器中,我们可以通过修改电极材料和电位的控制,来实现对特定物质的高选择性检测。
此外,电极过程动力学的理论还可以指导电化学合成的优化。
通过调控反应条件和电极材料,我们可以增强所需产物的选择性和活性,提高电化学合成的效率和经济性。
这在有机合成和能源转换领域具有广阔的应用前景。
最后,电极过程动力学的研究对于电池材料的开发和性能改进也至关重要。
通过了解电极反应速率的控制机制,我们可以设计更高效的电池材料,提高其能量密度、循环寿命和安全性能。
在新能源领域,电极过程动力学的研究将有助于推动电池技术的突破和革新。
综上所述,电极过程动力学是电化学领域的基础理论,具有广泛的技术应用前景。
通过深入研究电极过程动力学的基础原理和应用技术,我们可以在电化学分析、电化学合成和电池材料研究等领域取得更加创新和突破性的进展。
电极过程动力学

电极过程动力学电极过程动力学是电化学中的一个重要分支,它着重研究电极电荷转移过程和相关的动力学机制。
电极过程动力学的研究对象包括电化学反应速率、电极化学反应的机理以及电化学反应的动态过程等。
本文将从电极反应速率、电位调控机理以及实际应用方面对电极过程动力学进行详细的介绍和分析。
一、电极反应速率1. 项里反应速率常数项里反应速率常数是衡量电极反应速率的重要参数。
它表示单位时间内反应物和产物之间的数量变化率。
在计算过程中,可以根据电荷转移过程中的动力学机制来确定项里反应速率常数。
通常情况下,项里反应速率常数与反应物和产物之间的活化能和电荷转移系数有关。
一般来说,项里反应速率常数越大,反应速率越快。
2. 泊松分布模型泊松分布模型是一种根据电子传输动力学研究电极反应速率的经典方法。
泊松分布模型假设电子从电极表面进入液相中的分布满足泊松分布。
据此,可以利用该模型计算出电极反应速率以及与之相关的电极化学反应机理。
然而,实际情况中,由于电极表面可能存在着非均匀性和多孔性等特征,泊松分布模型过于理想化,难以准确预测电极反应速率。
3. 热力学因素对电极反应速率的影响热力学因素对电极反应速率有着重要的影响。
根据热力学定律,电位差和电极之间的电势差会影响电子传输和离子转移速率。
当电极电位愈高,电位差就愈大,因此,电子和离子的传输速率就变得更快。
此外,反应物和产物之间的物理和化学吸附现象也会影响电极反应速率。
这些因素的影响程度需要结合具体的条件和反应机理来进行考虑。
二、电位调控机理1. 电位和电场电位是电子在电场作用下所具有的势能差。
由于电场力是由电荷带来的,因此,电位和电场强度是密切相关的。
在电极过程动力学中,电位的变化会影响电子传输过程,进而影响电极化学反应的速率和机理。
2. 离子选择电位离子选择电位可以影响电极的电化学反应机理和速率。
当电极表面存在多种离子时,离子选择电位会决定电极表面上离子种类的比例。
因此,在研究电极过程动力学时,需要对离子选择电位进行分析和控制。
电化学电极过程动力学

电化学电极过程动力学复习、难点、习题传质过程(扩散极限电流)j d 影响传(电)荷过程传质过程(扩散极限电流)j d 影响传(电)荷过程电极过程动力学电极过程动力学控制电化学过程加快或减缓电化学反应速度(电流)控制电化学过程加快或减缓电化学反应速度(电流)超电势(电化学、浓差)极化现象三(二)电极体系j 0 ,η,α,B-V 方程,Tafel 公式极化曲线超电势--电流曲线jja =j= 10-3Acm-2’b =j= 10-6Acm-2’c =j= 10-9Acm-2’交换电流密度对i-η曲线的影响电荷传递系数对i-η曲线的影响Tafel曲线阳极超电势阴极超电势E=ϕa-ϕcI/A电解电池I-V曲线液相中的三种传质过程注意其所传输的物种及发生在溶液体相或在固/液界面电极界面溶液层的几部分反应物浓度体相电极溶液δ氢电极的极化曲线示意图H+ 离子的还原和析出氢气过程H3O+H3O+ H3O+adH adH2H2H3O+ + M + e M-H + H2O 迟缓放电机理Volmer反应氢超电势Hydrogen OverpotentialH 3O ++ M + e M-H + H 2O迟缓放电机理Volmer 反应(a) H 3O ++M-H+e M+H 2O+H 2Heyrovsky 反应(b) M-H + M-H 2M + H2Tafel反应4.(a) H 3O ++M-H+e M+H2O+H 2电化学脱附机理Heyrovsky 反应(b) M-H + M-H 2M + H 2Tafel 反应3. H 3O + + M + e M-H + H 2O 迟缓放电机理Volmer 反应3, 4(a), 4(b) 皆可能为速度控制步骤2H ++ 2e 2H ad (2M-H) M-H + M-H 2M + H (2][2irad Fk j Η=(忽略逆过程)][][ln '+ΗΗ−=r ad o r F RT ϕϕ][][ln '+ΗΗ−=ir ad o ir F RT ϕϕ][][ln'+ΗΗ−=ir ad o ir F RT ϕϕ⎭⎬⎫⎩⎨⎧−Η=ΗRT F c r ad ir ad ηexp ][][2][2irad Fk j Η=⎭⎬⎫⎩⎨⎧−Η=RT F Fk j c r ad η2exp ][22⎭⎬⎫⎩⎨⎧−=RT F j c η2exp 0jzFRT j zF RT c lg 303.2lg 303.20−=η注意: 没有α!21=α电化学方法的主要优点1. 通过方便调节电极电势显著地改变反应速度2. 较易控制电极反应方向3. 电极反应一般在常温常压下进行4. 反应所用氧化剂或还原剂为电子,环境污染少电化学学习重点物理化学固态电化学光电化学生物电化学量子化学统计热力学溶液电化学(电解质溶液)平衡态电化学热力学。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电极过程动力学
一、实验目的
通过对铜电极的阳极极化曲线和阴极极化曲线的测定,绘制出极化曲线图,从而进一步加深对电极极化原理以及有关极公曲线理论知识的理解。
通过本实验,熟悉用恒电流法测定极化曲线。
二、实验原理
当电池中由某金属和其金属离子组成的电极处于平衡状态时,金属原子失去电子变成离子获得电子变成原子的速度是相等的,在这种情况下的电极称为平衡电极电位。
电解时,由于外电源的作用,电极上有电流通过,电极电位偏高了平衡位,反应以一定的速度进行,以铜电极Cu|Cu2+为例,它的标准平衡电极电位是+0.337V,若电位比这个数值更负一些,就会使Cu2+获得电子的速度速度增加,Cu失去电子的速度减小,平衡被破坏,电极上总的反应是Cu2+析出;
反之,若电位比这个数值更正一些,就会使Cu失去电子的速度增加,Cu2+获得电子的速度减小,电极上总的反应是Cu溶解。
这种由于电极上有电流通过而导致电极离开其平衡状态,电极电位偏离其平衡的现象称为极化,如果电位比平衡值更负,因而电极进行还原反应,这种极化称为阴极极化,反之,若电位比平衡值更正,因而电极进行氧化反应,这种极化称为阳极极化。
对于电极过程,常用电流密度来表示反应速度,电流密度愈大,反应速度愈快。
电流密度的单位常用安培/厘米2,安培/米2。
由于电极电位是影响影响电流密度的主要因素,故通常用测定极化曲线的方法来研究电极的极化与电流密度的关系。
一、实验方法及装置
本实验电解液为CuSO4溶液(溶液中CuSO4.5H2O浓度为165g/l,H2SO4 180g/l);电极用φ=0.5mm铜丝作为工作电极,铂片电极作为辅助电极。
为了测得不同电流密度下的电极电位,以一个甘汞电极与被测电极组成电池,甘汞电极通过盐桥与被测电极相通,用CHI660B电化学工作站测得不同电流密度下对应的阴极或阳极极化曲线。
装置如图所示
3 1——铜丝(工作电极Ф1.0mm);
2——铂片(辅助电极);3——甘汞电极;4——盐桥;
二、实验步骤
1、将铜电极的工作表面用0号金相砂纸磨光,用蒸馏水洗净,用滤
纸擦干,然后放入装有CuSO
溶液的电解槽中。
4
2、在装有饱和KCl溶液的电解槽中放入盐桥连通管和甘汞电极。
3、测定阴极、阳极极化曲线
1)注意将工作电极(铜丝)接绿色夹子,甘汞电极接白色夹子(参比电极),辅助电极(铂片)接红色夹子,使盐桥所用连通管尖端靠近工作电极工作面。
2)打开CHI660B电化学工作站的电源和计算机,然后在桌面上双击chi660b 图标运行CHI660B电化学工作站软件。
在Control菜单下选择Open Current Potential测试开路电位。
3)点击Setup菜单下Technique选项,在弹出的Electrochemical
Techniques窗口中选择Chronopotentiometry(计时电位法),点OK确认。
4)阴极极化曲线的测定:点击Setup菜单下Parameters选项,在弹出的
Chronopotentiometry Parameters窗口中设置参数。
Cathodic Current(A)、Anodic Current(A)均设置为0.005A;High E Limit(V)为0.5V,Low E Limit(V)
为-0.5V;Initial Polarity选Cathodic(阴极)进行阴极极化曲线的测定。
Cathodic Current(A)、Anodic Current(A)依次设置为
0.010A,0.015A,0.020A重复上面实验。
阳极极化曲线的测定:点击Setup菜单下Parameters选项,在弹出的Chronopotentiometry Parameters窗口中设置参数。
Cathodic Current(A)、Anodic Current(A)均设置为0.005A;High E Limit(V)为0.5V,Low E Limit(V) 为-0.5V;Initial Polarity选Anodic(阳极)进行阳极极化曲线的测定。
Cathodic Current(A)、Anodic Current(A)依次设置为
0.010A,0.015A,0.020A重复上面实验。
注意:阴阳极交替试验可减少电极打磨次数。
5)在Control菜单下选择Run Experiment 开始实验。
结束实验可在Control 菜单下选择Stop Run或在工具栏中直接点击▲开始,■结束。
6)点击工具栏中将曲线放大。
7)在Graphics菜单下点击Copy to Clipboard至word打印。
4、关掉电源,取出电极冲洗干净。
三、数据处理
1.根据测得的电动势计算出阳、阴极电位,以伏为单位。
φ阳(阴)=φ实测-φ甘汞
2.根据电流及面积计算出电流密度,以安培/厘米2为单位。
四、编写实验报告
1.简述实验原理,方法及流程;
2.填写实验记录、数据处理及图表;
3.实验分析;
4.建议、意见。
