8大肠杆菌中高效表达外源蛋白的策略++
大肠杆菌中高效表达外源蛋白的策略
在大肠杆菌中高效表达外源蛋白的策略赵军侯云德(病毒基因工程国家重点实验室 100052 北京)本世纪60至70年代对大肠杆菌的研究使之成为自然界中最普遍为人们所认识的生物体。
大肠杆菌具有两个显着特征:操作简单和能在廉价的培养基中高密度培养,它的这些特征加上十多年外源基因表达的经验使其在大多数科研应用中成为高效表达异源蛋白最常用的原核表达系统。
尽管大肠杆菌有众多的优点,但并非每一种基因都能在其中有效表达。
这归因于每种基因都有其独特的结构、mRNA的稳定性和翻译效率、蛋白质折叠的难易程度、宿主细胞蛋白酶对蛋白质的降解、外源基因和E.coli在密码子利用上的主要差别以及蛋白质对宿主的潜在毒性等等。
但知识的大量积累还是有助于为表达方面某些特定的困难提供一般的解决方法。
大肠杆菌作为表达系统的主要障碍包括:不能象真核蛋白那样进行翻译后修饰、缺乏将蛋白质有效释放到培养基中的分泌机制和充分形成二硫键的能力。
另一方面,许多真核蛋白在非糖基化的形式下能保留其生物学活性,因而也就可以用大肠杆菌来表达。
如何实现外源基因在原核细胞中的有效表达,自60年代以来,对影响外源基因在其表达体系中表达效率的各个因素作了大量实验研究,并有多篇归纳性综述发表[1,2,3]。
国内针对外源基因在原核细胞中高效表达的关键因素,构建了高效表达载体[4],并在此基础上成功表达了一系列细胞因子的基因[5,6,7]。
我们在分析了国内外有关在原核系统中表达蛋白的实验资料的基础上,对在大肠杆菌中高效表达外源蛋白的策略所涉及的内容进行全面的总结,以期有助于我国在这方面的研究。
有效表达载体的构型构建表达质粒需要多种元件,需要仔细考虑它们的组合,以保证最高水平的蛋白质合成。
E.coli表达载体的基本结构如图1所示[8]。
RBSP启动子(以杂和的tac启动子为例)位于核糖体结合位点(RBS)上游10-100bp处,由调节基因(R)控制,调节基因可以是载体自身携带,也可以整合到宿主染色体上。
大肠杆菌表达系统与蛋白表达纯化

8。
大肠杆菌表达系统与蛋白表达纯化大肠杆菌表达系统遗传背景清楚,目的基因表达水平高,培养周期短,抗污染能力强等特点,是分子生物学研究和生物技术产业化发展进程中的重要工具.因此熟练掌握并运用大肠杆菌表达系统的基本原理和常规操作是对每一个研究生来说是非常必要的.本章节介绍了实验室常用的大肠杆菌表达系统的构成特点,归纳了利用大肠杆菌表达系统纯化重组蛋白的基本流程和详细操作步骤,并且结合笔者的操作经验,总结了初学者在操作过程中可能遇到的问题和解决策略。
8.1大肠杆菌表达系统的选择与构建8.1。
1表达载体的选择根据启动子的不同这些载体大致可以分为热诱导启动子,如λPL,cspA 等和另外一类就是广泛使用的IPTG诱导的启动子,如lac,trc,tac,T5/lac operator,T5/lac operator等.根据表达蛋白质的类型可分为单纯表达载体和融合表达载体。
融合表达是在目标蛋白的N端或C端添加特殊的序列,以提高蛋白的可溶性,促进蛋白的正确折叠,实现目的蛋白的快速亲和纯化,或者实现目标蛋白的表达定位。
常用的用于亲和纯化融合标签包括 Poly—Arg,Poly—His, Strep—Tag Ⅱ,S—tag,MBP等.其中His—Tag 和GST-Tag 是目前使用最多的。
His Tag 大多数是连续的六个His 融合于目标蛋白的N端或C端,通过His 与金属离子:Cu2+>Fe2+>Zn2+>Ni2+ 的螯合作用而实现亲和纯化,其中Ni2+是目前使用最广泛的。
His 标签具有较小的分子量,融合于目标蛋白的N端和C端不影响目标蛋白的活性,因此纯化过程中大多不需要去除。
目前常使用的表达载体主要是由Novagen 提供的pET 系列和Qiagen 公司提供的pQE 系列。
除了His 标签外,还原性谷胱甘肽S—转移酶是另一种实验室常用的融合标签.它可以通过还原性谷胱甘肽琼脂糖亲和层析而快速纯化.此外,与His 相比,GST 很多时候能够促进目标蛋白的正确折叠,提高目标蛋白表达的可溶性,因此,对于那些用his 标签表达易形成包涵体的蛋白,可以尝试用GST融合表达来改进。
外源基因在大肠杆菌中的高效表达

实验十八外源基因在大肠杆菌中的高效表达一、实验目的1. 掌握外源基因在大肠杆菌中表达的特点和方法。
2. 复习SDS-PAGE的制备及其分离原理。
二、实验原理一种高效的原核表达载体需要包括一个强大并且可以严紧调节的启动子;一位于翻译起始密码子5’端大约9bp的SD序列;位于目的基因3’末端的一个高效转录终止子。
此外,载体还需要一个复制起点,筛选标记和利于对启动子活性进行严紧调节的基因。
这些元件的作用往往具有基因特异性,因此要根据不同的情况加以取舍。
E.coli表达载体的基本结构见下图:1.有效的转录起始与基因的高效表达有效的转录起始是外源基因能否在宿主细胞中高效表达的关键性步骤之一。
最理想的强的可调控的启动子应该是:在发酵的早期阶段表达载体的启动子被紧紧地阻遏,这样可以避免出现表达载体不稳定,细胞生长缓慢或由于产物表达而引起的细胞死亡等问题。
对于原核细胞而言,可分为可诱导型启动子,比如lac,trp,tac,phoA等,和组成型启动子如T7噬菌体启动子。
2.mRNA 的有效延伸和转录终止与基因的高效表达转录开始后,mRNA 开始进行有效延伸,终止以及稳定的积累,在这个过程中,转录物内的衰减和非特异性终止能诱发转录中的mRNA分子提前终止。
衰减子位点具有简单终止子的特性,在原核细胞中其处于操纵子的启动子和第一个结构基因之间,为保证mRNA转录安全,在表达载体的组建中要尽量避免其存在。
正常的转录终止子序列的存在也是外源基因高效表达的一个因素,其作用是防止不必要的转录,使mRNA的长度限制到最小,增加表达质粒的稳定性。
对于真核细胞而言,表达载体上含有转录终止序列和poly A加入位点,使外源基因高效表达的重要因素。
3.有效的翻译起始与基因的高效表达在原核细胞中使翻译起始达到最大效率的一般原则:1) AUG(ATG)是最首选的起始密码子。
GUG、UUG、AUU和AUA有时也用作起始密码子,但非最佳选择。
2) SD序列中至少含有AGGAGG序列中的四个碱基。
基因在大肠杆菌、酵母中的高效的表达

c. 启动子与克隆基因间的距离对基因表达的影响
研究表明启动子和目的基因间的距离对基因的 表达效率影响很大,所以在构建新的表达载体时要考 虑到这一因素的影响。另外,在克隆基因的末端要就 近插入有效的终止子序列,否则会导致细胞能量的大 量消耗,或是形成不应有的二级结构,最终影响的目 的基因的表达效率。
影响目的基因在甲醇酵母中表达的因素
1.目的基因的特性 2.表达框的染色体整合位点与基因拷贝数 3.宿主的甲醇利用表型 4.分泌信号 5.产物稳定性 6.翻译后修饰
பைடு நூலகம்
b. 翻译起始序列对表达效率的影响
mRNA的有效翻译依赖于核糖体和其的稳定结 合,大肠杆菌的mRNA序列中,核糖体的结合位点是 起始密码子AUG和其上游的SD序列。所谓SD序列就 是由Shine-Dalgarno首先提出的一种位于位于起始密 码子上游的一段保守序列,为细菌核糖体有效结合和 翻译起始所必需。一般SD序列的长度约为3-9bp,位 于起始密码子上游3-11碱基的位置,它与16S核糖体 RNA的3‘端互补,控制了翻译的起始。 5’--AGGAGGUXXXAUG--- mRNA 3’AUUCCUCCACUAG----- 16S rRNA3’ 末端
构建表达载体的策略
⑴将真核基因克隆到一个强大的原核启动子和SD序列
的下游,使得真核基因处于原核调控体系中。 ⑵采用真核基因的cDNA序列作为构建表达载体的目的 基因,这样就解决了原核细胞没有RNA剪接功能的 问题。
⑶构建载体时,将真核基因插在几个原核密码子的后 面,翻译后就得到了原核多肽和真核多肽的融合 蛋白,这样就可以避免被原核蛋白酶的识别和降 解,最后可以将融合多肽切除。
3. mRNA合成后穿过核膜进入细胞质中后才进行翻译 工作,而且通常都有复杂的成熟和剪接过程; 4. 基因的启动子区和原核基因差异很大,而且有增强 子序列存在。
外源基因在大肠杆菌中的表达

PL 和 PR 表达系统
转录调控的机理
由 l 噬菌体 PE 启动子控制的 cI 基因的产物是 PL 、 PR 启动子转录的
阻遏物。cI 基因的产物在大肠杆菌宿主中的浓度取决于一系列宿主与 噬菌体因子之间的错综复杂的平衡关系。由于通过细胞因子来控制cI 基因产物的产生和消失是相当困难的。
由于 PL 和 PR 表达系统诱导时不加化学诱导剂,成本又低廉,最初几 个在大肠杆菌中制备的药用重组蛋白质都采用 PL 或 PR 表达系统。
缺陷 在热脉冲诱导过程中,大肠杆菌热休克蛋白的表达也会被激活,其 中一些是蛋白水解酶,有可能降解所表达的重组蛋白。 在大体积发酵培养菌体时,通过热平衡交换方式把培养温度从30℃ 提高到 42℃ 需要较长的时间,这种缓慢的升温方式影响诱导效 果,对重组蛋白表达量有一定的影响。
T7 表达系统
大肠杆菌 T7 噬菌体具有一套专一性非常强的转录体系,利用这一 体系中的元件为基础构建的表达系统称为 T7 表达系统。
T7 表达系统
T7 噬菌体基因 1 编码的 T7 RNA 聚合酶选择性的激活 T7 噬菌体启 动子的转录。
T7 RNA 聚合酶活性高,其合成 RNA 的速度比大肠杆菌 RNA 聚合 酶快 5倍左右。并可以转录某些不能被大肠杆菌 RNA聚合酶有效转 录的序列。
对宿主菌的要求
用溶源化 l 噬菌体的大肠杆菌作 PL、PR 启动子表达载体的宿主菌
N4830-1,POP2136 等菌株已经溶源化 cI 857(ts) l 噬菌体, 可用作表达外源基因时的宿主菌。 把 cI 857(ts) 基因组装在表达载体上 宿主菌选择范围更大
PL 和 PR 表达系统存在的问题
这两个启动子受在培养基中的无机磷(Pi)浓度调控(Pi﹥5mmol/L 时抑制,Pi﹤1mmol/L 时激活),具有较高的转录水平。
外源蛋白在大肠杆菌中的表达定位策略

《生物工程进展》2001,V ol.21,N o.6专 论外源蛋白在大肠杆菌中的表达定位策略 钟向阳 石歆莹 周宏灏(中南大学湘雅医学院基础与临床药理研究所,中国湖南 长沙 410078)摘要 外源基因在大肠杆菌中表达是对基因重组技术的成功应用。
外源基因在不同的大肠杆菌表达系统中表达产物可能定位于大肠杆菌空间结构的不同位置:胞质,胞质膜,胞周质,胞外膜和胞外培养基,五种表达定位方式各有其特点和用途。
关键词 大肠杆菌 外源蛋白 表达定位作者简介:钟向阳,男,博士。
石歆莹,女,博士生。
周宏灏,男,教授,博士生导师。
基因重组技术能从数量和质量上提供天然组织中难以得到的蛋白质等产物。
以大肠杆菌为宿主的体系是表达外源蛋白的首选体系,其遗传背景清楚、繁殖快、成本低、表达量高、易于操作。
虽然人们开发出了多种真核表达体系,以克服大肠杆菌含内毒素、缺少翻译后修饰、高表达时易折叠错误等不足,但尚不能完全取代大肠杆菌表达体系。
大肠杆菌细胞学结构特点使表达的外源蛋白可能定位的五个位置是:胞质,胞质膜,胞周质,外膜和胞外培养基[1]。
1 表达的外源蛋白定位在胞内将外源DNA 或目的基因与表达载体构建成DNA 重组体,转化大肠杆菌后外源蛋白表达定位于胞内,是常见的表达方式。
11直接表达:即非融合蛋白表达。
将外源基因插到原核表达载体强启动子和有效S D 序列下游,以外源基因mRNA 的AUG 为起始翻译,表达产物位于胞内,氨基端和羧基端不含其他蛋白或多肽序列。
小分子蛋白较易表达,产物接近天然蛋白,但易被水解,不稳定。
当外源基因在大肠杆菌高效表达,特别是表达出大分子蛋白时,则易在胞内形成包涵体。
111 包涵体的形成及利用包涵体是由蛋白肽链错误折叠形成的不溶于水的非结晶性蛋白聚集体。
通常一级结构正确,但其立体结构有误;无生物学活性或活性很低,需变性、复性才可能得到活性蛋白。
包涵体的分离方法简单(差别离心、洗涤等),其形成可减轻外源蛋白对宿主的毒害,如果复性成本又较低,可考虑促进包涵体的生成以获取大量表达产物。
大肠杆菌中高效表达外源蛋白的策略精编

大肠杆菌中高效表达外源蛋白的策略精编Document number:WTT-LKK-GBB-08921-EIGG-22986在大肠杆菌中高效表达外源蛋白的策略赵军侯云德(病毒基因工程国家重点实验室 100052 北京)本世纪60至70年代对大肠杆菌的研究使之成为自然界中最普遍为人们所认识的生物体。
大肠杆菌具有两个显着特征:操作简单和能在廉价的培养基中高密度培养,它的这些特征加上十多年外源基因表达的经验使其在大多数科研应用中成为高效表达异源蛋白最常用的原核表达系统。
尽管大肠杆菌有众多的优点,但并非每一种基因都能在其中有效表达。
这归因于每种基因都有其独特的结构、mRNA 的稳定性和翻译效率、蛋白质折叠的难易程度、宿主细胞蛋白酶对蛋白质的降解、外源基因和在密码子利用上的主要差别以及蛋白质对宿主的潜在毒性等等。
但知识的大量积累还是有助于为表达方面某些特定的困难提供一般的解决方法。
大肠杆菌作为表达系统的主要障碍包括:不能象真核蛋白那样进行翻译后修饰、缺乏将蛋白质有效释放到培养基中的分泌机制和充分形成二硫键的能力。
另一方面,许多真核蛋白在非糖基化的形式下能保留其生物学活性,因而也就可以用大肠杆菌来表达。
如何实现外源基因在原核细胞中的有效表达,自60年代以来,对影响外源基因在其表达体系中表达效率的各个因素作了大量实验研究,并有多篇归纳性综述发表[1,2,3]。
国内针对外源基因在原核细胞中高效表达的关键因素,构建了高效表达载体[4],并在此基础上成功表达了一系列细胞因子的基因[5,6,7]。
我们在分析了国内外有关在原核系统中表达蛋白的实验资料的基础上,对在大肠杆菌中高效表达外源蛋白的策略所涉及的内容进行全面的总结,以期有助于我国在这方面的研究。
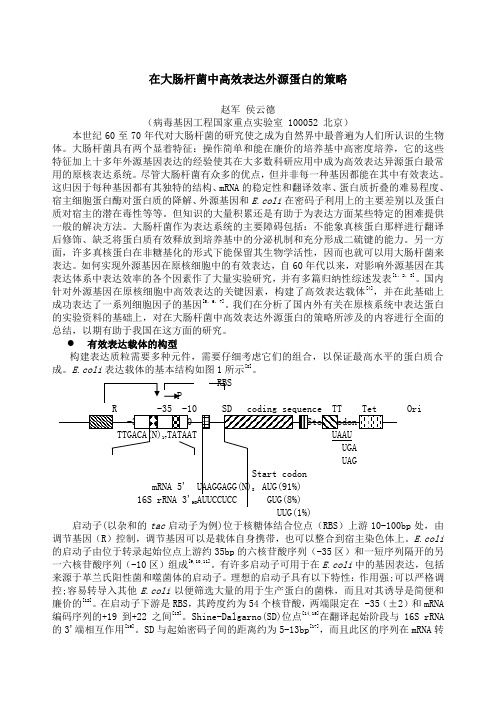
有效表达载体的构型构建表达质粒需要多种元件,需要仔细考虑它们的组合,以保证最高水平的蛋白质合成。
表达载体的基本结构如图1所示[8]。
RBSPR -35 -10 SD codingsequence TT Tet Ori-35 -10Stop codonTTGACA(N)17TATAAT UAAUUGAUAGStart codonmRNA 5' UAAGGAGG(N)8 AUG(91%)16S rRNA 3'HO AUUCCUCC GUG(8%)UUG(1%)启动子(以杂和的tac启动子为例)位于核糖体结合位点(RBS)上游10-100bp处,由调节基因(R)控制,调节基因可以是载体自身携带,也可以整合到宿主染色体上。
大肠杆菌在外源性蛋白表达中的研究进展

大肠杆菌在外源性蛋白表达中的研究进展随着生物技术的不断发展和进步,外源性蛋白表达在医药、工业和生物制品等领域中扮演着越来越重要的角色。
然而,对于外源性蛋白表达的技术瓶颈和提高表达效率的研究,已成为了当前生物技术的热点领域之一。
而大肠杆菌作为一种广泛应用于分子生物学领域的微生物,也成为了外源性蛋白表达的研究热点之一。
本文将就大肠杆菌在外源性蛋白表达中的研究进展展开论述。
第一部分:大肠杆菌在外源性蛋白表达中的特点外源性蛋白表达主要分为原核和真核系统两类。
而大肠杆菌则被广泛应用于原核系统中。
大肠杆菌在外源性蛋白表达方面的突出特点是其具有较高的表达效率和易于操作。
其表达的蛋白质具有良好的纯度和活性。
而在表达的技术方面,大肠杆菌可以利用各种载体进行转化。
同时,其遗传背景较为简单,为碱基序列仅为4.6MB的圆形染色体。
这一特点促使大肠杆菌成为了外源性蛋白表达的优选菌株。
第二部分:大肠杆菌在外源性蛋白表达中的常用载体常用载体主要包括pUC、pET和pBAD等。
其中pUC是一种常用的负责编码外源性蛋白质的表达载体,具有高效、快速、经济等特点。
同时,pUC载体可用于亚克隆、磷酸化和DNA序列分析等相关实验。
而外源性蛋白表达的pET系列载体采用T7启动子进行表达,可以具有高效率的表达效果,还可以对靶向蛋白进行不同形式的标记,以便于在纯化时分别使用。
此外,pBAD载体也是一种经典且有效的大肠杆菌表达载体,该载体可以通过调节l-arabinose的浓度来调节目标基因的表达量。
在新型载体的研发中,通过人工合成的方法合成的RNA表达系统在蛋白表达方面也可以取得显著的进展。
第三部分:大肠杆菌在外源性蛋白表达中的最新技术1. 合成生物学的应用:近年来合成生物学在外源性蛋白表达中的应用越来越受到重视。
这项技术通过重新设计和合成生物学的元件,再结合基因表达网络及传递过程等,从而改变微生物代谢的路线,进而提高微生物的表达效率及生产能力。
实验七 外源基因在大肠杆菌中的诱导表达

大肠杆菌包涵体的分离与蛋白质纯化
1 细菌的裂解: 常用方法有:① 高温珠磨法;② 高压匀浆;③ 超声破碎法; ④ 酶溶法;⑤ 化学渗透等。前三种方法属机械破碎法,并且方 法① 、② 已在工业生产中得到应用,后三种方法在实验室研究 中应用较为广泛。 下面介绍酶溶法和超声破碎法的实验步骤。
1、酶溶法。常用的溶解酶有溶菌酶;β-1,3 -葡聚糖酶;β-1,6 -葡聚糖酶;蛋白酶;壳 多糖酶;糖昔酶等。溶菌酶主要对细菌类有作用,而其他几种酶对酵母作用显著。 主要步骤为: ① 4 ℃ ,5000rpm 离心,15 min ,收集诱导表达的细菌培养液(100 mL )。弃 上清,约每克湿菌加3 mL 裂解缓冲液,悬浮沉淀。 ② 每克菌加8μL PMSF 及80μL 溶菌酶,搅拌20 min ;边搅拌边每克菌加4 mg 脱 氧胆酸(在冷室中进行)。 ③ 37 ℃ ,玻棒搅拌,溶液变得粘稠时加每克菌20μL DNase I。室温放置至溶液不 再粘稠。 2、超声破碎法。声频为15-20 kHz 的超声波在高强度声能输入下可以进行细胞破碎, 在处理少量样品时操作简便,液体量损失较少,同时还可对染色体DNA 进行剪切 ,大大降低液体的粘稠度。 ① 收集1 L 诱导表达的工程菌,40 ℃ ,5000r pm 离心,15 min ;弃上清,约每 克湿菌加3 mLTE 缓冲液。 ② 按超声处理仪厂家提供的功能参数进行破菌;10 000g 离心,15min ,分别收集 上清液和沉淀。 ③ 分别取少量上清和沉淀,加入等体积的2× 凝胶电泳加样缓冲液,进行SDS PAGE 。 注意事项:超声破碎与声频、声能、处理时间、细胞浓度、菌种类型等因素有关, 应根据具体情况掌握;超声波破菌前,标本经3 -4 次冻溶后更容易破碎。
实验七 外源基因在大肠杆菌中的诱导表达
8基因表达,大肠杆菌基因工程

核糖体结合位点
核糖体结合位点的结构
大肠杆菌核糖体结合位点包括下列四个特征结构要素:
位于翻译起始密码子上游的6-8个核苷酸序列5’ UAAGGAGG 3’
,即Shine-Dalgarno(SD)序列,它通过识别大肠杆菌核糖体小 亚基中的16S rRNA 3’端区域3’ AUUCCUCC 5’并与之专一性结合, 将mRNA定位于核糖体上,从而启动翻译; 翻译起始密码子:以AUG;GUG或UUG作为翻译起始密码子; SD序列与翻译起始密码子之间的距离及碱基组成; 基因编码区5’ 端若干密码子的碱基序列。
C末端的丙氨酸交换下来,所形成的人胰岛素叔丁酯再用三氯乙酸脱
去叔丁酯基团,最终获得人胰岛素。该过程的总转化率为60%,工 艺路线耗时,分离纯化操作复杂,产品的价格不菲。
人胰岛素的生产方法
利用基因工程菌发酵生产人胰岛素
1982年,美国Ely LiLi公司首先使用重组大肠杆菌生产人胰岛素, 成为世界上第一个上市的基因工程药物;1987年,Novo公司又推出
A链和B链分别表达法
基因工程菌的构建战略: 化学合成A链 和B链的编码
Apr
tac
Met b-Gal Met A peptide Apr
tac
Met b-Gal Met B peptide
序列
ori
ori
M
M
M
M
N
C
N
C
重组人胰岛素的大肠杆菌工程菌的构建
A链和B链分别表达法
表达产物的后处理路线:
b-Gal
外源基因在原核细胞中的表达
现将真核基因在原核细胞中表达: 1、外源基因克隆在表达载体并导人宿主菌。
2、外源基因不能有间隔序列(内含子),因而必须用cDNA或全
大肠杆菌表达外源蛋白,在超声破碎的时候,用含有1%triton-

大肠杆菌表达外源蛋白,在超声破碎的时候,用含有1%triton-X-100的PBS悬浮,然后超声的效果较好,1%triton-X-100的作用还是很明显的,对其他的一些细菌同样起作用,比如链霉菌。
细菌沉淀直接加样品1buffer,再加5ul的巯基乙醇,混匀,离心,煮沸10min,直接上样,染色脱色步骤如下:将胶放入适量的染色液微波炉里加热1min(下次适当补点醋酸即可),将染色液换成大量的水(自来水即可)在微波炉煮10min 就可以。
在表达重组蛋白后超声波破碎细胞,采用冰浴,400w,破2s停1s,但是不一会就产生大量泡沫,影响了破碎功率,pbs和tris缓冲液都是这样,最后都是破碎不完全,而我的目的蛋白就在这些未破碎的细胞中。
1*会产生气泡是因为你的探头位置没放好。
探头一定要接近底部,约1cm(我一般是距底部0.5mm)。
功率根据仪器不同会有所不同,但你可以观察液面,有波动但不要太剧烈就好。
2*破3S停10S,破个二三十次看看。
3*变幅杆位置摆放也要注意,听声音如果不对的话就要及时调整。
另外可以从菌浓度方面考虑。
在破碎时试着加大体积,强度最好不要超过60%.4*尝试超8s停8s,对有些菌体蛋白来说,你的方法很难散热,导致蛋白变性产生气泡,最好停顿时间稍长一些,这种情况多见于包涵体形式的蛋白。
链霉菌(放线菌)超声破碎的,用的方法条件是什么?前处理一般就是配置成一定浓度的菌悬液。
使用超声破碎时采用的具体条件是:(1)取细菌的24 h培养液于5 000 r/min 下离心5 min收集菌体.(2)用pH 7.5的Na2HPO -NaH2PO 缓冲液洗涤3次,再用该缓冲液将菌体配成1:3的菌悬液.置于40 mL 大塑料试管内.(3)将大塑料试管置于冰浴中,采用超声波破碎(功率200 W,1/2”探头,破碎30 s,间歇30 S).(4)破碎液于12 000 r/min下高速冷冻离心30 min,收集细胞碎片和上清夜.超声破菌流程与上述基本一致,就是洗涤菌体也可以用预冷的生理盐水或pH8的Tris-HCl,洗涤一次就可以。
大肠杆菌表达

大肠杆菌表达
大肠杆菌(Escherichia coli)是一种常见的革兰氏阴性杆菌,广泛存在于自然环境中。
由于其易于培养和转化,大肠杆菌常被用作生物学研究中的模式生物。
在分子生物学研究中,大肠杆菌常被用来表达外源蛋白。
表达外源蛋白的方法包括利用质粒系统和细菌基因组定点插入等策略。
常见的质粒系统包括pUC、pET等。
表达外源蛋白时,通过将目标基因克隆到质粒载体中,然后将质粒转化到大肠杆菌中,使细菌可以表达目标蛋白。
通过添加适当的启动子、终止子和调控元件,可以调控外源蛋白的表达水平。
另一种方法是利用细菌基因组中的定点插入位点,将目标基因插入到细菌基因组中的某个位点,达到目标蛋白的表达。
这种方法可以实现对外源蛋白的稳定高效表达,但需要进行基因组工程操作。
大肠杆菌表达系统的优点包括生长快、易于培养、高表达水平等。
然而,由于大肠杆菌的内毒素产生,需要注意控制表达条件,以避免产生毒性影响。
基因工程考试题目整理

1.如何区分重组DNA和空载体自连:(一)检测方法(1)双抗性筛选:具有四环素和氨苄青霉素两种抗生素抗性基因作为选择标记,一种抗性标记用来正选择转化子,另一种通过插入失活而可以鉴定重组子。
Ori位于Amp+和tet+这两个基因之间,在四环素平板上出现的菌落一定是获得了质粒的转化子,在此基础上,如果四环素抗性转化子对氨苄青霉素敏感,则说明在载体中有外源片段的插入而使氨苄青霉素抗性失活,即重组子;若对氨苄青霉素有抗性,则此转化子的质粒是空载体。
(2)抗生素插入失活法:如BamHI可以从四环素位点切开,使该基因不能表达,但仍能表达氨苄抗性基因,对四环素是敏感的。
筛选重组pBR322 按照以下方法进行,将转化细胞培养于氨苄培养基中,只有转化细胞可以生长形成克隆,影印到四环素培养基上,不能在该培养基上生长的菌落可能就是目的克隆。
(3)限制性内切酶法:外源片段通过特定的酶切位点插入到载体上,因此,可以通过这些限制性酶酶切重组质粒,电泳分析插入片段长度是否正确。
(抗生素+酶切检测+测序)(4)蓝白斑筛选:多克隆位点存在于编码β-半乳糖苷酶的N端的DNA序列中,与pUC载体一起使用的宿主菌携带编码β-半乳糖苷酶的C端序列的基因片段。
通过α互补机制,两个片段在体内相互弥补,产生一个有活性的β-半乳糖苷酶。
以X-gal作为指示剂。
若通过插入外源DNA到多克隆位点中而打断了β-半乳糖苷酶的部分基因,不能产生有活性的β-半乳糖苷酶,X-gal不会反应,重组子菌落为白色,而自连空载体转化的菌落则是蓝色的。
(5)PCR法:如果已知插入DNA片段的某些序列,就可以通过PCR的方法进行鉴定(6)菌落原位杂交:把菌落或噬菌斑转移到硝酸纤维素膜上,然后溶菌,变性并固定DNA,最后用标记的DNA或RNA探针进行杂交来检测这些被转移的菌落或噬菌斑。
(7)测序法:若通过前面这些方法鉴定之后还是有疑虑,不知道是否阳性者确为真阳性而不是空载体自连,可以将其送到生物公司进行测序以最终确定之。
大肠杆菌分泌表达

大肠杆菌分泌表达
大肠杆菌分泌表达是指将外源蛋白质分泌到细胞外的一种技术。
在这种技术中,目标蛋白质被克隆到大肠杆菌的表达载体中,并在大肠杆菌中进行表达。
表达蛋白质通过信号肽靶向到分泌途径,在经过膜转运后被分泌到细胞外。
大肠杆菌分泌表达技术通常采用信号肽和融合蛋白的策略。
信号肽通常是由靶向蛋白质本身所携带的,可以将其加入到表达载体的N端,使其与表达蛋白一同进行转录和翻译。
融合蛋白则是将表达蛋白与信号肽以及其他蛋白质进行融合,以此提高表达蛋白的稳定性和可溶性。
大肠杆菌分泌表达技术具有高效、易于操作、成本低等优点。
但是,由于大肠杆菌的分泌途径比较复杂,分泌表达的蛋白质也容易被降解和失去生物活性。
因此,在进行大肠杆菌分泌表达时,需要针对不同的表达蛋白和分泌途径进行优化,以提高表达效率和蛋白质稳定性。
生物制药复习题(有答案)

生物制药复习题(有答案)《生物技术制药》习题(课后作业)一、下列概念:⑴生物制药:⑵生物药物:包括生物技术药物,天然生化药物,微生物药物,海洋药物和生物制品。
(3)生物技术制药:采用现代生物技术,借助某些微生物、植物、动物生产医药品。
(4)生物技术药物:采用DNA重组技术或其他生物新技术研制的蛋白质或核酸类药物。
(5)现代生物技术:以现代生命科学为基础, 把生物体系与工程学技术有机结合在一起,按照预先的设计,定向地在不同水平上改造生物遗传性状或加工生物原料, 产生对人类有用的新产品(或达到某种目的)之综合性科学技术。
(6)基因表达:⒈转录:在RNA聚合酶的催化下以DNA为模板合成mRNA的过程。
2、翻译:以mRNA为模板,tRNA作为运载工具,将活化的氨基酸在核糖体上合成蛋白质的过程(7)质粒的分裂不稳定:基因工程菌分裂时产生一定比例不含质粒的子代菌的现象,即重组分子从受体细胞中逃逸。
(8)质粒的结构不稳定:DNA从质粒上丢失或碱基重排、缺失所致工程菌性能的改变。
重组DNA分子某一区域发生变异,导致表观生物学功能的丧失;(9)显微注射:显微注射就是借助光学显微镜的放大作用,利用显微操作仪,直接把DNA注射到动物早期胚胎、胚胎干细胞、体细胞或卵母细胞中,然后生产动物个体的技术。
经过显微注射DNA发育而成的动物中,有少数整合了被注射的DNA分子,成为转基因动物。
(10)悬浮细胞:(11)补料分批培养:是指分批培养过程中,间歇或连续地补加新鲜培养基的培养方法。
(12)连续培养行下去的一种培养方法。
(13)接触抑制:细胞在生长分裂时达到相互接触而停止分裂的现象,称为接触性抑制(14)单克隆抗体:由一个抗原决定簇刺激的、单一的B细胞和骨髓瘤细胞融合增殖后所产生的、高度均一的抗体。
(15)多克隆抗体:一种抗原具有多个抗原决定簇,每个抗原决定簇都能刺激一个B细胞产生一种抗体。
这样所获得的免疫血清是多种抗体的混和物。
外源蛋白在大肠杆菌中的表达

外源蛋白在大肠杆菌中的表达
大肠杆菌是一种常见的细菌,广泛存在于自然界中。
它是一种重要的研究对象,因为它具有许多有用的特性,例如易于培养、生长速度快、遗传变异性高等。
在大肠杆菌中,外源蛋白的表达是一项重要的研究领域。
外源蛋白是指来自于其他生物体的蛋白质,它们可以通过基因工程技术被导入到大肠杆菌中进行表达。
这种技术可以用于生产各种重要的蛋白质,例如药物、酶、抗体等。
外源蛋白的表达需要通过转化、选择、培养等步骤来完成。
转化是指将外源DNA导入到大肠杆菌中的过程。
这可以通过化学方法、电穿孔、热激等方式来实现。
选择是指筛选出表达外源蛋白的细胞。
这可以通过添加抗生素、荧光素等物质来实现。
培养是指将筛选出的细胞进行培养,使其表达外源蛋白。
外源蛋白的表达可以通过多种方式来实现。
最常用的方法是利用质粒载体来表达外源蛋白。
质粒是一种小型的DNA分子,可以在大肠杆菌中自主复制。
质粒中可以携带外源DNA序列,使其在大肠杆菌中得到表达。
此外,还可以利用噬菌体载体、整合载体等方式来表达外源蛋白。
外源蛋白的表达不仅可以用于生产各种重要的蛋白质,还可以用于研究蛋白质的结构和功能。
例如,可以利用大肠杆菌表达外源蛋白
来研究其结构和功能,从而为药物研发提供重要的信息。
外源蛋白在大肠杆菌中的表达是一项重要的研究领域。
通过基因工程技术,可以实现外源蛋白的高效表达,为生产各种重要的蛋白质和研究蛋白质的结构和功能提供了重要的手段。
外源基因在大肠杆菌中高效表达的原理

Ptrp 除去色氨酸
Ptrp
Ptrp
Otrp 或加3-吲哚丙烯酸 (IAA) 高效转录
Otrp 高效转录
Otrp
启动子的可控性
启动子
l噬菌体启动子PlL的可控性:
噬菌体启动子PL受CI阻遏蛋白阻 遏,很难直接诱导控制。在基因
Ptrp
工程中常使用温度敏感型的cI突
变基因cI857控制PL。 cI857阻遏蛋 在42℃时失活脱落,PL便可介导 目的基因的表达。但在大型细菌
目前广泛用于外源基因表达的大肠杆菌表达型质粒上,均含有 与启动子来源相同的核糖体结合位点序列,序列和间隔是最佳的
密码子
生物体对密码子的偏爱性
不同的生物,甚至同种生物不同的蛋白质编码基因,对简并密码 子使用频率并不相同,具有一定的偏爱性,其决定因素是:
生物基因组中的碱基含量 在富含AT的生物(如单链DNA噬菌体 fX174)基因组中,密码子第三位上的U和A出现的频率较高;而在GC 丰富的生物(如链霉菌)基因组中,第三位上含有G或C的简并密码子 占90%以上的绝对优势
子量又较大的外源基因而言,则选择相关tRNA编码基因同步克隆表达 的策略较为有利。例如,在人尿激酶原cDNA的412个密码子中,共含 有22个精氨酸密码子,其中7个AGG、2个AGA,而大肠杆菌受体细胞 中tRNAAGG和tRNAAGA的丰度较低。为了提高人尿激酶原cDNA在大肠 杆菌中的高效表达,将大肠杆菌的这两个tRNA编码基因克隆在另一个 高表达的质粒上。由此构建的大肠杆菌双质粒系统有效地解除了受体 细胞对外源基因高效表达的制约作用
ori
筛选Apr、Tcs的转化子
核糖体结合位点
外源基因在大肠杆菌细胞中的高效表达不仅取决于转录启动的 频率,而且在很大程度上还与mRNA的翻译起始效率密切相关。大 肠杆菌细胞中结构不同的mRNA分子具有不同的翻译效率,它们之 间的差别有时可高达数百倍。mRNA翻译的起始效率主要由其5‘ 端的结构序列所决定,称为核糖体结合位点(RBS)
大肠杆菌基因表达系统

必须用cDNA或者是化学合成的基因。 外源基因不能带有内含子。
除了具备克隆载体具备的条件外,还应具备以下条件: 强启动子、强转录终止子 可诱导性 合适的核糖体结合位点和起始密码ATG等
理想原核表达载体具备的基本特征
1
2
5
4
3
A dividing E. coli
原核或噬菌体启动子
MCS
SD序列
终止子
条件:
组成结构:
必须选择一个有lacI的宿主菌。
tac P
Lac O
S导物: IPTG(乳糖的类似物,不会被降解)
阻遏物
IPTG
2.分泌型表达载体
如:pIN III系列: 载体表达出的外源蛋白质与细菌的分泌信号肽连在一起,可被宿主菌分泌到细胞周质中。 pIN III-A1, pIN III-A2, pIN III-A3,
EcoR I
BamH I
凝血酶
Ile Giu Gly Arg Gly Ile Pro Gly Asn Ser Ser
EcoR I
BamH I
Xa因子
pGEX-3X的插入区:
Sma I
Sma I
其他融合蛋白系统
His-tag能与Ni2+柱结合,但很容易被EDTA(或咪唑溶液)洗脱下来,可以纯化蛋白质。
细胞质
外膜
内膜
周间质
质粒
染色体
“外排”: 蛋白质从细胞质跨过内外膜到培养液中。 “分泌”: 蛋白质从细胞质跨过内膜到周间质中。
01
碱性氨基酸
Leu、Ile
Arg、Lys
02
N
04
疏水氨基酸核心区
07
AlaGlySer
外源蛋白在大肠杆菌中的表达

外源蛋白在大肠杆菌中的表达一、引言外源蛋白是指不属于宿主生物体自身的蛋白质,通常是由其他生物体合成的蛋白质。
在大肠杆菌中表达外源蛋白已经成为了基因工程和生物技术领域中的一个重要研究方向。
本文将从大肠杆菌表达外源蛋白的原理、方法、策略等方面进行详细阐述。
二、原理1. 大肠杆菌表达系统原理大肠杆菌表达系统是指利用大肠杆菌作为宿主细胞,通过转化外源DNA进入细胞,使其在细胞内得到表达并产生相应的蛋白质。
这个系统包括三个部分:载体、宿主细胞和诱导剂。
2. 质粒载体质粒载体是指一种环状DNA分子,可以携带外源DNA序列并在大肠杆菌中进行复制和表达。
常用的载体有pUC19、pET28a等。
3. 宿主细胞宿主细胞是指被转化了质粒载体的大肠杆菌细胞。
常用的宿主细胞有BL21(DE3)等。
4. 诱导剂诱导剂是指在宿主细胞中引发表达外源蛋白的物质。
常用的诱导剂有IPTG、L-arabinose等。
三、方法1. 克隆外源DNA序列到质粒载体中将外源DNA序列克隆到质粒载体中,形成表达载体。
常用的方法有限制性酶切和连接法、PCR扩增法等。
2. 将表达载体转化到宿主细胞中将表达载体通过热激转化或电转化等方法导入到宿主细胞中,使其在细胞内进行复制和表达。
3. 选择正常表达的克隆通过筛选,选择出正常表达目标蛋白的克隆。
常用的筛选方法有PCR 检测、Western blotting等。
4. 诱导表达目标蛋白在选定的克隆中加入适量的诱导剂,使其开始表达目标蛋白。
通常在温度、时间、浓度等方面进行调节,以得到最佳效果。
四、策略1. 选择合适的载体和宿主细胞根据需要表达的外源蛋白的不同,选择适合的载体和宿主细胞。
例如,如果需要表达带有His标签的蛋白质,可以选择pET28a载体和BL21(DE3)宿主细胞。
2. 优化表达条件通过调节温度、时间、浓度等参数来优化表达条件,以提高目标蛋白的表达量和纯度。
3. 联合表达将多个外源蛋白基因克隆到同一个载体中,使其在同一宿主细胞中进行联合表达。
大肠杆菌表达原理(很好)

E.Coli (CE6)
T7 启动子
目的基因
热诱导
T7 RNA 聚合酶
PL 启动子 T7 RNA 聚合酶基因
cI857
T7 表达系统
转录调控的机理 双质粒系统 一个质粒带有 T7 RNA 聚合酶 基因,另一个质粒带有 T7 启 动子和目的基因
对宿主菌的要求
用溶源化 l 噬菌体的大肠杆菌作 PL、PR 启动子表达载体的宿主菌
N4830-1,POP2136 等菌株已经溶源化 cI 857(ts) l 噬菌体, 可用作表达外源基因时的宿主菌。 把 cI 857(ts) 基因组装在表达载体上 宿主菌选择范围更大
PL 和 PR 表达系统存在的问题
外源基因在大肠杆菌中的表达
外源基因在大肠杆菌中的表达
大肠杆菌作为表达外源基因受体菌的特征
大肠杆菌表达外源基因的优势 全基因组测序,共有4405个开放型阅读框架 基因克隆表达系统成熟完善 繁殖迅速、培养简单、操作方便、遗传稳定 被美国FDA批准为安全的基因工程受体生物
外源基因在大肠杆菌中的表达
大肠杆菌作为表达外源基因受体菌的特征
整合到染色体后,均能使 lac 和 tac 启动子的转录受到温度严紧调控 在较低温度(30℃)时抑制,在较高温度(42℃)时开放。
用乳糖替代 IPTG 诱导 lac 和 tac 启动子的转录 乳糖在 b-半乳糖苷酶作用下生成异乳糖,异乳糖具有诱导剂的作用 这一过程涉及乳糖的转运和转化,其效率受到多种因素的影响和制约 因此乳糖诱导的有效剂量大大高于IPTG。 乳糖本身作为一种碳源可以被大肠杆菌代谢利用,较多的乳糖存在也 会导致菌体生理及生长特性变化。乳糖替代 lPTG 作为诱导剂的研究 要与发酵工艺结合起来,才能显示其良好的前景。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
基 因 库 非盈利性基因、菌种保藏中心 基因酷保藏中心资源共享专区 基 因 酷 学术科研、人才项目交流平台 实验技术交流、基础实验专题区 在大肠杆菌中高效表达外源蛋白的策略赵军 侯云德(病毒基因工程国家重点实验室 100052 北京)本世纪60至70年代对大肠杆菌的研究使之成为自然界中最普遍为人们所认识的生物体。
大肠杆菌具有两个显著特征:操作简单和能在廉价的培养基中高密度培养,它的这些特征加上十多年外源基因表达的经验使其在大多数科研应用中成为高效表达异源蛋白最常用的原核表达系统。
尽管大肠杆菌有众多的优点,但并非每一种基因都能在其中有效表达。
这归因于每种基因都有其独特的结构、mRNA 的稳定性和翻译效率、蛋白质折叠的难易程度、宿主细胞蛋白酶对蛋白质的降解、外源基因和E.coli 在密码子利用上的主要差别以及蛋白质对宿主的潜在毒性等等。
但知识的大量积累还是有助于为表达方面某些特定的困难提供一般的解决方法。
大肠杆菌作为表达系统的主要障碍包括:不能象真核蛋白那样进行翻译后修饰、缺乏将蛋白质有效释放到培养基中的分泌机制和充分形成二硫键的能力。
另一方面,许多真核蛋白在非糖基化的形式下能保留其生物学活性,因而也就可以用大肠杆菌来表达。
如何实现外源基因在原核细胞中的有效表达,自60年代以来,对影响外源基因在其表达体系中表达效率的各个因素作了大量实验研究,并有多篇归纳性综述发表[1,2,3]。
国内针对外源基因在原核细胞中高效表达的关键因素,构建了高效表达载体[4],并在此基础上成功表达了一系列细胞因子的基因[5,6,7]。
我们在分析了国内外有关在原核系统中表达蛋白的实验资料的基础上,对在大肠杆菌中高效表达外源蛋白的策略所涉及的内容进行全面的总结,以期有助于我国在这方面的研究。
有效表达载体的构型构建表达质粒需要多种元件,需要仔细考虑它们的组合,以保证最高水平的蛋白质合成。
E.coli 表达载体的基本结构如图1所示[8]。
RBSPR -35 -10 SD coding sequence TT Tet OrimRNA 5' UAAGGAGG(N)8 AUG(91%)16S rRNA 3'HO AUUCCUCC GUG(8%)UUG(1%)启动子(以杂和的tac 启动子为例)位于核糖体结合位点(RBS )上游10-100bp 处,由的启动子由位于转录起始位点上游约35bp的六核苷酸序列(-35区)和一短序列隔开的另一六核苷酸序列(-10区)组成[9,10,11]。
有许多启动子可用于在E.coli中的基因表达,包括来源于革兰氏阳性菌和噬菌体的启动子。
理想的启动子具有以下特性:作用强;可以严格调控;容易转导入其他E.coli以便筛选大量的用于生产蛋白的菌株,而且对其诱导是简便和廉价的[12]。
在启动子下游是RBS,其跨度约为54个核苷酸,两端限定在 -35(±2)和mRNA 编码序列的+19到+22之间[13]。
Shine-Dalgarno(SD)位点[14,15]在翻译起始阶段与16S rRNA的3'端相互作用[16]。
SD与起始密码子间的距离约为5-13bp[17],而且此区的序列在mRNA转录物中应避免出现二级结构,否则将会降低翻译起始的效率[18]。
在RBS的5'和3'端均为A丰富区[19]。
转录终止子位于编码序列的下游,作为转录终止的信号[20]和组成发卡结构的保护性元件,阻止核酸外切酶对mRNA的降解,从而延长mRNA的半衰期[21]。
除了上述对基因表达的效率有直接影响的元件以外,载体还含有抗生素抗性基因,以方便质粒的筛选和传代。
氨苄青霉素是最常用的抗性标记。
但在生产人用治疗性蛋白时,最好选择其他抗性标记(如Tet)以避免可能发生的过敏反应[22]。
质粒的拷贝数由复制起点决定。
在特殊情况下,选用失控复制子能够获得大量的质粒拷贝数和较高产量的质粒编码蛋白[23,24]。
但在另外一些情况下,选用超过pBR322的高拷贝质粒似乎并没有好处。
而且已有资料表明,增加质粒的拷贝数降低E.coli中胰酶的产量,在高拷贝质粒中,强启动子的存在严重影响了细胞的活性[25,26]。
转录水平调控1.启动子能在E.coli中发挥作用的启动子很多。
这些启动子必须具有适合高水平蛋白质合成的某些特性。
首先启动子的作用要强,待表达基因的产物要占或超过菌体总蛋白的的10-30%;第二,它必须表现最低水平的基础转录活性。
若要求大量的基因表达,最好选用高密度培养细胞和表现最低活性的可诱导和非抑制启动子。
如果所表达的蛋白具有毒性或限制宿主细胞的生长,选用可抑制的启动子则至关重要[27,28]。
例如,轮状病毒的VP7蛋白能有效地杀死细胞,因此必须在严格控制的条件下表达[29]。
但在某些情况下,启动子的严格性并不合理,因为即使最小量的基因产物也能由于其毒性而杀死细胞。
如能灭活核糖体或破坏膜渗透压的分子对细胞来说是致死性的[30]。
对宿主的毒性并不仅限于外源基因,某种自身蛋白的过量表达也能造成同样的结果。
如编码外膜磷脂蛋白的tra T基因[31]。
另外,不完全抑制的表达系统会造成质粒的不稳定,细胞生长速度的下降和重组蛋白产量的降低[32,33]。
Lanzer和Bujard 曾对常用的lac启动子-操纵子系统进行了广泛的研究,证明操纵子放在启动子序列的不同位置会造成70倍差异的抑制。
将17bp的操纵子置于-10和-35六聚体区之间所形成的抑制比将其放在-35区的上游或-10区的下游要高50-70倍[34]。
启动子的第三个特性是其简便和廉价的可诱导性。
大量生产蛋白质最常用的启动子是热诱导(λP L)和化学诱导(trp)启动子。
异丙基硫代-β-D-半乳糖苷(IPTG)诱导的杂交启动子tac[35]或trc[36]都是强启动子,在基础研究中应用很广。
但在大量生产人用治疗性蛋白时用IPTG做诱导剂是不可取的,因为IPTG具有毒性而且价格昂贵[37]。
IPTG的这些不足至今仍限制tac或trc强启动子在大量生产人用治疗性蛋白中的应用。
编码热敏lac阻遏蛋白[38]的突变lacI(Ts)基因的出现使得目前能够对这些启动子进行热诱导[39,40]。
另外,还出现了一些新型载体,它们允许在30℃对trc启动子进行严紧调节。
最近还报道了两种不同的lac阻遏蛋白突变体,能够同时允许热诱导和IPTG诱导[41,42]。
尽管野生型lacI基因也能热诱导,但不能对其进行严紧型调节,基因库非盈利性基因、菌种保藏中心基因酷保藏中心资源共享专区基因酷学术科研、人才项目交流平台实验技术交流、基础实验专题区性抑制[43]。
因此,该系统只能用用于生产对宿主菌无害的一些蛋白。
冷反应启动子尽管不象其他启动子那样得到广泛的研究,但已经被证明能在低温条件下进行有效的基因表达。
噬菌体λP L启动子的活性在20℃时最高,随着温度的升高,其活性逐渐降低[44]。
P L启动子的冷反应由E.coli整合宿主因子,一种与DNA结合的序列特异性多功能蛋白来正调控[45,46]。
主要冷应激基因cspA启动子同样也被证明在低温具有活性[47]。
对cspA和P L启动子进行分子剖析,鉴定了在较低温度下参与增强转录的特异性DNA区域。
从而开发了一系列在20℃低温具有高活性的P L衍生启动子[48]。
选用冷反应启动子的基本原理是在15-20℃的条件下,蛋白质的折叠速度只受到轻微的影响,而作为生物化学反应,转录和翻译的速度将被充分降低。
这就为蛋白质折叠、产生有活性的蛋白和避免非活性蛋白聚合体即包涵体的形成提供了充足的时间,而目的蛋白的最终产量并未减少。
最近新报道的一些启动子具有诸多诱人之处,为选择新的高效表达系统提供了方便。
如非常强的pH启动子[49,50],重组蛋白的产量可达总蛋白的40-50%[51]。
但表达的水平会因不同的基因而有差异。
因为蛋白质的合成不仅依赖于启动子的强弱,而且有赖于转录的效率。
人们通常只考虑E.coli启动子的核心区域,即-10和-35六核苷酸区和一15-19bp的间隔序列。
但有人提出核心序列以外的元件也能刺激启动子的活性[52]。
许多研究也已证明,核心启动子上游的序列能够在体内提高转录起始的效率[53,54,55]。
Gourse等证明,位于E.coli rRNA启动子rrnB P1 -35区上游的DNA序列即UP元件,能够在体内和体外提高转录效率30倍[56]。
UP元件是作为一个独立的启动子组件发挥作用的,因为将其融合到其他启动子如lacUV5中也能刺激转录[57,58]。
UP元件与其他启动子融合所表现的这种转录增强子效应,使其有望通用于高效表达系统。
尽管已经证明rRNA启动子P1、P2的超强能力[59],但它们仍未被用于E.coli进行高水平表达,其主要原因是难以对其进行调控。
rRNA的体内合成从属于细胞增殖速度的控制。
在细胞快速增殖期,P1和P2是活化的,当细胞处于生长的静息期,则P1、P2被负调节。
因此,rRNA启动子在前诱导期将持续活化。
在体内快速增殖的细胞中,P2的活性很弱,而且可诱导性差,但若与P1分开,P2启动子的活性明显升高(达到P1的70%),且对应激反应敏感。
这表明在天然的串联体中,P2是部分关闭的[60]。
Brosius和Holy[61]将lac操纵子序列插入到rrnB rRNA P2启动子的下游,在带有lac Iq基因的菌株中成功地抑制了P2的活性。
转录活性是以氯霉素乙酰转移酶的产生和4.5s RNA的表达为标准的。
然而,P2构建体的活性只相当于tac启动子活性的1/2,而且当rrnB P1启动子被置于P2启动子下游时,不能完全抑制转录。
有人试图利用反转启动子的方向来严格调控rRNA启动子。
将rRNA启动子克隆于目的基因的上游,但转录方向相反。
利用λ整合位点和可调控的λ整合酶来实现启动子的反转,从而达到进行诱导的目的,而且,在高度活化的启动子上游有一强转录终止子将避免在前诱导期可能出现的载体的不稳定性。
2.转录终止子在原核生物中,转录终止有两种不同的机制。
一种是依赖六聚体蛋白rho的rho依赖性转录终止,rho蛋白能使新生RNA转录本从模板解离。
另一种是rho非依赖性转录终止,它特异性依赖于模板上编码的信号,即在新生RNA中形成发卡结构的一回文序列区,和位于该回文序列下游4-9bp处的dA、dT富含区[62,63]。
虽然转录终止子在表达质粒的构建过程中常被忽略,但有效的转录终止子是表达载体必不可少的元件,因为它们具有极其重要的作用。
贯穿启动子的转录将抑制启动子的功能,造成所谓的启动子封堵[64]。
这种效应可以通过在编码序列下游的适当位置放置一转录终止子,阻止转录贯穿别的启动子来避免。
