必修一1.2.2平均摩尔质量&十字交叉法
高中化学必修一1.2物质的量-知识点
小初高个性化辅导,助你提升学习力! 1 高中化学必修一1.2物质的量-知识点
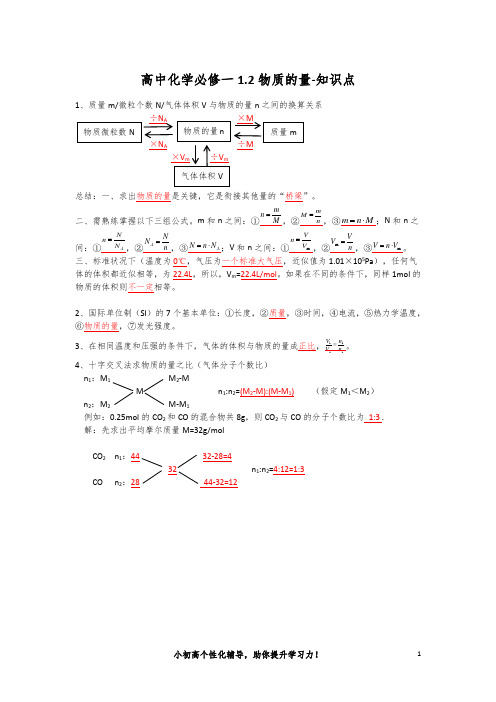
1、质量m/微粒个数N/气体体积V 与物质的量n 之间的换算关系
×N A ÷M
总结:一、求出物质的量是关键,它是衔接其他量的“桥梁”。
二、需熟练掌握以下三组公式。
m 和n 之间:①
M m n =,②n m M =,③M n m ⋅=;N 和n 之间:①A N N n =,②n N N A =,③A N n N ⋅=;V 和n 之间:①m V V n =,②n V V =m ,③m V n V ⋅=。
三、标准状况下(温度为0℃,气压为一个标准大气压,近似值为1.01×105Pa ),任何气体的体积都近似相等,为22.4L ,所以,V m =22.4L/mol 。
如果在不同的条件下,同样1mol 的物质的体积则不一定相等。
2、国际单位制(SI )的7个基本单位:①长度,②质量,③时间,④电流,⑤热力学温度,⑥物质的量,⑦发光强度。
3、在相同温度和压强的条件下,气体的体积与物质的量成正比,21
21n n V V =。
4、十字交叉法求物质的量之比(气体分子个数比)
n 1:M 1 M 2-M
M n 1:n 2=(M 2-M):(M-M 1) (假定M 1<M 2)
n 2:M 2 M-M 1
例如:0.25mol 的CO 2和CO 的混合物共8g ,则CO 2与CO 的分子个数比为 1:3 .
解:先求出平均摩尔质量M=32g/mol
CO 2 n 1 32-28=4
n 1:n 2=4:12=1:3
CO n 2:28 44-32=12。
高一化学必修一讲义:阿伏加德罗定律及平均摩尔质量的计算

阿伏加德罗定律及平均摩尔质量的计算【教学目标】1、掌握阿伏加德罗定律及其重要推论2、掌握阿伏加德罗定律及其相关计算【知识梳理】一、阿伏加德罗定律1、定律内容:同温同压下,相同体积的任何气体都含有相同的分子数2、理想气体的状态方程:pV =nRT[其中:p 为气体压强,V 为气体体积,n 为物质的量,R 为常数,T 为温度(单位为开尔文,符号是K)] 由理想气体的状态方程结合物质的量的相关公式可以推出:RT M mnRT PV ==【微点拨】①阿伏加德罗定律适用于任何气体,包括混合气体,不适用于非气体②同温、同压、同体积、同分子数,共同存在,相互制约,且“三同定一同”③标准状况下的气体摩尔体积是阿伏加德罗定律的一个特例④是分子不是原子⑤同温同压下,相同体积的任何气体含有相同物质的量的分子【即学即练1】1、在同温同压下,同体积的氢气和甲烷,它们的分子数之比是( );原子数之比是( );物质的量之比( ); 质量之比( )A .2:5B .1:1C .1:5D .1:82、同温同压下,同体积的下列气体,质量最大的是( )A .NH 3B .SO 2C .CH 4D .H 2二、阿伏伽德罗定律的推论 (可通过pV =nRT 及n =m M 、ρ=m V 导出)1、体积之比(1)语言叙述:同温同压下,气体的体积之比等于其物质的量之比,也等于其分子数之比(2)公式:V 1V 2=n 1n 2=N 1N 2(3)应用:比较相同条件(同温同压)下,如:0.3 mol H 2和0.2 mol CH 4①比较气体体积的大小可以直接比较物质的量的大小:V( H 2)>V(CH 4)②求体积比可以转化为求物质的量之比:V( H 2):V(CH 4)=0.3:0.2=3:2 ③求体积分数可以转化为求物质的量分数:%60%1002.03.03.02=⨯+=的体积分数H2、压强之比(1)语言叙述:同温同体积时,气体的压强之比等于其物质的量之比,也等于其分子数之比(2)公式:p 1p 2=n1n 2=N 1N 23、密度之比(1)语言叙述:同温同压下,气体的密度之比等于其摩尔质量之比,也等于其相对分子质量之比(2)公式:ρ1ρ2=M 1M 2(3)应用:比较相同条件(同温同压下),气体的密度相对大小4、质量之比(1)语言叙述:同温同压下,同体积的气体的质量之比等于其摩尔质量之比,也等于其相对分子质量之比(2)公式:m 1m 2=M 1M 2【即学即练2】1、同温同压下,同质量的下列气体,体积最大的( )A .NH 3B .SO 2C .CH 4D .H 22、在标准状况下,所占体积最大的是( )A .98g H 2SO 4B .6.02×1023个N 2分子C .44.8L HClD .6g H 23、下列各组物质中,所含分子数一定相同的是( )A .1g H 2和8 gO 2B .0.1mol HCl 和2.24 L HeC .150℃,1.01×105Pa 时,18LH 2O 和18LCO 2D .常温常压下28gCO 和6.02×1022个CO 分子4、(多选)关于m g H 2和n g He 的下列说法中,正确的是( )A .同温同压下,H 2与He 的体积比为m ∶2nB .同温同压下,若m=n ,则H 2与He 的分子数之比为2∶1C .同温同压下,同体积时,H 2与He 的质量比n m >1 D .同温同压下,H 2与He 的密度比为1∶2 5、标准状况下,m g A 气体与n g B 气体分子数相等,下列说法不正确的是( )A .标准状况下,同体积的气体A 和气体B 的质量比为m ∶nB .25 ℃时,1 kg 气体A 与1 kg 气体B 的分子数之比为n ∶mC .同温同压下,气体A 与气体B 的密度之比为m ∶nD .标准状况下,等质量的A 与B 的体积比为m ∶n6、同温同压下,下列气体的密度最大的是( )A .F 2B .Cl 2C .HClD .CO 2二、混合气体的平均摩尔质量(M )或平均相对分子质量1、混合气体的平均摩尔质量:总总n m M = 2、求混合气体的平均摩尔质量的方法 (1)混合气体的平均摩尔质量:总总n m M =(2)根据混合气体中各组分的物质的量分数或体积分数求混合气体的平均摩尔质量①M =m (总)n (总)=M 1n 1+M 2n 2+…+M i n i n (总)=M 1a 1%+M 2a 2%+…+M i a i % 其中a i %=n i n (总)×100%,是混合气体中某一组分的物质的量分数。
【人教版】高中化学必修一:1.2.1《物质的量的单位——摩尔》ppt课件

-18-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
知识点1 知识点2 知识点3
Z 知识梳理 HISHI SHULI
象是微观粒子,如原子、分子、离子、中子、质子、电子,也可以 是这些粒子的特定组合,而不能指宏观物体,因此“1 mol鸡蛋”说法 错误。在用“mol”时,要指明粒子的种类,如“1 mol O”表示1 mol氧原 子,“1 mol O2”表示1 mol氧气分子,“1 mol O2-”表示1 mol氧离子,而 不能说“1 mol氧”,因为这里的氧指代不明确。
1
1
联 系
摩尔质量以 g·mol-1 为单位时,在数值上等于其相对分子质量 或相对原子质量;混合物组成一定时,1 mol 混合物的质量在数 值上等于该混合物的平均相对分子质量
-13-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
-11-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
D典例透析 IANLI TOUXI
粒特的别质提量醒(m()1:m)已=知������������A阿; 同伏理加,德若罗已常知数m(、NAN)A和,则摩M尔=质m·量NA(。M),则一个微 (2)高中化学计算主要是以物质的量为中心的计算,学习中要养成
-15-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
2018学年高一化学人教版必修1第1.2.2 气体摩尔体积 含

绝密★启用前人教版必修一第一章第二节第二课时气体摩尔体积一、选择题1.下列有关物理量相应的单位表达错误的是()A. 摩尔质量g/molB. 气体摩尔体积L/molC. 溶解度g/100gD. 密度g/cm32.下列说法正确的是()A.1 mol任何气体的体积都是22.4 LB.在标准状况下,某气体的体积为22.4 L,则该气体的物质的量为1 mol,所含的分子数目约为6.02×1023C.当温度高于0 ℃时,一定量任何气体的体积都大于22.4 LD.当压强大于101 kPa时,1 mol任何气体的体积都小于22.4 L3.标准状况下,下列物质占体积最大的是()A.98 g H2SO4B.6.02×1023个CO2C.44.8 L HCl D.6 g H24.空气可近似认为N2和O2按体积比为4∶1组成的混合气体,则空气的平均相对分子质量约为()A.28 B.29 C.32 D.605.下列各组物质中,所含分子数一定相同的是()A.1 g H2和8 g O2B.0.1 mol HCl和2.24 L HeC.150 ℃、1.01×105 Pa时,18 L H2O和18 L CO2D.常温常压下,28 g CO和6.02×1022个CO分子6.在同温、同压下,A容器中的氧气和B容器中的氨气所含的原子个数相同,则A、B两容器中气体体积之比为()A.1∶2 B.2∶1 C.2∶3 D.3∶27.(双选题)关于m g H2和n g He的下列说法正确的是()A.同温同压下,H2和He的体积比为m∶2nB.同温同压下,若m=n,则H2与He的物质的量比为2∶1C.体积相同时,He的质量一定大于H2D.同温同压下,若二者的物质的量相等,其体积也相等8.某物质在一定条件下加热分解,产物都是气体。
分解方程式为:2A B+2C+2D。
测得生成的混合气体的平均相对分子质量为2a,则A的相对分子质量为()A.7a B.5a C.2.5a D.2a9.下列叙述正确的是()A.一定温度、压强下,气体体积由其分子的大小决定B.一定温度、压强下,气体体积由气体的物质的量的多少决定C.气体摩尔体积是指1 mol 任何气体所占的体积为22.4 LD.不同的气体,若体积不等,则它们所含的分子数一定不相等10.在两个容积相同的容器中,一个盛装氯化氢气体,另一个盛装氢气和氯气的混合气体。
1.2.1 物质的量的单位——摩尔-2020-2021学年高一化学同步课堂帮帮帮(人教版必修1)

第一章从实验学化学第二节化学计量在实验中的应用第1课时物质的量的单位——摩尔一、物质的量及其单位1.物质的量(1)概念:表示___________________________的物理量。
(2)符号:_________。
(3)单位:_________。
2.摩尔——物质的量的单位(1)标准:1 mol粒子集体所含的粒子数与0.012 kg 12C中所含的碳原子数相同,约为_______。
(2)符号:_________。
(3)计量对象:分子、原子、离子、原子团、电子、质子、中子等微观粒子。
3.阿伏加德罗常数(1)概念:_________任何粒子的粒子数。
(2)符号:_________。
(3)数值及单位:__________________。
4.物质的量、阿伏加德罗常数与粒子数间的关系:____________________________________。
二、摩尔质量【答案】一、1.(1)含有一定数目粒子的集合体(2)n(3)摩尔2.(1)6.02×1023(2)mol3.(1)1 mol(2)N A(3)6.02×1023 mol −14.n =AN N 或N = n ×N A 二、单位物质的量 M g/mol g·mol −1 相对原子质量 相对分子质量 n =m M或m = n ×M一、物质的量与摩尔质量的应用1.注意事项(1)物质的量:“物质的量”四个字是一个整体,不能拆开,也不能添或减字,如不能说成“物质量”或“物质的数量”等。
(2)摩尔质量。
①适用于任何一种微观粒子。
②纯净物和混合物都有摩尔质量,混合物的摩尔质量一般称为平均摩尔质量2.物质的量和摩尔质量的认识误区(1)误认为物质的量适用于所有物质。
物质的量只用于表示分子、原子、离子、质子、中子、电子等微观粒子的多少,不能用于表示宏观物质的数量,使用“摩尔”表示物质的量时,首先必须弄清物质所含微粒的种类,而摩尔只是它的单位。
2020—2021学年高中化学人教版必修一对点复习1.2.2气体摩尔体积

2020—2021学年高中化学人教版必修一对点复习1.2.2气体摩尔体积1.决定气体体积的因素:①气体分子的直径、②气体的物质的量多少、③气体分子间的平均距离、④气体分子的相对分子质量,则决定气体体积的因素主要为( )A.①②B.①③C.②③D.②④2.448mL某气体在标准状况下的质量为1.28g,该气体的摩尔质量约为( ) A.64g B.128g/mol C.64g/mol D.32g/mol3.在一定温度和压强下,8.8 g CO2的体积为4.9 L,则在该温度和压强下的气体摩尔体积为( )A.4.9 L/molB.22.4 L/molC.49 L/molD.24.5 L/mol4.1mol下列物质在标准状况下体积为22.4L的是( )A.水蒸气B.二氧化碳气体C.三氧化硫气体D.溴蒸气5.三种气体X、Y、Z的相对分子质量关系为()()()M X<M Y=0.5M Z,下列r r r说法正确的是()A.原子数目相等的三种气体,质量最大的是ZB.相同条件下,同质量的三种气体,气体密度最小的是XC.若一定条件下,三种气体体积均为2.24L,则它们的物质的量一定均为0.1molD.同温下,体积相同的两容器分别充入2g Y 气体和1g Z 气体,则其压强比为2:16.下列叙述正确的是( )A.—定温度、压强下,气体体积由其分子的大小决定B.—定温度、压强下,气体体积由气体的物质的量的多少决定C.气体摩尔体积是指1mol 任何气体所占的体积为22.4LD.不同的气体,若体积相等,则它们所含的分子数一定相等7.在标准状况下,如果2.8L 氧气含有n 个氧原子,则阿伏加德罗常数可表示为( ) A .4nB .16n C .8nD .8n8.下列叙述正确的是( ) A.1.5mol 2O 体积是33.6LB.在标准状况下,2mol 2H 的体积是44.8LC.不同的气体,若体积不同,则它们所含的分子数也不同D.32g 2O 的物质的量是1mol,其体积是22.4L9.体积相等的气体,在同温、同压下瓶内气体的关系一定正确的是( )A.原子数相等B.密度相等C.质量相等 D.摩尔质量相等10.下列条件下,两瓶气体所含原子数一定相等的是( )A.同质量、同体积的N2和COB.同温度、同体积的H2和N2C.同体积、同密度的C2H4和C3H4D.同压强、同体积的N2O和CO211.同温同压下,向两个体积可变的密闭容器中分别充满等质量的O、3O气2体,下列说法正确的是( )A.两气体的物质的量之比为3:2B.两个容器的体积之比为2:3C.两种气体的分子数目相等D.两种气体的密度之比是3:212.下列各组中,两种气体的分子数一定相等的是( )A. 温度相同、体积相同的O2和N2B. 体积相等、密度不等的CO和C2H4C. 质量相等、密度不等的N2和C2H4D. 压强相同、体积相同的N2和O213.下列一定量的各物质所含原子个数按由大到小的顺序排列的是( )①0.5mol氨气②标准状况下22.4L氦气③4 ℃时9mL水④0.2mol磷酸A.①④③②B.④③②①C.②③④①D.①④②③14.在同温下,在体积相同的两个密闭容器中,充入等质量的2CO 与2SO 气体,则下列说法正确的是( ) A .2CO 与2SO 的物质的量相等B .2CO 与2SO 的密度之比为11:16C .2CO 与2SO 的压强之比为16:11D .2CO 与2SO 中所含O 原子个数之比为1:115.在三个密闭容器中分别充入Ne 、H 2、O 2三种气体,在以下各种情况下排序正确的是 ( )A.当它们的体积、温度和压强均相同时,三种气体的密度22(H )(Ne)(O )ρρρ>>B.当它们的温度和密度都相同时,三种气体的压强P (H 2)>P (Ne)>P (O 2)C.当它们的质量、温度和压强均相同时,三种气体的体积V (O 2)>V (Ne)>V (H 2)D.当它们的压强、体积和温度均相同时,三种气体的质量m (H 2)>m (Ne)>m (O 2)16.下列条件下,两瓶气体所含原子的数目一定相等的是( ) ①同质量、不同密度的N 2和CO ②同温度、同体积的H 2和N 2③同体积、同密度的C 2H 4和C 3H 6两种气体 ④同压强、同体积的N 2O 和CO 2两种气体 A.①③B.②C.②③D.②④17.下列说法正确的是( )A.在25 ℃、1.01×105Pa 的条件下,2.24L H 2中含有的分子数小于0.1N AB.1L 1mol•L -1的CaCl 2溶液中含Cl -的数目为N AC.在标准状况下,22.4L H 2O 的质量约为18gD.22g CO 2与标准状况下11.2L H 2O 含有相同的分子数 18.下列叙述中正确的是( )①在标准状况下,0.2mol 任何物质的体积均为4.48L ②当1mol 气体的体积为22.4L 时,它一定处于标准状况下 ③标准状况下,1L HCl 和1L 2H O 的物质的量相同 ④标准状况下,1g 2H 和14g 2N 的体积相同 ⑤28g CO 的体积为22.4L⑥同温同压下,气体的密度与气体的相对分子质量成正比 A.①②③④ B.②③⑥ C.⑤⑥ D.④⑥19.在标准状况下有:①6.72L 4CH ;②233.0110 个氯化氢分子;③13.6g 硫B 化氢;④0.2mol 3NH 。
苏教版高中化学必修1教学设计1:1.2.2 气体摩尔体积

专题1 物质的分类及计量第二单元物质的化学计量第2课时气体摩尔体积教学目标1.知道不同聚集状态物质的一些特性,根据物质的存在状态进行分类,知道固、液、气态物质的一些特性。
2.了解影响气体体积的主要因素,初步学会运用气体摩尔体积等概念进行简单的计算。
3.能用物质的聚集状态等概念解释一些实际问题。
4.引导学生从微观角度理解化学物质的存在状态,在原有基础上提升对化学物质的认识,同时为后续内容的学习打好必要的基础。
教学重点及难点理解气体摩尔体积等概念并进行简单的计算。
教学过程(引出新内容)(过渡)那么物质的体积除了跟物质的量有关外,跟物质状态有关吗?(提问)物质有哪些常见的聚集状态呢?(学生回答)气态、液态和固态。
(提问)不同状态的物质理性质上有哪些差异?固体、液体、气体是否有固定的形状和体积?(学生回答)固体有固定的形状,液体没有固定的形状,但有固定的体积,气体没有固定的形状和体积;气体容易被压缩,而固体、液体不易被压缩。
(过渡)为什么固态、液态和气态物质之间存在这些差异?如何解释这种差异呢?(讲解)结构决定性质。
那么我们一起来看看1 mol物质所占有的体积。
(提问)若已知物质摩尔质量,即1 mol物质的质量,要知道其体积,还需要什么条件?(学生回答)密度。
完成表格(标准状况下1 mol不同物质的体积)(结论)1. 1 mol不同的固态或液态物质,体积不同。
2. 在相同状况下,1 mol气体的体积基本相同。
3. 1 mol固体和液体的体积较小,1 mol气体的体积较大。
(讨论)那么不同状态的物质,体积大小跟哪些因素有关呢?(举例)举一个例子:同学们在做操的时候,一个班在操场上所占的面积和哪些因素有关?(学生回答)人数、距离、胖瘦(提问)类似的,物质的体积与哪些因素有关?(学生回答)粒子数目、粒子大小、粒子间的距离。
(思考1)当粒子数一定时,固、液、气态物质的体积主要取决于什么因素?(学生回答)固、液态的体积主要决定于粒子本身的大小,而气态物质的体积主要决定于粒子间的距离。
1.2.2《气体摩尔体积》课时训练试题(含答案)-人教版高中化学必修一

(人教版必修1)1.2.2《气体摩尔体积》课时训练试题(满分:100分考试时间:40分钟)一、选择题:本题包括12小题,每小题6分,共60分。
1.下列关于决定物质体积的因素的说法不正确的是( )A.物质的体积取决于粒子数目、粒子大小和粒子间距B.相同条件下,粒子数相同的任何气体都具有相同体积C.同温同压下,1 mol任何物质所占有的体积均相同D.等质量的H2,压强越小、温度越高,气体所占体积越大【答案】C【解析】从微观角度来说,物质的体积由粒子数目、粒子大小和粒子间距决定,A正确;粒子数相同的气体的物质的量相同,则相同条件下体积也相同,B正确;该结论只适用于气态物质,C错误;等质量的H2,压强越小、温度越高,气体体积越大,D正确。
2.下列有关气体摩尔体积的描述中正确的是()A.单位物质的量的气体所占的体积就是气体摩尔体积B.通常状况下的气体摩尔体积约为22.4 LC.标准状况下的气体摩尔体积约为22.4 LD.标准状况下,1 mol O2的体积是22.4 L·mol-1【答案】A【解析】单位物质的量的气体所占的体积就是气体摩尔体积,A正确;标准状况下的气体摩尔体积约为22.4 L·mol-1,1 mol O2的体积约是22.4 L,B、C、D错误。
3.同温同压下,1 mol氢气与1 mol氧气,它们的()A.质量相同,体积不同B.分子数相同,质量不同C.体积相同,分子数不同D.体积相同,原子数不同【答案】B【解析】同温同压下,物质的量相同的氢气和氧气,其分子数和体积都相同;它们都是双原子分子,含有的原子数也相同;它们的摩尔质量不同,其质量一定不同。
4.下列叙述正确的是( )A.同温同压下,相同体积的物质,其物质的量一定相等B.等物质的量的甲烷和一氧化碳所含的分子数前者大于后者C.1 L 一氧化碳气体一定比1 L 氧气的质量小D.相同条件下的一氧化碳和氮气,若气体体积相等,则质量也相等【答案】D【解析】同温同压下,相同体积的气体,其物质的量一定相等,题中没有指明物质状态,A 项错误;等物质的量的甲烷和一氧化碳所含的分子数一定相等,B 项错误;两种气体不一定是处于相同条件下,无法判断二者的物质的量,则无法比较二者的质量大小,C 项错误;相同条件下的一氧化碳和氮气,若气体体积相等,则二者的物质的量相等,根据m =nM 可知二者的质量也相等,D 项正确。
1.2.2《气体摩尔体积》导学案(含答案)-人教版高中化学必修一

第一章从实验学化学第二节化学计量在实验中的应用(第二课时气体摩尔体积)【学习目标】1.通过观看填空、计算探究、对比探究,知道相同条件下1mol不同气体的体积是相同的,而1mol固体和液体的体积是不同的。
2.通过阅读填空、思考讨论,能从宏观和微观相结合的角度理解影响物质体积大小的因素,知道气体摩尔体积的含义,能叙述阿伏加德罗定律的内容。
3.通过阅读填空、交流讨论、归纳小结,能基于物质的量认识物质的组成及变化,建立n、m、Vm之间计算的模型,熟悉阿伏加德罗定律的应用。
【学习重点】气体摩尔体积,阿伏加德罗定律及其推论。
【学习难点】气体摩尔体积概念的建立、阿伏加德罗定律及其推论的理解。
【自主学习】旧知回顾:1.M=m/n,该公式表示的是单位物质的量的物质所具有的质量,物质确定,其摩尔质量就确定;M=m(一个粒子)·N A,即阿伏加德罗常数个粒子的质量;M r=m(一个原子)÷1/12m(12C),表示摩尔质量以g·mol-1为单位时在数值上等于其相对原子质量,即一个原子的实际质量与一个12C原子质量的1/12的比值。
2.气体容易被压缩(填“容易”或“难”,下同),说明气体分子间距离比较大,(填“大”或“小”,下同);温度越高,气体分子间距离越大;压强越大,气体分子间距离小;而固体和液体的体积难被压缩,这说明固体和液体分子间距离非常小。
新知预习:阅读教材P13~14,回答下列问题:1.气体摩尔体积的概念单位物质的量的气体所占体积,符号Vm,单位 L/mol 。
定义式为Vm=V/n。
气体摩尔体积的数值取决于气体所处的温度和压强。
标准状况下(温度为0℃,压强为 101KPa )Vm=_22.4L/mol_。
2.0【同步学习】问题导入:假设一个人每分钟净吸入500ml的O2 ,你知道他每分钟吸入了多少个O2分子吗?二、气体摩尔体积活动一、1mol物质的体积1.观看填空:观看教材P13图1-14或观看电解水实验视频完成P13“科学探究1(1)”:电解水生成的O 2和H 2的体积比约为 1:2 。
化学必修一摩尔质量

摩尔质量单位物质的量的物质所具有的质量,称为摩尔质量(molar mass),用符号M表示。
当物质的质量以克为单位时,摩尔质量的单位为g/mol,在数值上等于该物质的相对原子质量或相对分子质量。
对于某一纯净物来说,它的摩尔质量是固定不变的,而物质的质量则随着物质的物质的量不同而发生变化。
例如, 1 mol O2的质量是32 g,2 mol O2的质量是64 g,但O2的摩尔质量并不会发生任何变化,还是32 g/mo1。
根据科学实验的精确测定,知道12g 相对原子质量为12的碳中含有的碳原子数约6.02×10^23个(阿伏加德罗常数)。
科学上把含有6.02×10^23个微粒的集体作为一个单位,叫摩尔。
摩尔是表示物质的量(符号是n)的单位,简称为摩,单位符号是mol。
国际单位制中计量物质的量的基本单位,简称摩,国际符号mol。
1971年第十四届国际计量大会关于摩尔的定义有如下两段规定:“摩尔是一系统的物质的量,该系统中所包含的基本单元数与0.012kg碳—12的原子数目相等。
”“在使用摩尔时应予以指明基本单元,它可以是原子、分子、离子、电子及其他粒子,或是这些粒子的特定组合。
”上两段话应该看做是一个整体。
0.012kg碳—12核素所包含的碳原子数目就是阿伏加德罗常数(NA),目前实验测得的近似数值为NA=6.02×10^23。
摩尔跟一般的单位不同,它有两个特点:①它计量的对象是微观基本单元,如分子、离子等,而不能用于计量宏观物质。
②它以阿伏加德罗数为计量单位,是个批量,不是以个数来计量分子、原子等微粒的数量。
也可以用于计量微观粒子的特定组合,例如,用摩尔计量硫酸的物质的量,即1mol硫酸含有6.02×10^23个硫酸分子。
摩尔是化学上应用最广的计量单位,如用于化学反应方程式的计算,溶液中的计算,溶液的配制及其稀释,有关化学平衡的计算,气体摩尔体积及热化学中都离不开这个基本单位。
高一化学必修一讲义:阿伏加德罗定律及平均摩尔质量的计算

阿伏加德罗定律及平均摩尔质量的计算【教学目标】1、掌握阿伏加德罗定律及其重要推论2、掌握阿伏加德罗定律及其相关计算【知识梳理】一、阿伏加德罗定律1、定律内容:同温同压下,相同体积的任何气体都含有相同的分子数2、理想气体的状态方程:pV = nRT[其中:p为气体压强,V为气体体积,n为物质的量,R为常数,T为温度(单位为开尔文,符号是K)]由理想气体的状态方程结合物质的量的相关公式可以推出:PV = nRT = — RTM【微点找】①阿伏加德罗定律适用于任何气体,包括混合气体,不适用于非气体②同温、同压、同体积、同分子数,共同存在,相互制约,且“三同定一同”③标准状况下的气体摩尔体积是阿伏加德罗定律的一个特例④是分子不是原子⑤同温同压下,相同体枳的任何气体含有相同物质的量的分子【即学即练1】1、在同温同压下,同体积的氢气和甲烷,它们的分子数之比是():原子数之比是():物质的量之比()质量之比()A. 2: 5B. 1: 1C. 1: 5D. 1: 82、同温同压下,同体积的下列气体,质量最大的是()A. NH3B. S02C. CH4D. H2二、阿伏伽德罗定律的推论(可通过pV = nRT&n=^、p=?导出)1、体积之比(1)语言叙述:同温同压下,气体的体积之比等于其物质的量之比,也等于其分子数之比(八八玄左_生_业(2)么式:y-n-N1(3)应用:比较相同条件(同温同压)下,如:0.3 mol %和0.2 mol CH」①比较气体体枳的大小可以直接比较物质的量的大小:V( H2)>V(CH4)②求体积比可以转化为求物质的量之比:V( H2): V(CH4)=0.3:0.2=3:20 3③求体积分数可以转化为求物质的量分数:H,的体积分数=——xl00% = 60%- 0.3 + 0.22、压强之比(1)语言叙述:同温同体枳时,气体的压强之比等于其物质的量之比,也等于其分子数之比(2)公式.以=生=如3、密度之比(1)语言叙述:同温同压下,气体的密度之比等于其摩尔质量之比,也等于其相对分子质量之比⑵公式:食嗡⑶应用:比较相同条件(同温同压下),气体的密度相对大小4、质■之比(1)语言叙述:同温同压下,同体枳的气体的质量之比等于其鲜质量之比,也等于其相对分子质量之比) A.同温同压下,%与He 的体积比为m : 2nB.同温同压下,若m=n,则Hz 与He 的分子数之比为2: 1C.同温同压下,同体积时,出与He 的质量比上>1 nD.同温同压下,%与He 的密度比为1 : 2 5、标准状况下,mg A 气体与ngB 气体分子数相等,下列说法不正确的是()A.标准状况下,同体积的气体A 和气体B 的质量比为m : nB. 25 ℃时,1kg 气体A 与1kg 气体B 的分子数之比为n :mC.同温同压下,气体A 与气体B 的密度之比为m :nD.标准状况下,等质量的A 与B 的体积比为m :n6、同温同压下,下列气体的密度最大的是()A. F 2B. ChC. HC1D. CO2二、混合气体的平均摩尔质■(冠)或平均相对分子质量1、混合气体的平均摩尔质・:法='殳2、求混合气体的平均摩尔质置的方法(1)混合气体的平均摩尔质量:必=胆〃总(2)根据混合气体中各组分的物质的量分数或体积分数求混合气体的平均摩尔质量三—— M 总)M i +此小+…+(X )M = 〃(邙)= 〃(二:) =必41% + %42%+…+M"i%其中ai%=--X 100%,是混合气体中某一组分的物质的量分数。
专题1.2.2 气体摩尔体积-《易错点专项训练》2018-2019学年高一化学人教必修1(第1章)

第一章从实验学化学第二节化学计量在实验中的应用第2课时气体摩尔体积易错点一气体摩尔体积1.下列叙述中正确的是A.一定温度、压强下,气体体积由其分子的大小决定B.一定温度、压强下,气体体积由其物质的量的多少决定C.气体摩尔体积是指1 mol任何气体所占的体积为22.4 LD.不同的气体,若体积不等,则它们所含的分子数一定不等【答案】B【解析】决定气体体积大小的主要因素是气体分子数目的多少和气体分子间的距离。
一定温度、压强下,气体体积之比等于其物质的量之比,故A项错误,B项正确;说明某气体的摩尔体积时必须指明所处状况,C项错误;不同的气体,若体积不等,但在不同的特定温度和压强下,它们所含的分子数也可能相等,D项错误。
2.下列叙述中,正确的是A.摩尔是国际单位制七个基本物理量之一B.在标况下,1 mol任何物质的体积都约是22.4 LC.25℃和101 kPa的条件下,气体的摩尔体积大于22.4 L/molD.22.4 L气体所含的分子数一定大于11.2 L气体所含的分子数【答案】C【解析】A.摩尔是物质的量的单位,物质的量是国际单位制七个基本物理量之一,故A错误;B.在标况下,1 mol气体物质的体积约是22.4 L,固体和液体的体积不是22.4 L,故B错误;C、气体摩尔体积是1 mol气体在一定温度和压强下的体积,单位为L/mol,25 ℃和101 kPa的条件下,气体的摩尔体积大于22.4 L/mol,故C正确;D.未注明温度和压强,气体摩尔体积不确定,不能计算气体的物质的量,也不能判断气体分子数目的关系,故D错误;故选C。
3.下列说法正确的是①标准状况下,6.02×1023个分子所占的体积约是22.4 L②0.5 mol H2所占体积为11.2 L③标准状况下,1 mol H2O的体积为22.4 L④常温常压下,28 g CO与N2的混合气体所含的原子数为2N A⑤各种气体的气体摩尔体积都约为22.4 L·mol−1⑥标准状况下,体积相同的气体的分子数相同A.①③⑤B.④⑥C.③④⑥D.①④⑥【答案】B【解析】①标准状况下,6.02×1023个分子为1 mol,但该物质不一定是气体,故占有的体积不一定是22.4 L,故①错误;②氢气所处的状态不一定是标准化状况,气体摩尔体积不一定是22.4 L/mol,0.5 mol H2所占体积不一定为11.2 L,故②错误;③标准化状况下,水是液体,1 mol水的体积远大于22.4 L,故③错误;④28 g CO与N2的混合气体为1 mol,二者都是双原子分子,所含的原子数为2N A,故④正确;⑤影响气体摩尔体积的因素有温度、压强,气体所处的状态不确定,各气体的气体摩尔体积不一定是22.4 L/mol,故⑤错误;⑥同温同压下,体积相同,含有的分子数目相同,故⑥正确;故选B。
人教版高中化学必修1-1.2《摩尔质量》名师课件

摩尔质量
摩尔质量
作业
一、巩固性练习: 完成导学案中“课后作业”的巩固 性练习 二、拓展性练习: 1. 以本节课所学的知识点,在对战
小组所编写的题目的基础上再编 写两个空的填空题。 2. 用CO2和H2SO4为对战小组编写 一道填空题。
摩尔质量
环节四:由命题小组指定答题小组的汇报员展示并汇报解 题方法、答案和关注到的知识点。
环节五:由命题小组完善答题小组给出的解题过程和答案。
Go!
3210
5
4
3
2
1
0 (min)
摩尔质量
一、摩尔质量
概念:单位物质的量的物质具有的质量。 单位:g/mol 或 g .mol-1 转化关系:M = m/n 二、物质的量(n)、物质的质量(m)和摩尔质量(M)、 粒子数(N)和阿伏加德罗常数(NA)之间的关系 三、编写题目
每天取用 0.64 克铜?
摩尔质量
巩固练习
ቤተ መጻሕፍቲ ባይዱ
一、判断对错
x 1.H2O的摩尔质量是18 g
()
x 2. 水的摩尔质量等于水的相对分子质量 ( )
二、填空题
34克NH3的物质的量是 2
mol,
约含有 2× 6.02 × 1023 . 个NH3分子,
约含有 6× 6.02 × 1023 个 氢原子。
摩尔任质务量:为星星的朋友编写题目
高中化学 必修一 专题1 第一单元
丰富多彩的化学物质
物质的量
第二课时 摩尔质量
梧州高级中学 冯舒雯
摩尔质量
同学们能帮帮都教授,怎样才能快速地获取6.02×1021个 铜原子?
摩尔质量
1mol不同微粒所含的粒子数是 相同 的, 都约为 6.02x1023 个。
1.2.1《物质的量 摩尔质量》教学设计(含解析)-人教版高中化学必修一

【板书】5.n=N/NA
【讲解】摩尔是一个巨大数量粒子的集合体,可以是整数,也可以是小数,如可以有0.5 mol O2、0.01 mol H2SO4等。但分子、原子等具体的粒子,只能是整数,而不能是0.5个或0.01个。
下面,请大家做以下练习:
【思考1】1. 0.5 mol水中含有个水分子。
【交流】3.01×1023
【思考2】2 mol水中含有个水分子,个氢原子。
【交流】1.204×10242.408×1024
【思考3】1 mol H2SO4溶于水,水中存在的溶质粒子是什么?它们的物质的量各是多少?
【交流】氢离子、2 mol;硫酸根离子、1 mol。
【思考】怎样表示n、m、M三者之间的关系?
【交流并板书】2.m=nMn=m/M。
【讲解】Mg的摩尔质量为24g/mol,水的摩尔质量为18g/mol,KCl的摩尔质量为74.5g/mol,CO 的摩尔质量为60g/mol。
【典例1】下列表示错误的是()
A.1 mol H2B.1 mol Fe
C.1 mol NH D.1 mol小米
【答案】D
【解析】物质的量不适用于表示宏观物质。
【典例2】比较1 mol氧气和1 mol一氧化碳,下列说法正确的是()
A.质量相同B.分子总数相同
C.原子总数不同D.氧原子总数相同
【答案】B
【解析】氧气和一氧化碳的物质的量相同时:它们含有的分子总数相同;二者都是双原子分子,它们含有的原子总数也相同,但含有的氧原子总数不相同;二者的摩尔质量不同,它们的质量不相同。
【典例3】下列说法中错误的是()
高中化学必修一摩尔质量所有公式

高中化学必修一摩尔质量所有公式
摩尔质量是一种度量物质的单位,它定义了一个物质的化学特性以及它的宏观特征,是目前物理化学和物质研究中最常用的统一单位。
在高中化学课程中,摩尔质量的学习非常重要,其中有几个重要的摩尔质量公式,让学生能够更加全面地了解摩尔质量的概念和定义。
首先,对于学习摩尔质量,我们必须了解它的定义:摩尔质量是指一种特定物质中原子的数目,可以用其等数量的氢原子的质量表示。
因此,摩尔质量又称为“氢的质量”。
接下来介绍的是常用的摩尔质量公式。
首先,根据原子质量计算摩尔质量:摩尔质量=原子质量/AV(摩尔常数),其中AV=6.02×10^23;其次,根据分子数计算摩尔质量:摩尔质量=分子数×分子质量。
再次,根据物质的化学式计算摩尔质量:摩尔质量=将化学式中各元素
原子质量之和。
此外,有一种特殊的摩尔质量公式,叫做摩尔质量平衡公式,可以用于计算物质反应时质量的变化情况,它的公式如下:反应物的摩尔质量之和等于反应产物的摩尔质量之和。
最后,要说的是物质的“绝对质量”,它是指一种物质中所有原
子的质量之和,可以用以下的公式计算:绝对质量=原子质量x原子数。
总结起来,摩尔质量是计算物质的重要单位,它是化学和物理学中经常使用的重要参数,了解摩尔质量所有公式,学生可以更深入地理解摩尔质量的定义和计算方法,从而能够更准确地应用摩尔质量进
行实际计算。
人教版高中化学必修1-1.2《摩尔质量》名师教学设计

摩尔质量
一、基本说明
1.教学内容所属模块:高中化学必修一
2.年级:高一年级
3.所用教材出版单位:人民教育出版社
4.所属章节:第一章第二节
二、教学设计
1.教学目标
知识与技能:①理解摩尔质量的概念。
②理解物质的量是联系微粒个数和物质质量之间的桥梁。
过程与方法:①学会比较、学会归纳,培养从宏观到微观的思维转化能力。
②培养由感性到理性,由个别到一般的认识方法。
情感态度和价值观:通过命题培养学生自主学习的能力和体验学习的乐趣及成就感。
2.内容分析
摩尔质量的教学是物质的量教学的延伸,但也有其自身的特殊性。
学生已经对物质的量有所认识,将这种认识方法迁移过去是本节课的主要设计思想,避免了对摩尔质量概念形成过程中繁琐的讲解。
学习重点:摩尔质量的概念的形成。
学习难点:物质的量、摩尔质量和物质质量之间的区别与联系。
3.学情分析
①学生在初中学习了原子、分子、电子等微观粒子,学习了化学方程式的意义和常用的物理量,物质的量、阿伏伽德罗常数及其对应的单位;
②具备一定的计算能力和知识迁移能力;
③欠缺抽象思维。
三、教学过程。
2022-2023学年上海高一上学期化学同步讲练(沪科新版)1-2-2 气体摩尔体积(教师版)

1.2.2 气体摩尔体积物质存在的状态有固态、液态、气态,它们都有一定的体积,本节课,我们聚集气体的体积。
请观察下面的图1—4,从宏观上分析,影响气体体积的因素有哪些?请继续观察图5—8,从微观上分析,影响气体体积的因素有哪些?1 23 4567 8学习聚焦知识点01 影响物质体积的微观因素从微观来角度看,物质体积的大小取决于构成这种物质的粒子的数目、粒子的大小和粒子之间的距离。
1. 固态、液态物质粒子之间的距离是非常小的,因此决定固体或液体体积的主要因素是构成物质的粒子的数目和粒子的大小。
2. 气态分子之间的距离远远大于分子本身的大小,因此决定气体体积的主要因素则是构成气体的分子的数目和分子之间的距离。
【即学即练1】已知阿伏加德罗常数、物质的摩尔质量及摩尔体积,下列物理量中,尚不能全部计算出其近似值的是A .固体物质分子的大小和质量B .液体物质分子的大小和质量C .气体物质分子的大小和质量D .气体物质分子的质量【答案】C 【解析】使用摩尔质量和阿伏加德罗常数,可以算出任何状况下一个分子的质量ΑΝM m 。
但使用摩尔体积和阿伏加德罗常数,只能算出固体和液体一个分子体积的近似值,而不能算出一个气体分子体积的近似值,因为决定气体体积的因素主要是分子个数与分子间距,与分子本身的大小几乎无关。
知识点02 气体摩尔体积1. 定义:单位物质的量的气体所占有的体积,叫做气体摩尔体积。
2. 符号:V m3. 单位:L·mol -1(或L/mol )4. 数值:在标准状况(温度为0℃,压强为101 kPa )下,气体摩尔体积为22.4L/mol5. 计算公式:V =n ·V m说明:①气体摩尔体积只适用于气体,不适用于固体和液体;②22.4 L/mol 指的是标准状况下的气知识精讲体摩尔体积,是气体摩尔体积的一个特例;③在非标准状况下不能使用22.4 L/mol ,但同时改变温度和压强,气体摩尔体积也有可能是22.4 L/mol 。
化学必修一2-2摩尔质量

学科:化学编号:1-2 编写人:吴怀荣审核人:胡水秀使用时间:班级姓名:小组序号:组长评价:教师评价课题:第二节化学计量在实验中的应用第2课时摩尔质量【学习目标】1.能记住摩尔质量的基本含义。
2.能理解物质的量、摩尔质量、质量之间的相互关系,学会用物质的量来计量物质。
【学习重点与难点】学习重点:1、理解并能运用摩尔质量。
2、学会用物质的量来计量物质。
学习难点:摩尔质量的基本含义【使用说明与学法指导】1.合作学习、探究学习、理论与实践相结合预习案一、问题导学1.1 mol2.我们把单位物质的量的物质所具有的质量叫做摩尔质量。
摩尔质量的符号为M,常用的单位有g·mol-1或kg·mol-1。
你能想象出摩尔质量与相对原子质量或相对分子质量的关系如何吗?3.摩尔质量就是1 mol该物质的质量吗?为什么?4.由摩尔质量的定义可知,物质的量(n)、物质的质量(m)、摩尔质量(M)三者之间存在以下关系:。
二、知识梳理知识点一 摩尔质量摩尔质量1、定义:2、符号:3、单位:4、摩尔质量(M)与阿伏加德罗常数(NA)的关系:M = a × N A注(a:一个原子的实际质量)(二)、相对原子(分子)质量1、定义:一个原子的质量与12C 的1/12作比较,所得的比值;2、符号:A r3、单位: 14、公式:Ar = a /(b/12)= 12a / b (a : b : )(三)、比较摩尔质量与相对原子(分子)质量的区别与联系:1、1 mol 任何粒子的质量以克为单位时,在数值上都与该粒子的相对原子质量或相对分子质量相等。
2、摩尔质量在以g ·mol -1为单位时,在数值上才与微观粒子的相对原子质量或相对分子质量相等。
知识点二 摩尔质量,物质的量,质量的关系1.摩尔质量(M)与物质的量(n )的关系:n = m / M2.摩尔质量、质量、物质的量、微粒数之间的关系为:课堂练习:1.下列说法正确的是()A.NaOH的摩尔质量是40 g B.OH-的摩尔质量是17 g·mol-1C.440 g CO2的物质的量为11 mol D.水的摩尔质量等于水的相对分子质量2.下列叙述中正确的是()A.1 mol H2O的质量是18 g·mol-1 B.硫酸根离子的摩尔质量是96 g C.CO2的摩尔质量是44 g·mol-1D.HCl的相对分子质量是36.5 g·mol-1 3.下列有关摩尔质量的描述或应用中,正确的是()A.1 mol OH-的质量为17 gB.二氧化碳的摩尔质量为44 gC.铁原子的摩尔质量等于它的相对原子质量D.一个钠原子的质量等于236.02×1023·mol-14.下列说法正确的是()A.氧的摩尔质量是32 g•mol-1B.硫酸的摩尔质量是98gC.CO2的相对分子质量是44g D.CO32—摩尔质量是60g/mol5.amolH2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为()A.a/4bmol-1B.b/amol-1C.a/bmol-1D.b/4amol-16.已知铁的相对原子质量是56,则1个铁原子的质量约为g。
平均相对分子质量和平均摩尔质量

平均相对分子质量和平均摩尔质量嘿,朋友们,今天咱们要聊聊两个听起来高深莫测的东西——平均相对分子质量和平均摩尔质量。
这两个概念常常让人觉得像是从外星球发来的密码一样难懂,但其实它们也有点像那种老掉牙的数学题,认真琢磨琢磨,你会发现其实没那么复杂。
好了,咱们就用最简单易懂的方式,轻轻松松把它们搞明白!1.1 什么是平均相对分子质量?首先,来聊聊“平均相对分子质量”这个词。
别被它吓到,实际上它跟我们日常生活中的“分子”可有直接关系。
假如你拿着一杯水,那水里有各种水分子。
水分子的质量不是单一的,它是由氢原子和氧原子组成的。
所以,“平均相对分子质量”就是帮我们算一下,水中各种不同分子质量的平均值。
就像你班上同学的平均成绩一样,这个“平均”就是把所有分子质量加起来再除以它们的数量。
听起来是不是像是在解数学题?其实也就是这样。
1.2 如何计算?现在我们说说怎么计算这个“平均相对分子质量”。
首先,你得知道你要计算的是什么分子。
例如水,它的分子由两个氢原子和一个氧原子组成。
氢的相对原子质量是1,氧的相对原子质量是16。
那么,一个水分子的相对分子质量就是2×1+16=18。
是不是挺简单的?这就是平均相对分子质量的基本原理。
你只需要把各个原子的质量相加,就能得到一个分子的平均质量。
2. 平均摩尔质量:另一种视角接下来,我们再来说说“平均摩尔质量”。
这个词听起来有点吓人,但它其实跟前面讲的分子质量差不多,只是它看事情的角度有所不同。
摩尔质量是指1摩尔的某种物质的质量,记住了,一摩尔的意思就是6.022×10^23个分子,别忘了这个数字哦。
简而言之,就是你拿一大堆分子,然后称它们的总质量,再除以它们的数量,就能得出摩尔质量。
换句话说,它就是分子质量的“超级版本”,因为它考虑的数量更大了。
2.1 为什么要用摩尔质量?为什么我们要用摩尔质量呢?举个例子,想象一下你在厨房里做饼干,你需要知道面粉、糖等材料的量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
÷M ×M ×Vm
n ×NA
÷NALeabharlann N÷VmV
新课标高中化学必修一
新课标高中化学必修一
34 32
新课标高中化学必修一
平均摩尔质量的求算
标准状况下,将6.72LCH4和2.24LO2混合, 求所得混合气体的平均摩尔质量。
20g/mol
同温同压下,将8mLN2和2mLO2混合,求 所得混合气体的平均摩尔质量。
28.8g/mol
新课标高中化学必修一
十字交叉法
A: MA \ M B : MB /
根据相对密度求算
同温同压下,某气体对氧气的相对密度为2, 求该气体的相对分子质量。
64
由CO2、H2组成的混合气体在同温同压下 与氮气的密度相同,求该混合气体中CO2 和H2的体积比。
13:8
新课标高中化学必修一
根据标态密度求算
标准状况下,某气态氢化物H2R的密 度为1.52g/L,求H2R的相对分子质量, 求R的相对原子质量。
n1M1 n2 M 2 M n1 n2
M 1 a % M 2 b%
根据摩尔质量 的概念求算
标准状况下,0.01mol某气体的质量是 0.44g,求该气体的摩尔质量。 44g/mol
标准状况下,5.6L某气体的质量为8g,求 该气体的摩尔质量。
32g/mol
新课标高中化学必修一
复习以物质的量为中心的计算
物质 物质的量 (mol) CH4 0.25 HCl 2 O3 0.5 SO2 0.15 m 原子数(个) 质量 标准状况下 (g) 的体积(L) 7.525X1023 4 5.6 1.204X1024 73 44.8 9.03X1023 24 22.4 3.36 9.03X1022 9.6
/ M MB \ M M A
新课标高中化学必修一
十字交叉法
标准状况下,4.48LCH4与O2的混合气 体,总质量为4.4g,求混合气体的平均相 对分子质量;CH4与O2的体积比。
标准状况下,8.96LCO与CH4总质量为 7.6g,求混合气体的平均相对分子质量和 CH4的体积。
新课标高中化学必修一
新课标高中化学必修一
平均摩尔质量的计算
十字交叉法
新课标高中化学必修一
平均摩尔质量的 计算方法
(1)根据摩尔质量的概念求算
m总 M n总
1 (2)根据相对密度求算 M1 M 2 相对 M 2 2
(3)根据标态密度求算
M= Vm
M 标 22.4
新课标高中化学必修一
(4)平均相对分子质量的求算
