果糖胺测定试剂盒(四氮唑蓝法)产品技术要求柏定
果糖胺测定试剂盒(四氮唑蓝法)产品技术要求beijian

果糖胺测定试剂盒(四氮唑蓝法)适用范围:本产品用于体外定量测定人血清中果糖胺的含量。
1.1 规格具体产品规格见下表:1.2 组成成分1.2.1 试剂的组成硝基四氮唑蓝≥0.5mmol/L碳酸盐≥0.1mol/L1.2.2 校准品的组成(选配)果糖胺(1.00~2.50)mmol/L该校准品为血清基质冻干校准品1.2.3 质控品的组成(选配)果糖胺 (0.60~6.00) mmol/L该质控品为血清基质冻干质控品校准品、质控品有批特异性,具体靶值见靶值表。
2.1 外观2.1.1 外包装完整无破损;2.1.2 试剂:黄色澄清透明无杂质液体;2.1.3 校准品:白色或浅黄色冻干粉,复溶后为浅黄色溶液,无不溶物;2.1.4 质控品:白色或浅黄色冻干粉,复溶后为浅黄色溶液,无不溶物。
2.2 净含量净含量不低于标示值。
2.3 试剂空白吸光度在主波长546nm、副波长700nm、37℃条件下,试剂空白吸光度小于0.3。
2.4 线性2.4.1 线性范围[0.60,6.00]mmol/L,相关系数r>0.990。
2.4.2 线性偏差(2.00,6.00]mmol/L线性范围内,相对偏差不超过±10%;[0.60,2.00]mmol/L线性范围内,绝对偏差不超过±0.20mmol/L。
2.5 分析灵敏度检测浓度为1.50mmol/L的样本时,吸光度变化不小于0.014。
2.6 重复性2.6.1 试剂重复性测试高、低浓度的血清样本或质控品,重复测试10次,CV≤8%;用试剂测定1瓶校准品,重复测定10次,CV≤8%;2.6.3 质控品重复性用试剂测定1瓶质控品,重复测定10次,CV≤8%。
2.7 批间差用三个不同批号的试剂测试同一样品,重复测试3次,相对极差R≤10%。
2.8 瓶间差2.8.1 校准品瓶间差用试剂测定同一批号的10瓶校准品各1次,并测定上述10瓶中的1瓶,重复测定10次,CV≤8%;2.8.2 质控品瓶间差用试剂测定同一批号的10瓶质控品各1次,并测定上述10瓶中的1瓶,重复测定10次,CV≤8%。
血清糖化蛋白四氮唑蓝测定法

血清糖化蛋白四氮唑蓝测定法1. 实验原理血清糖化蛋白(即:果糖胺)是一种大分子酮胺类化合物。
碱性条件下可将四氮唑蓝还原成紫色甲月替,其生成量与血清果糖胺浓度成正比。
用比色法在540mm(530-550mm)、以糖化血清蛋白作校准物测出反应中甲月替的生成量从而得出血清果糖胺的浓度。
2. 标本:2.1 病人准备:无特殊。
2.2类型:血清、肝素或EDTA处理的血浆。
应使用新鲜标本。
标本必须避光保存!3. 标本存放:标本在2~8℃可稳定7天,-20℃保存至少稳定6个月。
4. 标本运输:常温条件下保存运输。
5. 标本拒收标准:标本溶血、细菌污染的标本。
6. 实验材料6.1 试剂南京波因特GSP测定试剂盒(试剂1×70ml)6.1.1 试剂组成:硝基四氮唑蓝、碳酸盐、稳定剂。
6.1.2 试剂准备:试剂为即用式。
6.1.3 试剂稳定性与贮存:试剂在2~8℃保存,自生产日起可稳定12个月。
6.1.4 变质指示:当试剂有看得见的微生物生长,有浊度,或者未开盖的液体有沉淀时,表明试剂已变质,不能继续使用。
6.1.5 注意事项:试剂和样品可因仪器要求不同,按比例增减;间隔时间可按仪器不同进行调整,但为减少样本中还原物质的干扰,延迟时间不应低于300秒。
不可入口!避免接触皮肤及粘膜。
应采取必要的预防措施使用试剂6.2 校准品:使用南京波因特提供的糖化血清蛋白校准品对自动分析仪进行校准,具体参见生化检验校准品和质控品.SOP文件。
6.3 质控品:具体参见生化检验校准品和质控品.SOP文件。
7. 仪器:贝克曼AU680生化分析8. 操作步骤8.1 项目基本参数:参见AU680生化分析仪项目测定参数.SOP文件8.2仪器操作步骤:参见AU680生化分析仪操作规程.SOP文件9. 检验结果的判断与分析:10. 质量控制:在每一批标本中都应把非定值血清水平I与II质控做为未知标本进行分析,以2S为质控警告限,3S为失控限,绘制质控图,判断是否在控。
血清果糖胺含量测定试剂盒[实用新型专利]
![血清果糖胺含量测定试剂盒[实用新型专利]](https://img.taocdn.com/s3/m/eb1953c23169a4517623a335.png)
专利名称:血清果糖胺含量测定试剂盒专利类型:实用新型专利
发明人:王辉,王军峰,孟菲,吴静,王宇飞申请号:CN201020509135.8
申请日:20100826
公开号:CN201828523U
公开日:
20110511
专利内容由知识产权出版社提供
摘要:本实用新型提供一种血清果糖胺含量测定试剂盒,包括盒盖、盒体以及置于盒体中的至少一个试剂瓶,所述试剂瓶盛装有液体检测试剂。
本实用新型提供的血清果糖胺含量检测试剂盒操作简单,生产成本低。
本实用新型试剂盒可用于人或动物血清果糖胺含量的检测。
申请人:上海执诚生物技术有限公司
地址:201204 上海市浦东新区莲溪路1210号2幢
国籍:CN
代理机构:上海天翔知识产权代理有限公司
代理人:梁晓霏
更多信息请下载全文后查看。
糖化血清蛋白(果糖胺GSP)测定试剂盒(NBT法)产品技术要求参考

医疗器械产品技术要求编号:糖化血清蛋白(果糖胺/GSP)测定试剂盒(NBT法)1.产品型号/规格及其划分说明1.1型号规格试剂盒共6种规格,分别为:20ml/盒、60ml/盒、120ml/盒、240ml/盒、420ml/盒、400T/盒;校准品(选配)规格为0.5ml/盒、1ml/盒;质控品(选配)规格为0.5ml/盒、1ml/盒。
1.2结构成分为液体单试剂,主要组成成分包括硝基四氮唑蓝(NBT)、碳酸盐缓冲液;校准品(选配):由单个浓度水平校准品组成,外观为无色液体,主要组成成分为:缓冲液、糖化血清蛋白、防腐剂、稳定剂;质控品(选配):由单个浓度水平质控品组成,外观为无色液体,主要组成成分为:缓冲液、糖化血清蛋白、防腐剂、稳定剂。
1.3适用范围适用于体外定量测定人血清或血浆中糖化血清蛋白(GSP)的浓度。
2.性能指标2.1外观性状试剂盒各种标识应清晰、端正,包装容器应无漏液;试剂外观应为澄清透明、无絮状物、无肉眼可见颗粒及沉淀的液体。
2.2试剂盒装量试剂盒装量应不少于标示量。
2.3准确度测定定值质控品,结果应在该定值质控品允许的误差范围内。
2.4灵敏度测定GSP浓度为3.85mmol/L的样品时,吸光度变化值(△A)应≥0.005。
2.5工作液空白吸光度在温度37℃、波长540nm条件下检测,试剂工作液空白吸光度应≤0.50(比色杯光径0.6cm)。
2.6线性范围线性范围为(0~6.0)mmol/L,回归系数r2应≥0.99。
2.7测量精密度2.7.1批内精密度CV%应≤4%。
2.7.2批间精密度CV%应≤6%。
2.8特异性胆红素<342μmol/L,甘油三酯<5.6mmol/L,血红蛋白<2.0g/L,维生素C<0.3g/L对测定结果造成的干扰,偏倚在±15%内。
果糖胺(Fruc)测定标准操作程序SOP文件

10.4溶血:溶血指数达到500时不会有明显干扰。(血红素浓度约为500mg/dl)
10.5血糖:葡萄糖的浓度低于900mg/dl时不会有干扰,因此不需要禁食。葡萄糖的浓度超出900mg/dl会引起结果的假性升高。
10.6 Vc的浓度低于4mg/dl不会干扰试验。尿酸的浓度低于40mg/dl不会干扰到检测。一般的常用药无不会干扰检测。
S1:0.9%的NaCl
S2: Precimat Fructosamine(货号:1098993)
贮存条件:校准物在2-8℃保存可保存至有效期。
准备:直接使用。
定标频率:A试剂瓶在仪器上放置超出7天
B如果前一个试剂瓶在仪器上放置超出7天,那末更换试剂瓶后需要进行重新定标
C试剂批号更换后
D由质控结果决定
9注意事项
9.1血清标本出现溶血、脂血或黄疸的干扰情况参见抗干扰能力。
9.2仅应用于体外诊断。
9.3扔弃废物应符合当地的法规。
9.4试剂R1的轻微黄颜色不会干扰试剂的性能。
10抗干扰能力:
10.1标准:回收率在90%-110%之间。
10.2黄疸:黄胆指数达到5时不会有明显干扰。(直接和间接胆红素浓度约为5mg/dl)
ABCD医院
生化实验室
文件编号:
ABCD-SOP-04-26
果糖胺(Fruc)测定
版序:ABCD
页码:第2页,共2页
5仪器
ROCHE MODULAR P或日立7060生化分析仪。
6上机操作
见仪器作业指导书,参数设置见附表。
7参考范围
205-285umol/l
8线性范围
果糖胺(FAN) 测定的标准操作程序

果糖胺(FAN)测定的标准操作程序【应用范围】体外检测血清、血浆果糖胺(FAN)测定。
【适用仪器】Olympus AU-2700全自动生化分析仪。
【程序改变】严格遵循仪器、试剂说明书及校准品使用说明。
【方法学原理】血清(浆)果糖胺是一种大分子酮胺类化合物。
在碱性条件下可将四氮唑蓝(NBT)还原生成紫色的甲月替,其生成量与果糖胺浓度成正比。
用比色法在546nm波长下,以糖化血清蛋白为校正物,可测出反应中甲月替生成量,从而求得血清果糖胺的浓度。
【试剂】在测定时的各组分和浓度磷酸盐缓冲液:0.2MpH 10.30NBT:0.25mmol/L抗干扰剂:适量表面活性剂:适量2.校准品:Electrollyte CAL 1、Electrollyte CAL 2。
3. 质控品:Randox Assayed Multiseral Level 2 and Level 3。
【标本收集与准备】血清或血浆标本根据实验室标准采集程序采集标本,适用标本为血清或肝素抗凝血浆(肝素钠抗凝结果高0.5mmol/l),不可从正在静脉滴注手臂上采血,上机标本不能有凝块,样品采集后2天内离心标本,分离血清,血清或血浆标本室温保存4天,冷藏7天,冷冻保存6个月。
【操作步骤】1.仪器测定参数设置Test Name:Sample: Volume L Dilutio LL DilutioLL Sec. ODMethod: First L Last L Reaction Slope: Measuring Last L Measuring Last Linearity A No-Lag-Time:2.试剂准备:将准备好的试剂置仪器试剂盘中(8℃)。
3.校准【校准品和控制品】建议使用复合校准品对自动分析仪进行校准。
每批样品检测时,建议使用质量控制品进行内部质量控制。
校准物的准备:将校准物从冰箱取出,冻干校准物按说明书加入蒸馏水复溶,轻轻颠倒混匀3次,不可用力震摇,室温放置30分钟至完全溶解;液体校准物从冰箱取出,室温放置15分钟以平衡至室温。
糖化血清蛋白(GSP)测定试剂盒(蛋白酶-果糖氨基酸氧化酶法)产品技术要求sainuopu

糖化血清蛋白(GSP)测定试剂盒(蛋白酶-果糖氨基酸氧化酶法)适用范围:用于体外定量测定人体血清中糖化血清蛋白的含量。
1.1试剂盒包装规格试剂1:1×20ml,试剂2:1×5ml;试剂1:2×60ml,试剂2:2×15ml;试剂1:3×40ml,试剂2:3×10ml;试剂1:4×60ml,试剂2:4×15ml;试剂1:2×400ml,试剂2:1×200ml;试剂1:1×8L,试剂2:1×2L;试剂1:2×40ml,试剂2:2×10ml。
校准品(选配,冻干品):1×1ml,2×1ml(单水平),1×3ml,2×3ml(单水平)。
质控品(选配,冻干品):1×1ml,1×3ml。
1.2试剂盒主要组成成分2.1 外观液体双试剂:试剂1无色至浅红黄色液体;试剂2:无色至浅红黄色液体。
校准品:冻干品,溶解后为无色至淡黄色液体。
质控品:冻干品,溶解后为无色至淡黄色液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、600nm波长、1cm光径条件下,试剂空白吸光度应不大于0.1。
2.4 分析灵敏度测定浓度为600μmol/L的样本时,吸光度变化值(ΔA)应不小于0.05。
2.5 线性范围在(50,1000)μmol/L范围内,线性相关系数r不小于0.996。
在(150,1000)μmol/L范围内的线性相对偏差不大于±10%;在(50,150]μmol/L范围内线性绝对偏差不大于±15.0 μmol/L。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于5%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于10%。
糖化血清蛋白(GSP)测定试剂盒(果糖胺法)

糖化血清蛋白(GSP)测定试剂盒说明书
(果糖胺法)一、原理:
血清葡萄糖能与白蛋白及其它血清蛋白分子N末端的氨基发生非酶促糖化反应,形成高分子酮胺结构。
此酮胺结构能在碱性环境中与硝基四氮唑蓝NBT 发生还原反应,生成甲月替,并以果糖胺DMF为标准参照物进行比色反应。
二、50管试剂盒组成与配制
1、2mmol/LDMF标准液:0.5ml×2瓶,-20℃保存。
2、牛血清白蛋白:0.5ml×2瓶,-20℃保存。
3、NBT显色剂:60ml×2瓶,避光4℃保存。
4、稳定剂:6ml×1瓶,室温保存。
(如凝固,请水浴加热至透明后再用。
)
三、血清中GSP的检测
混匀,37℃水浴15min。
混匀,530nm,1cm光径,空白管调零,比色。
五、计算公式:
测定管吸光度
×标准液浓度(2mmol/L)=GSPmmol/L
标准管吸光度−标准管吸光度
测定管吸光度
×标准管浓度(2mmol/L)×分子量(249)÷1000=GSPmg/L
标准管吸光度
本试剂盒仅用于科研。
以响应面设计为基础提高果糖胺试剂盒检测性能

以响应面设计为基础提高果糖胺试剂盒检测性能张宝华;王军峰【摘要】目的通过研究影响果糖胺试剂盒检测性能的因素来提高产品质量.方法首先使用Plackett-Burman试验设计对可能影响果糖胺试剂盒分析性能的因素进行筛选,然后通过爬坡试验探索出关键因素的响应区域,最后通过响应面试验完成试剂盒配方的优化.结果试剂优化的配方为:pH=10.3,氯化硝基四氮唑蓝(NBT)0.26 mmol/L,叠氮化钠0.55 g/L,碳酸盐0.1 mol/L,氯化钠0.1 g/L,表面活性剂1.1 mL/L.使用该配方的果糖胺试剂盒与某进口试剂盒检测结果差异无统计学意义.结论NBT和表面活性剂对试剂的质量有明显影响,说明该研究方法能够有效地提高果糖胺试剂盒质量.【期刊名称】《检验医学与临床》【年(卷),期】2011(008)018【总页数】3页(P2196-2198)【关键词】果糖胺;试剂盒,诊断;响应面设计【作者】张宝华;王军峰【作者单位】上海市虹口区江湾镇街道社区卫生服务中心,200434;上海执诚生物技术有限公司,201204【正文语种】中文糖化血清蛋白(glucosylated serum proteins,GSP)测定又称果糖胺测定[1],自1983年Johnson等[2]建立还原法测定果糖胺之后,现在临床多用此法测定血清果糖胺的含量来监测GSP的含量。
关于GSP测定的临床意义目前已有较多报道[3-5],但少有使用响应面设计方法优化试剂盒检验性能的研究。
试验设计具有计算简便、试验次数少、可靠性高、适用面广等特点,因此成为现代获取信息的通用工具,是目前优化和应用数学领域中最活跃、应用成果最显著的分支之一[6]。
近年来各种试验软件的推出,使试验设计更加高效和方便,目前常用的试验设计软件包括SAS、SPSS、minitab和Design expert等。
本文使用Design expert软件完成试验的设计和结果分析。
果糖胺测定试剂盒(NBT法)产品技术要求九强
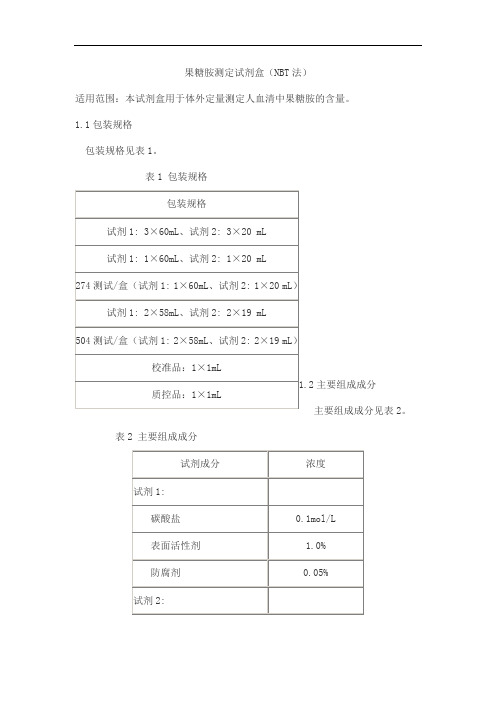
果糖胺测定试剂盒(NBT 法)适用范围:本试剂盒用于体外定量测定人血清中果糖胺的含量。
1.1包装规格 包装规格见表1。
表1 包装规格主要组成成分主要组成成分见表2。
表2 主要组成成分注:不同批号的校准品、质控品赋值有差异,具体赋值详见靶值单。
2.1 外观试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;质控品为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白吸光度A546nm下测定空白吸光度应≤0.1000。
2.4 准确度与已上市的产品进行比对试验:在[50,1000]µmol/L区间内,相关系数r≥0.975,在[50,150]µmol/L区间内绝对偏差应不超过±15µmol/L,在(150,1000]µmol/L区间内相对偏差应不超过±10%。
2.5 分析灵敏度样品浓度为290µmol/L时,吸光度的变化值在0.0200~0.0600之间。
2.6 线性区间在[50,1000]µmol/L区间内,线性相关系数r≥0.990,在[50,150]µmol/L 区间内绝对偏差应不超过±15µmol/L,在(150,1000]µmol/L区间内相对偏差应不超过±10%。
2.7 测量精密度2.7.1 重复性对高、低不同浓度的同一血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于10%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 稳定性试剂盒在2℃~8℃密封避光保存,有效期为12个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.3、2.4、2.5、2.6、2.7.1的要求。
果糖胺(GSP)检测

果糖胺(GSP)检测
【用途】
果糖胺(FRUCT)的测定反映糖化血清蛋白水平,可了解患者过去1-2周内平均血糖的水平。
增高,则表明为糖尿病。
【原理】
血清葡萄糖与血清蛋白分子末端的氨基发生非酶促糖化反应,形成高分子的酮胺结构(果糖胺)在碱性环境中还原硝基四氮唑蓝生成染料。
以糖化血清蛋白为标准参照物进行比色测定。
【标本要求】
不溶血的血清标本,也可用肝素抗凝血浆。
标本在2~8℃可保存一周,不推荐冰冻保存测定标本。
【仪器】仪器为拜尔DVIA 1650生化分析仪。
【试剂】
1.试剂组成:硝基四氮唑蓝、碳酸盐、稳定剂
2.储存:试剂应在2~8℃条件下避光保存,运输中应防潮、防水、注意保持低温。
【测定步骤】
1.
2.计算结果:
FRUCT浓度=[△A(样本)/△A(标准)]×标准浓度
【性能特性】
1.线性:0-4000μmol/L
2.精密度:批内精密度C V≤6.0%,批间相对极差≤8.0%
3.试剂空白吸光度<0.15
【参考范围】健康成人:1.65~2.15mmol/L
【注意事项】
1.试剂和样本可因仪器要求不同,按比例增减。
2.间隔时间可按仪器不同进行调整,但为减少样本中还原性
物质的干扰,延迟时间不应低于300秒。
3.当病人存在低蛋白血症时(如大量输液后,怀孕等)测值
可能偏低。
反应废液应稀释后再倾倒或经过污水处理后排放.。
果糖胺(FUN)测定试剂盒(比色法)产品技术要求mairui

1 性能指标
2.1外观
试剂应为清澈透明的液体,无沉淀、悬浮物和絮状物。
2.2净含量
液体试剂的净含量应不少于标示值。
2.3试剂空白
2.3.1试剂空白吸光度
试剂以水为空白在37℃±1℃,546 nm 波长条件下,吸光度应小于0.1 A。
2.3.2试剂空白吸光度变化率
试剂以水为空白在37℃±1℃,546 nm 波长条件下,吸光度变化率应小于0.002 A/min。
2.4分析灵敏度
当样本浓度为290 µmol/L 时,吸光度变化率应不小于0.018 A/min。
2.5线性范围
试剂盒在(5~1000)µmol/L 范围内:
a)线性相关系数r 应不小于0.9900;
b)当样本浓度不大于360 µmol/L 时,线性绝对偏差应不大于±36.0 µmol/L;当样本浓度大于360 µmol/L 时,线性相对偏差应不大于±10.0%。
2.6测量精密度
2.6.1重复性
变异系数:CV 应不大于 3.0%。
2.6.2批间差
相对偏差:R 应不大于 5.0%。
2.7准确度
测定校准品,测定结果与靶值的相对偏差应不大于±10.0%。
2.8分析特异性
血红蛋白浓度在500 mg/dL 内、内源性酯浓度在500 mg/dL 内、胆红素浓度在8 mg/dL
内,对试剂检测结果的偏差影响应在±10%以内。
2.9校准品均一性
试剂盒校准品的均一性:CV 应不大于 3.0%。
1。
检测果糖胺的试剂盒和方法[发明专利]
![检测果糖胺的试剂盒和方法[发明专利]](https://img.taocdn.com/s3/m/c3565eda846a561252d380eb6294dd88d0d23df4.png)
(19)中华人民共和国国家知识产权局(12)发明专利申请(10)申请公布号 (43)申请公布日 (21)申请号 202011345976.4(22)申请日 2020.11.25(71)申请人 迈克生物股份有限公司地址 611731 四川省成都市高新区百川路16号(72)发明人 任荣梅 龙腾镶 吴昌英 陈中洪 (74)专利代理机构 北京派特恩知识产权代理有限公司 11270代理人 陈万青 张颖玲(51)Int.Cl.G01N 21/77(2006.01)G01N 21/31(2006.01)(54)发明名称检测果糖胺的试剂盒和方法(57)摘要本发明涉及用于检测果糖胺的试剂盒,其包括:第一试剂,其含有碳酸盐缓冲液;第二试剂,其含有硝基四氮唑蓝和阴离子表面活性剂;和校准品,其中,所述阴离子表面活性剂选自磷酸酯盐类阴离子表面活性剂和磺酸盐类阴离子表面活性剂中的一种或更多种,可选地,所述试剂盒用于检测血浆中的果糖胺。
本发明改善了果糖胺检测时血清和血浆样本的检测结果一致性。
本发明还涉及检测果糖胺的方法,及阴离子表面活性剂在改善果糖胺检测结果一致性中的用途。
权利要求书2页 说明书14页CN 112326639 A 2021.02.05C N 112326639A1.一种用于检测果糖胺的试剂盒,包括:第一试剂,其含有碳酸盐缓冲液;第二试剂,其含有硝基四氮唑蓝和阴离子表面活性剂;和校准品,其中,所述阴离子表面活性剂选自磷酸酯盐类阴离子表面活性剂和磺酸盐类阴离子表面活性剂中的一种或更多种,可选地,所述试剂盒用于检测血浆中的果糖胺。
2.权利要求1所述的试剂盒,其中,所述磷酸酯盐类阴离子表面活性剂具有如式I或式II所示的结构,R(OC2H4)n OPO(OM)2 (I)(R(OC2H4)n)2OPO(OM) (II)其中,n=0-10中的任意整数;M是K+、Na+、二乙醇胺残基或三乙醇胺残基;n为0时,R是C8-C18烷基;n不为0时,R是烷基或烷基苯基。
果糖胺检测试剂盒(NBT比色法)产品技术要求

医疗器械产品技术要求编号:果糖胺检测试剂盒(NBT比色法)1.产品型号/规格及其划分说明序号规格1R:4×20ml2R:2×40ml3R:2×50ml4R:2×60ml5R:2×100ml6校准品(选配):1×2ml7质控品(选配):1×2ml2.性能指标2.1外观试剂盒R溶液应呈淡黄色、无颗粒、无杂质、无沉淀和悬浮物;校准品和质控品为白色冻干粉末。
2.2净含量试剂盒各试剂装量应不小于标示值。
2.3试剂空白吸光度用蒸馏水作为样品加入试剂测试,试剂空白吸光度A应≤0.80。
546nm2.4分析灵敏度测试2.50mmol/L被测物时,吸光度差值(△A)范围为0.05~0.25。
2.5线性范围在(0~4)mmol/L范围内,其线性相关系数r≥0.990;浓度≥0.5mmol/L时,相对偏差≤20%;浓度<0.5mmol/L时,绝对偏差≤0.05mmol/L。
2.6测量精密度2.6.1重复性用控制血清重复测试所得结果的重复性(变异系数,CV)应≤6.0%。
2.6.2批间差批间差应≤10.0%。
2.7准确度用参考物质进行测试,其相对偏差应≤10.0%。
3.检验方法仪器基本要求a)波长:546nm;恒温装置温度:37℃±1℃。
b)全自动生化分析仪。
测试方法按说明书规定,因不同机型使用试剂最终浓度相同。
在此推荐以本公司BECKMAN或HITACHI全自动生化分析仪进行测试。
3.1外观和性状目测检查,符合2.1的要求。
3.2净含量用通用量具进行测量,应符合2.2的要求。
3.3试剂空白吸光度用蒸馏水作为样品测试试剂(盒),在测试波长546nm下,记录测试启动时的吸光度(A1)和约5min(t)后的吸光度(A2),A2测试结果即为试剂空白吸光度测定值,应符合2.3的要求。
3.4分析灵敏度用2.50mmol/L的样品(定值血清)测试试剂(盒),记录试剂(盒)在546nm 下产生的吸光度改变,换算为吸光度差值(△A),结果应符合2.4的要求。
糖化血清蛋白测定试剂盒(四氮唑蓝法)产品技术要求万泰德瑞

糖化血清蛋白测定试剂盒(四氮唑蓝法)适用范围:用于体外定量测定人血清中糖化血清蛋白的浓度。
1.1包装规格1)试剂1:60mL×10;2)试剂1:60mL×4;3)试剂1:45mL×6;4)试剂1:20mL×4;5)试剂1:120mL×2;校准品:1.0mL×1(选配);质控品:1.0mL×1(选配)。
1.2组成成分试剂1:硝基四氮唑蓝 0.3mmol/L碳酸盐缓冲液 100mmol/L稳定剂适量校准品:1-脱氧-1-吗啉-D-果糖,磷酸盐缓冲液,人血清(≥5%),目标浓度范围为2.24mmol/L~3.36mmol/L,批特异,具体浓度见瓶签;质控品:1-脱氧-1-吗啉-D-果糖,磷酸盐缓冲液,人血清(≥5%),靶值范围为2.12mmol/L~3.18 mmol/L,批特异,具体浓度见瓶签。
2.1装量应不低于瓶签标示值。
2.2外观试剂1:无色或淡黄色液体;校准品:无色或淡黄色液体;质控品:无色或淡黄色液体。
2.3试剂空白吸光度在37℃、546nm波长、1cm光径条件下,试剂空白吸光度应小于0.3。
2.4准确度用比对试剂盒同时测试至少40例线性范围内的不同浓度的血清样本,其相关系数(r)不小于0.990;[0.6,0.84]mmol/L浓度线性绝对偏差不超过±0.126mmol/L,(0.84,4.2]mmol/L浓度线性相对偏差应不超过±15%。
2.5精密度2.5.1重复性重复测试高、中、低三个水平的血清样品或质控样品,其结果的变异系数应不超过10%。
2.5.2批间差重复测试血清样品或质控样品,其结果相对极差(R)应不超过10%。
2.6线性在[0.6,4.2]mmol/L范围内,线性回归的相关系数应不小于0.990;[0.6,0.84]mmol/L浓度线性绝对偏差不超过±0.126mmol/L,(0.84,4.2]mmol/L浓度线性相对偏差应不超过±15%。
果糖胺测定试剂盒(四氮唑蓝法)产品技术要求jiuqiang

果糖胺测定试剂盒(四氮唑蓝法)适用范围:用于体外定量测定人血清中果糖胺的含量。
1.1 包装规格包装规格见表1。
表1 包装规格1.2 主要组成成分主要组成成分见表2。
表2 主要组成成分2.1 外观试剂为无色或微黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白吸光度试剂空白:A540nm(主)/A700nm(副)下测定空白吸光度应≤0.1000。
2.4 准确度与已上市产品进行比对试验:在[10.0,1000.0] µmol/L区间内,相关系数r2≥0.90,在[10.0,100.0] µmol/L区间内测定的绝对偏差应不超过±15.0µmol/L,在(100.0,1000.0] µmol/L区间内测定的相对偏差应不超过±15%。
2.5 分析灵敏度样本浓度为290µmol/L时,其吸光度变化在0.0200~0.0600之间。
2.6 线性区间在[10.0,1000.0] µmol/L区间内,相关系数r≥0.990,在[10.0,100.0] µmol/L 区间内测定的线性绝对偏差应不超过±10.0µmol/L,在(100.0,1000.0] µmol/L 区间内测定的线性相对偏差应不超过±10%。
2.7 测量精密度2.7.1 重复性对高、低两个浓度的血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于10%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 稳定性试剂盒在2℃~8℃密封避光保存,有效期为12个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.3、2.4、2.5、2.6、2.7.1的要求。
03 FMN

复星长征体外诊断试剂标准操作规程试剂名称:血清果糖胺测定试剂盒(硝基四氮唑蓝法)上海复星长征医学科学有限公司目录1 试剂盒概况2 方法学原理3 试剂主要组分4 样本准备5 试剂准备6 校准要求7 质量控制8 计算方法9 参数设定10 参考范围11 试剂性能概要12 超出可报告范围的处理13 其他必须说明的内容14 参考文献1 试剂盒概况1.1 货号:1.03.1501/1.03.1502/。
1.2 包装规格:试剂1(R1):3×25mL。
1.3 医疗器械注册证编号/产品技术要求编号沪械注准20172400305/沪械注准201724003052 方法学原理血清果糖胺是一种大分子酮胺类化合物。
在碱性条件下可将四氮唑蓝还原形成紫色色原。
紫色色原的生产量与样本中血清果糖胺的浓度成正比。
在540nm处测定吸光度的变化值,即可测得样本中血清果糖胺(FMN)的浓度。
3 试剂主要组分硝基四氮唑蓝0.3mmol/L碳酸盐缓冲液100mmol/L3.2 储存条件3.2 . 1在2~8℃避光、密封的储存条件下,试剂盒自生产之日起效期12个月。
3.2 . 2 试剂启用后,在2~10℃避光的条件下可稳定14天。
4 样本准备样本要求:使用新鲜血清或者血浆,标本应不溶血,2-8℃避光、密封保存可稳定14天。
5 试剂准备试剂为液体单试剂形式,无须特别准备,可直接上机使用。
6 校准要求6.1 校准品:使用与试剂配套使用的复星长征血清果糖胺校准品进行校准。
6.2 校准及校准频次的要求:正常情况下,应每周至少一次对测定进行一次校准。
当试剂使用批号发生改变时,使用的仪器进行保养或者关键部件进行更换后、质控品的测定结果发生漂移或者超出规定的范围,应重新对测定进行校准后再对患者的样本进行检测。
7 质量控制复星长征临床化学控制血清为本试剂配套使用的质控品,进行日常室内质量控制。
8 计算方法样本吸光度血清果糖胺(mmol/L)= ×校准品浓度校准品吸光度9 参数设定按生化分析仪操作要求结合长征试剂说明书输入测定参数,并按校准、质量控制、样本测定的顺序进行常规测定。
用自动生化分析仪测定血清果糖胺的含量

用自动生化分析仪测定血清果糖胺的含量
马建锋
【期刊名称】《临床检验杂志》
【年(卷),期】1990(8)1
【摘要】血清果糖胺测定是根据氯化硝基四氮唑蓝(NBT)在碱性条件下,与糖、蛋白之间的酮胺键还原反应的原理建立;是糖尿病诊断的指标之一.目前国内介绍的多为手工测定方法.近年来我们参考有关文献,用美国IL 公司生产的monarch 2000型离心式自动生化分析仪测定血清中果糖胺含量。
【总页数】1页(P24)
【作者】马建锋
【作者单位】不详;不详
【正文语种】中文
【中图分类】R446.112
【相关文献】
1.自制吗啉果糖测定血清果糖胺的评价 [J], 兰雁飞;唐文淦
2.血清中果糖胺含量的初步探讨 [J], 似学红;任彩芬
3.血清中果糖胺含量的初步探讨 [J], 似学红;任彩芬
4.果糖胺测定——一种血清糖化蛋白测定方法 [J], 杨秀芳;俞茂华;王纹琴;洪绮霞;朱禧星;徐根宝;姚连生
5.用半自动生化分析仪测定果糖胺的含量 [J], 刘芳
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
果糖胺测定试剂盒(四氮唑蓝法)
适用范围:本试剂用于体外定量测定人血清中果糖胺的含量。
产品组成:
2.1 外观
2.1.1 试剂为淡黄色透明液体,无混浊,无未溶解物。
2.1.2 校准品无色透明液体,无混浊,无未溶解物。
2.1.3 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量
液体试剂的净含量不少于标示值。
2.3 试剂空白
2.3.1 试剂空白吸光度
A≤0.020(光径1.0cm,540nm±20nm 波长)。
2.3.2 试剂空白吸光度变化率
ΔA/分≤0.010。
2.4 分析灵敏度
测定2.0mmol/L样本,吸光度变化率在0.01/分~0.03/分范围内。
2.5 线性区间
2.5.1 [0.2,6.0]mmol/L。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.990。
2.5.2 [0.2,1.0]mmol/L范围内,线性绝对偏差应不超过±0.1mmol/L;(1.0,6.0]mmol/L范围内,线性相对偏差应不超过±10%。
2.6 精密度
2.6.1 重复性
变异系数CV≤5.0%。
2.6.2 批间差
批间差≤6.0%。
2.7 准确度
回收率在(100±10)%范围内。
2.8 稳定性
原装试剂2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应符合2.1、2.3、2.4、2.5、2.6.1、和2.7要求。
