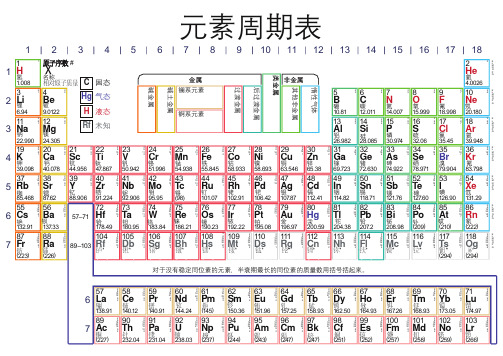
元素周期表1原子序数
元素周期(原始)表
练习: 1、完成下列表格:
2、已知某主族元素的原子结构示意图如下,判 断其位于第几周期,第几族?
3.已知碳元素、镁元素和溴元素的原子结构示意图:
它们分别位于第几周期?为什么? 回答: 碳有两个电子层,位于第二周期,镁有三个电 子层,位于第三周期;溴有四个电子层,位于第 四周期。
4、下列各表为周期表的一部分(表 中为原子序数),其中正确的是( D ) (A)
元素周期表的编排原则
原子序数:根据元素在周期表中位置的编号 原子序数=核电荷数=质子数=核外电子数 根据元素周期律,把已知的一百多种元 素中 电子层数目相同 的各种元素,按原 子序数递增的顺序从左到右排成 横行 , 再把不同横行中 最外电子层的电子数相同 的元素按电子层数递增的顺序由上而下排 成 ,这样得到的一个表,叫做元 纵行 素周期表。
短 周 期
长 周 期
不完全周期
周期:具有相同的电子层数的行
主族 (A)
主族:具有相同的最外层电子数的列
零 族副族 (B)Fra bibliotekVII I族
过渡元素
类别
周期序 数 1 2 3 4
起止元 素 H—He Li—Ne Na—Ar K—Kr Rb—Xe
包括元素 种数 2 8 8 18 18
核外电子 层数 1 2 3 4 5
(1)周期的分类
三个长周期,三个短周期,一个不完全周期
(2)主族与副族的对比
长周期元素和短周期元素共同构成主族,只有 长周期元素构成副族.
周期分类及各周期元素种数
周 期
一 二 三 四 五 六
2 8 短周期 8 18 18 长周期 32
七
26 不完全 周期
元素种数 周期分类
• 3.本节的基本规律: • 原子序数=核电荷数=质子数=核外电子 数 • 周期数=电子层数 • 主族序数=最外层电子数 • 各周期的元素数目:2,8,8,18, 18,32,32 • 稀有气体的原子序数:2,10,18, 36,54,86. • 记住1~20号元素的名称和符号
元素周期表、序数、原子量

化学元素表◇actinium 锕Ac 原子序数:89原子量:227◇aluminium 铝Al 原子序数:13原子量:26.9815◇americium 镅Am 原子序数:95原子量:243◇antimony 锑Sb 原子序数:51原子量:121.75◇argon 氩Ar原子序数:18原子量:39.948◇arsenic 砷As原子序数:33原子量:74.922◇astatine 砹At原子序数:85原子量:210◇barium 钡Ba原子序数:56原子量:137.34◇berkelium 锫Bk 原子序数:97原子量:247◇beryllium 铍Be 原子序数:4原子量:9.012◇bismuth 铋Bi原子序数:83原子量:208.98◇bohrium Bh 原子序数:107原子量:262◇boron 硼B原子序数:5原子量:10.81◇bromine 溴Br原子序数:35原子量:79.904◇cadmium 镉Cd 原子序数:48原子量:112.40◇caesium 铯Cs原子序数:55原子量:132.905◇calcium 钙Ca原子序数:20原子量:40.08◇californium 锎Cf 原子序数:98原子量:251◇carbon 碳C原子序数:6原子量:12.011◇cerium 铈Ce原子序数:58原子量:140.12◇chlorine 氯Cl原子序数:17原子量:35.453◇chromium 铬Cr 原子序数:24原子量:51.996◇cobalt 钴Co原子序数:27原子量:58.933◇copper 铜Cu原子序数:29原子量:63.546◇curium 锔Cm原子序数:96原子量:247◇dubnium Db 原子序数:105原子量:262◇dysprosium 镝Dy 原子序数:66原子量:162.50◇einsteinium 锿Es 原子序数:99原子量:254◇erbium 铒Er原子序数:68原子量:167.26◇europium 铕Eu 原子序数:63原子量:151.96◇fermium 镄Fm 原子序数:100原子量:257◇fluorine 氟 F原子序数:9原子量:18.9984◇francium 钫Fr原子序数:87原子量:223◇gadolinium 钆Gd 原子序数:64原子量:157.25◇gallium 镓Ga原子序数:31原子量:69.72◇germanium 锗Ge 原子序数:32原子量:72.59◇gold 金Au原子序数:79原子量:196.967◇hafnium 铪Hf原子序数:72原子量:178.49◇hassium Hs原子序数:108原子量:265◇helium 氦He原子序数:2原子量:4.0026◇holmium 钬Ho 原子序数:67原子量:164.930◇hydrogen 氢H原子序数:1原子量:1.008◇indium 铟In原子序数:49原子量:114.82◇iodine 碘I原子序数:53原子量:126.9045◇iridium 铱Ir原子序数:77原子量:192.22◇iron 铁Fe原子序数:26原子量:55.847◇krypton 氪Kr原子序数:36原子量:83.80◇lanthanum 镧La 原子序数:57原子量:138.9055◇lawrencium 铹Lr 原子序数:103原子量:257◇lead 铅Pb原子序数:82原子量:207.2◇lithium 锂Li原子序数:3原子量:6.941◇lutetium 镥Lu原子序数:71原子量:174.97◇magnesium 镁Mg 原子序数:12原子量:24.305◇manganese 锰Mn 原子序数:25原子量:54.938◇meitnerium Mt 原子序数:109原子量:266◇mendelevium 钔Md 原子序数:101原子量:256◇mercury 汞Hg原子序数:80原子量:200.59◇molybdenum 钼Mo 原子序数:42原子量:95.94◇neodymium 钕Nd 原子序数:60原子量:144.24◇neon 氖Ne原子序数:10原子量:20.18◇neptunium 镎Np原子序数:93原子量:237.0482◇nickel 镍Ni原子序数:28原子量:58.71◇niobium 铌Nb原子序数:41原子量:92.906◇nitrogen 氮N原子序数:7原子量:14.0067◇nobelium 锘No原子序数:102原子量:254◇osmium 锇Os原子序数:76原子量:190.2◇oxygen 氧O原子序数:8原子量:15.9994◇palladium 钯Pd原子序数:46原子量:106.4◇phosphorus 磷P原子序数:15原子量:30.9738◇platinum 铂Pt原子序数:78原子量:195.09◇plutonium 钚Pu原子序数:94原子量:244.6◇polonium 钋Po原子序数:84原子量:210◇potassium 钾K原子序数:19原子量:39.102◇praseodymium 镨Pr 原子序数:59原子量:140.9077◇promethium 钷Pm 原子序数:61原子量:145.6◇protactinium 镤Pa 原子序数:91原子量:231.0359◇radium 镭Ra原子序数:88原子量:226.0254◇radon 氡Rn原子序数:86原子量:222◇rhenium 铼Re原子序数:75原子量:186.2◇rhodium 铑Rh原子序数:45原子量:102.9055◇rubidium 铷Rb原子序数:37原子量:85.47◇rutherfordium Rf 原子序数:104原子量:261◇ruthenium 钌Ru原子序数:44原子量:101.07◇samarium 钐Sm原子序数:62原子量:150.36◇scandium 钪Sc原子序数:21原子量:44.956◇seaborgium Sg 原子序数:106原子量:263◇selenium 硒Se原子序数:34原子量:78.96◇silicon 硅Si原子序数:14原子量:28.086◇silver 银Ag原子序数:47原子量:107.868◇sodium 钠Na原子序数:11原子量:22.9898◇strontium 锶Sr 原子序数:38原子量:87.62◇sulphur 硫S原子序数:16原子量:32.066◇tantalum 钽Ta 原子序数:73原子量:180.948◇technetium 锝Tc 原子序数:43原子量:98.062◇tellurium 碲Te 原子序数:52原子量:127.60◇terbium 铽Tb原子序数:65原子量:158.9254◇thallium 铊Tl原子序数:81原子量:204.37◇thorium 钍Th原子序数:90原子量:232.038◇thulium 铥Tm 原子序数:69原子量:168.934◇tin 锡Sn原子序数:50原子量:118.69◇titanium 钛Ti 原子序数:22原子量:47.90◇tungsten 钨W 原子序数:74原子量:183.85◇uranium 铀U 原子序数:92原子量:238.0289◇vanadium 钒V 原子序数:23原子量:50.9414◇xenon 氙Xe原子序数:54原子量:131.30◇ytterbium 镱Yb 原子序数:70原子量:173.04◇yttrium 钇Y原子序数:39原子量:88.9059◇zinc 锌Zn原子序数:30原子量:65.39◇zirconium 锆Zr 原子序数:40原子量:91.22。
元素周期表

即:氯的相对原子量为35.453。
原子结构
已知:H有三种同位素H、D、T,则氢分子有几种? 其相对分子质量有几种?
课堂活动:
元素的种类比核素的()
课堂活动:
实际存在的 1H、2H、3H、H+、H ,他们是 2
A、H的5种同位素 B、五种氢元素 C、H的5种核素 D、氢元素的五种不同微粒
课堂活动:
F2 Cl2 Br2 I2,都有较强氧化性。 且氧化性依次增强,元素非金属 性依次增强。
小结: 同主族元素都具有相似性和递变性, 同一主族,从上至下, 元素的金属性在增强, 非金属性在减弱。
原子结构 原子核
质子
中子
核外电子
核电荷数=质子数
原子结构
已知:对于一个原子而言
原子序数=质子数=电子数 又∵核电荷数=质子数
∴原子序数=核电荷数=质子数=电子数
原子结构
构成原子的 粒子
质量/kg 相对质量
电子
质子 9.109×10-31 质子质量的 1/1836
原子核
中子
1.673×10-27 1.675×10-27 1.007 1.008
课堂活动:
A、B、C是周期表中相邻的三种元素,其中A、B是 同周期,B、C是同主族。此三种元素原子最外层电 子数之和为17,质子数之和为31,则A、B、C分别 为什么元素? A是氮元素 B是氧元素
C是硫元素
课堂活动:
元素X的原子获得3个电子或元素Y的原子失去2个电子后, 它们的电子层结构与氖原子的电子层结构相同。 元素X、Y在周期表中的位置是___ 。
如果用各核素的质量数A1、A2……代替 其相对原子质量,计算得到的是元素的 近似相对原子质量
原子结构
初三化学元素周期表(完整版)

初三化学元素周期表(完整版) 初三化学元素周期表原子序数元素符号元素名称相对原子质量元素名称读音1 H 氢 1.0079 (qīng)2 He 氦 4.0026 (hài)3 Li 锂 6.941 (lǐ)4 Be 铍 9.0122 (pí)5 B 硼 10.811 (péng)6 C 碳 12.011 (tàn)7 N 氮 14.007 (dàn)8 O 氧 15.999 (yǎng)9 F 氟 18.998 (fú)10 Ne 氖 20.17 (nǎi) 11 Na 钠 22.9898 (nà)12 Mg 镁 24.305 (měi)13 Al 铝 26.982 (lǚ)14 Si 硅 28.085 (guī)15 P 磷 30.974 (lín)16 S 硫 32.06 (liú)17 Cl 氯 35.453 (lǜ)18 Ar 氩 39.94 (yà)19 K 钾 39.098 (jiǎ)20 Ca 钙 40.08 (gài)21 Sc 钪 44.956 (kàng)22 Ti 钛 47.9 (tài)23 V 钒 50.94 (fán)24 Cr 铬 51.996 (gè)25 Mn 锰 54.938 (měng)26 Fe 铁 55.84 (tiě)27 Co 钴 58.9332 (gǔ)28 Ni 镍 58.69 (niè)29 Cu 铜 63.54 (tóng)30 Zn 锌 65.38 (xīn)31 Ga 镓 69.72 (jiā)32 Ge 锗 72.5 (zhě)33 As 砷 74.922 (shēn)34 Se 硒 78.9 (xī)35 Br 溴 79.904 (xiù)36 Kr 氪 83.8 (kè)37 Rb 铷 85.467 (rú)38 Sr 锶 87.62 (sī) 39 Y 钇 88.906 (yǐ)40 Zr 锆 91.22 (gào)41 Nb 铌 92.9064 (ní)42 Mo 钼 95.94 (mù)43 Tc 锝 (99) (dé)44 Ru 钌 161.0 (liǎo)45 Rh 铑 102.906 (lǎo)46 Pd 钯 106.42 (bǎ)47 Ag 银 107.868 (yín)48 Cd 镉 112.41 (gé)49 In 铟 114.82 (yīn)50 Sn 锡 118.6 (xī)51 Sb 锑 121.7 (tī)52 Te 碲 127.6 (dì)53 I 碘 126.905 (diǎn)54 Xe 氙 131.3 (xiān)55 Cs 铯 132.905 (sè)56 Ba 钡 137.33 (bèi) 57-71 La-Lu 镧系57 La 镧 138.9 (lán)58 Ce 铈 140.1 (shì)59 Pr 镨 140.9 (pǔ)60 Nd 钕 144.2 (nǚ)61 Pm 钷 (147) (pǒ)62 Sm 钐 150.3 (shān)63 Eu 铕 151.96 (yǒu)64 Gd 钆 157.25 (gá)65 Tb 铽 158.9 (tè) 66 Dy 镝 162.5 (dī)67 Ho 钬 164.9 (huǒ)68 Er 铒 167.2 (ěr)69 Tm 铥 168.9 (diū)70 Yb 镱 173.04 (yì)71 Lu 镥 174.967 (lǔ)72 Hf 铪 178.4 (hā)73 Ta 钽 180.947 (tǎn)74 W 钨 183.8 (wū)75 Re 铼 186.207 (lái)76 Os 锇 190.2 (é)77 Ir 铱 192.2 (yī)78 Pt 铂 195.08 (bó)79 Au 金 196.967 (jīn)80 Hg 汞 200.5 (gǒng)81 Tl 铊 204.3 (tā)82 Pb 铅 207.2 (qiān)83 Bi 铋 208.98 (bì)84 Po 钋 (209) (pō)85 At 砹 (201) (ài)86 Rn 氡 (222) (dōng)87 Fr 钫 (223) (fāng)88 Ra 镭 226.03 (léi) 89-103 Ac-Lr 锕系89 Ac 锕 (227) (ā)90 Th 钍 232.0 (tǔ)91 Pa 镤 231.0 (pú)92 U 铀 238.0 (yóu) 93 Np 镎 (237) (ná)94 Pu 钚 (244) (bù)95 Am 镅 (243) (méi)96 Cm 锔 (247) (jú)97 Bk 锫 (247) (péi)98 Cf 锎 (251) (kāi)99 Es 锿 (252) (āi) 100 Fm 镄 (257) (fèi) 101 Md 钔 (258) (mén) 102 No 锘 (259) (nuò) 103 Lr 铹 (262) (láo) 104 Rf 钅卢 (257) (lú) 105 Db 钅杜 (261) (dù) 106 Sg 钅喜 (262) (xǐ)107 Bh 钅波 (263) (bō)108 Hs 钅黑 (262) (hēi)109 Mt 钅麦 (265) (mài)110 Uun (281)111 Uuu (272)112 Uub (285)114 Uuq (289)(加括号的数据为该放射性元素半衰期最长同位素的质量数。
元素周期表(自制)

元素周期表(原子序数)——门捷列夫原子序数=核电荷数=质子数=核外电子书短周期(1-3)长周期(4-6)Ⅷ族(7)主族(A)副族(B)——Ⅷ族(8,9,10)(1)主族,副族,0族,Ⅷ族的位置(2)0族的序号(3)金属与非金属的分界线核素: X同位素:中子数不同的同一种元素同位素应用习题:1.判断位置2.应用选择元素周期律原子(原子核(A,Z),核外电子)电子层划分:K_M_N_O_P_Q→离核越来越远→能量越来越高核外电子排布的一些规律:(1)排满(2)最多容纳2n2个(n为电子层序数)(3)最外层不超过8,次外层不超过18倒数第三层不超过32非金属性,金属性变化研究:(1)原子序数增加,金属性,非金属性有周期性变化(2)原子序数增加,元素最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强。
元素周期律:(1)金属性与非金属性强弱(2)氧化还原性强弱(3)酸碱性强弱(4)元素的化合价(5)寻找新物质(6)粒子半径比较化学键:1.离子键——离子化合物2.共价键——共价化合物3.电子式4.极性键与非极性键5.分子间作用力6.氢键1~20号元素原子核外电子排布的特点:(1)最外层电子数和次外层电子数相等的原子有:(2)最外层电子数是次外层电子数2倍的原子是:(3)最外层电子数是次外层电子数3倍的原子是:(4)最外层电子数是次外层电子数4倍的原子是:(5)次外层电子数是最外层电子数2倍的原子有:(6)内层电子总数是最外层电子数2倍的原子有:(7)电子层数和最外层电子数相等的原子有:(8)电子层数是最外层电子数2倍的原子有:(9)最外层电子数是电子层数2倍的原子有:(10)最外层电子数是电子层数3倍的原子有:与He原子电子层结构相同的离子有____________________________________ 与Ne原子电子层结构相同的离子有____________________________________ 与Ar原子电子层结构相同的离子有____________________________________ (2)核外电子总数为10的粒子阳离子:____________________________________阴离子:____________________________________分子:____________________________________(3)核外电子总数为18的粒子阳离子:____________________________________阴离子:____________________________________分子:____________________________________核外电子总数及质子总数均相同的粒子____________________________________________________________________________________________________________。
核外电子排布与元素周期表

P S 110 104
K 227
Rb 248 Cs 265
Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As 197 161 145 132 125 124 124 125 125 128 133 122 122 121
Se 117
Br 114Байду номын сангаас
Kr 198
Xe 217
Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I 215 181 160 143 136 136 133 135 138 144 149 163 141 141 137 133 Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po 217 188 159 143 137 137 134 136 136 144 160 170 175 155 153
Au
Hg Tl
[Xe]4f145d106s1
[Xe]4f145d106s2 [Xe]4f145d106s26p1
82
83 84
Pb
Bi Po
[Xe]4f145d106s26p2
[Xe]4f145d106s26p3 [Xe]4f145d106s26p4
85
86
At
Rn
[Xe]4f145d106s26p5
(四)
31
32 33 34 35 36
Ga
Ce As Se Br Kr
[Ar]3d104s24p1
[Ar]3d104s24p2 [Ar]3d104s24p3 [Ar]3d104s24p4 [Ar]3dl04s24p5 [Ar]3d104s24p6
37 38 39 40
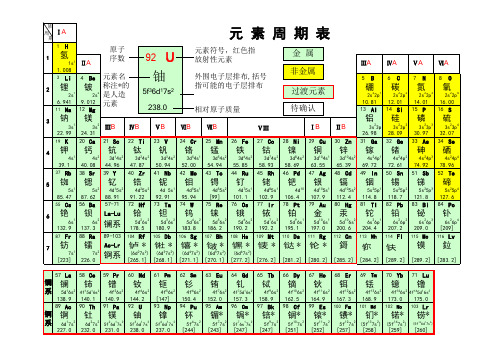
元素周期表(全面版)
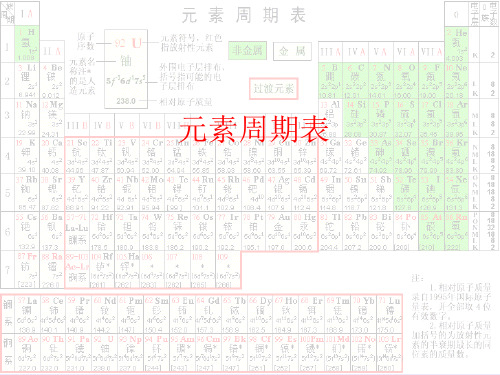
周期族I A1 0181 1 H 氢1.008 Ⅱ A2Ⅲ A13Ⅳ A14Ⅴ A15Ⅵ A16Ⅶ A172 He氦4.0032 3 Li 锂6.941 4 Be铍9.0125 B硼10.816 C碳12.017 N氮14.018 O氧16.009 F氟19.0010 Ne氖20.183 11 Na 钠22.99 12 Mg镁24.31Ⅲ B3Ⅳ B4Ⅴ B5Ⅵ B6Ⅶ B7Ⅷ8 9 10I B11Ⅱ B1213 Al铝26.9814 Si硅28.0915 P磷30.9716 S硫32.0617 Cl氯35.4518 Ar氩39.954 19 K钾39.10 20 Ca钙40.0821 Se钪44.9622 Ti钛47.8723 V钒50.9424 Cr铬52.0025 Mn锰54.9426 Fe铁55.8527 Co钴58.9328 Ni镍58.6929 Cu铜63.5530 Zn锌65.3831 Ga镓69.7232 Ge锗72.6333 As砷74.9234 Se硒78.9635 Br溴79.9036 Kr氪83.805 37 Rb 铷85.47 38 Sr锶87.6239 Y钇88.9140 Zr锆91.2241 Nb铌92.9142 Mo钼95.9643 Tc锝[98]44 Ru钌101.145 Rh铑102.946 Pd钯106.447 Ag银107.948 Cd镉112.449 In铟114.850 Sn锡118.751 Sb锑121.852 Te碲127.653 I碘126.954 Xe氙131.36 55 Cs 铯132.9 56 Ba钡137.357~71La~Lu镧系72 Hf铪178.573 Ta钽180.574 W钨183.975 Re铼186.276 Os锇190.277 Ir铱192.278 Pt铂195.179 Au金197.080 Hg汞200.681 Ti铊204.482 Pb铅207.283 Bi铋209.084 Po钋[209]85 At砹[210]86 Rn氡[222]7 87 Fr钫[223] 88 Ra镭[226]89~103Ac~Lr锕系104 Rf钅卢*[265]105 Db钅杜*[268]106 Sg钅喜*[271]107 Bh钅波*[270]108 Hs钅黑*[277]109 Mt钅麦*[276]110 Ds钅达*[281]111 Rg钅仑*[280]112 Cn钅哥*[285]113Uut*[284]114 Fl*[289]115Uup*[288]116 Lv*[293]117Uus*[294]118Uuo*[294]镧系57 La镧138.958 Ce铈140.159 Pr镨140.960 Nd钕144.261 Pm钷*[145]62 Sm钐150.463 Eu铕152.064 Gd钆157.365 Tb铋158.966 Dy镝162.567 Ho钬164.968 Er铒167.369 Tm铥168.970 Yb镱173.171 Lu镥175.0锕系89 Ac锕[227]90 Th钍232.091 Pa镤231.092 U铀238.093 Np镎[237]94 Pu钚[244]95 Am镅*[243]96 Cm锯*[247]97 Bk锫*[247]98 Cf锎*[251]99 Es锿*[252]100 Fm镄*[257]101 Md钔*[258]102 No锘*[259]103 Lr铹*[262]金属非金属过渡元素8 O氧16.00原子序数元素符号,红色指放射性元素元素名称,注*的是人造元素相对原子质量(加括号的数据为该放射性元素半衰期最长同位数的质量数)元素周期表元素周期表有关知识一、部分酸、碱和盐的溶解性表(室温)说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“-”表示那种物质不存在或遇水就分解了。
元素周期表
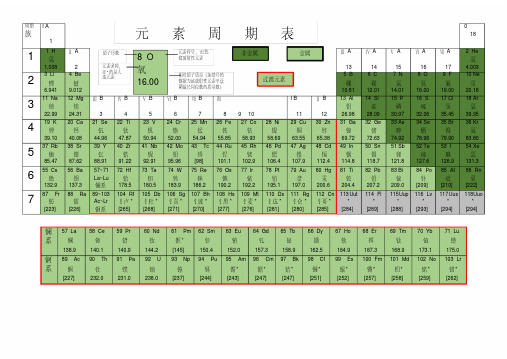
族I A 00 族周期电子数1 H2 He氢氦1s 1II A s 区p 区d 区 f 区III A IV A V A VI A VII A1s 21.0084.0033 Li4 Be43 Tc*5 B6 C7 N8 O9 F 10 Ne锂铍锝硼碳氮氧氟氖2s 12s 24d 75s 12s 22p 12s 22p 22s 22p 32s 22p 42s 22p 52s 22p 66.9419.012[99]10.8112.0114.01161920.1811 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl 18 Ar钠镁铝硅磷硫氯氩3s 13s 2III B IV B V B VI B VII B I B II B 3s 23p 13s 23p 23s 23p 33s 23p 43s 23p 53s 23p 622.9924.3126.9828.0930.9732.0635.4539.9519 K20 Ca 21 Sc22 Ti23 V24 Cr25 Mn26 Fe27 Co28 Ni29 Cu30 Zn31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr钾钙钪钛钒铬锰铁钴镍铜锌镓锗砷硒溴氪4s 14s 23d 14s 23d 24s 23d 34s 23d 34s 23d 54s 23d 64s 23d 74s 23d 84s 23d104s 13d104s 24s 24p 14s 24p 24s 24p 34s 24p 44s 24p 54s 24p 639.1040.0844.9647.8750.9452.0054.9655.8458.9358.6963.5565.4169.7272.6474.9278.9679.983.837 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc*44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe铷锶钇锆铌钼锝钌铑钯银镉铟锡锑碲碘氙5s 15s 24d 15s 24d 25s 24d 35s 24d 45s 24d 55s 24d 75s 14d 85s 14d 104d 105s 14d 105s 25s 25p 15s 25p 25s 25p 35s 25p 45s 25p 55s 25p 685.4787.6288.9191.2292.9195.94[99]101.07102.91106.42107.90112.40114.82118.71121.76127.60126.90131.2955 Cs56 Ba 57~7172 Hf 73 Ta 74 W 75 Re 76 Os 77 Ir 78 Pt 79 Au 80 Hg 81 Tl 82 Pb 83 Bi 84 Po 85 At 86 Rn铯钡La~Lu铪钽钨铼锇铱铂金汞铊铅铋钋砹氡6s 16s 25d 26s 25d 36s 25d 46s 25d 56s 25d 66s 25d 76s 25d 96s 15d106s 15d106s 26s 26p 16s 26p 26s 26p 36s 26p 46s 26p 56s 26p 6132.9137.3178.5180.9183.84186.21190.23192.22195.08197.00200.60204.38207.20209.00[209][210][222]87 Fr88 Ra 89~103104 Rf*105 Db*106 Sg*107 Bh*108 Hs*109 Mt*110 Ds*111 Rg*钫镭Ac~Lr……7s 17s 2[223][226]57 La58 Ce59 Pr60 Nd61 Pm*62 Sm63 Eu64 Gd65 Tb66 Dy67 Ho68 Er69 Tm70 Yb71 Lu镧铈镨钕钷钐铕钆铽镝钬铒铥镱镥5d 16s 24f 15d 16s24f 36s 24f 46s 24f 56s 24f 66s 24f 76s 24f 75d 16s24f 96s 24f106s 24f116s 24f126s 24f136s 24f146s25d 16s 2138.91140.12140.91144.24[145]150.36151.96157.25158.93162.50164.93167.26168.93173.04174.9789 Ac 90 Th 91 Pa 92 U 93 Np*94 Pu*95 Am*96 Cm*97 Bk*98 Cf*99 Es*100 Fm*101 Md*102 No*103 Lr*锕钍镤铀镎钚镅锔锫锎锿镄钔锘铹6d 17s 26d 27s 25f 26d 17s25f 36d 17s25f 46d 17s25f 67s 25f 77s 25f 76d 17s25f 97s 25f107s 25f117s 25f127s 25f137s 25f147s26d 17s 2[227]232.04231.04238.03[237][244][243][247][247][251][252][257][258][259][262]VIII 电子层KP O N M L K123456818321882镧系锕系7镧系锕系2L K82M L KN M L K O N M L K 882818828181882元 素 周 期 表外围电子排布元素名称元素符号,红色指放射性元素,注*的指人造元素相对原子质量(加括号表示该放射性元素半衰期最长同位素的质量数)注:此表为便于分析EPR 谱图参数(如g 、D 因子)与原子、离子外围电子排布的一一映射而绘制,详见相关章节。
元素周期表原子序数

4、主族元素的原子结构与位置的关系
分析:电子层数决定元素所在的周期, 最外层电子排布决定元素的所在的族。
周期序数=电子层数 主族序数=最外层电子数
(1) 已知某主族元素的原子结构示意图如 下,判断位于第几周期,第几族? 第三周期 第ⅥA族 第五周期 第ⅦA 族
练习:
X
Y
(2)已知某元素位于周期表中第三 周期,第ⅦA族,画出该元素的原子结构示 意图。
核外电子层数
1 2 3 4 Βιβλιοθήκη 6 7长 周 期5 6 7
②分类:7个横即7个周期。 周期分为短周期和长周期,短周 期包括第一、二、三周期,长周期包 括第四、五、六、七周期。 ③特点: 每一周期元素电子层数相同; 每一周期都是以活泼金属碱金属 元素开始逐渐过渡到活泼非金属卤素, 最后以稀有气体元素结束。
【预备知识】
元素的金属性和非金属性的强弱的判断 依据: 金属性强弱的判断: ①单质与水反应置换出氢的难易程度; ②单质与酸反应置换出氢的难易程度;③最 高价氧化物对应的水化物(氢氧化物)的碱 性强弱。 非金属性强弱的判断: ①与氢气反应生成氢化物的难易程度; ②氢化物的稳定性;③最高价氧化物对的水 化物的酸性强弱。
(2)化学性质:
①卤素单质与H2的反应
卤素单质与氢气的反应 F2 Cl2 Br2 在冷、暗处就能剧烈化合而爆炸,生成的氟 化氢很稳定。 在光照或点燃下发生剧烈反应,生成的氯化 氢较稳定。 化学方程式 F2+H2=2HF Cl2+H2=2HCl Br2+H2=2HBr
在加热至一定温度才能反应,生成的溴化氢 不如氯化氢稳定
第一章 物质结构 元素周期律
第一节 元素周期表
授课人:董 啸
元素周期表
1.20第一节 元素周期表

元素周期表一、元素周期表1. 原子序数:原子序数= ______________ = ___________________ = __________________2. 元素周期表的编排原则(1)将__________________的元素按_________________的顺序从左到右排成横行(2)把__________________的元素按_________________的顺序从上到下排成纵行3. 周期表的结构(1)周期:元素周期表共有个横行,每一横行称为一个,故元素周期表共有个周期(2)族:元素周期表共有个纵行,除了三个纵行称为Ⅷ外,其余的每一个纵行称为一个,故元素周期表共有个族。
族的序号一般用罗马数字表示。
①族的分类a、主族:由元素和元素共同构成的族,用A表示:如:ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦAb、副族:完全由长周期元素构成的族,用B表示:ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦBc、第Ⅷ族:三个纵行(注意: 第Ⅷ族既不是主族也不是副族)d、零族:第__ _ 纵行,即稀有气体元素②主族序数与最外层电子数的关系:练习:画出具有下列原子序数的元素原子结构示意图,并指出其在周期表中的位置。
9、16、14、5、17 7 6 13 15 8_______________________________________________________________________二、元素的性质和原子结构1、碱金属元素(1)结构从锂→铯:相同点: 最外层电子数均为_____________不同点: 随着核电荷数的增多,电子层数___________,,原子半径______________。
注意:比较元素金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度,以及它们的最高价氧化物的水化物的碱性强弱来比较(3)物理性质相似性:除Cs略带金属光泽外,其余的都是_________色,它们都比较________,有________性.密度都比较_________,熔点也都比较________ ,导电性和导热性也都_____________.递变性:随核电荷数的增多,碱金属的密度逐渐_________,熔、沸点逐渐_________________.思考:锂和钾的保存方法?_________________________________________________随堂练习:1.下列金属与水反应最剧烈的是A.Li B.K C.Rb D.Cs2.钠和铯都是碱金属元素,下列关于铯及其化合物的叙述中不正确的是A.硫酸铯的化学式为Cs2SO4B.氢氧化铯是一种强碱C.铯的熔沸点比钠的低D.碳酸铯受热易分解成氧化铯和二氧化碳2、卤族元素(1) 卤素的原子结构特点从氟至碘:相同点: 最外层电子数________________.不同点: 随着核电荷数的递增,电子层数逐渐_______________(2) 卤素单质的物理性质:从F2→I2颜色逐渐__________, 密度逐渐_____________, 熔沸点逐渐____________ .总结:从F→I,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱,因此,F2、Cl2、Br2、I2的氧化性依次减弱。
(完整版)化学元素周期表(高清)
173.0
102
锘*
系 6d17s2 6d27s2 5f26d17s 5f36d17s 5f46d17s 5f67s2 5f77s2 5f76s17s 5f97s2 5f107s2 5f117s2 5f127s2 (5f137s2 (5f147s2
227.0 232.0 231.0 238.0 237.0 [244] [243] [247] [247] [251] [252] [257] [258] [259]
族
ⅠA
周期
化学化工学院 化学教育 13班
李时雨 元201素0102周40621期 表
1H
1氢
1s1 ⅡA
原子 序数
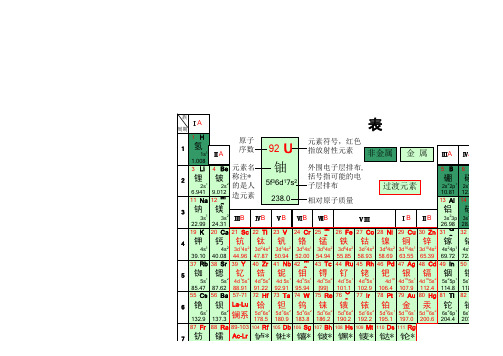
92 U
元素符号,红色
指放射性元素 非金属
金属
ⅢA ⅣA
1.008
3 Li 4 Be 元素名
铀
外围电子层排布s2 的是人
5f36d17s2
括号指可能的电 子层排布
6
55 Cs 56 Ba 57-71 72 Hf
铯 钡 La-Lu 铪
73 Ta 74 W
钽钨
75 Re
铼
76锇Os
77 Ir
铱
78 Pt 79 Au 80 Hg 81 Tl 82
铂金汞铊铅
6s1
镧系 6s2
5d26s2 5d36s2 5d46s2 5d56s2 5d66s2 5d76s2 5d96s1 5d106s1 5d106s2 6s26p1 6s26p2
39.10 40.08 44.96 47.87 50.94 52.00 54.94 55.85 58.93 58.69 63.55 65.39 69.72 72.61
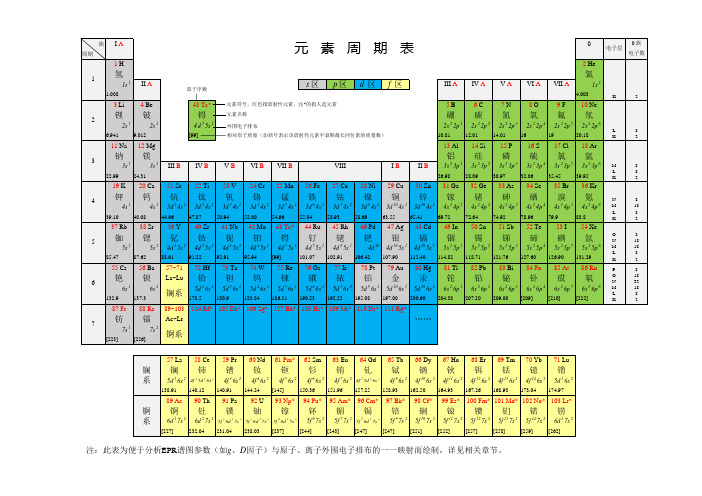
元素周期表(高清PDF版)
23 2
8 10
V 2 钒
24 2
8 11
2 Cr 铬
25 2
8 13
1 Mn 锰
26 2
8 13
2 Fe 铁
27 2
8 14
2 Co 钴
28 2
8 15
2 Ni 镍
29 2
8 16
30 2
8 18
31 2
8 18
32 2
8 18
33 2
8 18
34 2
8 18
35 2
8 18
36 2
8 18
2K 8L 18 M
Xe 18 7
氙
2K 8L 18 M 18 N 8O
P Q
101.07 102.91 106.42 107.87 112.41 114.82 118.71 121.76 127.60 126.90 131.29
55
56 2
8 18
2 8 18
72
73 2
8 18
74 2
8 18
75 2
8 18
76 2
2 Cu 1 Zn
2 Ga 3 Ge 4 As 5 Se
6 Br
7 Kr
8N O P
铜
锌
镓
锗
砷
硒
溴
氪
Q
39.098 40.078 44.956 47.867 50.942 51.996 54.938 55.845 58.933 58.693 63.546 65.38 69.723 72.630 74.922 78.971 79.904 83.798
37
38 2
8 18
5 Rb
元素周期表

元素周期表原子序数: 1 hydrogen氢符号: H原子量: 1.008原子序数: 2helium氦符号: He原子量: 4.003原子序数: 3lithium锂符号: Li原子量: 6.941原子序数: 4beryllium铍符号: Be原子量: 9.012原子序数: 5boron硼符号: B原子量: 10.81原子序数: 6carbon碳符号: C原子量: 12.01原子序数: 7nitrogen氮符号: N原子量: 14.01原子序数: 8 oxygen氧符号: O原子量: 16.00原子序数: 9 fluorine氟符号: F原子量: 19.00原子序数: 10 neon氖符号: Ne原子量: 20.18原子序数: 11 sodium钠符号: Na原子量: 22.99原子序数: 12 magnesium镁符号: Mg 原子量: 24.31原子序数: 13 aluminium铝符号: Al原子量: 26.98原子序数: 14 silicon硅符号: Si原子量: 28.09原子序数: 15 phosphorus磷符号: P原子量: 30.97原子序数: 16 sulphur硫符号: S原子量: 32.07原子序数: 17 chlorine氯符号: Cl原子量: 35.45原子序数: 18 argon氩符号: Ar原子量: 39.95原子序数: 19 potassium钾符号: K原子量: 39.10原子序数: 20 calcium钙符号: Ca原子量: 40.08原子序数: 21 scandium钪符号: Sc原子量: 44.96 原子序数: 22titanium钛符号: Ti原子量: 47.87原子序数: 23 vanadium钒符号: V原子量: 50.94原子序数: 24 chromium铬符号: Cr原子量: 52.00原子序数: 25 manganese锰符号: Mn 原子量: 54.94原子序数: 26 iron铁符号: Fe原子量: 55.85原子序数: 27 cobalt钴符号: Co原子量: 58.93原子序数: 28 nickel镍符号: Ni原子量: 58.69原子序数: 29 copper铜符号: Cu原子量: 63.55原子序数: 30 zinc锌符号: Zn原子量: 65.39原子序数: 31 gallium镓符号: Ga原子量: 69.72原子序数: 32 germanium锗符号: Ge原子量: 72.61原子序数: 33 arsenic砷符号: As原子量: 74.92原子序数: 34 selenium硒符号: Se原子量: 78.96原子序数: 35 bromine溴符号: Br原子量: 79.90原子序数: 36 krypton氪符号: Kr原子量: 83.80原子序数: 37rubidium铷符号: Rb原子量: 85.47原子序数: 38strontium锶符号: Sr原子量: 87.62原子序数: 39yttrium钇符号: Y原子量: 88.91原子序数: 40zirconium锆符号: Zr原子量: 91.22原子序数: 41niobium铌符号: Nb原子量: 92.91原子序数: 42molybdenum 钼符号: Mo原子量: 95.94原子序数: 43technetium锝符号: Tc原子量: [98]原子序数: 44 ruthenium钌符号: Ru原子量: 101.1原子序数: 45 rhodium铑符号: Rh原子量: 102.9原子序数: 46 palladium钯符号: Pd原子量: 106.4原子序数: 47 silver银符号: Ag原子量: 107.9原子序数: 48 cadmium镉符号: Cd原子量: 112.4原子序数: 49 indium铟符号: In原子量: 114.8原子序数: 50 tin锡符号: Sn原子量: 118.7原子序数: 51 antimony锑符号: Sb原子量: 121.8原子序数: 52 tellurium碲符号: Te原子量: 127.6原子序数: 53 iodine碘符号: I原子量: 126.9原子序数: 54 xenon氙符号: Xe原子量: 131.3原子序数: 55 caesium铯符号: Cs原子量: 132.9原子序数: 56 barium钡符号: Ba原子量: 137.3原子序数: 57 lanthanum镧符号: La原子量: 138.9 原子序数: 58cerium铈符号: Ce原子量: 140.1原子序数: 59 praseodymium镨符号: Pr原子量: 140.9原子序数: 60 neodymium钕符号: Nd 原子量: 144.2原子序数: 61 promethium钷符号: Pm 原子量: [145]原子序数: 62 samarium钐符号: Sm 原子量: 150.4原子序数: 63 europium铕符号: Eu原子量: 152.0原子序数: 64 gadolinium钆符号: Gd原子量: 157.3原子序数: 65 terbium铽符号: Tb原子量: 158.9原子序数: 66 dysprosium镝符号: Dy原子量: 162.5原子序数: 67 holmium钬符号: Ho原子量: 164.9原子序数: 68 erbium铒符号: Er原子量: 167.3原子序数: 69 thulium铥符号: Tm 原子量: 168.9原子序数: 70 ytterbium镱符号: Yb原子量: 173.0原子序数: 71 lutetium镥符号: Lu原子量: 175.0原子序数: 72 hafnium铪符号: Hf原子量: 178.5原子序数: 73 tantalum钽符号: Ta原子量: 180.9原子序数: 74 tungsten钨符号: W原子量: 183.8原子序数: 75 rhenium铼符号: Re原子量: 186.2原子序数: 76 osmium锇符号: Os原子量: 190.2原子序数: 77 iridium铱符号: Ir原子量: 192.2原子序数: 78 platinum铂符号: Pt原子量: 195.1原子序数: 79 gold金符号: Au原子量: 197.0 原子序数: 80mercury汞符号: Hg原子量: 200.6原子序数: 81thallium铊符号: Tl原子量: 204.4原子序数: 82lead铅符号: Pb原子量: 207.2原子序数: 83 bismuth铋符号: Bi原子量: 209.0原子序数: 84polonium钋符号: Po原子量: [210]原子序数: 85astatine砹符号: At原子量: [210]原子序数: 86radon氡符号: Rn原子量: [222]原子序数: 87 francium钫符号: Fr原子量: [223]原子序数: 88 radium镭符号: Ra原子量: [226]原子序数: 89 actinium锕符号: Ac原子量: [227]原子序数: 90 thorium钍符号: Th原子量: 232.0原子序数: 91 protactinium镤符号: Pa原子量: 231.0原子序数: 92 uranium铀符号: U原子量: 238.0原子序数: 93 neptunium镎符号: Np 原子量: [237]原子序数: 94plutonium钚符号: Pu 原子量: [244]原子序数: 95 americium镅符号: Am 原子量: [243]原子序数: 96 curium锔符号: Cm 原子量: [247]原子序数: 97 berkelium锫符号: Bk原子量: [247]原子序数: 98 californium锎符号: Cf原子量: [251]原子序数: 99 einsteinium锿符号: Es原子量: [252]原子序数: 100 fermium镄符号: Fm 原子量: [257]原子序数: 101 mendelevium钔符号: Md 原子量: [258]原子序数: 102 nobelium锘符号: No 原子量: [259]原子序数: 103 lawrencium铹符号: Lr原子量: [260]原子序数: 104 rutherfordium符号: Rf原子量: [261]原子序数: 105 dubnium符号: Db 原子量: [262]原子序数: 106 seaborgium符号: Sg原子量: [263]原子序数: 107 bohrium符号: Bh 原子量: [264]原子序数: 108 hassium符号: Hs 原子量: [265]原子序数: 109 meitnerium符号: Mt 原子量: [268]。
元素周期表原子序数

二、元素的性质与原子结构的关系
1、碱金属元素 【科学探究1】请同学们查阅有关信息,
并完成P5表。由此可以得出碱金属元素的 原子结构有何异同?
〖结论〗碱金属元素的原子结构特点:
①共同点:
最外层电子数都相同为1。 ②不同点:
核电荷数从Li到Cs逐渐增多;电子层 数依次增多;原子半径依次增大。
(1)物理性质:
【科学探究2】根据表1-1碱金属的物 理性质,请总结碱金属的物理性质有什么 相似性和递变性?
〖结论〗碱金属的物理性质:
①相似性:
银白色(除铯外),柔软,有延展性, 熔沸点低,密度小,导电导热性好。
②递变性:
随核电荷数增加,密度逐渐增大(K 除外),熔沸点逐渐降低。
(2)化学性质
〖实验探究〗钠和钾分别与氧气和水 反应比较。
主族:IA 、IIA、 IIIA 、IVA、 VA、 VIA、 VIIA 。
▪ 副族:由长周期元素共同构成的族,用 符号B 表示。
副族:IB、 IIB 、IIIB、 IVB 、VB、 VIB、 VIIB。
▪ 特殊族:第VIII族包括8、9、10三个纵 行的元素;0族为稀有气体元素。
③规律: 主族的序数=最外层电子数 ④特殊名称: IA:碱金属元素; IVA :碳族元素; VA :氮族元素; VIA :氧族元素; VIIA:卤族元素; 0族:稀有气体元素。
周期:具有相同的电子层数的行
3、周期表的结构
(1)周期: ①定义:
将具在相同电子层数的元素,按照原子 序数递增的顺序排列的一个横行,称为一个 周期。
序号:周期序数=电子层数
[学生活动]阅读教材P4页,数一数元素 周期表有多少个横行?思考周期表中有多少 周期?每周期有多少种元素?
化学元素周期表

化学元素周期表百科名片化学元素周期表是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,他将当时已知的63种元素依原子量大小并以表的形式排列,把有相似化学性质的元素放在同一行,就是元素周期表的雏形。
在周期表中,元素是以元素的原子序排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族。
现代化学的元素周期律是1869年的德米特里·伊万诺维奇·门捷列夫首创的。
19 13年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序数)排列,经过多年修订后才成为当代的周期表。
常见的元素周期表为长式元素周期表。
在长式元素周期表中,元素是以元素的原子序排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族,最后有两个系。
除长式元素周期表外,常见的还有短式元素周期表,螺旋元素周期表,三角元素周期表等。
道尔顿提出科学原子论后,随着各种元素的相对原子质量的数据日益完善和原子价(化合价)概念的提出,就使元素相对原子质量与性质(包括化合价)之间的联系显露出来。
德国化学家德贝莱纳就提出了“三元素组”观点。
他把当时已知的54种元素中的15种,分成5组,每组的三种元素性质相似,而且中间元素的相对原子质量等于较轻和较重的两个元素相对原子质量之和的一半。
例如钙、锶、钡,性质相似,锶的相对原子质量大约是钙和钡的相对原子质量之和的一半。
法国矿物学家尚古多提出了一个“螺旋图”的分类方法。
他将已知的62种元素按相对原子质量的大小顺序,标记在绕着圆柱体上升的螺旋线上,这样某些性质相近的元素恰好出现在同一母线上。
这种排列方法很有趣,但要达到井然有序的程度还有困难。
另外尚古多的文字也比较暧昧,不易理解,虽然是煞费苦心的大作,但长期未能让人理解。
英国化学家纽兰兹把当时已知的元素按相对原子质量大小的顺序进行排列,发现无论从哪一个元素算起,每到第八个元素就和第一一个元素的性质相近。
化学元素周期表
钨
5d46s2 183.8
铼
5d56s2 186.2
锇
5d66s2 190.2
铱
5d76s2 192.2
铂
5d96s1 195.1
金
5d106s1 197.0
汞
5d106s2 200.6
铊
6s26p1 204.4
铅
6s26p2 207.2
铋
6s26p3 209.0
钋
6s26p4 [209]
87 Fr 88 Ra 89-103 104 Rf 105 Db 106 Sg 107 Bh 108 Hs 109 Mt 110 Ds 111 Rg 112 Cn 113 Nh 114 Fl 115 Mc 116 Lv
7 钫 镭 Ac-Lr 钅卢 * 钅杜 * 钅喜 * 钅波 * 钅黑 * 钅麦 * 钅达 * 钅仑 * 鎶 钅尔 钅夫
镆鉝
7s1
锕系 7s2
(6d27s2) (6d37s2) (6d47s2) (6d57s2) (6d67s2)
[223] 226.0
[265.1] [268.1] [271.1] [270.1] [277.2] [276.2] [281.2] [280.2] [285.2] [284.2] [289.2] [289.2] [283.2]
2
2 He
氦
ⅦA
1s2
4.003 K
2
9 F 10 Ne
氟氖
2s22p5
2s22p6 L
8
19.00 20.18 K
2
17 Cl 18 Ar
氯
氩M
8
3s23p5
3s23p6 L
8
35.45 39.95 K
化学元素周期表

化学元素周期表元素周期表是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,后来又经过多名科学家多年的修订才形成当代的周期表。
元素周期表中共有118种元素。
每一种元素都有一个编号,大小恰好等于该元素原子的核内电子数目,这个编号称为原子序数。
原子的核外电子排布和性质有明显的规律性,科学家们是按原子序数递增排列,将电子层数相同的元素放在同一行,将最外层电子数相同的元素放在同一列。
元素周期表有7个周期,16个族。
每一个横行叫作一个周期,每一个纵行叫作一个族。
这7个周期又可分成短周期(1、2、3)、长周期(4、5、6)和不完全周期(7)。
共有16个族,又分为7个主族(ⅠA-ⅦA),7个副族(ⅠB-ⅦB),一个第ⅧB族,一个零族。
元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系。
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。
失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。
元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。
同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子序数递增,元素金属性递增,非金属性递减。
元素周期表的意义重大,科学家正是用此来寻找新型元素及化合物。
1、可以每五种元素为一句去记忆氢、氦、锂、铍、硼;H He Li Be B碳、氮、氧、氟、氖。
C N O F Ne钠、镁、铝、硅、磷;Na Mg Al Si P硫、氯、氩、钾、钙。
S Cl Ar K Ca2、按周期分的化学元素周期表口诀:第一周期:氢氦 ----侵害第二周期:锂铍硼碳氮氧氟氖 ---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命铁钴镍铜锌镓锗 ---- 铁姑捏痛新嫁者砷硒溴氪 ---- 生气休克第五周期:铷锶钇锆铌 ---- 如此一告你。
元素周期表(第一课时)

二、编排原则 1、按照原子序数(核电荷数)递增的顺序从左到右排列。 2、将电子层数相同的元素,按原子序数递增的顺序从 左到右排成一横行—周期。 3、把最外层电子数相同的元素,按电子层数递增的顺 序由上而下排成一纵行—族。
三、元素周期表的结构
1、周期 周期序数 = 电子层数
①元素周期表中具有相同的电子层数的元素,
N : +7 2 5
O : +8 2 6
F : +9 2 7 Ne : +10 2 8
Na : +11 2 8 1 Mg :+12 2 8 2 Al : +13 2 8 3 Si : +14 2 8 4
P : +15 2 8 5 S : +16 2 8 6 Cl : +17 2 8 7 Ar : +18 2 8 8
57
6 55 56 - 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86
71
18 32
7 87
88
89103
104
105
106
107
108
109
110
111
112
【小结】对于ⅢA到ⅦA族, 同主族相邻元素的原子序数相差下一周期所容纳元素种。类
2、同主族相邻元素的原子序数之差:
8 5 6 7 8 9 10
III IV V VI VII
3 11 12 B B B B B
VIII
8 IB
II B
13 14 15 16 17 18
M L k
18 4 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
1到18号元素序数

1到18号元素序数一、引言元素周期表是化学学科的基础,它按照元素的原子序数将元素分类排列。
在本文档中,我们将介绍元素周期表中的前18个元素的序数。
二、氢(H)序数:1符号:H原子序数:1原子团:H原子团三、氦(He)序数:2符号:He原子序数:2原子团:He原子团(稀有气体)四、锂(Li)序数:3符号:Li原子序数:3原子团:Li离子(正一价)五、铍(Be)序数:4符号:Be原子序数:4原子团:Be离子(正二价)六、硼(B)序数:5符号:B原子序数:5原子团:B离子(正三价)和B原子团(硼砂)七、碳(C)序数:6符号:C原子序数:6原子团:C离子(正四价)和C原子团(石墨)八、氮(N)序数:7符号:N原子序数:7原子团:N离子(正三价)和N原子团(氮气)九、氧(O)序数:8符号:O原子序数:8原子团:O离子(负二价)和O原子团(氧气)十、氟(F)序数:9符号:F原子序数:9原子团:F离子(负一价)和F原子团(氟气)十一、钠(Na)序数:11符号:Na原子序数:11原子团:Na离子(正一价)和Na原子团(金属钠)十二、镁(Mg)序数:12符号:Mg原子序数:12原子团:Mg离子(正二价)和Mg原子团(金属镁)十三、铝(Al)序数:13符号:Al原子序数:13原子团:Al离子(正三价)和Al原子团(铝)十四、硅(Si)序数:14符号:Si原子序数:14原子团:Si离子(正四价)和Si原子团(二氧化硅)十五、磷(P)序数:15符号:P原子序数:15原子团:P离子(正三价)和P原子团(白磷)十六、硫(S)序数:16符号:S原子序数:16原子团:S离子(负二价)和S原子团(二氧化硫)十七、氯(Cl)序数:17符号:Cl原子序数:17原子团:Cl离子(负一价)和Cl原子团(氯气)十八、氩(Ar)序数:18符号:Ar原子序数:18为稀有气体,无须提及任何离子或原子团。
以上就是前18号元素的元素序数。
这些元素在化学反应和物质组成中起着重要的作用。
原子序数就是元素周期表

原子序数就是元素周期表第一周期元素:1 氢(qīng) 2 氦(hài)第二周期元素:3 锂(lǐ) 4 铍(pí) 5 硼(péng) 6 碳(tàn) 7 氮(dàn) 8 氧(yǎng) 9 氟(fú) 10 氖(nǎi)第三周期元素:11 钠(nà) 12 镁(měi) 13 铝(lǚ) 14 硅(guī) 15 磷(lín) 16 硫(liú) 17 氯(lǜ) 18 氩(yà)第四周期元素:19 钾(jiǎ) 20 钙(gài) 21 钪(kàng) 22 钛(tài) 23 钒(fán) 24 铬(gè) 25 锰(měng) 26 铁(tiě) 27 钴(gǔ) 28 镍(niè) 29 铜(tóng) 30 锌(xīn) 31 镓(jiā) 32 锗(zhě) 33 砷(shēn) 34 硒(xī) 35 溴(xiù) 36 氪(kè) 第五周期元素:37 铷(rú) 38 锶(sī) 39 钇(yǐ) 40 锆(gào) 41 铌(ní) 42 钼(mù) 43 锝(dé) 44 钌(liǎo) 45 铑(lǎo) 46 钯(bǎ) 47 银(yín) 48 镉(gé) 49 铟(yīn) 50 锡(xī) 51 锑(tī) 52 碲(dì) 53 碘(diǎn) 54 氙(xiān)第六周期元素:55 铯(sè) 56 钡(bèi) 57 镧(lán) 58 铈(shì) 59 镨(pǔ) 60 钕(nǚ) 61 钷(pǒ) 62 钐(shān) 63 铕(yǒu) 64 钆(gá) 65 铽(tè) 66 镝(dī) 67 钬(huǒ) 68 铒(ěr) 69 铥(diū) 70 镱(yì) 71 镥(lǔ) 72 铪(hā) 73 钽(tǎn) 74 钨(wū) 75 铼(lái) 76 锇(é) 77 铱(yī) 78 铂(bó) 79 金(jīn) 80 汞(gǒng) 81 铊(tā) 82 铅(qiān) 83 铋(bì) 84 钋(pō) 85 砹(ài) 86 氡(dōng)第七周期元素:87 钫(fāng) 88 镭(léi) 89 锕(ā) 90 钍(tǔ) 91 镤(pú) 92 铀(yóu) 93 镎(ná) 94 钚(bù) 95 镅(méi) 96 锔(jú) 97 锫(péi) 98 锎(kāi) 99 锿(āi) 100 镄(fèi) 101 钔(mén) 102 锘(nuò) 103 铹(láo) 104 炉(lú) 105 (dù) 106 (xǐ) 107 (bō) 108 (hēi) 109 䥑(mài) 110 鐽(dá) 111 錀(lún) 112 (仍未有中文名) 注:新元素汉字请使用Win7系统浏览,XP系统下无法显示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(3) 填写下表
元素 原子序数 元素符号 周期 族 Mg 2 ⅥA 甲 乙 丙 13 丁 20
【小贴士】 一句话概括元素周期表的结构: 三短四长七周期;七主七副两特殊。 [思考]分析元素周期表中从ⅢB到 ⅡB之间的元素名称,它们的偏旁部首 有什么特点?说明什么? [结论]其偏旁均为“金”,说明它 们均为金属。元素周期表的中部从ⅢB 族到ⅡB族10个纵行,包括了第Ⅷ族和 全部副族元素,共六十多种元素,通称 为过渡元素。因为这些元素都是金属, 所以又把它们叫做过渡金属。
元素周期律的发现史——
1829年 1865年 1868年 1869.10 1869年2月 1871年 1930年 1981年 1995年 1998年 1999年
德贝莱纳(德)三素组 纽兰兹(英)的八音律 迈尔(德)的原子体积周期性图解 迈尔(德)的第三张周期表 门捷列夫(俄)的第一张周期表 门捷列夫(俄)的第二张周期表 发现稀有气体后的周期表 中国长式 中国长式 IUPAC推荐 长式 周期表远景图
1 2 3 4
起止元素 H—He Li—Ne Na—Ar K—Kr Rb—Xe Cs—Rn Fr~118
周期序数 1 2 3 4 5 6 7
元素种数 2 8 8 18 18 32 32
长 周 期
5 6 7
②分类:7个横即7个周期。 周期分为短周期和长周期,短周 期包括第一、二、三周期,长周期包 括第四、五、六、七周期。 ③特点: a.每一周期元素电子层数相同; b.每一周期都是以活泼金属碱金 属元素开始逐渐过渡到活泼非金属, 最后以稀有气体元素结束。
A:主族 VIA O 8氧 S 16硫 VIIA F 9氟 Cl 17氯
0 He 2氦 Ne 10氖 Ar 18氩
2
3
4
族:具有相同的最外层电子数的列 周期:具有相同的电子层数的行
元素周期表
3、周期表的结构
(1)周期: ①定义: 将具在相同电子层数的元素,按照原子 序数递增的顺序排列的一个横行,称为一个 周期。 序号:周期序数=电子层数 [学生活动]阅读教材P4页,数一数元素 周期表有多少个横行?思考周期表中有多少 周期?每周期有多少种元素?
第一章 物质结构 元素周期律
第一节 元素周期表
授课人:董 啸
元素周期表
元素周期表
1869年,俄国化学家门捷列夫试着按相对 原子质量递增的顺序,把当时的63种元素排成 几行,再把各行中性质相似的元素上下对齐, 制得第一张元素周期表。结果发现:每一横行 元素性质从从金属到非金属,每一纵行元素化 学性质相似。还预言十几种尚未发现的元素, 3 十几年后,事实证明了他的预见准确令人惊奇。
元素周期表
③规律: 主族的序数=最外层电子数 ④特殊名称: IA:碱金属元素; IVA :碳族元素; VA :氮族元素; VIA :氧族元素; VIIA:卤族元素; 0族:稀有气体元素。
元素周期表
【观察与思考】
在周期表中,元素最多的 周期是哪一周期?共有多少种 元素? 元素最多的族是哪一族?共 有多少种元素?
请画出1-20号元素的原子结构示意图。
+
19 2 8 8 1
+
20 2 8 8 2
钾(K) 钙(Ca)
元素周期表(1-20号元素)
1
IA H 1氢 Li 3锂 Na 11钠 K 19钾 IIA Be 4铍 Mg 12镁 Ca 20钙 IIIA B 5硼 Al 13铝 IVA C 6碳 Si 14硅 VA N 7氮 P 15磷
4、主族元素的原子结构与位置的关系
分析:电子层数决定元素所在的周期, 最外层电子排布决定元素的所在的族。
周期序数=电子层数 主族序数=最外层电子数
(1) 已知某主族元素的原子结构示意图如 下,判断位于第几周期,第几族? 第三周期 第ⅥA族 第五周期 第ⅦA 族
练习:
X
Y
(2)已知某元素位于周期表中第三 周期,第ⅦA族,画出该元素的原子结构示 意图。
元素周期表
②分类:
类别
核外电子层数
1 2 3 4 5 6 7
起止元素 H—He Li—Ne Na—Ar K—Kr Rb—Xe Cs—Rn Fr~118
周期序数
元素种6 7
起止元素 H—He Li—Ne Na—Ar K—Kr Rb—Xe Cs—Rn Fr~118
元素周期表
(2)族: ①定义: 将不同横行中最外层电子数相同 的元素,按照电子层的递增的顺序, 从上到下排成纵行,称为一个族。 周期表中的每一个纵行称为一族, 族的序号一般用罗马数字表示。 【学生活动】请同学们数一数周期 表中有多少个纵行。
元素周期表
②分类: 周期表中共有18个纵行,16个族。 主族:由短周期元素和长周期元素共同 构成的族,用符号A表示。 主族:IA 、IIA、 IIIA 、IVA、 VA、 VIA、 VIIA 。 副族:由长周期元素共同构成的族,用 符号B 表示。 副族:IB、 IIB 、IIIB、 IVB 、VB、 VIB、 VIIB。 特殊族:第VIII族包括8、9、10三个纵 行的元素;0族为稀有气体元素。
1829年 德贝莱纳(德)的三素组
幻灯片 19
1865年
纽兰兹(英)的八音律
1868年
迈尔(德)的原子体积周期性图解
1869年10月 迈尔(德)的第三张周期表
1869年2月 门捷列夫(俄)的第一张周期表
1871年
门捷列夫(俄)的第二张周期表
1930年
发现稀有气体后的周期表
1981年
中国长式
1995年
中国长式
1998年
IUPAC推荐
1999年长式元素周期表
周期表远景图
一、元素周期表
1、原子序数 (1)定义: 将元素按照核电荷数依次递增的顺序 进行编号所得的序号叫做元素的原子序数。 (2)关系: 原子序数=核电荷数=质子数=核外电子数
元素周期表
2、编排原则
【探索发现】 请大家仔细观察周期表,思考周期表 的编排依据是什么?周期和族划分的依据 是什么? 元素周期表的编排原则: ①将电子层数相同的元素按原子序数 递增的顺序从左到右排列排成横行。 ②将最外层电子相同的元素按电子层 的递增的顺序从上到下排成纵行。
周期序数 1 2 3 4 5 6 7
元素种数
②分类:
类别
核外电子层数
1 2 3 4 5 6 7
起止元素 H—He Li—Ne Na—Ar K—Kr Rb—Xe Cs—Rn Fr~118
周期序数 1 2 3 4 5 6 7
元素种数 2 8 8 18 18 32 32
②分类:
类别 短 周 期
核外电子层数
