有机化学氨基酸分析
有机化学基础知识点氨基酸与蛋白质的结构与性质

有机化学基础知识点氨基酸与蛋白质的结构与性质有机化学基础知识点:氨基酸与蛋白质的结构与性质在有机化学中,氨基酸是构成蛋白质的基本组成单位。
了解氨基酸的结构和性质对于深入理解蛋白质的功能和作用至关重要。
本文将介绍氨基酸的基本结构、分类以及蛋白质的结构和性质。
一、氨基酸的基本结构氨基酸是由一个氨基基团(-NH2)、一个羧酸基团(-COOH)和一个侧链基团(R)组成的。
氨基酸的碳原子上还有一个氢原子和一个与侧链基团连接的碳原子,即α碳原子。
氨基酸的侧链基团可以是不同的有机基团,决定了氨基酸的性质和功能。
根据侧链基团的性质,氨基酸可分为以下几类:1. 构成氨基酸主链的非极性氨基酸,如甘氨酸、丙氨酸等。
它们的侧链基团都是非极性的烷基或芳香烃基,不带电荷。
2. 构成氨基酸主链的极性氨基酸,如天冬酰胺酸、谷氨酸等。
它们的侧链基团含有极性官能团,具有某种电荷。
3. 构成氨基酸主链的带电氨基酸,如赖氨酸、精氨酸等。
它们的侧链基团带正电荷,在生物体内具有重要的生理功能。
此外,还有一些特殊的氨基酸,如脯氨酸、半胱氨酸等,它们在氨基酸的结构中具有特殊的官能团或化学键,参与了许多重要的生物反应。
二、蛋白质的结构蛋白质是由一条或多条多肽链组成,每个多肽链由多个氨基酸残基以肽键相连而成。
多肽链的折叠和空间排布决定了蛋白质的功能和性质。
1. 一级结构:指多肽链上氨基酸残基的线性排列顺序。
氨基酸之间通过肽键连接,多肽链的N端和C端分别指代氨基末端和羧基末端。
2. 二级结构:指蛋白质中多肽链的局部结构。
常见的二级结构有α-螺旋和β-折叠,它们是由氢键相互作用所稳定的。
3. 三级结构:指整个多肽链的三维空间结构。
蛋白质的三级结构由多个二级结构单元通过各种非共价键相互作用而形成。
4. 四级结构:指多肽链与多肽链之间的空间排布和相互作用。
多个多肽链通过非共价键和共价键相互连接而形成更复杂的蛋白质结构。
蛋白质的结构多种多样,不同的结构决定了不同的功能。
氨基酸的纸色谱实验报告

一、实验目的1. 了解纸色谱法的基本原理和操作技术。
2. 掌握氨基酸纸层析法的实验步骤和注意事项。
3. 通过纸色谱法分离和鉴定氨基酸混合物中各个氨基酸的化学成分。
二、实验原理纸色谱法是一种以纸为载体的色谱分离技术,主要用于分离和鉴定混合物中的各种化合物。
在纸色谱法中,固定相为纸纤维上吸附的水分,流动相为不与水相溶的有机溶剂。
将试样点在纸条的一端,然后在密闭的槽中用适宜溶剂进行展开。
由于各组分在两相中分配系数不同,最终形成互相分离的斑点。
通过比移值(Rf值)与已知样品比较,进行定性分析。
氨基酸是一类含有氨基和羧基的有机化合物,是构成蛋白质的基本单元。
在纸色谱法中,氨基酸在固定相和流动相之间的分配系数不同,导致其在滤纸上移动的距离不同,从而实现分离。
三、实验材料与仪器1. 实验材料:(1)氨基酸混合物:甘氨酸、丙氨酸、亮氨酸、苯丙氨酸、色氨酸等。
(2)层析滤纸(3)正丁醇、乙酸、水(混合液作为展开剂)(4)显色剂:三酮溶液2. 实验仪器:(1)层析缸(2)点样毛细管(3)小烧杯(4)培养皿(5)量筒(6)喷雾器(7)吹风机(8)直尺及铅笔四、实验步骤1. 准备层析滤纸:将层析滤纸裁剪成适当大小,用铅笔在滤纸的一端标记原点位置。
2. 点样:用点样毛细管将氨基酸混合物点在距滤纸一端约2~3cm的原点位置。
3. 展开剂准备:将正丁醇、乙酸、水按一定比例混合,作为展开剂。
4. 展开操作:将点好样的滤纸放入层析缸中,加入适量展开剂,确保展开剂液面高出滤纸上的样点。
5. 展开过程:密闭层析缸,待溶剂前沿线到达预定位置时取出滤纸。
6. 显色:将滤纸晾干,用喷雾器喷洒三酮溶液,在室温下晾干,观察显色结果。
7. 结果分析:根据各氨基酸斑点在滤纸上的位置,计算Rf值,与已知氨基酸的Rf值比较,进行定性分析。
五、实验结果与分析1. 氨基酸斑点在滤纸上分离,且各氨基酸斑点位置明显。
2. 通过计算Rf值,与已知氨基酸的Rf值比较,鉴定出各氨基酸。
氨基酸组成分析课件

以下是几种常见的氨基酸分析方法。
《氨基酸组成分析》PPT课件
(1)茚三酮法 Spackman等人最早将茚三酮试剂运用到氨基酸组成分
析上。离子交换层析后,各种氨基酸与茚三酮反应形成紫色 化合物,最大光吸收在570nm,摩尔消光系数2X104,茚 三酮和二级胺(脯氨酸和羟脯氨酸)形成黄色产物,在 440nm检出,摩尔消光系数3X103。目前此法的灵敏度可 达100pmol,但茚三酮试剂易氧化,必须隔绝空气避光保 存,试剂本身黏性大,需要有个柱后混合器才能与氨基酸充 分反应,对仪器要求较高。
氧化反应被用来转化半胱氨酸和胱氨酸成为半胱磺酸,过 甲酸氧化反应的缺点是它会影响其他氨基酸特别是甲硫氨酸 会转变成甲硫氨酸砜,酪氨酸会降解。为克服这一 缺点,必 须准备能分析两次的样品量,一次提供半胱氨酸数据,另一 次则提供其他氨基酸的组成数据。
《氨基酸组成分析》PPT课件
第四节 氨基酸组成原位分析
《氨基酸组成分析》PPT课件
第一节 氨基酸组成分析的目的
现代分离提纯技术的发展使蛋白质操作微量化,但也给 定量带来了困难,一般很难通过常规的称量或测蛋白质溶液 在280nm的光吸收值来准确定量蛋白质。所以如果在蛋白 质酶解或测序前,取蛋白质样品的一部分进行氨基酸组成分 析,根据结果便可以推算出蛋白量的可靠值。 另外,在蛋白质测序中有时遇到测不出结果的情况, 一种可能是蛋白质的N端封闭, 另一种可能则是样品本身不是蛋白质或绝大部分是非蛋白质 物质, 解决这个问题的很好途径便是做氨基酸组成分析以确定样品 的成分。
有机化学ppt-氨基酸蛋白质

如果改变条件,破坏蛋白质的稳定因素,就可以使蛋白质分 子从溶液中凝聚并析出。这种现象称为蛋白质的沉淀。
盐析法:在蛋白质溶液中加入大量盐[如 NaCl、硫酸铵、 Na2SO4等],由于盐既是电解又是亲水性的物质,它能破坏蛋白 质的水化膜,因此当加入的盐达到一定的浓度时,蛋白质就会从 溶液中沉淀析出,盐浓度变稀时蛋白质溶解,为可逆沉淀。
2.氨基酸的分类
(1)据氨基和羧基的相对位置分为α-氨基酸、β-氨基酸 和γ—氨基酸,与人关系最为密切的是α-氨基酸。
R αCH COOH NH2
α 氨基酸
R β CH α CH2COOH NH2
β 氨基酸
R γ CH β CH2αCH2COOH NH2
γ 氨基酸
(2)按分子中氨基和羧基的数目分为
系统命名法: 氨基酸的命名可以采用系统命名法,与羟基酸的命名相似 ,即以羧酸为母体,氨基为取代基,称为“氨基某酸”。 氨基的位置,习惯上用希腊字母α、β、γ等来表示,并写在 氨基酸名称前面。
CH3CH CHCOOH CH3 NH2
α-氨基--甲基丁酸
CH2CH COOH NH2
α-氨基--苯基丙酸
习惯命名法: 氨基酸多根据其来源或某些特性使用俗名,有时还用中文 或英文缩写符号表示。 α-氨基乙酸因具有甜味俗名甘氨酸,中文缩写为“甘”, 英文缩写为“Gly”。天门冬氨酸是因最初是从植物天门冬的幼 苗中分离出来而得名,中文缩写“天”, 英文缩写为“Asp”。
负离子存在。在一定介质时,主要以两性离子存在。
R CH COOH
NH3+ (Ⅰ) 正离子
OH- R CH COO- OH-
氨基酸成分分析

氨基酸成分分析氨基酸是有机化学中研究的基本单位,它们是蛋白质的最小构成单位,也是生命反应的催化剂,是生命活动的基本物质。
它们在动物或植物体内的含量和比例,决定着这种有机体的营养特性及其生存状况。
近年来,人们在研究氨基酸的成分分析上取得了重大进步,这也为在生物领域进行研究、分析、比较和诊断提供了一个新的维度。
氨基酸的成分分析包括有关氨基酸类型和组成的分析,以及生物体中氨基酸含量与比例的综合考察。
通常,氨基酸的分析主要分为总氨基酸分析和组氨基酸分析两种。
总氨基酸分析是指以氨基酸的比例进行分析,而组氨基酸分析则主要研究不同氨基酸类型在氨基酸总量中的比例,这也是目前大多数研究人员采用的方法之一。
除了组氨基酸分析,氨基酸成分分析还包括氨基酸指示分析、精氨酸分析、谷氨酸分析等。
氨基酸指示分析是指可以通过检测某种特定氨基酸类型的数量,来指示植物的营养状况或土壤质量等,有助于植物营养禁忌的研究。
精氨酸分析主要用于研究蛋白质代谢,综合考察精氨酸的生物合成、释放、代谢及其形式;谷氨酸分析主要用于考察植物的生理生态学状况,如植物的适应性、产量、耐病性等。
以上是氨基酸分析的基本方法,但是随着分析技术的发展,结合生物信息学、分子生物学和其他综合技术,如多维氨基酸分析(DAMS)等,人们的研究将会更加深入,这将有助于研究氨基酸的生态学及其在生物新物种的发现和分类中的作用。
总而言之,氨基酸是生命过程的基本组成单位,其分析对研究和诊断生物学过程至关重要。
近年来,氨基酸分析领域得到了重大发展,结合新技术,将会使研究更加深入,以期发掘更多有关氨基酸的秘密。
附录:《DAMS(多维氨基酸分析)》DAMS是一种新型氨基酸分析技术,通过结构分析的方法,对氨基酸的重要性、配位、双结构以及氨基酸间的相互作用状态进行分析,研究其细胞内的功能表达和调控,以期更好地理解氨基酸在活体中的作用,以及活体中蛋白质的功能分析。
DAMS分析可以帮助揭示氨基酸之间的结构和功能关系,有助于改善蛋白质的结构和功能。
氨基酸分析方法

✎ 增加显色基团,提高检测灵敏度 ✎ 改变样品的极性,改善分离结果
氨基酸的化学衍生
❀ 所谓化学衍生,就是选取某种化学试剂与氨基酸进行化 学反应,生成一种较易于被检测的新物质。用来与氨基 酸反应的试剂叫衍生试剂,例如: A + R→ D 氨基酸 衍生试剂 衍生产物
❀ 衍生反应可发生在色谱分离之前(柱前衍生),也可发生在 色谱分离之后(柱后衍生).
❀ 1958 - 氨基酸自动分析仪 (茚三酮) 问世, Spackman, Stein and Moore, Anal. Chem., 30, (1958)1190
氨基酸分析的特点
❀ 多数氨基酸没有“显色基团”
✎ 无法用简单的方法检测
❀ 所有的氨基酸极性都很大
RCH 2CH ( NH 3 ) + COO −
❀ 柱前衍生法的分离一般在反相柱(如C18)上完成,而柱后 衍生法的分离一般在阳离子交换柱上进行。柱后法的典 型代表为氨基酸分析仪,而AccQ·Tag为典型的柱前法。
今天还在使用的氨基酸分析技术
❀ 柱后衍生,离子交换法分离,衍生只是显色
✎ Ninhydrin(茚三酮) 或 OPA(邻苯二甲醛)
❀ 柱前衍生,反相分离,衍生同时改变极性和显色
柱前衍生技术的比较
技术 检测模式 典型检测限 反应条件
限制
Dansyl Chloride
PTH NBD Chloride
OPA
UV 254 荧光 UV 269 荧光
荧光
FMOC
荧光
PITC
UV 254
AQC
UV 248 荧光
OPA/FMOC 荧光
低至中 pmole 困难
分离衍生困难
生物有机化学氨基酸的分析方法综述

生物有机化学氨基酸的分析方法综述A Review on Amino acid Analysis Methods摘要:氨基酸电分析研究是生命科学中令人关注的课题。
本文就各种氨基酸的分析化学研究的最新进展进行了综述。
关键词:氨基酸分析方法综述Abstract:The analysis methods of amino acids are very important in ream of industry, agriculture and life science. Inthis paper,the analysis methods of amino acid are reviewed,with focus on chemistry method, spectrophotometry method, chromatography method and electrochemistry method.Key words: amino acids;analysis;review1 前言氨基酸是生物体中重要的生命物质,是组成酶和蛋白质的基本单元。
作为小分子,氨基酸对生物大分子的活性及其生理功能起着极为重要的作用;作为配体,它可与多种金属离子配位,为研究抗肿瘤、抗癌药物提供信息。
各种氨基酸在生物体中具有不同的生物功能,如生物体中的色氨酸与脑的正常代谢有密切的关系,L 一半胱氨酸能增强生物体的抗病能力,因此,准确灵敏地测定食物、药品和生物样品中氨基酸的含量具有十分重要的意义。
目前,对氨基酸的分析测定多采用离了交换色谱( IEC) [1]、高效液相色谱(HPLC) [2] 或气相色谱(GC) [3]等仪器,这些仪器所用的检测器包括紫外可见光谱吸收、荧光、化学发光等。
然而,由于多数氨基酸的紫外可见光谱的吸收极弱, 自身又无荧光,因此不能直接检测。
通常需要衍生化处理来提高检测的灵敏度和选择性。
电化学方法以其简单、灵敏、无放射、无污染等特点越来越受到人们的关注。
有机化学氨基酸分析

有机化学氨基酸分析氨基酸是生物体中重要的有机化合物之一,它具有结构多样性和功能多样性,广泛参与生物体内的代谢过程和各种生物学功能。
因此,研究和分析氨基酸在生物体内的存在和含量是生物化学和生物医学领域的重要课题之一氨基酸普遍具有两个基团:氨基基团和羧基基团。
氨基基团(-NH2)能够与酸性物质发生酸碱反应,而羧基基团(-COOH)可以与碱性物质反应。
因此,氨基酸可以在不同的pH环境下呈现出不同的离子化状态。
氨基酸分析的方法有很多种,其中最常用的方法是色谱法。
色谱法是基于物质在固定相和流动相之间相互分配过程的一种分离和测定方法。
氨基酸分析常用的色谱法有气相色谱法(GC)和高效液相色谱法(HPLC)。
气相色谱法是通过将氨基酸样品蒸发成气体态后,通过柱子分离各个氨基酸,并通过检测器进行定量测定。
GC法的优点是分离效果好、分析速度快,但需要样品具有较好的挥发性。
对于挥发性较低的氨基酸,通常需要先进行酸水解或酶解处理。
高效液相色谱法是通过将氨基酸溶解在流动相中,通过柱子分离各个氨基酸,并通过检测器进行定量测定。
HPLC法与GC法相比,对样品要求较低,适用范围更广。
HPLC法可以在较低的温度下进行分析,避免了氨基酸的热解和挥发损失。
除了色谱法外,还可以使用质谱法进行氨基酸分析。
质谱法是通过将氨基酸样品蒸发成气体态后,通过质谱仪进行分析。
质谱法的优点是分辨率高、灵敏度高,可以分析低浓度的氨基酸。
质谱法可以通过离子反应进行定量测定。
此外,还可以使用光谱法进行氨基酸分析。
光谱法是利用物质吸收、发射或散射光的特性进行分析的一种方法。
氨基酸中苯环的吸收或蛋白质中色氨酸的荧光可以用于氨基酸的分析。
在氨基酸分析中,常常需要先进行衍生化反应,将氨基酸转化为稳定的衍生物,提高其检测灵敏度和分离效果。
常用的衍生反应有酸衍生、酯化、取代反应等。
总结起来,氨基酸的分析方法有色谱法、质谱法和光谱法等。
这些方法各有特点,可以选择合适的方法根据不同的需要进行分析。
有机化学氨基酸、多肽、蛋白质

6 种异构体 24种异构体
许多种氨基酸按照不同的排列顺序, 构成了自 然界中种类繁多的多肽和蛋白质。
命名多肽时以C-末端的氨基酸残基为母体, 由 N-端叫起, 依次称为某氨酰(基)某氨酸。
O
O
O
H2N CHC NH CH2C NH CHC OH
N-端
CH3
CH2
C-端
丙氨酸残基 甘氨酸残基 苯丙氨酸残基
利用蛋白质分子胶体颗粒大不能透过半透膜 的性质可将蛋白质分离提纯,这种方法称为透析 法(dialysis)。
(三)蛋白质的沉淀和变性
调节蛋白质溶液的pH值至等电点, 再加入适当的脱水剂除去蛋白质分子表 面的水化膜, 可使蛋白质分子聚集而从溶液中沉淀析出。
根据生成紫色化合物颜色的深浅程度,或根据放出
CO2气体的体积,可对 α-氨基酸 进行定量分析。 也常用于层析实验中氨基酸的显色。
第二节 肽肽ຫໍສະໝຸດ 氨基酸残基之间彼此通过酰胺键 (肽键)连 接而成的一类化合物。其通式为:
RO
R’ O
H2N C-C-OH + H N C-C-OH
H
HH
A氨m基ino酸acid
第十四章 氨基酸、蛋白质
第一节 氨基酸
一、氨基酸的分类、命名和构型
氨基酸的结构特点
①都是α-氨基酸(脯氨酸是
α–亚氨基酸); H N
COOH H
R CH COO- 内盐
NH3+
偶极离子
②除甘氨酸外,都是L-氨基酸(左旋);
③各氨基酸侧链R基团不同,氨基酸结构和性质有差异
1、分类
据化学结构:
任何一种蛋白质分子在天然状态下均具有独特 而稳定的构象,这是蛋白质分子在结构上最显著的 特点。为了表示蛋白质分子不同层次的结构,常将 蛋白质分子结构分为一级、二级、三级和四级。一 级结构又称为初级结构或基本结构,二级结构以上 属于构象范畴,称为高级结构。
纸层析法分离鉴定氨基酸

纸层析法分离鉴定氨基酸纸层析法是一种常用的分离和纯化化学物质的实验方法,被广泛应用于有机合成、生物化学和食品科学等领域。
本文将介绍纸层析法在氨基酸分析中的应用。
一、实验原理氨基酸的分离和鉴定是生物化学实验中常用的手段。
氨基酸分子中含有羧基和氨基,可以通过纸层析法实现其分离。
纸层析法是一种基于物质分子间不同的吸附性能而进行分离的方法。
在纸层析实验中,将试样涂在纸层析片(通常为滤纸)的一侧,并将其放入溶剂(通常为水、丙酮、甲醇等)中,溶剂会沿纸层析片向上移动,分离出不同物质组分。
氨基酸分子的羧基和氨基分别具有不同的亲水性和疏水性,因此在纸层析分离中会表现出不同的吸附行为。
例如,疏水性较强的疏水基团会被生物样品或溶剂吸附,从而较慢地从纸层析片上移动,这些氨基酸通常出现在较高位置;而亲水性较强的羧基团则会被水吸附,因此移动速度较快,这些氨基酸通常出现在较低位置。
二、实验步骤1、制备样品:取大约1mg的氨基酸标准品或被测样品,加入1mL的去离子水中,并轻轻搅拌,制成1mmol/L的溶液。
2、制备纸层析片:取一张长约50cm的滤纸,将其叠成4层,然后将中间部分剪成30cm的长条,每条的宽度为1cm左右,用铅笔在底部标记出位置,离开1cm到1.5cm的距离。
3、涂样:在每个标记位置上滴加不同氨基酸溶液,每次加约5µL。
所有样品均按照氨基酸的相对极性从小到大进行涂样,从左到右编号,以便于鉴定。
4、溶剂选择:选择一种适宜的溶剂,通常为水、丙酮、甲醇等。
将滤纸上端放入溶剂中,约1cm左右的位置即可。
5、开始实验:用三角架和夹子将滤纸张贴在玻璃板上,使其呈现较小的倾斜面。
在滤纸的底部悬挂一张白纸,以便于观察样品在纸层析上的位置变化。
待溶剂无法再升高时,实验结束。
6、结果读取:按照行(从上到下)顺序,观察样品的移动距离。
三、实验结果及分析纸层析法可以分离并识别出存在于试样中的氨基酸分子,在实验中,通过观察样品从纸层析片底部开始向上移动的情况,可以确认每个氨基酸的相对位置和含量。
有机化学氨基酸分析

有机化学氨基酸分析1.色谱法色谱法是一种广泛使用的氨基酸分析方法,主要包括气相色谱法(GC)和液相色谱法(LC)。
气相色谱法:气相色谱法主要适用于描绘和鉴定原料氨基酸的种类、含量和结构等信息。
在该方法中,氨基酸样品首先通过酸水解生成对应的酸,然后酸再经甲醇酯化生成甲酯化酸。
最后通过气相色谱分离并检测酸甲酯化物。
液相色谱法:液相色谱法主要适用于定量分析氨基酸含量。
液相色谱法将氨基酸样品进行衍生化反应,如酰氯化反应或酸酐酯化反应,生成稳定的色氨酸酰胺衍生物,然后分离并检测各个衍生物。
2.光谱法主要包括紫外-可见吸收光谱法、红外光谱法和核磁共振光谱法等。
这些方法可以用于研究和确定氨基酸的结构和功能。
紫外-可见吸收光谱法:氨基酸溶液在特定波长范围内对紫外或可见光的吸收程度可以用来定量分析氨基酸的含量。
红外光谱法:红外光谱法可以用来研究氨基酸分子中的官能团和结构信息。
核磁共振光谱法:核磁共振光谱法可以提供关于氨基酸分子中原子的化学位移和耦合常数等信息。
3.电化学法电化学法主要包括电位滴定法和电化学发光法。
电位滴定法:通过测定氨基酸溶液的电化学行为,如氧化还原电位的变化,可以定量分析氨基酸的含量和测定其在酸碱条件下的酸解离常数。
电化学发光法:氨基酸在特定条件下通过电化学反应发光,凭借发光的强度可以定量分析氨基酸的浓度。
4.质谱法质谱法主要包括质子化时间飞行质谱法(PIT-TOFMS)和质子化辅助激光解吸电离质谱法(PALDIMS)等。
质子化时间飞行质谱法:PIT-TOFMS可以在非常短的时间内通过氨基酸分析样品中的氨基酸类型和含量。
该方法的优势在于可以同时测定样品中的多种氨基酸。
质子化辅助激光解吸电离质谱法:PALDIMS利用激光对氨基酸样品进行解离和电离,然后通过质谱仪进行质量分析。
该方法可以提供对氨基酸的结构、组成和含量等信息。
综上所述,有机化学氨基酸分析方法包括色谱法、光谱法、电化学法和质谱法等。
这些方法可以用于氨基酸的种类、含量、结构和功能的研究和分析。
氨基酸分析原理与方法

氨基酸分析原理与方法氨基酸是构成蛋白质的基本组成单位,它们的结构包含一个氨基基团(NH2)、一个羧基(COOH)以及一个特定的侧链基团(R)。
氨基酸分析的原理是通过特定的化学反应将氨基酸转化为可检测的化合物,然后利用不同的方法进行测定。
样品的预处理是为了去除样品中可能存在的干扰物质,例如油脂、无机盐以及非氨基酸的有机物。
常用的方法包括浸提、溶解、离心沉淀等。
蛋白质的水解是将蛋白质分解为氨基酸的过程。
水解反应一般使用强酸、强碱或酶类催化剂来进行。
其中,酶法水解是一种常用的方法,特点是反应条件温和,水解效率高。
氨基酸的衍生反应是将氨基酸中的羧基或氨基基团转化为可以检测的化合物。
常用的方法有酸衍生、碱衍生、甲酰化、丙酰化等。
例如,酰化反应可以将氨基酸中的氨基基团转化为酰基氨基酸,它在紫外光下有特征的吸收峰,便于测定。
衍生物的分离和定量测定是通过分析仪器进行的。
常用的方法包括高效液相色谱(HPLC)、气相色谱(GC)、毛细管电泳(CE)等。
其中,HPLC是最常用的方法,它可以根据不同的分离柱和检测器选择,实现对氨基酸的定量测定。
1.离子交换色谱法:利用离子交换树脂将氨基酸与其他离子区分开,然后通过温度梯度或者梯度洗脱的方法进行分离和定量。
2.薄层色谱法:将衍生后的氨基酸样品沿着特定的固定相(通常是硅胶或者聚脱氢乙烯等)的薄层上进行分离。
然后通过显色剂的染色或者紫外检测器检测颜色变化或吸收峰进行定量。
3.毛细管电泳法:利用毛细管内的电泳作用将氨基酸分离。
根据不同氨基酸的电荷、大小、疏水性等理化性质的差异,通过改变电流、电压、电泳缓冲液的pH值和离子强度等条件,实现氨基酸的分离和定量。
4.气相色谱法:首先将氨基酸进行酯化反应,然后通过气相色谱进行分离和定量。
气相色谱法具有高分辨率、灵敏度高等特点,适用于分析含有少量氨基酸的样品。
综上所述,氨基酸分析是通过将氨基酸转化为可检测的化合物,然后利用不同的方法进行分离和定量的过程。
大学化学《有机化学-氨基酸》课件

去保护基
R O CH3 (CH3)3C+ + CO2 + +NH3CHCNHCHCOO -
*1. 催化氢化和稀碱都不能除去BOC,通常用温 和的酸性水解法除去。
*2. 若氨基酸中有多个氨基,在接肽前均需保护。 *3. 用Z保护还是用BOC保护,视实际情况而定。
22.5.2 羧基的保护
RCHCOON+ H3
(甘-丙-亮)(Gly-Ala-Leu)
2 结构
1. 肽键和肽的几何形状
H O H RH O
NCCNC CNCC
HR H O H R
2. 二硫键
CH2SH
+
CHNH 3
COO-
空气氧化 Na +液NH3
CH2S
+
CHNH 3
COO-
SCH2
+
CHNH 3 COO-
Cys-Tyr-Ile-Glu-Arg-Cys-Pro-Leu-Gly •NH2
HCl
CH3OH
上保护基
R H2NCHCOOCH3
CH3
SO3H RCHCOOCH2
CH2OH NH2
上保护基
(CH3)2C=CH2
上保护基
O RCHCOBu-t
NH2
A
接肽
OR
R'CHCHNCHCOOCH3
NH2
去保护基 Na2CO3
A
接肽
Pd / H2
OR R'CHCHNCHCOOH
去保护基
NH2
蛋白质、碳水化合物、脂肪(甘油醇的 脂肪酸酯)是人的营养中的三种要素。
1 定义和分类
羧酸分子中烃基上的一个或几个氢原子被氨基取代生成的化合物叫氨基酸。
18种氨基酸检测方法

18种氨基酸检测方法【原创版4篇】目录(篇1)I.氨基酸检测方法概述1.氨基酸是生命中必不可少的有机化合物2.18种氨基酸是人体必需的营养物质3.氨基酸检测方法的研究意义II.氨基酸检测方法介绍1.传统检测方法2.现代检测方法3.新型检测方法III.氨基酸检测方法优缺点分析1.传统检测方法的优缺点2.现代检测方法的优缺点3.新型检测方法的优缺点IV.氨基酸检测方法应用前景展望1.在医疗领域的应用2.在食品行业的应用3.在其他领域的应用正文(篇1)一、氨基酸检测方法概述氨基酸是生命中必不可少的有机化合物,它们在人体内扮演着重要的角色。
人体内有18种氨基酸,其中一部分是由身体自身合成的,而其余的部分必须从食物中摄取。
因此,氨基酸检测方法的研究对于了解人体健康状况具有重要意义。
传统的氨基酸检测方法较为繁琐,需要耗时费力,而现代的检测方法则更加快速、准确、简便。
例如,高效液相色谱法、质谱法等。
此外,近年来还出现了一些新型的检测方法,如表面增强拉曼光谱法、近红外光谱法等。
二、氨基酸检测方法介绍1.传统检测方法:传统的氨基酸检测方法主要包括化学法、电泳法、色谱法等。
化学法是通过测定氨基酸的化学反应来测定其含量,但操作繁琐、误差较大;电泳法是通过氨基酸在电场中的迁移率来测定其含量,但需要消耗大量的样品;色谱法是通过氨基酸在色谱柱中的分离来测定其含量,但需要消耗大量的样品。
2.现代检测方法:现代的氨基酸检测方法主要包括高效液相色谱法、质谱法等。
高效液相色谱法是一种基于色谱分离技术的分析方法,可以快速、准确地分离和测定多种氨基酸;质谱法是一种基于质谱分离技术的分析方法,可以同时测定多种氨基酸,但需要消耗大量的样品。
3.新型检测方法:新型的氨基酸检测方法主要包括表面增强拉曼光谱法、近红外光谱法等。
表面增强拉曼光谱法是一种基于拉曼散射技术的分析方法,可以在不破坏样品的情况下快速、准确地测定多种氨基酸;近红外光谱法是一种基于光学技术的分析方法,可以在不破坏样品的情况下快速、准确地测定多种氨基酸。
氨基酸的分离鉴定实验报告

氨基酸的分离鉴定实验报告
《氨基酸的分离鉴定实验报告》
实验目的:通过对氨基酸的分离和鉴定实验,掌握氨基酸的分离技术和鉴定方法,提高实验操作能力和数据分析能力。
实验原理:氨基酸是生命体系中的重要有机分子,它们是蛋白质的组成单位。
在实验中,我们将利用离心分离、薄层色谱等技术,对氨基酸进行分离和鉴定。
实验步骤:
1. 将混合氨基酸样品溶解在适量的溶剂中,得到氨基酸溶液。
2. 利用离心技术,将氨基酸溶液中的杂质分离出来,得到纯净的氨基酸溶液。
3. 将纯净的氨基酸溶液加载到薄层色谱板上,进行薄层色谱分离。
4. 根据薄层色谱结果,对氨基酸进行鉴定和定量分析。
实验结果:
经过离心分离和薄层色谱分离,我们成功地分离出了混合氨基酸样品中的各种
氨基酸,并且得到了它们的定量数据。
通过比对标准氨基酸的色谱图谱,我们
成功地鉴定出了样品中的各种氨基酸成分。
实验结论:
通过本次实验,我们掌握了氨基酸的分离技术和鉴定方法,提高了实验操作能
力和数据分析能力。
同时,我们对氨基酸的结构和性质有了更深入的了解,为
今后的科研工作打下了坚实的基础。
总结:氨基酸的分离鉴定实验是一项重要的生物化学实验,通过本次实验,我
们不仅掌握了氨基酸的分离技术和鉴定方法,还提高了实验操作能力和数据分
析能力,为今后的科研工作提供了有力支持。
生物制品表征之氨基酸组成分析和消光系数分析
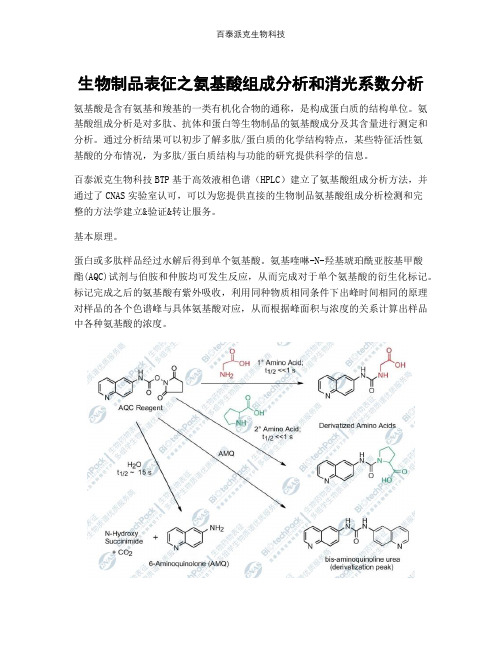
生物制品表征之氨基酸组成分析和消光系数分析氨基酸是含有氨基和羧基的一类有机化合物的通称,是构成蛋白质的结构单位。
氨基酸组成分析是对多肽、抗体和蛋白等生物制品的氨基酸成分及其含量进行测定和分析。
通过分析结果可以初步了解多肽/蛋白质的化学结构特点,某些特征活性氨基酸的分布情况,为多肽/蛋白质结构与功能的研究提供科学的信息。
百泰派克生物科技BTP基于高效液相色谱(HPLC)建立了氨基酸组成分析方法,并通过了CNAS实验室认可,可以为您提供直接的生物制品氨基酸组成分析检测和完整的方法学建立&验证&转让服务。
基本原理。
蛋白或多肽样品经过水解后得到单个氨基酸。
氨基喹啉-N-羟基琥珀酰亚胺基甲酸酯(AQC)试剂与伯胺和仲胺均可发生反应,从而完成对于单个氨基酸的衍生化标记。
标记完成之后的氨基酸有紫外吸收,利用同种物质相同条件下出峰时间相同的原理对样品的各个色谱峰与具体氨基酸对应,从而根据峰面积与浓度的关系计算出样品中各种氨基酸的浓度。
一般流程。
蛋白或多肽样品经过水解后用基于高效液相色谱(HPLC)的柱前衍生法对水解后的氨基酸进行分析,得到数据之后对数据进行计算处理,最后得到每种氨基酸的含量占比等信息。
具体过程如下:应用。
氨基酸组成分析可检测多肽、抗体和蛋白的氨基酸成分及其相对含量,比较不同批次样本的稳定性,侧面反应序列准确性等。
通过氨基酸组成分析得到的氨基酸个数可以进一步计算出蛋白的消光系数。
案例展示。
氨基酸标准品紫外吸收色谱图(横坐标为时间,纵坐标为紫外吸收)。
供试品紫外吸收色谱图(横坐标为时间,纵坐标为紫外吸收)。
根据标准品和样品的的峰面积与浓度的关系计算出样品中各种氨基酸的浓度;按照下方公式可以计算出对应的氨基酸个数。
氨基酸个数=(总蛋白分子量*氨基酸浓度)/(样品浓度*氨基酸分子量)。
根据蛋白浓度计算蛋白的消光系数:根据Lambert-Beer定律,当一束单色光透过流动池时,若流动相不吸收光,则吸收度A与吸光组分的浓度C和流动池的光径长度L成正比。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
比蔗糖甜150-200倍,体类代谢不需胰岛素参与, 是安全的食品添加剂,国际A1级甜味剂 ,适用于肥胖, 糖尿病,心血管疾病患者,代替蔗糖
路边的野生蘑菇不要采! 鹅膏菌(Amanita)是真菌门、担子菌亚门、担子菌 纲、伞菌目、鹅膏菌科、鹅膏菌属中一类真菌的总 称,大部分是有毒的,据统计,误食野生蘑菇的中毒 事件中,95%以上都是由鹅膏菌所致,因而对于鹅膏 菌毒素及其毒理的研究颇受毒理学、化学、生物学 和医学等研究人员的重视。人类致命蘑菇毒素中, 鹅膏毒肽是一类慢作用毒素,误食后8)10小时才会 有反应,先是剧烈的上吐下泻,之后有3天左右的假 愈期。其间,鹅膏毒肽由于在胃肠道中存在肠肝循 环而反复在体内被吸收,对肝脏及其它器官持续造 成危害,若抢救不及时,一般中毒后5-12天死亡.
第十六章
氨基酸、多肽与蛋白质
Ⅰ、氨基酸
一、结构、分类和命名
1、结构:分子中含有氨基和羧基
R
H C NH2 COOH
2、分类:
(1)根据氨基与羧基的位置分类
H R C NH2 COOH
R
CH NH2
CH2 COOH
CH2 NH2
CH2
CH2 COOH
α-氨基酸
β-氨基酸
γ-氨基酸
中性氨基酸
(2) 碱性氨基酸
链状氨基酸 (3) 芳香族氨基酸 杂环氨基酸
酸性氨基酸
3、命名
(1)系统命名法: 羧酸为母体,氨基为取代基
NH2CH2COOH
NH2CH2CH2COOH
α -氨基乙酸 甘氨酸 (2)俗名
β -氨基丙酸
丙氨酸
二、氨基酸的构型
COOH HO H CH 3
H 2N COOH H CH 3
L-乳酸
L-丙氨酸
O
丙氨酰苯丙氨酰甘氨酰丝氨酸
或丙·苯丙·甘·丝
O NH 2CH 2 C
CH 3 NH CHCOOH
甘 氨 酰 -丙 氨 酸
CH 3 O NH 2CH C NH CH 2COOH
丙 氨 酰 -甘 氨 酸
蜂毒肽简介 蜂毒(beevenom)是工蜂毒腺分泌出来的一种具有芳香气 味的透明毒液,它是一种成分复杂的混合物,主要含有蛋白 质多肽类、酶类、生物胺类和其他物质.蜂毒中研究较多的 是蜂毒溶血肽,又称蜂毒肽(melittin).蜂毒肽占蜂毒干重的 50%,是蜂毒中主要发挥作用的物质。蜂毒肽可以抗菌、抗 病毒、消炎、抗辐射,最近又有对其抗癌作用进行研究的 报道,受到抗癌研究人员的重视。相对抗生素,抗菌肽具有 抗菌谱广、低浓度下发挥作用、不易使微生物产生抗性以 及可以合成不同于天然肽的类似物等优势 ,所以其有望成 为新一代抗生素。
2、分类
二肽 三肽 多肽
3、命名 以含有完整羧基的氨基酸为母体,将以羧基 参加形成肽链的氨基酸中的酸字改为“酰”,依次 加在母体前面
O NH2CH2 C NHCH2COOH 甘氨酰甘氨酸
或甘·甘
CH3 O NH2CH C NH
O CH2OH CH C NH CH2C NH CHCOOH CH2C 6H5
蝎毒蛋白简介 蝎(scorpion)属原始肉食性蛛形纲蝎目、 甘蝎科的节支动物。据统计,目前全世界蝎目 分6科、70属,约600种,中国仅占其中15种。 东亚甘蝎在我国因分布广、种群大、药效好而 成为蝎类药材的主要来源。蝎的疗效在于蝎毒, 蝎毒具有广泛的药理学性质, 全蝎的主要有效成份蝎毒蛋白 具有抗肿瘤、镇痛、抗癫痫、抗栓、抗炎、抗风湿等药理作 用,蝎毒抗癌多肽是从东亚钳蝎蝎毒中提取分离的抗肿瘤有 效部位,对人食管癌、胃癌、喉癌、鼻咽癌及直肠腺癌细胞 株等有显著的细胞杀伤和细胞毒性作用,对肝癌、肺癌等有 确切的疗效。
2 谷氨酸
HOO-CH2CH2CH-COOH α-氨基戊二酸 NH2
谷氨酸是难溶水的结晶。通常由面筋和豆饼的 蛋白质酸水解而得,故名。谷氨酸可用于抢救肝 昏病。 L - (-)- 谷氨酸的单钠盐就是味精,工业上 可由糖类物质发酵或植物蛋白水解制取。
HOOC-CH2CH2CH-COONa NH2
3 肉碱
苍蝇的奥秘
苍蝇时时出没于肮脏之地,一只苍蝇身上通常带有 病菌60多种,计有1700万个,多的可达5亿个,还带 有很多病毒和寄生虫卵。苍蝇能传播伤寒、霍乱、痢疾等30 多种疾病。然而苍蝇自身却不会被病原物感染并能大量繁殖 其后代。其奥秘是由于苍蝇体内含有一种殊的小分子蛋白质, 称抗菌活性蛋白,就是这种抗菌活性蛋白成为蝇蛆本身各种 病菌的克星。据测定,这种抗菌蛋白(抗菌肤)只需要万分之一 的浓度就可杀死多种病菌,其效力超过青霉素。近年来日本 学者从麻蝇幼虫的体液中分离出一种具生物活性的物质—凝 聚素,有极强的抗癌作用,这是一种极有前景的有待开发的 治疗肿瘤的新型药物。苍蝇吸附吸附于物体表面时,会产生 某种特殊的液体,传递到乳附垫的底部,最近的实验证实了 苍蝇脚部豁附垫分泌特殊液体的现象,段从这些动物及昆虫 脚部除去此液体后,它们几乎失去了吸附的能力.
+
O
C O
内盐(偶极离子或两性离子)
-
+
HC l
RCH
+
COOH
+
Cl
NH3
RCH NH2
COOH
+
NaOH
RCH NH2
COO
+
Na
+
+
Cl
-
R H2 N CH
COO
H
+
R H3 N
+
CH
COO
-
H
+
R H3 N
+
CH
COOH
OH
OH
负离子
两性离子
正离子
等电点:溶液中正离子和负离子的量相等时,溶液的 pH值就是氨基酸的等电点。
C O 氢键 C O 氢键 H CH 氢键 R C O N R CH C O
H N N CH O H N H N R C H C O CH C OC R CH R H NH C O 氢键
0.54nm
蛋白质的二级结构(α-螺旋)
β-折叠片:肽链伸展在褶纸形的平面上,相邻的肽链又通过
R N 氢键 N 氢键 H R H O O H N O R N R R N H R H O O H N O R N R R N H R H O O H N O
O
H N
O
H N
O
H N
维持作用力 蛋白质的二级结构( :氢键 β-折叠角)
(3)三级结构—— 在二级结构的基础上,多肽链间通过氨基酸残 基侧链的相互作用,在三维空间沿多个方向进行卷曲、折叠、 盘绕形成紧密的球状结构称为蛋白质的三级结构。
蛋白质的三级结构 是其他次级键,如 -S-S-(二硫 键)、离子键、氢 键、疏水键、支链 等,共同作用的结 果。
Ⅱ、多肽
一、结构、分类及命名 1、结构
R R’ NH2-CH-COOH + HNH-CH-COOH R N端 -H2O O R’ NH2-CH-C-NH-CH-COOH
C-端
特点: C-N键具部分双键性质
肽键多为反式双键构型; 六个原子处于同一平面 不可自由旋转
α
肽键
O C N H
α
C
C
肽类甜味剂——天门酰苯丙氨酸甲酯 应用于焙烤食品,果冻,化妆品,饮料中
5.穿山甲的应用
穿山甲为哺乳纲鲮鲤科动物穿山甲的鳞甲,味咸,微寒,入肝、 胃经,其性善走窜,能祛瘀散结、攻坚排脓、搜风通络,能消痈疽 于将成之际,又能托疮痈于将溃之时,且可通经下乳、通络利弊, 功效宏大,多用于经闭、乳汁不通、痈疮肿毒、关节痹痛、麻 木拘挛等。《本草纲目》记载:“……盖此物能窜经络达于病所 故也……”。要的化学成分有多种氨基酸、锌、钾等微量元 素。 穿山甲有极强的挖洞本领。穿山甲的鳞片不仅是挖洞时扒土的 有效工具,而且起到重要的防护作用。穿山甲鳞片具有一定的 曲率变化,外表面呈宏观非光滑形态,是典型的双向等强度的板 壳结构,有一定的回弹能力,既坚固耐磨,又利于减粘脱土。因此, 研究穿山甲鳞片的成分、组织结构、力学和磨损特性,将研究 结果用于触土部件工作表面减粘抗磨的改形仿生,对研制和开 发既耐磨又减阻的仿生功能材料和表面形态技术具有重要的指 导意义。
Ⅲ、蛋白质
一、定义
相对分子量在10000以上的多肽 二、结构
1、蛋白质结构层次的内容包括哪些?如何定义各
个结构层次? 2、蛋白质的二级结构有几种类型?它们是如何形 成的? 3、使蛋白质三级结构稳定的因素包括哪些?各因 素的特点是什么?
(1) 一级结构 —指氨基酸的排列顺序
(2)二级结构——指肽键的主链在空间的排列多肽链主链 骨架中各个肽段所形成的规则的或无规则的构象称为蛋白质的 二级结构。多肽链主链骨架中形成的有规则的构象主要是依靠 氢键维持的。最常见的二级结构是-螺旋结构和-折叠结构。
明胶 来源于动物的骨、腱、软骨、皮肤等结缔组织 中的胶原蛋白。作为一种重要的高分子生物材 料,明胶具有许多优良的物理化学性质,如亲水性强、 在水中形成高黏度的溶液、溶液冷却后具有形成凝胶 的能力、溶胶与凝胶间可发生可逆性转化、成膜性好、 侧链基团反应活性高等特点,广泛应用于食品、医药、 照相、化工等领域。目前商业明胶原料主要来源于哺 乳动物猪、牛等的皮和骨。按照制备方法不同,明胶可分为两 类,即A型明胶和B型明胶:A型明胶是用酸水解猪皮得到的,可塑 性和弹性较好。B型明胶是碱水解骨头及动物皮肤得到的,硬度 较好。明胶是一种能够成膜和成球的好材料,将其制备成药物 微胶囊,既可降低药物的毒副作用,并使之具有良好的组织靶 向性,达到控制释放的目的.
水蛭素多肽——抗血栓分子药理 1884年Haycraft首先发现新鲜医用水蛭Hirud medicinalis提取物含抗凝血物质,但直至1955年Mark wardt等从医用水蛭中才分离出水蛭素(hirudin,HV),共有 7种异构体。1984年Dodt首先测出其一级结构,确认HV是 一条含65个左右氨基酸的多肽。HV酶是血液凝固、止血过程 和血栓形成的中心酶之一。它专一性地水解纤维蛋白原上的 Agr-Gly键,使之转变成纤维蛋白;纤维蛋白相互作用会进一 步形成血栓。HV的2个结构域通过不同的机制分别和凝血酶 相互作用,抑制其活性。其C端长链通过和凝血酶的纤维蛋白 原识别部位结合,拮抗凝血酶对纤维蛋白原的识别。而HV的N 末端核心结构域通过和凝血酶的活性部位结合而抑制它的催 化活性。临床实验结果也表明,HV的抗栓作用不需要其它因 子的作用;又不会引起出血等副作用。其效果超过小分子肝 素。因此被认为是2010年前最强的可逆性凝血酶直接抑制剂。 全球约有20亿美元市场销售量。
