盐类的水解规律全面版
《盐类的水解》 知识清单

《盐类的水解》知识清单一、盐类水解的定义在溶液中,盐电离产生的离子与水电离产生的氢离子或氢氧根离子结合生成弱电解质的反应,叫做盐类的水解。
二、盐类水解的实质盐类水解的实质是盐电离出的离子破坏了水的电离平衡,促进了水的电离,使得溶液中的 c(H⁺)和 c(OH⁻)不再相等,从而使溶液呈现出酸性、碱性或中性。
三、盐类水解的特点1、可逆性盐类水解是可逆反应,存在水解平衡。
2、微弱性盐类水解程度一般较小,水解产物的浓度较小。
3、吸热性盐类水解是吸热反应,升高温度,水解程度增大。
四、盐类水解的规律1、有弱才水解只有含有弱酸阴离子或弱碱阳离子的盐才能发生水解。
2、无弱不水解强酸强碱盐(如 NaCl、KNO₃等)不发生水解,溶液呈中性。
3、谁弱谁水解盐中的阴离子对应的酸越弱,水解程度越大;阳离子对应的碱越弱,水解程度越大。
4、越弱越水解酸或碱越弱,对应的盐水解程度越大。
5、谁强显谁性盐溶液中,阴离子和阳离子对应的酸和碱的相对强弱决定溶液的酸碱性。
例如,碳酸钠(Na₂CO₃)溶液中,碳酸根离子水解,而钠离子不水解,碳酸根离子对应的酸是碳酸氢根离子,碳酸氢根离子对应的酸是碳酸,碳酸是弱酸,所以碳酸钠溶液呈碱性。
五、盐类水解的影响因素1、内因盐本身的性质,即组成盐的弱酸根离子或弱碱阳离子对应的酸或碱越弱,水解程度越大。
2、外因(1)温度升高温度,水解程度增大。
因为水解是吸热反应,升高温度平衡向吸热方向移动。
(2)浓度①增大盐溶液的浓度,水解平衡向右移动,但水解程度减小。
②加水稀释,水解平衡向右移动,水解程度增大。
(3)溶液的酸碱性①外加酸或碱会抑制或促进盐的水解。
例如,在氯化铵(NH₄Cl)溶液中加入盐酸,会抑制铵根离子的水解;在碳酸钠溶液中加入氢氧化钠,会抑制碳酸根离子的水解。
②对于多元弱酸的酸式盐,其酸碱性取决于酸式酸根离子的电离程度和水解程度的相对大小。
例如,碳酸氢钠(NaHCO₃)溶液中,碳酸氢根离子的水解程度大于电离程度,溶液呈碱性;而亚硫酸氢钠(NaHSO₃)溶液中,亚硫酸氢根离子的电离程度大于水解程度,溶液呈酸性。
盐类的水解知识点
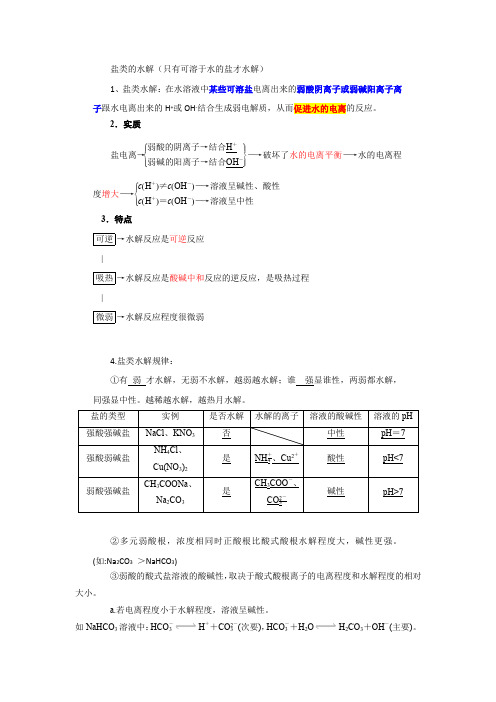
盐类的水解(只有可溶于水的盐才水解)1、盐类水解:在水溶液中某些可溶盐电离出来的弱酸阴离子或弱碱阳离子离子跟水电离出来的H +或OH -结合生成弱电解质,从而促进水的电离的反应。
2.实质盐电离→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子→结合H +弱碱的阳离子→结合OH -―→破坏了水的电离平衡―→水的电离程度增大―→⎩⎪⎨⎪⎧c (H +)≠c (OH -)―→溶液呈碱性、酸性c (H +)=c (OH -)―→溶液呈中性 3.特点可逆→水解反应是可逆反应 |吸热→水解反应是酸碱中和反应的逆反应,是吸热过程 |微弱→水解反应程度很微弱4.盐类水解规律:①有 弱 才水解,无弱不水解,越弱越水解;谁 强显谁性,两弱都水解,同强显中性。
越稀越水解,越热月水解。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。
(如:Na 2CO 3 >NaHCO 3)③弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
a.若电离程度小于水解程度,溶液呈碱性。
如NaHCO 3溶液中:HCO -3H ++CO 2-3(次要),HCO -3+H 2O H 2CO 3+OH -(主要)。
b.若电离程度大于水解程度,溶液显酸性。
如NaHSO3溶液中:HSO-3H++SO2-3(主要),HSO-3+H2O H2SO3+OH-(次要)。
(目前必须知道HC2O4-、HSO-3、HPO32—和H2PO4—的电离大于水解)5.表示方法——水解的离子方程式(1)一般盐类水解程度很小,水解产物很少,在书写盐类水解方程式时要用“”号连接。
盐类水解一般不会产生沉淀和气体,所以不用“↓”或“↑”表示水解产物(双水解例外)。
不把产物(如NH3·H2O、H2CO3)写成其分解产物的形式。
如:Cu(NO3)水解的离子方程式为Cu2++2H2O Cu(OH)2+2H+。
NH4Cl水解的离子方程式为NH+4+H2O NH3·H2O+H+。
盐类的水解

盐类的水解盐类水解:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。
1、盐水解的实质:水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合,破坏水的电离,是平衡向右移动,促进水的电离。
2、盐类水解规律:①有弱才水解,无弱不水解,越弱越水解;谁强显谁性,两弱都水解,同强显中性。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。
(如:Na2CO3>NaHCO3)3、盐类水解的特点:(1)可逆(与中和反应互逆)(2)程度小(3)吸热4、影响盐类水解的外界因素:①温度:温度越高水解程度越大(水解吸热,越热越水解)②浓度:浓度越小,水解程度越大(越稀越水解)③酸碱:促进或抑制盐的水解(H+促进阴离子水解而抑制阳离子水解;OH-促进阳离子水解而抑制阴离子水解)5、酸式盐溶液的酸碱性:①只电离不水解:如HSO4- 显酸性②电离程度>水解程度,显酸性(如: HSO3-、H2PO4-)③水解程度>电离程度,显碱性(如:HCO3-、HS-、HPO42-)7、双水解反应:(1)构成盐的阴阳离子均能发生水解的反应。
双水解反应相互促进,水解程度较大,有的甚至水解完全。
使得平衡向右移。
(2)常见的双水解反应完全的为:Fe3+、Al3+与AlO2-、CO32-(HCO3-)、S2-(HS-)、SO32-(HSO3-);S2-与NH4+;CO32-(HCO3-)与NH4+其特点是相互水解成沉淀或气体。
双水解完全的离子方程式配平依据是两边电荷平衡,如:2Al3++ 3S2- + 6H2O == 2Al(OH)3↓+3H2S↑9、水解平衡常数(Kh)对于强碱弱酸盐:Kh=Kw/Ka(Kw为该温度下水的离子积,Ka为该条件下该弱酸根形成的弱酸的电离平衡常数)对于强酸弱碱盐:Kh=Kw/Kb(Kw为该温度下水的离子积,Kb为该条件下该弱碱根形成的弱碱的电离平衡常数)电离、水解方程式的书写原则1)、多元弱酸(多元弱酸盐)的电离(水解)的书写原则:分步书写注意:不管是水解还是电离,都决定于第一步,第二步一般相当微弱。
盐类的水解

AlO2-
Fe3+
SiO32CO32-
HCO3-
AlO2-
NH4+
SiO32-
1、写出下列物质水解的离子方程式:
①FeCl3 ②Na2CO3 ③ NH4Cl ④ Al(HCO3)3
①Fe3+ + 3H2O
Fe(OH)3 + 3H+
②CO32- + H2O HCO3- +H2O
HCO3- + OHH2CO3 + OH-
草木灰不宜与铵态氮肥混合施用
草木灰的主要成分:K2CO3,水解呈碱性
CO32-+H2O
HCO3-+H2O
HCO3- +OH-
H2CO3 +OH-
铵态氮肥——铵盐,水解呈酸性。
NH4++H2O
NH3·H2O+ H+
有Na2CO3、Na2SO4、Na2S、NaOH四 种无色溶液,只用一种试剂就能把 四种无色溶液区别开,这种试剂可 能是( C) A.HCl B.BaCl2 C.AlCl3 D.酚酞
双水解:
两种水解情况相反的盐溶液混合时会互相
促进,使双方水解程度都增大
NH4++HCO3-+H2O NH3·H2O +H2CO3
2Al3++3S2-+6H2O == 2Al(OH)3↓+3H2S↑
AlO2SiO32-
CO32-
Al3+ SO32-
S2HSHCO3HSO3-
常见的、典型的双水解反应:
盐类的水解
一、盐类的水解:
1.盐类水解的本质
盐电离出的离子与水电离出的H+或OH-生成
盐类水解规律知识点总结

盐类水解规律知识点总结
以下是盐类水解规律的知识点总结:
1. 盐的定义:盐是由金属离子和非金属离子(或羧基)通过化学键结合而成的化合物,通常在水中溶解后会分解成阳离子和阴离子。
2. 阳离子和阴离子的水解:在盐类水解中,阳离子和阴离子的水解是分别进行的。
阳离子水解会产生酸性物质,而阴离子水解会产生碱性物质。
例如,氯化铵(NH4Cl)在水中会发生水解反应,产生NH4+和Cl-离子。
NH4+离子会与水分子发生反应,生成NH4OH和H+离子,从而产生酸性溶液;而Cl-离子会与水分子发生反应,生成OH-离子,从而产生碱性溶液。
3. 盐类水解的影响因素:盐类水解的速度和程度受到多种因素的影响,主要包括盐类的离子性和极性、水的性质、温度和压力等。
离子性和极性较强的盐类更容易发生水解反应,而水的性质、温度和压力则会影响水解反应的速率和平衡位置。
4. 盐类的水解平衡:盐类的水解反应会达到一个动态平衡状态,即反应速率的正向和反向反应同时发生,并达到一定的平衡位置。
平衡位置受到水解反应速率的影响,取决于反应物的浓度、温度和压力等因素。
当平衡位置发生偏移时,会影响溶液的酸碱性质。
5. 盐类水解的应用:盐类水解在化学工业和生活中有着广泛的应用。
例如,盐类水解反应可以用来制备酸碱溶液、调节土壤酸碱性、净化废水等。
此外,盐类水解规律的研究也为化学反应动力学和平衡化学等领域提供了重要的理论基础。
总之,盐类水解是化学领域中重要的概念之一,它在酸碱中和反应、化学平衡、工业生产和环境保护中都有着重要的应用价值。
对盐类水解规律的深入理解可以为相关领域的研究和应用提供重要的理论支持。
盐类水解知识点

盐类水解一、定义:在溶液中盐的 跟水所电离出来的 或 生成 的过程。
二、条件:盐必须溶于 ,必须能电离出 离子或 离子。
三、实质: 的生成,破坏了水的电离, 水的电离平衡发生移动。
四、规律:盐的构成中出现 离子或 离子,该盐就会水解;这些离子对应的碱或酸越 ,水解程度越大,溶液的pH 变化越大;水解后溶液的酸碱性由构成该盐离子对应的 和 相对强弱决定,酸强显 性,碱强显 性。
五、特点1.水解反应和 反应处于动态平衡,水解进行程度很小。
2.水解反应为 反应。
3.盐类溶解于水,以电离为主, 为辅。
4.多元弱酸根 水解且步步难,以 为主。
六、离子反应方程式: 1.应用 表示,2.在书写水解离子方程式时不标" "" ",但是如果存在双水解的情况,通常需要标注"↓""↑",且可逆符号要换成 号。
七、水解平衡的因素1.影响水解平衡进行程度最主要因素是 的性质。
(1)组成盐的酸根对应的酸越 ,水解程度越大,碱性就越 ,PH 越 ; (2)组成盐的阳离子对应的碱越 ,水解程度越大,酸性越 ,PH 越 。
例:已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L 的NaA 和NaB 混合溶液中,下列排序正确的是()A.c(OH -)>c(HA)>c(HB)>c(H +) B.c(OH -)>c(A -)>c(B -)>c(H +)C.c(OH -)>c(B -)>c(A -)>c(H +) D.c(OH -)>c(HB)>c(HA)>c(H +) 2.外界条件对平衡移动也有影响,移动方向应符合勒夏特列原理。
(1)温度:升温平衡 ,水解程度 。
(2)浓度:改变平衡体系中每一种物质的 ,都可使平衡移动。
盐的浓度越 ,水解程度越大。
(3)溶液的酸碱度:加入酸或碱能 或 盐类的水解。
盐类水解规律

盐类水解规律盐类水解是一种复杂的化学现象,它对于许多化学反应和生物过程都有着重要的影响。
了解盐类水解的规律有助于我们更好地理解化学反应的本质,提高实验技能和实际应用能力。
本篇文档将探讨盐类水解规律及其相关方面。
1.弱碱阳离子和弱酸阴离子在水中易水解盐类水解是指盐在水溶液中离解出酸或碱阳离子和酸或碱阴离子,并产生氢离子或氢氧根离子的过程。
在盐类水解中,弱碱阳离子和弱酸阴离子容易在水中发生水解。
这是因为它们在水溶液中不稳定,容易失去或接受质子,形成酸或碱。
2.酸式盐比正盐更容易水解酸式盐是含有氢离子的盐,其水溶液中存在氢离子。
由于氢离子可以与水中氢氧根离子结合形成水,因此酸式盐比正盐更容易发生水解。
3.含有弱离子的盐均能发生水解反应在盐类中,只要含有弱离子的盐均能发生水解反应。
弱离子包括弱碱阳离子、弱酸阴离子、酸式根离子等。
这些离子在水溶液中不稳定,容易发生质子转移,从而形成酸或碱。
4.水解反应是一个吸热反应水解反应是一个吸热反应,这意味着需要提供能量才能使水解反应发生。
这种能量通常来自环境的温度或外部能量源。
因此,水解反应可以在常温下进行,也可以在加热条件下加速。
5.水解平衡也是化学平衡的一种水解平衡是化学平衡的一种特殊形式。
在水解过程中,当盐的浓度达到一定程度时,水解反应会趋于平衡状态。
这个平衡状态可以通过化学平衡常数来描述,其数值取决于盐的种类、温度和浓度等因素。
6.影响水解平衡的因素有温度、浓度和酸度等影响水解平衡的因素包括温度、浓度和酸度等。
温度升高可以加速水解反应,提高水解程度;浓度增加可以促进水解反应,使水解程度加深;酸度增加可以抑制水解反应,降低水解程度。
这些因素的综合作用可以影响水解平衡的位置和稳定性。
7.水解产物与水解反应的类型有关不同类型的盐类具有不同的水解反应和产物。
例如,强碱弱酸盐在水中会生成弱酸和强碱;强酸弱碱盐在水中会生成弱碱和强酸;强酸强碱盐在水中则不会发生明显的化学反应。
盐类的水解2

3、加水稀释 加水稀释,有利于水解
4、双水解互相影响Biblioteka 两种盐水解溶液酸碱性相反时,盐类水
解反应可相互促进 如硫酸铝溶液和碳酸氢钠溶液混和产生 沉淀和气体
二、需要考虑盐类水解的几种 情况
1、判断盐溶液的酸碱性时 例如:同物质的量浓度的下列溶液按PH同大
到小的顺序排列为 ①Na2CO3②KHCO3③NaCl④NaAc ⑤NaOH⑥Na2SiO3 同物质的量浓度溶液酸碱性通常 PH:二元强碱、一元强碱、弱酸强碱盐、强 酸强碱盐、强酸弱碱盐、一元强酸、二元强酸
盐类的水解
盐类水解的规律
1、盐类水解的实质 盐类水解的实质是水的电离平衡发生移
动 2、只有能与氢离子或氢氧根离子结合成 难电离的物质的离子,如弱酸、弱碱的 离子,才能使水的电离平衡发生移动。
3、盐类水解是中和反应的逆反应,是一
个吸热反应,反应趋势小,生成物通常 无沉淀,气体等现象,方程式中也不标 沉淀、气体符号。 4、多元弱酸盐分步水解,第一步水解较 容易发生,第二步比第一步难水解,水 解以第一步为主
四、盐溶液中离子浓度的有关 问题
1、溶液中微粒种类或数目的比较 分析水溶液中微粒数目或种类,一般既
要考虑电解质的电离,又要考虑盐类的 水解,还应重视水的电离及存在。 如NaHS溶液中,存在的分子有: 存在的离子有:
2、溶液中微粒浓度比较 比较溶液中离子浓度大小必须明确 盐的水解规律;盐的水解与电离的比较;单水
溶液反应制取。 3、电离和水解矛盾统一 碳酸氢钠溶液呈碱性 磷酸二氢钠溶液呈酸性 磷酸氢二钠溶液呈碱性 硫酸氢钠溶液呈酸性
外因 1、温度 水解反应是一个吸热反应。如用纯碱水溶液洗
【重难点】《盐类的水解》知识点详解

盐类水解是高考的重难点内容之一,每年分值都不同,今天给大家分享这部分知识,需要的收藏哦!(一)盐类水解实质(从水的电离平衡下手)盐溶于水电离出的某种离子,与水电离的氢离子或氢氧根离子结合生成弱电解质,使水的电离平衡发生移动。
(二)盐类水解规律口诀:无弱不水解,有弱才水解,越弱越水解,双弱双水解,谁强显谁性.解释:(1)弱碱强酸盐的水解在溶液中,存在的电离和水的电离电离出来的可以跟水电离出来的结合成弱电解质,使下降,水的电离平衡向正向移动,从而造成溶液中的溶液呈现酸性。
(2)弱酸强碱盐的水解在溶液中的弱酸根阴离子,与电离出来的结合成弱电解质分子,使的电离平衡向正向移动,不断增大,直至建立起新的平衡,溶液呈现碱性。
规律:(1)弱碱强酸盐可溶性的弱碱强酸盐,如、、等能发生水解反应,水解后溶液呈现酸性。
(2)弱酸强碱盐可溶性的弱酸强碱盐,如、、、等能发生水解反应,水解后溶液呈现碱性。
(3)弱酸弱碱盐可溶性的弱酸弱碱盐,如、、等很容易发生水解反应,水解后溶液的酸碱性取决于该盐水解生成的弱酸、弱碱的相对强弱。
(4)强酸强碱盐各种强酸强碱盐均不能发生水解反应,溶液仍为中性。
(三)正确书写盐类水解的例子方程式盐类水解属于离子反应,可以按照离子方程式的书写规范,写出正确的离子方程式。
例如,硫酸铜水解的离子方程式可按以下三个步骤写出:第一步写出水解的化学方程式第二步把易溶于水的强电解质改写为离子形式第三步消去反应式两边相同的离子()上述这个盐类水解的离子方程式揭示了水解的实质,是使水的电离平衡破坏,生成弱碱分子和,使溶液呈现酸性,比盐类水解的化学方程式有更大的优越性。
书写盐类水解的离子方程式时,要注意以下三点:(1)要写可逆号“”,不能写等号。
(2)难溶化合物不写沉淀符号“↓”。
(3)气体物质不写气体符号“↑”。
怎样才能又迅速、又准确地书写盐类水解的离子方程式呢?(1)弱碱强酸盐水解的离子方程式是弱碱阳离子的水解,弱碱阳离子所带电荷数,就是水分子的系数,也是氢离子的系数。
高中化学:盐类的水解及应用知识点

高中化学:盐类的水解及应用知识点盐类水解的规律:有弱才水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性;同强显中性。
由此可见,盐类水解的前提条件是有弱碱的阳离子或弱酸的酸根离子,其水溶液的酸碱性由盐的类型决定,利用盐溶液的酸碱性可判断酸或碱的强弱。
(1)盐的类型是否水解溶液的pH强酸弱碱盐水解pH<7强碱弱酸盐水解pH>7强酸强碱盐不水解pH=7(2)组成盐的弱碱阳离子(M+)能水解显酸性,组成盐的弱酸阴离子(A-)能水解显碱性。
M++H2O MOH+H+显酸性A-+H2O HA+OH-显碱性(3)盐对应的酸(或碱)越弱,水解程度越大,溶液碱性(或酸性)越强。
盐类水解离子方程式的书写1.注意事项(1)一般要写可逆“”,只有彻底水解才用“===”。
(2)难溶化合物不写沉淀符号“↓”。
(3)气体物质不写气体符号“↑”。
2.书写方法(1)弱酸强碱盐①一元弱酸强碱盐水解弱酸根阴离子参与水解,生成弱酸。
例如:CH3COONa+H2O CH3COOH+NaOH离子方程式:CH3COO-+H2O CH3COOH+OH-②多元弱酸根阴离子分步水解由于多元弱酸的电离是分多步进行的,所以多元弱酸的酸根离子的水解也是分多步进行的,阴离子带几个电荷就要水解几步。
第一步水解最易,第二步较难,第三步水解更难。
例如:Na2CO3+H2O NaHCO3+NaOHNaHCO3+H2O H2CO3+NaOH离子方程式:CO3+H2O HCO3+OH-HCO3+H2O H2CO3+OH-③多元弱酸的酸式强碱盐水解例如:NaHCO3+H2O H2CO3+NaOH离子方程式:HCO3+H2O H2CO3+OH-(2)强酸弱碱盐①一元弱碱弱碱阳离子参与水解,生成弱碱。
②多元弱碱阳离子分步水解,但写水解离子方程式时一步完成。
例如:AlCl3+3H2O Al(OH)3+3HCl离子方程式:Al3++3H2O Al(OH)3+3H+(3)某些盐溶液在混合时,一种盐的阳离子和另一种盐的阴离子,在一起都发生水解,相互促进对方的水解,水解趋于完全。
盐类的水解知识点总结

盐类的水解知识点总结
定义:盐类的水解是指在溶液中,盐电离出来的离子与水电离出来的H+或OH-结合,生成弱电解质的反应。
这个过程破坏了水的电离平衡,促进了水的电离。
条件:盐必须溶于水,且能电离出弱酸根离子或弱碱阳离子。
规律:难溶不水解,有弱才水解,无弱不水解;谁弱谁水解,越弱越水解,都弱都水解;谁强显谁性(适用于正盐),同强显中性,弱弱具体定。
即盐的构成中出现弱碱阳离子或弱酸根阴离子,该盐就会水解;这些离子对应的碱或酸越弱,水解程度越大,溶液的pH变化越大;水解后溶液的酸碱性由构成该盐离子对应的酸和碱相对强弱决定,酸强显酸性,碱强显碱性。
特点:水解反应和中和反应处于动态平衡,水解进行程度很小;水解反应为吸热反应;盐类溶解于水,以电离为主,水解为辅;多元弱酸根离子分步水解,以第一步为主。
表示方法:盐类的水解用水解方程式表示。
由于盐类的水解程度通常很小,因此在书写水解离子方程式时不标“↓”“↑”,但是如果存在双水解的情况,通常需要标注“↓”“↑”,且可逆符号要换成等于号。
应用:盐类水解在生活和工业中有广泛的应用,如制造燃料、净水、制造清洁剂、制造精细化工产品、制造环保产品、制造化妆品、制造润滑剂和制造纸张等。
以上是盐类水解的基本知识点,理解并掌握这些内容,可以更好地理解和应用盐类水解的相关知识。
(完整版)盐类的水解知识点总结

(完整版)盐类的水解知识点总结水解中和盐类的水解1.复习重点1.盐类的水解原理及其应用2.溶液中微粒间的相互关系及守恒原理2.难点聚焦(一)盐的水解实质H2O H+—n当盐AB能电离出弱酸阴离子(B n—)或弱碱阳离子(A n+),即可与水电离出的H+或OH—结合成电解质分子,从而促进水进一步电离.与中和反应的关系:盐+水酸+碱(两者至少有一为弱)由此可知,盐的水解为中和反应的逆反应,但普通以为中和反应程度大,大多以为是彻底以应,但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
(二)水解规律简述为:有弱才水解,无弱别水解越弱越水解,弱弱都水解谁强显谁性,等强显中性具体为: 1.正盐溶液①强酸弱碱盐呈酸性②强碱弱酸盐呈碱性③强酸强碱盐呈中性④弱酸碱盐别一定如 NH4CN CH3CO2NH4 NH4F碱性中性酸性取决于弱酸弱碱相对强弱2.酸式盐①若惟独电离而无水解,则呈酸性(如NaHSO4)②若既有电离又有水解,取决于两者相对大小电离程度>水解程度,呈酸性电离程度<水解程度,呈碱性强碱弱酸式盐的电离和水解:如H3PO4及其三种阴离子随溶液pH变化可相互转化:pH值增大H3PO4 H2PO4— HPO42— PO43—pH减小③常见酸式盐溶液的酸碱性碱性:NaHCO3、NaHS、Na2HPO4、NaHS.酸性(非常特别,电离大于水解):NaHSO3、NaH2PO4、NaHSO4(三)妨碍水解的因素内因:盐的本性.外因:浓度、湿度、溶液碱性的变化(1)温度别变,浓度越小,水解程度越大.(2)浓度别变,湿度越高,水解程度越大.(3)改变溶液的pH值,可抑制或促进水解。
(四)比较外因对弱电解质电离和盐水解的妨碍.HA H++A——Q A—+H2O HA+OH——Q温度(T)T↑→α↑ T↑→h↑加水平衡正移,α↑促进水解,h↑增大[H+] 抑制电离,α↑促进水解,h↑增大[OH—]促进电离,α↑抑制水解,h↑增大[A—] 抑制电离,α↑水解程度,h↑注:α—电离程度 h—水解程度考虑:①弱酸的电离和弱酸根离子的水解互为可逆吗?②在CH3COOH和CH3COONO2的溶液中分不加入少量冰醋酸,对CH3COOH电离程度和CH3COO—水解程度各有何妨碍?(五)盐类水解原理的应用考点 1.推断或解释盐溶液的酸碱性例如:①正盐KX、KY、KZ的溶液物质的量浓度相同,其pH值分不为7、8、9,则HX、HY、HZ的酸性强弱的顺序是________________②相同条件下,测得①NaHCO3②CH3COONa ③NaAlO2三种溶液的pH值相同。
盐类的水解高三化学知识点

盐类的水解高三化学知识点盐类的水解高三化学知识点盐类水解的规律1.有弱才水解:含有弱酸根阴离子或弱碱阳离子的盐才发生水解。
2.无弱不水解:不含有弱酸根阴离子或弱碱阳离子的盐即强酸强碱盐不水解。
3.谁弱谁水解:发生水解的是弱酸根阴离子和弱碱阳离子。
4.谁强显谁性:弱酸弱碱盐看水解生成的酸和碱的强弱。
5.越弱越水解:弱酸根阴离子所对应的酸越弱,则越容易水解,水解程度越大。
若酸性HA>HB>HC,则相同浓度的NaA、NaB、NaC溶液的碱性逐渐增强,pH逐渐增大。
CO32-和HCO3-所对应的弱酸分别是HCO3- 和H2CO3,HCO3-比H2CO3的电离程度小得多,相同浓度时Na2CO3溶液的pH比NaHCO3的大。
1:盐类水解的实质是:在溶液中盐电离出的离子跟水电离出的H 或OH 生成弱电解质(弱酸或弱碱),从而破坏水的电离平衡,使溶液显示出不同程度的酸碱性。
2:盐类水解的规律为“遇弱才水解,无弱不水解,越弱越水解,谁强显谁性”. 如强酸强碱盐不水解;弱碱强酸盐水解显酸性;强碱弱酸盐水解显碱性。
3:盐类的水解是酸碱中和反应的逆反应,一般水解进行到一定程度达到平衡状态,影响水解平衡的因素有浓度、温度等.浓度越小,则水解程度越大;升高温度,水解程度增大。
4:盐类水解离子方程式的书写方法,除了遵循离子方程式的书写原则外,还应注意:①反应物中写出参加水解的离子和水。
②单水解用“ ”号,完全双水解才用“=” 。
③多元弱酸根离子的水解应分步写。
④单水解产物不应打“”或“” 要点盐类水解的定义和实质1.定义盐电离出的.一种或多种离子跟水电离出的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
2.实质盐电离出的离子(弱碱阳离子或弱酸根阴离子)跟水电离出的OH-或H+结合生成弱电解质(弱碱或弱酸)并建立电离平衡,从而促进水的电离。
3.盐类水解的特点①可逆的,其逆反应是中和反应;②微弱的;③动态的,水解达到平衡时v(水解)=v(中和)≠0;④吸热的,因中和反应是放热反应,故其逆反应是吸热反应。
2024年新高考版化学专题十三盐类的水解和沉淀溶解平衡讲解部分

弱酸阴离子和弱碱阳离子会相互促进水解,若水解产物均为容易脱离反
应体系的溶解度较小的物质(如溶解度不大的气体或沉淀),则其相互促进
水解的程度非常大,水解反应认为完全进行,应用“ ”“↑”“↓”
表示,如Al3++3HCO3
Al(OH)3↓+3CO2↑;若水解产物中有溶解度较大
的物质(无法脱离反应体系),虽水解反应能相互促进,但水解程度还是较
2)不同盐溶液中同一离子浓度的比较,要看溶液中其他离子对它的影
响。如相同浓度的NH4Cl(a)、CH3COONH4(b)、NH4HSO4(c)三种溶液中
c(N
H
4
)由大到小的顺序是c>a>b。
3)混合液中各离子浓度的比较,要综合分析水解因素和电离因素。如相
同浓度的NH4Cl和氨水混合液中,因NH3·H2O的电离程度>NH
3)酸式盐溶液酸碱性的判断 ①强酸的酸式盐只电离,不水解,其溶液一定显酸性,如NaHSO4。 ②弱酸的酸式盐溶液的酸碱性取决于酸式酸根离子的电离程度和水解 程度的相对大小。 a.若电离程度大于水解程度,则溶液显酸性。如NaHSO3、NaH2PO4。 b.若电离程度小于水解程度,则溶液显碱性。如NaHCO3、NaHS、Na2 HPO4。
难溶物,如用硝酸溶解金属硫化物(CuS、HgS等);③生成配合物法,如要溶 解AgCl可加入氨水生成[Ag(NH3)2]+;④盐溶解法,如用NH4Cl溶液溶解Mg (OH)2。 3)沉淀的转化:一般来说,若难溶电解质类型相同,则Ksp较大的沉淀易转化 为Ksp较小的沉淀;若类型不同,沉淀的溶解度差别越大,越容易转化。 注意:一种沉淀可以转化为更难溶的沉淀,这是一般规律,并不意味着溶解 度小的沉淀不能转化为溶解度大的沉淀,沉淀转化的实质是沉淀溶解平 衡的移动。如BaSO4比BaCO3更难溶解,但将BaSO4沉淀加入饱和的Na2
高中化学——盐类的水解

盐类的水解课标解读要点网络1.了解盐类水解的原理。
2.了解影响盐类水解的主要因素。
3.了解盐类水解的应用。
4.能正确书写盐类水解的化学或离子方程式。
盐类的水解原理及规律1.盐类的水解原理 (1)定义在溶液中由盐电离产生的离子与水电离产生的H +或OH -结合生成弱电解质的反应。
(2)实质―→[H +]≠[OH -]―→溶液不再呈中性。
(3)特点可逆→水解反应是可逆反应吸热→水解反应是酸碱中和反应的逆反应,ΔH >0 微弱→水解反应程度很微弱 (4)水解常数(K h ) A -+H 2OHA +OH -的水解常数表达式K h =[HA][OH -][A -]=[HA][OH -][H +][A -][H +]=K WK a,若25 ℃,HA 的K a 为1×10-6 mol·L -1则A -的水解常数K h 为1×10-8mol·L -1。
2.盐类的水解规律(1)类型盐的类型实例是否水解水解的离子溶液的酸碱性溶液的pH强酸强碱盐NaCl、KNO3否—中性=7强酸弱碱盐NH4Cl、Cu(NO3)2是NH+4、Cu2+酸性<7弱酸强碱盐CH3COONa、Na2CO3是CH3COO-、CO2-3碱性>7(2)一般规律有弱才水解,无弱不水解;越弱越水解,谁强显谁性;同强显中性,同弱不确定。
注意:这里说的“弱”指的是弱酸根离子或弱碱阳离子。
3.水解离子方程式的书写(1)书写形式在书写盐类水解方程式时一般要用“”号连接,产物不标“↑”或“↓”,用离子方程式表示为盐中的弱离子+水弱酸(或弱碱)+OH-(或H+)。
(2)书写规律①一般盐类水解程度很小,水解产物很少,如果产物易分解(如NH3·H2O、H2CO3)也不写成其分解产物的形式。
②多元弱酸盐的水解分步进行,以第一步为主,一般只写第一步水解的离子方程式,如Na2CO3的水解离子方程式:CO2-3+H2O HCO-3+OH-。
盐类的水解(水解规律1)

盐类水解的原理
盐类水解的原理是盐电离出的弱酸阴离子或弱碱阳离子与水电离产生的氢离子或 氢氧根离子结合,破坏了水的电离平衡,导致溶液中氢离子或氢氧根离子的浓度 发生变化。
盐类水解反应的实质是弱酸阴离子或弱碱阳离子结合水电离产生的氢离子或氢氧 根离子,生成弱电解质,从而促进了水的电离。
盐类水解的分类
溶液的酸碱度
酸碱度对水解的影响
溶液的酸碱度可以通过影响离子的存 在状态和活性来影响水解反应。在酸 性或碱性条件下,某些离子可能更稳 定或更容易发生水解反应。
缓冲溶液
对于一些弱酸或弱碱的盐类,在一定 的酸碱度范围内,其水解反应可以受 到溶液中存在的弱酸或弱碱的抑制, 这种现象称为缓冲作用。
03
盐类水解的应用
影响盐类水解的因素
盐类的性质
盐的类型
不同类型的盐在水中的溶解度和水解 程度不同,如强酸强碱盐、强酸弱碱 盐、弱酸强碱盐等。
盐的组成
盐中的阴阳离子对水解反应也有影响 ,某些离子更容易发生水解反应。
水的温度
温度影响
温度升高可以促进盐类的水解反应,因为温度升高可以增加水分子的热运动, 从而增加与离子碰撞的机会。
1
根据盐类水解反应的产物,盐类水解可以分为正 盐的水解和复盐的水解两类。
2
正盐的水解是指盐电离出的弱酸阴离子或弱碱阳 离子与水电离产生的氢离子或氢氧根离子结合, 生成弱电解质的过程。
3
复盐的水解是指复盐电离出的弱酸阴离子或弱碱 阳离子与水电离产生的氢离子或氢氧根离子结合, 生成弱电解质的过程。
02
3. 将烧杯置于恒温水浴锅 中,控制温度,观察水解 反应的变化情况。
2. 将水溶液分别倒入不同 的烧杯中,用玻璃棒搅拌 均匀。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
类型
实例 是否 水` 解的
水解 离子
强酸弱 碱盐
NH4Cl
水解
弱碱 阳离子
强碱弱 CH3COONa 水解 酸盐
弱酸 阴离子
生成的弱 电解质 弱碱
弱酸
溶液的酸 碱性 酸性
碱性
强酸强
碱盐
NaCl 不水解 无
无
中性
有弱才水解,无弱不水解。—条件 谁强显谁性,同强显中性。—结果 越弱越水解,都弱都水解。—程度
25.05.2019
上 页
下 页
首 页
返 回
3
课堂练习:
1. 下列溶液pH小于7的是
A、 溴化钾 B、 硫酸铜 C、 硫化钠 D、 硝酸钡
2. 下列溶液能使酚酞指示剂显红色的是
A 、碳酸钾 B、 硫酸氢钠 C、 碳酸氢钠 D、 氯化铁
3.下列离子在水溶液中不会发生水解的是
A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_
CH3COOH
CH3COONa + H2O CH3COOH+NaOH
_
CH3COO +H2O CH3COOH+OH
溶液中离子的浓度:
Na+
>
CH3COO-
>
_
OH
>
H+
25.05.2019
上 页
下 页
首 页
返 回
3 氯化铵在溶液中的变化:
NH4Cl H2O
NH4+ + Cl+ OH- +H+
25.05.2019
上 页
下 页
首 页
返 回
3
实验结果统计分析及推理:
测试对象
溶液酸碱性
生成该盐的
酸
碱
盐的类型
CH3COONa Na2CO3 KF
碱性
CH3COOH NaOH
H2CO3
NaOH
HF
KOH
强碱 弱酸盐
NH4Cl Al2(SO4)3 (NH4)2SO4
酸性
HCl H2SO4 H2SO4
NH3·H2O
Al(OH)3
强酸 弱碱盐
NH3 ·H2O
NaCl KNO3
中性
HCl HNO3
NaOH 强碱
KOH 强酸盐
Ba(NO3)2
25.05.2019
上 页
下 页
首 页
HNO3
返 回
Ba(OH)2
3
探究问题二
为什么上述不同类型盐溶液的酸 碱性不同?
25.05.2019
上 页
下 页
25.05.2019
上 页
下 页
首 页
返 回
3
课堂练习:
4. 氯化铵溶液中离子浓度从大到小排列正确的是:
A C
NHH4++、、CHl_+、、NOHH4-+、、COl_H _
B D
CCll__、、NNHH4+4+、、OHH+-、、OHH+ _
5.判断下列盐溶液的酸碱性,若能水解的写出水解 反应的离子方程式
(4) CH3COONa (5) AlCl3
结论:
(6)KNO3
CH3COONa 、 Na2CO3 的溶液显碱性 NH4Cl、 AlCl3 的溶液显酸性 NaCl 、KNO3 的溶液显中性
25.05.2019
上 页
下 页
首 页
返 回
3
实验结果统计分析及推理:
探究问题一
试用归纳法找出盐的组成与盐的 溶液酸碱性的关系?
NH3.H2O NH4Cl +H2O NH3.H2O + HCl
NH4+ +H2O NH3.H2O + H+
溶液中离子浓度: Cl- >NH4+ > H+ > OH-
25.05.2019
上 页
下 页首 页返 回来自3一. 盐类的水解
⒈定义:在溶液中盐__电离出 来的离子跟_水_所电离出来的 _H_+ 或 O__H_-_ 结 合 生 成 _弱__电__解_质__的反应,叫做盐类
⒉对概念的理解
①水解的条件:生成弱电解质。
②水解的实质:破坏了水的电离平衡, 促进 了水的电离。
③水解反应与中和反应的关系:
酸+碱 中和 盐+水 水解
④特点:中和反应进行的程度较大,是放热
反应;水解反应进行的程度较小,是吸热反
应。
25.05.2019
上 页
下 页
首 页
返 回
3 二. 盐类水解的规律
3
请思考
以水的电离平衡为基础, 说明HCl、NaOH 的水溶液为 什么分别显示酸性和碱性?
25.05.2019
上 页
下 页
首 页
返 回
3
25.05.2019
上 页
下 页
首 页
返 回
3
实验探究:
〖试一试〗用pH试纸检验下列溶液显酸性、碱 性、中性?
(1) NaCl
(2)Na2CO3 (3)NH4Cl
的水解。
25.05.2019
上 页
下 页
首 页
返 回
3
一. 盐类的水解
探究问题三
结合盐类水解的定义,探究下列问题: ⒈从盐的组成角度分析盐类水解 的条件、实质是什么?
⒉盐类水解反应与中和反应的关 系如何?反应程度如何?
25.05.2019
上 页
下 页
首 页
返 回
3
一. 盐类的水解
25.05.2019
上 页
下 页
首 页
返 回
3
探究问题四
如何书写盐类水解的化学方程式 及其离子方程式?
25.05.2019
上 页
下 页
首 页
返 回
3
三、盐类水解的化学、离子方程式的书写:
⒈盐类水解是可逆反应,反应方程式中要 写 符号,不写“=”符号。 ⒉盐类水解的程度一般很小,水解产物很 少,通常不生成沉淀和气体,不用“↓”、 “↑”符号,也不把生成物(如H2CO3、 NH3·H2O等)写成分解产物的形式。 ⒊多元弱酸盐分步水解,以第一步水解为 主,水解方程式一般只写第一步;多元弱 碱盐的水解不分步书写。
NaNO3、Cu(NO3)2、Na2S、FeCl3、NaClO
思考题:物质的量相同的下列溶液中含微粒种类最多的 是:
A.CaCl2 B.CH3COONa C.NH3
D.K2S
25.05.2019
上 页
下 页
首 页
返 回
只要我们坚持了,就没有克服不了的困难。或许,为了将来,为了自己的发展,我们会把一件事情想得非常透彻,对自己越来越严,要求越来越高,对任何机会都不曾错过,其 目的也只不过是不让自己随时陷入逆境与失去那种面对困难不曾屈服的精神。但有时,“千里之行,始于足下。”我们更需要用时间持久的用心去做一件事情,让自己其中那小 小的浅浅的进步,来击破打破突破自己那本以为可以高枕无忧十分舒适的区域,强迫逼迫自己一刻不停的马不停蹄的一直向前走,向前看,向前进。所有的未来,都是靠脚步去 丈量。没有走,怎么知道,不可能;没有去努力,又怎么知道不能实现?幸福都是奋斗出来的。那不如,生活中、工作中,就让这“幸福都是奋斗出来的”完完全全彻彻底底的 渗入我们的心灵,着心、心平气和的去体验、去察觉这一种灵魂深处的安详,侧耳聆听这仅属于我们自己生命最原始最动人的节奏。但,这种聆听,它绝不是仅限于、执着于 “我”,而是观察一种生命状态能够扩展和超脱到什么程度,也就是那“幸福都是奋斗出来的”深处又会是如何?生命不止,奋斗不息!又或者,对于很多优秀的人来说,我们 奋斗了一辈子,拼搏了一辈子,也只是人家的起点。可是,这微不足道的进步,对于我们来说,却是幸福的,也是知足的,因为我们清清楚楚的知道自己需要的是什么,隐隐约 约的感觉到自己的人生正把握在自己手中,并且这一切还是通过我们自己勤勤恳恳努力,去积极争取的!“宝剑锋从磨砺出,梅花香自苦寒来。”当我们坦然接受这人生的终局, 或许,这无所皈依的心灵就有了归宿,这生命中觅寻处那真正的幸福、真正的清香也就从此真正的灿烂了我们的人生。一生有多少属于我们的时光?陌上的花,落了又开了,开 了又落了。无数个岁月就这样在悄无声息的时光里静静的流逝。童年的玩伴,曾经的天真,只能在梦里回味,每回梦醒时分,总是多了很多伤感。不知不觉中,走过了青春年少, 走过了人世间风风雨雨。爱过了,恨过了,哭过了,笑过了,才渐渐明白,酸甜苦辣咸才是人生的真味!生老病死是自然规律。所以,面对生活中经历的一切顺境和逆境都学会 了坦然承受,面对突然而至的灾难多了一份从容和冷静。这世上没有什么不能承受的,只要你有足够的坚强!这世上没有什么不能放下的,只要你有足够的胸襟! 一生有多少 属于我们的时光?当你为今天的落日而感伤流泪的时候,你也将错过了明日的旭日东升;当你为过去的遗憾郁郁寡欢,患得患失的时候,你也将忽略了沿途美丽的风景,淡漠了 对未来美好生活的憧憬。没有十全十美的生活,没有一帆风顺的旅途。波平浪静的人生太乏味,抑郁忧伤的人生少欢乐,风雨过后的彩虹最绚丽,历经磨砺的生命才丰盈而深刻。 见过了各样的人生:有的轻浮,有的踏实;有的喧哗,有的落寞;有的激扬,有的低回。肉体凡胎的我们之所以苦恼或喜悦,大都是缘于生活里的际遇沉浮,走不出个人心里的 藩篱。也许我们能挺得过物质生活的匮乏,却不能抵挡住内心的种种纠结。其实幸福和欢乐大多时候是对人对事对生活的一种态度,一花一世界,一树一菩提,就是一粒小小的 沙子,也有自己精彩的乾坤。如果想到我们终有一天会灰飞烟灭,一切象风一样无影亦无踪,还去争个什么?还去抱怨什么?还要烦恼什么?未曾生我谁是我?生我之时我是谁? 长大成人方是我,合眼朦胧又是谁?一生真的没有多少时光,何必要和生活过不去,和自己过不去呢。你在与不在,太阳每天都会照常升起;你愁与不愁,生活都将要继续。时
