拜耳-维利格氧化反应
大学有机化学人名反应机理汇总
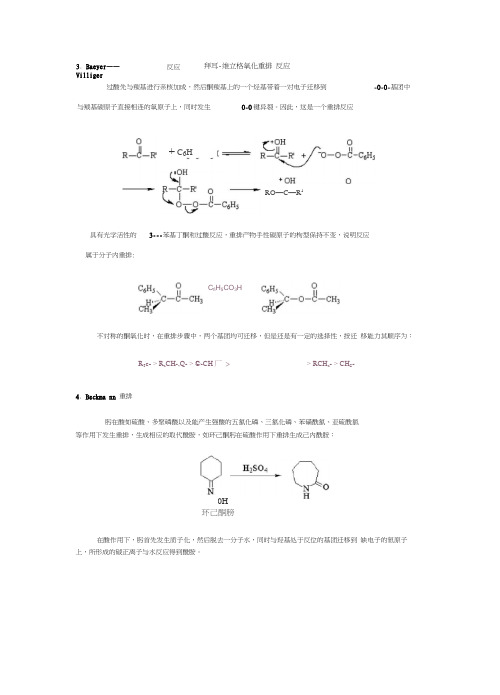
过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-0-0-基团中与羰基碳原子直接相连的氧原子上,同时发生0-0键异裂。
因此,这是一个重排反应具有光学活性的 3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁 移能力其顺序为:R 3c- > R a CH-,Q- > ©-CH 厂 > > RCH a - > CH S -4. Beckma nn 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:环己酮膀在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到 缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
3. Baeyer ——Villiger反应拜耳-维立格氧化重排 反应0H+ C 6H A ;O HRO —C —R 1C fi H 5CO 3H迁移基团如果是手性碳原子,则在迁移前后其构型不变。
7. Cannizzaro 反应凡a 位碳原子上无活泼氢的醛类和浓NaOH 或KOH 水或醇溶液作用时,不发生醇醛缩合 或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇:脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛 类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。
HCHO + C 6H 5CHO醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
眷£6+ C^CHQH9. Claisen 酯缩合反应HQR'-N=「一R + ---------- ■ R'—N=C-R甕一KHC —RHCHONaOH||C s Hj —C —H十0HII0H含有a -氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到B -酮酸酯。
大学有机化学人名反应机理汇总

3.Baeyer----Villiger 反应拜耳-维立格氧化重排反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
7.Cannizzaro 反应凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇:脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。
醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
9.Claisen 酯缩合反应含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
乙酸乙酯的α-氢酸性很弱(pK a-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的pK a~15.9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。
拜耳法生产氧化铝的基本原理

拜耳法生产氧化铝的基本原理
拜耳法生产氧化铝是一种新型的生产氧化铝的化学工艺,已经被普遍应用于金属表面处理行业。
其基本原理是通过将氧化铝直接转化为氢氧化碳来生产氢氧化铝,从而实现氧化铝生产。
从化学反应上看,拜耳法生产氧化铝的原理是通过电解反应,其中电极反应式为:
正极:2OH--+2H+ = H2O +2H2
2H2 + O2 = 2H2O
也就是说,在电解过程中,在正极上发生的反应使氧化钠产生氢氧化氢,而反应过程中负极上发生的反应使氢氧化铝产生氢氧化铝,最终氢氧化铝释放出来便会析出氧化铝沉淀。
拜耳法所使用的气体一般为氢、氮、氧、二氧化碳,氢气能够提供电解,从而起到氧化铝的溶解作用,氮气则对氧化铝的沉淀有较好的稳定作用,而氧气则有利于捕获沉淀的氧化铝,二氧化碳有利于调节接触能量,从而实现氧化铝的高质量的生产。
拜耳法生产氧化铝的优点是电解过程中水的反应产物为H2O,极少有有毒有害的物质排放,因此有利于环境保护;使用氢氮氧气体可以控制和优化比表面积和比容量,有利于生产现场的操作及控制。
Baeyer-Villiger_氧化

Baeyer-Villiger 氧化(卢加彬20093075 宋天洋20093078)约翰· 弗里德里希· 威廉阿道夫· 冯· 贝耶尔(1835 年 10 月 31 日-1917 年 8 月 20 日) 是德国化学家合成靛蓝的人,是 1905年收件人的诺贝尔化学奖。
出生于柏林,他最初学习数学和物理学在柏林大学之前将移动到海德堡研究化学与罗伯特接合。
在那儿他工作主要是在8 月Kekulé实验室,于1858 年赚他博士学位(从柏林)。
他跟随Kekulé根特大学,当Kekulé 成为那里教授。
他成了 1860 年,柏林贸易学院教授在 1871 年的斯特拉斯堡大学的讲师。
1875 年他成功贾斯斯· 冯· 利在慕尼黑大学化学教授.贝耶尔的主要成就包括合成及植物染料靛蓝的说明、酞染料、发现和调查的聚乙炔、 oxonium 盐、亚硝基化合物 (1869 年) 及尿酸衍生品(1860年和起)(包括巴比妥酸(1864 年) 的巴比妥类药物母化合物的发现)。
他是第一个提出正确的公式的吲哚于 1869 年后三年前出版的第一次合成。
他在理论化学的贡献包括小碳环 '应变' (Spannung)三债券和应变理论理论。
[3] 1871 年他发现酚酞合成缩邻苯二甲酸酐与两个相当于下苯酚的酸性条件(因此名称)。
那年他是首批获得合成荧光素,荧光色素常被称为pyoverdin自然微生物合成时(例如,通过一些荧光假单胞菌株)。
· 冯· 贝耶尔命名为resorcinphthalein他发现他已从邻苯二甲酸酐和间苯二酚人工合成它。
1881 年伦敦皇家学会颁发贝耶尔· 戴维奖章他的靛蓝染料的工作。
1884 年,他当选美国艺术与科学学院外国名誉会员。
[4] 1905 年他被授予诺贝尔化学奖"表彰的他在有机化学和化工行业,通过他对有机染料和 hydroaromatic 化合物的工作进步服务"。
拜耳-维利格氧化反应

拜⽿-维利格氧化反应拜⽿-维利格重排--经典有机反应/⼈名反应数据库拜⽿-维利格重排(Baeyer-Villiger Rearrangement)A. Baeyer, V. Villiger, Ber, 32,3625(1899); 23,858(1900)S.L.Friess, R. Pinson, J. Am. Chem. Soc. 74, 1302(1952)K. Mislow, J. Brenner, J. Am.Chem.Soc.75,2318(1953)W.A. Waters in H. Gilman, Organic Chemistry, vol 4,1169(John Wiley & Sons, New York, 1953)W. Sager, A. Duckworth, J.Am. Chem. Soc. 77, 188(1955)C.H.Hassall, Organic Reactions 9,73(1957)M.F.Hawthorne, W.D. Emmons, K.S. McCallum, J.Am.Chem.Soc 80,6393(1958)M.F. Hawthorne,W.D. Emmons,ibid,80,6398(1958)V. Franzen, Reaktionsmechanismen I p73-77(A. Huthig Verlag, Heidelberg, 1958)L.F.Fieser, M.Fieser, Advanced Organic Chemistry 427 (Reinhold, New York 1961)J.D.McClure, P.H. Williams, J. Org. Chem. 27,24,(1962)J.L. Mateos, H. Menchaca, ibid. 29,2026(1964)J.T.Pinhey, K.Schaffner, Tetrahedron Letters 1965,601J.C.Robertson, A. Swelim,ibid, 1967(30),2871拜⽿-维⽴格氧化重排反应(Baeyer-Villiger氧化重排反应)是酮在过氧化物(如过氧化氢、过氧化羧酸等)氧化下,在羰基和⼀个邻近烃基之间引⼊⼀个氧原⼦,得到相应的酯的化学反应。
《药物合成反应(闻韧主编第三版)》人名反应整理(新)

《药物合成反应(闻韧主编第三版)》人名反应整理一、卤化反应1、Hunsdriecke反应(汉斯狄克反应):羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
☆☆☆☆☆2、Sandmeyer反应(桑德迈尔反应):用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
☆☆3、Gattermann反应(加特曼反应):将Sandmeyer反应条件改为铜粉和氢卤酸。
☆☆4、Schiemann反应(席曼反应):将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或直接将芳胺用亚硝酸钠和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
☆二、烃化反应5、Willamson合成(威廉姆森合成):醇在碱(钠、氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
☆☆☆☆6、Gabriel合成(盖布瑞尔合成):将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾形成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,再经过肼解或酸水解即可得纯伯胺。
☆☆☆☆☆7、Delepine反应(德勒频反应):用卤代烃与环六亚甲基四胺(乌洛托品Methenamine)反应得季铵盐,然后水解即可得伯胺。
8、Leuckart-Wallach反应(鲁卡特-瓦拉赫反应):用甲酸及其铵盐可对醛酮进行还原烃化,得各类胺。
☆9、Ullmann反应(沃尔曼反应):卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
三、酰化反应10、Friedel-Crafts反应(傅列德尔-克拉夫茨反应,也称傅-克酰基化反应):羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
☆☆☆☆☆11、Hoesch反应(赫施反应):腈类化合物与氯化氢在Lewis酸催化剂ZnCl2等的存在下与烃基或烷氧基取代的芳烃进行反应可生成相应的酮亚胺,再经水解则得到羟基或烷氧基取代的芳香酮。
有机人名反应、试剂

颠茄酮
NH2OH Na/EtOH N OH NH2 (1) CH3I (2) AgOH O (1) Br2 (2) (CH3)2NH
N(CH3 )2
(1) CH3 I (2) AgOH
(1) Br2 (2) 喹啉
(1) HBr (2) (CH3)2NH
N(CH3)2
N(CH3)2 Na/EtOH N(CH3)2 Br2
Br (1) NaOH N(CH3)2 (2) Cl
Br Br
Br
Br Cl N(CH3)2 130 ℃ HBr NCH3 NCH3 H2SO4 NCH3
OH
O CrO3 NCH3
产率 0.75%
1896 Willstatter (1915 Nobel Prize)
21
Mannich反应-脱羧
CHO + CHO COOH COOH O NCH3 - 2CO2 NCH3 NH2CH3 + COOH O - 2H2O
芳醛与含有α–H的酮之间的交叉缩合生成α,β-不饱 和酮的反应成为克莱森–施密特反应。
O H + CH3COCH3 OH O C H O C H CH3
- H2O
100
OC
H C
例 如:
O
O H + CH3 OH
- H2O
100 C
O
H C
17
3.珀金(Perkin)反应
芳醛与含α-H的酸酐在碱催化下发生亲核加成反应,然后脱 去一分子羧酸,生成,-不饱合芳香酸的反应。
烯丙基芳基醚 克莱森 重排
CH3 O CH2 CH CH3 CH2 200 ° C HO H3C CH2 CH CH2 O CH2 CH CH2 200 ° C OH CH2 CH CH3 CH2
+++有机化学重排反应-总结
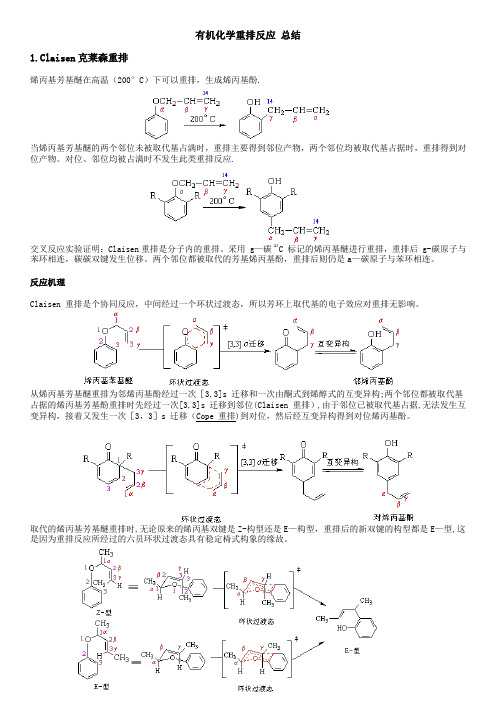
有机化学重排反应总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚.当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应.交叉反应实验证明:Claisen重排是分子内的重排。
采用 g—碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a—碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E—构型,重排后的新双键的构型都是E—型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2。
Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:3。
Bamberger,E。
重排苯基羟胺(N—羟基苯胺)和稀硫酸一起加热发生重排成对—氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
维林格重排的研究进展

维林格重排的研究进展作者:xx 指导老师:xx(xxxxxxx,xx,246000)摘要:介绍了近些年Baeyer-Villiger反应中氧化方面的研究情况,主要介绍常用的催化剂,包括酸类和具有碱性的水滑石类、过渡金属离子的分子筛类、微生物酶类及过渡金属配合物类,同时介绍了离子液体在Baeyer-Villiger氧化反应中的应用现状。
Baeyer一Viliger反应是一类将开链酮或环酮转化成相应的酯或内酯的氧化反应,从总的发展方向上看,这类反应催化剂作用的高效性、反应的原子经济性以及在不对称合成中的应用是特别值得关注的几个方面。
关键词:Baeyer-Villiger重排反应;催化剂;离子液体1引言Baeyer-Villiger是将酮氧化成相应的酯的一类氧化反应,也叫做Baeyer–Villiger重排[1,2]。
Adolf Baeyer等第一次于1899 年报道了Baeyer–Villiger重排反应,他们选择过硫酸钠和浓硫酸为氧化剂,进行了薄荷酮等的Baeyer-Villiger氧化反应。
此后,此类反应在天然产物等的合成中发挥着重要的意义。
对于此反应中常见的氧化剂,冯小明等[3]曾作过系统的综述,常规的B-V反应通常用三氟过氧乙酸、过氧苯甲酸等作为氧化剂,但用三氟过氧乙酸、过氧苯甲酸等作为氧化剂会对环境造成严重的污染,工业上已经很少被使用,新型的Baeyer-Villiger反应氧化剂以环境友好的H2O2和O2为主。
在对Baeyer–Villiger重排反应的研究中,催化剂方面的研究一直是热点。
同时,离子液体作为一类新型的绿色溶剂,近几年来也开始被应用于Baeyer–Villiger氧化反应。
2 Baeyer–Villiger氧化反应 5 类催化剂2.1 酸类在一些Baeyer一Villiger氧化反应体系中,如以氧化性很强的过酸为氧化剂时并不需要特殊的催化剂,当然也可以把它们归类于酸催化体系,因为过酸本身有一定的酸性,它很可能同时起到氧化剂和催化剂的作用。
有机合成第九章氧化反应

王鹏
山东科技大学 化学与环境工程学院
二、双键的双羟基化反应:
1、KMnO4:
使用稀、冷高锰酸钾等氧化剂可氧化得邻二醇类产 物。氧化历程如下:
KMnO4较少用于邻二醇,主要适于邻羟基酮和邻二 酮的合成:
含微量乙酸的丙酮中得邻羟基酮
王鹏
山东科技大学 化学与环境工程学院
乙酸酐中反应得到邻二酮
反应是亲核加成过程:
过氧化物的氧化属亲电反应 富电子的、供电子取代较多的双键优先氧化
问题:存在多个双键的烯烃,环氧化反应首先 在哪个双键上进行?
王鹏
山东科技大学 化学与环境工程学院
反应的选择性
控制条件,过氧酸优先氧化带供电子基团的碳碳双 键,例如:
×?
香叶醛
氧化选择性说明过氧酸倾向亲电加成
R1 C R2
迁移 O O CR
OH
缺电子中心
R向缺电子中心的迁移是反 应的关键
王鹏
OH
O
R1#43;
O R1O C R2
山东科技大学 化学与环境工程学院
原因:毒性和价格因素
王鹏
山东科技大学 化学与环境工程学院
三、碳碳双键臭氧化反应:
臭氧能氧化碳碳双键得臭氧化产物,产物加入 锌粉还原可得醛或酮,强还原剂则得醇
臭氧化产物除还原外还能水解和氧化得酮或酸
氧化
王鹏
山东科技大学 化学与环境工程学院
臭氧化首先在富电子的双键上反应,与过氧化 物的氧化机理相同,例如:
王鹏
山东科技大学 化学与环境工程学院
亲电的氧化反应过程: 反应举例:
王鹏
山东科技大学 化学与环境工程学院
过氧酸的使用注意:
第二章 氧化反应

四、高碘酸(H5IO6或HIO4· 2H2O )
氧化1,2-二醇,α-氨基醇,α-羟基酮并定量反应来自操作简单,可用于定量分析。
CH2 OH
O
CH OH
O C NH2 C H
CH2 OH
HIO4
2HCHO
+ HCOOH
HIO4
R1
R
C OH
RCOOH + R1COOH
HIO4
R1
R
C H
RCHO + R1CHO + NH3
亲核性越大重排也就越容易发生 • 烷基中:叔丁基>仲丁基>丙基>乙基>甲基 • 芳基:对甲氧基苯>苯>硝基苯
总体为:叔烷基>仲烷基>苯>环己基>伯烷基
二、锰化合物
1、高锰酸钾 2、活性二氧化锰
1、高锰酸钾
用于芳环或杂环的侧链氧化,氧化反应中电子云密 度大的易氧化。
NO2 NO2
KMnO4 OHNH2
用量按氧化计量计算。
氧化剂的种类
通用氧化剂:氧化能力强,选择性差
例如:KMnO4、 K2Cr2O7
专用氧化剂:氧化能力弱,选择性强
例如:Hg(Ac)2、CrO3、SeO2、Pb(OAc)4、H2O2
主要内容
一、过氧化物 二、锰化合物 三、铬酸及其衍生物 四、高碘酸 五、二氧化硒 六、四乙酸铅
一、过氧化物
CH2OH MnO2 CHO
CH3 C H C
CH3 CHOH CH3
MnO2
CH3 C H C
CH3 C CH3 O
三、铬酸及其衍生物
1、铬酸 H2CrO4 是一种通用氧化剂
003--第三章 氧化反应--2

Na2Cr2O7/H2SO4 H2O,65~70 C
o
CH3 O CH(CH3)2
94%
②.伯醇用重铬酸盐加酸的办法,仅适用于低沸点脂肪醛的 制备,并要求边反应边蒸出。
CH3CH2CH2OH
Na2Cr2O7/H2SO4 H2O,65~70 C
o
CH3CH2CHO
③.苄醇氧化成芳醛,是采用重铬酸钠水溶液在中性条件下 进行,产率较高。
CH3 CH3 O
HOO /CH3OH
-
HOO + H2O
O CH3 CH3 O-OH CH3
OH
O CH3 CH3 O CH3
CH3
②.酸性介质中: 过氧化氢异裂为 OH 和 OH ,后者为亲电 试剂。在有机酸介质中,过氧化氢首先生成过氧酸,而后进 行氧化反应,所得的环氧化合物遇酸开环。常用于烯烃的氧 化,最终产品为反式二醇。
70~78%
四.二元酚的制备
特别是邻苯二酚、对苯二酚和间苯二酚是合成香料、抗 氧化剂、橡胶粘合剂和染料的中间体。 1.传统制备方法:
生成邻苯二酚方法是用邻二氯苯水解法;生成间苯二酚是间苯二磺 酸碱融法; 生成对苯二酚则采用苯胺用二氧化锰或重铬酸钠在酸性介质 中氧化为对苯醌,然后用亚硫酸盐或铁粉将其还原为对苯二酚的方法。
HCOOOH + 2 H2O O (RCO)2O + H2O2 + H 2O R-C-O-OH 2.1 有机过氧酸的特点是可以将碳-碳双键氧化成环氧化物。 ①.烯烃环氧化 烯烃在适当无水惰性溶剂(CH2Cl2,CHCl3,苯等)中, 低温与有机过氧化酸反应,生成环氧化合物,该反应具有立 体专一性。
HCOOH + 2 H2O2
拜耳维利格反应

拜耳维利格反应
拜耳维利格氧化重排反应是过氧酸将酮氧化成酯的氧化反应,反应中发生亲核重排,反应中常用的过氧酸为过氧乙酸、过氧三氟乙酸、过氧化苯甲酸、3—氯代过氧化苯甲酸、过氧硫酸等。
在过氧试剂的存在下,醛和酮被氧化生成酯或内酯的反应被称为拜耳维利格氧化重排反应。
由于在反应过程中伴随着一个基团从碳原子向氧原子的迁移,所以叫拜耳维利格氧化重排反应。
拜耳维利格氧化重排反应被发现以来,已经成为有机合成中将醛和酮转变成为酯或内酯化合物的经典方法。
该反应具有以下特点:
(1)适用于多种羰基化合物。
(2)对多种官能团具有良好的兼容性。
(3)根据迁移基团的性质不同可预测反应的区域选择性。
(4)具有高度的立体选择性,迁移基团所连碳原子的绝对构型在反应前后保持不变。
反应步骤:
拜耳维利格氧化重排反应的机理包括两个步骤:首先是过氧酸对底物分子中羰基的亲核进攻,形成四取代中间体间体。
然后,Rm基团发生迁移,中间体重排生成相应的酯和酸。
其中,后一步骤是整个反应的速率决定步骤。
对于大多数底物而言,两个步骤的活化能基本相同。
因此,通常情况下,在反应中使用催化剂可以同时促进上述两
个步骤的进行。
拜尔魏立格反应

拜尔魏立格反应
重排反应(rearrangement reaction)是分子的碳骨架发生重排生成结构异构体的化学反应,是有机反应中的一大类。
重排反应通常涉及取代基由一个原子转移到同一个分子中的另一个原子上的过程。
拜尔-魏立格氧化重排:酮类化合物被过酸氧化,羰基碳与a-碳之间的键断裂,插入一个氧形成酯的反应称为拜尔(Boeyer)-魏立格(VilligerV)氧化重排。
拜耳-维立格氧化反应是用过氧酸把酮氧化到酯的反应。
氧化不对称酮时,较高级的烷基会转移到氧原子上。
烷基的立体化学在反应前后会保持。
酸性度高的过氧酸的氧化力更高。
反应性的大小顺序是
CH3COOOH<C6H5COOOH < mCPBA < p-NO2C6H4COOOH < CF3COOOH。
但从实用性和试剂处理操作上,还是mCPBA最好。
拜尔维利格氧化

拜尔维利格氧化引言拜尔维利格氧化是一种常用的有机合成反应,被广泛应用于化学领域。
本文将介绍拜尔维利格氧化的原理、应用和反应条件,旨在深入探讨该反应的各个方面。
原理拜尔维利格氧化是一种将次级醇氧化为相应的酮的重要反应。
该反应以过氧化氢为氧化剂,需要配合过渡金属催化剂,一般为钼酸盐或钨酸盐。
在反应中,过氧化氢被催化剂分解,形成活性的氧化剂氧,将次级醇的氢原子氧化为羰基。
应用合成药物拜尔维利格氧化在合成药物过程中起到重要作用。
许多药物合成的关键步骤就是将次级醇氧化为酮。
例如,拜尔维利格氧化被广泛应用于抗生素、降血脂药物和镇痛药物的制备过程中。
化学工业在化学工业中,拜尔维利格氧化也被广泛应用。
该反应可以用于生产酮类化合物,用作香料、颜料和涂料等的合成原料。
此外,拜尔维利格氧化还可以用于有机合成过程中的其他氧化反应,如烯烃的氧化和硫醇的氧化等。
生物化学研究拜尔维利格氧化在生物化学研究中也有重要应用。
研究人员可以利用该反应来氧化生物样品中的次级醇,以观察酮类产物的形成情况。
通过分析产物可以推测生物样品中的代谢物及其代谢途径,这对于研究生物体内新型化合物的代谢具有重要意义。
氧化剂拜尔维利格氧化所需的氧化剂为过氧化氢(H2O2)。
在实际应用中,一般使用30%浓度的过氧化氢溶液。
催化剂拜尔维利格氧化需要配合过渡金属催化剂。
常用的催化剂有钼酸盐和钨酸盐。
选择合适的催化剂可以提高反应的效率和选择性。
反应温度拜尔维利格氧化的反应温度一般较高,常在50-100摄氏度之间。
较高的温度有利于反应的进行。
反应时间反应时间可以根据具体的实验条件进行调整,一般在2-24小时之间。
反应时间过长可能导致副反应的发生,而反应时间过短则可能使反应不完全。
实验步骤拜尔维利格氧化的实验步骤如下: 1. 配制催化剂溶液:将适量的钼酸盐或钨酸盐溶解在适量的水中,得到催化剂溶液。
2. 加入过氧化氢:将催化剂溶液加入已配制好的30%过氧化氢溶液中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
拜耳-维利格重排--经典有机反应/人名反应数据库
拜耳-维利格重排(Baeyer-Villiger Rearrangement)
A. Baeyer, V. Villiger, Ber, 32,3625(1899); 23,858(1900)
S.L.Friess, R. Pinson, J. Am. Chem. Soc. 74, 1302(1952)
K. Mislow, J. Brenner, J. Am.Chem.Soc.75,2318(1953)
W.A. Waters in H. Gilman, Organic Chemistry, vol 4,1169(John Wiley & Sons, New York, 1953)
W. Sager, A. Duckworth, J.Am. Chem. Soc. 77, 188(1955)
C.H.Hassall, Organic Reactions 9,73(1957)
M.F.Hawthorne, W.D. Emmons, K.S. McCallum, J.Am.Chem.Soc 80,6393(1958)
M.F. Hawthorne,W.D. Emmons,ibid,80,6398(1958)
V. Franzen, Reaktionsmechanismen I p73-77(A. Huthig Verlag, Heidelberg, 1958)
L.F.Fieser, M.Fieser, Advanced Organic Chemistry 427 (Reinhold, New York 1961)
J.D.McClure, P.H. Williams, J. Org. Chem. 27,24,(1962)
J.L. Mateos, H. Menchaca, ibid. 29,2026(1964)
J.T.Pinhey, K.Schaffner, Tetrahedron Letters 1965,601
J.C.Robertson, A. Swelim,ibid, 1967(30),2871
拜耳-维立格氧化重排反应(Baeyer-Villiger氧化重排反应)是酮在过氧化物(如过氧化氢、过氧化羧酸等)氧化下,在羰基和一个邻近烃基之间引入一个氧原子,得到相应的酯的化学反应。
醛可以进行同样的反应,氧化的产物是相应的羧酸。
常用的氧化剂包括间氯过氧化苯甲酸、过氧化乙酸、过氧化三氟乙酸等。
为避免生成的酯在酸性条件下发生酯交换反应,常在反应物中加入磷酸氢二钠,以保持溶液接近中性。
从表面上看来,该反应仅是一个氧原子对碳-碳键进行的插入反应。
事实上,该反应是一个典型的1,2-迁移反应,其机制与霍夫曼重排、频哪醇重排等是类似的。
首先,反应物的羰基被质子活化(反应1),从而易于接受过氧酸的亲核进攻(反应2)。
亲核加成的产物中带有一个氧鎓离子,其质子将较容易转移到邻近的氧原子上,并通过正电荷与羰基共轭而获得额外的稳定性(反应3)。
随后,与原来过氧酸对应的羧酸从中间体离去,留下一个缺电子的氧正离子(反应4)。
由于氧具有很高的电负性,缺电子的氧是不稳定的,一个烃基(这里是R2)就通过1,2-迁移反应使整个分子再度处处符合八隅律,得到一个质子化的酯(反应5),并很快脱去质子而得到最终产物(反应6)。
由于反应4的产物极不稳定,通常认为(4)、(5)两步是同时发生的,即羧酸的离去与烃基的迁移是同时进行,相互促进的。
苯偶酰重排,又称苯甲酰重排:苯偶酰类化合物(即α-二酮类)在强碱作用下,发生分子内重排生成α-羟基酸的反应。
最著名的是二苯基乙二酮(苯偶酰)的重排
一:定义:过氧试剂将醛或酮氧化成酯(或内酯)的反应称为Baeyer-Villiger氧化反应(或叫Baeyer-Villiger氧化重排)。
二:机理:1:过氧酸或对羰基(或质子化的羰基)进行亲核进攻,产生四取代中间体(被称为Criegee中间体)。
2:迁移基团发生迁移,酸离去。
第二步为决速步。
(详见教科书),迁移完成后迁移基团绝对构型保持不变。
三:常用的酸
最适合的过酸最好通过实验测定。
常见有机过酸氧化能力顺序:三氟过氧乙酸(TFPAA)>单过氧马来酸(单过氧顺丁二烯酸,PMA)>单过氧邻苯二甲酸(MPAA)>3,5二硝基过氧苯甲酸>对硝基过氧苯甲酸(p-MPBA)>间氯过氧苯甲酸(m-CPBA)>过氧苯甲酸(PBA)>过氧乙酸(PAA)。
最常用90%TFPAA以及85%m-CPBA。
其中PAA氧化性最弱但是一般区域选择性更强,但是有可能根本不反应。
另外也有用H2SO4,KHSO5体系和直接使用H2O2。
为了防止酯解水解等副反应,Baeyer-Villiger反应可以在缓冲体系进行。
四:基团迁移顺序
1、首先需要满足Criegee四面体中间体的立体电子效应(在有刚性结构的化合物中比较常见),立体电子效应指的是i 迁移基团(中心碳原子指向迁移基团的连线)必须和过氧酸O-O键处于反向平行位置ii迁移基团必须和羟基上的孤对电子(羟基氧原子指向孤对电子的连线)处于反向平行位置。
2、在满足立体电子效应的前提下,富电子、大位阻基团优先迁移(但是位阻过大要当心过氧酸无法对羰基进攻),顺序一般是:叔烷基>环己基>仲烷基≈苄基>苯基>伯烷基>环戊基>环丙基>氢,其中基团α位连有氧、氮、硅等杂原子原子的基团变得容易迁移,富电子苯环更加容易迁移。
甚至β位有硅基和硒基取代的相邻α位碳原子也更加容易迁移。
卤素取代的基团变得不容易迁移。
五:区域选择性
1:羰基两侧都是伯烷基的非环酮不能被PBA和PPA氧化,要选用更强的氧化剂如TFPAA。
2:邻位取代苯基因为位阻过大一般不能迁移。
同理位阻过大的碳不能迁移。
3:1,2二羰基化合物进行Baeyer-Villiger反应通常可以得到酸酐,同时其水解产物或酯解产物可能成为主产物。
4:醛的Baeyer-Villiger氧化反应存在其氧化为酸的竞争,其主产物取决于迁移基团的活性和氧化剂。
比如季铵硫酸氢盐(比如CH3(n-C8H17)3NHSO4)存在下过氧化氢氧化醛为酸(是很清洁的氧化方法),苯甲酸可以被过氧酸氧化为甲酸苯酯。
六:竞争反应
1:非共轭不饱和醛、酮进行Baeyer-Villiger反应一般首先得到环氧化合物。
(有特殊情况)
2:缺电子烯烃可以不发生环氧化,位阻过大的双键同样不发生环氧化。
3:碱性过氧化氢不氧化双键,具有高度选择性。
(但是氧化能力不强要注意无法反应的问题)
4:强氧化能力过酸,强酸性条件有助于Baeyer-Villiger反应,惰性溶剂低温反应有助于环氧化
5:对于非环α-β不饱和醛、酮,一般优先得到环氧产物。
,对于单环α-β不饱和醛、酮存在下列三种情况:
①:双键在环内,羰基在环外
②:双键在环外,羰基在环内
③:双键和羰基都在环内
一般来说,第一种情况发生Baeyer-Villiger反应(有特殊情况),第二种情况发生环氧化几率高于第一种,但是环氧化反应同样很少。
第三种情况优先发生Baeyer-Villiger反应,随后可能进行环氧化反应,可能伴随一系列反应,反应复杂。
