荧光定量PCR之绝对定量分析——标准曲线的绘制.doc
荧光定量PCR之绝对定量分析——标准曲线的绘制
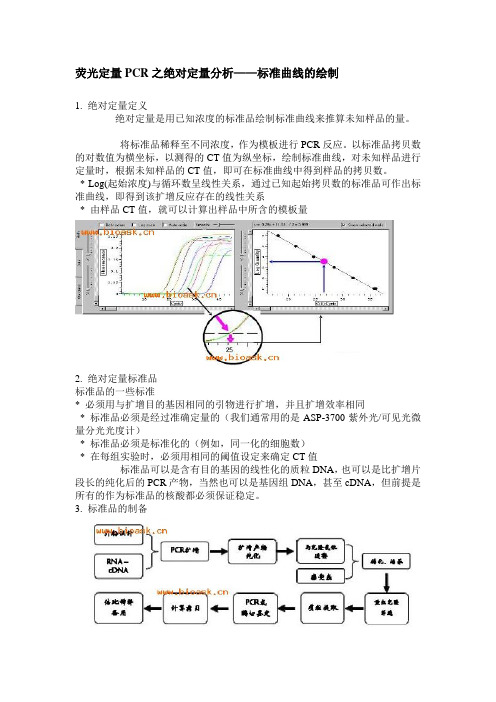
荧光定量PCR之绝对定量分析——标准曲线的绘制1. 绝对定量定义绝对定量是用已知浓度的标准品绘制标准曲线来推算未知样品的量。
将标准品稀释至不同浓度,作为模板进行PCR反应。
以标准品拷贝数的对数值为横坐标,以测得的CT值为纵坐标,绘制标准曲线,对未知样品进行定量时,根据未知样品的CT值,即可在标准曲线中得到样品的拷贝数。
* Log(起始浓度)与循环数呈线性关系,通过已知起始拷贝数的标准品可作出标准曲线,即得到该扩增反应存在的线性关系* 由样品CT值,就可以计算出样品中所含的模板量2. 绝对定量标准品标准品的一些标准* 必须用与扩增目的基因相同的引物进行扩增,并且扩增效率相同* 标准品必须是经过准确定量的(我们通常用的是ASP-3700紫外光/可见光微量分光光度计)* 标准品必须是标准化的(例如,同一化的细胞数)* 在每组实验时,必须用相同的阈值设定来确定CT值标准品可以是含有目的基因的线性化的质粒DNA,也可以是比扩增片段长的纯化后的PCR产物,当然也可以是基因组DNA,甚至cDNA,但前提是所有的作为标准品的核酸都必须保证稳定。
3. 标准品的制备一般一条标准曲线取四到五个点,浓度范围要能覆盖样品的浓度区间,以保证定量的准确性。
一般一个点重复三至五次,对于常期稳定使用的标准品可以适当减少重复的次数。
倍比梯度稀释方法:1v原液(标准品i)+9v稀释缓冲液,得标准品ii1v标准品ii+9v稀释缓冲液,得标准品iii1v标准品iii+9v稀释缓冲液,得标准品iv1v标准品iv+9v稀释缓冲液,得标准品v依次倍比稀释拷贝数的计算:详见核酸拷贝数的计算4. 实例标准品的制作:将标准品依次进行10倍稀释,ASP-3700 测得其拷贝数1.55×108copy /ul标准曲线的绘制(1cycle=1min)设置对照:浓度为1.55×107、1.55×106、1.55×105、1.55×104、1.55×103、1.55×102、1.55×101的标准样品各一个,设空白对照PCR反应:以不同浓度标准品作为模板标准品的扩增曲线标准品的溶解曲线标准品的标准曲线图扩增效率(E)计算:E=10-1/斜率=10-1/-3.23=2.04,E%=(2.04-1)×100%=104%若未知样本的CT值为19.11,将CT值代入线性方程:即19.11=34.29-3.23X,所以X=(19.11-34.29)/(-3.23)=4.7Quantityunknow=104.7=50118 copies核酸拷贝数的计算一、分步推理如何计算核酸拷贝数1A260吸光度值=dsDNA 50ug/ml=ssDNA 33ug/ml=ssRNA 40ug/ml核酸浓度=(OD260)×(dilution factor)×[33或40或50]=ng/ulMW代表克/摩尔,单位dolton:1dolton即表示1g/mol1摩尔=6.02x1023摩尔分子(拷贝数)平均分子量(MW):dsDNA=(碱基数)×(660道尔顿/碱基)ssDNA = (碱基数)×(330道尔顿/碱基) ssRNA=(碱基数)×(340道尔顿/碱基)得到拷贝数计算公式:(6.02x1023拷贝数/摩尔)×(浓度)/(MW g/mol)= copies/ml. 即(6.02x1023)×(g/ml)/(DNA length×660)=copies/ml.或(6.02×1023)×(ng/ul×10-9)/(DNA length×660)=copies/ul.例:3000碱基质粒,浓度100 ng/ulMW=3000bp×660dalton/bp=1.98×106daltons,即1mol=1.98×106g(100ng×10-9)g/1.98×106=摩尔数copy数=摩尔数×6.02×1023=3×1010copies/ul.二、这是一个小小的计算器,使你计算更加方便快捷,免去算数之苦……http://www.bioask.me/html/541.html什么是拷贝数?/html/540.html如何计算拷贝数?计算方法:(6.02×1023拷贝数/摩尔) ×(浓度g/ml) / (MW g/mol) = copies/ml[平均分子量(MW g/mol):dsDNA=(碱基数)×(660道尔顿/碱基);ssDNA=(碱基数)×(330道尔顿/碱基);ssRNA=(碱基数)×(340道尔顿/碱基)]。
荧光定量PCR标准曲线的建立

〈八〉试验十三、荧光定量PCR标准曲线的建立一、实验目的获得温度的的熔解曲线,绘制荧光定量PCR标准曲线。
二、实验材料1.451bp重组质粒2.仪器:BIO-RAD iCyeler iQ5型荧光定量PCR仪微量加样器德国Eppdorf公司三、实验步骤1.模板质粒DNA参考质粒抽提试剂盒提取451bp重组质粒,按10倍梯度稀释6个浓度备用。
2.运用特异性引物荧光定量检测样品特异性引物对CAPFW/ CAPRV1CAPFW: 5′-TTTAGTTGGGGGTCTTGTACC-3′(21bp)CAPRV1:5′-CCTCCACAACCAGCAACA-3′ (18bp)荧光定量PCR反应体系(50μL):25μl SYBR premx Ex Taq(2×);1μl CAPFW (10uM);1μl CAPRV1 (10uM);4μl DNA模板;O。
19 ul ddH2PCR扩增条件:95℃预变性2min;95℃变性30sec,56℃退火30sec,72℃延伸1 min和40个循环;72℃延伸5 min。
(在84°C检测目标扩增(熔融温度(Tm)= 86.5℃)的荧光。
)熔解曲线:65℃-95℃,在520 nm下每10 s升高0.5℃直至加热到95℃时连续测量荧光,获得温度的融解曲线。
绘制标准曲线:辣椒疫霉菌DNA按10倍梯度稀释6个浓度的对数为横坐标,以PCR反应的循环数(Ct)为纵坐标绘制标准曲线。
4.Bio-Rad iQ5软件绘制标准曲线,分析处理数据。
应用公式如下:待测样本浓度(ng/ul)=OD260×50×稀释倍数样本分子量=碱基数×324待测样本拷贝数= 待测样本浓度×6×104样本分子量付:Chelex-100法提取土壤中辣椒疫霉菌DNA 称取0.1g土样,放入EP管中液氮研磨;向收集土壤的1.5ml离心管中加入100ul 5% chelex-100悬浊液,混匀,65℃水浴2h;沸水浴10min;置于冰浴3min;12000r/min离心10分钟,取上清做PCR模板待用。
荧光定量标准曲线怎么做

荧光定量标准曲线怎么做
荧光定量标准曲线是一种常用的实验方法,用于测定待测物质的浓度。
下面将
详细介绍荧光定量标准曲线的制作方法,希望对您有所帮助。
首先,准备实验所需的材料和试剂。
包括待测物质的标准品、荧光素、缓冲液、溶剂等。
确保所有试剂的纯度和质量符合实验要求。
其次,按照一定的比例将标准品溶解于缓冲液中,制备不同浓度的标准溶液。
通常需要制备至少5个不同浓度的标准溶液,以构建标准曲线的线性范围。
接下来,将荧光素加入到标准溶液中,使其产生荧光信号。
注意控制荧光素的
加入量,避免过高或过低的信号强度影响后续的测定结果。
然后,使用荧光分光光度计或荧光显微镜等设备,测定各个标准溶液的荧光强度。
记录下不同浓度下的荧光信号数值。
接着,根据实验测得的荧光信号数值和标准溶液的浓度,绘制荧光定量标准曲线。
通常使用线性回归分析方法,拟合出标准曲线的方程式。
最后,利用标准曲线对待测物质进行浓度测定。
测量待测样品的荧光信号,根
据标准曲线的方程式,计算出待测物质的浓度。
需要注意的是,在进行荧光定量标准曲线实验时,应该严格控制实验条件,避
免外界因素对实验结果的影响。
同时,实验过程中要注意安全,避免接触有毒、易燃的试剂。
总之,荧光定量标准曲线的制作方法并不复杂,但需要严谨的实验操作和精确
的数据处理。
通过正确的实验操作和数据分析,可以得到准确可靠的浓度测定结果。
希望本文的介绍对您有所帮助,祝实验顺利!。
荧光定量pcr标准曲线分析

荧光定量pcr标准曲线分析荧光定量PCR(qPCR)是一种用于检测和定量DNA或RNA分子的技术,它利用荧光信号来监测PCR反应的进行。
在qPCR实验中,标准曲线分析是非常重要的一步,它可以帮助我们准确地定量目标分子的起始量。
本文将介绍荧光定量PCR标准曲线分析的步骤和注意事项。
首先,准备实验所需的材料和试剂,包括PCR试剂盒、引物、模板DNA或RNA、荧光定量PCR仪等。
接下来,按照试剂盒说明书中的操作步骤,将PCR反应体系配置好,包括PCR反应缓冲液、引物、模板DNA或RNA等。
注意在配置反应体系时,要严格控制每个试管中各组分的添加量,确保实验的准确性和可重复性。
然后,进行PCR反应,设置合适的PCR程序。
在PCR反应过程中,要注意监测荧光信号的变化,以确保PCR反应的进行。
完成PCR反应后,将反应体系中的产物进行电泳检测,验证PCR反应的特异性和产物大小。
接下来,进行标准曲线的构建。
首先,选取一系列已知浓度的标准样品,分别进行PCR反应,得到一系列标准曲线上的数据点。
然后,利用这些数据点,通过绘制标准曲线,可以得到PCR反应的效率和相关系数等参数。
在绘制标准曲线时,要注意选择合适的数据处理方法和拟合模型,确保标准曲线的准确性和可靠性。
最后,利用构建好的标准曲线,对待测样品进行荧光定量PCR分析。
根据待测样品的荧光信号,可以通过标准曲线,计算出目标分子的起始量。
在进行数据分析时,要注意排除干扰因素,确保数据的准确性和可靠性。
在进行荧光定量PCR标准曲线分析时,需要注意一些常见的问题和注意事项。
例如,在配置PCR反应体系时,要注意避免污染和交叉污染,确保实验的准确性;在构建标准曲线时,要选择合适的标准样品,并进行多次重复实验,以确保标准曲线的可靠性;在进行数据分析时,要注意排除异常数据,确保结果的可信度。
总之,荧光定量PCR标准曲线分析是一项非常重要的实验步骤,它可以帮助我们准确地定量目标分子的起始量。
荧光定量标准曲线制作

荧光定量标准曲线制作荧光定量标准曲线是一种用于测定未知样品中目标分子含量的方法,通过建立标准曲线,可以准确地确定未知样品中目标分子的浓度。
本文将介绍荧光定量标准曲线的制作步骤和注意事项。
1. 实验材料准备。
首先,准备实验所需的材料,包括标准品溶液、稀释液、荧光标记物等。
在选择标准品时,应该选择具有较高纯度和稳定性的化合物作为标准品。
同时,稀释液的选择也非常重要,应该选择与标准品相容的稀释液,以保证实验结果的准确性。
2. 样品制备。
将标准品按照一定的比例用稀释液稀释,制备出一系列不同浓度的标准溶液。
同时,也需要制备未知样品的溶液,确保样品的制备过程中要避免污染和损失。
3. 荧光测定。
将标准品溶液和未知样品溶液分别加入到测定皿中,使用荧光光度计进行测定。
在测定过程中,要注意避免气泡的产生,以免影响测定结果的准确性。
4. 建立标准曲线。
将测定得到的标准品溶液荧光强度值与其对应的浓度值进行绘图,得到标准曲线。
通常情况下,标准曲线应该是一条直线,如果出现曲线不理想的情况,可能需要重新制备标准品溶液或者调整荧光测定条件。
5. 浓度测定。
将未知样品的荧光强度值代入标准曲线中,根据标准曲线得到的拟合方程,计算出未知样品中目标分子的浓度。
注意事项:1. 在实验过程中,要严格控制实验条件,避免因为实验条件不同而导致测定结果的误差。
2. 实验中应该注意实验仪器的使用和维护,确保荧光光度计的准确性和稳定性。
3. 实验中的所有操作都应该按照标准操作程序进行,确保实验过程的可重复性和准确性。
4. 实验结束后,要对实验仪器和实验场地进行清洁和消毒,确保实验环境的整洁和安全。
总结:荧光定量标准曲线的制作是一项重要的实验技术,正确的制作标准曲线可以保证实验结果的准确性和可靠性。
在实验过程中,要严格控制实验条件,注意实验操作的规范性,确保实验结果的准确性和可重复性。
希望本文的介绍对于荧光定量标准曲线的制作有所帮助,让实验工作者能够更加准确地测定未知样品中目标分子的含量。
荧光定量PCR标准曲线的建立

〈八〉试验十三、荧光定量PCR标准曲线的建立一、实验目的获得温度的的熔解曲线,绘制荧光定量PCR标准曲线。
二、实验材料1.451bp重组质粒2.仪器:BIO-RAD iCyeler iQ5型荧光定量PCR仪微量加样器德国Eppdorf公司三、实验步骤1.模板质粒DNA参考质粒抽提试剂盒提取451bp重组质粒,按10倍梯度稀释6个浓度备用。
2.运用特异性引物荧光定量检测样品特异性引物对CAPFW/ CAPRV1CAPFW: 5′-TTTAGTTGGGGGTCTTGTACC-3′(21bp)CAPRV1:5′-CCTCCACAACCAGCAACA-3′ (18bp)荧光定量PCR反应体系(50μL):25μl SYBR premx Ex Taq(2×);1μl CAPFW (10uM);1μl CAPRV1 (10uM);4μl DNA模板;O。
19 ul ddH2PCR扩增条件:95℃预变性2min;95℃变性30sec,56℃退火30sec,72℃延伸1 min和40个循环;72℃延伸5 min。
(在84°C检测目标扩增(熔融温度(Tm)= 86.5℃)的荧光。
)熔解曲线:65℃-95℃,在520 nm下每10 s升高0.5℃直至加热到95℃时连续测量荧光,获得温度的融解曲线。
绘制标准曲线:辣椒疫霉菌DNA按10倍梯度稀释6个浓度的对数为横坐标,以PCR反应的循环数(Ct)为纵坐标绘制标准曲线。
4.Bio-Rad iQ5软件绘制标准曲线,分析处理数据。
应用公式如下:待测样本浓度(ng/ul)=OD260×50×稀释倍数样本分子量=碱基数×324待测样本拷贝数= 待测样本浓度×6×104样本分子量付:Chelex-100法提取土壤中辣椒疫霉菌DNA 称取0.1g土样,放入EP管中液氮研磨;向收集土壤的1.5ml离心管中加入100ul 5% chelex-100悬浊液,混匀,65℃水浴2h;沸水浴10min;置于冰浴3min;12000r/min离心10分钟,取上清做PCR模板待用。
荧光定量标准曲线

荧光定量标准曲线荧光定量标准曲线是一种用于测定荧光物质浓度的重要方法,它通过建立标准曲线来确定待测样品的浓度。
在实验室分析中,荧光定量标准曲线常常被用于测定各种生物分子的浓度,如蛋白质、核酸等。
本文将介绍荧光定量标准曲线的建立方法、应用范围及注意事项。
一、建立荧光定量标准曲线的方法。
1. 准备标准溶液,首先需要准备一系列已知浓度的标准溶液,浓度范围应该覆盖待测样品的浓度范围。
例如,对于蛋白质浓度的测定,可以准备一系列不同浓度的蛋白标准溶液。
2. 测定荧光强度,将标准溶液和待测样品分别置于荧光分析仪中,测定它们的荧光强度。
需要注意的是,测定时应选择适当的激发波长和发射波长,并确保仪器处于稳定状态。
3. 绘制标准曲线,将测得的荧光强度值与标准溶液的浓度对应起来,然后利用这些数据绘制标准曲线。
通常情况下,标准曲线可以通过线性回归或多项式拟合来得到。
二、荧光定量标准曲线的应用范围。
荧光定量标准曲线可以广泛应用于生物分子的浓度测定。
例如,在生物化学实验中,可以利用荧光定量标准曲线来测定蛋白质、核酸、小分子药物等的浓度。
此外,荧光定量标准曲线还可以用于药物分析、环境监测等领域。
三、注意事项。
在建立荧光定量标准曲线时,需要注意以下几点:1. 标准曲线的选择,应根据待测样品的特性选择合适的标准曲线类型,如线性、对数线性、多项式等。
2. 样品处理,待测样品的处理方法应与标准溶液一致,以保证测定结果的准确性。
3. 仪器校准,在进行荧光强度测定前,需要对荧光分析仪进行校准,确保测定结果准确可靠。
4. 实验环境,应在光线较暗的实验室环境中进行荧光强度测定,避免外部光线对测定结果的影响。
总结:荧光定量标准曲线是一种重要的定量分析方法,它在生物化学、药物分析等领域具有广泛的应用价值。
建立标准曲线的方法简单易行,但在实际操作中需要严格控制各项条件,以确保测定结果的准确性和可靠性。
希望本文对您有所帮助,谢谢阅读!。
荧光定量pcr标准曲线

荧光定量pcr标准曲线荧光定量PCR标准曲线。
荧光定量PCR(qPCR)是一种用于检测DNA或RNA的数量的方法,它能够快速、准确地定量目标序列的数量。
而荧光定量PCR标准曲线则是在进行实验前必须要构建的一项重要工作,它对于后续的定量分析具有至关重要的作用。
首先,构建荧光定量PCR标准曲线需要准备一系列已知浓度的标准品。
这些标准品可以是纯化的DNA或RNA片段,也可以是合成的基因序列。
在进行实验前,需要根据实际需要选择合适的标准品,并按照一定的浓度梯度进行稀释,以构建一条浓度递增的标准曲线。
接下来,将稀释后的标准品进行荧光定量PCR实验,并记录下每个浓度点对应的荧光信号强度。
在实验过程中,需要确保反应体系的稳定性和准确性,以保证实验结果的可靠性。
实验完成后,将荧光信号强度作为纵坐标,标准品的浓度作为横坐标,绘制出标准曲线。
标准曲线通常是一条经过原点的直线,其斜率和截距分别代表了PCR扩增效率和起始模板数量。
通过标准曲线,可以准确地计算出待测样本中目标序列的起始数量。
在实际操作中,构建荧光定量PCR标准曲线需要注意以下几点:1. 选择合适的标准品,确保其与待测样本中的目标序列具有相似的性质。
2. 精确稀释标准品,确保每个浓度点的浓度值准确无误。
3. 实验过程中要严格控制反应条件,确保每个浓度点的PCR反应都处于最佳状态。
4. 绘制标准曲线时,要选择合适的拟合方法,确保曲线的拟合度和可靠性。
总之,荧光定量PCR标准曲线是荧光定量PCR实验中至关重要的一环,它直接影响着后续定量分析的准确性和可靠性。
在进行实验前,需要充分准备和注意实验细节,确保构建出高质量的标准曲线,从而为后续的定量分析奠定可靠的基础。
荧光定量PCR之绝对定量分析

荧光定量PCR之绝对定量分析——标准曲线的绘制1.绝对定量定义绝对定量是用已知浓度的标准品绘制标准曲线来推算未知样品的量。
将标准品稀释至不同浓度,作为模板进行PCR反应。
以标准品拷贝数的对数值为横坐标,以测得的CT值为纵坐标,绘制标准曲线,对未知样品进行定量时,根据未知样品的CT值,即可在标准曲线中得到样品的拷贝数。
______________ _____ _♦ Log(起始浓度)与循环数呈线性关系,通过已知起始拷贝数的标准品可作出标准曲线,即得到该扩增反应存在的线性关系CT值,就可以计算出样品中所含的模板量♦由样品厂闻w I it 厂Of”他 *标准品的一些标准*必须用与扩增目的基因相同的引物进行扩增,并且扩增效率相同♦标准品必须是经过准确定量的(我们通常用的是ASP-3700紫外光/可见光微量分光光度计)*标准品必须是标准化的(例如,同一化的细胞数)*在每组实验时,必须用相同的阈值设定来确定CT值 _____标准品可以是含有目的基因的线性化的质粒DNA,也可以是比扩增片段长的纯化后的PCR产物,当然也可以是基因组DMA,甚至cDNA,但前提是所有的作为标准品的核酸都必须保证稳定。
3.标准品的制备RNA-cDNAPCR<一般一条标准曲线取四到五个点,浓度围要能覆盖样品的浓度区间,以保证定量的准确性。
一般一个点重复三至五次,对于常期稳定使用的标准品可以适当减少重复 的次数。
倍比梯度稀释方法:1V 原液(标准品i) +9v 稀释缓冲液,得标准品ii lv 标准品ii+9v 稀释缓冲液,得标准品iii lv 标准品iii+9v 稀释缓冲液,得标准品iv lv 标准品iv+9v 稀释缓冲液,得标准品v 依次倍比稀释拷贝数的计算:详见核酸拷贝数的计算4. ________________________________________________________________________ 实例 ________________________________________________________________________________ 标准品的制作:将标准品依次进行10倍稀释,ASP-3700测得其拷贝数1.55X 108copy /ul 标准曲线的绘制(lcycle=lmin)设置对照:浓度为 1.55X107, 1.55X106、1.55X105, 1.55X104、1.55X103, 1.55X 102. 1.55X101的标准样品各一个,设空白对照PCR 反应:以不同浓度标准品作为模板标准品的扩增曲线半学半 g 购hi 上fola&kLdn 丄胡叶.型 _LLii?并吃 I 025SD0 4IK4 D.2Q51F oo )wo- MSI”?.8 门&&2 0592D1 WWb♦ ・bioask +cn+山5"叽6), J-n-sspdocs)' —HFi —-HrH空白対腮训3叽cnB 1512 i<1« 2D 22 Z< 2623 JD 12 洌 3(- J8 -It 农仏僱伦 W %54 M 5B W<yii»标准品的溶解曲线n>o o o o*J.1 t 9 |L 广 制.T_ 1玉 75£s £s s £7.寰57養45.S 92M .S SM SJ a J 201.S Zo.nBRD ・i583s君a £22s£s須34.293.23 代5 M S I593650O b -・6 2・8s 5・2 6」7・6 ogunma- copyrulmbera^rw勢盖扩增效率(E)计算E二10-1/斜率=10-1/-3. 23-2. 04, E%= (2. 04-1) X100%= 104%若未知样本的CT值为19.11,将CT值代入线性方程: 即19. 11=34.29-3. 23X,所以X=(19. 11-34. 29)/(-3. 23)-4. 7 Quantityunknow-104. 7-50118 copies。
荧光定量pcr 标准曲线

荧光定量pcr 标准曲线荧光定量PCR(qPCR)是一种用于快速、准确测量DNA或RNA样本中特定序列数量的技术。
通过构建标准曲线,可以实现对样本中目标序列的定量分析。
本文将介绍荧光定量PCR标准曲线的构建方法及相关注意事项。
首先,准备实验所需的试剂和设备,包括PCR试剂盒、引物、探针、DNA模板、荧光定量PCR仪等。
接下来,设计引物和探针,确保其特异性和高效性。
引物和探针的设计是构建标准曲线的关键步骤之一,需要根据目标序列的特点进行精心设计。
然后,准备一系列不同浓度的模板DNA溶液,通常建议从较高浓度到较低浓度依次稀释。
每个浓度的模板DNA溶液都需要进行多次重复实验,以确保结果的准确性。
在PCR反应中,需要同时设置一系列标准曲线样品和待测样品,以便后续对待测样品的定量分析。
接下来,进行PCR扩增反应,并利用荧光定量PCR仪测量每个样品的荧光强度。
根据标准曲线样品的PCR扩增结果和荧光强度,可以绘制标准曲线。
标准曲线通常是以对数形式绘制的,横坐标为模板DNA的对数浓度,纵坐标为荧光信号的对数值。
在绘制标准曲线时,需要注意以下几点,首先,标准曲线的斜率和相关系数是衡量曲线质量的重要指标,通常要求斜率接近-3.3,相关系数大于0.99。
其次,标准曲线的线性范围需要覆盖待测样品的浓度范围,以确保定量结果的准确性。
最后,标准曲线样品的PCR扩增效率应该接近100%,否则会影响定量结果的准确性。
在实际应用中,构建好的标准曲线可以用于对待测样品进行定量分析。
通过荧光定量PCR仪测量待测样品的荧光强度,并利用标准曲线进行定量计算,可以得到待测样品中目标序列的数量。
需要注意的是,待测样品的PCR扩增效率和荧光信号强度需要与标准曲线样品进行比较,以确保定量结果的准确性。
总之,荧光定量PCR标准曲线的构建是该技术的关键步骤之一,合理设计引物和探针、准备标准曲线样品、绘制标准曲线并进行质控是非常重要的。
只有严格按照标准操作流程进行,才能确保荧光定量PCR技术的准确性和可靠性。
荧光定量pcr标准曲线

荧光定量pcr标准曲线荧光定量PCR(Polymerase Chain Reaction)是一种用于检测DNA浓度的常用技术,它可以通过测量PCR产物的荧光强度来定量DNA的含量。
而荧光定量PCR标准曲线则是在进行荧光定量PCR实验时必不可少的一个步骤,它可以帮助我们准确地计算出待测样品中的目标DNA含量。
本文将介绍荧光定量PCR标准曲线的构建方法及其在实验中的应用。
首先,我们需要准备一系列已知浓度的DNA标准溶液,通常会选择一定浓度的DNA模板,然后通过连续稀释的方法制备一系列浓度递减的标准溶液。
接下来,我们需要设计一对特异性引物,这对引物将会与我们待测样品中的目标DNA序列特异性结合。
在进行PCR反应时,这对引物将会扩增出一条特定长度的DNA片段。
我们可以选择一个荧光染料,使其与PCR产物结合,产生荧光信号。
在进行PCR反应后,我们需要将每个标准溶液和待测样品分别进行荧光定量PCR实验,得到一系列荧光信号强度值。
然后,我们将这些荧光信号强度值与对应的DNA标准溶液浓度进行关联,构建出一条荧光定量PCR标准曲线。
通常情况下,我们会选择对数坐标系来绘制标准曲线,因为在对数坐标系下,PCR产物的浓度与荧光信号强度之间呈现出线性关系。
一旦我们构建好了荧光定量PCR标准曲线,我们就可以将待测样品的荧光信号强度值代入标准曲线中,通过插值的方法计算出待测样品中目标DNA的浓度。
这样,我们就可以准确地定量待测样品中的目标DNA含量了。
需要注意的是,为了保证实验结果的准确性,我们应该在每次实验中都要重复构建标准曲线,并且选择合适的PCR条件和荧光定量PCR仪器来进行实验。
在实际应用中,荧光定量PCR标准曲线可以广泛应用于基因表达分析、病原微生物检测、基因定量分析等领域。
通过准确地测量DNA含量,我们可以更好地了解生物学过程的发生和发展,为科研工作和临床诊断提供有力的支持。
总之,荧光定量PCR标准曲线是荧光定量PCR实验中的重要步骤,它可以帮助我们准确地定量待测样品中的目标DNA含量。
荧光定量pcr标准曲线

荧光定量pcr标准曲线荧光定量PCR(Polymerase Chain Reaction)是一种用于定量检测DNA的技术,它利用DNA聚合酶在PCR过程中不断合成DNA来实现对目标DNA的定量检测。
而荧光定量PCR标准曲线则是该技术中非常重要的一部分,它可以用来确定目标DNA的数量,为实验结果的准确性提供保障。
在进行荧光定量PCR实验时,通常需要构建一条标准曲线来确定目标DNA的数量。
构建标准曲线的关键是准备一系列已知浓度的标准样品,然后利用这些标准样品进行PCR扩增,并测定其荧光信号强度。
通过测定不同浓度标准样品的荧光信号强度,可以得到一系列荧光信号强度与目标DNA浓度的对应关系,从而构建出标准曲线。
构建标准曲线的第一步是准备标准样品。
通常可以选择从已知数量的目标DNA中提取一定量的DNA,然后依次稀释得到一系列不同浓度的标准样品。
在制备标准样品的过程中,需要注意保证每个标准样品的浓度准确,并且避免污染和损失。
接下来是进行PCR扩增和测定荧光信号强度。
在PCR扩增过程中,需要使用特定的引物和荧光探针来选择性地扩增目标DNA,并产生荧光信号。
扩增反应结束后,利用荧光定量PCR仪器测定每个标准样品的荧光信号强度,通常会得到一系列荧光信号值。
得到荧光信号值后,需要将其与标准样品的已知浓度进行对应,然后绘制标准曲线。
通常可以使用线性回归分析来拟合标准曲线,从而得到荧光信号强度与目标DNA浓度的关系方程。
标准曲线的斜率、截距和相关系数等参数可以反映出PCR扩增的效率和准确性。
最后,利用构建好的标准曲线,可以通过测定待测样品的荧光信号强度,然后通过标准曲线的方程计算出待测样品中目标DNA的浓度。
这样就可以实现对目标DNA的定量检测,为后续的实验数据分析提供可靠的依据。
总的来说,荧光定量PCR标准曲线的构建是荧光定量PCR技术中至关重要的一步,它直接关系到实验结果的准确性和可靠性。
因此,在进行荧光定量PCR实验时,务必要认真、准确地构建标准曲线,以确保实验结果的准确性和可靠性。
荧光定量PCR之绝对定量分析——标准曲线的绘制
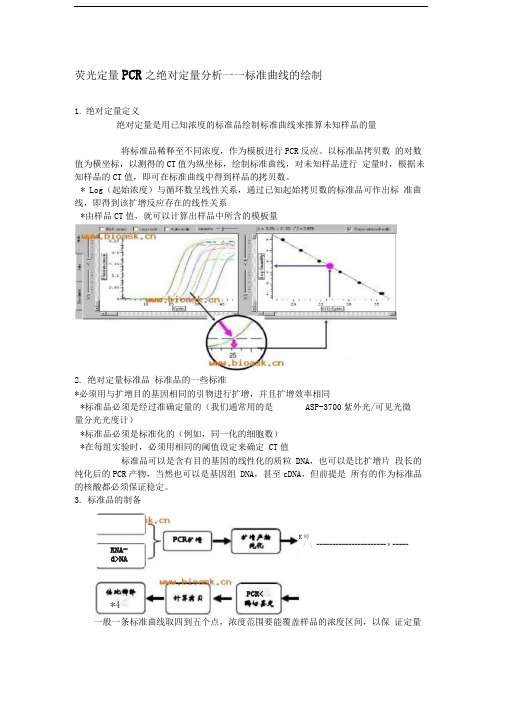
K 哼 / \ ---------------------- * -----荧光定量PCR 之绝对定量分析一一标准曲线的绘制1. 绝对定量定义绝对定量是用已知浓度的标准品绘制标准曲线来推算未知样品的量将标准品稀释至不同浓度,作为模板进行PCR 反应。
以标准品拷贝数 的对数值为横坐标,以测得的CT 值为纵坐标,绘制标准曲线,对未知样品进行 定量时,根据未知样品的CT 值,即可在标准曲线中得到样品的拷贝数。
* Log (起始浓度)与循环数呈线性关系,通过已知起始拷贝数的标准品可作出标 准曲线,即得到该扩增反应存在的线性关系*由样品CT 值,就可以计算出样品中所含的模板量2. 绝对定量标准品 标准品的一些标准*必须用与扩增目的基因相同的引物进行扩增,并且扩增效率相同*标准品必须是经过准确定量的(我们通常用的是 ASP-3700紫外光/可见光微 量分光光度计)*标准品必须是标准化的(例如,同一化的细胞数)*在每组实验时,必须用相同的阈值设定来确定 CT 值标准品可以是含有目的基因的线性化的质粒 DNA ,也可以是比扩增片 段长的纯化后的PCR 产物,当然也可以是基因组 DNA ,甚至cDNA ,但前提是 所有的作为标准品的核酸都必须保证稳定。
3. 标准品的制备一般一条标准曲线取四到五个点,浓度范围要能覆盖样品的浓度区间,以保证定量RNA-d>NA PCR<*4的准确性。
一般一个点重复三至五次,对于常期稳定使用的标准品可以适当减少重复的次数。
倍比梯度稀释方法:1v原液(标准品i) +9v稀释缓冲液,得标准品ii1v标准品ii+9v稀释缓冲液,得标准品iii1v标准品iii+9v稀释缓冲液,得标准品iv1v标准品iv+9v稀释缓冲液,得标准品v 依次倍比稀释拷贝数的计算:详见核酸拷贝数的计算4.实例标准品的制作:将标准品依次进行10倍稀释,ASP-3700测得其拷贝数1.55X 810 copy /ul标准曲线的绘制(1cycle=1mi n)设置对照:浓度为 1.55X 107、1.55X 106、1.55X 105、1.55X 104、1.55X 103、1.55X 102、1.55X 101的标准样品各一个,设空白对照PCR反应:以不同浓度标准品作为模板标准品的扩增曲线标准品的标准曲线图XLog 7 6 5 4 3 2 1 Y CT 值「 12.01 14.89 17.92 21.18 「24.56 27.89 31.25 亠U-UO*EA POU31U标准品的溶解曲线5-34.29-3 23x S r 0.2l533fi50r r th 彌颐轴,.<扩增效率(E)计算:E=10-1/斜率=10-1/-3.23=2.04, E%=(2.04-1)X 100%=104%若未知样本的CT值为19.11,将CT值代入线性方程:即 19.11=34.29-3.23X,所以 X=(19.11-34.29)/(-3.23)=4.74 7Qua ntity unkno w=10 =50118 copies核酸拷贝数的计算一、分步推理如何计算核酸拷贝数1A260 吸光度值=dsDNA 50ug/ml=ssDNA 33ug/ml=ssRNA 40ug/ml核酸浓度=(OD260)x (dilution factor)x [33 或 40 或 50]=ng/ulMW 代表克/摩尔,单位dolton: 1dolton即表示1g/mol1摩尔=6.02x1023摩尔分子(拷贝数)平均分子量(MW) : dsDNA=(碱基数)x (660道尔顿/碱基)ssDNA = (碱基数)x (330 道尔顿/碱基)ssRNA=(碱基数)x (340道尔顿/碱基)得到拷贝数计算公式:(6.02x1023拷贝数/摩尔)x (浓度)/(MW g/mol)= copies/ml. 即(6.02X102)x (g/ml)/(DNA length x 660)=copies/ml.或(6.02x 1023)x (ng/ul x 10-9)/(DNA length x 660)=copies/ul.例:3000碱基质粒,浓度100 ng/ulMW=3000bp x 660dalton/bp=1.98x 10 daltons,即 1mol=1.98 x 10 g(100 ng x 10-9)g/1.98x 106 =摩尔数copy数=摩尔数x 6.02x 1023 = 3x 1010copies/ul.二、这是一个小小的计算器,使你计算更加方便快捷,免去算数之苦……http://www.bioask.me/html/541.html什么是拷贝数?www.bioask.c n/html/540.html如何计算拷贝数?计算方法:(6.02x 1023拷贝数 /摩尔)x (浓度 g/ml) / (MW g/mol) = copies/ml[平均分子量(MW g/mol): dsDNA=(碱基数)x (660道尔顿/碱基);ssDNA=(碱基数)x (330道尔顿/碱基);ssRNA=(碱基数)x (340道尔顿/碱基)]。
绝对定量标准曲线的构建

绝对定量标准曲线的构建
绝对定量标准曲线的构建是用于精确测定物质浓度的方法。
以下是构建绝对定量标准曲线的步骤:
1. 准备标准溶液:首先制备一系列已知浓度的标准溶液。
这些标准溶液应该涵盖要测定物质的整个浓度范围。
2. 实验测定:使用适当的技术或仪器,测定每个标准溶液的信号强度。
信号强度可以是吸光度、荧光强度、电信号等,具体取决于所使用的测量方法。
3. 绘制曲线:将每个标准溶液的浓度与其相应的信号强度绘制在坐标系中。
通常使用线性坐标,其中浓度作为独立变量,信号强度作为因变量。
4. 拟合曲线:根据实验数据确定最佳的曲线形式。
常见的拟合方法包括线性回归、多项式回归、指数回归等。
选择最佳拟合函数可以通过统计指标(如R平方值、残差分析)来评估。
5. 验证和优化:使用一些未知浓度的样品进行验证。
在标准曲线上的信号强度可以通过插值计算出该样品的浓度。
验证结果应与实际浓度相符合。
如果不符合,可以对标准曲线进行调整和优化。
绝对定量标准曲线的构建可以为实验室提供高精度和准确性的测量结果。
但需要注意的是,构建标准曲线的每一步骤都要精确控制,以确保曲线的可信度和可靠性。
荧光定量标准曲线

荧光定量标准曲线荧光定量标准曲线是一种常用的实验方法,用于确定待测物质的浓度。
通过建立标准曲线,可以将荧光强度与物质浓度之间的关系进行定量分析,从而得到待测物质的浓度。
本文将介绍荧光定量标准曲线的建立方法及相关实验操作。
首先,准备工作。
在进行荧光定量标准曲线实验之前,需要准备好实验所需的试剂和仪器设备。
首先,准备待测物质的标准溶液,根据实验需要选择合适的浓度范围。
其次,准备好荧光分析仪器,确保仪器的正常运行。
最后,准备好实验所需的其他试剂和实验器材。
其次,建立标准曲线。
首先,取一系列不同浓度的标准溶液,分别进行荧光测定,得到它们对应的荧光强度数值。
然后,将这些荧光强度数值与标准溶液的浓度进行配对,得到一组荧光强度与浓度的数据点。
接着,利用这些数据点进行曲线拟合,得到荧光定量标准曲线的方程。
最后,通过标准曲线的方程,可以根据待测物质的荧光强度,反推出其浓度。
接下来,实验操作。
首先,将待测物质的样品溶液放入荧光分析仪器中,进行荧光测定,得到其荧光强度数值。
然后,利用荧光定量标准曲线的方程,将待测物质的荧光强度数值代入方程,计算出其浓度。
最后,根据实验需要,可以进行进一步的数据处理和分析。
最后,实验结果与分析。
通过荧光定量标准曲线的建立和实验操作,可以得到待测物质的浓度。
根据实验结果,可以进行进一步的数据分析和比较,从而得出结论。
同时,还可以对实验过程中出现的问题进行讨论和分析,总结经验教训,为今后的实验工作提供参考。
总之,荧光定量标准曲线是一种重要的实验方法,可以用于确定待测物质的浓度。
通过建立标准曲线、实验操作和数据分析,可以得到准确的实验结果,并为相关研究工作提供支持。
希望本文介绍的内容能够对您有所帮助,谢谢阅读!。
荧光定量PCR技术5(“曲线”相关文档)共8张

确定最佳阈值
❖ 标准曲线法
❖பைடு நூலகம்斜率的绝对值接近 ❖ R2接近1 ❖ 较好的区分样品
❖ 重复
❖ 平行样的Ct值之间的差
确定最佳阈值 确定最佳阈值 确定最佳阈值 确定最佳阈值 确定最佳阈值 平行样的Ct值之间的差 确定最佳阈值 确定最佳阈值 确定最佳阈值 确定最佳阈值
确定最佳阈值 确定最佳阈值 确定最佳阈值 确定最佳阈值 确定最佳阈值 确定最佳阈值 确定最佳阈值 确定最佳阈值 确定最佳阈值 确定最佳阈值 确定最佳阈值 确定最佳阈值 确定最佳阈值 确定最佳阈值 确定最佳阈值 确定最佳阈值
荧光定量pcr标准曲线

荧光定量pcr标准曲线荧光定量PCR(qPCR)是一种用于测定DNA或RNA含量的高灵敏度技术,广泛应用于基因表达分析、病原体检测、基因型鉴定等领域。
在进行荧光定量PCR实验时,构建标准曲线是非常重要的一步,它可以帮助我们准确测定待测样本中的目标基因含量。
本文将介绍荧光定量PCR标准曲线的构建方法及相关注意事项。
1. 标准曲线构建方法。
在构建荧光定量PCR标准曲线时,首先需要选择适当的内参基因或外源标准品作为模板,通过稀释系列浓度来构建标准曲线。
在进行PCR扩增反应后,利用荧光定量PCR仪器检测不同模板浓度对应的荧光信号强度,并绘制荧光强度与模板浓度的标准曲线图。
通常情况下,我们会选择5-6个不同浓度的模板进行扩增,以确保标准曲线的可靠性和稳定性。
2. 注意事项。
在构建荧光定量PCR标准曲线时,需要注意以下几点:(1)选择合适的内参基因或外源标准品,确保其在待测样本中不受到影响,并且具有稳定的表达水平。
(2)稀释系列浓度要合理,通常建议选择1:10的倍数进行稀释,以确保标准曲线的线性范围覆盖待测样本的目标浓度范围。
(3)在进行PCR扩增反应时,需要严格控制反应条件,确保不同浓度模板的扩增效率一致,避免扩增偏差对标准曲线的影响。
(4)在检测荧光信号强度时,要选择合适的荧光通道,确保能够准确检测到目标信号,避免干扰信号对结果的影响。
(5)绘制标准曲线图时,要选择合适的曲线拟合模型,确保曲线拟合的稳定性和准确性。
3. 应用示例。
以某基因的荧光定量PCR标准曲线构建为例,我们选择了内参基因作为模板,通过稀释系列浓度,得到了不同浓度模板对应的荧光信号强度。
通过绘制标准曲线图,我们发现在一定浓度范围内,荧光信号强度与模板浓度呈现出良好的线性关系,R²值达到0.99,表明标准曲线的拟合效果良好。
在实际应用中,我们可以利用该标准曲线对待测样本进行定量检测,准确测定目标基因的含量。
4. 结语。
荧光定量PCR标准曲线的构建是荧光定量PCR实验中的关键步骤,正确的构建方法和严格的操作流程可以保证标准曲线的准确性和稳定性,为后续实验结果的可靠性提供保障。
定量pcr标准曲线

定量pcr标准曲线定量PCR标准曲线。
定量PCR(Quantitative PCR,qPCR)是一种用于测定DNA或RNA在样本中的相对数量的技术。
在定量PCR实验中,标准曲线是非常重要的,它可以帮助我们准确地测定目标分子的数量。
本文将介绍定量PCR标准曲线的构建方法和应用技巧。
1. 标准曲线的构建。
在构建定量PCR标准曲线时,首先需要准备一系列已知浓度的标准溶液。
这些标准溶液中包含了目标分子的不同浓度,通常是10倍稀释的序列。
接下来,我们将这些标准溶液进行定量PCR实验,得到相应的Ct值(threshold cycle)。
Ct值是指在PCR反应中,荧光信号首次超过背景信号的周期数,它与起始模板的数量成反比。
通过绘制标准曲线,将Ct值作为横坐标,目标分子的对数浓度作为纵坐标,我们可以得到一条斜率和截距都已知的直线,这就是标准曲线。
2. 标准曲线的应用。
有了标准曲线,我们就可以利用它来测定未知样本中目标分子的数量。
首先,我们需要对未知样本进行定量PCR实验,得到相应的Ct值。
然后,将这个Ct值代入标准曲线方程中,就可以计算出目标分子在未知样本中的数量。
需要注意的是,为了准确测定目标分子的数量,我们通常会在同一实验中测定内参基因的数量,用来对样本之间的差异进行校正。
3. 注意事项。
在构建和应用标准曲线时,有一些注意事项需要我们特别关注。
首先,标准曲线的斜率和截距应该在一定范围内,通常来说,斜率的绝对值应该在-3.6至-3.1之间,截距应该在10至40之间。
其次,标准曲线的相关系数(R2)应该接近1,这表示标准曲线的拟合度很好。
最后,为了减小实验误差,我们通常会重复测定标准曲线上的点,然后取平均值作为最终结果。
4. 结语。
定量PCR标准曲线是定量PCR实验中的重要工具,它可以帮助我们准确地测定目标分子的数量。
通过本文的介绍,相信大家已经对定量PCR标准曲线的构建方法和应用技巧有了更深入的了解。
在实际操作中,我们需要严格按照标准曲线的构建方法进行实验,并注意标准曲线的斜率、截距和相关系数,以确保实验结果的准确性和可靠性。
荧光定量pcr标准曲线

荧光定量pcr标准曲线荧光定量PCR(Polymerase Chain Reaction)是一种常用的分子生物学技术,用于检测DNA或RNA的数量。
荧光定量PCR标准曲线是用于确定未知样品中目标序列的浓度的一种方法。
下面是荧光定量PCR标准曲线的详细步骤:1. 准备样品和试剂将需要检测的DNA或RNA样品制备好,并配制好PCR反应体系所需的试剂,如引物、TaqMan探针、dNTPs、Taq聚合酶等。
2. 制备标准曲线选取一段已知浓度的DNA或RNA作为模板,通过逐步稀释来制备一系列不同浓度的模板溶液。
通常可以选择10倍或2倍稀释,最后得到5-6个不同浓度的模板溶液。
3. 进行PCR扩增将每个模板溶液和待检测样品分别加入PCR反应管中,进行PCR扩增。
反应条件可以根据实验需要进行优化,一般包括初始变性、循环扩增和终止延伸等步骤。
4. 检测荧光信号在PCR扩增过程中,引物和探针会与目标序列结合,产生荧光信号。
使用荧光定量PCR仪器检测PCR反应体系中的荧光信号,并记录下每个样品的荧光值。
5. 绘制标准曲线将每个模板溶液的荧光值与其对应的浓度进行配对,绘制出标准曲线。
通常使用对数坐标轴来绘制,将荧光值作为y轴,模板浓度作为x轴。
通过拟合曲线方程可以计算出未知样品中目标序列的浓度。
6. 分析结果根据标准曲线计算出未知样品中目标序列的浓度,并进行数据分析和统计处理。
需要注意的是,在进行PCR反应和数据分析时,应遵循良好实验室规范和质量控制要求,确保实验结果的可靠性和准确性。
总之,荧光定量PCR标准曲线是一种常用的分子生物学技术,在基础研究、临床诊断、环境监测等领域都有广泛应用。
通过合理选择模板、优化反应条件、精确绘制标准曲线等步骤,可以获得高质量、可靠的实验结果。
荧光pcr标准曲线操作流程

荧光pcr标准曲线操作流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!荧光 PCR 标准曲线操作流程如下:1. 标准品制备:选择合适的标准品,如已知浓度的 DNA 或 RNA 片段。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
荧光定量PCR之绝对定量分析——标准曲线的绘制
1. 绝对定量定义
绝对定量是用已知浓度的标准品绘制标准曲线来推算未知样品的量。
将标准品稀释至不同浓度,作为模板进行PCR反应。
以标准品拷贝数的对数值为横坐标,以测得的CT值为纵坐标,绘制标准曲线,对未知样品进行定量时,根据未知样品的CT值,即可在标准曲线中得到样品的拷贝数。
* Log(起始浓度)与循环数呈线性关系,通过已知起始拷贝数的标准品可作出标准曲线,即得到该扩增反应存在的线性关系
* 由样品CT值,就可以计算出样品中所含的模板量
2. 绝对定量标准品
标准品的一些标准
* 必须用与扩增目的基因相同的引物进行扩增,并且扩增效率相同
* 标准品必须是经过准确定量的(我们通常用的是ASP-3700紫外光/可见光微量分光光度计)
* 标准品必须是标准化的(例如,同一化的细胞数)
* 在每组实验时,必须用相同的阈值设定来确定CT值
标准品可以是含有目的基因的线性化的质粒DNA,也可以是比扩增片段长的纯化后的PCR产物,当然也可以是基因组DNA,甚至cDNA,但前提是所有的作为标准品的核酸都必须保证稳定。
3. 标准品的制备
一般一条标准曲线取四到五个点,浓度范围要能覆盖样品的浓度区间,以保证定量的准确性。
一般一个点重复三至五次,对于常期稳定使用的标准品可以适当减少重复的次数。
倍比梯度稀释方法:
1v原液(标准品i)+9v稀释缓冲液,得标准品ii
1v标准品ii+9v稀释缓冲液,得标准品iii
1v标准品iii+9v稀释缓冲液,得标准品iv
1v标准品iv+9v稀释缓冲液,得标准品v
依次倍比稀释
拷贝数的计算:详见核酸拷贝数的计算
4. 实例
标准品的制作:将标准品依次进行10倍稀释,ASP-3700 测得其拷贝数1.55×108copy /ul
标准曲线的绘制(1cycle=1min)
设置对照:浓度为1.55×107、1.55×106、1.55×105、1.55×104、1.55×103、1.55×102、1.55×101的标准样品各一个,设空白对照
PCR反应:以不同浓度标准品作为模板
标准品的扩增曲线
标准品的溶解曲线
标准品的标准曲线图
X Log 7 6 5 4 3 2 1
Y CT值12.01 14.89 17.92 21.18 24.56 27.89 31.25
扩增效率(E)计算:
E=10-1/斜率=10-1/-3.23=2.04,E%=(2.04-1)×100%=104%
若未知样本的CT值为19.11,将CT值代入线性方程:
即19.11=34.29-3.23X,所以X=(19.11-34.29)/(-3.23)=4.7
Quantityunknow=104.7=50118 copies
核酸拷贝数的计算
一、分步推理如何计算核酸拷贝数
1A260吸光度值=dsDNA 50ug/ml=ssDNA 33ug/ml=ssRNA 40ug/ml
核酸浓度=(OD260)×(dilution factor)×[33或40或50]=ng/ul
MW代表克/摩尔,单位dolton:1dolton即表示1g/mol
1摩尔=6.02x1023摩尔分子(拷贝数)
平均分子量(MW):dsDNA=(碱基数)×(660道尔顿/碱基)
ssDNA = (碱基数)×(330道尔顿/碱基) ssRNA=(碱基数)×(340道尔顿/碱基)
得到拷贝数计算公式:(6.02x1023拷贝数/摩尔)×(浓度)/(MW g/mol)= copies/ml. 即(6.02x1023)×(g/ml)/(DNA length×660)=copies/ml.
或(6.02×1023)×(ng/ul×10-9)/(DNA length×660)=copies/ul.
例:3000碱基质粒,浓度100 ng/ul
MW=3000bp×660dalton/bp=1.98×106daltons,即1mol=1.98×106g
(100ng×10-9)g/1.98×106=摩尔数
copy数=摩尔数×6.02×1023=3×1010copies/ul.
二、这是一个小小的计算器,使你计算更加方便快捷,免去算数之苦……http://www.bioask.me/html/541.html
什么是拷贝数?/html/540.html
如何计算拷贝数?
计算方法:(6.02×1023拷贝数/摩尔) ×(浓度g/ml) / (MW g/mol) = copies/ml
[平均分子量(MW g/mol):dsDNA=(碱基数)×(660道尔顿/碱基);ssDNA=(碱基数)×(330道尔顿/碱基);ssRNA=(碱基数)×(340道尔顿/碱基)]
精品资料。
