T细胞性淋巴瘤诊断中TCR基因重排检测的应用
t细胞淋巴瘤tcrγ基因重排特征的分析及检测方法优化

T细胞淋巴瘤TCRT基N重排特征分析及检测方法的优化摘要研究背景与目的淋巴瘤在组织和细胞形态学方面与高度反应增生性淋巴组织的鉴别诊断十分困难,容易造成误诊。
淋巴瘤病理诊断是临床病理工作的难题之一。
目前国内主要依靠以形态学为主、免疫组化为辅的诊断手段。
随着分子生物学的发展,从基因水平研究和分析诊断疾病的技术不断出现并且日趋成熟,为淋巴瘤诊断提供了有效工具。
淋巴瘤是由单克隆淋巴细胞增生所致,而反应增生性淋巴组织则来自于多克隆淋巴细胞,这是二者的重要区别。
编码免疫球蛋白(Ig)或T细胞受体(TCR)的基因经过重排以后,不同克隆之间的重排基因互不相同,因此,基因重排对淋巴瘤的诊断具有特异性价值。
以PCR技术为基础的方法以其简便、高效、廉价及适用面广而在淋巴瘤基因重排研究方面越来越受重视。
但不同研究文献中所采用的引物、PCR条件、PCR产物检测方法等都不尽相同,结果也有差异。
因此,难以找到适于常规临床病理诊断之用的标准程序。
Jurkat细胞是T细胞淋巴瘤基因重排研究中常用的阳性对照细胞,但有关Jurkat细胞基因重排的详细情况也未见报道。
假基因是Ig和TCR胚系DNA中常见的基因,有关假基因参与重排的情况以及在设计引物方面是否应将假基因包括在内也未见有关研究报道。
本实验以TCR基因重排为研究对象,通过优化引物选择、PCR条件及PCR产物的检测方法等,分析T细胞淋巴瘤基因重排检测的最佳方法。
同时,分析TCR基因重排的特点,为进一步研究TCR基因重排提供理论和技术支持。
方法1以TCRy基因重排为研究对象,选用通用引物TVG、VvI及TCR7家族特异性引物为工具。
用正交设计实验优化ⅥI引物的PCR条件。
另选一对TCR[j通用引物作为TCRy引物的补充和比较。
2利用PCR和测序研究Jurkat细胞基因重排情况,分析TCR基因重排的基本特点。
3PCR产物检测方法①利用TCR通用引物检测淋巴瘤克隆性基因重排阳性率,分别用琼脂糖电泳和SSCP分析PCR产物;②将PCR产物分别进行直接测序和克隆后测序,分析TCR基因重排的特点及探索测序方法在基因重排检测中的应用;⑧分析PCR产物中DNA的克隆数与SSCP中条带数目的关系。
TCR基因重排检测在T细胞淋巴瘤病理诊断中的作用

TCR Gene Rearrangement in the Pathologic Diagnosisof T-cell LymphomaDissertation Submitted toNorth China University of Science and Technology in partial fulfillment of the requirementfor the degree ofMaster of MedicinebyJia Wen(Pathology and Pathophysiology)Supervisor:Ph.D Ma XiaobingJune,2015独创性说明本人郑重声明:所呈交的论文是我个人在导师指导下进行的研究工作及取得的研究成果。
尽我所知,除了文中特别加以标注和致谢的地方外,论文中不包含其他人已经发表或撰写的研究成果,也不包含为获得华北理工大学以外其他教育机构的学位或证书所使用过的材料。
与我一同工作的同志对本研究所做的任何贡献均已在论文中做了明确的说明并表示了谢意。
论文作者签名:日期:2015年6月10日关于论文使用授权的说明本人完全了解华北理工大学有关保留、使用学位论文的规定,即:已获学位的研究生必须按学校规定提交学位论文,学校有权保留、送交论文的复印件,允许论文被查阅和借阅;学校可以将学位论文的全部或部分内容采用影印、缩印或编入有关数据库进行公开、检索和交流。
作者及导师同意论文公开及网上交流的时间:□自授予学位之日起;□自年月日起。
作者签名:导师签名:签字日期:2015年6月10日签字日期:2015年6月10日√摘要摘要目的探讨T细胞抗原受体(T cell receptor,TCR)基因重排在T细胞淋巴瘤中的特异性及其在病理诊断中的价值。
由于淋巴瘤在临床病理诊断中难度较大,仅凭HE和免疫组织化学特点得出的结论易造成误诊和漏诊。
在恶性淋巴瘤的分类中,T细胞淋巴瘤是一种临床上相对少见且异质性较高的肿瘤,准确做出诊断给病人的治疗和预后带来不可或缺的价值。
T细胞淋巴瘤的治疗

T细胞非霍奇金淋巴瘤诊疗进展山西医学科学院山西大医院张巧花侯淑玲T细胞非霍奇金淋巴瘤(T-NHL)是一种来源于T淋巴细胞的恶性克隆性增殖性疾病。
异质性强,病理诊断类型复杂,2008年WHO病理分20种类型,临床表现与治疗因不同发病部位、不同病理类型以及基因型而差异较大。
T-NHL的发病机制尚不清楚,近年来随着对T淋巴细胞作用机制以及T-NHL的生物学、细胞遗传学以及分子生物学研究的不断深入,T-NHL的诊治取得了瞩目的进展。
一、T-NHL的流行病及诊断与分型1.流行病因。
T-NHL的发病率远低于B-NHL,而且与地域分布有关,亚洲人群发病率高于欧美地区。
T-NHL在我国占非霍奇金淋巴瘤的34%,而在欧美国家仅占所有5%-15%。
亚洲地区以节外病变为主,如EB病毒相关的鼻部自然杀伤细胞(NK)淋巴瘤/T-NHL;在欧美地区主要是淋巴结内型,包括非特指型的外周T细胞淋巴瘤(PTCL-NOS)、间变型大B细胞淋巴瘤、血管免疫母细胞性T-NHL。
2.诊断WHO于2008年更新的NHL疾病分类中,在2001年基础上进行了更精细的分类,将T-NHL分为20种独立的疾病,每种独立的类型都有其各自的定义及相应的病理形态、免疫表型和遗传特点。
按照发病部位可分为:播散型、节内型、节外型和皮肤型。
原发性全身型ALCL中有分为ALK+和ALK-两个独立的亚型。
将皮肤脂膜炎样T-NHL仅限于表型为αβ。
原表型为γδ的皮肤脂膜炎样T-NHL由于预后较差,另外归类于原发性皮肤型PTCL。
原发皮肤侵袭性嗜表皮性CD8+细胞毒性T-NHL和原发性皮肤小/中CD4+T-NHL也归类在原发性皮肤型PTCL中。
蕈样霉菌病(MF)和sezary综合征分为不同两型。
增加了EB病毒相关的克隆性淋巴组织增殖性疾病(儿童)。
NCCN2009年制定的NHL分类中,T-NHL按照细胞形态分为间变性和非间变性两种。
非间变性又可分为:节内型、节外型和皮肤型。
PCR检测TCRγ基因重排技术的临床应用

脉、 迷路动脉、 内耳动脉 的血流下 降 、 缺血 、 缺氧而引 察表 明, 治疗组的显效率和 总有效率均明显优于对照 起。 现代医学认为动脉硬化及颈椎病是本病的两大病 组 , 疗效确切而显著 。其作用机理也在于其能扩张脑 理基础四 椎动脉受压或被牵拉 , 。 致使椎 一基底动脉血 血管 , 而且能改 善血液黏稠度 , 从而改善脑循环 ; 不失 流灌注不足 , 障碍是眩晕发作的主要动因。治疗 为治疗此类疾病可以选择的 良药。 循环 上可采用扩张脑血管 , 改善脑血液供应 , 降低血液黏 稠度等综合措施 , 以提高脑组织 的耐缺 氧能力 , 改善 【 参考文献】
维普资讯
第 2 卷第 3 9 期
20 0 6年 9月
遵Leabharlann 义医学院
学
报
V0. 9 No 3 12 .
Sp 20 e. 06
AC ADEMI TA AC AE MEDI I C NAE Z UNYI
椎一 基底动脉供血不足性眩晕是 以脑动脉硬化 效。将该药用于治疗椎 一基底动脉供血不足性眩晕 , 及颈椎退行性病为基础 , 导致小脑 前动脉 、 小脑下动 有一定的理论基础。而且 , 通过以上两组病例 临床观
迹分子杂交分析 I 与 T R基 因重排 ,取得了特异性 N L g C H 分类的临床应用价值。
tcr测序的分类

tcr测序的分类TCR测序是一种用于研究T细胞受体(TCR)多样性和功能的技术。
TCR是T细胞表面的膜结构,负责识别和结合抗原,从而引发免疫反应。
对TCR的深入了解有助于我们理解T细胞的免疫调节、感染、自身免疫疾病和肿瘤免疫等方面的机制。
本文将介绍TCR测序的原理、应用和发展前景。
1. 原理TCR是一种由α链和β链或γ链和δ链组成的异二聚体。
每个TCR链由可变(V)、多样(D)、连接(C)和常规(J)区域组成。
V区域是TCR链的最变异部分,决定了其特异性,而J和C区域负责链的连接和信号传导。
TCR测序的基本步骤是提取T细胞DNA或RNA,然后通过PCR扩增TCR链的V(D)J区域。
PCR产物经过测序后,通过比对参考数据库,可以确定每个TCR链的序列及其各区域的合并方式。
得到TCR链的序列信息后,可以根据其V区域序列进行TCR的克隆分析和多样性分析。
2. 应用TCR测序的应用非常广泛。
首先,TCR测序可以用于揭示正常T细胞库的基础TCR β链多样性和克隆分布。
这对于了解正常T细胞库的构成和免疫系统的功能非常重要。
其次,TCR测序可以用于研究免疫应答和疾病过程中的T细胞动态变化。
通过对T细胞库的TCR序列进行跟踪,可以获得有关特定抗原刺激引发的T细胞克隆扩张和分化的信息。
这对于研究免疫耐受和自身免疫疾病等免疫调节过程具有重要意义。
此外,TCR测序还可以用于研究肿瘤免疫。
由于肿瘤相关抗原的存在,T细胞库中可能存在特异性肿瘤浸润淋巴细胞(TILs)。
通过对T细胞库中TCR的测序,可以分析肿瘤相关抗原特异性T细胞的克隆扩张和功能状态,为肿瘤免疫治疗提供重要信息。
3. 发展前景随着高通量测序技术的发展,TCR测序技术的应用前景非常广阔。
首先,TCR测序可以更深入地揭示T细胞库的多样性和克隆动态,从而对免疫系统和疾病过程有更全面的理解。
其次,TCR测序还可以结合机器学习等方法,对大规模的TCR测序数据进行分析和解读。
淋巴瘤的分子生物学诊断知识点

淋巴瘤的分子生物学诊断知识点淋巴瘤是一种以淋巴细胞增生异常为特征的恶性肿瘤,包括多种亚型,具有不同的生物学特征和临床表现。
分子生物学诊断技术在淋巴瘤的分类、预后评估和治疗选择等方面起到了重要的作用。
本文将介绍淋巴瘤分子生物学诊断的一些重要知识点。
一、免疫组织化学检测(IHC)免疫组织化学检测通过检测肿瘤细胞表面或细胞内的特定分子标志物,帮助确定淋巴瘤的亚型和对应的治疗策略。
例如,CD20和CD79a是B细胞标志物,CD3是T细胞标志物,CD30是霍奇金淋巴瘤的标志物等。
免疫组织化学检测可以通过染色的强度和分布情况来判断特定标志物的阳性率,并结合其他临床和病理学特征进行综合分析。
二、基因重排检测淋巴瘤的发生和发展与基因重排异常密切相关。
通过检测重排的免疫球蛋白(Ig)和T细胞受体(TCR)基因,可以帮助确定淋巴瘤的亚型和起源。
例如,典型的霍奇金淋巴瘤患者常存在免疫球蛋白基因的重排。
PCR和Southern blot是常用的基因重排检测方法,可以通过扩增和分析特定基因区域的DNA序列来判断重排情况。
三、染色体异常检测淋巴瘤中常伴随着染色体异常,如染色体重排、整倍体性改变和部分染色体缺失等。
通过检测染色体异常,可以帮助确定淋巴瘤的亚型、预后风险和治疗选择。
常用的染色体异常检测方法包括常规染色体核型分析、荧光原位杂交(FISH)和比较基因组杂交(CGH)等。
FISH 可以通过探针标记的染色体特定区域来检测染色体重排和缺失。
而CGH则可以全基因组范围内分析基因拷贝数变异。
四、新一代测序技术随着新一代测序技术的发展,淋巴瘤分子生物学诊断也得到了进一步的提升。
新一代测序技术可以高效地获得淋巴瘤患者的全基因组、外显子组、转录组和甲基化组等信息。
这些信息可以帮助识别新的突变驱动基因和疾病相关的生物学过程,为个体化治疗提供重要依据。
总结:以上介绍了淋巴瘤分子生物学诊断的一些重要知识点,包括免疫组织化学检测、基因重排检测、染色体异常检测和新一代测序技术。
tcr基因重排

tcr基因重排
近几年,基因重排技术在免疫学领域取得了重大进展。
作为免疫基因重构技术家族的一员,TCR(T细胞受体)基因重排技术具有革命性的价值,从而为治疗各种恶性肿瘤和慢性非恶性疾病带来了新的可能性。
TCR(T细胞受体)是一种免疫细胞,它能够识别外源抗原,从而建立免疫应答。
其中,αβ型TCR是囊括多种免疫细胞中最重要的一种,它可以在T细胞激活和增殖过程中产生免疫应答。
但是,由于TCRβ具有高度多样性,以致于其结构及结合性能受到很大的限制,使得其传统克隆技术的效率非常低。
因此,TCR基因重排技术的出现,为利用T细胞发挥免疫治疗效果带来了新的希望。
TCR基因重排技术是利用获取的T细胞的原始TCR基因,然后通过特定的基因重排技术来改造它们,最终实现合成的表达载体,以实现T细胞媒介的杀伤抗原特异性原核表达。
该技术具有高效率、快速正确、精确相容等优点,能极大提高T细胞受体αβ的结构多样性,具有强大的应用价值。
首先,重构的T细胞受体αβ能够增强其识别抗原的敏感性,从而增强免疫应答的功效,并具有更强的治疗潜力。
其次,TCR基因重排技术可以使T细胞受体αβ能够更有效地结合抗原,具有更强的杀伤能力,而且更能有效地抑制宿主免疫应答,具有抑制疾病发展的效果。
此外,利用TCR基因重排技术配合抗原特异性疫苗,可以更加精准地引导宿主免疫细胞,激活宿主免疫,并以最佳的免疫应答进行抗病理的治疗,以达到精准医疗的目的。
总之,TCR基因重排技术是一种具有巨大治疗潜力和精准医疗价值的免疫技术,它可以提升T细胞免疫反应的效率,有助于克服传统基因克隆中效率低、抗原特异性缺乏等问题,有望在慢性非恶性疾病和恶性肿瘤的治疗中发挥重要作用。
Hela细胞诱导下TCR Vβ基因的选择性表达与重排研究

Hela细胞诱导下TCR Vβ基因的选择性表达与重排研究胡丽莉;余雪松;王丁丁;张凤兰;张国锋;黄树林【摘要】目的研究Hela细胞诱导下T细胞受体(Tcell receptor,TCR)Vβ亚家族基因的优势表达规律,并探讨其是否与重排激活基因(RAGs)介导的TCR重排相关.方法将Hela细胞与健康人外周血单个核细胞(PBMC)混合培养,利用反转录聚合酶链式反应(reverse transcription-PCR,RT-PCR)检测共培养前后TCR Vβ各亚家族基因、重排激活酶RAGs、非同源末端连接(non-homogousend joining,NHEJ)途径中的核心蛋白Ku70/Ku80及末端脱氧核苷酸转移酶(terminal deoxynucleotidyl transferase,TdT)等的表达特点.结果随着混合培养时间的推移,TCR Vβ各亚家族基因由最初的全部表达逐渐转变为选择性的部分表达,其中,TCR Vβ7在各时间段都有明显的表达;Ku70随着培养时间的推移表达量逐渐减少直至没有表达;而RAGs、kuS0和TdT基因在各个时间段均未检测到其表达.结论在Hela细胞诱导下,TCRVβ各亚家族基因的表达有一定的选择性但无明显的特异性,该选择性表达可能与RAGs介导的二次重排无关.%Objective To study the expression pattern of TCR Vf! Gene induced by Hela cells,and explore the correlation between the expression pattern and the rearrangement in T cell receptor ( TCR) mediated by recombination activating genes (RAGs). Methods The peripheral blood mononuclear cells ( PBMC) and Hela cells were co-cultured. The expression of TCRVJ3,RAGs,Ku70/Ku8O in non-homologous end joining (NHEJ) pathway and the terminal deoxynucleotidyl transferase (TdT) genes were analyzed by reverse transcription polymerase chain reaction ( RT-PCR). Results All of TCR K/3 subfamily genes expressed equally before two cells co-cultured.When extend the culture time,the expression of TCR ^3 subfamily genes changed in different ways. TCR VβH gene was highly expressed at all time, but the expression of KiflO was gradually decreased until to no detection. Meanwhile, RAGs, kuSO and TdT genes were not detected. Conclusion The expression of TCR Vβ subfa mily genes is only selective,no specific,when induced by Hela cells. The selective expression may be independent onA4Gs-mediated secondary rearrangement.【期刊名称】《广东药学院学报》【年(卷),期】2011(027)004【总页数】6页(P417-422)【关键词】Hela细胞;TCR Vβ基因;重排【作者】胡丽莉;余雪松;王丁丁;张凤兰;张国锋;黄树林【作者单位】广东药学院生命科学与生物制药学院,广东广州510006;广东药学院生命科学与生物制药学院,广东广州510006;广东药学院生命科学与生物制药学院,广东广州510006;广东药学院生命科学与生物制药学院,广东广州510006;广东药学院生命科学与生物制药学院,广东广州510006;广东药学院生命科学与生物制药学院,广东广州510006【正文语种】中文【中图分类】Q78宫颈癌已成为威胁妇女健康的常见疾病,位居全球女性癌症发病率之首。
基因重排检测技术的建立及其在淋巴瘤诊断中的应用

基因重排检测技术的建立及其在淋巴瘤诊断中的应用【关键词】淋巴瘤Detection and clinical significance of gene rearrangements in diagnosis of lymphomas【Abstract】 AIM: To establish a way to detect the gene rearrangements of IgH and TCR and to assess the application of the detection technique in the diagnosis of malignant lymphoma. METHODS: Fiftythree cases of malignant lymphoma and 20 cases of reactive lymphoid hyperplasia were chosen for making tissue sections. Genomic DNA was extracted, and amplified via PCR. The products were resolved on denaturing polyacrylamide gels and visualized through silver staining. RESULTS: Gene rearrangements of IgH and TCR were negative in 20 cases of reactive lymphoid hyperplasia. In all of 18 cases of T cellnonHodgkins lymphoma (TNHL), gene rearrangement of TCR γ was found in 12 cases and that of TCR β was found in 3 cases, and IgH gene rearrangement was not found. IgH gene rearrangement was found in 28 cases out of 32 cases of B cellNHL (BNHL),in 2 cases of which gene rearrangements of TCR γ and IgH were both found. There was IgH gene rearrangement in 3 cases of suspected lymphomas. There was a remarkable difference between NHL group and benign group in gene rearrangment (P<0.05). CONCLUSION: The detection of gene rearrangements of IgH and TCR by PCR can be a kind of subsidiary means to diagnose the lymphoproliferative disease. Particularly, the clonality showed in the formalinfixed and paraffinembedded samples may be useful in the retrospective researches.【Keywords】 lymphoma; gene rearrangement; polymerase chain reaction; neoplasm【摘要】目的:建立基于克隆性分析技术的B和T淋巴细胞产生的抗原受体分子基因重排检测技术,探讨B淋巴细胞免疫球蛋白及T淋巴细胞受体基因重排在恶性淋巴瘤临床诊断中的应用. 方法:从组织蜡块中切取组织片5~10张,提取基因组DNA,PCR扩增,聚丙烯酰胺凝胶电泳后银染显示基因重排结果. 结果:20例良性淋巴组织反应性增生病例中,淋巴细胞IgH及TCR基因重排均为阴性;18例T细胞非何杰金氏淋巴瘤中TCRγ基因重排12例,TCRβ基因重排3例,未见有IgH基因重排;32例B细胞性非何杰金氏淋巴瘤标本中有28例IgH基因重排阳性,有2例TCRγ和IgH基因重排均阳性;3例未确诊的疑难病例均为IgH基因重排;IgH及TCR基因重排检出率在淋巴瘤组与良性组之间,差异有显著意义(P<0.05). 结论:应用PCR法检测B淋巴细胞IgH和T淋巴细胞TCR基因重排可作为淋巴细胞来源的良、恶性病变的一种辅助诊断手段,且适用于石蜡标本以进行回顾性研究.【关键词】淋巴瘤;基因重排;聚合酶链反应;肿瘤0引言恶性淋巴瘤(malignant lymphoma)是免疫系统的原发性恶性肿瘤,主要发生于淋巴器官和淋巴组织. 根据肿瘤的组织结构及细胞学特征可分为何杰金氏病(Hodgkins disease, HD)及非何杰金恶性淋巴瘤(nonHodgkins malignant lymphoma, NHL),淋巴瘤的诊断一直是病理诊断中的难点,部分淋巴组织增生性病变单纯通过HE和免疫组化很难明确性质,另外NHL由于种类繁多,分类复杂,给临床病理工作者带来了一定的困难.淋巴细胞从原始的胚系构型到分化成熟,其抗原受体(Ig和TCR)基因通过基因重排而形成有功能的基因. 一个T,B细胞或其克隆性后代,均只含一种独特的分子遗传学标记. 一旦某一克隆的淋巴细胞发生恶性变化,即可呈现特异的基因重排[1]. 因此,对基因重排类型进行检测可用于对淋巴细胞增殖性疾病的诊断. 此研究拟应用这一手段,探讨淋巴组织增生性病变的性质,并对该技术在恶性淋巴瘤中的诊断价值进行探讨.1材料和方法1.1材料53例恶性淋巴瘤标本均来自第四军医大学唐都医院病理科(1995~2005). 其中男性29例(55%),女性24例(45%);年龄12~76岁,平均年龄44.2岁. 所有标本均为福尔马林固定、石蜡包埋组织. 其中B细胞非何杰金淋巴瘤32例,T细胞非何杰金淋巴瘤18例,未能定性的淋巴组织增生性病变3例. 20例良性淋巴组织反应性增生病例作为阴性对照. 所有淋巴瘤病例均在取PCR 模板前经临床病理HE和免疫组化标记(B细胞: CD20,CD79α; T细胞: CD3,CD45RO)证实,以确定为相应病例且所取部位确为病变部位,包含有需检测的部分. 3例未能定性的淋巴组织增生性病变怀疑为BNHL(免疫组化标记CD79α阳性),但诊断仍未明确.1.2方法1.2.1石蜡包埋组织DNA的提取每例标本制备厚度为4 μm的切片6张,贴于载玻片上,常规烤片、二甲苯脱蜡、乙醇冲洗,切片自然干燥. 用无菌双面刀片将组织刮入1.5 mL的离心管中,按以前的方法[2-3]提取基因组DNA.1.2.2引物合成引物序列由上海生工生物工程技术公司合成. 引物序列为: β球蛋白基因内对照PC03:ACACAACTGTGTTCACTAGC, PC04:CAACTTCATCCACGTTCACC;免疫球蛋白基因重排(IgH) FR3A:ACACGGCTGTGTATTACTGT, LJH: TGAGGAGACGGTGACC,VLJH:GTGACCAGGGTACCTTGGCCCCAG;T细胞受体基因重排(TCR β链和γ链)Db1: CAAAGCTGTAACATTGTGGGGAC, Jb2:AGCACTGTGAGCCTGGTGCC,TVG: AGGGTTGTGTTGGAATCAGG, TJX: CGTCGACAACAAGTGTTGTTCCAC,Vγ11: TCTGGAGTCTATTACTGTGC,Vγ101: CTCACACTCTCACTTC,Jγ12:CAAGTGTTG TTCCACTGCC, Jp12: GTTACTATGAGCTAGTCC.1.2.3PCR扩增及循环条件PCR扩增在PT200型热循环仪(MJ Research)上进行. 反应体系为25 μL,含10 mmol/L dNTP(Gibco BRL)2 μL,10×缓冲液2.5 μL,50 mmol/L MgCl2 0.75 μL,Taq DNA聚合酶(Gibco BRL) 1 U,20 pmol/L引物1 μL,DNA样品1~5 μL. IgH基因采用半巢氏PCR扩增: 第一轮引物为FR3A和LJH,95℃预变性3 min,然后94℃变性40 s,62℃退火50 s,72℃延伸40 s,共30个循环; 最后72℃延伸10 min. 扩增产物经1∶100稀释后取1 μL进行第二轮扩增,引物为FR3A和VLJH,95℃预变性3 min,然后94℃变性40 s,60℃退火50 s,72℃延伸40 s,共30个循环; 最后72℃延伸10 min. FR 3A与VLJH扩增产物为100~120 bp.TCRβ和TCRγ采用40个循环,其中TCRγ引物为Vγ11,Vγ101和Jγ12或Vγ11,Vγ101和Jp12的混合物. 95℃预变性3 min,然后94℃变性40 s,56℃退火50 s,72℃延伸40 s;最后72℃延伸10 min. TCRβ扩增产物为65~85 bp. TCRγ各组扩增产物在70~200 bp不等.β球蛋白基因引物作为内对照进行扩赠,共40个循环. 95℃预变性3 min,然后94℃变性40 s,60℃退火50 s,72℃延伸40 s;最后72℃延伸10 min. 产物长度为110 bp.1.2.4电泳及结果观察琼脂糖凝胶(20 g/L)电泳评价扩增效果后,将3 μL产物和等体积的上样缓冲液[4](990 mL/L甲酰胺,1 g/L溴酚蓝,1 g/L二甲苯青)混匀后加到厚度为0.8 mm的聚丙烯酰胺凝胶(100 g/L,含尿素8mol/L),应用miniVE系统(AmershamPharmacia Biotech)泳动8 h(80 V).取出后按以前的方法[2]银染,分别用UVP凝胶分析系统(UVP, Cambridge,UK)和光学照相记录数据,根据IgH及TCR相应阳性位置判断结果.1.2.5结果判定阳性结果判定标准:①PCR扩增电泳条带清晰,宽度不大于1 mm,边缘锐利;②片段大小与预计范围相符,与期望值相差不超过5 bp;③若出现期望值大小之外的其他条带或期望值内出现两条或以上可接受的条带,应判定为重排阴性.统计学处理:采用SPSS 10.0统计分析软件对组间率的差别进行χ2检验,以P<0.05为有统计学意义.2结果2.1组织学观察和免疫组织化学结果32例B细胞非何杰金淋巴瘤免疫组化证实CD20和(或)CD79α阳性, CD3和CD45RO阴性(图1); 18例T细胞非何杰金淋巴瘤免疫组化证实CD3和(或)CD45RO阳性, CD20和CD79α阴性(图2),支持原来的诊断和分型. 3例未能定性的淋巴组织增生性病变免疫组化标记CD79α阳性, CD3和CD45RO阴性,怀疑为BNHL. 20例良性淋巴组织反应性增生病例CD20,CD79α,CD3,CD45RO均有不同程度的阳性表达.A: CD79а; B: CD20.图1BNHL组织中CD79а和CD20阳性表达(略)A: CD45RO; B: CD3.图2TNHL组织中CD45RO和CD3阳性表达(略)2.2基因重排检测结果2.2.1石蜡组织标本DNA检测PC03,PC04引物对良性增生的淋巴组织以及淋巴瘤组织DNA进行扩增,均见110 bp大小的β球蛋白特异条带(图3).右侧泳道为100 bp DNA标志物的位置. 1:实验组TNHL. 黄色箭头为110 bp涌动位置;2:实验组BNHL;3:阳性对照TNHL(已知TCRγ重排阳性);4:阳性对照BNHL(已知IgH重排阳性);5:反应性增生淋巴组织作为阴性对照.图3PC03/PC04引物PCR扩增结果电泳图(略)2.2.2良性淋巴组织反应性增生病例结果20例良性淋巴组织反应性增生病变组织B细胞和T细胞抗原受体重排均为阴性(图4).2.2.3阳性对照T,B淋巴瘤检测结果B细胞淋巴瘤阳性对照标本组织B细胞Ig重排阳性(图5). T细胞淋巴瘤阳性对照标本组织T细胞TCRγ1重排阳性(图6).右侧泳道为100 bp DNA标志物的位置. 1:IgH FR3A/LJH, FR3A/VLJH引物扩增产物;2:TCRβDb1/Jb2引物扩增产物;3:TCRγ1 TVG/TJX引物扩增产物;4:TCRγ2 Vγ11/Vγ101/Jγ12引物扩增产物; 5:TCRγ3Vγ11/Vγ101/Jp12引物扩增产物. 黄色箭头为110 bp涌动位置.图4良性淋巴组织反应性增生病例PCR扩增结果电泳图(略)左侧泳道为100 bp DNA标志物的位置. 1:内对照PC03/PC04引物扩增产物;2:IgH FR3A/LJH,FR3A/VLJH引物扩增产物;3:TCRβDb1/Jb2引物扩增产物; 4:TCRγ1 TVG/TJX引物扩增产物; 5:TCRγ2 Vγ11/Vγ101/Jγ12引物扩增产物;6:TCRγ3 Vγ11/Vγ101/Jp12引物扩增产物;7:阴性对照FR3A/LJH,FR3A/VLJH引物扩增产物. 黄色箭头为110 bp涌动位置.图5阳性对照BNHL PCR扩增结果电泳图(略)2.2.4淋巴瘤组织检测结果18例T细胞淋巴瘤中TCRγ基因重排为12例,TCRβ基因重排为3例, TCR基因重排阳性率83.3%,与良性组(TCR基因重排均阴性)相比,差异有显著意义(χ2=15.10, P<0.05);32例B细胞性非何杰金氏淋巴瘤标本中有28例IgH基因重排阳性,其中2例TCRγ基因重排也阳性,基因重排阳性率87.5%,与良性组(IgH基因重排均阴性)相比,差异有显著意义(χ2=25.30, P<0.05).中间泳道为100 bp DNA标志物的位置. 1:TCRβDb1/Jb2引物扩增产物; 2:TCRγ3 Vγ11/Vγ101/Jp12引物扩增产物;3:TCRγ2Vγ11/Vγ101/Jγ12引物扩增产物;4:TCRγ1 TVG/TJX与内对照PC03/PC04引物扩增产物;5:阴性对照TCRγ1 TVG/TJX与内对照PC03/PC04引物扩增产物;6:阴性对照TCRγ2 Vγ11/Vγ101/Jγ12引物扩增产物; 7:阴性对照TCRγ3Vγ11/Vγ101/Jp12引物扩增产物;8:IgH FR3A/LJH,FR3A/VLJH引物扩增产物. 黄色箭头为110 bp涌动位置,红色箭头为190 bp涌动位置,红色箭头为80 bp涌动位置.图6阳性对照TNHL PCR扩增结果电泳图(略)2.2.5未确诊病例检测结果3例未确诊的疑难病例均为IgH基因重排,经FR3A/LJH,FR3A/VLJH引物采用半巢氏PCR扩增后出现95 bp大小IgH阳性条带.3讨论恶性淋巴瘤(malignant lymphoma)是免疫系统的原发性恶性肿瘤,主要发生于淋巴器官和淋巴组织. 淋巴瘤的诊断一直是病理诊断中的难点,部分淋巴组织增生性病变单纯通过HE染色和免疫组化方法很难明确性质,另外NHL种类繁多,分类复杂,给临床病理工作者带来了一定的困难[5].干细胞在向淋巴细胞分化过程中, Ig重链基因(IgH)和T细胞受体(TCR)基因的可变区(V)和结合区(J)基因会发生重排[6]. 基因重排过程是一个正常的过程,正常淋巴细胞在发育中是多克隆性质,但淋巴造血系统肿瘤所具有的是单克隆性重排,也就是全部肿瘤细胞具有一个相同的免疫球蛋白或TCR 基因重排,即表现为重排基因为单一模式,这对研究淋巴细胞恶变的机制和解决临床的诊断问题都十分重要[6]. 检测单克隆性免疫球蛋白和T细胞受体基因有助于鉴别淋巴系统的肿瘤性和反应性增生,并确定细胞的来源.本研究中18例T细胞淋巴瘤中TCRγ基因重排为12例,TCRβ基因重排为3例, TCR基因重排阳性率83.3%,与Diss等[7]报道的T 细胞淋巴瘤78.2%的检出率相近. 而良性淋巴组织未见克隆性条带, TCR基因重排检出率在TNHL及良性淋巴结反应性增生之间相比,差异有显著意义(P<0.05). 说明TCR基因引物对T细胞性NHL的克隆性确定有重要价值. 32例B细胞性非何杰金氏淋巴瘤标本中有28例IgH基因重排阳性,基因重排阳性率87.5%,与Kros等[8]报道的B细胞淋巴瘤77%的检出率以及国内王萍等[9]报道的B细胞淋巴瘤72 %的检出率相近. 而TNHL及反应性增生均未见IgH克隆性基因重排, IgH基因重排检出率在BNHL及良性淋巴结反应性增生之间相比,差异有显著意义(P<0.05). 说明IgH基因引物对B细胞性NHL的克隆性和细胞源性确定有重要价值,可用于淋巴瘤的诊断和分型.B淋巴细胞产生的抗原受体分子Ig和T淋巴细胞产生的抗原受体分子TCR,其编码基因在细胞的分化过程中均发生重排. 一个T,B细胞或其克隆性后代,均只含一种独特的分子遗传学标记. 大量的实验已证实,淋巴细胞肿瘤源于单克隆性增生. 我们利用特定的引物对其基因进行扩增,当将扩增产物进行聚丙烯酰胺凝胶电泳时,多克隆淋巴细胞将产生一片弥漫带(见于反应性增生),而单克隆性增殖的淋巴组织则出现一明显条带(见于恶性淋巴瘤).因此对于淋巴瘤的诊断,首先应依靠形态学检查,并辅以免疫组化结果,对于仍不能明确诊断一小部分病例得,可行基因重排检测,在本研究中有3例较难诊断病例,由于病理HE切片、免疫组化均不能做出明确诊断,通过运用PCR技术对其进行基因重排检测,有IgH的特异性重排条带,提示基因重排的检测对于识别此类交界性及淋巴瘤的早期发现可能具有重要价值.参考文献[1] Garcia MJ, Delgado BM, Granizo JJ, et al. IgH,TCRγ and TCRβ gene rearrangement in 80 B and Tcell NonHodgkins lymphomas: Study of the association between proliferation and the socalled “A berrant” patterns[J]. Diag Mol Pathol, 2001, 10(2): 69-77.[2]王淑芳,苏勤,朱少君,等.多发性子宫平滑肌瘤的克隆性[J].中华病理学杂志,2002, 31:107-111.[3]朱少君,苏勤,王淑芳,等. 女性外阴尖锐湿疣的克隆性[J]. 诊断病理学杂志, 2003, 10:81-84.[4] Lucas DR, Shroyer KR, McCarthy PJ, et al. Desmoid tumor is a clonal cellular proliferation: PCR amplification of HUMARA for analysis of patterns of Xchromosome inactivation[J]. Am J SurgPathol, 1997, 21:306-312.[5]高子芬,潘增刚,裴斐,译. 女性生殖系统. 见: Juan Rosai,ed. 回允中,主译. 阿克曼外科病理学[M]. 8版. 沈阳: 辽宁教育出版社,1999. 1319.[6]朱平. 现代血液肿瘤诊断治疗学[M] . 北京:北京医科大学、中国协和医科大学联合出版社,1998:24-41.[7] Diss TC, Watts M, Pan LX, et al. The polymerase chain reaction in the demonstration of monoclonality in T cell lymphomas[J]. J Clin Pathol, 1995, 48:1045-1050.[8] Kros JM, Bagdi EK, Zheng P, et al. Analysis of immunoglobulin H gene rearrangement by polymerase chain reaction in primary central nervous system lymphoma[J]. J Neurosurg, 2002,97:1390-1396.[9]王萍,王瑞年,卢健,等. 非霍奇金淋巴瘤的IgH和TCRδ基因重排[J]. 临床与实验病理学杂志, 2002,18: 21-23.。
TCR重排

TCR重排一、临床意义:近年来小儿急性淋巴细胞白血病的发生日趋增多, 并且在成年人的发病率也呈增长的趋势, 虽然部分患者经过化疗或干细胞移植, 能够达到临床或血液学的完全缓解( Complete Remission, CR) , 但白血病微小残留病(Minimal Residual Disease, MRD) 导致白血病复发的问题一直困扰着医务人员。
目前检测MRD 的手段很多, 如流式细胞仪检测白血病细胞、RT-PCR 检测白血病基因等方法, 其中白血病基因检测具有灵敏度高的特点具有很高的参考价值。
然而淋巴细胞白血病因为不具有高特异性的白血病基因, 所以在MRD 的监测上比较困难。
1、TCR基因重排技术是检测淋巴细胞克隆性增生的金标准,应用于恶性淋巴瘤的早期诊断和鉴别诊断有重大意义,特别是对于经常规HE、免疫组化检测仍不能确诊的病例有较好的用途和前景。
非霍奇金淋巴瘤是发生于单一亲本细胞的单克隆恶性增殖,瘤细胞的基因重排高度一致。
而正常淋巴组织和良性淋巴组织增生性疾病呈多克隆性,因此可作为非霍奇金淋巴瘤的基因标志。
TCRγ或TCRβ基因重排常作为T 细胞淋巴瘤的基因标志,阳性率可达70%~80%。
为非霍奇金淋巴瘤的诊断、分型及评估预后提供参考依据。
由此可见TCR 基因重排是淋巴细胞恶性增生的特异性标志。
2、我们通过对T 细胞受体(Tcell receptor , TCR) 检测以及它们在监测MRD 中的临床意义的研究, 观察到这种TCR基因重排的检测持续阳性的患者, 更容易导致白血病的早期复发。
因而在ALL 病程中对TCR基因重排进行动态监测, 极大的提高MRD 检出的特异性和敏感性,对ALL患儿的预后、复发的判断及制定相应的个体化治疗方案有重要的指导意义,可以使患儿最大程度的长期无病生存,减少化疗所致的远期不良反应。
二、检测方法:1、S outhern杂交技术(印迹杂交)优点是稳定、可靠, 被称为基因重排的金标准,缺点是成本较高, 需要较多新鲜组织、操作复杂和费时, 且国内收费标准较低, 无法广泛应用于淋巴瘤的鉴别诊断。
肝脾T细胞淋巴瘤13例临床病理分析及预后

肝脾T细胞淋巴瘤13例临床病理分析及预后陈旭;赵武干;王冠男;李文才【摘要】目的探讨肝脾T细胞淋巴瘤(HSTCL)的临床病理学特点、诊断及鉴别诊断.方法收集13例HSTCL的临床资料并进行形态学观察,应用免疫组化和TCR基因重排检测,并复习相关文献.结果 13例瘤细胞CD2、CD3、CD7均阳性,T细胞限制性胞内抗原TIA-1、CD56部分阳性,细胞毒性相关分子粒酶B(Granzyme-B)、EBER阴性.11例标本TCR克隆性重排检测阳性.13例患者临床治疗方案不同(脾切除术后化疗,保脾化疗,自体造血干细胞移植),随访6~58个月,预后均较差.结论HSTCL是一类罕见的结外侵袭性外周T细胞淋巴瘤,其病理表现多样且独特,结合免疫表型、TCR基因重排可确诊.【期刊名称】《河南外科学杂志》【年(卷),期】2019(025)003【总页数】3页(P1-3)【关键词】肝脾T细胞淋巴瘤;γδT细胞抗原受体;TCR基因重排【作者】陈旭;赵武干;王冠男;李文才【作者单位】郑州大学第一附属医院病理科郑州 450052;郑州大学第一附属医院病理科郑州 450052;郑州大学第一附属医院病理科郑州 450052;郑州大学第一附属医院病理科郑州 450052【正文语种】中文【中图分类】R730.263肝脾T细胞淋巴瘤(Hepatosplenic T cell lymphoma,HSTCL)是一种较罕见的外周T细胞淋巴瘤(Peripheral T cell lymphoma,PTCL),占非霍奇金淋巴瘤的10%~20%,占所有外周T细胞淋巴瘤的5%以下[1]。
1990年首次提出,1994年被REAL分型确认为一个独立的淋巴瘤亚型。
根据T细胞受体(T-cell receptors,TCR)的不同,HSTCL分为γδ和αβT细胞淋巴瘤两种亚型,前者占绝大多数。
WHO(2001)淋巴造血系统肿瘤分类将其正式归入PTCL,命名为HSTCL。
肠病性T细胞淋巴瘤临床病理特征分析

肠病性T细胞淋巴瘤临床病理特征分析芦华莉;沈靖;王朝夫【摘要】目的:探讨肠病性T细胞淋巴瘤(enteropathic T-cell lymphoma,ETCL)临床病理特点、免疫表型及分子遗传学特征.方法:对1例ETCL的临床、病理组织学、免疫表型及免疫球蛋白重链和T细胞受体(TCR)基因克隆性重排进行观察并复习相关文献.结果:眼观部分回肠及右半结肠切除标本:回肠、结肠节段性溃疡.镜检回肠浅表溃疡病变累及黏膜层和黏膜下层,深度溃疡病变累及全层,肠壁各层在炎症背景下出现异常淋巴细胞浸润.结肠病变与回肠相同.免疫表型见瘤细胞呈CD43+,CD45RO+,CD56+,TIA1+,GB+,PF+,CD3-,CD3(单),CD30-,EMA-,CD20-,CD79a-.TCRγ重排:JVⅠ(+) JVⅡ(+).EBER原位杂交检测(-).结论:ETCL多发生于青年男性,临床症状多无特异性,病程发展迅猛,预后极差.病变的肠管表现为多发性溃疡,TCRγ克隆性重排.%Objective:To investigate the clinicopathological features,immunophenotype and molecular genetics of enteropathic T-cell lymphoma(ETCL) . Methods:The histopathological appearance, the immunophenotype, immunoglobulin heavy chain, the gene clonality rearrangement of T-cell receptor ( TCR) of a ETCL cases were observed, and relevant references were reviewed. Results: Segmental ulcers were found in ileum and right colon. Superficial ulcer involving the ileal mucosa and submucosa, the deeper ulcerative lesions invasing the full thickness and abnormal lymphocytes encroached all layers of the intestinal wall in the context of inflammation of ileum and colon were observed under microscope. According to immunophenotype, the immunophenotype of CD43 + , CD45RO+ , CD56+ , TIA1 + , GB + and PF + of the tumor cellspresented postive results, but the expression of CD3 , CD3 ( monoclone) CD30 , EMA , CD20 and CD79a were negative. According to TCR-γ gene rearrangement, JV I and JV II showed positive, and the result of hybridization in situ of EBER was negative. Conclusions:ETCL occurs mostin young men with no specific symptoms. Its progresses is rapidly and the result of prognosis is poor. The multiple ulcer in intestinal canal and TCR-γ gene rearrangement are its main characteristic.【期刊名称】《蚌埠医学院学报》【年(卷),期】2012(037)006【总页数】3页(P650-652)【关键词】淋巴瘤;T-细胞;肠病型;免疫组织化学;基因重排【作者】芦华莉;沈靖;王朝夫【作者单位】安徽省蚌埠市第三人民医院,病理科,233000;安徽省蚌埠市第三人民医院,病理科,233000;复旦大学附属肿瘤医院,病理科,上海,200032【正文语种】中文【中图分类】R733.4肠病性T细胞淋巴瘤(enteropathic type T-cell lymphoma,ETCL)是一种少见的、发生在消化道的淋巴结外的T细胞淋巴瘤,多发于青年男性,临床症状多无特异性,病程发展迅猛,预后极差。
TCR测序,怎么哪哪都有你?
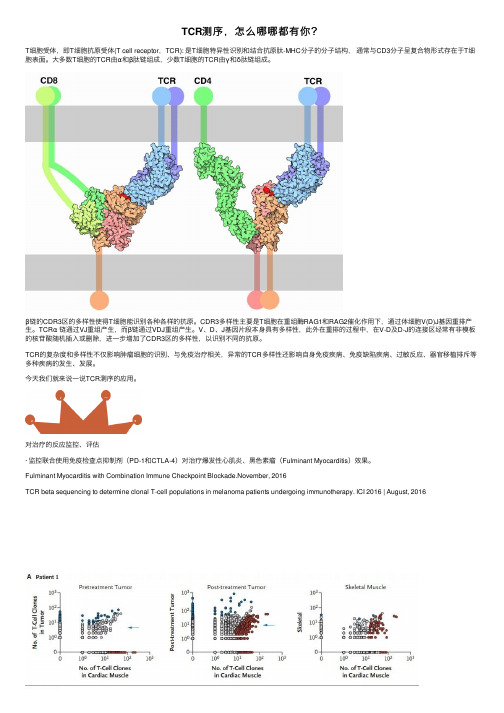
TCR测序,怎么哪哪都有你?T细胞受体,即T细胞抗原受体(T cell receptor,TCR): 是T细胞特异性识别和结合抗原肽-MHC分⼦的分⼦结构,通常与CD3分⼦呈复合物形式存在于T细胞表⾯。
⼤多数T细胞的TCR由α和β肽链组成,少数T细胞的TCR由γ和δ肽链组成。
β链的CDR3区的多样性使得T细胞能识别各种各样的抗原。
CDR3多样性主要是T细胞在重组酶RAG1和RAG2催化作⽤下,通过体细胞V(D)J基因重排产⽣。
TCRα链通过VJ重组产⽣,⽽β链通过VDJ重组产⽣。
V、D、J基因⽚段本⾝具有多样性,此外在重排的过程中,在V-D及D-J的连接区经常有⾮模板的核苷酸随机插⼊或删除,进⼀步增加了CDR3区的多样性,以识别不同的抗原。
TCR的复杂度和多样性不仅影响肿瘤细胞的识别、与免疫治疗相关,异常的TCR多样性还影响⾃⾝免疫疾病、免疫缺陷疾病、过敏反应、器官移植排斥等多种疾病的发⽣、发展。
今天我们就来说⼀说TCR测序的应⽤。
对治疗的反应监控、评估· 监控联合使⽤免疫检查点抑制剂(PD-1和CTLA-4)对治疗爆发性⼼肌炎、⿊⾊素瘤(Fulminant Myocarditis)效果。
Fulminant Myocarditis with Combination Immune Checkpoint Blockade.November, 2016TCR beta sequencing to determine clonal T-cell populations in melanoma patients undergoing immunotherapy. ICI 2016 | August, 2016· 监测免疫检查点抑制剂CTLA-4治疗前列腺病( prostate cancer)、早期乳腺癌(breast cancer)的效果。
Clonal expansion of CD8 T cells in the systemic circulation precedes development of ipilimumab-induced toxicities. PNAS | October, 2016 Deep Sequencing of T-Cell Receptor DNA as a biomarker of clonally expanded TILs in breast cancer after immunotherapy. Cancer ImmunologyResearch | September, 2016· 评估PD-1抑制剂对免疫系统副作⽤反应。
tcr-t技术原理

tcr-t技术原理
TCR-T技术是一种免疫细胞治疗技术,其原理主要涉及T细胞
受体的改造和应用。
首先,TCR-T技术通过基因工程手段将患者的T
细胞中的T细胞受体(TCR)基因改造,使其表达特定的抗原识别受体。
这些受体能够识别并结合肿瘤细胞表面的特定抗原,从而激活
T细胞对肿瘤细胞的攻击。
其次,改造后的T细胞被扩增培养,使其数量增加到足够的水平,然后重新注入患者体内。
一旦这些改造后的T细胞重新进入患
者的体内,它们将寻找并攻击表达目标抗原的肿瘤细胞,从而发挥
抗肿瘤作用。
此外,TCR-T技术还涉及到对患者T细胞的采集、基因改造和
扩增培养的具体操作流程,以及对患者的免疫系统状态和肿瘤抗原
的筛选和评估。
这些都是确保该技术安全有效应用的重要步骤。
总的来说,TCR-T技术的原理是通过改造患者的T细胞,使其
具有更强的抗肿瘤能力,然后重新注入患者体内,发挥抗肿瘤作用。
这一技术为肿瘤治疗领域带来了新的希望,但也面临着诸多挑战和
待解决的问题。
希望未来能够进一步完善和发展这一技术,使其在临床应用中发挥更大的作用。
分子生物学技术在免疫学诊断中的应用

分子生物学技术在免疫学诊断中的应用一、BCR和TCR基因重排检测对血细胞恶性变如白血病、淋巴瘤等的诊断,长期以来多应用细胞形态学检查和免疫细胞表型分析。
由于这些方法在特异性和敏感性上的限制,对于丢失了细胞表面标志,或分化较好难以和正常细胞区别。
也可能由于恶性细胞数量少,混在大量正常细胞中难以查出。
近年来由于分子生物学技术的广泛应用,且由于获得了Ig片段的特异基因克隆及TCR各链的基因克隆,在此基础上发展了应用Ig基因重排作为B细胞的特异标记,诊断B细胞来源的白血病的和应用TCR基因重排为T 细胞特异标志诊断T细胞恶性变引起的白血病,从而将白血病的细胞学分类法提高到基因水平分析,建立了免疫基因型诊断的新方法,大大提高了诊断的敏感性和特异性。
该方法不但可以确定细胞来源、分化程度,且由于DNA分析的高度敏感性而能查出显微镜不能看到的微小变化,从而能监测治疗效果,发现微量残留病变细胞。
该方法首先要从待检的细胞中分离出总DNA。
在非T、非B细胞的Ig 和TCR基因不发生重排称为胚基因(germ line)。
而T和B细胞在分化早期即有TCR和Ig基因重排,重排后的Ig和TCR片段,转移至硝酸纤维膜或尼龙膜上,然后用同位素或酶标记的Ig血病细胞进行分类鉴定,若有Ig基因重排说明恶性细胞来源于B细胞,若有TCR基因发生重排,则为T细胞来源的。
如果既无Ig基因重排,又无TCR基因重排的淋巴细胞则属非T、非B细胞来源的瘤细胞。
二、限制酶切片段长度多态性组织配型法迄今,一直是血清学和细胞学方法进行HLA抗原结构分析,最近已开始应用分子生物学基因克隆技术进行HLA定型。
由于人们已常握了HLA共同和特异的抗原的核苷酸序列,才有可能用此新方法进行组织配型检验。
限制酶切片段长度多态性(restriction fragment length polym orphism,RFLP)组织配型技术的原理是目前已掌握了编码HLA抗原的核苷酸序列,包括各等位基因共有的和专有的序列。
淋巴瘤基因克隆性重排检测

1-5年
9.2-18.9年
OS
3.2-10年
17.9-25.8年
预后
不良
良好
PFS:无进展生存期(Progression free survival) OS:总生存期(Overall survival)
IGH V区的SHM状态检测被推荐为新诊断CLL患者预后分析的生物标志物。
专注分子诊断 | 引领精准医学
22q11
专注分子诊断 |
蛋白 TCRα TCRβ TCRγ TCRδ
引领精准医学
基因
TRA TRB TRG TRD
染色体定位 14q11 7q32 7p15 14q11.2
多样性与克隆性
正常淋巴细胞成熟过程/良性病变 多克隆性
多种形式的基因重排
恶性淋巴瘤发生的过程
单克隆性
突出单一形式的基因重排
IGH, TRB & TRD: V, D, and J IGK, IGL, and TRG: V and J regions
专注分子诊断 | 引领精准医学
淋巴细胞克隆性基因重排检测产品特点
1
BIOMED-2唯 一授权的商品
化试剂
2
3
4
5
全面涵盖各种 T\B细胞重排类
型
超过400例的临床样本 验证,反应体系稳定,
结果可靠
可疑淋巴组织增 最丰富的阳性
生性疾病克隆性
对照
分析的“金标准”
Focus On Molecular Diagnosis | Leading Precision Medicine
预后分层
CLL/CLL TLGL ALCL DLBCL WM/LPL
FL MCL PTLD SMZL
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
T细胞性淋巴瘤诊断中TCR基因重排检测的应用潘鑫艳;杨长绍;黎贵芸;杨举伦;王丽【摘要】目的:探讨T细胞受体( T cell receptors, TCR)基因重排检测对T细胞性淋巴瘤诊断的价值。
方法收集T细胞性淋巴瘤30例和淋巴反应性增生组织30例,提取DNA,应用BIOMED-2引物系统中的56条引物进行PCR扩增,核酸分子异源双链凝胶电泳分析结果。
结果30例T细胞性淋巴瘤标本中TCRβ、TCRγ、TCRδ的检出率分别为83.3%(25/30)、93.3%(28/30)、13.3%(4/30),三者联合检测的检出率为96.7%(29/30),30例淋巴反应性增生组织中均未检测出TCR 基因重排。
结论利用BIOMED-2引物系统检测TCR 基因重排可作为T细胞性淋巴瘤的辅助诊断工具。
%Purpose To discuss the TCR gene rearrangements in the diagnosis of T-cell lymphomas. Methods Formalin-fixed and paraffin-embedded samples including 30 cases of T-cell lymphomas and 30 cases of reactive lymphoid hyperplasia were chosen for ex-tracting genomic DNA and PCR amplification using 56 BIOMED-2 primers. PCR products were analyzed by heteroduplex and polyacryl-amide gel electrophoresis. Results In all 30 cases of T-cell lymphomas, 25 cases (83. 3%) showed TCRβ gene monoclonal rear-ran gements, 28 cases (93. 3%) of TCRγ gene monoclonal rearrangements, 4 cases (13. 3%) of TCRδ gene monoclonal rearrange-ments. 29 cases (96. 7%) with TCRβ+TCRγ+TCRδ gene monoclonal rearrangements were detected. but no clonal TCR gene rear-rangements were found in 30 cases of reactive lymphoid hyperplasia. Conclusions The detection of TCR gene rearrangements using BIOMED-2 primers is a useful assistant method for the diagnosis of T-cell lymphomas.【期刊名称】《临床与实验病理学杂志》【年(卷),期】2015(000)004【总页数】4页(P400-403)【关键词】T细胞性淋巴瘤;基因重排;BIOMED-2;TCR基因【作者】潘鑫艳;杨长绍;黎贵芸;杨举伦;王丽【作者单位】成都军区昆明总医院病理科,昆明 650032;成都军区昆明总医院病理科,昆明 650032;成都军区昆明总医院病理科,昆明 650032;成都军区昆明总医院病理科,昆明 650032;成都军区昆明总医院病理科,昆明 650032【正文语种】中文【中图分类】R733.4非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)包括B细胞性淋巴瘤(B-cell lymphoma)和T细胞性淋巴瘤(T-cell lymphoma),因T细胞性淋巴瘤种类繁多,分类复杂,病理诊断较难。
某些T细胞性淋巴瘤的诊断单凭HE和免疫组化染色很难明确性质,给临床病理工作者带来了一定困难。
自1985年Mullis首创PCR扩增技术以来,由于PCR技术具有简便、经济、省时、敏感、高效、易自动化等优点[1],很快被应用于B、T细胞性淋巴瘤的Ig和T细胞受体(T cell receptors,TCR)基因的诊断。
本实验运用BIOMED-2引物系统[2]分析T细胞性淋巴瘤的TCR基因重排,探讨TCR基因重排在T细胞性淋巴瘤分型分类和鉴别诊断中的临床应用价值。
1.1 材料收集2011~2013年解放军成都军区昆明总医院病理科存档的T细胞性淋巴瘤标本30例,另收集淋巴反应性增生组织30例作为对照组。
所有标本均经两位病理医师分析确诊,采用WHO(2008)造血和淋巴组织肿瘤分类标准对上述30例T细胞性淋巴瘤进行分类[3],包括外周T细胞淋巴瘤-非特殊类型13例;间变性大细胞淋巴瘤4例;血管免疫母细胞性T细胞淋巴瘤4例; EB病毒(epstein-barr virus,EBV)阳性的NK/T细胞淋巴瘤2 例; T淋巴母细胞性淋巴瘤2例;皮下脂膜样T细胞淋巴瘤2例;肠病型T细胞淋巴瘤2例;皮肤T细胞淋巴瘤1例。
1.2 主要试剂BIOMED-2引物序列(深圳华大基因公司);50 bp Marker6×Loading buffer、2. 5 mmol/L dNTP Mixture(天根生化公司); DNA提取试剂盒QIAamp DNA FFPE Tissue Kit(德国QIAGEN公司); rTaq DNA聚合酶、10×PCR buffer(Takara公司)。
1.3 石蜡样本基因组DNA提取为保证无交叉污染需采用新刀片或酒精擦拭消毒刀片,石蜡组织8 μm厚切片8~10张,并放于1. 5 ml灭菌EP管中,经脱蜡、脱二甲苯后置于56℃恒温器中干燥。
DNA提取试剂盒(Cat. 56404)提取石蜡标本的基因组DNA,并通过NanoDrop2000紫外分光光度计测定所有样品DNA纯度和浓度。
1.4 引物设计TCR基因克隆性重排分析的56条引物全部从BIOMED-2引物系统中选取(表1)[2],该引物组合后用于检测TCRβ、TCRγ、TCRδ链,其中TCRβ分成TCRB-A、B、C 3组,用于检测Vβ-Jβ 和Dβ-Jβ; TCRγ检测Vγ-Jγ,包括TCRG-A、B两组; TCRδ检测Vδ-Dδ-Jδ。
同时还包含了5条内对照S引物,用于检测样本质量。
1.5 PCR扩增采用25 μl扩增体系:引物浓度0. 1 μmol/L,dNTP混合物浓度0. 2 mmol/L,10× PCR buffer,2个单位的rTaq DNA聚合酶。
PCR扩增条件:94℃预变性10 min; 94℃变性45 s,60℃退火45 s,72℃延伸90 s,循环40次;最后72℃延伸10 min,4℃保存。
1.6 异源双链核酸分析及聚丙烯酰胺凝胶电泳检测PCR产物于95℃加热5 min,4℃立即冷却1 h,使其快速随机复性,产生异源双链核酸分子。
上述产物经8%聚丙烯酰胺凝胶电泳检测,分子量标准采用50 bp Marker,电泳完成后,溴化乙锭染色3~6 min,紫外凝胶成像仪下观察重排结果。
1.7 基因重排结果判读若电泳条带边缘锐利、清晰明亮、且大小与BIOMED-2引物系统中阳性片段相符,则判读为单克隆重排,相反则为阴性。
采用BIOMED-2引物系统时必须注意引物设计中允许在特定的位置出现非特异性条带。
如TCRB-A(273 bp)、TCRB-B(221 bp、<150 bp)、TCRB-C(128 bp)、TCRD(90 bp)。
2.1 PCR扩增通过聚丙烯酰胺凝胶电泳进行TCR重排分析,所有扩增样品的内对照S、β-action及阳性对照均扩增出正确条带,表明提取的样品基因组DNA质量合格,并能满足PCR扩增条件和体系要求。
空白组和阴性对照组未出现任何条带,说明PCR扩增体系无污染。
上述结果证明本组30例样品的扩增结果完全合格。
2.2 TCR重排分析TCRβ、TCRγ、TCRδ的检出率分别为83. 3%、93. 3%、13. 3%,三者联合检出率为96. 7%。
对照组(30例淋巴反应性增生组织)均未扩增出任何TCR重排条带(表2,图1)。
TCR基因重排是指在T细胞性淋巴细胞发育过程中,T细胞基因组上彼此分离的基因片段通过DNA重组便可形成有效的TCR基因,进而表达抗原受体的过程。
恶性疾病(如恶性淋巴瘤或淋巴细胞性白血病)是由于在TCR基因重排过程的任何一个阶段产生了单克隆增生而引发的病变[4]。
αβ和γδ链组成了T细胞表面抗原受体分子TCR,约95%的外周T细胞TCR含有α和β两条链,二者均有C、V、J区,β链还含有D区。
δ和γ链组成了其余大部分的TCR分子,不表达β和α链的成熟外周T细胞,约占5%。
γ链的VJ和β链的VDJ片段决定了TCR的特异性,为识别环境中各式各样的抗原,γ和β链可通过DNA重排组成多种特异性不同的TCR分子[5]。
TCR基因按照特定的顺序发生基因重排: TCRδ基因最先发生,其次为γ基因,再者为β、α基因。
Moreau 等[6]报道TCRγ基因重排发生在几乎所有的TCR α/β T淋巴瘤中,而TCRβ基因重排发生在大部分TCRγ/δ T细胞淋巴瘤中,因此即便检测出TCRβ或γ基因重排也不能证明其来源于T细胞的γ/δ或α/β细胞。
由于α基因的结构比较复杂,而发育后阶段的T淋巴细胞中常缺失δ基因,因此,β和γ链常用来作为TCR重排克隆性分析。
检测DNA重排的“金标准”是Southern blot法,但该方法需要提取大量高质量的DNA分子,然而石蜡包埋标本DNA分子降解成小片段,限制该方法的应用[7]。
PCR法具有省力、省时、高效、快速等优点,同时对样本DNA的质量和数量要求低(可采用10%中性福尔马林固定的穿刺石蜡包埋标本),所以PCR法应用非常广泛,并逐渐替代淋巴瘤基因重排检测的“金标准”[8]。
由于TCR多样性导致淋巴瘤重排方式不尽相同,而以往采用的通用引物只能覆盖一部分重排,具有很大的局限性,假阴性率高,阻碍其在临床诊断中的应用。
研究表明TCRγ基因重排的阳性率仅为73. 3%[9],只有结合其他基因标志物共同检测,才能让检测更加精确。
因此,为规范化PCR分析技术和解决引物不完全等问题,2003年建立的BIOMED-2多重PCR引物系统[2],其中包括扩增效率可达86%的TCRβ引物,该引物含有绝大部分Vβ和Jβ功能性基因片段,即13个Jβ、2个Dβ 和23个Vβ。
TCRγ基因是TCR基因重排分析的另一个优选基因,其原因是TCRγ所包含的Jγ和Vγ基因片段数量相对较少,5个连接基因中分别有两组具有高度同源性,而且其可变区家族Ⅰ的7个Vγ片段也具有高度同源性[8]。
