压片机验证方案
压片机验证方案

目录一、验证概述 (1)二、验证组织机构和职责 (1)三.验证实施计划 (2)四、验证风险评估及范围 (2)五.验证内容 (2)六、验证异常情况处理 (4)七、验证总结 (5)八、再验证周期 (5)九、附件 (5)一、验证概述1.验证对象本次再验证的对象为:固体制剂2号车间PG30B型高速旋转式压片机, 旋转式高速压片机用以将各种颗粒原料压制成圆片及异形片,是适合批量生产的基本设备。
其结构为双压式,有两套加料装置和两套轮。
转盘上可装30副冲模。
压片时转盘的速度、物料的充填深度、压片厚度可调节。
机上的机械缓冲装置可避免因过载而引起的机件损坏。
机内配有吸粉箱。
通过吸嘴可吸取机器动转时所产生的粉尘,避免粘结堵塞,并可回收原料重新使用。
设备参数如下:2.验证目的本PG30B型高速旋转式压片机已通过验证并已投入使用,现由于固体制剂2号车间改造,设备移位且重新安装,根据《药品生产质量管理规范》(2010年版)和《设备确认管理规程》(SOP-CV-0003)的规定,为确保设备性能依然符合设计要求,应对该设备进行再确认。
3.依据标准《药品生产质量管理规范》(2010年版)《药品生产验证指南》(2003版)二、验证组织机构和职责三、验证实施计划1.方案起草审批年月日至年月日。
2.组织实施验证年月日至年月日整个验证过程实施。
3.出具报告年月日至年月日,收集验证数据,分析、评价并得出结论,报告批准归档。
四.验证风险评估及范围为保证设备确认有效开展,将依据风险评估的结果来确认本次确认的程度,评估过程采用头脑风暴工具,评估结论如下。
五.验证内容1.前期确认1.1.人员培训的确认为了执行本次确认,执行人员必须有资质并且熟悉验证内容与设备操作。
方案实施前,检查参与本确认的相关人员是否经过确认方案及相关标准操作规程的培训并考核合格,将确认结果记录在《人员培训检查确认记录》(附件1)中。
合格标准:参与本次确认的人员已经过方案及相关标准操作规程的培训,并考核合格。
旋转式压片机验证方案

ZP—124型旋转式压片机验证方案1 适用范围本方案适用于ZP-124型旋转式压片机的验证。
2职责设备动力科:负责验证方案的起草,并负责预确认、安装确认、运行确认的组织实施.生产车间:负责性能确认的组织实施。
质量部QC:负责按计划完成设备验证中的相关检验任务,确保检验结论正确可靠.QA验证管理员:负责验证工作的管理,协助验证方案的起草,组织协调验证工作,并总结验证结果,起草验证报告.质量部经理:负责验证方案及报告的审核。
质量总监:负责验证方案及报告的批准。
3内容3.1概述:该压片机是我公司三车间用于压片之用,是根据工艺要求将已制成的适宜药粉颗粒,通过加料器导入模孔,经上下冲模挤压而成所需形状的片剂。
一般通过调整充填深度以控制片重,通过调节片厚及压力以控制片剂硬度,通过适宜的物料处方及模孔间差异控制片重差异。
压片是片剂生产的一道关键工序,影响成品的片重差异、溶出度、硬度及外观。
因此必须对压片机进行验证,以确保产品质量稳定均一,符合GMP要求.依据《设备及公用系统验证规程》、《验证管理程序》、《设备使用说明书》。
预确认3.1.1目的:根据公司生产要求,选择与公司生产能力相适应的设备,确保所选设备能满足生产要求和GMP要求.3.1.2技术适用性及供货要求:3.1.2.1要选择适合本公司厂房(3。
6×3.4×2.7m3)及生产能力(≥5万片/h)需要的机型.3.1.2.2与药品接触部分材质应为不锈钢或其他符合医药卫生要求的材料,内表面光滑、平整。
3.1.2.3能有效的控制片重差异及片剂硬度。
3.1.2.4速度可调,调节过程中运行平稳,有吸尘系统.3.1.2.5可选用不同型号模具,压制设计不同形状片子。
3.1.2.6有进料自动控制装置,可调节下料速度。
3.1.2.7结构易清洗,无死角。
3.1.2.8设备操作方便、运行安全.3.1.2.9整个设备预确认过程应严格执行《设备前期管理程序》。
压片机验证

压片机验证XX药业有限公司验证文件一、ZP35A型旋转式压片机验证方案文头目录正文1验证目的本公司ZP35A型旋转式压片机一台,安装在固体制剂车间压片间,用于三七片、银翘解毒片、精血补片等片剂品种的压片。
本验证的目的是:确认本设备的设计、选型、安装符合要求,确定有关文件和资料符合GMP要求;并确认:①该设备能满足片剂压片生产的工艺的要求;②ZP35A型旋转式压片机的标准操作规程(SOP)。
2职责及工作内容2.1公司验证领导小组名单2.2职责和工作内容2.3项目验证小组:ZP35A型旋转式压片机验证小组2.3.1成员名单2.3.2职责和工作内容3设备基本情况3.1ZP35A型旋转式压片机为XX机械制造有限公司生产,具有自动旋转、连续冲压功能,可将颗粒状物料压制成圆形或异形状片设备名称:旋转式压片机设备编号:HSG0502017出厂编号:2003103规格型号:ZP35A生产厂家:XX机械制造有限公司出厂日期:2003.12供货厂家:XX机械制造有限公司到货日期:2004.6安装日期:2010.6使用部门:固体制剂车间工作间:固体制剂车间压片间维修部件:重要部件一年保修。
服务单位名称:XX机械制造有限公司主要技术参数:冲模个数:35个;产品产量:150000片/小时;压片直径:12mm;压片厚度:6mm;充填深度:15mm;工作压力:60kN;电源电压:380V;电机功率:3.00kW;电机频率:50Hz;外形长度:910mm;外形宽度:1120mm;外形高度:1650mm;产品净重:2150kg。
3.2工作原理ZP35A型旋转式压片机工作原理是采用容积计量方法,物料由真空上料器或提升式加料装置或人工将颗粒状物料送入料斗,然后经料斗口进入月形栅式加料器,经栅板使颗粒物料多次充入模孔。
再经过填充量装置,调节下冲头在模孔内的位置来改变模孔的容积,同时安装在加料器末挡位于计量装置上方紧贴于转台工作面的刮板,将模圈及转台工作面的颗粒刮平。
压片机清洁验证方案

*****药业有限公司ZP-35B型旋转式压片机清洁验证方案验证方案目录序号:小标题I、验证审批II、综述2.1 目的2.2适用范围2.3验证阶段2.4验证组织和职责III、相关文件IV、说明V、清洁验证的程序VI、偏差和变更控制的管理及验证I、验证方案审批起草审核批准II、综述2.1 目的:口服固体制剂(片剂)车间ZP-35B型旋转式压片机是生产克咳片、消炎止咳片等产品的设备,为防止因设备不清洁而导致交叉污染,确保产品质量。
对现行口服固体制剂车间ZP-35B型旋转式压片机清洁方法进行前验证,收集数据证明设备生产后按照相关清洁SOP清洁后,其清洁效果是否可达到生产要求。
2.2 适用范围2.2.1用于*****药业有限公司口服固体制剂(片剂)车间ZP-35B型旋转式压片机定期清洁验证。
2.2.2用于*****药业有限公司口服固体制剂(片剂)车间ZP-35B型旋转式压片机更换或清洁规程变更。
2.2.3用于*****药业有限公司口服固体制剂(片剂)车间新增更难清洁药品。
2.3 验证阶段:前验证2.4 验证组织和职责2.4.1 设立工艺验证小组,负责人及小组成员如下:验证负责人:小组成员:2.4.2验证小组:负责验证方案的起草、设计,经批准后组织执行,负责收集、整理验证数据,起草阶段性和最终结论文件,上报总负责人审批。
2.4.3 生产部:负责协调进行各项验证,负责报告试验结果,保证生产操作过程中,严格遵守批准生效的各种文件。
2.4.4 设备部:负责在公用系统、生产设备、设备维修及校正等各项工作中提供及可靠的支持和服务。
2.4.5 质量部:负责审核验证中的评价结果及结论。
负责生产过程中全面质量控制和质量保证,按标准规定取样、检验并及时报告检验结果。
III、相关文件3.1 确认洁净厂房验证已经完成。
3.2 确认口服固体制剂车间的空气净化系统、纯化水系统、动力系统等的验证已经完成。
3.3 确认口服固体制剂车间的生产设备验证已经完成。
PG26旋转式压片机验证方案

PG26旋转式压片机验证方案简介PG26旋转式压片机是一种常用于医药制药行业中的设备。
该设备具有高压、高效、高精度等特点,能够对药品进行良好的压制和成型处理。
采用该设备可以有效提高药品生产效率,应用范围广泛。
为了确保PG26旋转式压片机的正常运行和良好的性能表现,需要对其进行验证测试。
本文将介绍一种PG26旋转式压片机的验证方案,确保该设备在重要工序中能够稳定运行并且性能表现符合要求。
验证方案步骤一:设备准备在进行PG26旋转式压片机性能验证之前,必须先确保设备正常、干净、无异味。
清除设备上的杂质和残留,防止对实验结果产生干扰。
步骤二:设备检查在正式进行PG26旋转式压片机性能验证之前,还需要检查设备的细节部位,确保设备不能出现丝毫问题。
1.检查设备是否处于平坦位置,并且设备刹车是否能够协调和有效的启动。
2.检查设备加油加脂是否到位,并且设备的主轴是否处于正确的方式和方位。
3.检查设备上的控制电源是否能够正常启动和工作,并检查仪表显示数据是否准确;步骤三:验证过程在完成以上两个步骤后,进入PG26旋转式压片机的验证过程。
1.确定压片机的最大和最小容量,按照使用要求将药物材料和配料加入上模具中,并将药片压缩成预设的形状和厚度。
2.重复进行多次压片操作,确保所有数据的准确性,并根据不同测试数据类型进行记录;3.将数据整理并进行分析,从中得出,判断设备的性能是否符合预定的规格。
验证结果及通过对PG26旋转式压片机的验证测试,所得到的验证结果如下:1.压片机的标准工作时,它的压制力均在设计范围内而且很稳定。
2.压片机在不同的压力、角度和速度上都可以正常工作,并没有出现任何异常。
3.在加压和减压过程中,压片机的控制信号响应良好,加压力和设定值之间具有很高的匹配度。
4.压片机的全自动、半自动和手动控制方式均可运作良好,响应灵敏。
,PG26旋转式压片机的性能表现符合规格要求,验证结果可靠,可以恰当地扩展到其他相似设备中,实验结果可以用来指导制药设备的使用与操作。
高速压片机验证方案

目录1 验证目的 (3)2 适用范围 (3)3 编写依据 (3)4 简述 (3)5 验证职责及小组成员 (4)6 验证计划 (5)7 培训确认 (5)8 设计确认 (6)8.1 目的 (6)8.2 检查记录 (6)9 安装确认 (7)9.1 目的 (7)9.2 检查记录 (7)10 运行确认 (9)10.1 目的 (9)10.2 合格标准 (9)10.3 运行前检查 (9)10.4 运行项目确认 (9)11 性能确认 (11)12 验证结果评定与结论 (11)1 验证目的通过设备验证,确认该设备是否符合设备设计参数及生产工艺要求,从设备方面为产品质量提供保障。
2 适用范围本验证方案适用于三车间GZPTS-75高速压片机验证。
3 编写依据《药品生产质量管理规范》2010年版《药品生产验证指南》2010年版4 简述GZPTS-Ⅱ75高速压片机为全自动高速旋转式双出料压片机,经上下预压轮和上下主压轮分两次将各种颗粒状原料压制成片。
旋转一周完成两次压片过程。
压片颗粒一般要求如下:药片重量为0.3g以下选择16-20目的粉粒:药片重量为0.3g以上选择10-14目的粉粒:颗粒含水量在1%-5%。
半固体粉粒、潮湿粉粒、细粉不能压片。
GZPTS-Ⅱ75高速压片机上部为全封闭的压片室,压片室与药粉接触的材料;金属为耐酸碱的奥氏体不锈钢,非金属材料为无毒无味材料。
四个透明门可全部打开,使机器清洁无阻碍,更换冲具方便。
机器下部由四扇内粘隔音材料的不锈钢门封闭,内装主传动、循环润滑系统、干油润滑系统、稀油润滑系统、液压系统等,座体上安装下部导轨和下预压轮主压轮机构,压片过程由充填、定量、预压、主压、出片五道工序完成。
压片机的操作由触摸屏功能键完成。
上部导轨由六块导轨组成个连续曲线形成的,提升导轨为双轨。
上下主压轮安装在上下压臂上,通过手轮及蜗轮蜗杆减速机的驱动下,下压臂可上下运动,从而实现增压与卸压。
转动平移手轮使上下压臂位置改变,即上下主压轮同时位移,它可以改变压片在中模中的位置。
压片机验证方案范文

压片机验证方案范文一、背景介绍:压片机是一种常见的制药设备,用于制作片剂。
在制药过程中,对压片机的验证十分重要,以确保其工作性能符合要求,保证产品质量的稳定性和一致性。
二、验证目的:验证压片机的目的是确保其性能符合相关规范和标准要求,验证过程需要对压片机的关键参数进行测试和验证,以保证其在实际应用中的稳定性和可靠性。
三、验证步骤:1.确定验证计划:根据产品特性和根据GMP指导原则,确定验证计划和验证内容,并编制验证方案和验证报告。
2.准备验证样品:按照产品要求制备符合配方要求的样品。
3.进行初始检查:对压片机进行全面检查,包括外观、尺寸、工作环境等方面的检查,确保设备满足要求。
4.进行性能验证:根据验证计划,进行性能验证,包括以下内容:-压片机参数验证:对压片机的压力、速度、温度和湿度等参数进行测试和验证。
-压片机表面温度验证:使用合适的温度计或红外线测温仪对压片机表面进行温度测量,并比较结果与规范要求。
-压制质量验证:对压制的样品进行重量、硬度、厚度等方面的测试和验证,以确定其质量是否符合要求。
-执行工艺验证:根据验证计划,按照标准工艺要求对压片机进行测试和验证。
-切割质量验证:对切割后的片剂进行质量测试和验证,包括重量、硬度、厚度、断裂强度等方面的测试。
5.进行可靠性验证:进行长时间运行测试和验证,以确保压片机在实际工作环境下的可靠性和稳定性。
6.编制验证报告:根据验证结果编制验证报告,汇总验证过程和结果,包括验证方法、数据、结论等内容。
四、验证记录和数据处理:在验证过程中,需要对每个验证步骤进行记录,包括验证内容、验证方法、验证结果等,确保数据的准确性和可追溯性。
验证结果应进行统计和分析,以判断压片机的性能是否符合预期。
五、验证结果和结论:根据验证结果,判断压片机的性能是否符合要求,如果发现问题或不符合要求的情况,应及时采取纠正措施并重新进行验证,直到达到要求为止。
根据验证结果,可以得出验证结论,并作出相应的改进和调整。
高速压片机验证方案

高速压片机验证方案目录1.2概述1.3验证目的:1.4验证依据及采用文件2.预确认3.安装确认3.1安装确认的目的3.2安装确认项目及方法3.2.1安装分环境、位置3.2.2主要技术参数的确认3.2.3主要技术参数的确认3.2.4公用介质连接3.2.5仪器仪表的校验4.运行确认4.1运行确认的目的4.2运行确认的方法4.2.1开机停机检查5.性能确认5.1性能确认的目的5.2性能确认的项目及方法5.2.1负载运行状况检查6.操作、清洗、装拆、保养情况测试7.验证周期1.1.1验证小组人员1.1.2验证小组责任验证小组组长—负责方案起草、方案实施全过程的组织和验证报告。
验证小组组员—分别负责方案实施中安装确认部分和运行、性能确认部分具体工作。
1.1.3验证工作中各部门责任验证领导小组—组织编写验证方案,领导协调验证项目的实施,协调验证领导小组一及专家组的工作,对维过程的技术、质量负责,参加验证方案的会签、终审和批准,参加验证报告的批准。
生产技术部—组织实施验证方案,参加会签验证方案、验证报告,收集验证资料、数据并记录。
质量保证部—负责组织验证方案、验证报告、验证结果的会审会签;负责对验证全过程实施监控。
负责验证的协调工作,以保证本验证方案规定项目的顺利实施;负责建立验证档案,及时将批准实施的验证资料发存归档。
质量控制部—负责验证过程的取样、检验、测试及结果报告,起草有关的检验规程和SOP。
设备部—确保验证过程的设备、仪器仪表的调试与校正,保证验证设备的完好运行,为验证过程中提供有关的技术服务。
供应部—为验证过程提供物质支持。
1.2概述GZPS系列高速压片机为全自动高速旋转式压片机,经一对预压轮一对主压轮两次将各种颗粒状原料压制成片。
GZPS系列压片机上部为全封闭的压片室,压片室与药粉接触的材料金属为耐酸碱的奥氏体不锈钢,非金属材料为无毒材料。
压片过程由充填、计量、预压、出片五道工序完成。
压片面的操作由电控柜上方的四个(三个)手轮和操作面板完成(带PC的机器也可在PC屏上操作)。
GZPL-28C高速旋转压片机清洗再验证方案

GZPL-28C高速旋转压片机清洗再验证方案验证编号:验证类型:生效日期:验证方案审批表验证方案会签单目录1.验证机构成员及工作职责1.1验证领导小组1.2验证小组2.引言2.1概述2.2验证目的2.3验证范围2.4验证前的确认3. 验证内容3.1相关条件的确认3. 2验证步骤3.3验证合格标准4.验证过程异常情况及偏差处理5. SOP的修订6.验证总结7.拟定再验证周期8.评价与建议9.验证领导小组审核批准1.验证机构成员及工作职责1.1验证领导小组成员及职责1.2验证小组成员及职责2.引言2.1概述压片机上残留的药粉、清洁剂等在药品生产中会造成污染及交叉污染,其清洁度即清洗效果直接影响产品质量,设备与药品直接接触的部位依次用饮用水、纯化水清洁后用75℅乙醇溶液进行消毒。
目前使用本设备的品种为盐酸吡格列酮片。
2.2验证目的验证GZPL-28C型高速旋转压片机清洁程序的可行性,评价水溶性成分在整个设备内表面(或与物料所接触部位)的潜在残留量和微生物污染情况,以保证药品的生产是在符合GMP要求的情况下生产的。
使用该设备生产产品时没有来自上批产品及清洗过程所带来污染的风险,从而给患者提供安全、纯净、有效的药品。
2.3验证范围:GZPL-28C型高速旋转压片机清洁程序的再验证。
2.4验证前的确认2.4.1人员资格审查与方案培训的确认固体制剂车间、设备部、QA、QC相关人员的职工健康档案、职工培训确认,并对本验证方案进行培训。
2. 4.1. 1 审查项目、审查方法、存放地点2.4.1. 2 将审核结果记录下表:2.4.2验证所需文件的确认2.4.2.2将审核结果记录下表:3.验证内容3.1相关条件的确认固体制剂车间进行生产后,实施本次验证。
3.2 验证步骤3.2.1 标志药物的选择压片机主要品种生产情况目前,该设备只生产盐酸吡格列酮片,因此选择盐酸吡格列酮作为此次清洁验证的标志药物。
3.2.2 残留量最大限度标准计算依据:按照前一品种最小日剂量的1/1000(也是下一品种最大日剂量中允许上一品种残存的量)对人体不产生药理反应为原则,以盐酸吡格列酮片换产盐酸吡格列酮片进行残留量限度计算。
旋转式压片机设备验证方案模板
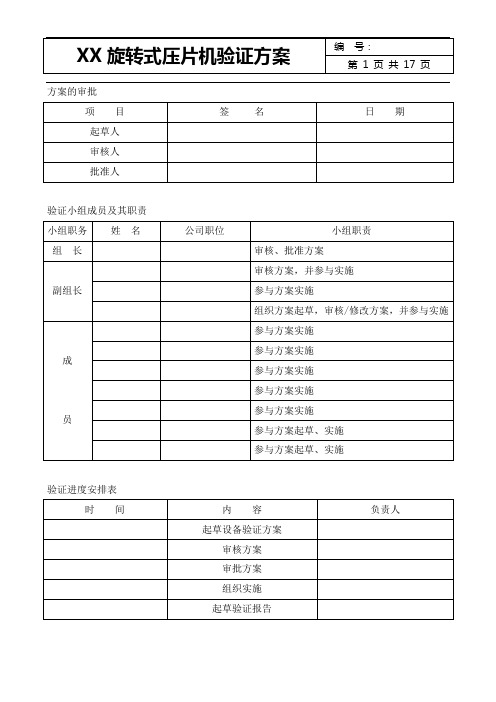
方案的审批验证小组成员及其职责验证进度安排表目录一、概述1 验证目的2 验证范围3 相关文件4 验证条件5工艺流程图二、验证内容1 预确认2 安装确认3 运行确认4 性能确认三、综合分析与总体评价四、结论五、再验证计划六、确立文件七、审批意见八、验证证书九、附表一、概述本机传动链:电动机(由变频仪无级调整)-带轮传动-蜗杆传动-由主轴带动转台旋转。
本机的制片工艺流程为加料、充填、压片和出片,由四道程序连续进行。
本机工作时,转台带动37付冲模作顺时针运转,上下冲模沿曲线导轨作升降运动,并通过压轮来完成压片。
上下压轮装置采用切线磨擦,有利于减少磨擦,降低功率损耗。
压力轮安全卸荷装置由弹簧平衡,其作压力弹簧套调整,超压时会自动卸荷。
同时,指示灯显示过载并自动停机。
这样有利于稳定,减少冲击,起到保护冲杆的作用。
充填、片厚和转速等部分结构实行集中控制,易于操作。
本机采用封闭式浸油润滑的蜗轮传动,以减少润滑油损耗,延长蜗杆蜗轮使用寿命。
本机的外围部件采用全封闭结构,又使密封的压制室和驱动结构完全分开,可防止粉尘飞扬且避免了油污的污染。
本机配置单独高效吸尘设备,由于吸尘效率高,确保机器正常运转。
1 验证目的为了保证xx旋转式压片机的安装和运行符合制造厂和公司的规定标准和使用要求,本方案制定了该设备的验证范围和方法。
验证结果用于确认该设备的安装和运行是否符合生产要求和GMP要求。
2 验证范围本方案适用于本公司压片岗位的ZP37 D旋转式压片机的安装确认、运行确认和性能确认。
3 相关文件4 验证条件本设备涉及到的厂房与设施、公用系统等验证工作已完成,安装在设备上的仪表、仪器以及本次验证工作检测用的仪器、仪表校验已完成。
仪器、仪表校验情况记录于下表中:5 工艺流程图:二、验证内容1 预确认1.1 验证目的考察设备的主要性能参数是否适合生产工艺、维修保养、清洗要求。
1.2 验证方法收集该设备的相关技术资料,按图样及技术要求对机器进行标准检查。
zpy35e型旋转式压片机验证方案及报告

zpy35e型旋转式压片机验证方案及报告以zpy35e型旋转式压片机验证方案及报告为标题一、引言在制药工业中,压片机是一种常用的设备,用于将药粉或颗粒压制成片剂。
本文将介绍zpy35e型旋转式压片机的验证方案,并撰写验证报告。
二、zpy35e型旋转式压片机验证方案1. 验证目的验证zpy35e型旋转式压片机的性能参数是否符合规定要求,确保其在生产过程中的稳定性和可靠性。
2. 验证方法2.1 设备准备准备好zpy35e型旋转式压片机,根据设备说明书进行正确安装和调试。
2.2 验证参数根据相关标准和规范要求,选择合适的验证参数,包括压力、转速、出片速度、片剂硬度等。
2.3 验证步骤按照以下步骤进行验证:(1) 调整设备参数:根据验证参数要求,调整压力、转速等参数。
(2) 准备样品:准备好符合要求的药粉或颗粒样品。
(3) 进行压片:将样品放入压片机的模具中,启动设备进行压片。
(4) 测量结果:根据要求测量片剂硬度、重量等参数。
(5) 分析结果:对测量结果进行分析和比对,判断设备性能是否符合要求。
2.4 验证记录在验证过程中,记录每一步的操作、参数设置和测量结果。
确保验证过程的可追溯性和准确性。
三、zpy35e型旋转式压片机验证报告1. 设备信息zpy35e型旋转式压片机是一种用于制药工业的压片设备,具有高效、稳定的特点。
2. 验证结果经过验证,zpy35e型旋转式压片机的性能参数符合规定要求,具体验证结果如下:(1) 压力:根据验证要求,设备在不同压力下进行压片,结果表明压力控制精度良好,符合标准要求。
(2) 转速:验证结果显示设备的转速稳定,无明显波动,符合规定范围。
(3) 出片速度:经验证,设备的出片速度符合标准要求,保证了生产效率。
(4) 片剂硬度:测量结果表明,片剂硬度均匀一致,符合要求。
3. 结论经过验证,zpy35e型旋转式压片机的性能参数符合规定要求,具备稳定性和可靠性,适用于生产过程中的药片压制工作。
旋转式压片机验证方案

旋转式压片机验证方案1. 引言旋转式压片机是一种用于压制片剂的设备,其中压片制剂的质量对于药品的安全性和有效性至关重要。
为确保旋转式压片机的准确性和性能,验证方案必不可少。
本文将介绍一种旋转式压片机的验证方案,以确保其符合药品生产的质量要求。
2. 验证目标验证方案的主要目标是验证旋转式压片机的性能和功能是否符合预期和规定要求。
具体而言,我们需要验证以下方面:2.1 压片压力准确性旋转式压片机应能以准确的压力压制片剂。
验证方案将包括对压力传感器的测试,以确保其输出准确性和一致性。
2.2 压片速度准确性验证方案还将测试旋转式压片机的压片速度是否符合预定要求。
这将涉及对旋转装置的测试,以确保其旋转速度稳定且一致。
2.3 压片均匀性压片均匀性对于片剂质量的均一性至关重要。
验证方案将通过检测多个压制周期中的片剂厚度来评估压片机的均匀性。
2.4 压片机清洁性能旋转式压片机应具备良好的清洁性能,以确保在不同批次药物生产之间的无交叉污染。
我们将验证清洁过程是否能够完全清除之前批次药物的残留。
3. 验证方法为了实施上述验证目标,以下是我们提出的验证方法:3.1 压力准确性验证1.使用标准压力计工具进行压力传感器的初步测试。
记录测试结果并与压片机的压力传感器读数进行比较。
2.针对压力传感器的读数进行多次测试,并记录测试结果。
对测试结果进行统计分析,以评估压力准确性。
3.2 速度准确性验证1.测量旋转式压片机的旋转装置并记录其实际旋转速度。
2.对多个运行周期进行速度测试,并记录测试结果。
对测试结果进行统计分析,评估速度准确性。
3.3 压片均匀性验证1.使用厚度测试仪对多个压制周期中的片剂进行厚度测量。
记录测量结果并进行统计分析。
2.通过比较测量结果的变化来评估压片机的均匀性。
3.4 清洁性能验证1.运行压片机并生产一批药片。
2.将压片机进行清洁,并采集清洗过程中的样品。
3.对样品进行药物残留分析,确保残留物的浓度低于指定的限度。
ZP37B压片机验证方案

武汉长江巨龙药业有限公司ZP-37B型旋转式压片机验证方案文件编号:TS-VM/E-1032-00武汉长江巨龙药业有限公司验证文件类别:验证方案编号:TS-VM/E-1032-00 ZP-37B型旋转压片机证方案版次:□新订□替代:起草:年月日审阅会签:批准:年月日实施日期:年月日文件编号:TS-VM/E-1032-00文件名称:ZP-37B型旋转压片机验证方案目录1、概述2、预确认3、安装确认4、运行确认5、性能确认6、结果分析评价及建议7、最终批准文件编号:TS-VM/E-1032-00文件名称:ZP-37B型旋转压片机验证方案1、概述1.1 设备编号:S-II-86设备型号:ZP-37B型生产厂家:上海天合制药机械有限公司使用部门:口服固体车间ZP-37B型旋转式压片机工作原理是采用容积计量方式,物料由真空上料器或提升式加料装置或人工将颗粒状原料送入料斗,然后经料斗进入月星栅式加料器,经栅板使颗粒物料多次充入模孔。
再经过填充量装置,调节下冲头在膜孔内的位置来改变模孔的容积,同时安装在加料器末挡位于计量装置上方紧贴于转台工作面的刮板,将模圈及转台工作面的颗粒刮平。
然后,上下冲借助凸轮,使上下冲头进入模孔。
经上下压轮压片成型。
最后下冲杆借助下凸轮上升,将片剂顶出模面。
1.2验证目的通过对该设备进行验证,确认该设备是否符合设计要求和我公司生产工艺的要求,文件资料是否符合GMP要求。
1.3验证小组人员1.4文件检查所需的各种文件。
文件编号:TS-VM/E-1032-00文件名称:ZP-37B型旋转压片机验证方案2、预确认2.1预确认内容产品型号是否为选定机型,其性能指标是否满足生产工艺需要。
供应商是否按照公司要求的技术参数供应设备,供应商提供技术支持能力情况。
设备材质及设计是否满足GMP要求。
2.2结论生产部:质管部:日期:年月日3、安装确认ZP-37B型压片机的安装以及环境温湿度符合设计要求,从而保证设备运行符合设计要求和工艺标准。
压片机验证方案

生药0911 第五组
目录
• • • • • • • • • 目的 适用范围 验证小组组成及职责 安装确认 运行确认 性能确认 评估与建议 验证报告汇签表 验证批准
目的
• 根据公司生产要求,选择与公司生产能力 相适应的设备,确保所选设备能满足生产 要求和GMP要求。
适用范围
• 本方案适用于ZP-124型旋转式压片机的验 证。
经验证,同意“旋转式压片机投入使用”。 批准人:职务 验证委员会主任 签名:
日期:
验证小组组成及职责
• 设备动力科 设备动力科:负责验证方案的起草,并负责预确 认、安装确认、运行确认的组织实施。 • 生产车间:负责性能确认的组织实施。 • 质量部QC 质量部QC QC:负责按计划完成设备验证中的相关检 验任务,确保检验结论正确可靠。 • QA验证管理员 QA验证管理员 验证管理员:负责验证工作的管理,协助验证方案的起草,组织协调验证工作,并总结验证 结果,起草验证报告。 • 质量部经理 质量部经理:负责验证方案及报告的审核。 • 质量总监 质量总监:负责验证方案及报告的批准。
技术适用性及供货要求
1、要选择适合本公司厂房(3.6×3.4×2.7m3)及生 产能力(≥5万片/h)需要的机型。 2、与药品接触部分材质应为不锈钢或其他符合医药 卫生要求的材料,内表面光滑、平整。 3、能有效的控制片重差异及片剂硬度。 4、速度可调,调节过程中运行平稳,有吸尘系统。 5、可选用不同型号模具,压制设计不同形状片子。 6、有进料自动控制装置,可调节下料速度。 7、结构易清洗,无死角。 8、设备操作方便、运行安全。 9、设备预确认过程应严格执行《设备前期管理程序》
评估与建议
1、该设备应按批准的标准操作、维护保养程 序进行操作、维护和保养. 2、再验证 2.1 该设备应在当前验证的条件下使用,使 用 条件发生变更,应报验证委员会审核, 必要时重新验证. 2.2 该设备一年再验证一次.
旋转式压片机验证方案

设备验证方案***型旋转式压片机起草人:起草日期:--------审核人:审核日期:-------- 批准人:批准日期:--------目录一、引言验证小组人员及责任概述验证目的验证依据及采纳文件1.5验证标准1.6验证文件预备二、验证方案预确认设计确认安装确认运行确认性能确认3、结果分析及评判4、设备验证评定报告5、验证合格后批准的正式文件6. 再验证7.验证小组评判与建议1、引言1.1.验证小组人员及责任1.2概述设备生产厂家:型号:本公司设备编号:压片机是片剂生产的重要设备,本机采纳变频调速,由电机通过三角带轮﹑电磁聚散器﹑传动蜗杆﹑蜗轮,使转盘按顺时针方向旋转。
转盘上装有41副冲模,与一般冲压片机相较,有以下特点:每副冲模沿上下曲线导轨作起落运动,经压轮等机构,能持续完成加料﹑填充﹑压片﹑出片等一系列工艺流程。
本机不适用于半固体,潮湿颗粒和粉末原料。
本机可压制φ13mm以下的圆形片,上冲杆装定向键后,还可压制相应尺寸的异型片。
本机为双压式,即每旋转一周可完成二次工作循环,从而提高了设备的工作效率。
高速回转部份及着力机构均采纳转动磨擦,减少磨损,降低功率花费,增加机械利用寿命。
整机属全封锁式,在工作台周围别离装上有机玻璃门,并设有双口吸粉嘴,其涡轮、涡杆等传动机构均密封在机械内部浸油润滑运转,既维持了机件内部清洁,同时也完全排除对片剂及工作环境的污染,确保符合GMP要求。
为确保本公司***型旋转式压片性能够知足生产工艺要求,依据《***型旋转式压片机验证程序》对设备的安装、运行、性能进行确认,并对该设备的再验证规程进行了评判。
该设备适用于将各类颗粒物料压制成圆形片剂,是制药工业片剂生产的大体设备之一,本公司用该设备作为片剂压片设备。
要紧技术参数检查并确认设备安装是不是符合要求,资料和文件是不是齐全并符合的治理要求。
依照设备操作规程对设备进行足够的空载运行以确保该设备能在要求范围内准确运行,并达到规定的技术指标。
GZPT-45 高速压片机验证方案

1/30福建广生堂药业股份有限公司Fujian Cosunter Pharmaceutical Co., Ltd.文件使用类型:项目姓名/职位日期签名人员起草人贾永滨/设备部部长审核人林心镇/生产负责人批准人曾炳祥/质量受权人序号部门名称部门负责人1 质量部方中海2 设备部贾永滨3 生产部巫建新2/30福建广生堂药业股份有限公司Fujian Cosunter Pharmaceutical Co., Ltd.文件变更列表版本号变更日期变更内容摘要3/30福建广生堂药业股份有限公司Fujian Cosunter Pharmaceutical Co., Ltd.目录1、产品概述 (4)2、验证目的 (6)3、验证职责 (6)4、验证培训 (7)5、验证计划实施日期 (7)6、设计确认 (8)7、开箱验收 (8)8、安装确认 (9)9、运行确认 (9)10、性能确认 (10)11、拟定日常监测程序及验证周期 (13)12、验证结果评定与结论 (13)13、验证报告与会签、入档 (14)14、附件 (14)4/30福建广生堂药业股份有限公司Fujian Cosunter Pharmaceutical Co., Ltd.1、产品概述1.1 GZPT系列全自动高速旋转式压片机是根据国内市场要求,自行开发的新产品。
主要用于制药行业,亦可用于化工、食品、电子、冶金、日用品等行业。
它可以将各种颗粒状原料制成圆形片、异形片、图形片、双面刻字片等。
生产厂家:辽宁天亿机械有限公司设备型号:GZPT45生产时间:2011年6月安装位置:239压片间1.2设备主要技术性能指标1.2.1该及具有工控微机(PLC)程序自动化控制,具有国际先进水平的单片及批量自动剔废功能、自动控制药片重量、自动故障报警、彩色触摸屏、人机界面、操作界面中文显示等功能;1.2.2具有主压和预压大的液压系统,且液压系统连续自动保压;1.2.3具有稀油自动润滑系统,流量及间隔时间可调,润滑油不足可自动报警;1.2.4主电机、加料电机采用变频调速,产量连续可调,并带有上、下限控制功能;1.2.5上、下冲头过紧保护功能。
压片机清洁消毒验证方案

压片机清洁消毒验证方案编码:JH-YZ-015-R05方案起草:时间:年月日方案审核:时间:年月日方案批准:时间:年月日实施时间:目录1.概述2.验证地点3.验证时间4.验证目的5.验证小组成员6. 执行文件7.验证方案8.验证结果及评定9.验证周期10.批准11.设备的清洁消毒验证记录压片机清洁消毒效果验证方案1.概述:为了压片机的洁净,预防对生产产品的污染,制定了“三十万级洁净区设备的清洁消毒管理规程”“压片岗位操作法”经2008年2月验证,清洁效果符合规定,为了防止细菌产生耐药性并对此规定的清洁方法进行相应的再验证。
2. 验证地点:压片岗位3. 验证时间:二00九年二月六日至二00九年二月二十日4.验证目的:确认压片机按规定的清洁方法清洁,效果符合规定。
5.验证小组:组长:王秦涛组员:曹岱伟、杜孟菊、耿国柱、戴菊莹、李梅6.执行文件:6.1三十万级洁净区生产设备的清洁消毒管理规程6.2压片岗位操作法7.验证内容:7.1原理:将生产过甲芬那酸片的压片机按“三十万级洁净区设备的清洁消毒管理规程”及“固体制剂压片岗位操作法”要求进行,按更换品种时的清洁消毒方法进行清洁,消毒前、消毒后分别取样检测。
每一种消毒剂各做一次。
7.2合格标准为:7.2.1压片机的纯化终淋水pH值与纯化水相同。
7.2.2表面细菌数≤100CFU/25cm27.3取样点:压片机转盘下轨道表面、冲模表面。
7.4清洁消毒方法:将压片机按“固体制剂压片岗位操作法”吸尘器吸除转盘下转盘下轨道上的粉尘、料斗、刮粉器、冲头、冲模拆除送生产工具清洁间清洗,按“三十万级洁净区生产设备清洁消毒管理规定”要求先用0.2%碳酸钠溶液刷洗一次,用饮用水洗两次,再用纯化水冲洗两次,用75%乙醇溶液或0.2%新洁尔灭溶液擦洗消毒一次,5分钟后,用纯化水冲洗两次。
7.5取样方法:7.5.1取250ml烧杯接取冲模纯化水终洗水,按pH值测定法测定pH 值。
验证方案示例

验证方案示例验证方案示例PG40高速旋转式压片机验证方案编制签名职务日期备注审核签名职务日期备注批准签名职务日期备注北京国药龙立科技有限公司1 验证目的和范围1.1 目的:为了保证PG40高速旋转式压片机的安装、运行和性能符合制药公司的规定标准及使用要求,本方案制定了该设备的验证范围和方法。
确认结果用于确认该设备的设计、安装、运行和性能是否达到原设计标准和GMP要求。
1.2 本方案适用于制药公司生产单位压片岗位的PG40高速旋转式压片机的设计确认、安装确认、运行确认和性能确认。
1.3 设备概述1.4 工作原理1.5 冲盘的节圆冲孔中安装着上下冲杆及中模,上冲由一个连续凸轮引导,下冲由下拉凸轮、填充凸轮和出片凸轮引导,上下冲杆的尾部嵌在固定的曲线导轨上,当冲盘作旋转运动时,上下冲杆即随着曲线导轨作升降运动,并通过压轮的挤压作用达到压片的目的。
1.6 工艺用途和适用范围1.7 本机适用于含粉量(100目以上)不超过10%的颗粒状原料压片。
用于制造过程中的压片工艺。
本机适用于含粉量(100目以上)不超过10%的颗粒状原料压片。
1.8 设备组成1.9 主传动系统有大功率主电机、变频器、蜗轮减速器、主传动轴,冲压组合有冲盘组合、上下冲杆、中模、上下预压轮、上下主压轮、填充装置、上导轨盘、下导轨凸轮,配套装置有强迫加料系统、出片装置、吸尘系统、液压系统、润滑系统、手轮调节机构和电气控制柜等组成。
1.10 该设备全封闭,中冲盘为不锈钢材料,表面光亮,能防止交叉污染,符合GMP要求。
采用变频调速,操作方便,运行平稳。
配有过载保护装置,当压力过载时,能自动停机。
强迫充填,二次压力成型,电脑自动控制。
触模屏显示,参数设置,三菱PLC控制。
1.112 验证人员及职责姓名部门职务职责生产单位设备员起草方案,实施验证,起草报告生产单位保全工验证方案的实施,数据收集、统计生产单位电工检测电气线路、电动机运转状况生产单位设备主任审核验证方案、报告,作验证评价设备处管理员验证方案及结论的审核和批准质量处科长负责验证方案及结论的审核,并负责验证期间各项工作的协调设备处处长批准验证方案、验证报告3 设计确认设计确认主要是对设备的选型和订购的设备的技术规格、技术参数和指标适用性的审查,参照设备的使用说明书,考察它是否适合并符合生产工艺、校准、维修保养、清洗以及药典等方面的要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
压片机验证方案
PG30B型高速旋转式压片机安装、运行再确认方案
目录
一、验证概述 (1)
二、验证组织机构和职责 (1)
三.验证实施计划 (2)
四、验证风险评估及范围 (2)
五.验证内容 (2)
六、验证异常情况处理 (4)
七、验证总结 (5)
八、再验证周期 (5)
九、附件 (5)
一、验证概述
1.验证对象
本次再验证的对象为:固体制剂2号车间PG30B型高速旋转式压片机, 旋转式高速压片机用以将各种颗粒原料压制成圆片及异形片,是适合批量生产的基本设备。
其结构为双压式,有两套加料装置和两套轮。
转盘上可装30副冲模。
压片时转盘的速度、物料的充填深度、压片厚度可调节。
机上的机械缓冲装置可避免因过载而引起的机件损坏。
机内配有吸粉箱。
通过吸嘴可吸取机器动转时所产生的粉尘,避免粘结堵塞,并可回收原料重新使用。
设备参数如下:
设备名称型号设备编号安装位置
高速旋转式压片机PG30B ZZ-02-051 固体制剂2号车间压片间(2130)
2.验证目的
本PG30B型高速旋转式压片机已通过验证并已投入使用,现由于固体制剂2号车间改造,设备移位且重新安装,根据《药品生产质量管理规范》(2010年版)和《设备确认管理规程》(SOP-CV-0003)的规定,为确保设备性能依然符合设计要求,应对该设备进行再确认。
3.依据标准
《药品生产质量管理规范》(2010年版)
《药品生产验证指南》(2003版)
二、验证组织机构和职责
姓名职务小组职务职责
总负责人验证方案的审核、对验证报告进行批准
协调人验证方案、报告的审核,验证过程的协调
组员验证方案、验证报告文件的起草
组员验证方案、报告的审核,验证过程的协调
姓名职务小组职务职责
组员验证方案、报告的审核,验证过程的协调
组员验证过程的具体实施
组员验证过程的具体实施
三、验证实施计划
1.方案起草审批
年月日至年月日。
2.组织实施验证
年月日至年月日整个验证过程实施。
3.出具报告
年月日至年月日,收集验证数据,分析、评价并得出结论,报告批准归档。
四.验证风险评估及范围
为保证设备确认有效开展,将依据风险评估的结果来确认本次确认的程度,评估过程采用头脑风暴工具,评估结论如下。
序号风险点风险分析控制措施
1 人员培训方案实施人员不熟悉验证流程,验证实
施过程可能存在操作失误的情况,影响
整个验证结论。
验证方案实施前,对参与
实施的验证人员进行培
训,并考核合格。
2 文件资料验证方案涉及的文件、资料不全,导致
验证过程无依据或无操作指导文件,影
响验证过程的正确执行。
核查验证方案涉及的文
件资料是否齐全。
3 设备完好性设备经过3年的运行后,设备的稳固性,
安全性,设备外观,安装环境等,可能
存在漂移,对设备性能可能造成影响。
在安装确认时对设备的
安装状态,安装环境,
设备外观进行确认。
4 设备运行设备重新安装位移后,运转状态较出厂
时设备性能出现漂移。
在运行确认时将对设备
的整体运行情况进行再
确认。
五.验证内容
1.前期确认
1.1.人员培训的确认
为了执行本次确认,执行人员必须有资质并且熟悉验证内容与设备操作。
方案实施前,检查参与本确认的相关人员是否经过确认方案及相关标准操作规程的培训并考核合格,将确认结果记录在《人员培训检查确认记录》(附件1)中。
合格标准:参与本次确认的人员已经过方案及相关标准操作规程的培训,并考核合格。
1.2.支持性材料的确认
根据相关要求,核对设备编号,对PG30B型高速旋转式压片机的使用说明书、标准及操作规程等相关资料,将确认结果记录在《文件资料确认记录》(附件2)中。
合格标准:所有验证所需使用的规范、标准及操作规程齐全且为现行版本,满足验证需要和GMP的要求。
1.3.仪器仪表校准
本次确认所使用的仪器仪表均应经过校准,并在有效期内,校准范围应包含设备使用范围,校准证书应能溯源到国家标准。
将确认结果记录在《仪表检查确认记录》(附件3)中。
合格标准:检查所使用的仪器仪表校准证书,核实相关校准信息,确认校准有效期与校准范围均在范围之内。
2.安装确认
检查PG30B型高速旋转式压片机的使用说明书、的仪表及设备安装、电气等系统的连接、安装效果,确保设备安装符合设计及工艺要求。
将确认结果记录在《安装确认记录》(附件4)中。
项目评价标准检查方法
1. PG45S型高速旋转式压片机
电源电源条件:380V/50Hz/3P 用万用表检查
保护接地:电阻≤5Ω用欧姆表检查
安装位置与图纸位置一致,安装于固体制剂2号车间D
级的洁净室压片间(2130),四周空间足够,
便于操作与维修
现场目测
安装环境设备周围无其他设备产生的振动、电磁辐射影
响设备的运行,温度18-26℃,湿度45-65%
仪器检测
关键材质确
认直接接触药品的自动下料器材质应为304不
锈钢
检查材质证明
主机整机固定牢靠,安装稳固,设备安装水平现场检查设备外观机身、外罩无锈蚀,防锈漆涂敷层无剥落现场检查
电气控制柜电气柜和电气柜门密封良好,防尘土、防水等
防护措施
现场检查
润滑系统远离物料(药物),不直接影响产品安全。
现场检查
安全标识设置了明显警示标识,如高温,有电等。
现场检查
3.运行确认
设备接通电源,测试检查各机构运行状态,对设备进行运行效果整体检测,以确认设备运行正确、可靠,并能达到规定的技术指标和使用要求。
3.1设备运行情况确认
通过对PG30B型高速旋转式压片机控制系统及运行参数进行检查,确认PG30B型高速旋转式压片机控制系统灵敏有效,运行参数符合设计及生产工艺要求。
通过对PG30B型高速旋转式压片机进行空载操作,检查设备是否能够正常运行,具体项目、评价标准、检查方法见下表,将确认结果记录在《运行确认记录》(附件6)中。
检查内容评价标准检查方法
主机运行确认设备运转正常,无卡阻现象,无异常声响,检
查电、水、气、油系统无泄漏现象
现场检查调节“工作速度”上、下键,改变设备的运
转速度
现场检查主压力﹑预压力在可调范围给料装置工作正
常
现场检查冲模无缺边、裂缝和松紧合理现场检查螺栓、螺钉、螺母牢靠无松动现场检查
检查内容评价标准检查方法强迫加料器运行正常无杂音现场检查
吸尘柜开启吸风且可调节现场检查
筛片机表面无破损、运转无异常声响现场检查
控制系统功能
确认点击操作目录上的各功能键,能正确的进入相
应的界面
现场检查点击“机器参数,检查机器各系统是否正常,
并调节好各分系统工作参数
现场检查点击“手动加料”物料加料器运转现场检查设置“手动”运行调节素片填充量,待重量达
到要求后再转动片厚轮调节素片硬度
现场检查设置平均压力相对值和压力偏差相对值,再根
据平均压力设定单值上限和下限
现场检查设置自动运行,设定药品名称、批号、日期后
保存并开启筛片机。
现场检查当片重超过设置上限和下限值偏差时会报警现场检查
六、验证异常情况处理
1.偏差、OOS/OOT的调查
1.1.当检测结果异常时,按照《实验室超标、超常检验结果处理管理规程》(SOP-QM-0033)和《偏差处理管理规程》(SOP-QM-0017)的操作规程执行。
1.2.当验证过程出现偏离验证方案要求时,按照《偏差处理管理规程》(SOP-QM-0017)的操作规程执行。
2.方案变更的控制程序
当方案在执行过程中,发现方案内容或要求与实际执行情况不一致,需对原批准方案进行变更时,执行部门应填写《验证变更审批表》(REC-CV-0001-004),经质量管理部部长批准后执行。
七、验证总结
1.按照确认方案的内容认真核对和审查文件
1.1.检查主要的确认试验是否按计划完成。
1.2.重要试验结果的记录是否完整,对确认过程中异常情况是否有完整的调查、分析、处理,并将处理过程附入确认报告中。
1.3.确认过程中形成的相关记录由文件的起草人员负责收集整理。
2.验证结论
确认实施完成后应得出符合、部分符合或不符合验证标准的结论。
八、再验证周期
确认合格后,由验证实施小组根据确认结果确定再确认周期,并列入确认报告中。
九、附件
附件1 人员培训检查确认记录
附件2 文件检查确认记录
附件3 仪表确认记录
附件4 安装确认记录
附件5 运行确认记录
PG30B型高速旋转式压片机安装、运行再确认方案附件1
人员培训检查确认记录
附件2
文件检查确认记录
附件3
仪表检查确认记录
VP-30004-2015 Page 10 of 1 0
安装确认记录
附件5
运行确认记录。
