第7章电化学基础.
第7章 熔盐电解

7.1 概述
二、熔盐电化学的特点
(1)虽然熔盐也属于第二类导体,但其形成条件和 状态、结构都和水溶液大不相同。
(2)熔盐电解过程一般都在高温下进行,因此导致 熔盐电极过程在热力学及动力学方面都具有特点。 熔盐中,电极过程的分步骤都具有很高的速度,因 此电解可以采用很高的电流密度,达到105A/m2。 (3)同样是因为高温,产生了熔盐中金属与熔盐的 相互作用,导致金属的溶解,高温还会对电化学反 应器的材料和结构提出更高的要求。
粘度与密度一样,是熔盐的一种特性。粘度与熔盐及其混 合熔体的组成和结构有一定关系。粘度大而流动性差的熔盐 电解质不适合于金属的熔盐电解,这是因为在这种熔体当中, 金属液体将与熔盐搅和而难于从盐相中分离出来。此外,粘 滞的熔盐电解质的电导往往比较小。因此,在熔盐电解中, 需选择熔盐成份,使其粘度小流动性好,可保证熔盐电解质 导电良好并能保证金属、气体和熔盐的良好分离。
7.2 熔盐电解电化学基础 一、熔盐的结构
熔盐即盐类的熔体,主要由阳离子和阴离子构成,
由于热作用,由电解质熔融形成。
熔盐的“准晶格模型” 熔盐的结构介于固态与气态之间,并更接近于 固态,具有“近程有序,远程无序”的特点。 关于熔盐的结构模型有“空穴模型”、“细胞模 型”、“自由体积模型”等,但都不完整。
7.2 熔盐电解电化学基础 三、熔盐电化学热力学的特点
2、由于熔盐温度高,温度变化的区间大,电极电 位变化范围大,甚至可能导致相互位置的变化。 3、电极电位测量比较困难,缺少通用的参比电 极,因而不易确定共同的电极电位标度,所得的 数据也较难比较。
7.2 熔盐电解电化学基础 四、熔盐电极反应的特点
第七章 熔盐电解
7.1 概述 7.2 熔盐电解电化学基础 7.3 铝电解 7.4 镁的熔盐电解 7.5 碱金属的熔盐电解
第七章-氧化还原反应与电化学基础

§7.2 电化学电池
5. 正负极
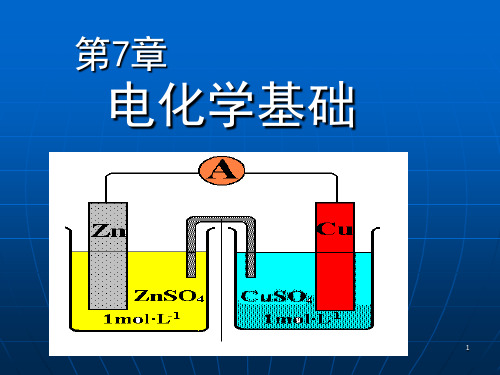
• 电子的流出极叫负极:Zn极 • 电子的流入极叫正极:Cu极
6. 阴阳极
• 阳极(Positive Electrode): 凡是进行氧化反应的电极叫阳极。
• 阴极(Negative Electrode): 凡是进行还原反应的电极叫阴极。
第七章 氧化还原反应与电化学基础
在超氧化物中(KO2),氧的氧化数 为 1 ;
2
在氧的氟化物(OF2,O2F2)中,氧的 氧化数分别为+2和+1。
❖ 在所有的氟化物中氟的氧化数为-1。
第七章 氧化还原反应与电化学基础
§7.1 基本概念
例:
SiO2: Si的氧化数为+4; Cr2O72-:Cr的氧化数为+6; Fe3O4: Fe的氧化数为 8 ;
Mz+(aq)+ze-
–
离子电极
2OH-(aq) Pt | O2(p)|OH-(c)
金属-难 溶盐电极
AgCl(s) +e-
Ag(s) +Cl-(aq) Ag|AgCl|Cl-
§7.3 电极电势
(Electrode Potential)
7.3.1 电极电势的产生 7.3.2 电极电势的意义 7.3.3 电池电动势 7.3.4 标准电极电势 7.3.5 标准电极电势表 7.3.6 Nernst方程式 7.3.7 Nernst 方程式的应用
MgCl2(s)
第七章 氧化还原反应与电化学基础
§7.1 基本概念
2. 失去电子的过程叫氧化,得到电子的
过程叫还原
Zn(s) Zn2+(aq)+2eCu2+(aq)+2e- Cu(s) 局限性:形成共价分子的氧化过程不
电化学基础-PPT课件

Cu
√E
F
M
N
CCuu2SS OO 44
酒精
N a C l溶 液
H 2SO 4 H 2SO 4
大家学习辛苦了,还是要坚持
继续保持安静
例2. 在盛有稀H2SO4的烧杯中放入用 导线连接的锌片和铜片,下列叙述正
确的是( D )
(A)正极附近的SO42 -离子浓度逐渐增大 (B)电子通过导线由铜片流向锌片
知识结构
电化学基础
氧化还 原反应
§1原电池
化学能转化 §3电解池
为电能,自
§2化学电源
发进行
电能转化为
化学能,外
§4金属的电化学腐蚀与防护 界能量推动
一、原电池原理
把化学能转变为电能的装置叫 原电池
要解决的问题: 1. 什么是原电池? 2. 原电池的工作原理? (电子的流向、电流的流向、离子的流向、形 成条件、电极的判断、电极反应的写法)
(1) 热敷袋使用时,为什么会放出热量? 利用铁被氧气氧化时放热反应所放出的热量。
(2)碳粉的主要作用是什么?氯化钠又起了什么作 用?碳粉的主要作用是和铁粉、氯化钠溶液一起
构成原电池,加速铁屑的氧化。 氯化钠溶于水,形成了电解质溶液。
(3)试写出有关的电极反应式和化学方程式。
负极:2Fe - 4e- = 2Fe2+ 正极:O2+2H2O + 4e- = 4OH总反应:4Fe+3O2+6H2O = 4Fe(OH)3
反应过程中产生臭鸡蛋气味的气体,原电池总反 应方程式为
3Ag2S+2Al+6H2O=6Ag+2Al(OH)3↓+3H2S↑
2.熔融盐燃料电池具有高的发电效率, 因而受到重视,可用Li2CO3和Na2CO3的 熔融盐混合物做电解质,CO为阳极燃气, 空气与CO2的混合气为阴极助燃气,制 得在650℃下工作的燃料电池,完成有关 的电池反应式:
《电化学基础》课件

电化学反应速率
总结词
电化学反应速率描述了电化学反应的快 慢程度,是衡量反应速度的重要参数。
VS
详细描述
电化学反应速率与参与反应的物质的浓度 、温度、催化剂等条件有关。在一定条件 下,反应速率可由实验测定,对于一些特 定的电化学反应,也可以通过理论计算来 预测其反应速率。
反应速率常数
总结词
反应速率常数是描述电化学反应速率的重要参数,它反映了电化学反应的内在性质。
详细描述
反应速率常数与参与反应的物质的性质、温度等条件有关。在一定条件下,反应速率常数可以通过实验测定,也 可以通过理论计算得到。反应速率常数越大,表示该反应的速率越快。
反应机理
总结词
电化学反应机理是描述电化学反应过程中各步骤的详细过程和相互关系的模型。
详细描述
电化学反应机理可以帮助人们深入理解电化学反应的本质和过程,从而更好地控制和优化电化学反应 。不同的电化学反应可能有不同的反应机理,同一电化学反应也可能存在多种可能的反应机理。 Nhomakorabea05
电化学研究方法
实验研究方法
01
重要手段
02
实验研究是电化学研究的重要手段,通过实验可以观察和测量电化学 反应的过程和现象,探究反应机理和反应动力学。
03
实验研究方法包括控制电流、电位、电场等电学参数,以及观察和测 量电流、电位、电导等电化学参数。
04
实验研究需要精密的实验设备和仪器,以及严格的操作规范和实验条 件控制。
01
02
03
电池种类
介绍不同类型电池的制造 过程,如锂离子电池、铅 酸电池、镍镉电池等。
电池材料
阐述电池制造过程中涉及 的主要材料,如正负极材 料、电解液、隔膜等。
大学无机化学-第七章-氧化还原反应-电化学基础-课件

种元素的原子总数各自相等且电荷数相等 ④ 确定两半反应方程式得、失电子数目的最小公倍
数。将两个半反应方程式中各项分别乘以相应的 系数,使得、失电子数目相同。然后,将两者合 并,就得到了配平的氧化还原反应的离子方程式。 有时根据需要可将其改为分子方程式。
3Cl2 (g) + 6OH- = 5Cl- + ClO3- + 3H2O 3Cl2 (g) + 6NaOH = 5NaCl + NaClO3 + 3H2O
无机化学
§7.1 氧化还原反应的基本概念
例 4 配平方程式
Cr(OH)3 (s) + Br2 (l) + KOH
K2CrO4 + KBr
Cr(OH)3 (s) + Br2 (l)
电极组成:Pt , Cl2(p) | Cl- (a)
电极反应: Cl2 + 2e
2Cl-
无机化学
§7.2 电化学电池
3. 金属-金属难溶盐-阴离子电极
将金属表面涂有其金属难溶盐的固体,然后浸 入与该盐具有相同阴离子的溶液中构成的电极
电极组成:Ag ,AgCl(s)| Cl- (a) 电极反应:AgCl + e Ag + Cl电极组成:Hg ,Hg2Cl2(s)| Cl- (a) 电极反应:Hg2Cl2+2e 2Hg +2Cl-
无机化学
§7.1 氧化还原反应的基本概念
2-2 半反应法(离子—电子法) 配平原则 (1)反应过程中氧化剂得到的电子数等于还
原剂失去的电子数 (2)反应前后各元素的原子总数相等
工学氧化还原反应电化学基础

7-1 氧化还原反应的基本概念 7-2 电化学电池 7-3 电极电势 7-4 电极电势的应用
知识回顾: 四大平衡
酸碱 氧化还 沉淀溶 络合反 平衡 原平衡 解平衡 应平衡
思考:
对于氧化还原反应:
7-1 氧化还原反应的基本概念
7.1.1 氧化值 Def:
属1。的氢化物(如NaH、CaH2、LiAlH4)中,氢的氧化值为★ 通常,在化合物中氧的氧化值为-2;但在过氧化物(如
HO22OF22中,,Na氧2O的2,氧B化aO值2)分中别氧为的+氧2和化+值1为。-1;而在OF2和 ★ 在所有氟化物中,氟的氧化值为-1。 ★ 碱金属和碱土金属在化合物中的氧化值分别为+1和+2。 ★ 在中性分子中,各元素氧化值的代数和为零。在多原
氧化值法 离子—电子半反应法(适用于有介质参与的复
杂反应)
配平氧化还原反应方程式的基本原则:
电荷守恒 质量守恒
下面分别用酸性溶液和碱性溶液中的氧 化还原反应为例介绍离子-电子法的配平步骤。
配平酸性溶液中的反应:
KMnO4 K2SO3 H MnSO4 K2SO4
e-
7-2 电化学电池
伏特(Alessandro Volta 1745~ 1827)。意大利物理学家。 1800年3月20日宣布发明伏打 电堆,这是最早的直流电源。 从此,人类对电的研究从静 电发展到流动电(电流)。为纪 念他,人们将电动势单位取 名伏特。
7.2.1 原电池的构造
原电池: 将化学能转化为电能的装置
MnO4 8H Mn2 4H 2O SO32 H2O SO42 2H
口诀:少氧的一边加H2O,多氧的一边加H+。
第7章 氧化还原反应 电化学基础

第7章氧化还原反应电化学基础一、单选题1. 下列电对中,Eθ值最小的是:A: Ag+/Ag;B: AgCl/Ag;C: AgBr/Ag;D: AgI/Ag2. Eθ(Cu2+/Cu+)=0.158V,Eθ(Cu+/Cu)=0.522V,则反应2 Cu+Cu2+ + Cu的Kθ为:A: 6.93×10-7;B: 1.98×1012;C: 1.4×106; D: 4.8×10-133. 已知Eθ(Cl2/ Cl-)= +1.36V,在下列电极反应中标准电极电势为+1.36V 的电极反应是:A: Cl2+2e- = 2Cl- B: 2 Cl- - 2e- = Cl2C: 1/2 Cl2+e- = Cl- D: 都是4. 下列都是常见的氧化剂,其中氧化能力与溶液pH 值的大小无关的是:A: K2Cr2O7 B: PbO2C: O2 D: FeCl35. 下列电极反应中,有关离子浓度减小时,电极电势增大的是:A: Sn4+ + 2e- = Sn2+B: Cl2+2e- = 2Cl-C: Fe - 2e- = Fe2+ D: 2H+ + 2e- = H26. 为防止配制的SnCl2 溶液中Sn2+被完全氧化,最好的方法是:A: 加入Sn 粒B:. 加Fe 屑C: 通入H2D: 均可7. 反应Zn (s) + 2H+→ Zn 2++ H2 (g)的平衡常数是多少?A: 2×10-33 B: 1×10-13 C: 7×10-12 D: 5×10 26二、是非题(判断下列各项叙述是否正确,对的在括号中填“√”,错的填“×”)1. 在氧化还原反应中,如果两个电对的电极电势相差越大,反应就进行得越快2.由于Eθ(Cu+/Cu)= +0.52V , Eθ(I2/ I-)= +0.536V , 故Cu+ 和I2不能发生氧化还原反应。
电化学基础第7章习题答案

电化学基础第7章习题答案电化学是研究电与化学之间相互关系的学科,涉及到电解、电极反应、电解质溶液、电池等内容。
在电化学的学习过程中,习题的解答是巩固知识和提高能力的重要方法。
本文将针对电化学基础第7章的习题进行解答,帮助读者更好地理解电化学的相关概念和原理。
1. 电解质溶液的电导率与浓度的关系是什么?电解质溶液的电导率与浓度呈正相关关系。
当溶液中电解质浓度增加时,溶液中的离子数目增多,离子间的碰撞频率增加,导致电流的传导能力增强,电导率也随之增加。
2. 什么是电导率极限?电导率极限是指在无限稀释条件下,电解质溶液的电导率达到的最大值。
当溶液中电解质的浓度趋近于无限稀释时,离子间的相互作用减弱,离子迁移速率趋于极限值,因此电导率也趋于极限值。
3. 什么是电解质溶液的离子迁移率?电解质溶液的离子迁移率是指离子在电场作用下迁移的速率。
离子迁移率与离子的电荷量、电场强度以及溶液中的粘度等因素有关。
一般来说,阳离子的迁移率大于阴离子的迁移率。
4. 什么是电解质溶液的电导率测量方法?电解质溶液的电导率可以通过电导仪进行测量。
电导仪是一种测量电解质溶液电导率的仪器,通过测量电解质溶液中的电流和电压,计算得到电导率的数值。
电导仪的原理是根据欧姆定律,通过测量电流和电压的比值来确定电解质溶液的电导率。
5. 什么是电解质溶液的电解过程?电解质溶液的电解过程是指在外加电压的作用下,电解质溶液中的阳离子和阴离子被迁移到电极上,发生氧化还原反应的过程。
在电解过程中,阳离子会向阴极迁移,发生还原反应;阴离子则向阳极迁移,发生氧化反应。
电解质溶液的电解过程是电池和电解质溶液的基础。
6. 什么是电解质溶液的电解电位?电解质溶液的电解电位是指在电解质溶液中发生氧化还原反应时,电极上的电位差。
电解电位可以通过测量电解质溶液中的电流和电压,计算得到。
电解电位的大小决定了电解过程的方向和速率。
7. 什么是电解质溶液的离子迁移数?电解质溶液的离子迁移数是指单位时间内离子的迁移量。
第7章-电化学基础
标准电极电势的测定
例5 简述测定Pt | Fe3+(1.0), Fe2+(1.0)的标准电极电势的方法及结果。 解 将Pt | Fe3+(1.0), Fe2+(1.0)与标准氢电极组成电池。从实验电流的方向确定此待测电极为正极,标准氢电极为负极。 测得电动势为0.771V,则 EΘ= E+Θ - E- Θ = EΘFe3+ /Fe2+ - EΘH+/H2
2.电极反应
任何氧化还原反应都可拆分为两个氧化还原电对的半反应(半电池反应,电极反应): Fe3+ + e → Fe2+ Sn2+ → Sn4+ + 2e 氧化-还原反应的实质: 两个共轭电对之间的电子转移反应。
3.电对拆分:
2MnO4-+5H2C2O4 + 6H+ → 2Mn2+ + 10CO2 + 8H2O MnO4- + 8H+ + 5e → Mn2+ + 4H2O ① H2C2O4 → 2CO2 + 2H+ + 2e ② MnO4- / Mn2+; CO2 /H2C2O4
例1 用离子-电子法配平下列氧化还原反应: K2Cr2O7 + KI + H2SO4 →K2SO4 + Cr2(SO4)3+I2+H2O 解:先写成离子反应式: Cr2O72- + I- + H+→ Cr3+ + I2 + H2O 将离子反应式分成两个半反应: I- → I2(电对:I2 /I- ) Cr2O72- + H+ → Cr3+ + H2O(电对:Cr2O72- /Cr3+) 分别配平两个半反应: 2I- = I2 + 2e Cr2O72- + 14 H+ + 6e = 2Cr3+ +7 H2O
《电化学基础》课件

学习储能装置和电池技术的原 理,如锂离子电池和太阳能电 池。
燃料电池和电化学传感器
燃料电池
探索燃料电池的原理与应用,如氢燃料电池和燃料电池汽车。
电化学传感器
了解电化学传感器的工作原理,以及其在环境监测和医学诊断中的应用。
《电化学基础》PPT课件
本PPT课件将介绍电化学的基础理论、动力学、电池与电解池、电化学表征技 术以及电化学的应用领域,带你深入了解这个令人着迷的领域。
电化学基础理论
1 电化学基础概念
2 电化学反应的基本
学习电化学的基础概念,
特征和实验表征方 法
包括电解质、离子和电
探索电化学反应的特征
子传输。
以及实验方法,包括溶
了解反应速率和速率常数的 定义及其在动力学研究中的 重要性。
电池和电解池
1
电池和电解池的基本概念
探索电池与电解池的原理和应用,包
奥姆定律和纳尔斯特方程
2
括电子转移和离子传输过程。
学习奥姆定律和纳尔斯特方程,揭示
电池和电解池中电流与电势之间的关
系。
3
活性质量、化学放电和电化学 效率
和计时电流法
深入了解线性扫描伏安法和循环伏安法的 原理和应用。
探索电位阶跃法和计时电流法在电化学研 究中的重要性。
电化学应用
电催化和电极催化反应
电化学合成和电化学分析 储能装置和电池技术
了解电催化和电极催化反应的 应用,如催化转化和废水处理。
探索电化学合成和电化学分析 在化学工业和实验室中的应用。
电解和电沉积过程
4
响,以及化学放电和电化学效率的计
算。
了解电解和电沉积在电化学中的应用
以及相关实验和工业过程。
无机化学第7章氧化还原及电化学基础

SO32-—— SO42-
Cr2O72- —— Cr3+
H2O2—— O2
H2O2—— H2O
Cl-—— Cl2 Fe2+—— Fe3+
MnO2 —— Mn2+
H2C2O4—— CO2
3/20/2022
13
§ 7.2 电化学电池
7.2.1 原电池的构造
* 7.2.2 电解池与Faraday定律
7.2.3 原电池电动势的测定
3/20/2022
11
例2:配平
Cl2(g) NaOH(aq)ΔNaCl(aq) NaClO3(aq)
第1步:Cl2 OH Cl ClO3
第2步:Cl2 Cl
Cl 2
ClO
3
第3步:Cl2 2e = 2Cl
Cl 2
12OH
10e
=
2ClO
3
6H 2O
第4步:①×5 +② :
6Cl 2
3/20/2022
16
负极 (失电子 ) Zn(s) 2e 正极 (得电子 ) Cu 2 2e
Zn 2 氧化反应 Cu(s) 还原反应
两个半电池中发生的反应,叫电极反应。
每个电极反应由氧化型和还原型构成一个电对:
电对:氧化型/还原型:Cu2+/Cu, Zn2+/Zn:
原电池反应: Zn(s) Cu 2 (aq) Zn 2 (aq) Cu(s)
第七章 氧化还原反应 电化学基础
§7.1 氧化还原反应的基本概念 §7.2 电化学电池 §7.3 电极电势 §7.4 电极电势的应用
3/20/2022
1
教学目的
1. 熟悉氧化还原反应的概念,会用离子—电子半反 应法配平反应方程式。
电化学基础 第七讲

由于 (a) 在 (b) 的上面,其 大,还原倾向 大,所以其氧化态易被还原,[Ox]1可作氧 化剂;
• 对应地,[Re]2可作 还原剂,发生如下 反应:
[Ox ]1 + [Re]2 [Re]1+ [Ox ]2
例:
½ O2 + H2 H2O
相应的电池电动势为
E = a b
结论:
A
【例】 金属腐蚀的判断
例:Fe
的电化学腐蚀: )Fe Fe 2+ + 2e +)2H+ + 2e H2
Fe 2 / Fe
Fe 2 / Fe
RT ln aFe 2 2F
设:T 298K,aFe 2 1
则: Fe 2 / Fe 0.4402 ( V )
如图:
2)氢电极电势
2H+ + 2e = H2 (T = 298 K)
H
2
H / H2
a RT ln ( ) 2F aH 2
2 H
0.05916 pH 0.02958 lg
PH 2
P
当 PH2 = 1 atm,
H 2 0.05916pH
当 PH2 = 100 atm,
第七讲
平衡体系的电化学(六)
二、电位滴定
测定原理:
滴定过程中,待测离子的浓度不断变化,与 其有关的电池的电动势也变,在等当点附近, 电动势 E 的变化最剧烈。 例如: 用标准 NaOH 溶液滴定酸,测玻璃电极、甘 汞电极构成的电池的电动势 E:
E = 甘汞 玻 = 0.2801 玻 + 0.05916 pH 随着滴定 NaOH 量的增加,pH↗,电动势 E↗; 在等当点处 pH 值变化率最大,E 的变化率 也最大。如图:
第七章 氧还原反应 电化学基础

§7.1 氧化还原反应的基本概念•氧化还原反应由氧化反应和还原反应两个半反应组成一、氧化态•定义:氧化态(氧化数)是元素一个原子的形式电荷,这种形式电荷是由假设两个键中的电子指定给电负性更大的原子而求得(以化合价为基础)•氧化态是按一定规则(人为规定)指定的形式电荷的数值(可以是负数、正数、零or分数)。
二、确定氧化态的规则1. 离子型化合物中,元素的氧化数等于该离子所带的电荷数2. 共价型化合物中,共用电子对偏向于电负性大的原子,两原子的形式电荷数即为它们的氧化数3. 单质中,元素的氧化数为零;离子Xn-氧化数为n-4. 中性分子中,各元素原子的氧化数的代数和为零,复杂离子的电荷等于各元素氧化数的代数和5. 氢的氧化数一般为+1,在金属氢化物中为-1,如NaH6. 氧的氧化数一般为(-II),例外有-I、+I、+II等,在过氧化物中为-1,如Na2O2 ,在超氧化物中为-0.5,如KO2 ,在氧的氟化物中为+1或+2,如O2F2 和OF2中7. 氧化数可以是分数Fe3O4(Fe2O3·FeO),Fe的氧化数为8/3,可见是平均氧化数•氧化数、化合价、化学键数的区分§7.2电化学电池一、原电池•借助于氧化还原反应将化学能直接转变成电能的装置。
理论上,任何氧化还原反应都可以设计为原电池。
•要求:(1) 自发氧化还原反应(2)装置,氧化过程和还原过程分别在不同的电极上进行,电极之间要通过导线和盐桥连接。
•盐桥:饱和的电解质溶液。
如KCl 溶液。
•目的:保持溶液电中性——由于K+和Cl-的定向移动,使两池中过剩的正负电荷得到平衡,恢复电中性。
于是两个半电池反应乃至电池反应得以继续,电流得以维持。
•原电池装置可用简单的符号表示,称为电池图示。
例:Daniell电池的电池图示——(-) Zn | Zn2+(c1) ||Cu2+(c2) | Cu (+)•原电池符号的要求:(1) 负极在左,正极在右(2) 按顺序排列各物质,两相之间的界面用“ | ”隔开(3) 盐桥用“||”表示(4) 溶液需标出浓度,气体需标出压力§7.3电极电势一、原电池的电动势原电池的电动势E MF等于正极的电极电势E(+)减去负极的电极电势E(-) 。
物理化学电子课件第七章电化学基础

第二节 电解质溶液
一、电导和电导率 图7-4所示为几种电解质溶液的电导率与浓度的关系。
第二节 电解质溶液
二、摩尔电导率
因为电解质溶液的电导率与浓度有关,因此不能用电导率来比较 不同浓度、不同类型的电解质的导电能力,需要引入摩尔电导率的概 念。
第二节 电解质溶液
三、电导的测定
电导是电阻的倒数,因此测量电解质溶液的电导实际上是测量其 电阻。测量溶液的电阻可利用惠斯通电桥,如图7-5所示。
第二节 电解质溶液
第三节 可逆电池及原电池热力学
一、可逆电池
(1)充电、放电反应必须可逆,即化学可逆和物质可逆,要求
(2)反应要在无限接近电化学平衡条件下进行,即可逆电池的 能量转移必须是热力学可逆的,要求电池必须在电流趋于无限小(即
I 0)的状态下工作。放电时对外所做的电功和充电时消耗的电功 大小相等,保证当系统恢复原状时环境也能复原,不留下任何变
第一节 电化学的基本概念
三、离子的电迁移和迁移数
3. 离子迁移数 t有多种测定方法,这里主要介绍希托夫(Hittorf) 法。其原理是:分别测定离子迁出或迁入相应电极区的物质的量及发 生电极反应的物质的量,然后通过物料衡算得到离子迁移数。实验装 置如图7-3所示。
第一节 电化学的基本概念
三、离子的电迁移和迁移数 实验测定中的物料衡算思路为:电解后某离子剩余的物质的量
二、法拉第电解定律
1833年,英国科学家法拉第(Faraday)在研究了大量电解过程后提出 了著名的法拉第电解定律——电解时电极上发生化学反应的物质的量与 通过电解池的电荷量成正比,简称为法拉第定律,其数学表达式为:
第一节 电化学的基本概念
三、离子的电迁移和迁移数
通电于电解质溶液后,溶液中承担导电任务的阴、阳离子分别向 阳极和阴极移动,同时在相应的两个电极界面上发生氧化或还原作用。 这种在电场作用下阴、阳离子分别向两极运动的现象称为电迁移。电 迁移是电解质溶液导电的必要条件。即
第七章 氧化还原反应 电化学基础

Eθ =1.229V
解(1) EBr2 / Br (2) E MnO
0.0592 2 = 1.065 lg cBr 2
2+
2 / Mn
0.0592 cMn 2+ = 1.228 lg 4 4 cH +
(3) EO2 / H 2O
0.0592 1 = 1.229 lg 4 4 cH + pO2
第七章 氧化还原反应 电化学基础
§7.1 氧化还原反应的基本概念 §7.2 电化学电池
§7.3 电极电势
§7.4 电极电势的应用
§ 7.1 氧化还原反应的基本概念
7.1.1 氧化值 7.1.2 氧化还原反应方程式的配平
7.1.1 氧化值
有电子得失或电子转移的反应,被称为 氧化还原反应。
Cu (aq) + Zn(s) Zn (aq) + Cu(s) 得失电子 H 2 (g)+ Cl2( ) 2HCl( ) g g 电子偏移 氧化值:是指某元素的一个原子的荷电 数,该荷电数是假定把每一化学键中的电 子指定给电负性更大的原子而求得的。
2KMnO + 5K2SO3 + 3H2SO4 4 = 2MnSO4 + 6K2SO4 + 3H2O
配平的难点是未发生电子得失的原子的配平 在进行未发生电子得失的H和O原子数配平时,有 下列规律:
(1) 反应在酸性介质中进行,则方程式两边根据需要均可 出现H+或H20,但绝不能出现OH-.如果反应前氧原子数小 于反应后的,则在左边加上H20,右边生成H+;反之,则左边 加H+,右边生成H20. (2) 反应在碱性介质中进行,则方程式两边根据需要均可 出现OH-或H20,但绝不能出现H+.如果反应前氧原子数小 于反应后的,则在左边加上0H-,右边生成H2O;反之,则左 边加H20,右边生成0H-. (3)反应在中性介质中进行,则左边加H20,右边(产 物)根据需要均可出现H+或OH-.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
DrGm=-nEF
由化学反应设计电池(1) Zn(s)+H2SO4(aq)→H2(p)+ZnSO4(aq) Zn(s)|ZnSO4||H2SO4|H2(p),Pt 验证: (-) Zn(s) →Zn2++2e(+) 2H++2e-→H2(p) 净反应: Zn(s)+2H+→Zn2++H2(p)
可逆电极的类型
可逆电池的书写方法及电动势的取号
由化学反应式设计电池
电化学与热力学的联系
桥梁公式:
DrGm=-nEF
组成可逆电池的必要条件
原电池
电解池
原电池
Zn(s)+Cu2+
电解池
Zn2++Cu(s)
1、化学反应可逆 ;能量变化可逆。
2、充、放电时阻力与动力之差为一无限小。理想化装置
可逆电极的类型
⑴第一类电极 金属与其阳离子组成的电极 氢电极 氧电极 卤素电极 ⑵第二类电极
金属-难溶盐及其阴离子组成的电极 金属-氧化物电极
⑶第三类电极 氧化-还原电极
可逆电极的类型
可逆电池的书写方法及电动势的取号
1. 左边为负极,起氧化作用; 右边为正极,起还原作用。
2.“|”表示相界面,有电势差存在。 3.“||”表示盐桥,使液接电势降到可以忽略不计。
电动势E判据
当对于电池反应: 当恒温、恒压、可逆时:ΔrGm=WR’ =
-nFE
该式表明:原电池的电能来源于电池反应的吉布斯函数的降低,
反映了化学能与电能转化的定量关系。并给出用电池电动势判断
反应方向限度的判据:
E0
标准状态下
> 自发 = 平衡状态
D r Gm nFE
这两个关系式沟通了化学热力学与电化学的关系,由此可 以推得电池电动势与其它热力学函数的关系。
E E和( T ) p
与DrHm和QR关系
电池电动势及电动势的温度系数与 D r H m 关系
将QR代入△rHm表达式得:
D r H m D r Gm TD r S m E D r H m nFE nFT ( )p T 电池电动势与反应可逆热的关系 E QR TD r S m nFT ( )p T
E 与平衡常数 K 关系
D r G nFE
m
m
D rG RT ln K
RT E ln K nF
所处的状态不同, 处于标准态, 与 K E K E
处于平衡态,只是 D r Gm 将两者从数值上联系在
一起。用该式可由标准电动势求平衡常数。 较热力学函数法准确。-无机化学内容
E ( )p T
与DrHm和QR关系
,即电池反应焓变的减少
E (1)当 ( ) p 0, QR 0,WR D r H m T
全部转变为电功。
D r H m nFE QR
E (2)当 ( ) p 0, QR 0,WR D r H m T
,即电池反应焓变的减少 大于可逆电功,多出的部分以热的形式放出。
由化学反应设计电池(2) AgCl(s)→Ag++ClAg(s)|Ag+(aq)||Cl-(aq)|AgCl(s)|Ag(s) 验证: ⊙ (-) Ag(s) →Ag++e(+) AgCl(s)+e-→Ag(s)+Cl净反应: AgCl(s)→Ag++Cl-
7.6 可逆电池的热力学 电动势E判据 E☉与平衡常数K☉关系 从E及其温度系数与△ rHm和△ rSm关系 E与活度a的关系-能氏方程
4. 要注明温度,不注明就是299.15 K;要注明物态, 气体要注明压力;溶液要注明浓度。
5. 气体电极和氧化还原电极要写出导电的惰性电极, 通常是铂电极。
Zn(s)|Zn2+(a1)||Cu2+ (a2)|Cu(s)
可逆电池的书写方法及电动势的取号 自发电池: DrGm<0,E>0 非自发电池: DrGm>0,E<0 例如 Zn(s)|Zn2+||Cu2+|Cu(s) Zn(s)+Cu2+→Zn2++Cu(s) DrGm<0,E>0 Cu(s)|Cu2+||Zn2+|Zn(s) Zn2++Cu(s)→Zn(s)+Cu2+ DrGm>0,E<0
E (3)当 ( T ) p 0, QR 0,WR D r H m
,即电池反应焓变的减少 小于可逆电功,不足的部分来自环境吸热。
实际工作中,因电动势测量精度要比量热法高,若反应能 设计在电池中发生,则通过测定原电池电动势和温度系数,按 上述各式计算 D r Gm、D r S m、D r H m、QR 可得出较准确的热力 学数据。例
可见,电池反应的焓变包括两部分,一是可逆放电时所做的电 功,二是可逆电池以热的形式与环境交换的能量。若不可逆, 电功绝对值减小,做功能力的一部分转变为热;当电池短路或 直接进行化学反应时,电功为零, △rHm =QR 即Δr H m全部以 热的形式放出。
D r H m nFE QR
E和
E E或 ( T ) p
与DrSm关系
G S T p
(DG) DS T p
dG SdT Vdp
( nFE ) [ ] p D r Sm T
E D r S m nF ( ) p T
式中 ( E ) p 为定压下电池电动势随温度的变化率,称为 T 原电池电动势的温度系数。
E与a(活度)的关系-能氏方程
对于电池反应: 化学反应等温式
D r Gm D r G RT lnQa
代入下式ΔrGm = -nFE 得
m
RT EE ln Qa nF
上式称为电池的奈恩斯特方程式,它表示一定温度下电池电动 势随参加反应各物质活度变化的关系。298K时,近似为:
物理化学
第7章 电化学基础(二)
第七章 电化学基础(二)
主要内容
可逆电池和可逆电极 可逆电池的热力学 电动势产生的机理 电极电势和电池的电动势 浓差电池和液体接界电势的计算公式 电动势测定的应用 极化作用与电极反应
7.5 可逆电池和可逆电极
电化学与热力学的联系
组成可逆电池的必要条件
