第14章-奥美拉唑生产工艺0615
奥美拉唑原料药的生产工艺

奥美拉唑原料药的生产工艺
奥美拉唑(Omeprazole)是一种用于治疗胃酸相关疾病的药物,如胃溃疡、胃食管反流症和消化性溃疡。
以下是奥美拉唑原料药的一般生产工艺:
1. 首先,通过化学合成方法合成奥美拉唑的前体物质,如丙酮咪唑
(2,3-dimethyl-5-methoxy pyridine)和乙醇胺。
2. 接下来,将丙酮咪唑和乙醇胺进行缩合反应,生成硫脲化合物。
3. 将硫脲与酒石酸进行反应,生成奥美拉唑。
4. 对原料药进行精馏、结晶、洗涤等步骤,以提高纯度。
5. 最后,通过干燥和粉碎等工艺,将奥美拉唑原料药制备成粉末或颗粒状的成品。
需要注意的是,这只是一般的奥美拉唑原料药生产工艺,实际的生产工艺可能会有一些细微的差异。
同时,为了确保原料药的质量和纯度,生产中还会使用一系列的工艺控制和质量检测方法。
奥美拉唑生产工艺原理课件

泮托拉唑(Pantoprazole)
雷贝拉唑(Rabeprazole)
依索拉唑(Esomeprazole)
第二节 合成路线及其选择
奥美拉唑合成线路分析:
断开a键
一、5-甲氧基-1H-苯并咪唑-2-硫醇(7-6)与2-氯甲
基-3,5-二甲基-4-甲氧基吡啶盐酸盐(7-7)反应
(一) 5-甲氧基-1H-苯并咪唑-2-硫醇(7-6)的合成
② 操作方法: 将对氨基苯甲醚、冰乙酸和水混合,搅拌至溶解。加 入碎冰,0-5℃加入乙酸酐,搅拌下结晶析出。 冰浴冷却下,加入浓硝酸,60-65℃保温10min。 冷却至25℃,结晶完全析出后,抽滤,冰水洗涤至中 性,干燥,得黄色结晶 4-甲氧基 -2-硝基乙酰苯胺 , mp114-116℃,收率84%。
(3)反应条件与影响因素
① 乙酰化反应温度控制在0-5℃? ② 4-甲氧基乙酰苯胺与对氨基苯甲醚如何分离?所得 产品乙酰化物如何处理以利于下一步硝化反应? ③ 如何加快硝化反应的速率?
2. 4-甲氧基-2-硝基苯胺的制备 (1)工艺原理
(2)工艺过程
① 配料比: 重量配料比为4-甲氧基-2-硝基乙酰苯胺:碱液:水 =1:1.86:1.56.
(2)工艺过程
将(7-17)和无水甲醇混合,加热回流下,滴加甲醇 钠的甲醇溶液(甲醇钠:甲醇=1:3.85)回流12h。 冷至室温,加水稀释反应液,减压回收甲醇,加水稀释 残留液,用氯仿萃取三次,合并有机相,无水硫酸钠干 燥。减压浓缩回收氯仿后,得棕黄色固体(7-18),收 率为80.6%。
(3)反应条件与影响因素
-2-吡啶甲硫醇反应
两种原料来源困难,合成难度大,文献资料少,实用 价值不大。
断开C处
三、4-甲氧基邻苯二胺和2-[(3,5-二甲基-4-甲氧基-2吡啶基)甲硫基]甲酸反应
制药工艺奥美拉唑的生产工艺原理

O
NH2
+
N
S
NH2
HOOC
O
(7-23)
N
O
NS
NaIO4
O
O
N H
HCl
ON NS
O N H
(R,S)
(7-23)化合物合成路线长,制备困难。 使整个合成路线较长,后处理麻烦 总收率低于奥美拉唑的合成(Ⅰ)
d切断
ON
O
NS
O
N H
d
O
O
NS
CH3
N H
N O
四、5-甲氧基-2-甲基亚磺酰基-1H-苯并咪唑金 属盐与1,4-二甲氧基-3,5-二甲基吡啶鎓盐反应
制药工艺奥美拉唑 的生产工艺原理
结构特点
苯并咪唑环
吡啶基
3
O
1
N
5
O
5
N2 S
2 3
4O
N1
H
酸性
亚磺酰基
亚 砜 基 的 S具 有 光 学 活 性
奥美拉唑 O N
O
NS
O
N H
为第一个上市的质子泵抑制剂。
其化学稳定性好, 对组胺、五肽胃泌素、乙酰胆碱 、食物及刺激迷走神经等引起的胃酸分泌均有强而 持久的抑制作用。
N
O
NS
O
N H
ON
O
NS
O
N H
㈠ 5-甲氧基-1H-苯并咪唑-2-硫醇合成
O
NH2
NH2
㈠ 5-甲氧基-1H-苯并咪唑-2-硫醇合成
方法1
H3CO O
1.Ac2O H3CO NH2 2.HNO3
NO2
KOH/H2O
NHCOCH3
奥美拉唑投产工艺规程

生产工艺规程扬子江药业集团有限公司一、产品概述消化性溃疡病是一种常见病、多发病,发病率约占人口总数的10%。
目前消化道溃疡受体拮抗剂(雷尼替丁等)、胃粘膜保护剂治疗药主要有质子泵抑制剂(奥美拉唑等)、H2(铋剂)、抗酸剂(氢氧化铝)。
目前国内使用最广泛的质子泵抑制剂为奥美拉唑,销售额占据胃肠道溃疡治疗用药的首位。
奥美拉唑(Omeprazole,Omep)是瑞典Hassle公司于1979年首次合成的苯并咪唑衍生物,与现有的抗消化性溃疡药相比,具有明显的优势。
奥美拉唑肠溶胶囊适用于胃溃疡、十二指肠溃疡、应激性溃疡、反流性食管炎和卓-艾综合征(胃泌素瘤)。
本品为脂溶性弱碱性药物,易浓集于酸性环境中,因此口服后可特异地分布于胃粘膜壁细胞的分泌小管中,并在此高酸环境下转化为亚磺酰胺的活性形式,然后通过二硫键与壁细胞分泌膜中的H+,K+-ATP酶(又称质子泵)的巯基呈不可逆性的结合,生成亚磺酰胺与质子泵的复合物,从而抑制该酶活性,阻断胃酸分泌的最后步骤,因此本品对各种原因引起的胃酸分泌具有强而持久的抑制作用。
奥美拉唑肠溶胶囊口服后,经小肠吸收,1小时内起效,0.5~3.5小时血药浓度达峰值,作用持续24小时以上,可分布到肝、肾、胃、十二指肠、甲状腺等组织,且易透过胎盘。
通常单剂量生物利用度约35%,多剂量生物利用度增至约60%,血浆蛋白结合率为95%~96%,血浆半衰期为0.5~1小时,慢性肝病患者为3小时。
本品在体内经肝脏微粒体细胞色素P氧化酶系统代谢,代谢物的约80%经尿排泄,其余由胆汁分泌后从粪便排450泄。
二、生产工艺操作要求和技术参数 1、工艺流程图一般区 三十万级2、岗位质量监控要点3、工艺过程和工艺参数3.1 领取合格的奥美拉唑、羟丙甲纤维素(E3)、吐温-80、磷酸氢二钠、磷酸三钠、药用微丸丸芯、丙二醇、Eudragit(L30D-55)、聚乙二醇6000、滑石粉。
3.2 按批生产指令单称取羟丙甲纤维素(E3)、吐温-80、磷酸氢二钠、磷酸三钠,用适量水溶解后,加入处方量的奥美拉唑,搅拌,使成均匀的混悬液,得含主药药液。
奥美拉唑的生产工艺流程框图
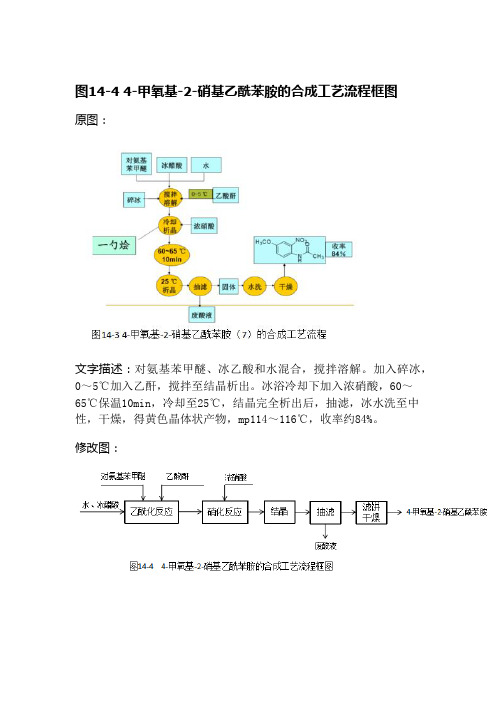
图14-4 4-甲氧基-2-硝基乙酰苯胺的合成工艺流程框图原图:文字描述:对氨基苯甲醚、冰乙酸和水混合,搅拌溶解。
加入碎冰,0~5℃加入乙酐,搅拌至结晶析出。
冰浴冷却下加入浓硝酸,60~65℃保温10min,冷却至25℃,结晶完全析出后,抽滤,冰水洗至中性,干燥,得黄色晶体状产物,mp114~116℃,收率约84%。
修改图:图14-5 4-甲氧基-2-硝基苯胺的合成工艺流程框图原图:文字描述:将4-甲氧基-2-硝基乙酰苯胺原料加入Claisen碱液中,加热回流15min,加水,再回流15min,冷却至0~5℃结晶,抽滤,冰水洗3次,得砖红色固体产物,mp122~123℃,收率约88%。
修改图:图14-6 4-甲氧基邻苯二胺的合成工艺流程框图原图:文字描述:SnCl2与浓盐酸混合溶解,20℃下加入4-甲氧基-2-硝基苯胺,搅拌反应3h。
滴加40%NaOH液至pH=14,控温不超过40℃。
用乙酸乙酯萃取2次,水洗有机相,无水Na2SO4干燥。
减压脱出溶剂,黄色油状物冷冻结晶,得产物4-甲氧基邻苯二胺,收率约72%。
修改图:图14-7 5-甲氧基-1H-苯并咪唑-2-硫醇制备工艺流程框图原图:文字描述:搅拌下将4-甲氧基邻苯二胺和CS2加到95%EtOH和KOH的混合液中,加热回流3h。
加入活性炭回流,趁热过滤。
滤液搅拌下滴加乙酸至pH=4~5析出结晶,冷却至4~5℃使析出完全。
抽滤,水洗至中性,干燥,得土黄色产物结晶,mp254~256℃,收率约78%。
修改图:图14-8 2,3,5-三甲基吡啶-N-氧化物的制备工艺流程框图原图:文字描述:将2,3,5-三甲基吡啶与H2O2、HAc混合,搅拌下缓缓升温至80~90℃,反应24h。
减压蒸除溶剂,冷却,用40%的NaOH调节pH =14,用CHCl3萃取3次,无水Na2SO4干燥。
减压浓缩,50~60℃真空干燥,得黄色固体产物,收率80.3%。
修改图:图14-9 4-硝基-2,3,5-三甲基吡啶-N-氧化物制备的工艺流程框图原图:文字描述:搅拌、控温<90℃,将硫酸滴加到三甲基吡啶氧化物中,缓慢滴加混酸(硫硝比=1∶1.10),90℃保温反应20h。
奥美拉唑的合成工艺路线

H 3C O
1.Zn/H C l/C H 3O H
N H 2
2.C S2
N S H
N H
• 合成路线三
• 2-氨基-4-甲氧基乙酰苯胺与异硫氰酸丙脂反应,然后加热回流环合,生成5甲氧基-1H-苯并咪唑-2-硫醇,两步反应总收率可达65%。但由于异硫氰酸丙 脂来源困难,大量制备受到限制。
H3CO
NH2 O
奥美拉唑 (Omeprazole),又名洛赛克(Losec)或亚枫咪唑 (Moprial);
化学名称:5-甲氧基-2-{[(4-甲氧基-3,5-二甲基-2-吡啶基)-甲基]-亚 磺酰基}-1H-苯并咪唑 化学式:
H3CO
O H3C
O CH3
N
HS
N
CH3
H
N
•
奥美拉唑具有独特的胃酸抑制作用,对基础胃酸分泌、夜间酸分泌
H 3C O H3CO
氧化
N N H
H3CO
H 3C
SH +
OCH3 CH3
N H
Cl
CH2Cl
N
H 3C
OCH3
S
N H
N
N
O
H 3C
CH3 OCH3
S
CH3
N
H
N
奥美拉唑由 5-甲氧基-1H-苯咪唑-2-硫醇的合成
•
Hale Waihona Puke 以对氨基苯甲醚为原料,经氨基保护和硝化反应生成4-甲
氧基-2-硝基乙酰苯胺,脱保护得到 4-甲氧基-2-硝基苯胺,在用 SnCl2 / HCl、Fe/HCl 法或催化氢化等方法还原硝基,生成4-甲氧基 邻苯二胺。形成咪唑环的有3种方法如下:
H3CO
RNCS
奥美拉唑投产工艺规程

生产工艺规程扬子江药业集团有限公司一、产品概述消化性溃疡病是一种常见病、多发病,发病率约占人口总数的10%。
目前消化道溃疡治疗药主要有质子泵抑制剂(奥美拉唑等)、H2受体拮抗剂(雷尼替丁等)、胃粘膜保护剂(铋剂)、抗酸剂(氢氧化铝)。
目前国内使用最广泛的质子泵抑制剂为奥美拉唑,销售额占据胃肠道溃疡治疗用药的首位。
奥美拉唑(Omeprazole,Omep)是瑞典Hassle公司于1979年首次合成的苯并咪唑衍生物,与现有的抗消化性溃疡药相比,具有明显的优势。
奥美拉唑肠溶胶囊适用于胃溃疡、十二指肠溃疡、应激性溃疡、反流性食管炎和卓-艾综合征(胃泌素瘤)。
本品为脂溶性弱碱性药物,易浓集于酸性环境中,因此口服后可特异地分布于胃粘膜壁细胞的分泌小管中,并在此高酸环境下转化为亚磺酰胺的活性形式,然后通过二硫键与壁细胞分泌膜中的H+,K+-ATP酶(又称质子泵)的巯基呈不可逆性的结合,生成亚磺酰胺与质子泵的复合物,从而抑制该酶活性,阻断胃酸分泌的最后步骤,因此本品对各种原因引起的胃酸分泌具有强而持久的抑制作用。
奥美拉唑肠溶胶囊口服后,经小肠吸收,1小时内起效,0.5~3.5小时血药浓度达峰值,作用持续24小时以上,可分布到肝、肾、胃、十二指肠、甲状腺等组织,且易透过胎盘。
通常单剂量生物利用度约35%,多剂量生物利用度增至约60%,血浆蛋白结合率为95%~96%,血浆半衰期为0.5~1小时,慢性肝病患者为3小时。
本品在体内经肝脏微粒体细胞色素P450氧化酶系统代谢,代谢物的约80%经尿排泄,其余由胆汁分泌后从粪便排泄。
二、生产工艺操作要求和技术参数 1、工艺流程图一般区 三十万级2、岗位质量监控要点3、工艺过程和工艺参数3.1 领取合格的奥美拉唑、羟丙甲纤维素(E3)、吐温-80、磷酸氢二钠、磷酸三钠、药用微丸丸芯、丙二醇、Eudragit(L30D-55)、聚乙二醇6000、滑石粉。
3.2 按批生产指令单称取羟丙甲纤维素(E3)、吐温-80、磷酸氢二钠、磷酸三钠,用适量水溶解后,加入处方量的奥美拉唑,搅拌,使成均匀的混悬液,得含主药药液。
奥美拉唑-微丸投产工艺规程精品文档32页

生产工艺规程扬子江药业集团有限公司一、产品概述消化性溃疡病是一种常见病、多发病,发病率约占人口总数的10%。
目前消化道溃疡治疗药主要有质子泵抑制剂(奥美拉唑等)、H2受体拮抗剂(雷尼替丁等)、胃粘膜保护剂(铋剂)、抗酸剂(氢氧化铝)。
目前国内使用最广泛的质子泵抑制剂为奥美拉唑,销售额占据胃肠道溃疡治疗用药的首位。
奥美拉唑(Omeprazole,Omep)是瑞典Hassle公司于1979年首次合成的苯并咪唑衍生物,与现有的抗消化性溃疡药相比,具有明显的优势。
奥美拉唑肠溶胶囊适用于胃溃疡、十二指肠溃疡、应激性溃疡、反流性食管炎和卓-艾综合征(胃泌素瘤)。
本品为脂溶性弱碱性药物,易浓集于酸性环境中,因此口服后可特异地分布于胃粘膜壁细胞的分泌小管中,并在此高酸环境下转化为亚磺酰胺的活性形式,然后通过二硫键与壁细胞分泌膜中的H+,K+-ATP酶(又称质子泵)的巯基呈不可逆性的结合,生成亚磺酰胺与质子泵的复合物,从而抑制该酶活性,阻断胃酸分泌的最后步骤,因此本品对各种原因引起的胃酸分泌具有强而持久的抑制作用。
奥美拉唑肠溶胶囊口服后,经小肠吸收,1小时内起效,0.5~3.5小时血药浓度达峰值,作用持续24小时以上,可分布到肝、肾、胃、十二指肠、甲状腺等组织,且易透过胎盘。
通常单剂量生物利用度约35%,多剂量生物利用度增至约60%,血浆蛋白结合率为95%~96%,血浆半衰期为0.5~1小时,慢性肝病患者为3小时。
本品在体内经肝脏微粒体细胞色素P450氧化酶系统代谢,代谢物的约80%经尿排泄,其余由胆汁分泌后从粪便排泄。
二、生产工艺操作要求和技术参数 1、工艺流程图2、岗位质量监控要点3、工艺过程和工艺参数3.1 领取合格的奥美拉唑、羟丙甲纤维素(E3)、吐温-80、磷酸氢二钠、磷酸三钠、药用微丸丸芯、丙二醇、Eudragit(L30D-55)、聚乙二醇6000、滑石粉。
3.2 按批生产指令单称取羟丙甲纤维素(E3)、吐温-80、磷酸氢二钠、磷酸三钠,用适量水溶解后,加入处方量的奥美拉唑,搅拌,使成均匀的混悬液,得含主药药液。
化学制药工艺学课件-奥美拉唑的生产工艺原理

封口技术
奥美拉唑的封口技术主要有热封、冷封和超 声波封口等。热封是利用高温使包装材料熔 融并粘合在一起;冷封则是利用特定的粘合 剂将包装材料粘合在一起;超声波封口则是 利用超声波振动使包装材料产生局部高温并 粘合在一起。在选择封口技术时,需要考虑 包装材料的特性、生产效率以及封口效果等
因素。
06
生产设备选型与布局规划
催化剂优化
尝试不同的催化剂和催化体系,提高关键反应的效率 和选择性。
实验验证与数据分析
进行多组实验验证,收集并分析实验数据,评估优化 条件的实际效果。
04
中间体质量控制与纯化方法
中间体质量标准制定
纯度要求
奥美拉唑中间体的纯度应达到98%以上,以确保最终产品的质量和 稳定性。
杂质限度
制定严格的杂质限度标准,控制中间体中的有机杂质、无机杂质以 及残留溶剂等,保证产品质量及安全性。
根据风险评估结果,制定相应的 风险控制措施,如采用替代原料、 改进工艺、加强设备维护等。
废弃物处理及资源回收利用方案
废弃物分类收集
对奥美拉唑生产工艺中产生的废弃物进行分类收集,避免不同性质 废弃物的混放。
无害化处理
针对不同类型的废弃物,采用相应的无害化处理方法,如焚烧、物 化处理、生物处理等,确保废弃物不会对环境和人体健康造成影响。
结晶条件
奥美拉唑的结晶条件包括温度、溶剂种类、溶液浓度、搅拌速度等。其中,温度是影响结晶过程的重 要因素,需要根据奥美拉唑的性质和溶剂的特性选择合适的结晶温度。
干燥设备类型及操作要点
干燥设备类型
奥美拉唑的干燥设备主要有气流干燥器 、喷雾干燥器、真空干燥器等。气流干 燥器适用于小颗粒物料,喷雾干燥器适 用于液体物料,真空干燥器则适用于热 敏性物料。
奥美拉唑生产工艺规程
×××药业有限公司现行文件奥美拉唑的生产工艺规程文件编号:SOP-MF-301-00起草人:技术员起草日期:年月日审阅人:车间主任审阅日期:年月日审核人:质保经理审核日期:年月日批准人:总经理审批日期:年月日执行日期:年月日分发部门:质量保证部2份生产技术部2份设备部1份目录1、产品概述2、原辅料、包装材料质量标准及规格3、化学反应过程4、生产流程图5、工艺过程6、中间体、半成品的质量标准和检验方法7、技术安全与防火8、综合利用与三废治理9、操作工时与生产周期10、劳动组织与岗位定员11、设备一览表及主要设备生产能力12、原材料、能源消耗定额和技术经济指标13、物料平衡附录附页奥美拉唑的生产工艺规程一:产品概述(一)产品名称1、中文名称:奥美拉唑,别名洛赛克2、英文名称:Omeprazole、Losec3、化学名称:5-甲氧基-2-{[(4-甲氧基-3,5-二甲基-2-吡啶基)-甲基]-亚磺酰基}-1H-苯并咪唑4、分子式:C17H19N3O3S5、分子式量:345.426、化学结构:7、理化性质:本品为白色至类白色结晶性粉末,无臭,遇光易变色,熔点156℃。
本品在二氯甲烷中易溶,在甲醇或乙醇中略溶,在丙酮中微溶,在水中不溶;在0.1mol/L氢氧化钠溶液中溶解。
(二)临床用途①消化性溃疡出血、吻合口溃疡出血。
②应激状态时并发的急性胃黏膜损害,和非甾体类抗炎药引起的急性胃黏膜损伤;③亦常用于预防重症疾病(如脑出血、严重创伤等)胃手术后预防再出血等;④全身麻醉或大手术后以及衰弱昏迷患者防止胃酸反流合并吸入性肺炎。
(三)药理作用本品是近年来研究开发的作用机制不同于H2受体拮抗作用的全新抗消化性溃疡药。
它特异性地作用于胃粘膜壁细胞,降低壁细胞中的氢钾ATP酶的活性,从而抑制基础胃酸和刺激引起的胃酸分泌。
由于氢钾ATP酶又称做"质子泵",故本类药物又称为"质子泵抑制剂"。
奥美拉唑生产工艺流程框图0612
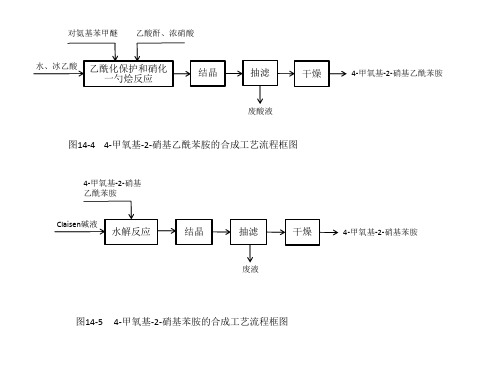
水、冰乙酸 乙酰化保护和硝化 一勺烩反应
结晶
抽滤
干燥
废酸液
图14-4 4-甲氧基-2-硝基乙酰苯胺的合成工艺流程框图
4-甲氧基-2-硝基乙酰苯胺
4-甲氧基-2-硝基 乙酰苯胺
Claisen碱液 水解反应
结晶
抽滤
干燥
4-甲氧基-2-硝基苯胺
废液
图14-5 4-甲氧基-2-硝基苯胺的合成工艺流程框图
4-甲氧基-2硝基苯胺
浓盐酸 二氯亚锡
还原 反应
NaOH
乙酸乙酯
油层
调节pH、萃取
水洗
干燥
减蒸
水层
废水
乙酸乙酯
图14-6 4-甲氧基邻苯二胺的合成工艺流程框图
结晶
4-甲氧基邻苯二胺
二硫化碳
4-甲氧基邻苯二胺
氢氧化钾
乙醇 5-甲氧基-1H-苯并咪唑-2硫醇合成
结晶
抽滤
废液
干燥
5-甲氧基-1H苯并咪唑-2-硫醇
洗涤
干燥
减压 浓缩
回收氯仿
图14-14 奥美拉唑的制备工艺流程框图
乙腈
重结晶
奥美拉唑成品
N-氧化物
NaOH
硝化反应
调节pH
氯仿
萃取
废水
干燥
减压浓缩
回收氯仿
固化
4-硝基-2,3,5三甲基吡啶-N-氧化 物
图14-9 4-硝基-2,3,5-三甲基吡啶-N-氧化物制备的工艺流程框图
甲醇钠
4-硝基-2,3,5三甲基吡啶-N-氧化物
甲醇
取代反应
减蒸
氯仿
萃取 有机相 干燥
回收甲醇
废液
奥美拉唑生产的工艺路线

奥美拉唑生产的工艺路线摘要奥美拉唑是一种新型抗消化性溃疡药,奥美拉唑是一类OTC类西药,用于胃溃疡、十二指肠溃疡、应激性溃疡、反流性食管炎和卓-艾综合征(胃泌素瘤)。
但也有其相应的副作用,总结奥美拉唑的功能,药理作用,理化性质以及合成路线本文主要对奥美拉唑生产的工艺路线进行介绍和比对得出奥美拉唑最佳的生产工艺路线。
关键词:奥美拉唑,生产,工艺路线前言:奥美拉唑选择性地作用于胃粘膜壁细胞,抑制处于胃壁细胞顶端膜构成的分泌性微管和胞浆内的管状泡上的H+,K+-ATP酶的活性,从而有效地抑制胃酸的分泌,起效迅速,适用于胃及十二指肠溃疡,返流性食管炎和胃泌素瘤。
这种H+,K+-ATP酶抑制剂又名质子泵抑制剂。
由于H+、K+-ATP酶是壁细胞泌酸的最后一个过程,故本品抑酸能力强大。
它不仅能非竞争性抑制促胃液素、组胺、胆碱及食物、刺激迷走神经等引起的胃酸分泌,而且能抑制不受胆碱或H2受体阻断剂影响的部分基础胃酸分泌,对H2受体拮抗剂不能抑制的由二丁基环腺苷酸(DcAMP)刺激引起的胃酸分泌也有强而持久的抑制作用。
本品对胃蛋白酶分泌也有抑制作用,对胃黏膜血流量改变不明显,也不影响体温、胃腔温度、动脉血压、静脉血红蛋白、动脉氧分压、二氧化碳分压及动脉血pH目录摘要 (1)关键字 (1)前言 (1)目录 (1)第一章奥美拉唑简介.......................... (2)第一节奥美拉唑功能.......................... (2)第二节奥美拉唑的副作用.......................... (2)第三节奥美拉唑的应用历史..................... (2)第二章药理作用和理化性质........................ (3)第一节奥美拉唑的药理作用 (3)第二节奥美拉唑的理化性质 (3)第三章工艺路线 (4)第一节合成路线一 (4)第二节合成路线二 (4)第三节合成路线三 (4)第四节合成路线四 (4)第五节奥美拉唑研究进展 (4)第六节我国的使用历史 (4)第四章对制药工程专业的认识 (5)第五章制药业发展现状与发展趋势 (5)参考文献 (6)第一章奥美拉唑简介第一节奥美拉唑的功能1.质子泵抑制剂,即壁细胞内H+-K+-ATP酶抑制剂。
奥美拉唑的合成

9、知识产权保护:对于涉及到的专有技术或专利技术,需要在生产过程中 注意知识产权保护。采取适当的保密措施和技术转让协议可以保护企业的商业机 密和合法权益。
10、产品质量标准:为了保证奥美拉唑的质量和安全性,需要遵循相关的国 际和国内质量标准进行生产和检验。例如,中国药典对奥美拉唑的质量标准有明 确规定,包括性状、鉴别、检查、含量测定等方面的要求。同时还需要进行稳定 性测试和有效期验证等程序来确定产品的质量和安全性符合规定要求。
针对以上不足和挑战,我们提出以下建议和展望:
1、加强新工艺的工业化研究:对于仍处于实验室阶段的新合成工艺,需要 进一步研究和优化,提高其适应工业化生产的能力。可以探索新的反应条件、改 进设备等方面的研究,以降低生产成本和提高生产效率。
2、探索绿色合成方法:为了降低对环境的影响,需要研究和开发更加环保 的合成方法。可以探索生物催化、光催化、电化学等绿色化学技术在水溶性苯并 咪唑类化合物的合成中的应用。
参考内容
引言
奥美拉唑是一种常见的质子泵抑制剂,广泛应用于消化系统疾病的治疗。作 为一种关键的有机合成药物,奥美拉唑的合成工艺研究历来受到重视。本次演示 将围绕奥美拉唑的合成工艺研究展开讨论,探讨相关的实验设计、反应机理、工 艺优化等内容,以期为未来的研究提供参考和启示。
关键词
奥美拉唑、合成工艺、研究、反应机理、工艺优化、质子泵抑制剂
催化氢化法是以苯并咪唑为原料,在催化剂的作用下进行氢化反应得到醇, 再经过成盐得到奥美拉唑。该方法的优点是反应条件温和、收率高、成本低,但 需要使用催化剂,且对于某些特殊杂质的处理较为困难。
除了以上两种方法外,还有一些新的合成工艺正在研究阶段,如光催化法、 电化学法等。这些新工艺的研究为奥美拉唑的合成提供了更多的选择,有望在未 来实现工业化生产。
奥美拉挫生产工艺流程

奥美拉挫生产工艺流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!奥美拉唑是一种常用的质子泵抑制剂,用于治疗胃酸过多引起的疾病,如胃溃疡、十二指肠溃疡等。
奥美拉唑的工艺规程

燃, 桶或 有 180KG/ 毒, 桶 腐蚀 性药 品
怕湿 防止 日晒 不与 酸类 混放
40kg/袋 或
50kg/袋
GB/T6026- 外 透明液体
1998
观
怕 160KG/ GB190-
11.1设备一览表··················································19 11.2主要设备生产能力···········································20 12.原材料、能源消耗定额和技术经济指标····························20
14.1物料平衡计算公式···········································23 14.2换算表······················································23 15.附页····························································23
水合 肼
工 HG-T3259- 外 大于55%水合肼 腐 200KG/ GB/T191-
业 2004
观 为无色透明发 蚀, 桶
2000
烟液体怕晒Βιβλιοθήκη 药品,不与
氧化
剂,
植物
纤维
混存
过氧 化氢
工 GB1616业 2003
外 无色透明液体 观
防止 不超过 日光 50KG/ 照射 桶 或受 热,
GB1912000
1.1 产品名称:【中文名称】: 奥美拉唑 【简写拼音】: AMLZ 【外文名】Omeprazole、Losec
化学制药工艺--奥美拉唑的生产工艺原理

化学制药工艺--奥美拉唑的生产工艺原理奥美拉唑的生产工艺原理一概述1 药物名称结构式【中文名称】奥美拉唑(omeprazole),又名洛赛克(losec_)或亚砜咪唑(Moprial_),安胃哌唑,奥美拉唑,甲氧磺唑,沃必唑,渥米哌唑等【英文名称】Antra、Aoxikang、Audazol、H-168/68、Logastric、Losec、Mepral、Miol、Mopral、Moprial、Norpramin、Omapren、Omepral、Omeprazen、Omeprazolum、Parizac、Prilosec、Zoltum【化学名称】5-甲氧基-2-{[(4-甲氧基-3,5-二甲基-2-吡啶基)-甲基]-亚磺酰基}-1H-苯并咪唑【结构式】2 理化性质纯净的奥美拉唑为白色结晶或结晶性粉末,溶于二氯甲烷、三氯甲烷,几乎不溶于乙腈和乙酸乙酯,熔点为147~150℃[1]。
奥美拉唑呈弱碱性,在pH值=7~9的条件下化学稳定性好。
3 药理作用【药效学】本药为具有脂溶性的质子泵抑制药,呈弱碱性,易浓集于酸性环境中,能特异性地作用于胃壁细胞顶端膜构成的分泌性微管和胞质内的管状泡上(即胃壁细胞质子泵所在部位),并转化为亚磺酰胺的活性形式,然后通过二硫键与质子泵的巯基呈不可逆结合,生成亚磺酰胺与质子泵(H+-K+?ATP酶)的复合物,从而抑制该酶活性,使壁细胞内的H+不能转运到胃腔中,阻断了胃酸分泌的最后步骤,使胃液中的胃酸量大为减少。
实验证明,本药对基础胃酸分泌和由组胺、五肽胃泌素及刺激迷走神经引起的胃酸分泌具有强而持久的抑制作用,对H2受体阻断药不能抑制的由二丁基环腺苷酸引起的胃酸分泌亦有明显的抑制作用。
由于本药对质子泵的抑制作用具有不可逆性,故本药的抑酸作用时间长,只有待新的质子泵形成后,才能恢复其泌酸作用。
健康志愿者单次口服本药,其抗酸作用可维持24小时;多次口服(1周)可使基础胃酸和五肽胃泌素刺激引起的胃酸分泌抑制70%-80%。
制药工艺奥美拉唑的生产工艺原理

加强环保意识宣传,提高员工的环保意识。同时,企业应 建立完善的环境保护制度,确保生产过程中的废气、废水 等达标排放。
06 总结与展望
本次项目成果回顾
01
成功研发出高效、稳定的奥美拉唑生产工艺,实现了工业化 生产。
02
通过优化反应条件和改进工艺流程,提高了产品质量和收率 ,降低了生产成本。
进一步提高产品的纯度和质量。
完善检测手段,如薄层色谱法、紫外可见分光光度法等
对产品进行全面质量控制,确保产品质量符合相关标准。
04 设备选型及操作要点
设备类型及特点分析
反应釜
01
用于奥美拉唑的合成反应,具有高温高压操作能力,良好的搅
拌效果和传热性能。
离心机
02
用于分离反应液中的固体和液体,具有高效分离、易操作、维
检测方法
采用高效液相色谱法(HPLC)、紫外可见分光光度法(UV)、红外光谱法 (IR)等方法对奥美拉唑进行定性定量分析,确保产品质量符合标准。
生产过程中安全保障措施
设备安全
选用符合GMP要求的设备,定期进行维护和保养,确保设备运行稳 定,减少故障率。
操作安全
制定详细的操作规程,对员工进行定期培训,提高员工的安全意识 和操作技能。
在离心前需对反应液进行预处理,如过滤去除大颗粒杂质 等。离心时应选择合适的转速和时间,确保固体和液体完 全分离。离心后应及时清洗离心机,防止残留物对下次操 作的影响。
干燥设备操作
在干燥前需对奥美拉唑湿品进行适当处理,如破碎成大颗 粒或喷雾成小液滴等。干燥时应控制好温度和真空度,避 免产品受热过度或氧化变质。干燥后应及时清理干燥设备 ,确保下次操作的顺利进行。
物料安全
对原料、辅料、包装材料等物料进行严格的质量控制,确保物料质量 符合标准,防止不合格物料进入生产环节。
奥美拉唑生产工艺流程框图0603

回流
过滤
乙酸
调节 pH
结晶
回收活性炭 尾气处理
图14-7 5-甲氧基-1H-苯并咪唑-2-硫醇制备工艺流程框图
抽滤
废液
滤饼 干燥
5-甲氧基-1H苯并咪唑-2-硫醇
2,3,5-三甲基吡啶 H2O2
冰醋酸
氧化 反应
减蒸
NaOH
调节 pH
醋酸、水
氯仿
无水Na2SO4
萃取 有机相 干燥
减压 浓缩
废液
回收氯仿
图14-8 2,3,5-三甲基吡啶-N-氧化物的制备工艺流程框图
真空干燥
2,3,5-三甲基吡啶N-氧化物
浓硫酸 硝酸
2,3,5-三甲基吡啶-
N-氧化物
NaOH
硝化反应
调节pH
氯仿
无水Na2SO4
萃取
干燥
减压浓缩
废水
回收氯仿
固化
4-硝基-2,3,5三甲基吡啶-N-氧化 物
图14-9 4-硝基-2,3,5-三甲基吡啶-N-氧化物制备的工艺流程框图
水
硫醇钠合成
甲醇
Williams 反应
蒸馏
萃取
减压 浓缩
重结晶
硫醚
回收甲醇
废液
回收乙酸乙酯
图14-13 硫醚的制备工艺流程框图
硫醚
MCPBA的 氯仿溶液
饱和NaHCO3水溶液、水
无水MgSO4
氯仿
氧化反应
洗涤
干燥
减压 浓缩
回收氯仿
图14-14 奥美拉唑的制备工艺流程框图
乙腈
重结晶
奥美拉唑成品
4-甲氧基-2-硝基苯胺
4-甲氧基-2硝基苯胺
浓盐酸 二氯亚锡
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十四章奥美拉唑生产工艺学习目标:掌握采用追溯求源法进行奥美拉唑化学合成工艺路线设计的思路,了解各条工艺路线的优缺点。
掌握奥美拉唑及主要中间体的生产工艺原理、工艺条件的选择及控制,熟悉奥美拉唑及主要中间体的生产工艺过程,了解奥美拉唑的三废处理方法。
奥美拉唑在临床上被广泛用于治疗胃酸相关性的疾病,如胃溃疡、十二指肠溃疡等,是20世纪消化性溃疡治疗史上的新里程碑。
从不同起始原料出发,可设计出多条奥美拉唑的化学合成工艺路线。
本章以国内广泛采用的合成路线为例,介绍奥美拉唑的生产工艺原理及其过程。
14.1 概述奥美拉唑为第一个上市的质子泵抑制剂,能特异性地作用于胃壁细胞膜中的H+/K+-ATP 酶(质子泵),从而阻断胃酸分泌的终端步骤,产生强力的抑制胃酸分泌作用。
其作用特异性高,作用强大且时间长,临床广泛用于治疗胃酸相关性的疾病,如胃溃疡、十二指肠溃疡、反流性食管炎和卓-艾氏综合征等。
14.1.1 奥美拉唑的理化性质奥美拉唑(Omeprazole),化学名称为:5-甲氧基-2-{[(4-甲氧基-3,5-二甲基-2-吡啶基)-甲基]-亚磺酰基}-1H-苯并咪唑,英文化学名称为:5-methoxy-2-[(4-methoxy-3,5-dimethylpyridin-2-yl)methylsulfinyl]-1H-benzimidazole。
化学结构式如图14-1所示。
结构中亚磺酰基(亚砜基)的S原子所连的两个取代基不同,S原子具有手性,亚砜具有光学活性。
最初上市的药物奥美拉唑是外消旋体。
图14-1 奥美拉唑的结构(1)奥美拉唑为白色或类白色结晶性粉末;无臭;遇光易变色。
在二氯甲烷中易溶,在水、甲醇或乙醇中微溶;在0.lmol/L氢氧化钠溶液中溶解。
几乎不溶于乙腈和乙酸乙酯,熔点为156℃。
奥美拉唑呈弱碱性,在pH值=7~9的条件下化学稳定性好。
14.1.2 奥美拉唑的临床应用奥美拉唑为苯并咪唑类质子泵抑制剂,能特异性地作用于胃壁细胞膜中的H+/K+-ATP酶(质子泵),从而阻断胃酸分泌的终端步骤,产生强力的抑制胃酸分泌作用。
奥美拉唑是一种无活性的前药,是非竞争性酶抑制剂。
口服后,由于其为弱碱性化合物,在pH值为7的环境中不易解离,为非活性状态。
通过细胞膜进入胃壁细胞分泌小管的高酸性环境中,在H+的影响下,依次转化为螺环中间体,次磺酸和次磺酰胺。
次磺酰胺是奥美拉唑的活性代谢物,其结构中的硫原子可与H+/K+-ATP酶α-亚单位上的半胱酸残基(cys)中的巯基共价结合形成二硫键,不可逆地使H+/K+-ATP酶失活,导致胃壁细胞内的H+不能转运到胃腔中,阻断了胃酸分泌的最后步骤,使胃液中的胃酸量大为减少。
临床用于治疗胃酸相关性的疾病,如消化性溃疡、反流性食管炎和卓-艾氏综合征(胃泌素瘤)。
14.1.3 奥美拉唑的研发历史奥美拉唑是瑞典ASTRA 公司研制开发的第一代苯并咪唑类质子泵拮抗剂,商品名为洛赛克(Losec ),于1988年首次上市。
到目前已有60多个国家和地区批准和使用, 1998-2000年连续三年列全球畅销药物的第一名,是20世纪消化性溃疡治疗史上的新里程碑。
2000年10月奥美拉唑的专利期满,ASTRA 公司推出了奥美拉唑的S-对映异构体(图14-1)埃索美拉唑(esomeprazole )或依索拉唑,商品名为耐信(Nexium ),适用症范围和奥美拉唑基本相同。
但比洛赛克作用更强,在控制胃酸水平减轻疼痛症状和促进愈合方面更有效。
耐信的全球销售额逐年增长,年销售额达37亿美元,是近年来最热销的抗溃疡药品。
14.2 奥美拉唑合成工艺路线的设计与选择从奥美拉唑的结构出发,采用追溯求源法对其进行化学合成工艺路线的设计,采用不同的切断方式,可得到三条合成路线。
对各路线进行分析和比较,筛选得到一条适合工业生产的最佳路线。
本节对奥美拉唑的合成工艺路线进行设计和分析。
14.2.1 奥美拉唑的结构拆分从奥美拉唑的结构出发,首先要确定其基本骨架和官能团以及二者的结合情况,找出易拆键部位。
采用追溯求源法对其结构进行逆向切断,考虑其前体可能是什么以及经什么反应可以构建该连接键。
反复追溯求源直到最简单的化合物,即起始原料为止,便可设计出奥美拉唑的化学合成路线。
图14-2 奥美拉唑结构的拆分如图14-2所示,奥美拉唑为苯并咪唑类化合物,结构上可以分为苯并咪唑和取代吡啶两部分。
亚磺酰基可由硫醚氧化而成,在最后一步反应中进行。
根据连接苯并咪唑和取代吡啶两部分的甲硫基构建方式的不同,可有四种不同的切断方式,分别以图14-2中的a, b, c, d 来表示。
其中a,b 两种切断方式比较类似,硫醚键的生成可由不同的硫醇和氯代化合物经缩合反应而得,称为缩合反应路线;从c 处切断,由4-甲氧基邻苯二胺和连有吡啶取代基的甲硫基甲酸发生环合反应,生成咪唑环,称为环合反应路线;而从d 处切断的话,则可由苯并咪唑亚磺酰基的碱金属盐与吡啶鎓盐发生反应,将吡啶环与亚磺酰基相连,称为鎓盐反应路线。
相应地,可设计出如下三条合成路线。
14.2.2 缩合反应工艺路线a 和b 两种切断方式均属于缩合反应路线。
从a 处切断,5-甲氧基-1H-苯并咪唑-2-硫醇(2)与 2-氯甲基—3,5-二甲基-4-甲氧基吡啶盐酸盐(3)缩合形成硫醚(4),再经氧化反应生成亚磺酰基,得到奥美拉唑(1)。
a b c d N NO SN O H这条路线的核心是合成5-甲氧基-1H-苯并咪唑-2-硫醇(2)与2-氯甲基-3,5-二甲基-4-甲氧基吡啶盐酸盐(3)两个关键中间体。
14.2.2.1 5-甲氧基-1H-苯并咪唑-2-硫醇(2)的合成以对氨基苯甲醚(5)为原料,经氨基保护和硝化反应生成4-甲氧基-2-硝基乙酰苯胺(6),脱保护得到4-甲氧基-2-硝基苯胺(7),再用SnCl2/HCl、Fe/HCl法或催化氢化等方法还原硝基,生成4-甲氧基邻苯二胺(8)。
形成咪唑环有三种方法,分别以中间体(6)、(7)、(8)为原料。
4-甲氧基-2-硝基乙酰苯胺(6)的硝基还原,制备得到2-氨基-4-甲氧基乙酰苯胺(9),然后与异硫氰酸苯酯或异硫氰酸烯丙酯反应,加热回流环合,生成5-甲氧基-1H-苯并咪唑-2-硫醇(2)。
由2-氨基-4-甲氧基乙酰苯胺(9)到中间体(2),两步反应的收率可达65%。
但由于异硫氰酸苯酯或异硫氰酸烯丙酯来源困难,大量制备受到限制。
4-甲氧基-2-硝基苯胺(7)与Zn/HCl/CS2作用,在50~55℃条件下反应4h,硝基还原和环化“一勺烩”得到5-甲氧基-1H-苯并咪唑-2-硫醇(2),收率为94%。
反应条件温和,收率高,有很高的实用价值。
4-甲氧基邻苯二胺(8)在CS2/KOH/C2H5OH条件下成咪唑环,或者4-甲氧基邻苯二胺(8)不经分离,直接与乙氧基黄原酸钾作用制得5-甲氧基-1H-苯并咪唑-2-硫醇(2)。
该工艺反应条件温和,工艺成熟,是国内厂家生产奥美拉唑采用的方法。
14.2.2.2 2-氯甲基-3,5-二甲基-4-甲氧基吡啶盐酸盐(3)的合成现有两条路线合成2-氯甲基-3,5-二甲基-4-甲氧基吡啶盐酸盐(3),分别以3,5-二甲基吡啶(10)和2,3,5-三甲基吡啶(13)为起始原料。
以3,5-二甲基吡啶(10)为起始原料:3,5-二甲基吡啶经氧化、硝化和醚化,生成3,5-二甲基-4-甲氧基吡啶-N-氧化物(11),在硫酸二甲酯和连二硫酸铵的作用下,发生重排反应,得到2-羟甲基-3,5-二甲基-4-甲氧基吡啶(12)。
最后经氯化反应,生成盐酸盐(3)。
这条路线曾是工业采用的方法,但由3,5-二甲基-4-甲氧基吡啶-N-氧化物(11)生成(12)这步反应收率低,仅为40%,这是此路线的不足之处。
在2,3,5-三甲基吡啶(13)的来源得到解决后,该路线已逐渐被代替。
以2,3,5-三甲基吡啶(13)为起始原料:与前面路线相似,2,3,5-三甲基吡啶(13)经氧化、硝化和醚化反应,生成2,3,5-三甲基-4-甲氧基吡啶-N-氧化物(16),在乙酸酐的作用下,发生重排反应,得到2-羟甲基-3,5-二甲基-4-甲氧基吡啶(12),最后经氯化反应,生成盐酸盐(3)。
工业上采用此路线生产奥美拉唑。
若是在图2中的b处切断,则是以2-氯-5-甲氧基-1H-苯并咪唑(17)与3,5-二甲基-4-甲氧基-2-吡啶甲硫醇(18)为原料,缩合生成奥美拉唑。
反应条件与从a处切断相似,但是两种原料来源困难,合成难度大,实用价值不大。
14.2.3 环合反应路线在酸性条件下,4-甲氧基邻苯二胺(8)和2-[(3,5-二甲基-4-甲氧基-2-吡啶基)甲硫基]甲酸(19)反应,环合生成咪唑环,在高碘酸钠作用下氧化成产物奥美拉唑,两步反应收率75%。
但2-[(3,5-二甲基-4-甲氧基-2-吡啶基)甲硫基]甲酸(19)的合成路线长,制备困难,使整个路线较长,后处理麻烦,总收率低于缩合反应路线。
14.2.4 鎓盐反应路线5-甲氧基-2-甲基亚磺酰基-1H-苯并咪唑在丁基锂的作用下,-15℃反应生成碱金属盐(20),再与1,4-二甲氧基-3,5-二甲基吡啶鎓盐(21)作用,生成奥美拉唑。
这条路线的特点是不使用制备困难的2-卤代吡啶,但是碱金属盐要求在低温下进行制备,丁基锂价格昂贵而且遇水和空气分解,反应条件要求苛刻。
14.2.5生产工艺路线的选择通过对以上三条合成路线的分析,可以得出结论: 缩合反应路线(a处切断)为最佳路线,即以对氨基苯甲醚(5)和2,3,5-三甲基吡啶(13)为起始原料,以5-甲氧基-1H-苯并咪唑-2-硫醇(2)和2-氯甲基-3,5-二甲基-4-甲氧基吡啶盐酸盐(3)为关键中间体的合成工艺路线(图14-3)。
,图14-3 奥美拉唑的生产工艺路线14.3 奥美拉唑的生产工艺原理及其过程本节以缩合反应路线为例,以对氨基苯甲醚(5)和2,3,5-三甲基吡啶(13)为起始原料,以5-甲氧基-1H-苯并咪唑-2-硫醇(2)和2-氯甲基-3,5-二甲基-4-甲氧基吡啶盐酸盐(3)为关键中间体,介绍奥美拉唑的生产工艺原理及其过程。
14.3.1 5-甲氧基-1H-苯并咪唑-2-硫醇(2)的生产工艺原理及过程14.3.1.1 合成工艺路线以对氨基苯甲醚(5)为起始原料,经乙酰化保护、硝化、脱保护得到4-甲氧基-2-硝基苯胺(7),SnCl2/HCl法还原硝基,生成的4-甲氧基邻苯二胺(8),在CS2/KOH/C2H5OH条件下成咪唑环,或者4-甲氧基邻苯二胺不经分离,直接与乙氧基黄原酸钾作用,生成5-甲氧基-1H-苯并咪唑-2-硫醇(2)。
14.3.1.2 4-甲氧基-2-硝基乙酰苯胺(6)的合成工艺以对氨基苯甲醚(5)为起始原料,经乙酰化保护和硝化一勺烩反应,再经结晶、抽滤、干燥等单元操作制备4-甲氧基-2-硝基乙酰苯胺(6)的工艺流程如图14-4所示。
