432 金属指示剂
常用金属指示剂

常用金属指示剂①铬黑T铬黑T属于O,O′-二羟基偶氮类染料,简称EBT,化学名称是1-(1-羟基-2-萘偶氮基)-6-硝基-2-萘酚-4-磺酸钠,铬黑T溶于水时,磺酸基上的Na+全都解离,形成H2In-,它在溶液中有下列酸碱平衡:pKa2=6.3 pKa3=11.55H2In-=== HIn2- === In3-紫红蓝橙根据酸碱指示剂的变色原理,可近似估计出铬黑T在不同pH下的颜色如下:pH=pKa2=6.3时,[H2In-]=[HIn2-],呈现蓝色与紫红色的混合色;pH<6.3时,[H2In-]>[HIn2-],呈紫红色;pH=6.3~11.55 时,呈蓝色;pH>11.55时,呈橙色。
铬黑T与金属离子形成的配合物显红色。
可以预料,在pH<6.3和pH>11.55的溶液中,由于指示剂本身接近红色,故不能使用。
根据实验结果,使用铬黑T的最适宜酸度是pH=9~10.5。
在pH=10的缓冲溶液中,用EDTA直接滴定Mg2+、Zn2+、Cd2+、Pb2+和Hg2+等离子时,铬黑T是良好的指示剂,但Al3+、Fe3+、Co2+、Ni2+、Cu2+、Ti4+等对指示剂有封闭作用。
固体铬黑T性质稳定,但其水溶液只能保存几天。
这是由于发生聚合反应和氧化反应的缘故。
铬黑T的聚合反应如下:nH2In- (H2In-)n紫红色棕色在pH<6.5的溶液中,聚合更为严重。
指示剂聚合后,不能与金属离子显色。
在配制溶液时,如加入三乙醇胺,可减慢聚合速度。
在碱性溶液中,空气中的O2以及Mn(IV)和Ce4+等能将铬黑T氧化并褪色。
加入盐酸羟氨或抗坏血酸等还原剂,可防止其氧化。
配制指示剂的另一方法是:将铬黑T与干燥的纯NaCl按1:100混合研细,密闭保存。
使用时用药匙取约0.1g,直接加于溶液中。
用以指示滴定终点的试剂。
在各类滴定过程中,随着滴定剂的加入,被滴定物质和滴定剂的浓度都在不断变化,在等当点附近,离子浓度会发生较大变化,能够对这种离子浓度变化作出显示(如改变溶液颜色,生成沉淀等)的试剂就叫指示剂。
酸碱指示剂的种类和用途

酸碱指示剂的种类和用途酸碱指示剂是化学实验中常用的一种试剂,可以通过改变颜色显示溶液的酸碱性质。
根据其化学性质和颜色变化特点的不同,酸碱指示剂可以分为多种类型。
本文将介绍常见的酸碱指示剂的种类和用途。
一、自然指示剂1. 红蓝石蕊(litmus)红蓝石蕊是应用广泛的自然指示剂,它可以将溶液的酸碱性质显示为红色或蓝色。
当溶液为酸性时,红蓝石蕊呈现红色;当溶液为碱性时,红蓝石蕊呈现蓝色。
这种指示剂比较方便使用,对一般实验来说已经足够。
2. 酚酞(phenolphthalein)酚酞是另一种常见的自然指示剂,它在酸性溶液下呈现无色,而在碱性溶液下呈现粉红色。
酚酞的颜色转变非常明显,适用于中性溶液和弱碱溶液的测定。
二、合成指示剂1. 甲基橙(methyl orange)甲基橙是一种合成指示剂,它在酸性溶液下呈现红色,而在碱性溶液下呈现黄色。
甲基橙的颜色转变较为鲜明,适用于酸碱中度浓度测定。
2. 溴腈酚蓝(bromothymol blue)溴腈酚蓝是一种常见的合成指示剂,它在酸性溶液下呈现黄色,而在碱性溶液下呈现蓝色。
溴腈酚蓝的颜色转变范围较宽,青绿色是其中间的过渡颜色,常应用于酸碱量的测定。
3. 苏丹红(sudan red)苏丹红是一种有机合成指示剂,它在酸性溶液下呈现红色,而在碱性溶液下呈现粉红色。
苏丹红的颜色转变较为饱和,适用于高酸度和高碱度的测定。
三、金属指示剂1. 酞菁钴(cobalt thiocyanate)酞菁钴是一种金属指示剂,它在酸性溶液中呈现红色,而在碱性溶液中呈现蓝色。
酞菁钴的颜色转变非常明显,适用于测定沉淀中的酸碱度。
2. 锌指示剂(zinc indicator)锌指示剂是一种金属指示剂,它在酸性溶液中呈现无色,而在碱性溶液中呈现蓝色。
锌指示剂对于酸碱中度浓度的测定具有较高的准确性。
四、其他指示剂除了上述常见的酸碱指示剂外,实验中还可以使用一些特殊的指示剂,如溴酚蓝(bromophenol blue)、溴酚绿(bromophenol green)和酮酚蓝(thymol blue)等。
金属指示剂

络合滴定的滴定曲线 (2) )
• 左图为在 不同pH值 时以 左图为在不同 值 不同 0.010mol/LEDTA 滴 定 + 0.01mol·L 的Ca2+(仅考 虑酸效应的影响) 虑酸效应的影响) 。
• 络合物的条件稳定常数 大 小 随 pH 值 而 变 化 . 当 pH 值 为 7 时 ,lgK′Ca = 7.3 , 曲线上看不到突跃。 曲线上看不到突跃。 • 所以 溶液pH值的选择在 所以,溶液 值的选择在 溶液 络合滴定法中十分重要 。
小结( ) 小结(2)
3. MIn与In在测定的体系中呈现的颜色, 与 在测定的体系中呈现的颜色 在测定的体系中呈现的颜色, 要有较显著的差别,有利终点的确定。 要有较显著的差别,有利终点的确定。 4. 指示剂与金属离子的反立必须迅速, 指示剂与金属离子的反立必须迅速, 且有较好的可逆性。 且有较好的可逆性。
金属指示剂指示终点原理( ) 金属指示剂指示终点原理(3)
• 临近终点时的滴定反应 临近终点时的滴定反应: Y + MgIn (红色 = MgY + In(蓝色) 红色) 红色 (蓝色) • pH=10 络合剂将与指示剂络合的金属离子夺取出来,使 络合剂将与指示剂络合的金属离子夺取出来 使 指示剂游离出来,在该介质条件下呈现指示剂本 指示剂游离出来,在该介质条件下呈现指示剂本 身的颜色. 身的颜色 根据上面的讨论,络合滴定中金属离子指示剂指 根据上面的讨论 络合滴定中金属离子指示剂指 示终点的原理可用下面的通式表示: 示终点的原理可用下面的通式表示 Y+MIn=MY+In = MIn与In(游离指示剂 的颜色有较显著的差别 游离指示剂)的颜色有较显著的差别 与 游离指示剂
• • •
四、金属指示剂的选择和滴定误差(1) 金属指示剂的选择和滴定误差( )
金属指示剂

化学计量点时:
由于滴定反应已经按计量关系完成,溶液中[Zn’]来自络 合物ZnY的解离,所以根据化学计量点时的平衡关系:
Zn2 Y ZnY
Znsp
Znsp
cZspn Zn spcZspn12cZn
KZ' nY[Z[Zn']n[YY]']
cZspn [Zn']2sp
即 [Zn']sp cZspn/KZ' nY
lg1–lg4分别为2.27,4.61,7.01和9.06;
lgKZnY=16.50
pH 10时: lgZnOH 2.4 Zn(NH3) 1 1[NH3] 2[NH3]2 3[NH3]3 4[NH3]4
1102.27101.00 104.61102.00 107.01103.00 109.06104.00
⑷ MIn一般易溶于水,终点变色反应灵敏、迅速,有良好 可逆性。
⑸ 指示剂性质稳定,便于贮藏和使用。
四、金属指示剂在使用中存在的问题
1、指示剂的封闭现象
有时指示剂能与金属离子生成极为稳定的络合物,比对应的MY络合物 更稳定,以致达到化学计量点,滴入过量EDTA也不能夺取指示剂络合物 (MIn)中的金属离子,使指示剂不能释放出来,看不到颜色的变化,这种 现象叫指示剂的封闭现象。
(2) 金属离子的指示剂络合物(MIn)应该足够稳定。否则,在 化学计量点前,就会分解而显示出指示剂本身的颜色,→ 终点提前,颜色变化也不敏锐。
但“M-In”络合物的稳定性应小于“M-EDTA”络合物的稳 定性,才能使EDTA滴定到化学计量点时将指示剂从“ MIn”络合物中取代出来。
⑶ 指示剂应具有一定的选择性,即在一定条件下,只对其一 种(或某几种)离子发生显色反应。
金属指示剂具备的条件

金属指示剂具备的条件金属指示剂是一种用于检测金属离子存在与否或进行金属离子浓度分析的化学试剂。
以下是金属指示剂具备的一些条件和相关参考内容。
1. 明显的颜色变化能力:金属指示剂应能够产生明显的颜色变化来指示金属离子的存在。
这是由于金属离子与金属指示剂发生配位或氧化还原反应而产生的。
颜色变化应该是可观察的,以便进行定性或定量分析。
2. 选择性:金属指示剂应该具备一定的选择性,即能够与特定金属离子发生反应,而不与其他金属离子发生反应。
这可以通过合适的配体选择和反应条件控制来实现。
例如,酞菁类染料可以选择性地与铜离子反应形成稳定的络合物。
3. 灵敏度:金属指示剂应具备足够的灵敏度,即能够检测到低浓度的金属离子。
这可以通过增加指示剂的摩尔吸光系数或灵敏度来实现。
4. 耐久性:金属指示剂应该稳定,并能在常规实验条件下保持其反应性能。
这样可以确保金属指示剂的可靠性和可重复性。
5. 可逆性:金属指示剂的颜色变化应该是可逆的,即颜色变化能随金属离子的存在或消失而变化。
这样可以进行多次使用和操作。
除了以上条件,金属指示剂的选择还受到以下因素的影响:- 容易获取和储存的:金属指示剂应该是容易获得和储存的,以便在实验室中广泛使用。
- 经济性:金属指示剂的制备成本应该相对较低,能够提供经济有效的分析方法。
- 可持续性和环境友好性:金属指示剂的使用和处理过程应符合环境保护的要求,不对环境造成污染或危害。
金属指示剂的研究和开发是一个广泛的领域,有许多文献和研究文章可供参考。
例如,研究人员可以通过查阅化学文摘数据库或相关学术期刊来了解最新的金属指示剂制备和应用方法。
一些常见的金属指示剂家族包括酞菁类染料、锂离子缓冲盐、肼氧化铀盐等。
此外,相关化学实验教材和指南中也会提供关于金属指示剂的详细信息和实验操作步骤,供学生和实验员参考。
分析化学第6章金属指示剂

15
判断单一离子能否准确滴定
Et
10pM 10-pM (K (MY) csp (M))1/ 2
当pM=±0.2 , Et≤±0.1%时 计算: csp(M) ·K ’(MY)≥10 6.0
若 csp(M) = 0.01mol·L-1 则 K ’ (MY)≥108.0
即 lg K ’ (MY)≥8.0
6.4.1 金属指示剂
1. 金属指示剂的作用原理 EDTA
In + M
MIn + M A色
MY + In B色
要求: 1)A、B颜色不同(合适的pH); 2)反应快,可逆性好; 3)稳定性适当,K(MIn) < K(MY).
1
EBT(铬黑T)
O-
HO
NN
-O3S
+ Mg2+
HIn2- (蓝)
NO2
此pH下Bi3+水解,影响滴定.
➢ 实际上,在pH=1.0条件下滴定Bi3+ (XO指示剂)
lgY(H)=18.3, lgK(BiY’)=27.9-18.3=9.6
可以准确滴定Bi3+
滴定Bi3+后, 用N4(CH2)6调pH至5左右,继续滴定Pb2+.
28
6.7 使用掩蔽剂提高滴定选择性
(clgK’<5.0)
O
Mg O
NN
-O3S
MgIn-(红)
lgK(MgIn)=7.0
NO2
2
EBT本身是酸碱物质
H3In pKa1 H2In- pKa2
紫红 3.9 紫红 6.3
HIn2- pKa3 In3-
蓝 11.6 橙 pH
EBT适用pH范围:8~10
四金属离子指示剂的作用原理

滴定过程
滴定反应
体系颜色变化
滴定开始前,加入金属
M + In(甲色) = MIn(乙色)
指示剂
甲色变成乙色
滴定开始至滴定终点 前
保持乙色不变
滴定终点
乙色变成甲色
滴定前: M + In = MIn 溶液颜色是金属离子M与MIn 叠加色 化学计量点时: MIn+Y=MY+In 溶液的颜色是MY与In 的叠加色
又ቤተ መጻሕፍቲ ባይዱ
滴定突跃即指化学计量点前后允许误差(这里选为
)范围内的 pPb
值,相应的 pPb 值是 6.8±1.8,即滴定突跃为 pPb 5.0 ~ 8.6。 查附录表 14,二甲
酚橙在 pH=5.0 时的 pPbep=7.0, 正处于滴定突跃范围内,所以它是合适的指示剂。
例题 pH=5.0 时,用 0.02000 mol.L-1 EDTA 滴定 20.OO ml 0.02000 mol.L-1 的金属 离子 M,当加入 EDTA 体积分别为 19.96ml 和 20.04ml 时,用电位法测得 pM 分 别为 4.7 和 7.3,求 KMY ? 解 :据
据滴定反应平衡
,
化学计量点时
故
取对数
六、终点误差
(一)定义公式
以EDTA(Y)滴定浓度为 的金属离子M
滴定反应
化学计量点时
nY = nM
设终点在化学计量点之前
剩余的M浓度为[M']余 ,终点时M的总浓度为cM,ep ,滴定终点总体积为Vep 终点误差
设终点在化学计量点之后 过量的Y的浓度为 ,终点误差
要求指示剂在突跃范围内发生颜色变化,且使指示剂变色点的pMep与化学计 量点的pMsp尽量一致。金属指示剂的条件与选择都比较苛刻,因为,在实际工作 中,金属指示剂易发生封闭与僵化现象。 (1)封闭:至化学计量点时,MIn络合物颜色不变的现象。 产生的原因:溶液中可能存在某些离子与指示剂形成十分稳定的络合物,且比该 金属离子与Y形成的螯合物还稳定,因而造成颜色不变。指示剂的封闭现象可以 是待测金属离子产生,也可以由体系中共存离子产生。如以铬黑T作指示剂,用 EDTA滴定Ca2+和Mg2+时,若有Fe3+,Al3+存在,就会发生封闭现象,可用三乙醇 胺与氰化钾或硫化物掩蔽Fe3+,Al3+而加以消除。 消除方法:可采用适当掩蔽剂加以消除。 (2)僵化:至化学计量点时,MIn络合物颜色变化缓慢的现象。 产生的原因:指示剂的僵化现象是指金属离子与指示剂生成难溶于水的有色络合 物,虽然它的稳定性比该金属离子与EDTA生成的螯合物差,但置换反应速度慢, 使终点拖长。一般采用加入适当的有机溶剂或加热来使指示剂颜色变化敏锐。如 用PAN作指示剂时,加入乙醇或丙酮或加热,可使指示剂颜色变化明显。
金属指示剂作用原理

金属指示剂的作用原理金属指示剂是一种能够与金属离子发生化学反应并产生可观察的颜色变化的化合物。
它通常用于检测金属离子的存在和浓度。
金属指示剂的作用原理涉及到化学配位和电子跃迁的过程。
下面将详细讨论金属指示剂的基本原理以及与之相关的化学现象。
1. 金属指示剂的选择金属指示剂的选择是根据所要检测的金属离子的特性和需要进行的分析方法进行的。
不同的金属离子对应的金属指示剂是不同的,因此在选择金属指示剂时需要考虑到金属离子的种类和浓度。
常见的金属指示剂包括:天蓝素、酞菁、卤代苯酚类、联醋酸纸、指示剂酶等。
这些指示剂根据不同的金属离子能够呈现出不同的颜色变化,在金属离子的存在下形成显色化合物。
2. 金属离子与配位反应金属指示剂与金属离子发生配位反应是金属指示剂作用的关键步骤。
在配位反应中,金属离子与金属指示剂中的配体发生配位作用,形成配位化合物。
配位反应的基本原理涉及到配体和金属离子之间的化学结合。
通常情况下,金属离子所具有的正电荷会与配体中的阴离子或氧化还原体发生静电或共价键结合,从而形成金属配合物。
这种配位反应是可逆的,其平衡状态可以通过配位反应的速度和反应条件来控制和调整。
3. 配位化合物的颜色变化金属指示剂的特殊之处在于它们与金属离子形成的配位化合物通常具有不同的颜色。
这是因为配合物中的金属离子所处的电子能级发生了改变,导致了电子跃迁的现象。
在配位化合物中,金属离子被配位体所包围,而配位体中的电子与金属离子之间发生相互作用。
这种相互作用导致了原子轨道的混合和重新排布,形成了新的电子能级。
当金属离子发生电子跃迁时,能级差的能量对应着某种特定的电磁辐射,通常体现为可见光的一部分。
这种辐射在光谱上表现为特定波长的吸收或发射峰,从而产生了特定的颜色。
不同金属离子和配体之间的电子跃迁能级差不同,因此产生的吸收或发射峰也不同,导致了不同的颜色变化。
这就是金属指示剂的颜色变化背后的基本原理。
4. 具体实例下面以酞菁作为金属指示剂为例,来解释金属指示剂的作用原理。
50种常用PH指示剂

50种常用PH指示剂1 乙氧基黄叱精指示液取乙氧基黄叱精0.1g,加乙醇100ml使溶解,即得。
变色范围pH3.5~5.5(红→黄)。
二甲基黄指示液取二甲基黄0.1g。
加乙醇100ml使溶解,即得。
变色范围pH2.9~4.0(红→黄)。
2 二甲基黄-亚甲蓝混合指示液取二甲基黄与亚甲蓝各15mg,加氯仿100ml,振摇使溶解(必要时微温),滤过,即得。
3 二甲基黄-溶剂蓝19混合指示液取二甲基黄与溶剂蓝19各15mg,加氯仿100ml使溶解,即得。
4 二甲酚橙指示液取二甲酚橙0.2g,加水100ml使溶解,即得。
5 二苯偕肼指示液取二苯偕肼1g,加乙醇100ml使溶解,即得。
6 儿茶酚紫指示液取儿茶酚紫0.1g,加水100ml使溶解,即得。
变色范围pH6.0~7.0~9.0(黄→紫→紫红)。
7 中性红指示液取中性红0.5g,加水使溶解成100ml,滤过,即得。
变色范围pH6.8~8.0(红→黄)。
8 孔雀绿指示液取孔雀绿0.3g,加冰醋酸100ml使溶解,即得。
变色范围pH0.0~2.0(黄→绿);11.0~13.5(绿→无色)9 石蕊指示液取石蕊粉末10g,加乙醇40ml,回流煮沸1小时,静置,倾去上层清液,再用同一方法处理2次,每次用乙醇30ml,残渣用水10ml洗涤,倾去洗液,再加水50ml煮沸,放冷,滤过,即得。
变色范围pH4.5~8.0(红→蓝)。
10 甲基红指示液取甲基红0.1g,加0.05mol/L氢氧化钠溶液7.4ml使溶解,再加水稀释至200ml,即得。
变色范围pH4.2~6.3(红→黄)。
11 甲基红-亚甲蓝混合指示液取0.1%甲基红的乙醇溶液20ml,加0.2%亚甲蓝溶液8ml,摇匀,即得。
12 甲基红-溴甲酚绿混合指示液取0.1%甲基红的乙醇溶液20ml,加0.2%溴甲酚绿的乙醇溶液30ml,摇匀,即得。
13 甲基橙指示液取甲基橙0.1g,加水100ml使溶解,即得。
变色范围pH3.2~4.4(红→黄)。
金属指示剂介绍课件

06
电化学指示剂:用于指示 溶液中的电化学反应情况
金属指示剂的化 学反应原理
显色反应原理
01
金属指示剂与金属离子形成配合物, 02
配合物的形成与金属离子的浓度和
使溶液颜色发生变化
指示剂的浓度有关
03
配合物的稳定性与金属离子的种类 04
显色反应的灵敏度和选择性与指示
和指示剂的结构有关
剂的结构和金属离子的种类有关
金属指示剂介绍课件
演讲人
目录
01. 金属指示剂的基本概念 02. 金属指示剂的化学反应原理 03. 金属指示剂的应用 04. 金属指示剂的发展趋势
金属指示剂的基 本概念
指示剂的定义
指示剂是一种 化学物质,用 于检测溶液中 的特定离子或
分子。
指示剂通常具 有特定的颜色 变化,当与特 定离子或分子 反应时,颜色 会发生改变。
全
材料科学领 域:用于研 究金属离子 对材料性能 的影响,优 化材料性能
绿色环保型指示剂的开发
绿色环保型指示剂的优点:低毒、无污染、 可降解
绿色环保型指示剂的应用领域:废水处理、 土壤修复、大气污染治理等
绿色环保型指示剂的研究进展:新型绿色环 保型指示剂的合成、性能优化、应用研究等
绿色环保型指示剂的发展趋势:更加高效、 环保、经济,满足可持续发展需求
反应条件
酸度:金属指 示剂通常在酸 性环境中反应
01
反应时间:反 应时间通常在 几分钟至数小 时之间
03
催化剂:某些 反应可能需要 催化剂来促进 反应进行
05
02
温度:反应温 度通常在室温 至80℃之间
04
反应物浓度: 反应物浓度通 常在0
06
金属指示剂
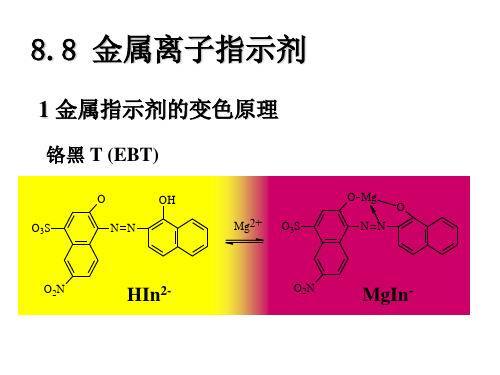
1 金属指示剂的变色原理
铬黑 T (EBT)
O
-
OH N N Mg2+
-
O Mg O3S N N
O
O3S
O2N
HIn2-
O2N
MgIn-
金属指示剂的变色原理 金属指示剂的变色原理
滴定前加入指示剂
In + M
游离态颜色
MIn
配合物颜色
滴定开始至终点前
Y
+
M
MY
MY无色或浅色 无色或浅色
(1)指示剂的封闭 ) 滴定前加入指示剂
In + M MIn
滴定开始至终点前 Y + M 终点
Y + MIn MY +
MY
由于K’MY < K’MIn , 反 应不进行
In
例如Cu 2+, Co 2+, Ni 2+, Fe 3+, Al 3+ 等对铬黑T 具有封闭作用。 等对铬黑T 具有封闭作用。 例如 终点
H6In
-
-4 H+ pKa1 ~pKa4
H2In4pKa5 = 6.3
HIn5-
pH pH < 6.3 pH > 6.3
型体及颜色
H2In4HIn5-
指示剂络合物颜色
2H+
+ M
MIn
+ຫໍສະໝຸດ H+适宜pH 范围:< 6.3 范围: 适宜
3 常用金属指示剂
吡啶基偶氮) 萘酚 萘酚) ( 吡啶基偶氮 (3) PAN金属指示剂 (1-(2-吡啶基偶氮)-2-萘酚) ) 金属指示剂
H2In
金属指示剂的僵化名词解释

金属指示剂的僵化名词解释
金属指示剂是一种用于检测金属离子的化学试剂。
它通常是一种有机
分子,能够与金属离子形成配合物,从而呈现出不同的颜色或发生其
他可观察的变化。
金属指示剂广泛应用于分析化学、环境监测、生物
医学等领域。
金属指示剂的作用基于其与金属离子之间的化学反应。
当金属指示剂
与金属离子配位时,它们之间的电荷转移会导致分子内部电荷分布的
改变,从而引起吸收光谱或发射光谱的变化。
这些变化可以通过光谱
仪等设备进行检测和定量分析。
不同种类的金属指示剂对不同类型的金属离子具有不同的选择性。
EDTA是一种常用于配合镁、钙等碱土金属离子的指示剂;硫氰酸铵则可选择性地配合铁离子;而苯酚蓝则可用于检测铜、镍等过渡金属离子。
在实际应用中,常见的金属指示剂包括溴甲酚绿、二茂铁、菲咯啉等。
它们具有灵敏度高、选择性好等优点,可广泛用于水质检测、食品安
全检测等领域。
同时,也有一些缺点,如对环境的影响、对人体的毒
性等问题需要注意。
金属指示剂是一种重要的化学试剂,在各个领域中都有广泛的应用和
研究。
随着科技的不断进步和需求的不断增加,金属指示剂也将不断
发展和完善。
3-3金属离子指示剂

所以 , 金属指示剂也是一种络合剂,它能与金属离子形
成与其本身颜色显著不同的络合物 , 因而它能够指示出溶液 中金属离子浓度的变化情况,从而指示滴定终点。
2、金属指示剂(In)的变色原理
滴定前溶液呈:(MIn+M)色;
滴定开始到化学计量点前溶液呈:(MIn+MY)色;
终点时,由于MY比MIn更稳定,发生MIn + Y = MY + In 即呈现:(MY+In)色, 所以:溶液颜色由(MIn+MY)色→(MY+In)色,表示终点到 达。 现以 EDTA 滴 定 Mg2+ 离子 ( 在 pH = 10 的条件下 ) ,用铬黑 T(EBT)作指示剂为例,说明金属指示剂的变色原理。
2、金属指示剂变色点(pMep) 在金属离子与指示剂的络合反应中,同样也存在副反应,
如指示剂的酸效应、金属离子的络合效应和共存离子的影
响等。 如果只考虑酸效应,即指示剂 In 与 H+ 的副反应,指示剂 的变色点: 在溶液中存在 MIn M +In
K MIn
K MIn [ MIn] [ MIn] [ M ][In' ] [ M ][In] In ( H ) In ( H )
金属指示剂

1. 血清钙的测定 在pH=12~13的碱性溶液中, 加入 钙指示剂, 血清中的部分钙离子先 与钙指示剂形成红色配合物, 然后 用EDTA标准溶液滴定, 到计量点 时, 滴加的EDTA夺取钙指示剂,使 钙指示剂游离出来, 溶液从红色变 为蓝色,即达滴定终点。
滴定前 Ca+In 滴定终点 CaIn+Y 红色
由以上数据看出EDTP可以 选择性滴定Cu2+ ,而Zn2+, Cd2+, Mn2+不对其产生干扰 。 不能采用上述方法消除干 扰时, 只有用分离的方法除去 干扰离子。
(七) EDTA标准溶液的配制和 标定 配制:通常用EDTA二钠盐
(Na2H2Y. 2H2O)配制成近似浓度
的溶液,再用标准物质标定。其 浓度为0.01~0.05moI/L。
(1) 指示剂离子的颜色和金属离子 与指示剂配合物的颜色应有明显 的差别, 且颜色变化要敏锐、迅 速、有可逆性. (2) 金属离子与指示剂配合物MIn的 稳定性要适当,既要有足够的稳定 性, 又要比金属离子与EDTA配合 物MY的稳定性小, 且两者相差要 在100倍以上.
(3) 金属离子与指示剂配位物 MIn应当是可溶的。 (4) 金属指示剂本身应当比较 稳定,便于贮存和使用.
此时的pM值以pMt表示,则有
lg KMIn lgIn(H) pMt lg KMIn
(式2-37)
在选择络合指示剂时,必须考虑
体系的酸度和指示剂的KMIn,使pMep
与pMsp尽量一致,至少应在化学计量
点附近的pM突跃范围内,否则误差
较大。
3. 金属指示剂的封闭、僵化现象及 其消除 指示剂的封闭: 有时当滴定到达 计量点时,虽滴入足量的EDTA也 不能从金属离子与指示剂配合物 MIn中置换出指示剂而显示颜色 变化,这种现象称为指示剂的封闭。
金属离子指示剂

[M ']ep [M ']sp 10pM ' [Y ']ep [Y ']sp 10pY '
TE%
[Y
' ]sp
10pY '
[M CMsp
' ]sp
10pM
'
100%
因为化计点时KM' Y(sp) KM' Y(ep)且[MY ]sp [MY ]ep
所以
[MY ]sp
[MY ]ep
[M ' ]sp [Y ' ]sp [M ' ]ep [Y ' ]ep
的溶解度太小,使得滴定剂EDTA与金属-指 示剂配合物的置换反应速度缓慢,终点拖长, 颜色变化不明显的现象。
Fe3+ 、Al3+ 、Cu2+ 、Co2+ 、Ni2+ 对EBT、 XO有封闭作用;若KMIn太小, 终点提前
解决办法:加入有机溶剂或加热,以增大 其溶解度。
河北农大化学系
C 指示剂的氧化变质现象 定 义: 金属指示剂大多是含有双键的有机
1.8 1011 1.0 106
1.8105 mol
/L
可见,当pH=11.00时,溶液中游离的Mg2+已 很少了,说明在此条件下,Mg(OH)2已沉淀很完 全了。
河北农大化学系
2.二甲酚橙(xylenol orange--XO)
• H3In4• 黄色
H+ + H2In5- pKa = 6.3 红色
• 它与金属离子形成的络合物为紫红色, Ni2+,Fe3+ 和Al3+封闭作用.
• 使用范围:pH﹤6的酸性溶液
金属指示剂 (2)综述

1.5~2.5 无 色
紫 红
pH=1.5~2.5Fe3+
5%水 ssal本身 溶液 无 色,FeY呈黄色
常见的金属指示剂(续)
指示剂 使用的 适宜 pH范 围 颜色变 化 In MIn 蓝 红 pH=12~13, Ca2+ 直接滴定的 离子 指示 剂配 制 注意事项
12~13 钙指示剂 (calconcarboxylic acid简称NN) PAN [1-(2pyridylazo)2-naphthol] 2~12
以 [In']/[MIn]=10/1 为临界值代入上式,求
得滴定终点时金属离子浓度为:
pMep=lgK'MIn+1
金属指示剂的选择和滴定误差(3)
• 由此可见,终点时pMep的值与所选用的指示剂 的 性 质 有 关 ( K'MIn 大 小 ) , 且 在 lgK'MIn~lgK'MIn+1之间。 • 选择的金属离子指示剂应使 pMep 与化学计量 点的pMsp尽量一致,或在此化学计量点附近的 pM突变范围内。 • 化学计量点的pMsp由下式求得:
1:100 Fe3+ Al3+ NaCl Ni2+TiIVCu2+ 2+ 2+ (固体) Mn Co 等 离子封闭NN 0.1% MIn在水中 乙醇 溶解度小,为 溶液 防止PAN僵 化,滴定时须 加热
黄
紫 红
pH=2~3Bi3+ Th4+ pH=4~5Cu2+ Ni2+Zn2+ Cd2+Pb2+ Mn2+Fe2+
四、金属指示剂的选择和滴定误差(1)
• 滴定体系中存在多种平衡:
