胎儿先天性肺囊腺瘤超声诊断价值
胎儿先天性肺囊腺瘤样畸形超声声像图特征及预后分析

malformation(CCAM).M ethods The ultrasonographic features of 21 cases of fetal CCAM conf irmed by
prenatal ultrasound were analyzed.And ultrasound findings were compared wit h t he postnatal thoracic computed
王丽敏 马小燕 涂艳萍 刘向娇 尚宁 俞钢 江玮
【摘要 】 目的 探讨胎儿先天性肺囊腺瘤样 畸形 (ccAM)超声声像 图特征 ,为胎儿 临床结局 评 估提供依据 。方法 分析 2l例产前超声诊 断为胎 儿 CCAM 的超声声像 图特征 ,并与产后 CT、手 术及随访结果进行对照 。结 果 (1)21例胎儿 CCAM 产前超声声像 图特征:CCAM I型 2例 (10%, 2/21),CCAM II型 13例 (62%,13/21),CCAM III型 6例 (28%,6/21); 位 于 一 侧 胸 腔 20例
tomography(ca3,surgical result and follow-up data.Results (1)Prenatal ultrasonographic findings:2 cases of
CCAM type I(10D/o,2/21),13 ca ses oftype II(62%,13/21),and 6 cases oftype III(28%,6/21).Ofthem,95%
.
The CVR was<
1.6 and>
1.6 in 16(76%,16/21)
an d 5(24%,5/21)cases respectively.After reaching the maximum volume,the size of mass remained
超声诊断胎儿肺囊腺瘤1例

超声诊断胎儿肺囊腺瘤1例发表时间:2014-07-14T15:49:27.047Z 来源:《中外健康文摘》2014年第12期供稿作者:吴红霞[导读] 先天性肺囊性腺瘤样病变(CCAM)是肺错构瘤之一,发病率约1:4000,大多数为单侧病变,或仅累计一侧肺叶。
吴红霞(河南省濮阳市妇幼保健院 457000)【中图分类号】R445.1 【文献标识码】B 【文章编号】1672-5085(2014)12-0264-01 1.病例分析:患者女,初产妇,23岁,妊娠29周,一般状况好,应用GE-730四维彩超诊断仪二位超声探头示:颅骨呈椭圆形光环,脑中线结构居中,侧脑室不宽,两侧丘脑可见,小脑半球形态正常,小脑蚓部可见,颅后窝池无增大;嘴唇连续可见,眼、鼻可见;脊柱排列整齐,肝、胆、胃肠、双肾、膀胱均可见,双侧肾盂无分离;胎儿四肢及手足均可见。
孕妇取仰卧位探头置于孕妇腹壁,探测胎儿胸腔,可见心脏受压位于右侧胸腔,心脏四腔心切面可见,左右房室大小对称,中央十字交叉存在,左右室流出道可见,左肺增大,约49mm*29mm,回声增强,右肺较小,回声正常,胸腔可见液性暗区,范围约23mm*12mm。
CDFI:左侧肺内可见肺动脉供血。
2.讨论:先天性肺囊性腺瘤样病变(CCAM)是肺错构瘤之一,发病率约1:4000,大多数为单侧病变,或仅累计一侧肺叶。
病理上分为三型:I 型为大囊肿型,II型为多个小囊肿,III型为“实质性”肿块。
文献报道70%-80%的CCAM病例预后较好,但由于病灶的存在和膨胀,使纵隔移位、血管心脏受压,可导致胎儿非免疫性水肿,如果食管受压患儿吞咽羊水减少,可出现羊水过多。
由于正常肺组织受压不能正常发育,产后可发生呼吸窘迫综合征。
产后部分病例需行病变肺叶切除术,其术后疗效一般均较好。
但有生机儿产前诊断中型至大型CCAM 或已出现胎儿水肿,可考虑终止妊娠。
因此,产前选择一种准确、有效的诊断方法至关重要。
对减少宫内及出生死亡率有很大帮助。
产前超声测量肺头比评估胎儿肺囊腺瘤样畸形预后的价值
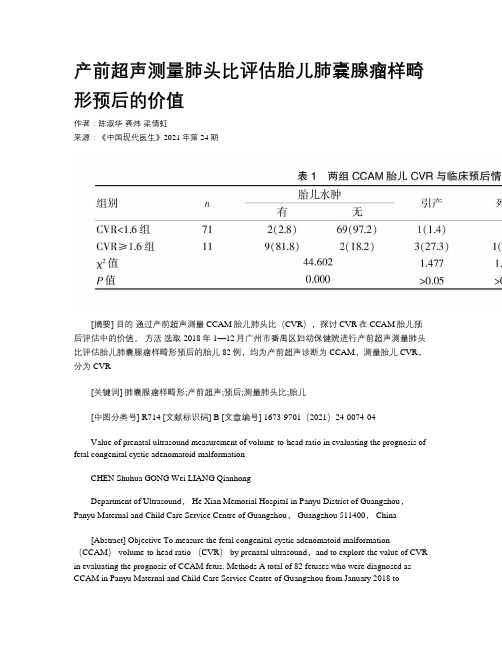
产前超声测量肺头比评估胎儿肺囊腺瘤样畸形预后的价值作者:陈淑华龚炜梁倩虹来源:《中国现代医生》2021年第24期[摘要] 目的通过产前超声测量CCAM胎儿肺头比(CVR),探讨CVR在CCAM胎儿预后评估中的价值。
方法选取2018年1—12月广州市番禺区妇幼保健院进行产前超声测量肺头比评估胎儿肺囊腺瘤样畸形预后的胎儿82例,均为产前超声诊断为CCAM,测量胎儿CVR,分为CVR[关键词] 肺囊腺瘤样畸形;产前超声;预后;测量肺头比;胎儿[中图分类号] R714 [文献标识码] B [文章编号] 1673-9701(2021)24-0074-04Value of prenatal ultrasound measurement of volume-to-head ratio in evaluating the prognosis of fetal congenital cystic adenomatoid malformationCHEN Shuhua GONG Wei LIANG QianhongDepartment of Ultrasound, He Xian Memorial Hospital in Panyu District of Guangzhou,Panyu Maternal and Child Care Service Centre of Guangzhou, Guangzhou 511400, China[Abstract] Objective To measure the fetal congenital cystic adenomatoid malformation (CCAM) volume-to-head ratio (CVR) by prenatal ultrasound,and to explore the value of CVR in evaluating the prognosis of CCAM fetus. Methods A total of 82 fetuses who were diagnosed as CCAM in Panyu Maternal and Child Care Service Centre of Guangzhou from January 2018 toDecember 2018 by prenatal ultrasound were selected as objects. After measuring CVR,they were divided into CVR<1.6 group and CVR≥1.6 group. Prenatal ultrasound features and classification,follow-up results and clinical prognosis were compared between two groups were observed and compared. Results Among 82 CCAM fetuses, there were 29 females and 53 males. The lump was located in the left lung in 48 cases and the right lung in 34 cases. There were 17 cases of type ⅠCCAM, 41 cases of type Ⅱ CCAM and 24 cases of type Ⅲ CCAM. All 82 cases of CCAM fetuses showed that the blood supply of lung mass came from pulmonary artery. In CVR<1.6 group,there were 2 cases (2.8%) of fetal edema, 69 cases (97.2%) without fetal edema, 1 case (1.4%)of induced labor, 0 case of stillbirth, 4 cases (5.7%) of postpartum respiratory distress, 66 cases (95.3%) without fetal edema and 1 case of postpartum death (1.1%). In CVR≥1.6 group, there were 9 cases(81.8%) of fetal edema, 2 cases(18.2%) without fetal edema, 3 cases (27.3%) of induced labor, 1 case (9.1%) of stillbirth, 6 cases (85.7%) of postpartum respiratory distress, 1 case (14.3%) of non-abortion, and 2 cases (18.2%) of postpartum death. Therefore, there were statistical differences in edema rate, postpartum respiratory distress rate and postpartum death rate between CVR<1.6 group and CVR≥1.6 group(P<0.05). Conclusion The incidences of fetal edema and postpartum respiratory distress in CCAM with CVR≥ 1.6 are increased, which show that CVR is an effective indicator for prenatal evaluation of fetal CCAM prognosis.[Key words] Congenital cystic adenomatoid malformation; Prenatal ultrasound; Prognosis; Measurement of volume-to-head ratio; Fetus临床儿科中的错构瘤样病变之一就是先天性胎儿肺囊腺瘤样畸形(Congenital cystic adenmatiod malformation of the lung,CCAM),是终末细支气管异常过度增生,正常肺泡的生长受抑、发育不良。
胎儿先天性肺囊性腺瘤样畸形的早期超声诊断

胎儿先天性肺囊性腺瘤样畸形的早期超声诊断
郭徐林;赵晓月;权太东;万兰;扬慧芝
【期刊名称】《临床超声医学杂志》
【年(卷),期】2008(10)7
【摘要】胎儿先天性肺囊腺瘤样畸肜(congenital cystic adenomantoid malformation of lung,CCAM)是胎儿较常见肺部畸形。
其预后取决于病变的
类型和累及肺叶的程度,轻者虽可顺产成活,但可诱发新生儿期肺部疾病而致死亡;严重者宫内死亡;偶有报道局限在一叶肺的囊腺瘤样畸形随着孕周的增加可以自行消失。
超声检查是发现胎儿CCAM最有效和最早期的方法之一,并可协助判断预后。
【总页数】2页(P494-495)
【作者】郭徐林;赵晓月;权太东;万兰;扬慧芝
【作者单位】510602,广州市,解放军458医院特诊科;510602,广州市,解放军458
医院特诊科;510602,广州市,解放军458医院特诊科;510602,广州市,解放军458医院特诊科;510602,广州市,解放军458医院特诊科
【正文语种】中文
【中图分类】R73
【相关文献】
1.产前超声诊断胎儿先天性肺囊性腺瘤样畸形 [J], 卢洪涛;李清
2.产前超声诊断胎儿先天性肺囊性腺瘤样畸形 [J], 冯志华;周苏晋
3.胎儿先天性肺囊性腺瘤样畸形的超声诊断价值 [J], 琚竹梅
4.产前超声诊断胎儿先天性肺囊性腺瘤样畸形的临床分析 [J], 莫遵玉
5.超声诊断胎儿肺囊性腺瘤样畸形(Ⅲ型)1例分析 [J], 任永凤;王洲;张伟丽;孟辉因版权原因,仅展示原文概要,查看原文内容请购买。
胎儿先天性肺囊腺瘤畸形1例

( 稿 日期 :0 2— 5—1 ) 收 21 0 0
1 病 历资 料
患者 2 8岁 。因停 经 3 9周 ”, 阴道 流 液2h 于 ,
21 0 0 2— 4—0 , :0住 院 。末 次 月 经 2 1 975 0 1—0 7一 O , 时月 经 周 期 规 律 , 期 经 过顺 利 , 统 产 检 。 6平 孕 系
( 放军二五一 医院, 解 河北 张 家 口 0 5 0 ) 70 0
妊娠 3 9周 ”, 2产 0 左 枕 前 位 , 带绕 颈 2周 , 孕 , 脐 胎 膜早破 , 儿窘 迫 。急诊 在 硬 腰联 合 麻 醉下 行 剖 胎 宫 产术 , 中见羊水 Ⅲ度 污染 , 0 L 胎 头娩 出 术 量2 0m 。
离肺 、 经源 性肿 块 、 管重 复畸形相 鉴 别 , 神 食 如果 肿
块 类似 实性 时 , 应考 虑 先 天性 囊腺 瘤 畸 形 和隔 离 则 肺 ; 神 经源 性肿 块 、 管重 复畸形 的肿 块 , 而 食 主要 位
于后纵 隔 。
( 编辑 : 薛 凡 )
产前超声对胎儿先天性肺囊腺瘤样畸形的诊断价值

医学影像影像研究与医学应用 2019年9月 第3卷第17期表1 观察两组子宫内膜病变超声诊断结果差异[n(%)]分组子宫内膜厚度(mm)内部团块回声均匀子宫内膜病灶血流信号丰富内膜与肌层分界清晰A组(n=53)8.76±2.98291935B组(n=53)14.53±3.85123618χ2/t7.68111.49510.92110.906P0.0000.0010.0010.0013 讨论子宫内膜癌、子宫内膜息肉临床表现存在相似,临床诊断时容易造成混淆,导致疾病误诊,影响医师进一步制定治疗方案及治疗效果,不利于预后。
因此选择合理的诊断方法对两种疾病进行鉴别诊断十分重要,利于医师进一步制定合理的治疗方案,改善患者预后。
彩色多普勒超声具有无创、重复性好等优势,近年来在妇科疾病中应用广泛,检查方式包括传统经腹超声及经阴道超声。
与传统经腹超声相比,经阴道超声具有以下优势:(1)几乎不会受到肠气、腹壁干扰,可更加清晰显示图像。
(2)患者检查时不需憋尿,可节约检查前准备时间,还可避免部分患者无法憋尿的情况。
(3)阴道探头频率较高,置入阴道内可紧贴宫颈壁,更加清晰、准确的观察患者内膜微小病灶,利于提升诊断准确率[3]。
子宫内膜癌因浸润生长,可导致肿瘤侵犯子宫内膜及肌层等,因此超声图像可显示不均匀回声,组织分界不清晰[4];通过彩超监测其血流信号,通常血流信号较为丰富,且多见低阻高速血流特征[5]。
子宫内膜息肉典型表现为宫腔内异常光团,多数表现为高回声团,直径较小,边界多清晰。
本次研究结果显示,子宫内膜息肉患者子宫内膜无明显增厚现象,肌层与内膜分界较为清晰,内膜病灶及周边血流信号稀少,而子宫内膜癌患者子宫内膜明显增厚,肌层与内膜分界不清晰,内膜病灶及周边血流信号较为丰富,可通过上述方面对两种疾病进行鉴别诊断。
综上所述,经阴道彩色多普勒超声对子宫内膜息肉与子宫内膜癌具有较高鉴别诊断作用,值得推广。
胎儿肺囊腺瘤畸形的产前超声诊断与分型

【 关键词 】 超声检查 , 产前 ; 胎儿 ; 肺囊腺瘤 ; 隔离肺
Pr na a ag ss a y ng o e lc si e m a o d m alor a in f t e l e t ldi no i nd t pi ff t y tc ad no a ti f m to o h ung by ulr s nd t a ou
Co rs n n auh r: repo dig to DENG edD , al xu d n e g@ 16 .c r Xu — Em i: e o gd n 3 o n
【 s at O jci T xl e te c n a a e a d yi hrce sc f pea l Abt c 】 r bet e v o epo h l i l l n t n c aatrt o rnt r i c v u pg ii a
u rsn g p yf t yt d nm tdm l r a o f h n ( A ) M e o s Ut sngahc haoor h r e l sca eo a i a om t no el g C ML . t d laoor i a o fa c i o f i t u h r p
医
பைடு நூலகம்
21 0 2年 6月 第 9卷 第 6期 C i dUt sud Eet ncE io )Jn 0 2 V l , o6 hnJMe laon ( l r i dtn , e2 1 ,o N . r co i u 9
.
妇 产 科 超 声 影 像
胎 儿 肺 囊 腺 瘤 畸形 的产 前 超 声 诊 断 与 分 型
殷 林 亮 邓 学 东 唐 亚 奇 凌 晨 梁泓 姜 小力
超声诊断胎儿先天性肺囊腺瘤畸形1例

超声诊断胎儿先天性肺囊腺瘤畸形1例标签:超声;胎儿先天性肺囊腺瘤畸形笔者所在医院收治1例胎儿先天性肺囊腺瘤畸形孕妇,本文对其超声诊断的过程进行回顾性分析,现报告如下。
1 病例介绍孕妇,26岁,妊娠4个月,常规进行产前检查,既往仅于早期妊娠时进行过超声检查。
本次超声所见:双顶径4.5 cm,头围16.2 cm,腹围15.9 cm,股骨长径3.0 cm,胎盘前壁0级,羊水最深3.8 cm,超声孕周(19.4±1.0)周。
胎头颅骨光环完整,脑中线居中,侧脑室不增宽,脊柱连续性好,腹壁胸壁线连续完整,胸腔探查,胎儿右侧胸腔可见范围约2.8 cm×3.6 cm×2.9 cm偏强回声,占据胎儿整个右侧胸腔(图1),形态较规则,边界清楚,心脏及左侧胸腔明显受挤至两侧胸腔不对称(图2)。
超声考虑右侧胸腔偏强回声-先天性肺囊腺瘤畸形可能。
患者转北京妇产医院进一步检查并引产,病理证实该诊断。
2 讨论先天性肺囊腺瘤畸形是一种肺组织错构导致的一种先天性肺发育畸形,一般在检查中只要注意观察两侧胸腔结构即可发现异常改变,一般表现为单侧胸腔内可见实性强回声或囊实性肿块,多数强回声内至少可检出一个囊肿[1],检查时应注意探查肿块大小、是否合并纵膈移位、胎儿胸水腹水、全身水肿、羊水过多等推断预后[2] ,一般肿块呈实性病变者、肿块巨大且有合并症者预后差,肿块呈大囊型且无合并症者一般预后良好,可以随诊观察肿块变化,约20%逐渐减小或消失。
本病重点要与胎儿隔离肺相鉴别,一般前者至少能在肿块中检测出一个囊肿(而后者大多数为均匀的强回声块),且前者血供来源于肺动脉,后者血供来源于胸主动脉或腹主动脉,但当肿块内均有囊肿,则无法判断出血供来源,致使产前难以区别。
参考文献[1]张成秀.胎儿先天性肺囊腺瘤畸形的产前超声诊断及预后分析[J].实用医学影像杂志,2012,13(4):223-224.[2]邓冀业,韦德湛,卢展辉.胎儿先天性肺囊腺瘤畸形的超声诊断分析[J].中国医学创新,2011,8(8):107-109.。
超声CVR对预测胎儿肺部肿块预后的价值

超声CVR对预测胎儿肺部肿块预后的价值胡永铭;俞钢;马晓燕;肖祎炜;尚宁;康兰;关策;李小清;郝洁【摘要】目的探讨产前超声检测胎儿先天性肺部肿块(CLM)的体积与胎儿头围比值(CVR)对其预后的预测价值,为临床确定CLM治疗方案提供依据.方法回顾性分析经产前超声检测的82例CLM胎儿资料,分为CVR<1.6和CVR≥1.6两组.出生后存活者均随访预后情况,根据预后表现分为预后良好、预后不良趋势(出生后呼吸困难)、预后不良3种情况.结果 82例胎儿中CVR< 1.6者71例(86.6%),CVR≥1.6者11例(13.4%).5例合并胎儿水肿,除1例CVR≥2.0合并胎儿水肿胎死宫内外,其余均继续妊娠至出生.57例(69.5%)出生时无呼吸困难等症状,19例(23.2%)出生时有症状,6例预后不良(7.3%).两组间水肿发生率、预后情况差异均有统计学意义(P<0.05),若截断值由1.6改为2.0,则水肿发生率、预后不良率差异有统计学意义(P<0.01).结论经产前评估、监测和规范诊疗,CVR<2的CLM胎儿是相对较为安全的;CVR≥1.6水肿发生率高,其预后取决于产前专业评估和新生儿早期手术干预.【期刊名称】《重庆医学》【年(卷),期】2017(046)025【总页数】3页(P3587-3589)【关键词】胎儿;先天性肺部肿块;胎儿头围;超声检查【作者】胡永铭;俞钢;马晓燕;肖祎炜;尚宁;康兰;关策;李小清;郝洁【作者单位】海南省海口市妇幼保健院超声影像科 570203;广东省妇幼保健院胎儿医学科,广州511422;广东省妇幼保健院超声科,广州511422;广东省妇幼保健院超声科,广州511422;广东省妇幼保健院超声科,广州511422;海南省海口市妇幼保健院超声影像科 570203;海南省海口市妇幼保健院超声影像科 570203;海南省海口市妇幼保健院超声影像科 570203;海南省海口市妇幼保健院超声影像科 570203【正文语种】中文【中图分类】R445.1胎儿先天性肺部肿块(congenital lung masses,CLM)发病率约为0.14%[1],预测CLM是否会发展为严重的胎儿水肿或引起胎儿出生时呼吸困难极其重要,但目前的检查手段尚不足以提供一个客观的诊断金标准[2]。
产前超声系统检查诊断胎儿肺囊腺瘤与隔离肺的价值

肺囊腺瘤又称先天性囊性腺瘤样畸形 ( c o n g e n i —
t a l c y s t i c a d e n o ma t o i d ma l f o r m a t i o n , C C A M) 肺, 是 一 种
产 前超声 系统 检查 对 C C A M 及 隔离肺 的诊 断价值 。
( c o l o r D o p p l e r l f o w i m a g i n g , C D F I ) 显示病灶 的血流来 源情况 , 若结果提示病灶滋养血管来 自肺循环 , 则诊 断为肺囊腺瘤 , 若 是来 自体循环 , 则诊断为 隔离肺 。
查 胎儿 头 面 部 、 脊柱 、 胸腹壁、 胸腹 腔 脏 器 、 四肢及 脐
带、 胎盘、 羊水等结构。如果发现肺部有可疑病灶 , 则 需重点对胎儿肺 内异常声像进行多切面观察 , 包括病 灶位置、 大小和 回声情况 , 同时观察病灶是否压迫邻
近 的肺组织 、 心 脏和纵 隔 。采用 彩色多 普勒 血流 成像
如果 不属 于 以上 两 种 情 况 , 则 不做 具 体 诊 断 , 统 称 为 肺 内异 常声像 。
1 资料与方法
1 . 1 研 究对象 2 0 0 9年 1 月至 2 0 1 2 年 6月在我 院 行 中晚孕产前 超声 系统检查的胎儿 2 5 9 1 2例 , 其中 经临床确诊肺囊腺瘤 1 3 例, 隔离肺 7 例。该 2 0例孕 妇 年龄 1 8~ 3 l 岁, 平均 2 5 . 9岁 , 孕周 2 3 . 6— 2 7 . 4周 ,
胎儿肺囊腺瘤畸形的产前超声诊断与鉴别

胎儿肺囊腺瘤畸形的产前超声诊断与鉴别
张彤;石伟元;曾灵峰
【期刊名称】《湘南学院学报(医学版)》
【年(卷),期】2015(017)001
【摘要】目的探讨胎儿肺囊腺瘤的产前超声诊断及鉴别诊断.方法对产前超声诊断为肺囊腺瘤畸形并产后证实的38例胎儿的超声声像图进行回顾性分析,并与产后病理、手术及随访结果进行对照.结果 38例胎儿肺囊腺瘤中发生在左侧者20例,右侧18例;Ⅰ型6例、Ⅱ型19例、Ⅲ型13例,3例合并其他畸形,36例有纵膈移位,2例合并水肿.其中31例引产,尸检病理诊断均为肺囊腺瘤.7例随访至出生,1例手术治疗,1例失访,5例无明显临床表现.结论超声检查能清晰诊断与鉴别诊断先天性肺囊腺瘤畸形,易于重复观察肿块大小变化,对临床处理提供重要的参考价值.
【总页数】3页(P24-26)
【作者】张彤;石伟元;曾灵峰
【作者单位】郴州市第一人民医院,湖南郴州423000;郴州市第一人民医院,湖南郴州423000;郴州市第一人民医院,湖南郴州423000
【正文语种】中文
【中图分类】R445.1
【相关文献】
1.产前超声测量肺头比评估胎儿先天性肺囊腺瘤样畸形预后的研究 [J], 张海春;田军章;陈钟萍;周苏晋;祁丹;邓雪红
2.产前超声测量肺头比对胎儿隔离肺和先天性肺囊腺瘤畸形预后的评估价值 [J], 陈佳
3.产前超声与MRI对胎儿先天性肺囊腺瘤样畸形分型的鉴别诊断 [J], 阎冲
4.产前超声测量肺头比评估胎儿肺囊腺瘤样畸形预后的价值 [J], 陈淑华;龚炜;梁倩虹
5.产前超声诊断胎儿先天性肺囊腺瘤畸形的临床价值及准确性 [J], 黎兆平
因版权原因,仅展示原文概要,查看原文内容请购买。
产前超声检查对胎儿肺发育不良病因的诊断价值

安徽医学Anhui Medical Journal 第41卷第11期2020年11月1306产前超声检查对胎儿肺发育不良病因的诊断价值许海棠阮吟孙云孙医学[摘要]目的探讨产前超声检查对胎儿肺发育不良病因的诊断价值。
方法选取蚌埠医学院第一附属医院2015年1月至2019年9月产前超声诊断为肺发育不良(PH)的32例胎儿为研究对象,回顾性分析其共同声像图特征,对可能造成胎儿PH的病因进行归纳总结。
结果32例PH的胎儿中,产前超声提示为胸腔占位所致者15例,占46.88%[其中先天性膈疝8例(53.33%),肺囊腺瘤样病变4例(26.67%),隔离肺3例(20.00%)],单纯骨发育异常所致者4例,占12.50%,单纯泌尿系统异常致肺发育不良者6例,占18.75%,骨与泌尿系统发育异常共同致PH者7例,占21.88%。
结论胎儿PH常见病因为胸腔占位性病变、泌尿和骨骼系统发育异常,产前超声检查可提前预判PH的可能病因,为临床诊疗提供重要的信息。
[关键词]胎儿肺发育不良;产前超声;病因doi:10.3969/j.issn.1000-0399.2020.11.015肺发育不良(pulmonary hypoplasia,PH)是指各种原因引起的胎儿生长发育过程中,支气管发育不良并远端肺组织分化不良,造成肺的重量和体积较相应孕周绝对减小,可发生于单侧或双侧,与新生儿呼吸窘迫密切相关,在存活新生儿中发病率为1.1%。
,围产期死亡率高达70%⑷。
因此,产前明确胎儿PH的病因对于孕期尽早干预及新生儿治疗极为重要。
本研究旨在对PH胎儿的超声声像图特征进行分析总结,对产前超声在胎儿PH病因中的诊断价值进行探讨与总结。
1资料与方法1.1一般资料选取蚌埠医学院第一附属医院2015年1月至2019年9月产前超声诊断为PH的32例胎儿为研究对象,回顾性分析其声像图特征。
纳入标准:单胎,经引产后病理解剖、出生后手术或CT、MRI证实。
产前超声对胎儿肺部肿块的诊断及监测

产前超声对胎儿肺部肿块的诊断及监测胡永铭;陈新;俞钢;邹勤;康岚;葛菲【摘要】目的探讨产前超声诊断及监测胎儿肺部肿块的价值.方法 2012年7月至2015年1月海口市妇幼保健院中孕期产前超声筛查发现肺部肿块的胎儿36例,对胎儿肺部肿块进行诊断分析,检测肺部肿块的体积与胎儿头围比值(CVR值)或健侧肺面积与胎儿头围比值(LHR值),初步评估预后并超声监测复查.结果产前超声诊断胎儿肺部囊腺瘤(CCAM) 18例,隔离肺(BPS) 6例,隔离肺合并囊腺瘤5例,膈疝(CDH) 7例.除引产12例外,出生后状态良好未行检查11例,病灶变小或不明显5例,手术7例,出生1 d内死亡1例.结论产前超声及早诊断胎儿肺部肿块,通过规范监测和临床干预,对促进胎肺成熟、减少不良妊娠结局具有较大临床意义.%Objective To study the value of prenatal ultrasonic diagnosis and monitoring of fetal lung mass. Methods Thirty-six fetuses with lung mass found by prenatal ultrasonic monitoring in Haikou Women and Children Hospital from Jul. 2012 to Jan. 2015 were included in the study. The lung masses were diagnosed and analyzed, with cystic volume ratio (CVR) or lung area to head circumference ratio (LHR) determined. The prognosis was preliminary assessed and the fetuses were reexamined by ultrasound. Results Among the 36 cases of fetal lung mass, there were 18 cases of congenital cystic adenomatiod malformation (CCAM), 6 cases of bronchopulmonary sequestration (BPS), 5 cases of CCAM+BPS, 7 cases of congenital diaphragmatic hernia (CDH). Among the 36 fetuses, 12 suffered odinopoeia. Eleven were in good health condition after birth and received no more examination. Five showed smaller or unobvious lesions. Sevenunderwent surgery, and one died within one day after birth. Conclusion Prenatal ultra-sonic diagnosis of fetal lung mass, combined with standardized monitoring and clinical intervention, has great clinical significance for promoting fetal lung maturation and reducing adverse pregnancy outcome.【期刊名称】《海南医学》【年(卷),期】2015(026)021【总页数】3页(P3157-3159)【关键词】产前超声;诊断;监测;胎儿肺部肿块【作者】胡永铭;陈新;俞钢;邹勤;康岚;葛菲【作者单位】海口市妇幼保健院超声影像科,海南海口 570203;海口市妇幼保健院超声影像科,海南海口 570203;广东省妇幼保健院胎儿医学科,广东广州 511422;武警海南省总队医院特诊科,海南海口 570203;海口市妇幼保健院超声影像科,海南海口 570203;海口市妇幼保健院超声影像科,海南海口 570203【正文语种】中文【中图分类】R714.5胎儿肺脏良好的发育是出生后是否能够存活的决定性因素之一[1],最常见影响胎肺发育的疾病有先天性肺囊腺瘤样畸形(Congenital cystic adenomatiod malformation,CCAM)、支气管肺隔离症(Bronchopulmonary sequestration,BPS)、先天性膈疝(Congenital diaphragmatic hernia,CDH)及胸腔积液等。
超声诊断胎儿先天性肺囊腺瘤畸形1例

肇 曼 孽 童
! ! ! Y _ Q Q 曼 璺
布 洛 芬 混 悬液 诱 发 支气 管哮 Ⅱ 器 发 作 2例 报 告
刘 云凤
分钟后患儿 咳嗽加 重 , 烦躁、 继 之 出 现 喘
洛 芬 等非 甾 体 抗 炎 药 物 与 激 素 有 药 效 学
1 1 2 0 0 1 辽 宁 铁 岭 市 中心 医 院 儿 科
要 不 良反 应 是 胃 肠 道 反 应 , 表现 恶心 、 腹
例 1 : 患儿 , 5岁 , 因 咳 喘 2天 就 诊 , 3
年前确诊哮 喘, 末 正规 治疗 , 查体 : 神情, 状 呵, 呼 吸 略促 , 双肺 散 在 喘 呜音 , 心率 1 0 0 t k/ 分, 腹软 , 四肢 活动 良, 胸 片 双肺
哮 喘患 者 有 增 多 趋 势 , 有 的 儿 童 感 冒后 或 剧 烈 运 动 就 容 易 出现 哮 喘症 状 , 这 类 患 儿
一
型哮喘 , 由于病 因明确 , 一旦确诊 , 可以有
效地进行预 防, 随着 药 物 种 类 逐 渐 增 多 , 药物性哮喘发生率逐渐增高 , 临床 医 生 应 给予高度重视 , 引 以 为戒 。
滴, 泵吸沙丁胺醇 , 及 给予 抗 组 织胺 药 物 , 经抢救患 儿 最后 转 危 为安 , 病 情 平 稳 出
院。
综上所述 , 药 源 性 哮 喘 是 一 种 特 殊 类
很强 的 支 气 管 收 缩 效 应 , 从 而 引 起 哮 喘 , 这也 是 布 洛芬类 诱 发 哮 喘往 往来 势凶猛 、 发作 剧烈的原 因之一。 布洛芬虽然安全性较高 , 但是某些患 者仍然不 能使用 。①哮 喘患者 : 目前儿童
胎儿肿瘤的彩超诊断价值

L ㈡# ㈡ 工 0 : 医学检验 ^ 1 v0 巨 , 0
胎 儿 肿 瘤 的 彩 超 诊 断 价 值
聂红莲 李 开林 方北 那 丽娟 刘 海祥 廖翕 和 531) 2 10 ( 中山大 学 附属 东华 医 院超声 科 广 东 东莞
【 要】 摘 目的 探讨彩超 在胎儿肿瘤产前检 查中的诊断价 值。 法 对6例产前彩超检 出l 方 6 眙儿肿瘤的图 特征 与引产. 像 产后病理 诊 断及 产后随访对比分析。 结果 颅内肿瘤2 颈部囊状淋 巴管瘸2例 例 5 先天性肺 囊腺 瘸5 心脏肿瘤3 卵巢囊肿7 骶 尾 倒、 例, 倒、 部畸 胎瘤4 胆总管囊肿3 肝血管瘤2 附属物 肿瘤1倒, 例、 例、 例, 2 其中l例合 并其他部位畸 形( 2%, 5 占 3) 误诊2 占 %。 例( 3 )结论 产前彩
瘤 增大 。 引产
图4 彩超产前诊断胆总管囊肿 , 产后1 个月手
术 治 疗
图5 胎儿脐带囊肿( 脐带胎盘插入处 )
中国卫生产业 ・ 第八卷 ・ 第七期 ・ 下
71
: 。 ㈡ _ /
÷
。.
。。 . 医学检验 . .
囊状 淋 巴管 合 并 全 身 水 肿6 , 并 心 脏 流 道 梗 阻 , 例 合 反复 观 察 确 诊 后 , 终 止 妊 参考随 访 证实 的 H J; 瘤6 例 , # L ̄ 6 孕 布 。 I 疑腹 、 盆腔 囊性 占位 时 , 进行 隔 时 多次
发生率 为 17 35 17活 产 儿Ⅲ随 着 彩 . ~1 ./ 0j - 。 周 1 ~3 周 , 均 孕 周 2 . 周 , 妇年 龄 检 查 , 点观 察其 与膀 胱 、 l 5 平 03 孕 重 胃泡 观 察 是 否 其 大 小 、 态 随 时 间 改 变 , 图像 存 入 工 形 将 作站。
胎儿先天性肺囊腺瘤样畸形的诊断与治疗进展

胎儿先天性肺囊腺瘤样畸形的诊断与治疗进展褚艳侠;杨晨【摘要】肺的良好发育为胎儿出生后成活的一个决定性因素,若是胎儿时期出现肺部发育异常,则会对胎儿生长发育构成严重威胁。
胎儿期先天性肺囊腺瘤样畸形(CCAM)比较少见,死亡率相对较高,多发生在单侧或者是只累及一叶肺,少数发生在双肺。
一般情况下,肺部发育存在缺陷,在肿物不断增大时,会发生纵膈偏移,严重时会造成心脏受压移位,造成胎儿血流动力学改变。
严重影响着胎儿的生命健康,因此临床提出产前诊断是十分必要的,可提高临床预后治疗效果。
本文笔者综合分析胎儿先天性肺囊腺瘤样畸形发生病因、诊断以及预后治疗进展等方面。
%The good development of the lung is a decisive factor for the survival of the fetus after birth. If the lung development abnormality occurs during the fetal period, it will pose a serious threat to the growth and development of the fetus. Fetal congenital pulmonary cystadenomatoid malformation (CCAM) is relatively rare, relatively high mortality, occurred in the unilateral or only involving the one leaf lung, a few occur in the lungs. Under normal circumstances, there must be developmental defects in the tumor is increasing, mediastinal shift occurs, which will cause severe cardiac pressure shift, resulting in fetal hemodynamic changes. Seriously affecting the life and health of the fetus, so clinical prenatal diagnosis isvery necessary to improve the clinical outcome of treatment. The author of this comprehensive analysis of fetal congenital pulmonary cystadenoma-like abnormalities in the etiology, diagnosis and prognosis of treatment progress.【期刊名称】《中国继续医学教育》【年(卷),期】2016(008)032【总页数】2页(P67-68)【关键词】胎儿;先天性肺囊腺瘤样畸形;诊断【作者】褚艳侠;杨晨【作者单位】苏州市立医院本部妇产科,江苏苏州 215000;苏州市立医院本部妇产科,江苏苏州 215000【正文语种】中文【中图分类】R445.2胎儿期先天性肺囊腺瘤样畸形为胎儿期比较少见的一种肺部疾病,具有较高的病死率,严重影响胎儿的成长发育[1]。
肺头比在评估胎儿肺囊腺瘤样病变预后中的价值

肺头比在评估胎儿肺囊腺瘤样病变预后中的价值目的:探讨肺头比(CVR)在胎儿肺囊腺瘤样病变(CCAM)预后评估中的价值。
方法:分析本院2015年1月-2016年11月产前超声诊断为肺囊腺瘤样病变的胎儿共74例,均测量胎儿CVR,根据CVR测值分为CVR10.0 cm,在疏松的间质组织表面覆盖扁平上皮,此型预后较好。
3.2 胎儿CCAM的产前超声诊断、合并症及鉴别诊断CCAM产前超声主要表现为胸腔内实性强回声或囊实性混合回声包块,囊肿直径大小不等,微囊型呈实性强回声,确诊依赖于彩色多普勒检出肿块供应血管是否来自肺动脉分支[16]。
胎儿肺囊腺瘤Ⅰ、Ⅱ型有较明显的小囊结构,故不易漏诊,Ⅲ型因小囊结构比较小,超声表现表现很难分辨,只显示回声增强肿块,较易漏误诊。
本研究产前超声诊断CCAM Ⅰ型43例(58.1%),CCAM Ⅱ型17例(23.0%),CCAMⅢ型14例(18.9%)。
合并症:当CCAM体积较大时,会出现周围组织受压移位,当肿块压迫纵隔导致心脏移位及静脉回流障碍时,易导致胎儿水肿,胎儿水肿是CCAM最严重合并症[17]。
导致羊水过多的原因是由于肿块压迫食管,从而胎儿吞咽羊水减少,或肿块本身产生的液体过多所致[18]。
当肿块占据大部分胸腔时,心脏及纵隔可受压移位,偏向对侧,正常肺组织减少,从而引起肺发育不良和胎儿水肿。
CCAM还可合并隔离肺、膈疝、肾脏疾病及先天性心脏病等[3]。
本研究74例病例中,1例CCAM Ⅱ型合并肺隔離症(pulmonary sequestration,PS),1例CCAM Ⅱ型合并膈疝,1例为18-三体合并开放性脊柱裂、柠檬头、香蕉脑,1例CCAM 合并双侧唇裂并腭裂;1例合并肾囊肿,1例合并脑室增宽,1例合并右侧支气管闭锁可能,只有1例患儿是18-三体合并CCAM,目前尚无证据显示CCAM 与染色体异常有关[4]。
鉴别诊断包括:(1)PS:超声表现为肺内实性肿块,需与微囊性CCAM相鉴别,如彩色多普勒显示包块供应血管来自正常肺动脉时,则考虑为CCAM,而PS几乎所有的动脉供应来自体循环。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胎儿先天性肺囊腺瘤超声诊断价值目的:探讨胎儿先天性肺囊腺瘤的超声诊断价值,并对预后进行分析。
方法:2007年1月-2014年3月,对本院产前超声诊断为胎儿先天性肺囊腺瘤的11例孕妇进行观察,重点扫查胎儿双侧肺,观察病灶二维超声声像图特征,应用彩色多普勒显示病灶血供情况,并注意观察有无胎儿水肿和其他胎儿异常畸形存在,随访临床、影像或病理检查结果。
结果:检出的11例胎儿先天性肺囊腺瘤中,10例病灶位于单侧肺,1例病灶双侧肺均有;单侧肺病例中,6例位于左侧,4例位于右侧;Ⅰ型3例,Ⅱ型5例,Ⅲ型3例;4例伴有羊水过多;2例Ⅲ型伴有胎儿水肿;1例Ⅱ型伴有同侧胸腔少量积液及合并胎儿唇裂畸形;2例Ⅱ型定期复查显示病灶逐渐缩小;1例Ⅰ型出生后经手术治疗,术后患儿如常;7例选择终止妊娠,引产后病理证实与超声诊断相符。
结论:产前超声检查能准确诊断胎儿先天性肺囊腺瘤畸形,可对病灶进行分型并评估预后。
胎儿畸形是胚胎发育过程中,宫内异常发育所致,多由遗传和染色体异常造成,部分由母体疾病引起[1]。
先天性肺囊腺瘤畸形(congenital cystic adenomatoid malformation,CCAM)是一种肺组织错构畸形,是由于末端支气管的过度生长,在肺实质内形成有明显界限的腺瘤样病变。
CCAM发生于胚胎发育第5~10周左右[2]。
超声最早能在孕15周即做出CCAM诊断,能对病灶变化进行跟踪对比,对CCAM可能导致的胎儿肺发育不良、胸水、水肿、纵隔移位进行实时观察,并以此来协助临床判断预后,因此产前超声检查对胎儿CCAM具有重要价值,本研究通过病例分析探讨胎儿CCAM产前超声表现及其转归和预后。
1 资料与方法1.1 一般资料以2007年1月-2014年3月在本院行产前超声检查诊断为胎儿CCAM的11例孕妇为研究对象。
年龄20~35岁,平均(28.2±2.4)岁,孕周16~40周,平均(26.3±3.2)周。
7例为初次妊娠,4例为多次妊娠,11例均为单胎妊娠。
1.2 仪器与方法采用麦迪逊Accuvix V20彩色多普勒超声显像仪,凸阵探头频率3.0~7.0 MHz。
孕妇平卧位,超声检查内容包括测量胎儿双顶径、头围、腹围、股骨及羊水,对胎儿头部、内脏、脊柱排列、四肢情况等进行仔细扫查。
通过心脏四腔心切面、胸部矢状及横切面观察胎儿肺实质。
发现肺内异常病灶时,多切面观察病灶位置、大小及回声情况,同时观察心脏、纵隔有无受压移位,胎儿是否存在水肿。
应用彩色多普勒(CDFI)明确病灶血供来源。
对无心脏及纵隔移位、无胎儿水肿声像者,建议每隔2周行超声复查,观察病灶变化情况;对胎儿合并其他结构异常的,建议进一步行胎儿染色体检查;对引产病例追踪尸检结果;活产病例产后行MRI确诊检查。
1.3 胎儿CCAM产前超声分型根据肺内病灶囊泡直径大小分3型:Ⅰ型为大囊肿型,直径>2 cm;Ⅱ型为多发小囊型,直径20 mm的大囊肿,最大囊泡直径达32 mm(孕38周时所见);Ⅱ型5例,病灶位于左肺3例、右肺1例、双侧肺1例,表现为肺内多个大小不等似“蜂窝状”的小囊性暗区,5例病灶囊泡直径9~15 mm大小;Ⅲ型3例,病灶位于左肺1例、右肺2例,表现为肺内边界清楚的不均质强回声实性光团。
11例胎儿CCAM中2例Ⅰ型、1例Ⅱ型病灶大,占据2/3胸腔,致使同侧和对侧肺明显受压迫,纵隔和心脏均受压偏移,其中1例孕19周胎儿,左肺病灶挤压心脏移位至右侧胸腔;2例Ⅲ型胎儿伴有头皮和腹部皮肤软组织水肿增厚;1例Ⅱ型伴胸腔少量积液并合并有唇裂畸形;1例Ⅰ型、1例Ⅱ型、2例Ⅲ型伴有羊水过多。
CDFI显示11例胎儿CCAM中,9例病灶内部未探及彩色血流信号,1例Ⅰ型1例Ⅱ型病灶探及来自肺动脉分支血管的条束状彩色血流信号。
2例Ⅰ型2例Ⅱ型3例Ⅲ型病例或因肺发育不良、心脏及纵隔严重移位、胎儿水肿、孕妇主动放弃等因素而选择终止妊娠,引产后病理证实为胎儿CCAM。
2例Ⅱ型胎儿CCAM病例因无合并症及其他异常存在而选择继续妊娠,并每隔2周进行超声随访检查,多次检查发现随着孕周增大病灶逐渐缩小,至临产时病灶仅数毫米大小,胎儿出生后无临床异常症状,新生儿预后良好。
1例Ⅰ型1例Ⅱ型病例从首次发现病灶至临产时,病灶大小无明显变化,出生后经MRI检查确诊并行外科手术治疗,术后患儿状况良好。
3 讨论据报道,胎儿CCAM发生率约占胎儿先天性肺畸形的25%[3]。
CCAM典型者为单侧,常累及一侧肺或一叶肺,80%~95%发生在单一肺叶,双侧肺叶或一叶以上肺叶或整侧肺受累的发生率不足2%[4]。
引起胎儿CCAM的病因目前尚不完全清楚,较为普遍的观点是CCAM为一种错构瘤样病变,在胎儿肺芽发育过程中受未知因素影响,引起局部肺发育受阻,继而导致已发育的肺组织过度生长所致[5]。
胎儿CCAM由肺循环系统供血,肿物压迫纵隔移位容易出现静脉回流障碍,导致胎儿水肿;较大肿物的占位使正常肺组织受挤压,从而导致肺发育不良。
依照病理学按Stocker分类[6],胎儿CCAM分为3型:Ⅰ型(大囊肿型):病变最显著,存在大的厚壁囊腔,直径>2 cm,周围可有囊腔,囊肿内衬假复层纤毛柱状上皮,厚壁周围有平滑肌和弹力纤维,在大囊之间或邻近大囊肿中存在像肺泡样结构。
Ⅱ型(多发小囊肿型):病变以许多平均分隔的囊腔为特征,囊腔最大直径很少超过1 cm,囊肿内衬立方或高柱状纤毛上皮,只有很少假复层。
Ⅲ型(实质性肿块型):病变大体上类似坚实的肺组织肿块,产生明显纵隔移位。
正常胎儿的肺组织呈对称均匀的中等回声,较肝脏回声略高,随着孕周的增大回声逐渐增强。
当发现肺内异常病灶时,测量并记录病灶所在肺内的位置,对比病灶与正常肺组织的回声差别。
当病灶引起纵隔或心脏移位压迫对侧肺组织时,测量对侧肺面积和心胸比,了解受压迫程度。
通过CDFI明确病灶血供来源加以鉴别。
胎儿CCAM超声最常检出在孕18~26周[7],肿块的分型、大小变化速度、纵隔移位程度、以及是否出现胎儿水肿和羊水过多均与预后有关,成为评价预后的重要指标。
胎儿CCAMⅠ型并发畸形少,预后好,多可成活;Ⅱ型预后主要取决于伴发畸形多少及严重程度,若无合并胎儿水肿、羊水过多、纵隔移位等可存活至出生;Ⅲ型并发畸形较多,病变常累及整个肺,较易出现肺水肿,往往死于宫内,预后差。
有学者通过研究提出用CCAM病灶体积与胎儿头围比值(volume to head circumference ratio,CVR)来评价胎儿水肿情况,当CVR≥1.6时,80%的胎儿出现水肿,当CVR<1.6且病灶不大时,胎儿出现水肿的风险仅为2%[8]。
胎儿水肿出现与存活率有密切关系,有文献报道,胎儿CCAM如不发生水肿,存活率为92%,发生水肿时存活率仅为21%[9]。
本组11例胎儿CCAM 中4例存在羊水过多情况,推测是由于食管被病灶压迫导致胎儿吞咽羊水减少,本组研究中发现,病灶体积越大羊水过多的程度越高,两者之间的关联性也印证了上述推测。
本组2例CCAMⅡ型病灶随着孕周的增加而逐渐变小,原因不明,有学者提出可能的发病机制是,胎儿CCAM内液体向气管支气管树的分流减压或病灶生长过快以致血供不足[10]。
MacGillivray等也曾报道过6例合并纵隔移位的胎儿CCAM病灶随妊娠的进展而逐渐缩小至消失,且均无合并胎儿水肿。
因此,对于逐渐缩小且无合并水肿的CCAM胎儿,可以继续妊娠并定期超声复查至足月,出生后再行MRI检查以确定CCAM的存在。
对于出生后无症状的CCAM患者可以选择密切观察而不必手术切除,但病灶的持续存在患者终生有感染和恶变的风险[11],所以生后7~10个月通过肺叶切除术完整切除病灶是CCAM治疗的首选方式[12]。
胎儿CCAM主要与隔离肺、先天性膈疝、支气管囊肿、纵隔畸胎瘤相鉴别。
(1)隔离肺:最容易与胎儿CCAM Ⅲ型相混淆,隔离肺的声像图表现也呈均匀一致的强回声,累及一侧肺或一叶肺,也可造成纵隔偏移,但是病灶主要出现在下叶肺,CDFI显示病灶滋养血管来自体循环是重要鉴别点。
(2)先天性膈疝:是膈的发育缺陷导致腹腔内容物疝入胸腔,以左侧多见,超声声像图可见胸腔内疝入的胃及肠管回声,动态观察时可见疝入的胃泡大小的变化以及肠管的蠕动。
(3)支气管囊肿:主要与胎儿CCAMⅠ型相鉴别,支气管囊肿与气管、支气管相连,声像图表现为肺实质内孤立的囊状结构,多为单发,体积相对较小且靠近中线。
(4)纵隔畸胎瘤:纵隔畸胎瘤的声像图表现多样,单纯囊性的畸胎瘤不易与CCAM鉴别。
综上所述,超声检查方便、无创、在胎儿早期即可检出CCAM,能动态观察病灶发展和变化并对预后进行评估,对优生优育,提高出生人口质量有重要价值。
参考文献[1]丛晓丽,王晓毅.胎儿畸形的超声诊断价值[J].中国医学创新,2011,8(22):75-76.[2]孙子燕,夏黎明,陈欣林,等.胎儿先天性肺囊腺瘤样畸形的MRI表现及其诊断价值[J].中华放射学杂志,2007,41(5):490-492.[3] Andreas R,Axel F,Peter W. Prenatal diagnosis of bilateral cystic adenomatoid malformation of the lung[J]. J Clin Ultrasound,1987,15(1):3-8.[4] Sfakianaki A K,Copel J A. Congenital cystic lesions of the lung:congenital cystic adenomatoid malformation and bronchopulmonary sequestration[J]. Rev Obstet Gynecol,2012,5(2):85-93.[5] Berrocal T,Madrid C,Novo S,et al. Congenital anomalies of thetracheobronchial tree,lung,and mediastinum:embryology,radiology,and pathology[J]. Radiographics,2004,24(1):17.[6] Stocker J J,Madwell J E,Drake R M. Congenital cystic adenomatiod malformation of lung classification and morphologic spectrum[J]. Hum Pathol,1977,8(2):155-171.[7]洪淳,俞钢,马小燕.胎儿先天性肺囊腺瘤诊治进展[J].临床小儿外科杂志,2012,11(1):49-52.[8] Crombleholme T M,Coleman B,Hedrick H,et al. Cystic adenomatoid malformation volume ratio predicts outcome in prenatally diagnosed cystic adenomatoid maiformation of the lung[J]. Pediatr Surg,2002,37(3):331-338.[9] Iraj F. Hydrops fetalis:recent advances[J]. Obstet Gynecol Sur,1997,52(4):130-138.[10] Yong P J,V on Dadelszen P,Carpara D,et al. Prediction of pediatric outcome after prenatal diagnosis and expectant antenatal management of congenital cystic adenomatoid malformation[J]. Fetal Diagn Ther,2012,31(5):94-102.[11]孙瑜.胎儿先天性肺囊腺瘤的筛查与诊治[J].中华围产医学杂志.2013,16(9):532-534.[12] Laje P,Liechty K W. Postnatal management and outcome of prenatally diagnosed lung lesions[J]. Prenat Diagn,2008,28(6):612-618.。
