氮及其化合物PPT(1)
高一化学氮及其化合物ppt课件.ppt
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
氮气
1、氮元素的存在及单质的物理性质
存 游离态形式存在于空气中 在 化合态形式存在于多种无机物及有机物中
物 理 无色无味的气体、密度比空气小; 性 难溶于水,1体积水溶解0.02体积的氮气。
思考题
1、1molMg在足量的氮气、空气、纯氧气、二
氧化碳气体中燃烧生成 的固体质量由大到小的 排列次序是_二__氧__化__碳__>__氧__气___>_空__气__>__氮__气_____.
点燃
2Mg + O2 →2MgO
点燃
3Mg + N2 → Mg3N2
(40g) (100/3g)
2Mg + CO2 →点燃2MgO +C (46g)
质
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
工业上怎样制取氮气?利用氮气的什么性质?
空气
液化
先气化 液态空气
氮气 b.p -195.8℃
后气化
氧气 b.p -183℃
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
氮的固定------把大气中的游离态氮转化为氮的化合物 1生物固氮
豆科作物根瘤中的固氮菌常温下将空气中的氮 气转化为硝酸盐。
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
第四章第4节 氮及其重要化合物(共100张PPT)

N2O3、NO2、N2O4、N2O5共六种氮的氧化物都是大气污染物, 会形成酸雨、光化学烟雾,主要来源于煤和石油的燃烧、汽车 尾气、硝酸工厂等,其中NO2与N2O4存在下列平衡: 2NO2 N2O4。
(2)NO只能用排水法收集,不能用排空气法收集;而NO2 只能用向下排空气法收集,不能用排水法收集。 (3)验证某无色气体是NO的方法:向无色气体中通入O2(或 空气),无色气体变为红棕色。
[特别提醒]
(1)硝酸具有强氧化性,浓硝酸的还原产物一
般是NO2,稀硝酸的还原产物一般是NO,硝酸的浓度越大,氧 化性越强,即浓硝酸的氧化性强于稀硝酸。 (2)硝酸能溶解除Au、Pt以外的所有金属,金属与硝酸反 应时硝酸的作用是强氧化性和酸性。 (3)浓硝酸保存在棕色细口瓶中,因溶解NO2显示黄色,需 用玻璃塞而不用橡胶塞。
追本溯源拓认知
知识点一 1.氮气 (1)物理性质
氮气和氮的氧化物
无色无味的气体,密度比空气略小,难溶于水。 (2)化学性质
-3
氧化性 0 还原性+2 N H3 ――→ N2 ――→ N O 放电 N + O ===== 2NO 。 2 ①与氧气反应: 2
N2+3H2
②与氢气反应:
高温、高压 催化剂
(4)硝酸与较活泼的金属反应不产生H2,且H 、NO3 具有强氧 化性,与还原性离子:Fe2+、I-、S2-等不能大量共存。 (5)
知识点二
氨和铵盐
1.氨的物理性质 无色有刺激性气味的气体,密度比空气小,易液化。极易 溶于水(1∶700),可由 喷泉 实验证明。
2.氨的化学性质
(1)还原性
催化剂 4NH3+5O2 ===== 4NO+6H2O △ 与氧气反应: 。
(2)与酸反应
化学人教版 必修第二册第五章第二节氮及其化合物(共25张ppt)

在断电之后,为什么氧气浓度又有了一次下降? 可能N2与O2生成NO2的过程有中间产物,中间产物与 O2反应最终生成了NO2 。
如何设计实验证明呢?
16
NO与O2的反应 将装有NO气体的注射器吸入少量空气,观察现象?
注射器内出现红棕色气体,说明生成了NO2 总结对空气放电后发生的化学反应,并写出方程式?
红棕色气体消失,说明二氧化氮发生了反应,分析产 物的可能性,该如何验证呢?
测反应后溶液的pH,若显酸性,则证明有硝酸生 成。 再向注射器内吸入部分空气,若有红棕色气体出现, 则证明有一氧化氮生成。
20
在价类二维图上画出“雷雨发庄稼”涉及到的物质转化 规律,并写出方程式。
21
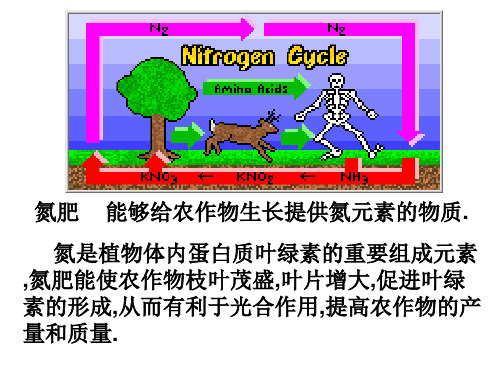
我们将大气中游离态的氮转化为氮的化合物的过程称为
回忆初中对氮气的知识,描述氮气的性质。 性质稳定,不易与其他物质发生反应。 写出氮气的电子式与结构式,尝试解释氮气性质稳 定的原因。
9
观察价类二维图,你觉得性质稳定的氮气该如何一 步步转化为我们所需要的氮肥呢?
氮元素化合价
+5
HNO3
NO3-
+4
NO2
+2
NO
0
N2
-3
NH3
NH3·H2O NH4+
量, 氮不能,如果氮气可行的话,那么我们就没
有必要施肥了。
植物到底能够吸收什么样的含氮物质呢?
5
6
氨态氮肥:主要提供铵根离子 硝态氮肥:主要提供硝酸根 尿素(NH2CONH2)
空气中的氮气很充足,该如何转化为植物所能吸收 的硝酸根和铵根呢?
7
一 氮气与氮的固定
24
放电或高温
N2+O2=====2NO 2NO+O2=====2NO2 3NO2+H2O===2HNO3+NO
氮及其化合物ppt课件

二、一氧化氮和二氧化氮
4. 氮氧化物对环境的污染 (1)NOx在紫外线作用下与碳氢化合物发生 一系列光化学反应,产生光化学烟雾。 (2)NOx排入大气中后,与水反应生成HNO3 和HNO2,随雨雪降到地面形成酸雨。 (3)破坏臭氧层:NO2可使平流层中的臭氧减 少,导致地面紫外线辐射量增加。 (4)NO与血红蛋白结合使人中毒。
硝酸的酸性比磷酸强
化合价: -3、 0、 +2、 +3、 +4、 +5
一、氮气及氮的固定
1.氮气的物理性质
颜色 无色
气味 无味
状态 气体
液氮
密度 密度比空气稍小
水溶解 难溶
一、氮气及氮的固定
2.氮气的化学性质
化学式
N2
电子式
N
N
结构式
NN
共价三键、键能大,性质稳定,难与其他物质反应
N2 表现氧化性
课堂导入
“死亡谷”之谜 青藏高原上的那棱格勒峡谷,每当牧民和牲畜进入后,风和
日丽的晴天顷刻电闪雷鸣,狂风大作,人畜常遭雷击而倒毙。奇 怪的是这里牧草茂盛,水草肥美,被当地牧民称为“死亡谷”。
考察队测定后发现,这里的磁场强度非常高。这里的地层, 除了分布着大面积的三叠纪火山喷发的强磁性玄武岩外,还有大 大小小30多个磁铁矿脉及石英闪长岩体。正是这些岩体和磁铁矿 产生了强大的地磁异常带。夏季,它使因昆仑山的阻挡而沿山谷 东西分布的雷、雨、云中的电荷常常在此汇集,形成超强磁场。 一旦遇到异物,便会发生尖端放电即产生雷击现象,使人和畜瞬 间死亡。巨大的磁力还导致了指南针失灵,仪器不准。
氮及其化合物(第1课时 氮和氮的氧化物)高一化学课件(人教版2019必修第二册)

教学过程
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下: NO2+NO+2NaOH===2NaNO2+H2O, 2NO2+2NaOH===NaNO2+NaNO3+H2O
现有V L某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。 ①所用烧碱溶液的物质的量浓度至少为________ mol·L−1。 ②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=______ 。 ③用含n和m的代数式表示所得溶液中和浓度的比值c(NO3-)∶c(NO2-)=________。
课堂练习
典例6.氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如下:
回答下列问题: ①酸雨的pH________(填“>”、“<”或“=”)5.6。 ②D物质的化学式为____________。 ③反应②的化学方程式为_________________________________________。 (2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定 条件下反应的化学方程式:_____________________________________,反应中氧化剂是_______ ,还原剂是_______。
素养目标
1.通过从结构分析氮和氮氧化物的性质,培养学生“宏观辨识与微观探析”的学科素养。 2.通过对氮的氧化物的污染与防治的学习,培养学生“科学态度与社会责任”的学科素养。
情境引入
据说在新疆与青海两省区交界处有一狭长山谷,每当人畜进入后,经 常电闪雷鸣,狂风暴雨把人畜击毙。然而谷内却是牧草茂盛,四季常青,被 当地牧民称为“魔鬼谷”。为什么魔鬼谷牧草旺盛 ?
氮及其氮的化合物课件

03
硝酸盐的种类
硝酸盐是一类无机化合物 的总称,包括硝酸钠、硝 酸钾、硝酸钙等。
硝酸盐的性质
硝酸盐易溶于水,具有较 高的稳定性,在自然界中 广泛存在。
硝酸盐的应用
硝酸盐是重要的工业原料 ,可用于制造化肥、炸药 、烟火等。
铵盐
铵盐的种类
铵盐是一类含氮的离子化 合物,常见的有氯化铵、 硫酸铵、硝酸铵等。
铵盐的性质
铵盐易溶于水,具有刺激 性气味,在加热时易分解 。
铵盐的应用
铵盐是重要的氮肥,也可 用于制造其他含氮化合物 和药物。
氰化物
氰化物的种类
氰化物是一类含碳和氮的化合物,常见的有氰化钠、氰化钾、氢 氰酸等。
氰化物的性质
氰化物具有剧毒,易溶于水,可在生物体内分解。
氰化物的作用与危害
氰化物在工业上用于电镀、金属热处理等,但如果不慎摄入或接触 ,会对人体造成严重危害,甚至致命。
氮气是一种非极性分子,不溶于水, 但可以溶于乙醇和乙醚等有机溶剂。
氮气的化学性质
氮气是一种惰性气体,化学性质不活 泼,常温下很难与其他物质发生反应 。
氮气是一种重要的工业气体,广泛应 用于化工、电子、航空航天等领域。
在高温或放电条件下,氮气可以与氧 气、氢气等物质发生反应,生成一氧 化氮、二氧化氮、氨气等化合物。
氮及其氮的化合物课件
目录
• 氮气 • 氮的氧化物 • 含氮无机化合物 • 氮的有机化合物 • 氮肥 • 总结与展望
01
氮气
氮气的物理性质
氮气的分子式为N2,是一种无色、 无味、无毒的气体。
氮气是一种双原子气体,其化学键是 共价键,分子之间是单键结合。
氮气的相对分子质量为28.0134,是 空气的主要成分之一,约占空气的 78%。
【课件】氮及其化合物-氮气与氮氧化物 课件 高一下学期化学人教版(2019)必修第二册

第五章化工生产中的重要非金属元素 第二节 氮及其化合物
第1课时 氮及氮的固定
一、氮与氮的固定
氮元素位于元素周期表的第二周期,VA族。 氮原子结构示意图:
N
+7 2 5
空气中氮气的体积分数约为78%
氮原子的最外层有5个电子,既不容易得到3个电子,也不容易失去5个电 子。一般通过共用电子对与其他原子结合。在自然界里,氮元素主要以氮 分子的形式存在于空气中,部分氮元素存在于动植物体内的蛋白质中, 还有部分氮元素存在于土壤、海洋里的硝酸盐和铵盐中。
2NO+O2==2NO2
总:4NO2+O2+2H2O==4HNO3
4.把一支充满NO气体的试管倒置在水槽中,不断地缓慢通入氧 气,充分反应后,生成的产物为?
2NO+O2==2NO2 3NO2+H2O==2HNO3+NO 总:4NO+3O2+2H2O==4HNO3
氮的氧化物溶于水的有关计算
1、NO2或(NO2、NO混合)气体溶于水:剩余的气体只有_N__O___。 3NO2 + H2O = 2HNO3 + NO
2、NO2和O2的混合气体溶于水:
总:4NO2 +O2 +2H2O =4HNO3
VNO2 VO2
> 4:1 剩余NO = 4:1 恰好完全反应
< 4:1 剩余O2
3、NO和O2的混合气体溶于水: 总:4NO +3O2 +2H2O= 4HNO3
VNO VO2
> 4:3 剩余NO = 4:3 恰好完全反应 < 4:3 剩余O2
启示:硝酸工业常在吸收反应进行过程中,补充一些空气, 使生成的NO被氧化成NO2,NO2溶于水又生成HNO3和 NO,经过多次氧化和吸收,NO2可以比较完全被水吸 收,能够尽可能地转化为HNO3
氮及其化合物ppt

氮及其化合物1. 氮的概述氮(N)是自然界中最丰富的元素之一,占据了空气中的大部分。
在化学中,氮具有多种化合价和氧化态,可以形成众多的化合物。
氮和其化合物在科学研究和工业应用中具有重要地位。
2. 氮的性质氮是一种无色无臭的气体,具有良好的稳定性。
它的沸点为-195.8°C,熔点为-210.0°C。
氮具有高度的惰性,不与大多数物质发生反应。
氮分子中的三键非常稳定,需要较高的能量才能使其断裂。
3. 氮的应用3.1 农业氮是植物生长的关键元素之一,植物利用氮来合成蛋白质和其他生物分子。
在农业中,氮肥的施用可以促进植物的生长和增加产量。
3.2 化工氮气在化工工业中具有广泛的应用。
它可以用作气体保护剂,防止某些物质与空气发生反应。
此外,氮气还用于控制火灾和爆炸的风险。
3.3 生物技术氮在生物技术领域中扮演着重要角色。
例如,在细菌培养或发酵过程中,氮气可以作为气体氛围来提供缺氧条件,促进微生物代谢产物的生产。
4. 氮的化合物氮可以形成多种化合物,其中一些具有重要的科学和工业应用。
以下是一些常见的氮化合物:4.1 氨(NH3)氨是一种无色气体,具有刺激性气味。
它是一种常用的肥料,并且被广泛用于化学工业中作为原料。
4.2 亚硝酸盐(NO2-)亚硝酸盐是一种含有亚硝基(NO2)的化合物。
它在环境和生物体中起着重要的作用,并与大气污染和水质有关。
4.3 氮氧化物(NOx)氮氧化物是一类包含氮和氧原子的化合物。
它们由空气中的氮和氧在高温下反应产生,是导致酸雨和大气污染的主要原因之一。
4.4 氮化钾(KN)氮化钾是一种具有高氮含量的化合物,常用作火箭推进剂和炸药的原料。
5. 总结氮及其化合物在农业、化工和生物技术等领域具有重要的应用。
了解氮的性质和应用可以帮助我们更好地利用这一元素。
同时,对于氮化合物的研究和控制较好地管理氮的应用也是必要的,以减少相关的环境和健康风险。
第五章第二节氮及其化合物(第一课时)课件 高一化学下学期人教版(2019)必修第二册

是 1:3
。
3、将等体积NO2和O2充入试管,并倒立于水槽中,最后试管中剩余气体
为
O2
,剩余气体体积为原气体体积的 3/8 。
变式3:现有NO2、O2的混合气体12 mL,通入足量水中,充分反应后剩余气体 2 mL(同温同压下),则原混合气体中氧气的体积可能是__4__m_L_或__1_._2_m__L__。
是什么? 4NO+3O2+2H2O===4HNO3
当V(NO):V(O2)=4:3时,恰好完全反应,无气体剩余; 当V(NO):V(O2)>4:3时,NO过量,剩余气体为NO; 当V(NO):V(O2)<4:3时,O2过量,剩余气体为O2。
【课堂练习】
1.将盛有60 mL NO2气体的试管倒立于水中,经过足够长的时间
后,试管内气体的体积缩小。则反应后剩余气体的体积
是 20 mL
。
2.现有NO2、N2的混合气体12 mL,通入足量水中,充分反应后剩余气体6 mL(同温
同压下),则原混合气体中氮气的体积是__3_m__L____,NO的体积是 9 mL
。
变式2:现有NO2、N2的混合气体,通入足量水中,充分反应后剩余气体的体积缩 小 为 原 来 的 一 半 ( 同 温 同 压 下 ) , 则 原 混 合 气 体 中 氮 气 与 NO 的 体 积 比
2.结合实验探究,了解一氧化氮与氧气反应、二氧化氮与水反应,感受化学 变化的奇妙。掌握NO、NO2的性质,掌握NO、NO2之间的相互转化关系。培 养学生“科学探究与创新意识”的核心素养。
任务一:氮气与氮的固定 1.氮在自然界中的存在
游离态的氮以N2形式存在于空气中,约占空气体积的78%
(78%) 氮气
放电
5.2 氮及其化合物(一)课件(共39张PPT)

2. 化学性质
(2)与酸的反应:
现象: 有大量白烟产生
原因: 氨与氯化氢相遇迅速反应生成固体小颗粒
原理: NH3+HCl = NH4Cl
思 a 浓氨水遇浓硫酸、浓硝酸也会产生白烟吗?
考
浓硝酸 NH3+HNO3 = NH4NO3
b 氨与其它酸的反应:
1. 实验室制法 (1) 原料: NH4Cl与Ca(OH)2 (2) 原理:
≜ 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
(3) 制取装置: 固固加热装置 (4) 收集装置: 向下排空气法 (5) 棉花的作用:防止空气对流
(三)氨气的实验室制法
(6) 验满:
a. 湿润的红色石蕊试纸变蓝 b. 蘸有浓HCl的玻璃棒接近试管口产生白烟
的压强迅速减小,与外界大气形成较大的压强差,在压强差作用 下,液体迅速流动,通过带尖嘴的导管喷出来,形成喷泉。
(2)某同学做该实验时,打开止水夹后将胶头滴管内的水挤入烧瓶内, 可并未产生喷泉,试分析实验失败可能的原因是什么?
①装置气密性不好 ②收集的NH3纯度较低 ③烧瓶不干燥等 (3)若将NH3换为NO2,能否形成喷泉?若能形成,则实验后液体能否 充满烧瓶?
(2)取少许样品于试管中,加入碱后加热,用蘸有浓盐酸的玻 璃棒靠近试管口,若有白烟产生,则证明样品中含有NH4+ 。
思考与讨论
图5-13为实验室制取氨的简 易装置示意图。请仔细观察实验 装置,思考如何检验试管中已收 集满氨,如何吸收处理实验中多 余的氨。
图5-13实验室制取氨的简易装置示意图
(三)氨气的实验室制法
思考与讨论: 如果将注射器中的NO充分转化,可以采取什么措施? 上述实验对工业生产硝酸有什么启示?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5.中学化学中常见的几种物质存在如下关系,其中甲是
第四节 氮及其化合物
全局性掌控
全局性掌控
本节重要知识有N2、NO、NO2、NH3、HNO3、铵 盐的性质及用途,NH3的制法,NH的检验等,主要考 查硝酸的强氧化性,如离子共存,氨气的性质、实验室 制法及相关探究性实验,硝酸与金属反应的相关计算,
大气污染等.硝酸的强氧化性一直是高考的热点,硝酸
与金属的反应也经常出现,预测2012年的高考中氮及 其化合物知识仍会与理论知识结合起来综合考查.
(
)
A.N2分子的结构较稳定,因而氮气不能支持任何物 质的燃烧 B.23 g NO2和N2O4混合气含有0.5 NA个氮原子(NA表
示阿伏加德罗常数)
C.NO可用向上排空气法或者排水法收集 D.浓硝酸保存在棕色瓶内是因为硝酸易挥发
解析:N2 分子的结构较稳定,但 N2 能与 Mg 反应,因此支 持 Mg 的燃烧,A 错;设 23 g NO2 和 N2O4 混合气中 NO2 x 23-x 的质量为 x g,则氮原子数为( + ×2)NA=0.5 NA,B 46 92 对;NO 能与空气中的 O2 反应:2NO+O2 = = = 2NO2,故 不能用向上排空气法收集,只能用排水法收集,C 错;浓 硝酸保存在棕色瓶内是因为硝酸见光容易分解,D 错.
解析:在上述气体中,CH4、NO、CO不溶于NaOH 溶液,也不与NaOH溶液反应,所以不能做喷泉实验, 而HCl、SO2、CO2可溶于NaOH溶液而且可与NaOH
溶液反应,所以能形成喷泉.
答案:A
4.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列
叙述正确的是
A.反应速率:两者相同 B.消耗硝酸的物质的量:前者多,后者少 C.反应生成气体的颜色:前者浅,后者深 D.反应中转移的电子总数:前者多,后者少
的氨水是指每100 g氨水中含NH3· H2O 25 g D.NH3· H2O的热不稳定性可以解释实验室中用加热氨 水的方法制取氨气
解析:氨气极易溶于水,常温下1体积的水溶解约700
体积的氨气,故A项中剩余气体中不含氨气,错误; 氨水显碱性的原因是氨气与水反应生成的一水合氨电 离出氢氧根离子,B项错误;虽然氨在其水溶液中主 要以一水合氨的形式存在,但习惯上认为氨水的溶质
①久置的浓HNO3显 黄 色,原因是HNO3分解产生的 NO2
溶于硝酸的缘故. ②浓HNO3通常保存在棕色试剂瓶 中且置于冷暗处,瓶 塞不能用橡胶塞.
(3)强氧化性
2.久置的浓HNO3常显黄色,如何除去黄色?
提示:通入足量空气可除去黄色(4NO2+O2+2H2O
=== 4HNO3).
1.(2011· 烟台测试)下列关于氮的说法正确的是
2.一氧化氮和二氧化氮 (1)物理性质
颜色
NO NO2
气味
无色 红棕
色
无味
溶解性 有毒 比空气 大 不溶于水
比空气
毒性
密度
刺激性 气 有毒
味
大
与水反应
(2)化学性质
2NO+O2 === 2NO2 ①NO与O2反应: ②NO2与水反应: 3NO2+H2O === 2HNO3+NO
1.NO能否用排空气法收集?NO2能否用排水法收集? 提示: NO易与O2反应,不能用排空气法收集,NO2
(2)化学性质
(3)NH+ 4 的检验 强碱 湿润红 铵盐――→无色刺激性气味气体――――――→试纸变蓝色 △ 色石蕊试纸
三、硝酸
1.物理性质
气味 刺激性 颜色 无色 挥发性 易挥发 溶解性 与水互溶
2.化学性质
(1)酸的通性.(HNO3与金属反应时不产生H2) (2)不稳定性.浓HNO3不稳定,见光或受热易分解,化学 光照 4HNO3(浓)= = = = = 4NO2↑+O2↑+2H2O 或△ 方程式为 .
(
)
解析:铜片与浓、稀硝酸反应的化学方程式分别为Cu +4HNO3(浓) === Cu(NO3)2+2NO2↑+2H2O,3Cu+ 8HNO3(稀) === 3Cu(NO3)2+2NO↑+4H2O,因浓度 越大反应速率越大,A错误;NO2为红棕色,NO为无
色,C错误;因两种酸都过量,铜完全溶解,所以转
答案:B
2.有关氨气的实验较多,下列对这些实验或实验原理的 分析中,正确的是 ( )
A.某同学将收集到的一大试管氨气倒扣在盛满水的
烧杯中,充分吸收后试管中还有少量气体,该同学 用红色石蕊试纸检验该气体中可能含有氨气 B.氨水中滴入酚酞变红,是因为氨气能电离出氢氧 根离子
C.因氨水中的氨主要以NH3· H2O的形式存在,故25%
与水反应,不能用排水法收集.
3.氮氧化物对环境的影响 (1)形成 硝酸型酸雨. (2)形成 光化学烟雾 .Leabharlann 二、氨和铵盐1.氨
(1)结构与物理性质 电子式 密度 比空气小 气味 刺激性 气味 水溶性 常温常压下,1体 积水大约能溶解
700
体积氨气
(2)化学性质
2.铵盐 (1)物理性质 都是白色或无色晶体,都 易 溶于水.
6-A
定存在(2010· 山东卷T13-C项)
、
4.NO可用于某些疾病的治疗(2010· 上海卷T4-D项) 5.将NH3通入热的CuSO4溶液中能使Cu2+还原成 Cu(2010· 全国卷ⅠT7-D项)
一、氮气及氮的氧化物
1.氮气 (1)物理性质 无色无味气体,密度比空气略 小 ,难溶于水. (2)化学性质
是氨,C项错误;NH3· H2O不稳定,受热容易分解,
向浓氨水中加入氧化钙制取氨气的原因之一就是氧化 钙与水反应消耗水以及反应放热. 答案:D
3.都能用右图所示装置进行喷泉实验的 一组气体是(注:烧杯内为NaOH溶 液) A.HCl和CO2 ( )
B.NH3和CH4
C.SO2和CO D.NO2和NO
选项式诊断 诊断
×
× × √ ×
判断正误,在诊断一栏内打“√”或“×”
1.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+ === Fe2++2H2O(2010· 四川卷T9-B项) 2.CO、NO、NO2都是大气污染气体,在空气中都能稳
2+ 3 3.pH= 2- 1的溶液中能大量共存的离子组:Fe 、NO SO4 、Na+(2010· 江苏卷T 项)
