生化检测方法汇总样本
常见的生化检测方法

---------------------------------------------------------------最新资料推荐------------------------------------------------------常见的生化检测方法Western-blot 法 Western Blot 印迹法是把通过电泳分离的蛋白质组分从凝胶转移至一种固相支持物,通过抗体与附着于固相支持物的靶蛋白的抗原表位发生特异性反应进行检测。
Western Blot 既可以定性,又可以半定量,是初步鉴定靶蛋白表达的最方便也是最通用的方法。
1、试剂耗材的准备:⑴、转膜缓冲液(48 mM Tris-HCl, 39 mM 甘氨酸, 0. 037% SDS, 20%甲醇):⑵、 10丽春红染液:⑶、 TBS 缓冲液:⑷、 TBST 缓冲液(含 20%Tween20 的 TBS 缓冲液):⑸、封闭液(含 5%脱脂奶粉的 TBST 缓冲液):⑹、一抗、二抗及抗体稀释液:参照说明书,以封闭液或 TBST 进行稀释。
⑺、底物显色液 ECL,4℃ 避光保存,现用现配。
⑻、显影液和定影液。
用水稀释 10-20 倍于铝盒中,可多次使用。
室温避光存放。
2、实验步骤:⑴、蛋白样品制备:1 / 15用细胞裂解液抽提蛋白,并测蛋白浓度。
⑵、取 1mg 蛋白进行 SDS-PAGE。
⑶、转膜:(转膜缓冲液4℃预冷备用,冷却装置于-80℃冰箱冷冻备用)。
⑷、将 2 张海绵垫、 2 张滤纸、转膜夹子及玻棒浸泡在盛转膜缓冲液的铝盒中。
⑸、戴上手套,剪一张与凝胶尺寸相近的 PVDF 膜(83 mm75 mm),左上角剪一缺口作为标记,浸泡在盛有 20mL 甲醇的平皿中约 15 sec,直到膜变半透明。
用纯水冲洗膜2 次。
浸泡在盛转膜缓冲液的铝盒中。
⑹、 SDS-PAGE 结束后,小心地剥下两块凝胶,一块用于考马斯亮兰染色观察电泳情况,另一块浸泡在转膜缓冲液中预平衡。
生化检测方法汇总情况

一、血清谷丙转氨酶(SGPT)赖氏改良法器材:试管及试管架、移液器或吸量管、恒温水浴锅、721型分光光度计、温度计、动物血清试剂:(1)0.1mol/L pH7.4磷酸盐缓冲液:①0.1mol/L磷酸氢二钠溶液:称取Na2HPO414.22g或Na2HPO4·2H2O17.8g溶解于蒸馏水中,并稀释至1 000ml,4℃保存。
②0.1mol/L磷酸二氢钾溶液:称KH2PO413.61g溶解dH2O中,稀释至1000ml,4℃保存。
③将0.1mol/L磷酸氢二钠溶液420ml和0.1mol/L磷酸二氢钾溶液80ml混和即为0.1mol/L pH7.4的磷酸盐缓冲液。
加氯仿数滴,4℃保存。
(2)标准丙酮酸(含丙酮酸2.0μmol/mL):取标准丙酮酸钠10mg,用上述缓冲液准确定容为50mL。
此液须当日用当日配。
(3)SGPT底物液(含α-酮戊二酸2μmol/ml及DL-丙氨酸200μmol/ml) : 取α-酮戊二酸29.2mg,DL-丙氨酸7g ,用试剂1溶成100ml,在稀释到刻度前,以1mol /L NaOH调pH 7.4(因为转氨酶在pH7.3以下或7.6以上的环境中酶活性下降),加数滴氯仿防腐。
此液于冰箱保存可使用4天。
(4)GOT底物液(DL–天冬氨酸200mmol/L ,α-酮戊二酸 2mmol/L):称取α- 酮戊二酸29.2mg 和DL-门冬氨酸2.66g置于一小烧杯中,加入1mol/L氢氧化钠20.5ml使溶解,并校正pH 至7.4,然后将溶液移入100ml容量瓶,用0.1mol/L磷酸盐缓冲液定容至刻度。
放置冰箱保存。
(5)2.4-二硝基苯肼溶液:取分析纯2,4-二硝基苯肼19.8mg,用1mol/L HCl溶于100ml,置棕色瓶中保存。
(6)0.4mol/L NaOH溶液:0.1M磷酸盐缓冲液PH7.4 0.1 0.1 0.1 0.1 0.1 0.1相当于谷丙转氨酶单位0 28 57 97 150 200相当于谷草转氨酶单位0 24 61 114 190 —每个样做3个平行,置37水浴30分钟,各管加2,4-二硝基苯肼液0.5mL,混匀,再在37℃水浴中放置20mL,各管加0.4mol/L氢氧化钠溶液5mL,混匀,10分钟后,从水浴箱中取出,以蒸馏水调“零”点,用520nm波长比色,读取各管之吸光值,各管之吸光值均减去空白的吸光值,然后以吸光值为纵坐标,各管相应的转氨酶单位为横坐标。
如何进行生化检验

如何进行生化检验生化检验是一项重要的医学检验方法,主要用于检测人体内各种生物分子的含量和分布情况,以揭示疾病的发生和发展状况。
这项检验对于现代医学的诊断和治疗起着至关重要的作用。
以下将详细介绍如何进行生化检验。
一、选择适当的生物样本生化检验通常涉及到多种不同类型的生物样本,包括血液、尿液、唾液、毛发等。
这些样本中所含有不同种类的生物分子,如蛋白质、酶、代谢产物等,可以被生化方法分析出来。
在选择生物样本时需要根据具体疾病和检测目的选择适当的样本进行检测分析。
二、收集样本在进行生化检验之前,需要先收集所需的生物样本。
对于血液、尿液等样本,可以通过采血管和尿采集器等器具进行采集。
对于唾液和毛发等样本,则需要经过特别的处理方式,如使用唾液采集器或化学分解等方法来进行处理。
在收集样本时需要在保持样本稳定的情况下,最大限度的减少检验过程对样本的影响,以保证检验结果的准确性。
三、样本处理将采集到的生物样本加入样品杯中,对样本进行加热、冷却、离心、萃取、过滤等样本处理方法,以消除样品中的杂质,并得到足够的生化分析物质测定。
样本处理过程中需要控制样本的温度、时间、加盐量等因素,以保证样品的质量和稳定性。
四、分离和纯化这是生化检验的核心过程之一,该过程需要将样品中的目标生物分子从其他成分中分离出来,并纯化出所需的生物分子。
目前用来分离和纯化目标生物分子最多的方法包括色谱法、电泳法、南方杂交等方法。
在分离和纯化过程中需要严格控制实验室环境的卫生等条件,以免影响检验结果的准确性。
五、生化分析分离和纯化后得到的生物分子需要进行定量的生化分析。
这是生化检验过程中最关键的环节之一。
目前主要采用的生化分析方法有光学法、放射性同位素法、荧光法、化学发光法等方法。
在进行生化分析时,需要严格控制实验室环境的温度、湿度、反应时间等因素,同时要注意实验室设备的卫生和维护。
总之,生化检验是现代医学中不可缺少的检验方法之一。
在进行生化检验时需要掌握一定的专业知识和实验技术,并严格按照标准程序进行操作,以保证检验结果的准确性和可靠性。
生化的检测原理和方法

生化的检测原理和方法
生化的检测原理和方法是通过测量生物体内相关物质或生物过程的变化来判断生物体的健康状况或病理状态。
生化检测的原理主要有以下几种:
1. 化学法:利用化学反应来检测生物体内的化学物质浓度变化。
例如,酶促反应法可以测量血糖、血脂等物质的浓度。
2. 免疫学法:利用抗原与抗体的特异性结合来检测相关物质的存在。
例如,酶联免疫吸附试验(ELISA)可以检测病原体、
药物、激素等的浓度。
3. 光谱法:利用物质对光的吸收、散射或发射特性进行测定。
例如,紫外可见光谱可以测定蛋白质、核酸等的浓度。
4. 电化学法:利用电流、电位等电化学参数来检测生物体内活性物质的浓度变化。
例如,电化学法可以测定电解质、肝功能、心肌损伤等指标。
而生化检测的方法通常包括以下几个步骤:
1. 采集样本:一般通过采血、尿液、体液等方式采集样本。
2. 样本预处理:对采集到的样本进行处理,如离心、滤过、稀释等,以得到合适的测试样品。
3. 加入试剂:将样品与相应的试剂进行反应,触发化学、生物或免疫反应。
4. 测量结果:利用相应的仪器设备对反应后的样品进行测量,如光谱仪、分光光度计、电化学分析仪器等。
5. 分析结果:根据测量结果,与参考范围或标准曲线对比,来评估样品中所测定物质的浓度。
6. 结果判读:将分析得到的结果与相关的疾病诊断标准进行比
对,判断生物体的健康状况或病理状态。
总之,生化的检测原理和方法通过测量生物体内相关物质或生物过程的变化,利用化学、免疫学、光谱学等原理,通过一系列的采集、处理、反应和测量等步骤来进行。
生化项目测定方法整理

生化项目的基本分析方法1.终点法检测1.1定义完全被转化成产物,不再进行反应达到终点,取反应终点的吸光度来计算被测物质的浓度。
生化检验中除酶和BUN、CRE外几乎都用终点法来进行检测。
被测物质(反应底物)在化学反应过程中完全被消耗或转换,即反应达到平衡(终点),通过测定产物(反应生成物)的多少来定量测定被测底物的含量。
终点法一般用来检测代谢物的浓度,通过测定标准液(校准液)的反应吸光度,建立一条浓度与吸光度变化的标准曲线。
通过检测标本的吸光度与标准液的吸光度进行比较,计算出该标本中待测物的浓度。
1.2检测流程一点终点法:取反应达终点时的一个点的吸光度来计算结果。
对于单一试剂,在加入标本后,反应即可进行,在反应达到终点后,读取反应点(吸光度),故一般选用一点终点法。
以试剂和样品混合之前的空气空白(GB)、水空白(WB)或试剂空白(RB)的吸光度值为测定计算基点,以反应终点的吸光度读数减去空白读数,得到反应吸光度。
通过与相同条件下校准液反应吸光度的比较,求得测定结果。
常与一点校准法配合使用,即采用一个校准浓度,校准曲线通过零点且成线性。
也应用多点校准。
•计算公式:C=(Am-Ab)*KAm----终点读数点的吸光度Ab----试剂空白吸光度K----校正系数二点终点法:加入第一试剂,主要起缓冲或者消除干扰等作用,此时可读取初始反应点,加入第二试剂后,在反应达到终点后,读取结束反应点。
取反应尚未开始时读取一个点的吸光度,待反应达终点时再取第二点的吸光度,用第二点吸光度减去第一点吸光度的差值来计算结果。
以试剂和样品混合之后的某一时间点作为始点,以反应终点的吸光度读数减去始点读数。
一定条件下可降低样品对反应或反应本身的特异性于扰(主要指色度干扰)。
常采用双试剂,多以加R2前某一点作测定始点;某些情况下,也可以加R2后一点作测定始点。
若使用单试剂,主反应启动太快或仪器起始读数点受限时难以运用。
主要用于扣除试剂和样品空白,保证结果的准确性,一般双试剂用。
临床常用的生化检查要求和检测方法

2.低 密 度 脂 蛋 白 胆 固 醇 ( LDL-C) 测 定 【 原 理 】 LDL 是 胆 固 醇 的 主 要 携 带 者 ,LDL 向 组 织 及 细 胞内运送胆固醇,直接促进动脉粥样硬化症的形成。 【 参 考 值 】 沉 淀 法 : 2.073.12mmol/L 【 临 床 意 义 】 L D L -C 与 冠 心 病 发 病 呈 正 相 关 . L D L ≥ 3.64 m m o l/L 为 明 显 升 高 ,是 动 脉 粥 样 硬 化 的 潜 在危险因素.
低密度脂蛋白胆固醇(LDL-C) 3.36 mmol/L 2.07 – 3.10
(一 ) 血 清 总 胆 固 醇 (TC)测 定 【 原 理 】 TC 包 括 游 离 胆 固 醇 和 胆 固 醇 酯 , 胆 固 醇 酯 由 胆 固 醇 和 脂 肪 酸 在 肝 脏 中 合 成 ,血 液 的 胆 固 醇 1020%从 食 物 中 摄 取 ,其 余 主 要 由 肝 脏 (7080%)和 肾 上腺等组织合成. 胆固醇作为细胞膜的成分维持细 胞的形态和功能,是类固醇激素和维生素 D等的前体. 胆 固 醇 在 肝 脏 中 转 化 为 胆 汁 酸 ,随 胆 汁 排 入 肠 道
除 术 后 营 养 障 碍 ,均 可 发 生 餐 后 低 血 糖
( 二 ) 葡 萄 糖 耐 量 试 验 ( G T T )(或OGTT) 【原理】正常人口服或注射一定量葡萄糖后血糖暂时 升 高 ,并 刺 激 胰 岛 素 的 分 泌 增 多 ,促 使 大 量 葡 萄 糖 合 成 糖 原 加 以 贮 存 ,在 短 时 间 内 血 糖 可 降 至 空 腹 水 平 ,此 现 象 称 为 耐 糖 现 象 .糖 代 谢 紊 乱 时 , 口 服 或 注 射 一 定 量 葡萄糖则血糖急剧升高或升高不明显, 在短时间内不 能 降 至 空 腹 水 平 ,称 为 耐 糖 异 常 或 糖 耐 量 降 低 .GTT 常 用 于 了 解 和 观 察 糖 代 谢 是 否 健 全 ,对 隐 匿 型 糖 尿 病 的 诊断有重要意义.
检验科生化指标检测方法与结果解读

检验科生化指标检测方法与结果解读随着医学技术的不断发展,生化指标检测在临床治疗和健康管理中扮演着重要角色。
本文将详细介绍生化指标检测的方法和结果解读,帮助读者更好地理解和应用这些检测结果。
一、生化指标检测方法生化指标检测是通过检测人体样本中的生化物质来评估机体的代谢状态和器官功能。
常见的生化指标包括血液中的葡萄糖、脂质、肝功能指标、肾功能指标、电解质等。
下面将介绍几种常见的生化指标检测方法。
1. 血液检测法血液检测法是最常见、最常用的生化指标检测方法之一。
通过采集患者的静脉血样本,经过离心分离血浆或血清后,使用自动生化分析仪器进行检测。
血液检测法能够全面评估多个生化指标,具有快速、准确、灵敏等优点。
2. 尿液检测法尿液检测法主要用于评估肾功能和某些代谢疾病。
通过搜集患者的尿液样本,使用尿分析仪器进行检测。
尿液检测法简单易行,对患者无创伤,但仅适用于某些特定的生化指标。
3. 针刺穿刺法针刺穿刺法常用于脂肪组织的检测。
通过针刺穿刺,获取患者的脂肪组织样本,然后送往实验室进行检测。
这种方法常用于评估患者的胆固醇水平和脂肪代谢情况。
二、生化指标检测结果解读对于生化指标检测结果的解读,需要综合考虑多个指标的变化及其对机体的影响。
下面将从一些常见的生化指标进行解读。
1.血糖血糖是评估糖尿病和糖代谢状况的重要指标。
正常人的空腹血糖浓度应该在3.9-6.1mmol/L之间。
超过这个范围可能意味着存在糖尿病或糖尿病前期。
2.血脂血脂是评估心血管疾病风险的重要指标。
总胆固醇、低密度脂蛋白胆固醇(LDL-C)和甘油三酯水平的升高与心血管疾病风险增加有关,而高密度脂蛋白胆固醇(HDL-C)的升高对心血管健康有益。
3.肝功能指标肝功能指标包括丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素等。
这些指标的异常可能意味着肝脏损伤、炎症或胆道疾病等。
4.肾功能指标肾功能指标主要包括肌酐、尿素氮等。
高肌酐和尿素氮水平可能表明肾脏功能受损,常见于慢性肾脏疾病、肾功能不全等情况。
各种生化指标测定方法

2.3 各项指标的测定方法2.3.1 生物学指标的测定于芥蓝菜薹采收期,每处理随机抽取6株,测定芥蓝生物学性状指标,包括株高,薹粗,节数,单株产量和叶面积。
2.3.1.1 株高测定菜薹长度为第一片真叶基部至生长点的距离,取平均值。
2.3.1.2 薹粗测定用游标卡尺测量第5与第6片叶之间的粗度,取平均值。
2.3.1.3节数和节间长度测定节数为第一片真叶基部起至生长点的节数,节间长度=株高/节数2.3.1.4 单株产量测定取第4节位以上植株进行测定,求单株鲜重。
2.3.1.5 蜡粉含量的测定参照Kumar.S方法测定(Kumar S,1987)。
将芥蓝叶片剪成条状,称取1.0g,放于培养皿中,用10ml氯仿浸泡30秒,取出叶片立即烘干。
将培养皿在室温下蒸发干燥,蜡粉含量为培养皿增重(mg/g)。
重复三次。
2.3.2 光和系统指标的测定2.3.2.1 叶面积的测定取第5片及以上共6片叶进行测定,求单株总叶面积。
采用Li-COR 公司生产的Li-3000A 型叶面积仪测量叶面积。
用直尺测量芥蓝叶片的长度(L,叶柄基部到叶尖的距离)和宽度(W,与主脉垂直的最大宽度),用Li- COR公司的Li- 3000A型叶面积仪测量实际叶面积(LA)。
用回归的方法建立实际叶面积与芥蓝叶片长乘以宽面积之间的回归方程,找出最佳回归系数。
2.3.2.2 比叶重测定于各处理中随机取10片叶子,用0.8mm打孔器,在叶片最宽处离主脉两侧的中心位置打孔,将10个小圆片放在烘样盒后在105℃杀青10min,再80℃烘至恒重。
比叶重=总叶干重/总叶面积(g/m2)2.3.2.3 叶绿素含量测定采用95%乙醇浸泡法(李合生,2000),称取剪碎的新鲜样品0.1g放入试管,用95%的乙醇15ml,在黑暗条件下浸泡24h,至叶片表皮变白,取上清夜在波长665nm、649nm、470nm下测定吸光度。
计算公式:叶绿素a(mg/L)=13.95A665-6.88A649 (1)叶绿素b(mg/L)=24.96 A649-7.32A665 (2)类胡萝卜素(mg/L)=(1000A470-2.05C a-114.8C b)/245(1)、(2)相加即得叶绿素总浓度,在按照下式计算叶绿素和类胡萝卜素的含量。
生化检测方法汇总

一、血清谷丙转氨酶(SGPT)赖氏改良法器材:试管及试管架、移液器或吸量管、恒温水浴锅、721型分光光度计、温度计、动物血清试剂:(1)O.1mol/L pH7.4磷酸盐缓冲液:①O.1mol/L 磷酸氢二钠溶液:称取Na2HPO414.22或Na2HPO4 2H2O17.8g溶解于蒸馏水中,并稀释至1 000ml,4 C保存。
②O.1mol/L磷酸二氢钾溶液:称KH2PO413.61g§解dH2O中,稀释至1000ml,4 C保存。
③将0.1mol/L磷酸氢二钠溶液420ml和0.1mol/L磷酸二氢钾溶液80ml混和即为0.1mol/L pH7.4的磷酸盐缓冲液。
加氯仿数滴,4C保存。
(2)标准丙酮酸(含丙酮酸2.0卩mol/mL):取标准丙酮酸钠10mg用上述缓冲液准确定容为50mL此液须当日用当日配。
(3)SGPT底物液(含a -酮戊二酸2卩mol/ml及DL-丙氨酸200卩mol/ml): 取a -酮戊二酸29.2mg, DL-丙氨酸7g ,用试剂1溶成100ml,在稀释到刻度前,以1mol /L NaOH调pH 7.4 (因为转氨酶在pH7.3以下或7.6以上的环境中酶活性下降),加数滴氯仿防腐。
此液于冰箱保存可使用4天。
(4)GOT底物液(DL -天冬氨酸200mmol/L , a -酮戊二酸2mmol/L):称取a -酮戊二酸29.2mg 和DL-门冬氨酸2.66g置于一小烧杯中,加入1mol/L氢氧化钠20.5ml使溶解,并校正pH 至7.4,然后将溶液移入100ml容量瓶内,用0.1mol/L磷酸盐缓冲液定容至刻度。
放置冰箱内保存。
(5) 2.4-二硝基苯肼溶液:取分析纯2,4-二硝基苯肼19.8mg,用1mol/L HCl溶于100ml,置棕色瓶中保存。
(6)0.4mol/L NaOH 溶液:称取16g固体NaOH用蒸馏水溶解,冷却至室温,定容至1000mL备用。
检验科常用检验样本采集样本一览表

检验科常用检验样本采集样本一览表以下是检验科常用的检验样本和采集方法的一览表:
1. 血液样本
- 采集方法:皮下静脉穿刺,或者采用针头采血器
- 适用于血常规检验、生化检验、免疫学检验等项目
2. 尿液样本
- 采集方法:由患者本人使用尿杯采集中段尿
- 适用于尿常规检验、尿蛋白定量检测等项目
3. 粪便样本
- 采集方法:由患者本人在干燥、清洁的中收集新鲜的粪便样本
- 适用于寄生虫检测、血液潜血、糖蛋白标记物等项目
4. 喉拭子样本
- 采集方法:使用纱球棉签沾湿,沿着喉咙后壁刮擦
- 适用于细菌培养、草莓酮体检测等项目
5. 痰液样本
- 采集方法:由患者本人在干燥、清洁的中收集新鲜的痰液样本
- 适用于痰常规检验、酸性酶测定等项目
6. 食物样本
- 采集方法:收集患者在就餐前后所摄入的食物样本,妥善保存
- 适用于食物过敏原检测、食物营养成分分析等项目
请按照采集方法正确采集样本,并注意妥善保存样本的质量和完整性。
在采集样本时,务必注意遵循无菌操作原则,以确保样本的可靠性和准确性。
同时,采集样本后要及时送至相应的实验室进行检验。
以上是检验科常用的检验样本采集一览表,供参考。
如有疑问或需要进一步的指导,请与检验科人员联系。
生化检验相关实验简化版

一、血糖检测:--糖尿病1、葡萄糖氧化酶法:过氧化物酶;4-氨基安替比林和苯酚氧化缩合生成红色的醌类化合物(Trinder反应);505nm2、己糖激酶法:NADPH 340nm二、血清总蛋白检测:1、微量凯氏定氮比色法:纳氏试剂(碘化钾汞复盐),棕黄色440nm2、双缩脲法:540nm3、血清蛋白质醋酸纤维素薄膜电泳分析:等电点不同,从正极开始:白蛋白,α1,α2,β,γ三、血清白蛋白检测1、电泳法2、免疫化学法3、染料结合法(溴甲酚绿BCG),最常用,无需分离白蛋白和球蛋白;蓝绿色630nm。
四、血清丙氨酸氨基转移酶(ALT)测定--肝功能损害1、赖氏比色法:丙氨酸,α-酮戊二酸;2,4-二硝基苯肼(腙)红棕色505nm五、血清(尿)淀粉酶检测--急性胰腺炎1、碘-淀粉比色法:AMY:淀粉酶蓝色660nm六、血清乳酸脱氢酶测定—心肌梗死、肝病和某些恶性肿瘤1、LD, 2,4-二硝基苯肼(腙)红棕色440nm七、血清肌酸激酶(CK)测定—骨骼肌、心肌、脑组织,心肌梗死、多发性肌炎、休克1、比色法:无机磷酸法、酶偶联丙酮酸测定法、肌酸显色法(常用):A TP,肌酸与双乙酰和α-萘酚生成红色化合物;540nm2、速率法3、荧光分析法八、血清碱性磷酸酶(ALP)测定—肝胆系统、骨骼系统1、氨基安替比林比色法:ALP在碱性条件下使磷酸苯二钠水解,生成磷酸和游离酚,后者与4-氨基安替比林作用,并经铁氰化钾氧化成红色醌类化合物,510nm。
2、速率法:ALP在碱性条件下,使磷酸对硝基苯酚(4-NPP)释放出磷酸基团,生成磷酸基团和游离的对硝基苯酚(4-NP),形成黄色的醌,405nm九、血清γ-谷氨酰基移换酶(GGT)测定—肝胆系统1、底物:L-γ-谷氨酰-3-羧基-对硝基苯胺;受体:双甘肽,在GGT的催化下,谷氨酰基转移到双甘肽分子上,同时释放出黄色的3-羧基-对硝基苯胺,405nm十、血清三脂酰甘油测定—动脉硬化1、分溶抽提-乙酰丙酮显色法:皂化反应、甘油、过碘酸。
检验科生化学常见检测与分析方法

检验科生化学常见检测与分析方法生化学是一门研究生物体内化学变化及相互关系的科学。
在检验科中,生化学是一项重要的技术领域,用于检测和分析样本中的化学成分和反应。
本文将介绍一些生化学常见的检测与分析方法。
一、色谱法色谱法是一种常见的分离和检测技术,广泛应用于生化学领域。
其中,气相色谱法(GC)和液相色谱法(LC)是两种常见的色谱方法。
1. 气相色谱法气相色谱法是将气体或者挥发性液体样品通过色谱柱进行分离和检测的方法。
该方法适用于分离和检测样品中的挥发性有机化合物和气体。
它的原理是通过样品在高温下蒸发,然后被带动进入色谱柱中。
在色谱柱中,不同物质由于相互作用力的差异而分离,最终通过检测器检测。
气相色谱法常用于环境监测、食品安全等领域。
2. 液相色谱法液相色谱法是将溶解在溶剂中的样品通过色谱柱进行分离和检测的方法。
该方法适用于分离和检测样品中的非挥发性有机化合物和离子。
它的原理是将样品溶解在流动相中,通过色谱柱的分离作用,不同物质在色谱柱中的停留时间不同,从而实现分离和检测。
液相色谱法常用于药物分析、食品成分分析等领域。
二、光谱法光谱法是一种通过物质对光的吸收、散射或者发射来进行分析的方法。
常见的光谱方法包括紫外可见光谱法(UV-Vis)、红外光谱法(IR)和质谱法(MS)。
1. 紫外可见光谱法紫外可见光谱法是一种用于测定物质在紫外和可见光波段吸收特性的方法。
该方法适用于分析样品中的有机物、无机物和生物分子等。
紫外可见光谱法的原理是通过物质对紫外或者可见光的吸收来得到样品的吸收光谱,进而推断出样品中的成分和浓度。
紫外可见光谱法在药物分析、环境监测等领域得到广泛应用。
2. 红外光谱法红外光谱法是一种用于测定物质在红外光波段吸收特性的方法。
该方法适用于分析样品中的有机物和无机物等。
红外光谱法的原理是通过物质对红外光的吸收来得到样品的红外光谱,进而推断出样品中的分子结构和化学键的类型。
红外光谱法在药物研发、聚合物材料分析等领域具有重要应用价值。
临床生化检验项目及方法
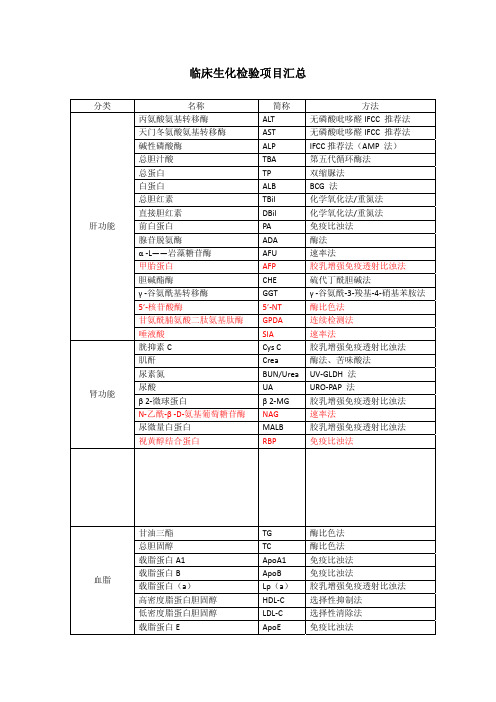
临床生化检验项目汇总分类 名称 简称 方法肝功能 丙氨酸氨基转移酶 ALT 无磷酸吡哆醛IFCC 推荐法天门冬氨酸氨基转移酶 AST 无磷酸吡哆醛IFCC 推荐法碱性磷酸酶 ALP IFCC推荐法(AMP 法)总胆汁酸 TBA 第五代循环酶法总蛋白 TP 双缩脲法白蛋白 ALB BCG 法总胆红素 TBil 化学氧化法/重氮法直接胆红素 DBil 化学氧化法/重氮法前白蛋白 PA 免疫比浊法腺苷脱氨酶 ADA 酶法α ‐L——岩藻糖苷酶 AFU 速率法甲胎蛋白 AFP 胶乳增强免疫透射比浊法胆碱酯酶 CHE 硫代丁酰胆碱法γ ‐谷氨酰基转移酶 GGT γ ‐谷氨酰‐3‐羧基‐4‐硝基苯胺法 5’‐核苷酸酶 5’‐NT 酶比色法甘氨酰脯氨酸二肽氨基肽酶 GPDA 连续检测法唾液酸 SIA 速率法肾功能 胱抑素C Cys C 胶乳增强免疫透射比浊法 肌酐 Crea 酶法、苦味酸法尿素氮 BUN/Urea UV‐GLDH 法尿酸 UA URO‐PAP 法β 2‐微球蛋白 β 2‐MG 胶乳增强免疫透射比浊法 N‐乙酰‐β ‐D‐氨基葡萄糖苷酶 NAG 速率法尿微量白蛋白 MALB 胶乳增强免疫透射比浊法 视黄醇结合蛋白 RBP 免疫比浊法血脂 甘油三酯 TG 酶比色法总胆固醇 TC 酶比色法载脂蛋白A1 ApoA1 免疫比浊法载脂蛋白B ApoB 免疫比浊法载脂蛋白(a) Lp(a) 胶乳增强免疫透射比浊法 高密度脂蛋白胆固醇 HDL‐C 选择性抑制法低密度脂蛋白胆固醇 LDL‐C 选择性清除法载脂蛋白E ApoE 免疫比浊法心血管、心肌酶 同型半胱氨酸 Hcy 循环酶法肌酸激酶 CK N‐乙酰半胱氨酸法肌酸激酶 MB 同工酶 CK‐MB 免疫抑制法 高敏C‐反应蛋白 hs‐CRP 胶乳增强免疫透射比浊法 乳酸脱氢酶 LDH IFCC 法α ‐羟丁酸脱氢酶 HBDH 连续监测法肌红蛋白 Mb 胶乳增强免疫透射比浊法 肌钙蛋白 cTnI 胶乳增强免疫透射比浊法 血管紧张素转化酶 ACE IFCC 法免疫类 免疫球蛋白G IgG 免疫比浊法 免疫球蛋白M IgM 免疫比浊法 免疫球蛋白A IgA 免疫比浊法 补体C3 C3 免疫比浊法 补体C4 C4 免疫比浊法风湿三项 类风湿因子 RF 胶乳增强免疫透射比浊法 抗链球菌溶血素“O” ASO 胶乳增强免疫透射比浊法 C‐反应蛋白 CRP 免疫比浊法糖尿病 葡糖糖 GLU 氧化酶法/己糖激酶法糖化血红蛋白 HbA1C 胶乳增强免疫透射比浊法 β ‐羟丁酸 D3‐H 酶比色法微量元素 钙 Ca 偶氮胂Ⅲ法 镁 Mg XB 法无机磷 P 紫外法二氧化碳 CO2 酶法胰腺炎 淀粉酶 AMY G2‐CNP 法脂肪酶 LPS 酶比色法 其它 D‐二聚体 D‐Dimer 胶乳增强免疫透射比浊法 转铁蛋白 TRF 免疫比浊法铜蓝蛋白 CP 免疫比浊法纤维蛋白原 Fg 免疫比浊法标红为较新项目,其他为常规项目。
生化检测方法汇总

一、血清谷丙转氨酶(SGPT)赖氏改良法每个样做3个平行,置37水浴30分钟,各管加2,4-二硝基苯肼液0.5mL,混匀,再在37℃水浴中放置20mL,各管加0.4mol/L氢氧化钠溶液5mL,混匀,10分钟后,从水浴箱中取出,以蒸馏水调“零”点,用520nm波长比色,读取各管之吸光值,各管之吸光值均减去空白的吸光值,然后以吸光值为纵坐标,各管相应的转氨酶单位为横坐标。
绘制成标准曲线。
为了方便,可列出各光度相当于转氨酶单位表。
对照及样品各做3个平行,充分摇匀,静置10分钟后,用520nm波长比色,以蒸馏水调节零点,读取吸光值,用样品减去对照吸光值,求得样品的谷丙转氨酶活力。
谷丙转氨酶活性单位:37℃, pH7.4,每小时每毫升血清催化生成1μmol 丙酮酸为1个单位。
例:0.1ml 血清每小时催化生成0.1μmol丙酮酸, 即相当于GPT 100U / 100ml 血清。
注意:1. 在测定SGPT时,应事先将底物、血清在37℃水浴中保温,然后在血清管中加入底物,准确记时。
2. 标准曲线上数值在20~500U是准确可靠的,超过500U时,需将样品稀释。
3. 转氨酶只能作用于α-L-氨基酸,对D-氨基酸无作用。
实验室多用α-DL-氨基酸(较L-氨基酸价廉),若用L-氨基酸,则用量减半。
4. 溶血标本不宜使用,因血细胞中转氨酶活力较高,会影响测定效果。
5. 血清样品的测定需在显色后30分钟内完成。
6.丙酮酸标准液的浓度要求十分精确。
由于丙酮酸开封后易变质为多聚丙酮酸,而影响丙酮酸标准液的有效浓度而不易察觉。
建议使用质量可靠的市售丙酮酸标准液。
7.每批试剂的空白管吸光度上下波动不应超过0.015A,若有超出,应仔细检查试剂与仪器方面的问题。
8.严重脂血、黄疸、溶血和糖尿病酮症酸中毒病人血清标本可增加测定的吸光度,测定这类标本应做血清标本对照管优点:尽管基质液中余下的a-酮戊二酸同样可生成红棕色苯腙硝醌化合物而影响测定结果,但因其量不多,加之对505nm的吸光度远不如丙酮酸生成的苯腙硝醌化合物强,尤其用标准曲线作测定时,所用的酶活性单位通过卡门氏分光光度速率法矫正,摈弃了赖氏法一些固有弊端,结果比其他比色法准确.故卫生部临检中心建议国内无条件使用连续监测法的单位使用赖氏法.1981年全国常规生化检验方法学术讨论会认为赖氏法测定ALT活性较为合理, 缺点:由于赖氏法设计的底物浓度,如a-酮戊二酸不足,反应速度只能达到最大速度的65%;显色剂2,4-二硝基苯肼的用量只及反应液中酮酸浓度的一半;保温30min的酶促反应后,新生成的丙酮酸和未用完的a-酮戊二酸存在着无法人为控制的竞争显色的几率问题,如此等等,使赖氏法的重现性较差,在测量精度上仍与连续监测法相差甚大.* 1个卡门氏单位的定义是:在温度25℃,pH7.4,波长340nm,光径1cm的条件下,1ml血清使NADH的吸光度下降0.001的转氨酶活性。
生化检查操作方法

肝功能GPT:工作液1ml 加血清100ml 混匀1分钟测定GOT:工作液1ml 加血清100ml 混匀1分钟测定空白:R 12ml 加生理盐水100ml 样品:工作液2ml 加样品100ml 混匀浴温10分钟测定标准:工作液2ml 加标准液100ml 空白:R 12ml 加生理盐水8ml 样品:工作液2ml 加样品8ml 混匀浴温5分钟测定标准:工作液2ml 加标准液8ml 空白:工作液1.5ml 加蒸馏水10ml 校准:工作液1.5ml 加校准液10ml 混匀浴温10分钟测定样品:工作液1.5ml 加样品10ml血脂加空白:工作液1ml 加蒸馏水100ml 校准:工作液1ml 加校准液100ml 混匀20秒测定样品:工作液1ml 加样品100ml 空白:工作液1ml 加蒸馏水10ml 校准:工作液1ml 加校准液10ml 混匀30秒测定样品:工作液1ml 加样品10ml 空白:工作液1ml 加蒸馏水10ml 校准:工作液1ml 加校准液10ml 混匀浴温10分钟测定样品:工作液1ml 加样品10ml 空白:工作液1ml 加蒸馏水10ml 校准:工作液1ml 加校准液10ml 混匀浴温6分钟测定样品:工作液1ml 加样品10ml 参考值:GPT:0-40U/L Glu: 3.89-6.11umol/L GOT:0-40U/L Cre:男53-97umol/LT-Bili: 5.1-19umol/L 女44-80umol/L D-Bili:0-5.1umol/L Ua:1.7-8.3mmol/L TG: 1.71-2.26mmol/LCho: 5.17-6.47mmol/L血糖Glu 生化检查操作方法总胆红素T-Bili直接胆红素D-Bili肌酐Cre〉〉〉〉〉〉〉尿素Ua甘油三脂TG总胆固醇Cho测定10分钟测定10分钟测定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、血清谷丙转氨酶( SGPT) 赖氏改良法
器材:试管及试管架、移液器或吸量管、恒温水浴锅、 721型分光光度计、温度计、动物血清
试剂:
( 1) 0.1mol/L pH7.4磷酸盐缓冲液:
①0.1mol/L磷酸氢二钠溶液: 称取Na2HPO414.22g或
Na2HPO4·2H2O17.8g溶
解于蒸馏水中, 并稀释至1 000ml,4℃保存。
②0.1mol/L磷酸二氢钾溶液: 称KH2PO413.61g溶解dH2O中, 稀释至
1000ml,
4℃保存。
③将0.1mol/L磷酸氢二钠溶液420ml和0.1mol/L磷酸二氢钾溶液80ml混
和即
为0.1mol/L pH7.4的磷酸盐缓冲液。
加氯仿数滴, 4℃保存。
( 2) 标准丙酮酸( 含丙酮酸2.0μmol/mL) :
取标准丙酮酸钠10mg, 用上述缓冲液准确定容为50mL。
此液须当日用当日配。
( 3) SGPT底物液(含α-酮戊二酸2μmol/ml及DL-丙氨酸200μmol/ml) :取α-酮戊二酸29.2mg, DL-丙氨酸7g ,用试剂1溶成100ml, 在稀释到刻度前, 以1mol /L NaOH调pH 7.4( 因为转氨酶在pH7.3以下或7.6以上的环境中酶活性下降) , 加数滴氯仿防腐。
此液于冰箱保存可使用4天。
( 4) GOT底物液(DL–天冬氨酸200mmol/L ,α-酮戊二酸 2mmol/L):称取α- 酮戊二酸29.2mg和DL-门冬氨酸2.66g置于一小烧杯中,加入1mol/L氢
氧化钠20.5ml使溶解,并校正pH至7.4,然后将溶液移入100ml容量瓶内,用0.1mol/L磷酸盐缓冲液定容至刻度。
放置冰箱内保存。
( 5) 2.4-二硝基苯肼溶液:
取分析纯2,4-二硝基苯肼19.8mg, 用1mol/L HCl溶于100ml, 置棕色瓶中保存。
( 6) 0.4mol/L NaOH溶液:
称取16g固体NaOH, 用蒸馏水溶解, 冷却至室温, 定容至1000mL, 备用。
操作步骤:
1、标准曲线绘制: 取试管18支按下表操作。
每个样做3个平行, 置37水浴30分钟, 各管加2, 4-二硝基苯肼液0.5mL, 混匀, 再在37℃水浴中放置20mL, 各管加0.4mol/L氢氧化钠溶液5mL, 混匀, 10分钟后, 从水浴箱中取出, 以蒸馏水调”零”点, 用520nm 波长比色, 读取各管之吸光值, 各管之吸光值均减去空白的吸光值, 然后以吸光值为纵坐标, 各管相应的转氨酶单位为横坐标。
绘制成标准曲线。
为了方便, 可列出各光度相当于转氨酶单位表。
2、酶活性测定: 取试管两支, 注明测定管及对照管。
置37℃水浴30分钟( SGOT为37℃, 60分钟后再加枸橼酸苯胺1滴)
2.4-二硝基苯肼( mL) 0.5 0.5
置37℃水浴20分钟
SGPT或SGOT底物( mL) —0.5 NaOH溶液( mL) 5.0 5.0
对照及样品各做3个平行, 充分摇匀, 静置10分钟后, 用520nm波长比色, 以蒸馏水调节零点, 读取吸光值, 用样品减去对照吸光值, 求得样品的谷丙转氨酶活力。
●谷丙转氨酶活性单位:
37℃, pH7.4, 每小时每毫升血清催化生成1μmol 丙酮酸为1个单位。
例: 0.1ml血清每小时催化生成0.1μmol丙酮酸, 即相当于GPT 100U / 100ml 血清。
●注意:
1. 在测定SGPT时, 应事先将底物、血清在37℃水浴中
保温, 然后在血清管中加入底物, 准确记时。
2. 标准曲线上数值在20~500U是准确可靠的, 超过
500U时, 需将样品稀释。
3. 转氨酶只能作用于α-L-氨基酸, 对D-氨基酸无
作用。
实验室多用α-DL-氨基酸( 较L-氨基酸
价廉) , 若用L-氨基酸, 则用量减半。
4. 溶血标本不宜使用, 因血细胞中转氨酶活力较高,
会影响测定效果。
5. 血清样品的测定需在显色后30分钟内完成。
6.丙酮酸标准液的浓度要求十分精确。
由于丙酮酸开封后易
变质为多聚丙酮酸, 而影响丙酮酸标准液的有效浓度而不
易察觉。
建议使用质量可靠的市售丙酮酸标准液。
7.每批试剂的空白管吸光度上下波动不应超过0.015A, 若有
超出, 应仔细检查试剂与仪器方面的问题。
8.严重脂血、黄疸、溶血和糖尿病酮症酸中毒病人血清标本
可增加测定的吸光度, 测定这类标本应做血清标本对照管
优点: 尽管基质液中余下的a-酮戊二酸同样可生成红棕色苯腙硝醌化合物而影响测定结果,但因其量不多,加之对505nm的吸光度远不如丙酮酸生成的苯
腙硝醌化合物强,特别用标准曲线作测定时,所用的酶活性单位经过卡门氏分
光光度速率法矫正,摈弃了赖氏法一些固有弊端,结果比其它比色法准确.故
卫生部临检中心建议国内无条件使用连续监测法的单位使用赖氏法.1981年
全国常规生化检验方法学术讨论会认为赖氏法测定ALT活性较为合理, 缺点: 由于赖氏法设计的底物浓度,如a-酮戊二酸不足,反应速度只能达到最大速度的65%;显色剂2,4-二硝基苯肼的用量只及反应液中酮酸浓度的一半;保温
30min的酶促反应后,新生成的丙酮酸和未用完的a-酮戊二酸存在着无法人
为控制的竞争显色的几率问题,如此等等,使赖氏法的重现性较差,在测量精
度上仍与连续监测法相差甚大.
* 1个卡门氏单位的定义是: 在温度25℃, pH7.4, 波长340nm, 光径1cm 的条件下, 1ml血清使NADH的吸光度下降0.001的转氨酶活性。
* 国际单位: 在最适温度( 25℃) 下, 1分钟产生1μmol丙酮酸的酶量为1个活性单位, 即1IU=1umol/min。
* King法单位定义是: 每1ml血清在37℃条件下与底物作用60 min, 生成1μmol丙酮酸称为一个单位。
* Mohun 法单位定义是: 每毫升血清在pH=7.4, 37℃条件下与底物作用
30 min, 每生成2.5微克丙酮酸为1单位。
二、尿素氮( BUN) ( 二乙酰一肟法尿素测定)
( 一) 仪器设备: 水浴锅、紫外分光光度计、 10mL试管
( 二) 试剂:
1、尿素氮试剂: 蒸馏水100mL, 浓硫酸44mL, 85%磷酸66mL, 冷却至室温后,
加氨基硫脲50mg, 硫酸镉( 3CdSO4·8H2O) 2g, 溶解后稀释至1000mL。
2、20g/L二乙酰一肟试剂: 称取二乙酰一肟20g, 加入蒸馏水溶解, 定容至
1000mL。
3、尿素氮标准贮存液( 357mmol/L) : 称取尿素1.072g溶解于蒸馏水中定容
至1000mL, 至于棕色瓶中贮存。
4、尿素氮标准应用液( 17.85mmol/L) : 取贮存液5mL, 加蒸馏水定容至
100mL。
( 三) 操作步骤
按下面表格的试剂配比操作:
按上述表的配方每个样做3个平行样, 混匀, 置沸水浴中加热15min, 立即用自来水冷却5分钟。
分光光度计选用540nm波长, 以空白管调零点, 读取各管吸光度。
尿素( mg%) =测定管吸光度/标准管吸光度×17.85(mg/ml)
⏹ 1. 此法灵敏度高, 用量极微( 一般只需0.02ml血清即可) 。
本实验是
先将血清用生理水以1: 4加以稀释再取0.1ml, 故最后计算时, 应乘以稀释倍数”5”
⏹ 2. 试剂中加入硫胺脲和镉离子, 可增进显色强度和色泽稳定性, 但仍
有轻度褪色现象( 小于5%/h) 。
⏹ 3. 此法操作简单, 特异性强, 不受其它非蛋白质含氮化合物如尿酸、
肌酸等影响, 但应控制好实验条件。
