新水杨酸溶出度标准片的标定与评价
HPLC法测定烟酸片的溶出度

色 谱 条 件 色 谱 柱: 赛 默 飞 Hypersil Gold C18 柱 11.0356、11.0438、11.0445、11.0550, 平 均 峰 面 积 为
(4.6 mm×250 mm,5 μm); 流 动 相:0.1% 三 乙 胺 11.0420,RSD=0.07%(n=6),结果表明该方法精密度良好。
2.20 ~ 39.93 mg•L-1 浓度范围内显良好的线性关系(r=1), 置 100 mL 容量瓶中,加水溶解并稀释至刻度,作为对照
平均回收率为 99.51%(n=9),RSD 为 0.79%。结论 : 该 品溶液。
方法准确、可靠,可用于烟酸片的溶出度测定。
溶出度供试品溶液的制备 取本品按照溶出度测定法
差异均不大,峰型均保持良好,本文流动相系统耐用性较好。
拓展测定比较 按处方比例自制三批样品,采用高效
液相法和紫外分光光度法对更多批次烟酸片溶出度进行拓
展测定比较,并采用统计学分析方法对测定结果差异进行
了分析评价,结果,高效液相法与紫外分光光度法测定结
果基本一致。
参考文献 [1] 孙丹杰 . 托伐他汀与烟酸缓释片联合治疗高脂血症 的疗效分析 [J]. 母婴世界 ,2019,(18):104-104. [2] 韩奕奕 , 王霞 , 马颖清 , 等 . 乳粉中烟酸和烟酰胺 含量测定能力验证结果与分析 [J]. 食品安全质量检测学 报 ,2020,(17):93-99. [3] 国家药典委员会 . 中华人民共和国药典:二部 [S]. 北京:中国医药科技出版社,2020:1410-1411. [4] 韩 素 超, 张 红 中, 祖 振 涛, 等 .JJF( 浙)10962014《药物溶出度仪校准规范》问题探讨 [J]. 计量与测试 技术,2020,(10):104-105. [5] 刘晓雨,胡洋,王卓,等 . 烟酸在水中的溶解度及 介稳性质的研究 [J]. 化学工程,2019, 47(7):35-40. [6] 纪 世 彬 . 高 效 液 相 色 谱 - 二 极 管 阵 列 检 测 器 法 测 定 复 合 维 生 素 B 片 中 5 种 组 分 的 溶 出 度 [J]. 安 徽 医 药 ,2020,24(8):1512-1514. [7] 蔡迪鸣 .HPLC 法同时测定党参中烟酸及党参炔苷 含量的方法探究 [J]. 医药前沿,2018, 8(18):398-398. [8] 黄 丹, 丁 家 昱, 刘 秀 秀, 等 . HPLC 测 定 盐 酸 烟 酰美金刚胺中的烟酸及其他有关物质 [J]. 华西药学杂志, 2017, 32(4):421-423. [9]Cellar Nicholas A.,McClure Sean C.,Reddy Todime M.,et al.A new sample preparation and separation combination for precise, accurate, rapid, and simultaneous determination of vitamins B-1, B-2, B-3, B-5, B-6, B-7, and B-9 in infant formula and related nutritionals by LC-MS/MS[J].Analytica Chimica Acta,2016,934:180-185. 作者简介:梁晓云,女,主管药师,主要从事食品药
新水杨酸溶出度标准片的标定与评价

新水杨酸溶出度标准片的标定与评价
李杨;李连杰;黄德友;蒋登高
【期刊名称】《中国当代医药》
【年(卷),期】2014(21)21
【摘要】目的对新水杨酸溶出度标准片A样和B样进行标定和评价.方法分别采用篮法、桨法、小杯法对标准片进行溶出度试验,以紫外分光光度法对水杨酸的浓度进行测定.结果 A样与B样的平均溶出度为26.81%、24.21%(篮法);28.95%、26.56%(桨法);22.50%、20.33%(小杯法).A样与B样的RSD为1.1%、1.2%(篮法);1.3%、2.1%(桨法);3.7%、3.9%(小杯法).结论两种水杨酸片均可作为标准片使用.
【总页数】3页(P11-13)
【作者】李杨;李连杰;黄德友;蒋登高
【作者单位】河南省食品药品检验所,郑州450003;郑州大学化工与能源学院,郑州450001;郑州大学化工与能源学院,郑州450001;郑州大学化工与能源学院,郑州450001
【正文语种】中文
【中图分类】R917
【相关文献】
1.头孢特仑新戊酯片溶出度测定方法研究 [J], 蒲静;周化印;王淑梅
2.改善乙酰水杨酸片溶出度的研究 [J], 石强
3.头孢呋辛酯片与新菌灵片的溶出度比较 [J], 张洁玫;陈鸿彬;陈丹瑾
4.头孢呋辛酯片与新菌灵片的溶出度比较 [J], 张洁玫; 陈鸿彬; 陈丹瑾
5.水杨酸片溶出度测定的不确定度评定 [J], 刘斌; 冯春艳; 邢征宇
因版权原因,仅展示原文概要,查看原文内容请购买。
乙酰水杨酸片溶出

药剂学实验课
乙酰水杨酸片溶出度的测定
药剂学实验课
实验目的
• 掌握片剂溶出度的测定方法及其意义
药剂学实验课
理原验实
1.溶出度:药物从片剂等固体制剂中溶 出的速度和程度。 2.测定方法:① 转篮法 ② 浆法 ③ 小杯法
药剂学实验课
溶 出 过 程
实验原理
一般药物的溶出速度主要受扩散的影响。 溶解度小于0.1-1%的药物,药物的溶出是其 吸收的限制过程。
药剂学实验课
实验原理
崩解时限与体内的吸收并不都存在着平衡关系。 了解机体吸收的可靠方法是对该制品进行活体的 生物利用度测定,但测定血药浓度,尿药排泄速 率及其代谢物等方法比较复杂,代价太高,有实 际困难。实验证明,很多药物的体外溶出与吸收 有相关性,因此溶出度测定法作为反映或模拟体 内吸收情况的试验方法,在评定质量上有着重要 意义。
药剂学实验课
实验原理
片剂中还有些药物除规定有崩解时限外, 还要进行溶出度测定,发生相互作用的药物
③久贮后溶解度降低的药物
④剂量小、药效强、副作用大的药物片剂
药剂学实验课
溶出速率测定:
实验内容
1.配制人工胃液:
1000 ml蒸馏水+浓盐酸,调PH值至1.2~1.7.(约需要浓盐酸10ml) 2.放入大烧杯中,在水浴中加热至37±1℃,在操作中维持此温度。 3.放入已精密称定的片剂1片,开始运转计时。 4.按2′、4′、6′、10′、20′、30′、40′、50′定量取样,每次取样5ml,
乙酰水杨酸片剂及胶囊剂的制备及其溶出度的测定

xxx大学生命与环境科学学院药剂学实验报告乙酰水杨酸片剂及胶囊剂的制备及其溶出度的测定Preparation and Dissolution Rate Determination of Acetyl Salicylic Acid’s Tablet and Capsule姓名:xxx学号:xxx 年级:xxx专业:xxx小组成员:xxx指导教师:xxx2014年6月15日乙酰水杨酸片剂及胶囊剂的制备及其溶出度的测定Xxx(xxx大学生命与环境科学学院,,100081)摘要:目的制备乙酰水杨酸的片剂及胶囊剂,并测定两种乙酰水杨酸剂型溶出度。
方法:《中国药典》2005年版中溶出度测定的基本操作和数据处理方法,用紫外分光光度仪在303nm下测定不同时间溶出度。
结果:乙酰水杨酸的片剂溶出度大于其胶囊剂。
关键词:乙酰水杨酸;片剂;胶囊剂;溶出度Preparation and Dissolution Rate Determinationof Acetyl Salicylic Acid’s Tablet and Capsulexxx(College of Life and Environmental Science, xxx, Beijing, 100081)Abstract:Objective: To prepare the Acetyl Salicylic Acid’s tablet and capsule, and determine their dissolution rate. Method: Dissolution rate was determined according to Pharmaeopoeia of China (2005) by testing the light absorption value (A) spectrophotometrically at 530 nm. Result: the Acetyl Salicylic Acid tablet’s dissolution rate is more than that of capsule. Conclusion: provide the scientifical data for choosing the form of Acetyl Salicylic Acid.Keywords: Acetyl salicylic acid;tablet and capsule;dissolution rate前言【研究背景】药物的有效性,不仅取决于药物的有效成分及药物的化学结构,口服固体制剂的溶出度也是影响人体生物利用度的一个重要因素,两者有着明显的相关性,特别是难溶性药物,如乙酰水杨酸,由于颗粒大小或加入赋型剂不同,尽管口服剂量相同,疗效却存在很大差异。
GMP质量体系水杨酸检验操作规程

GMP质量体系水杨酸检验操作规程GMP(Good Manufacturing Practice,良好生产规范)是制药行业常用的一种质量管理体系,用来确保药品质量和安全性。
在GMP质量体系中,水杨酸是一种重要的药物原料,对其进行质量检验具有重要意义。
以下是水杨酸检验的操作规程,共计1200字以上:一、检验目的及范围水杨酸检验的目的是确保水杨酸符合国家相关标准和企业内部质量要求。
检验范围包括外观检查、物理性质检测、化学性质检验、控制杂质检验等。
二、检验设备及试剂1.称重器具:电子天平。
2.温度计:精密温度计。
3.PH计:PH检测仪。
4.外观检查器具:显微镜、放大镜。
5.化学试剂:甲醇、酸化钠、氢氧化钠、硝酸银等。
三、检验项目及方法1.外观检查:a.宏观外观检查:观察水杨酸样品的颜色、形状、气味等。
b.微观外观检查:在显微镜下观察水杨酸样品的形态结构、晶体形态等。
2.物理性质检测:a.熔点测定:将水杨酸样品放入装有玻璃母液的试管中,加热直到样品完全熔化,记录熔点。
b.干燥失重:称取一定量的水杨酸样品,放入预称好的干燥皿中,将其放入干燥器中干燥至恒重,计算失重率。
c.溶解性测定:称取一定量的水杨酸样品,加入一定体积的溶剂,在恒定温度条件下搅拌直到溶解,记录加入溶剂的量。
3.化学性质检验:a.酸溶液性质测定:将水杨酸样品加入少量的甲醇和酸化钠溶液中,观察是否有气体释放。
b.碱溶液性质测定:将水杨酸样品加入少量的甲醇和氢氧化钠溶液中,观察溶液的颜色和气味变化。
c.化学反应测定:将水杨酸样品与硝酸银溶液反应,观察是否有白色沉淀生成。
d.PH值测定:将水杨酸样品与适量的水调成溶液,使用PH计测量其PH值。
4.杂质检验:a.铁杂质检验:使用铁离子试剂进行反应,观察是否出现深红色沉淀。
b.水分测定:取一定量的水杨酸样品,放入烘箱中烘干至恒重,计算水分含量。
四、检验记录与报告1.检验记录应包括样品信息、检测日期、检验人员、检验方法和结果等内容。
复方乙酰水杨酸片质量标准研究
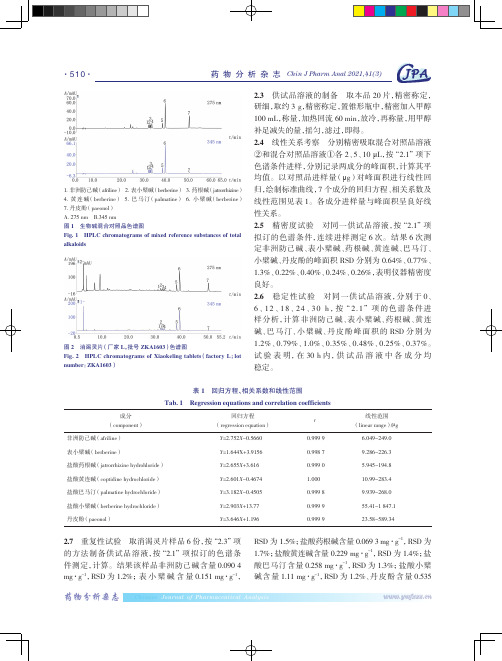
·510·1. 非洲防己碱(afriline)2. 表小檗碱(berberine)3. 药根碱(jatrorrhizine)4. 黄连碱(berberine)5. 巴马汀(palmatine)6. 小檗碱(berberine)7. 丹皮酚(paeonol)A.275 nm B.345 nm图1 生物碱混合对照品色谱图Fig. 1 HPLC chromatograms of mixed reference substances of totalalkaloids图2 消渴灵片(厂家L,批号 ZKA1603)色谱图Fig. 2 HPLC chromatograms of Xiaokeling tablets(factory L;lotnumber:ZKA1603)表 1 回归方程、Tab. 1 Regression equations and correlation coefficients成分(component)回归方程(regression equation非洲防己碱(afriline)Y=2.752X表小檗碱(berberine)Y=1.644X+3.9156盐酸药根碱(jatrorrhizine hydrohloride)Y=2.655X盐酸黄连碱(coptidine hydrochloride)Y=2.601X盐酸巴马汀(palmatine hydrochloride)Y=3.182X盐酸小檗碱(berberine hydrochloride)Y=2.903X丹皮酚(paeonol)Y=3.646X2.7 重复性试验 取消渴灵片样品6份,按“2.3”项的方法制备供试品溶液,按“2.1”项拟订的色谱条件测定,计算。
结果该样品非洲防己碱含量0.090 4 mg·g-1,RSD为1.2%;表小檗碱含量0.151 mg·g-1,Journal of Pharmaceutical AnalysisChinese·512· 消渴灵片样品主成分分析 Principal component analysis of Xiaoqiling tabletsChineseJournal of Pharmaceutical Analysis化学计量分析的优势 运用化学计量方法对样品的色谱图进行分析,是基于含量测定方法基础上,对多批次样品进行总体的分析考察。
水杨酸片溶出度测定的不确定度及Z比分数研究

[1]
[2]
Tel: (0574)87831518
Chin J Mod Appl Pharm, 2015 December, Vol.32 No.12
中国现代应用药学 2015 年 12 月第 32 卷第 12 期
为获得扩展不确定度 , 对合成标准不确定度所乘 之数字因子, 一般在 2~3 内, 它等于扩展不确定度 与合成标准不确定度之比。 Z 比分数法[3]是国际公认、中国实验室认可评 价实验室检测能力的一种方法。在实验室能力比 对前,由组织者准备好均匀的样品,统一试验方 法后,分发给各参加单位,参加单位按时返回比 对结果。通过 Z 比分数法得出每一个比对结果对 应的 Z 比分数。进而评价出该比对结果是“满意 结果” 、 “可疑值”或者“离群值” ,作为一个定性 的评价。 1 仪器与试剂 Sotax AT7 型溶出仪(瑞士 Sotax);UV-2550 紫 外分光光度计及工作站(日本岛津);CP225D 电子 天平(德国 Sartorius); 水杨酸溶出度校正片(中国药 品生物制品检定所,批号:101030-200610,标示 量:每片 300 mg);水杨酸对照品(中国药品生物 制品检定所, 批号: 100106-201104, 纯度: 100%); 磷酸二氢钾 ( 批号: 10017618) ;氢氧化钠 ( 批号: 10019718) ;乙醇 ( 批号: 10009164) 均购自国药集 团化学试剂有限公司;纯水(实验室自制)。 2 2.1 溶出仪的性能确认 校正所用溶出度测定仪 按中国药典 2010 年版二部附录ⅩC 第一法(篮 法)、第二法(浆法)操作。 2.2 溶出介质的配制 取磷酸二氢钾 6.80 g,加氢氧化钠 1.58 g,先 用尽量少的水溶解(约 50 mL),加煮沸并冷却至约 41 ℃的水稀释至 1 000 mL,即得。 2.3 对照品溶液的制备 精密称取水杨酸对照品 2 份约 20 mg ,置 100 mL 量瓶中, 加乙醇 1 mL, 摇匀, 加溶剂适量, 经超声处理 30 min,使水杨酸溶解,加溶剂至刻 度,摇匀,精密量取 5.0 mL 置 50 mL 量瓶中,溶 剂稀释至刻度,摇匀,作为对照品溶液。 2.4 校正溶液的制备 取介质溶剂各 900 mL,分别注入每个操作容 器中,温度保持在 (37±0.5)℃,按规定 (篮法,浆 法均为 100 r·min1 )调整转速。取水杨酸溶出度校 正片 6 片,分别精密称定,分置 6 个容器中,自 药片接触溶出介质时开始计时,30 min 时取样。 2.5 测定法 精密吸取校正溶液 5.0 mL,分别置 25 mL 量
水杨酸的质量指标及每一项指标的分析

水杨酸的质量指标及每一项指标的分析
一、质量标准
性状:白色细微的针状结晶或白色结晶性粉末
熔点:158-161o C
含量测定:不得少于98.5%
二、检测方法
2.1性状
本品为白色细微的针状结晶或白色结晶性粉末;无臭或几乎无臭,味微甜,后转不适。
本品在乙醇或乙醚中易溶,在沸水中溶解,在氯仿中略溶,在水中微溶。
2.2熔点
熔点:取本品适量,按照《熔点测定法》测定,本品的熔点为158-161o C。
2.3含量
(1)试剂/试药:中性乙醇、酚酞指示液、氢氧化钠滴定液(0.1mol/L)
(2)仪器用具:25ml移液管、滴定管、锥形瓶
(3)检验方法:取本品约0.3g,精密称定,加中性乙醇(对酚酞指示液显中性)25mL溶解后,加酚酞指示液3滴,用氢氧化钠滴
定液(0.1mol/L)滴定。
每1mL氢氧化钠滴定液(0.1mol/L)相当于13.81mg的水杨酸。
水杨酸片溶出度测定能力验证的结果分析

全国31个 省 (市)、自 治 区 共 40 家 实 验 室 报 名参加本次 能 力 验 证 计 划,40 家 实 验 室 反 馈 了 结 果。其 中, 中 检 院 2 个 实 验 室 (占 5.0%), 省 (市 )、 自 治 区 (食 品 ) 药 品 检 验 所 31 家 (占 77.5%),武警药检所1 家 (占 2.5%), 市 级 (食 品) 药品检验所6家 (占 15.0%), 实 验 室 所 在 地 区 分 布 见 表 1。
本次能力 验 证 方 法 为 参 照 《中 国 药 典 》2010 年版二部附录 ⅩC 溶 出 度 测 定 法 中 所 涉 及 的 篮 法、 桨法和小杯法3种方法进行,因此,除药物溶出仪 的各项机械性能应符合药典附录要求外,在进行样 品测定前还应用溶出度标准片对仪器进行性能确认 试验,按照标准片的说明书操作,试验结果应符合 标准片的规定。 1.4 统 计 方 法
参照 CNAS-GL02:能力验 证 结 果 的 统 计 处 理 和 能 力 评 价 指 南 并 [3] 结 合 药 物 溶 出 度 测 定 的 特 点, 采用 EXCEL 分别对篮法、桨法和小杯法溶 出 度 测 定能力验证结果进行了结果总数、剔除离群值后结 果的平均值、平均值 ±3 标 准 偏 差 (SD)、 最 大 值 (Max)、最 小 值 (Min)、 极 值 (Max "Min)、 相 对标准偏差 (RSD) 进行了统计分析。 1.5 结 果 判 定 标 准
sotax溶出仪确认方案

sotax溶出仪确认方案Sotax溶出仪确认方案确认方案编号仪器编号流程部门签名日期XX制定人XX审核人XX审核人XX批准人1.确认目的及范围1.1研究所Sotax溶出试验仪(仪器编号:)用于样品溶出度测定,每6个月进行一次性能确认,验证有效期至,因此需开展性能确认。
2.确认小组及职责2.1.确认小组及职责组长姓名职务部门确认工作职责XX XX XX确认文件、报告的批准组员XX XX XX确认文件、报告的审核XX XX XX确认文件、报告的审核XX XX XX确认文件、报告模板的起草、操作培训、现场指导、报告审核XX XX XX按方案进行操作及数据整理,填写相关数据,及检查相关、报告编写3.仪器描述3.1.仪器信息确认要求:在开始确认前记录仪器的基本信息确认内容确认人确认日期仪器名称仪器型号仪器SN号仪器编号安装地点4.风险评估N/A5.确认前准备5.1操作人信息确认操作人员信息:姓名:部门:职务:日期:年月日上岗证编号:注:需附上岗证复印件及培训签到表5.2检查人信息确认检查人员信息:姓名:部门:职务:日期:年月日导师证号:注:需附导师证复印件5.4电子天平信息确认仪器名称:型号:生产厂家:证书编号:校准日期:有效期至:是否有偏差□是□否确认人(日期):检查人(日期):(备注:应将溯源性证书复印件附于报告后)5.5紫外分光光度计信息确认仪器名称:型号:生产厂家:证书编号:校准日期:有效期至:是否有偏差□是□否确认人(日期):检查人(日期):(备注:应将溯源性证书复印件附于报告后)5.6标准品信息确认标准品名称:规格:生产厂家:合格证编号:5.8温湿度计信息确认6.进度安排序号项目名称时间 1 验证方案起草 10个工作日 3 验证方案培训及实施 15个工作日 4验证报告3个工作日7.性能确认7.1.仪器显示时间确认:内容标准结果结论确实仪器显示时间是否与北京时间一致拨打12117电话与之对应,时间差距不超过5min□合格□不合格7.2.水杨酸片校正7.2.1调试溶出度仪,先调试桨法,桨法完后,再调试篮法。
溶出度检查法
目的:确保检验数据的准确和生产的顺利进行。
范围:适用于溶出度的测定。
责任者:操作员规程:1、简述1.1 溶出度是指药物从片剂或胶囊剂等口服固体制剂在规定溶剂中溶出的速度和程度。
它是评价药物口服固体制剂质量的一个指标,是一种模拟口服固体制剂在胃肠道中崩解和溶出的体外简易的试验方法。
1.2 溶出度测定法是将某种固体制剂的一定量分别置于溶出度仪的转篮(或烧杯)中,在(37±0.5℃)恒温下,在规定的转速、溶剂中依法操作,在规定的时间内测定其溶出的量。
1.3 本方法适用于片剂、胶囊剂及颗粒剂的测定。
1.4 中国药典2000年版收载三种测定方法,第一法转篮法、第二法桨法、第三法小杯法。
1.5 检查溶出度的制剂,不再进行崩解时限的检查。
2、仪器与用具2.1 溶出度仪2.1.1 仪器的组成:溶出度仪主要由电动机、恒温水浴、篮体、篮轴、搅拌桨、圆底烧杯及杯盖等组成。
2.1.2 仪器的装置与使用:按溶出度测定仪SOP进行操作。
2.1.3 仪器的校正:为使同一种药物的溶出度测定得到良好的重现性,应对新安装的溶出度仪采用校正片进行校正,对已使用过的仪器也应定期或在出现异常情况时采用校正片进行校正。
2.1.3.1 溶出度校正片分崩解型和非崩解型两种,崩解型为泼尼松片,非崩解型为水杨酸片。
2.1.3.2 校正片测定前,应先调试所用仪器,上述两种校正片只适用于六杯式溶出度仪。
2.1.3.3 按溶出度校正片使用说明校正仪器时,应注意在标准吸收度的测定与溶出度的测定前,均需将溶液经滤纸滤过,不宜使用滤膜滤过。
2.2 取样器:注射器(5、10、15、20ml)及取样针头。
2.3 滤过器:滤头及滤膜(≤0.8μM)。
3、操作方法3.1 仪器的调试3.1.1 每次使用前应检查转轴是否垂直,与圆底烧杯的轴线间偏离要小于±2mm,旋转应平稳、无颤动。
稳速误差不得超过±4%。
3.1.2 水浴的温度应能使圆底烧杯内溶剂的温度保持在(37±0.5)℃。
国产氟苯水杨酸胶囊剂与进口片剂溶出度的比较

国产氟苯水杨酸胶囊剂与进口片剂溶出度的比较
林芳;王胜浩
【期刊名称】《药学实践杂志》
【年(卷),期】1999(017)006
【摘要】目的对国产氟苯水杨酸胶囊剂与进口片剂进行溶出度的比较。
方法参
照USP23版氟苯水杨酸片剂的溶出度测定方法,用紫外分光光度仪测定其含量。
结果测定方法的平均回收率为100.27%,RSD为0.62%,溶出度的重现性与均一性都较好。
胶囊剂与片剂溶出80%所需的时间分别为12.80min与13.04min。
结论:胶囊剂与片剂均符合质量标准中所规定的溶出限度,T80两者无显著性差异。
【总页数】3页(P339-341)
【作者】林芳;王胜浩
【作者单位】浙江省医学科学院药物所;浙江省医学科学院药物所
【正文语种】中文
【中图分类】R944.5
【相关文献】
1.头孢羟氨苄片剂与胶囊剂体外溶出度比较 [J], 韦曦;黄月好
2.替米沙坦片剂与胶囊剂体外溶出度的比较 [J], 黄德芳;刘伟光;梁惠芬
3.阿莫西林片剂与胶囊剂体外溶出度的比较 [J], 匡福有
4.依诺沙星片剂与胶囊剂体外溶出度比较 [J], 钱薇;朱华
5.盐酸头孢他美酯片剂与胶囊剂体外溶出度比较 [J], 朱华;许建国;蒋丹
因版权原因,仅展示原文概要,查看原文内容请购买。
水杨酸溶出度标准片(校正片)说明书

水杨酸溶出度标准片(校正片)说明书一、产品概述水杨酸溶出度标准片(校正片)是用于测定药物中水杨酸溶出度的标准样品。
该产品具有准确的水杨酸溶出度,可用于药物制剂质量控制和药物溶出度测试仪器的校正。
本说明书将详细介绍水杨酸溶出度标准片的使用方法和注意事项。
二、产品规格1. 外形:圆片状2. 直径:10 mm3. 厚度:2 mm4. 片重:约5 g5. 溶出度:每片含水杨酸约100 mg ± 5%三、使用方法1. 准备工作:a. 检查包装是否完好,确认标准片未损坏。
b. 确保药物溶出度测试仪器已校准,并符合相关要求。
2. 实验操作:a. 将水杨酸溶出度标准片放入溶液中,确保片面与溶液完全接触。
b. 将溶液温度控制在37℃±0.5℃,并保持恒定。
c. 按照相关标准测试方法,测定水杨酸的溶出度。
3. 结果计算:a. 测定水杨酸的溶出度后,使用相关计算公式计算溶出度百分比。
b. 比较实际测得的溶出度与水杨酸溶出度标准值的百分比偏差,评估药物制剂的质量控制是否合格。
四、注意事项1. 使用前请检查水杨酸溶出度标准片是否完好,如有损坏请勿使用。
2. 建议使用前先测定水杨酸溶出度标准片的初始溶出度,确定其符合相关要求。
3. 在实验操作中,请确保标准片与溶液的充分接触,避免气泡产生。
4. 在测定水杨酸溶出度时,应按照规定的温度和时间进行实验,确保结果的准确性和可比性。
5. 存放水杨酸溶出度标准片时,请避免阳光直射和高温环境,确保产品质量不受损害。
五、产品包装和储存1. 包装:水杨酸溶出度标准片采用密封包装,每包含1片。
2. 储存条件:储存在干燥、阴凉处,避免高温和阳光直射。
六、售后服务与技术支持如果对本产品的使用方法或其他方面有任何疑问,敬请联系我们的售后服务部门。
我们将竭诚为您提供解答和支持。
七、免责声明本说明书仅供参考,使用者需按照相关法规和规定,结合实际情况进行操作。
对于因使用不当或未能遵循指示造成的任何损失,本公司概不负责。
水杨酸片溶出度测定篮法

水杨酸片溶出度测定篮法水杨酸片溶出度测定篮法是一种常用于药物质量控制的重要方法。
下面将详细介绍该方法的操作步骤,以及一些需要注意的实验技巧。
首先,准备实验所需材料和仪器。
我们需要水杨酸片样品、溶出度测定篮、适量的溶剂、恒温槽、磁力搅拌器和紫外可见分光光度计。
然后,取一定数量的水杨酸片样品,称重并将其放入溶出度测定篮中。
注意,所取样品的数量应当与实际服用剂量相匹配,以确保测试结果的可靠性。
接下来,将溶出度测定篮放入预先加热至37℃的恒温槽中,并加入适量的溶剂。
溶剂的选择需根据水杨酸片所需的理化特性和药物溶出度条件而定,常见的溶剂有磷酸氢二钠溶液、仿生介质等。
然后,开启恒温槽并设置合适的搅拌速度,通常为100 rpm。
在放置恒温槽中一定时间后,取出溶出度测定篮,并将篮内溶剂进行混合均匀。
接下来,用紫外可见分光光度计检测溶液中水杨酸的浓度。
通过比较不同时间点的测定结果,就可以获得水杨酸片的溶出度,并绘制出溶出曲线。
在进行水杨酸片溶出度测定篮法实验时,需要注意以下几点。
首先,确保使用的仪器和材料完好无损,并且事先进行必要的校准操作,以保证结果的准确性。
其次,恒温槽的温度应稳定在37℃,并且固定搅拌速度不变。
此外,测定的时间点应选择合适,以便获取准确的溶出度数据。
水杨酸片溶出度测定篮法是一种成熟、可靠的测定方法,广泛应用于药物质量检测和研发领域。
通过该方法可以评估药物的溶出速率和溶出度特性,为制定合理的药品质量标准提供参考。
同时,该方法也为药物设计与开发提供了重要的信息。
总之,水杨酸片溶出度测定篮法是一种简单实用、全面可靠的药物质量控制方法。
在进行实验时需要注意操作规范,确保仪器和材料的质量以及实验条件的准确性。
这一方法为药物行业的研发和质量控制提供了重要的技术支持。
水杨酸片溶出度测定的不确定度评定

参加 2019 年中国食品药品检定研究院组织的实验室测量审核,本 文以此为实验依据,讨论了紫外-可见分光光度法测定溶出度的不 确定度评定方法和步骤。
1 仪器与试剂
溶出仪型号:Sotax AT Xtend Semi 型;紫外分光光度计:岛 津 UV-2700;电子天平:Mettler toledo XS205;
定法和《测量不确定度要求的实施指南》,分析来自于对照品的取样、溶液的配制过程、仪器测定过程以及测量的重复性等各种不确定度影响
因素,并对其进行评估。取包含因子 k=2,篮法测定水杨酸片溶出度的扩展不确定度 U=0.36 %,桨法 U=0.68 %。
[关键词]不确定度;紫外-可见分光光度法;水杨酸片;溶出度
解,并稀释至刻度,摇匀,即得。
2.4 供试品溶液的制备 取溶出介质各 900 mL,分别置各溶出杯内,温度平衡后,保
持在 37±0.5 ℃,调整转速为 100 转/min。用洗耳球小心除去片子 表面的粉尘,选取水杨酸片 6 片称重,分别置于干燥的转篮中(篮 法)或同时投入六个杯中(桨法)。自水杨酸片接触溶出介质时开始 计时,30 min 时取样,用 0.45 µm 孔径的滤膜滤过,取续滤液为 供试品溶液。自取样至过滤应在 30 s 内完成。 2.5 测定法
Abstract: To establish an uncertainty evaluation method for the dissolution of solid preparation such as tablets or capsules by ultraviolet-visible spectrophotometry. According to the dissolution method of Ch.P 2015 and the Guidance on the Application of the Requirements for Measurement Uncertainty, the factors affecting the uncertainty, including the sampling process of the reference substance, the solution preparation process, the instrumental determination process and the repeatability of the measurement, were analyzed and evaluated. The expanded uncertainty of basket and paddle dissolution methods of Salicylic Acid Tablets were 0.36 % and 0.68 % with the coverage factor as 2.
溶出仪比对总结

溶出仪比对总结
使用溶出度标准片-水杨酸片(标示量:300mg)对两台溶出度仪(编号:127和052)进行性能确认。
方法参照中国药典2015年版四部通则0931第一法(转篮法),转速为100rpm,温度为37℃,时间为30min,采用手动和自动取样。
结果显示,溶出度仪(127)的6片水杨酸片手动取样的平均溶出量为26%,RSD为4%;溶出度仪(052)的6片水杨酸片自动取样的平均溶出量为23%,RSD为1%,手动取样的平均溶出量为25%,RSD为3%。
标准水杨酸片在两台溶出度仪的溶出量和RSD均符合标准规定的21%~26%和≤5%的要求。
溶出度仪(编号:127和052)进行性能确认之后,对两批进行过初检溶出度不合格的阿司匹林肠溶片进行复检,所得结果与初检结果基本一致。
其中,一批阿司匹林肠溶片在溶出度仪(编号:127)自动取样的结果为64%,手动取样的为65%;另一批阿司匹林肠溶片在溶出度仪(编号:052)自动取样的结果为54%,手动取样的为56%。
通过上述的结果基本可以得出以下结论:两台溶出度仪的性能良好,可以满足日常检验要求;对于含量均匀、片重稳定的样品,如标准水杨酸片,两个仪器使用相同的取样方法得出的结果相差不大;同一台溶出度仪自动取样和手动取样的结果稍微有差别,手动取样比自动取样的结果高出1%~2%;手动取样的RSD一般都大于自动取样的RSD,手动取样的重复性小于自动取样,这与手动取样不能6片同时取样且耗时更长有关,建议使用自动取样进行溶出度测定。
水杨酸较正片测定法

共页第页
水杨酸较正片测定法
1.溶济:磷酸盐缓冲液(pH=7.40±0.05)。
2.对照品溶液的制备取本品1片,精密称定,置乳钵中,研细,精密称取适量(约相当于水杨酸20mg),置100ml量瓶中,加乙醇1ml,摇匀,加溶剂适量,经超声处理30分钟,使水杨酸溶解,加溶剂至刻度,摇匀,滤过,作为对照品溶液。
3.供试品溶液的制备取本品6片,分别精密称定,分置干燥的网篮中,待溶出杯中900ml溶剂恒温后,按转篮法开启转速,自药片接触溶出介质时,开始计时,并分别在10,15,20,25,和30分钟取样,每次抽取2ml,各自经滤纸滤过,滤液为供试品溶液。
测定法精密吸取对照品溶液及供试品溶液各1ml,分别置5ml量瓶中,加上述溶剂至刻度,摇匀,在紫外分光光度计296nm的波长处,用1cm吸收池分别测定其吸收度,与对照相比较计算每片的溶出量。
水杨酸校正片(0103—9505,300mg,中国药品生物制品检定所)
片重:g
取样 1 2
吸收度 1 2
每片在296nm波长处吸收度及相应的RSD与r值(见表1)
每片溶出量按公式X%= 计算即得。
以时间为横坐标,以溶出度平均值为纵坐标,可求出相关系数(r)值。
共页第页表1:
校正片中每片的30分钟溶出量应在32%~36%%之内。
RSD除10分种一组可以在10%以下外,其它组应在5%以下。
相关系数(r)值应在0.99以上。
结论:本溶出度测定仪经药品检验仪器检定规程(中国药品生物制品检定所)检定,结果。
溶出度试验质量标准的制订

溶出度试验质量标准的制订本文详尽阐述了如何科学,客观地拟定质量标准中溶出度试验各参数,并廓清了拟定出发点和控制要素,为如何使该试验法的拟定体现出制剂的内在品质提供了佐证与参考。
溶出度试验作为“评价固体制剂内在品质的灵魂与核心”,随着人们对该项技术的不断研究与深入,对其认识与理解亦在不断发展与变化着。
现今,该试验不仅具有为建立体内外相关性而设立的宗旨,且已成为证明药物体内释放特性的一种简单、廉价而不失严谨的实验室检测方法。
“在多种pH值溶出介质中溶出曲线(本文的“溶出度曲线”包含释放曲线,以下同)的测定以及比对”更是成为“剖析”固体制剂内在品质一种重要手段,成为固体制剂内在品质呈现于外在的一种“表象”、“映射”与“载体”,成为在仿制药“殊途同归”的研发进程中提高生物等效性(BE)试验成功率所历经的必由之路,甚至成为该品种在其工艺与处方完全成熟、持续进行多批大规模生产后,所拥有的特定特征“指纹图谱”。
总之,“多条溶出曲线的测定”可在与固体制剂品质相关的所有环节上均发挥出举足轻重的作用。
本文将就个人工作经验与感悟,详尽阐述仿制药如何制订溶出度试验质量标准。
无论是《药品注册管理办法》中的三类新药(已在国外上市销售但尚未在国内上市销售的药品)还是六类新药(已有国家药品标准的原料药或者制剂),两者唯一区别就是有无“可参照的质量标准”,但均请按照以下思路进行。
既有质量标准的可参照性关于六类仿制药,实验者肯定会查询到相关参考文献,如各国药典、国家药监局标准、进口质量标准、《日本橙皮书》、美国FDA公布的溶出曲线数据库、日本仿制药技术申报资料概要等,由于这些标准本身具有局限性、历史性和利益性,因此绝不建议实验者对原研品不经剖析就直接撷取,即便是国外药典或进口质量标准,制订者也不应盲目迷信。
这正是国家药品审评中心自2008年起就反复提出“仿产品不是仿标准”宗旨的核心要素之一(对于口服固体制剂,还有一要素为“有关物质”)。
水杨酸溶出度标准片(校正片)说明书

水杨酸溶出度标准片(校正片)说明书为使同一药品的溶出度测定结果得到良好的重现性,对新安装的溶出度仪应采用溶出度标准片进行性能确认,对当前使用的溶出度仪也应定期(或在出现异常情况时)进行性能确认,溶出度标准片的溶出数据是检定溶出度仪是否良好和实验操作是否规范的依据。
水杨酸片是非崩解型溶出度标准片。
1.试验方法1.1 调试所用溶出度仪按照中国药典2005年版二部附录Ⅹ C 要求进行1.2 溶出介质的制备取磷酸二氢钾6.80g,加氢氧化钠1.58g,用水稀释至1000ml,即得磷酸盐缓冲液( pH =7.4±0.05 )。
将配制好的磷酸盐缓冲液加热至约45℃,趁热减压过滤(0.45µm)。
减压条件下电磁搅拌5分钟(最大体积4000ml)。
即得。
或取磷酸二氢钾6.80g,加氢氧化钠1.58g,先用尽量少的水溶解(约50ml),加煮沸并冷却至约41℃的水稀释至1000ml,即得。
也可采用其他等效的脱气方法,溶出介质中的溶解氧应不超过2.8mg/L。
1.3 对照品溶液的制备取水杨酸对照品约15mg,精密称定,置200ml量瓶中,加溶出介质适量,使水杨酸溶解并稀释至刻度,摇匀。
作为对照品溶液(1)(供篮法和桨法使用);取对照品溶液(1)10.0ml,置50ml量瓶中,用溶出介质稀释至刻度,摇匀,作为对照品溶液(2)(供小杯法使用)为了加快水杨酸的溶解速度,也可先用少量乙醇溶解后再用溶出介质稀释至刻度。
但是乙醇的用量应不超过总体积的1%。
1.4供试品溶液的制备1.4.1篮法和桨法方法A取溶出介质各900ml,分别置各溶出杯内,注意不要将空气带入溶出介质中,不要搅拌,温度平衡后,保持在37±0.5℃,调整转速为100转/分钟。
用吹风机(冷风)、洗耳球或软刷小心除去片子表面的粉尘,选取水杨酸溶出度标准片6片称重后分别置于干燥的转篮中(篮法)或同时投入六个杯中(桨法)。
自标准片接触溶出介质时开始计时,经30分钟时取样(误差应不超过20秒),用不大于0.8µm孔径的滤膜滤过,取续滤液为供试品溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
新水杨酸溶出度标准片的标定与评价
目的对新水杨酸溶出度标准片A样和B样进行标定和评价。
方法分别采用篮法、桨法、小杯法对标准片进行溶出度试验,以紫外分光光度法对水杨酸的浓度进行测定。
结果A样与B样的平均溶出度为26.81%、24.21%(篮法);
28.95%、26.56%(桨法);22.50%、20.33%(小杯法)。
A样与B样的RSD为1.1%、1.2%(篮法);1.3%、2.1%(桨法);3.7%、3.9%(小杯法)。
结论两种水杨酸片均可作为标准片使用。
标签:标准片;溶出度;评价
溶出度标准片是用来检定溶出度仪是否良好和实验操作是否规范的依据,即在规定的条件下,测定标准片的溶出度,并与标准片说明书中规定的溶出范围进行比较,确定溶出仪的性能指标是否符合药典要求。
水杨酸片属于非崩解型标准片,一方面要求片子间的性能差异要小,另一方面又要求针对溶出条件的改变有一定的灵敏度,从而真正达到校正的目的。
本文将中国食品药品检定研究院提供的水杨酸溶出度校正A样和B样分别采用篮法、桨法、小杯法测定,并改变了部分溶出条件,对其进行再次测定,从而达到了标定和评价的目的。
1 仪器与样品
1.1 仪器
溶出仪:天津大学无线电厂ZRS-8G智能溶出试验仪,紫外分光光度计:美国PE公司Lambda35UV/VIS分光光度计,天平:瑞士Mettler Toledo公司XS205电子天平,针筒式微孔滤膜过滤器(水系0.8 μm)[1]。
1.2 样品
水杨酸溶出度标准片(批号100103-200610,规格300 mg),水杨酸对照品(批号:100106-200404,含量100%),水杨酸溶出度校正A样(规格300 mg),水杨酸溶出度校正B样(规格300 mg)均由中国食品药品检定研究院提供。
2 方法与结果
2.1 溶出方法
2.1.1 篮法,桨法溶剂:磷酸盐缓冲液(pH=7.4,取磷酸二氢钾6.80 g,加氢氧化钠1.58 g,先用尽量少的水溶解,加煮沸并冷却至约41℃的水稀释至1000 ml,即得),体积900 ml,温度(37.0±0.5)℃,取样时间30 min,转速100 r/min。
对照品溶液:对照品20 mg,置250 ml量瓶中,加溶出介质适量溶解并稀释至刻度,摇匀,精密量取10 ml,置50 ml量瓶中,用溶出介质稀释至刻度即得;供试品溶液:用吹风机小心除去片子表面的粉尘,选取6片称重后置于干燥转篮或
同时投入6个杯中(桨法),1片→900 ml,滤过,精密量取续滤液10 ml,置50 ml量瓶中,用溶出介质稀释至刻度,摇匀即得[2]。
2.1.2 小杯法溶剂同上,体积250 ml[3],温度(37.0±0.5)℃,转速75 r/min。
对照品溶液:配制同上。
供试品溶液:用吹风机小心除去片子表面的粉尘,选取6片称重后同时投入6个杯中,1片→250 ml,滤过,精密量取续滤液5 ml,置50 ml量瓶中,用溶出介质稀释至刻度,摇匀即得。
2.2 测定及计算方法
采用1.0 cm的吸收池,在296 nm的波长处测定吸光度[4]。
A供为供试品溶液的吸光度[5]。
F为两份对照品溶液的平均响应因子:
2.3 校正结果
市售标准片在篮法、桨法、小杯法的规定溶出度分别为25%~30%、25%~32%、18%~26%;规定RSD为<5%、<7%、<8%。
测定结果(表1)的RSD远小于规定限度值,溶出度均值也落在规定范围的中值附近,表明该仪器状态良好,能够通过市售标准片的校正实验。
2.4 样品测定
A样和B样的RSD与市售标准片相差不大,但3种溶出方法中的B样溶出度均值比A样和市售片均小2%左右(表2、表3)。
2.5 耐用性试验
2.5.1 改变转速转速均下降4%后[7],测得结果见表4、表5。
与表2、表3比较,表4、表5中,转速下降后,A样和B样的溶出度均值基本没有变化,A 样的篮法和桨法以及B样的篮法的RSD值均增大了1倍左右,而两者的小杯法的RSD值均略有下降。
2.5.2 温度的变化将水浴温度都提高0.5℃后[8],测得结果见表6、表7。
与表2、表3相比,表6、表7中,水温升高后,除B样的篮法RSD值增大了1倍左右外,A样和B样的溶出度均值及其他RSD值基本没有变化。
2.5.3 取样时间的差别取样时间均改为32 min[9],测得溶出结果见表8、表9。
与表2、表3相比,由表9、表10可知,取样时间滞后2 min,A样和B样的各种方法项下的溶出度均值均增大,其中A样的篮法增加显著,达到了3%左右;而两者的RSD值除B样桨法降低一半外,其余均无变化。
3 讨论
溶出介质虽已经过脱气处理[10],但仍会有少许气泡附着在标准片周围,通过校正试验2.3的结果可知3种溶出方法的仪器状态良好,实验人员操作得当,少许气泡的存在并不影响实验的准确度[11],实验条件满足对新水杨酸标准片的协作标定和质量评价。
样品测定过程中,B样较A样溶出度普遍偏低2%左右,这与制片的工艺有关[12];两者的校正能力强弱有待进一步比较和考察。
根据中国药典2010年二部的相关规定[13],转速的误差应在±4%;温度的误差应在±0.5℃。
因此改变溶出条件如2.5项下:当转速均下降4%以及水浴温度升高0.5℃时,A样与B样的3种溶出方法的溶出度约下降1%和上升1%左右,可忽略不计;转速下降4%后,A样的篮法和桨法以及B样的篮法的RSD值均增大了1倍左右,而小杯法的RSD值较正常情况下偏小,可见转速对新标准片的影响较大,在小杯法中转速下降掩盖了标准片之间的差异,可能会给校正带来一定的误差;水温升高后,除B样的篮法RSD值增大了1倍左右外,A样和B 样的溶出度均值及其他RSD值基本没有变化,与转速的影响相比,水温在规定范围内变化的影响不大;当取样时间滞后2 min后,A样溶出度的篮法增加3%左右,桨法增加1%左右,小杯法增加2%左右;B样溶出度的篮法增加1%左右,桨法增加2%左右,小杯法增加1%左右,由比较可知,A样较B样对取样时间的敏感度强。
4 小结
溶出度标准片由于本身的非均匀性和不稳定性,在对仪器的校正时存在一定的困难,这也是研发者一直在对标准片改进的原因所在,但就目前国内外的溶出度水平而言,用标准片对仪器进行必要的校正试验仍将是一种必不可少的实验方法,两种新标准片质量相近,均可作为标准片使用。
[参考文献]
[1] 陈颖,汤莉娜,瞿发林.不同厂家利培酮片的体外溶出度比较[J].中国药师,2012,15(5):683-685.
[2] 薛萍,颜俊,沈于兰,等.水杨酸溶出度标准片的协作标定[J].中国药师,2009,12(11):1661-1663.
[3] 霍天凤.改进阿莫西林胶囊溶出度的测定方法[J].中国当代医药,2012,19(12):36-37.
[4] 谢沐风.如何科学地、客观地制订溶出度试验质量标准[J].中国医药工业杂志,2012,43(3):A23-A32.
[5] 马粤闽,曾常青,黄春晖,等.复方氨酚那敏颗粒中对乙酰氨基酚的溶出度测定[J].中国当代医药,2013,20(29):67-70.
[6] 张余霞,符方非.小儿氨酚黄那敏片中对乙酰氨基酚溶出度方法学研究[J].
中国当代医药,2009,16(15):147-148.
[7] 郭怀忠,庞晓敏,王进文.高效液相色谱法测定维C 银翘片溶出度的研究[J].中成药,2011,33(7):1178-1182.
[8] 张雪峰,徐岳参,董赛文.高效液相色谱法测定感冒灵颗粒中对乙酰氨基酚含量[J].中国药业,2010 19 6 30-32.
[9] 欧阳吉德,王灿,胡雯婷,等.小儿氨酚黄那敏颗粒质量标准的研究[J].药物分析杂志,2009,29(8):1352-1355.
[10] 冯锁民,张湛睿,秦蓓,等.高效液相色谱法测定酚氨咖敏片的溶出度[J].药物分析杂志,2009,29(10):1723-1724.
[11] 唐燕平,李伟.草酸-S-西酞普兰片溶出度测定方法研究[J].西北药学杂志,2011,26(6):449-450.
[12] 梁韬.HPLC法测定氨酚伪麻片Ⅱ的溶出度[J].中国当代医药,2012,19(8):55-56.
[13] 国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:附录ⅩC.。
