人的外周血淋巴细胞培养
人的外周血淋巴细胞培养及染色体制片方法、染色体组型分析

人的外周血淋巴细胞培养及染色体制片方法、染色体组型分析一、实验背景1、Carnoy固定液:固定液的重要特性是能迅速穿透细胞,将其固定并维持染色体结构的完整性,还要能够增强染色体的嗜碱性,达到优良染色效果。
单纯的固定液一般难以达到这些要求,因此在实验中使用两种混合的固定液。
由于Carnoy首先使用的甲醇和冰乙酸混合液而称其为卡诺氏固定液。
Carnoy固定液(甲醇∶冰乙酸=3∶1)每次使用前需临时配制,长时间放置影响固定效果,固定时间15min至24h,冰箱、室温均可。
必要时可改变甲醇和冰乙酸的比例,冰乙酸比例增加,利于细胞膨胀、染色体铺展,但易导致细胞破裂、染色体散失。
2、低渗液(hypotonic solution)低渗液是指渗透压和离子强度均低于正常细胞生理条件的溶液,渗透压低于组织液,与外周血混在一起时,水分迅速进入细胞,使其膨胀,甚至破裂,获得分散良好的染色体分裂象。
常见的低渗液:水、低渗的柠檬酸钠或氯化钠、甘油磷酸钾(0.65mol/L)、氯化钾(0.075mol/L)等。
低渗效果取决于低渗液的化学组成、低渗的温度和处理时间。
低渗处理是凭借反渗透作用使细胞膨胀染色体铺展,同时可使黏附于染色体的核仁物质散开,以便能在一个平面上观察所有染色体形态。
实验室中一般选用0.075mol/L KCl为低渗液,其优点有:①染色体轮廓清楚,可染色性强,染色时间短。
②用于显带染色时能充分显示带型特点。
低渗处理为37℃,25~30min,以预实验条件为准。
2、肝素N-硫酸和艾杜糖醛酸含量较多的一种糖胺聚糖,由D-β-葡糖醛酸(或L-α-艾杜糖醛酸)和N-乙酰氨基葡糖形成重复二糖单位组成的多糖。
肝素是一种抗凝剂,是由二种多糖交替连接而成的多聚体,在体内外都有抗凝血作用。
2、PHA植物血凝素(Phytohaemagglutinin)是一种有丝分裂原,主要用于激活免疫细胞—淋巴细胞。
是一种干扰素诱导剂,不仅可以刺激机体产生白介素-2和干扰素;还可以刺激机体产生非特异性抗体。
人体外周血淋巴细胞培养及染色体标本制备实验报告

人体外周血淋巴细胞培养及染色体标本制备实验报告今天咱们来聊聊人体外周血淋巴细胞培养和染色体标本制备这个实验。
说实话,听到这些名词,可能不少人脑袋都开始发懵了,觉得这不就是一堆复杂的科学术语吗?别急,咱们慢慢捋,听我给你讲讲。
这可不是要你背什么枯燥的理论,而是要带你一起走进实验的世界,让你感受到那种“哦,原来是这么回事”的瞬间。
毕竟,科学嘛,有时候就像拆礼物,总有惊喜!实验的核心就是“外周血淋巴细胞培养”。
乍一听,你是不是就想,外周血、淋巴细胞,都是啥玩意儿?咱们先聊聊外周血吧,这其实就是咱们常常说的“血液”啦。
血液里有好多种细胞,其中淋巴细胞是一类非常重要的免疫细胞,它们在咱们身体里干着“保卫战”的活儿,专门用来对付入侵的细菌、病毒什么的。
简单来说,外周血淋巴细胞培养,就是从咱们的血液里把这些“小卫兵”挑出来,然后在实验室里“喂养”它们,让它们活得更好,变得更强大。
你可能好奇,咱们怎么从血液中把这些淋巴细胞分离出来呢?这个过程就像是“捞金子”。
先把血液给分离开,过滤掉那些不需要的部分,然后通过一些化学方法把淋巴细胞从里面提取出来。
想象一下,就像在沙滩上捡贝壳,虽然周围一片沙子,关键是得挑到最闪亮的那个!而这些淋巴细胞就像是你捡到的宝贝,咱们要把它们培养得越来越强,看看它们会变成什么样子。
咱们要讲到“染色体标本制备”了。
这一步可以说是实验的“高光时刻”,也是最让人兴奋的地方。
你想啊,细胞里的染色体其实就是所有遗传信息的“宝藏”,它们决定了咱们长得像谁、会不会秃头、是不是容易发胖,这些东西统统都藏在里面。
所以,看看这些染色体的“真面目”就成了实验的终极目标。
为了能看清楚它们,咱们要用一些特殊的染色技术,让染色体变得更“显眼”。
你可以想象,染色体就像一张复杂的地图,原本是密密麻麻、看不清楚的,但一旦染上颜色,它们就变得清晰可见,咱们才能一目了然地分辨出它们的结构和形态。
在这个过程中,首先咱们得让细胞分裂。
人外周血培养实验报告

1. 掌握人外周血淋巴细胞体外培养技术。
2. 学习制备染色体标本并进行核型分析。
3. 了解淋巴细胞有丝分裂过程及其影响因素。
二、实验原理淋巴细胞是免疫系统中的重要细胞,在免疫应答和维持内环境稳定中起关键作用。
在体外培养条件下,淋巴细胞受到植物血球凝集素(PHA)的刺激,可转化为淋巴母细胞,进入有丝分裂周期。
通过秋水仙素处理,使细胞分裂停滞在中期,便于染色体标本的制备和核型分析。
三、实验材料1. 实验动物:小鼠2. 试剂:PHA、秋水仙素、KCL、甲醇、冰醋酸、PRMI 1640或M199培养基、小牛血清、肝素、双抗等3. 仪器:显微镜、培养箱、吸管、培养瓶、载玻片、酒精灯、碘酒、无菌棉签等四、实验方法1. 采样:无菌条件下,取小鼠外周血0.5-1ml。
2. 培养液配制:无菌条件下,按照比例配制PRMI 1640或M199培养基、小牛血清、PHA、肝素、双抗等。
3. 细胞培养:将外周血加入培养瓶中,每瓶加20滴左右,轻摇均匀。
将培养瓶置于36℃培养箱中培养72小时,每隔12小时轻摇1次。
4. 秋水仙素处理:在培养72小时后,加入适量秋水仙素,使细胞分裂停滞在中期。
5. 细胞收获:收获细胞,进行低渗处理,使细胞膜破裂,染色体释放。
6. 固定:将低渗处理后的细胞加入甲醇和冰醋酸的混合液中固定。
7. 染色:将固定后的细胞涂片,进行染色。
8. 显微镜观察:在显微镜下观察染色体形态,进行核型分析。
1. 细胞培养:在培养过程中,细胞逐渐增多,形成细胞群体。
2. 秋水仙素处理:细胞分裂停滞在中期,染色体形态清晰。
3. 显微镜观察:观察到人类染色体,男性为46,XY;女性为46,XX。
六、实验讨论1. 外周血淋巴细胞培养的成功与否,取决于培养液的成分和培养条件。
本实验采用PRMI 1640或M199培养基,并加入适量小牛血清、PHA、肝素、双抗等,保证了细胞的正常生长。
2. 秋水仙素处理是本实验的关键步骤。
适量的秋水仙素可以使细胞分裂停滞在中期,便于染色体标本的制备和核型分析。
hpbmc淋巴细胞的培养方法

hpbmc淋巴细胞的培养方法HPBMC(Human Peripheral Blood Mononuclear Cells)是指人外周血单个核细胞,其中包括淋巴细胞、单核细胞和浆细胞。
淋巴细胞是一类重要的免疫细胞,对于免疫系统的功能发挥起着至关重要的作用。
因此,淋巴细胞的培养方法对于研究免疫系统的功能和机制至关重要。
本文将介绍HPBMC淋巴细胞的培养方法。
为了获得HPBMC,我们需要采集新鲜的外周血样本。
在采集外周血样本时,需要使用消毒的器具,避免污染。
一般来说,我们可以选择采用静脉采血的方式,将外周血收集到抗凝剂处理的试管中。
接下来,我们需要将外周血样本进行分离,获取到其中的HPBMC。
常用的分离方法有密度梯度离心法和负选择法。
密度梯度离心法是将外周血样本加入到含有密度梯度溶液的离心管中,经过离心后,不同细胞类型会分布在不同的密度层中,从而实现淋巴细胞的分离。
负选择法是使用磁珠或抗体等对非淋巴细胞进行标记,通过磁力或柱子的作用,将非淋巴细胞分离出去,从而获得HPBMC。
获得HPBMC后,我们需要对其进行培养。
首先,我们需要选择合适的培养基。
常用的培养基包括RPMI-1640培养基、DMEM培养基等。
在培养基中,我们需要添加适当浓度的血清、抗生素和其他生长因子等,以提供细胞所需的营养物质和环境。
接下来,我们将HPBMC加入到培养基中,并将其转移到培养皿中。
在培养过程中,我们需要控制培养皿中的温度、湿度和CO2浓度等环境因素。
一般来说,培养温度为37摄氏度,湿度为95%,CO2浓度为5%。
在培养过程中,我们需要定期更换培养基,以保证细胞的生长和增殖。
通常情况下,每隔2-3天更换一次培养基。
此外,我们还可以根据实验需要添加不同的刺激物,如抗原、细胞因子等,以模拟特定的免疫反应。
在培养的过程中,我们可以通过显微镜观察细胞的形态和增殖情况。
如果需要进一步分析细胞的免疫功能,我们可以使用流式细胞术、ELISA等技术进行检测。
遗传实验05:人外周血培养与染

3、离心前配平,离心速度过高,细胞团不易打散; 反之,细胞易丢失。
4、固定液应在使用前临时配制。
5、载玻片一定要洁净,否则染色体分散不好。
六、实验结果与分析:
染色体核型分析:人类每个体细胞有 46条染色体,22对常染色体和一对性染色 体,男性为46,XY;女性为46,XX。
人类染色体分组
A组(No.1~ 3):是最大的一组染色体,它们的 着丝粒在中部或几乎在中部,为中部着丝粒染色 体;
B组(N0.4~5):为两对大的亚中部着丝粒染色 体,它们有明显的长臂和短臂;
C组(N0.6~12+X):为中等大小的亚中部着丝 粒染色体,它们大小相差不多,X染色体大小介 于期间,一般难以区分;
G组(N0.21~22+Y):为最小的一组近端着丝粒 染色体,在N0.21~22的短臂上可见随体。Y染 色体常呈现异固缩状态,着色更深,可以识别。
人类染色体核型分析结果
重要参数: (1)染色体的相对长度 (2)臂比率 (3)着丝点指数
七、作业及思考题:
1、将分散良好的标本进行显微照相; 2、观察人类染色体的形态、结构特点; 3、对比男性和女性的染色体标本,比较异同; 4、总结做好本实验的关键因素。
每个培养瓶接25-28滴(约0.5ml),轻轻摇匀后 将培养瓶放在37℃温箱中培养72小时。培养过程 中,每天应轻轻摇动两次培养瓶。
3、秋水仙素处理:在终止培养前3-4小时,向培养 瓶中加 20µ g/ml的秋水仙素20µ l,轻轻温箱中取出培养瓶,用吸管将培养液转 入10ml的刻度离心管内。2000转/分,离心10分钟。
人体外周血淋巴细胞培养及染色体制片实验原理

实验原理人体的1ml 外周血中一般含有约1-3×106个小淋巴细胞,通常它们都处于间期的GO和G1期。
在培养条件下给予药物刺激时,经过53-72小时可在培养物中获得大量的有丝分裂细胞,供染色体标本制备和分析之用。
这种外周血培养方法是在1960年由Moorhead等所建立的。
人体外周血的形成包括红细胞、白细胞、血小板,其中红细胞和血小板不能离体培养。
血细胞中的小淋巴细胞处于间期的GO和G1期。
在培养时给予药物刺激,可转变为淋巴细胞,随后进行有丝分裂。
这样经过66-72小时短期培养、秋水仙素处理,低渗和固定,就可获得大量有丝分裂的细胞。
这种微量全血培养技术已得到了广泛的应用。
1912年,Warfter 最先研究人类染色体。
1923年,报道人类染色体的二倍体为48条。
细胞遗传学、组织培养技术为人类染色体的研究提供了条件。
技术突破主要在于:(1)人体外周血淋巴细胞培养和PHA的应用:PHA 是从菜豆种子中提取出来的,大量的PHA具有凝血作用。
如果适合,可刺激细胞转为母细胞,从而进行有丝分裂。
(2)秋水仙素的应用:秋水仙素可阻断纺缍体截止于中期,使染色体个体大,结构清晰,缩短适度,细胞质粘度降低。
(3)低渗处理(水或0.075mlKcl)使红细胞胀破,白细胞胀大,染色体空间变大,易伸展,便于观察。
1956年,J.H.Tjio A.Levan 培养人胚胎组织细胞,计数人体细胞染色体数为46条。
1960年,Moorhead建立人体外周血培养技术,使染色体的研究跃进一步。
1968年,T.U. Casperssan 提出染色体显带技术。
实验试剂RPMI1640培养基,植物血凝素(PHA),小牛血清,肝素,双抗,秋水仙素,低渗液:0.075Mol/L Kcl,卡诺氏固定液,Giemsa染色液,0.1Mol/L 磷酸缓冲液(pH7.4-7.6)等。
磷酸缓冲液的配制0.1Mol/L 磷酸缓冲液(pH7.4-7.6):A:Na2HPO4•12H2O 28.8克B:Na2HPO4•7H2O 2.164克KH2PO4 2.67克NaH2PO4•2H2O 0.3克溶解于1000 ml双蒸水中溶解于1000 ml双蒸水中实验设备2ml灭菌注射器,离心机,电子天平,恒温培养箱,除菌滤器,显微镜,酒精灯,载玻片等。
人外周血淋巴细胞培养

通过人外周血淋巴细胞培养,可以研究疾病的预 防策略,如利用疫苗进行预防接种等。3Fra bibliotek个体化医疗
利用人外周血淋巴细胞培养,可以开展个体化医 疗研究,根据患者的免疫状况制定个性化的治疗 方案。
05
结论
研究成果总结
01
成功建立了人外周血淋巴细胞的培养方法,并观察到了淋巴细胞的生 长和增殖过程。
02
细胞活性检测
使用台盼蓝染色等方法检测细胞的活性。
培养基检测
定期检测培养基的pH值和营养物质浓度, 确保培养条件适宜。
04
人外周血淋巴细胞培养的 应用和前景
在免疫学研究中的应用
免疫应答机制研究
通过人外周血淋巴细胞培养,可以深入了解免疫应答的机 制,包括抗原识别、信号转导、细胞活化等过程。
免疫细胞功能分析
淋巴细胞分为T细胞、B细胞和NK细胞等多种类型,每种细胞类型具有不同的功能和 特点。
淋巴细胞在人体健康和疾病发生中起着至关重要的作用,因此研究淋巴细胞对于了 解疾病机制和开发治疗手段具有重要意义。
淋巴细胞培养技术
淋巴细胞分离技术
淋巴细胞功能检测方法
通过密度梯度离心法和免疫磁珠分离 法等手段从外周血中分离出淋巴细胞。
疫苗免疫原性研究
通过培养的人外周血淋巴细胞,可以研究疫苗对免疫系统的刺激作 用,评估疫苗的免疫原性。
疫苗效果评估
利用人外周血淋巴细胞培养,可以对疫苗进行效果评估,包括疫苗 的保护率、免疫持久性以及对不同人群的适应性等。
在疾病治疗和预防中的应用前景
1 2
疾病治疗
利用人外周血淋巴细胞培养,可以为某些疾病的 治疗提供支持,如肿瘤免疫治疗、自身免疫性疾 病治疗等。
研究意义
人体外周血淋巴细胞染色体制备与观察实验方案 (1)

人体外周血淋巴细胞培养及染色体组型分析实验方案2012级师范2班第3组组员:吴婵胡颖月央珍杨基伟杨青松宋海燕田金梅(组长)一、实验目的掌握人体外周血淋巴细胞培养与染色体组型分析的方法。
二、实验原理人的1ml外周血约含有1×10*6~3×10*6个小淋巴细胞,它们几乎都处于G0或G1期,一般情况下不分裂,但但采用人工离体培养的方法,经PHA(植物血球凝集素)刺激后,能转变成可分裂的淋巴母细胞进行有丝分裂。
所谓外周血培养即是将外周血接种在适当的培养物中加入适量的秋水仙素,使纺锤体微管解聚,这样细胞停留在中期,可以获得大量的分裂细胞。
用低渗盐溶液(一般是0.075mol/L的KCl)处理,使其中的红细胞及分裂相细胞膜和一部分细胞质除去然后用Carnoy固定液固定,最后以气干法制片,可获得较好的染色体标本。
核型(karyotype)指一个细胞中的整套染色体,按其大小、形态特征顺序排列所构成的图像。
通常是将显微摄影得到的染色体照片剪贴而成。
在完全正常的情况下,一个体细胞的核型一般可代表该个体的核型。
组型(idiogram)是以模式图的方式表示,它是通过许多细胞染色体的测量取其平均值绘制成的,是理想的,模式化的染色体组成,代表一物种染色体组型的特征。
将待测细胞的核型进行染色体数目、形态特性的分析,确定其是否与正常核型完全一致,称为核型分析(karyotype analysis)。
这对于探索人类遗传病的发病机理,探讨动物和植物的起源,以及物种间的亲缘关系等都具有重要意义。
染色体的特征以有丝分裂中期最为显著,所以一般都分析中期分裂相。
根据染色体着丝粒位置可将染色体分为中部着丝粒染色体(m),亚中部着丝粒染色体(sm),亚端部着丝力粒染色体(st),端部着丝力粒染色体(t)。
对于任何一个的基本形态特征来说,重要的参数有以下3个:(1)相对长度=单条染色体的长度/(单倍体常染色体+X或Y染色体)的总长度×100%(2)臂指数=长臂/短臂(反映着丝粒位置的指数)(3)着丝粒指数=短臂/整个染色体长度×100%(反映着丝粒位置的指数)人类体细胞的正常核型是含有23对染色体,共46条。
外周血淋巴细胞培养和染色体标本制备

乙液:一水磷酸二氢钠,1/15M溶液含9.2g/L 甲液:二水磷酸氢二钠,1/15M溶液含 11.864g/L 根据要求的PH值,取X毫升甲液与Y毫升乙液, 混合均匀即得.
实验步骤
•
1培养液的分装:在无菌室或接种罩内,用移液管将培养液和其它各 试剂剂分装入玻瓶,每瓶量为 :
•
•
完全培养基3ml
PHA 20ul
外周血淋巴细胞培养和染色体 标本制备,染色体组型分析
实验目的
•
1、了解动物细胞培养的方法。掌握人体外周血淋巴细胞培养与 染色体标本制备。 2、熟悉人类染色体的镜下检查和核型分析方法。
•
实验原理
•
人体外周血的形成包括红细胞、白细胞、血小板,其中红细胞 和血小板不能离体培养。每1ml 外周血中一般含有约1~3×106 个小淋巴细胞, 几乎都处于G1期或G0期的非增殖状态 ,一般情 况下是不再分裂的。但当在培养液中加入植物凝血素(PHA)后, 淋巴细胞受刺激便转化为淋巴母细胞,重新进入增殖周期,进行 有丝分裂。经过66~72小时(三个周期)的短期培养,秋水仙素的 处理,低渗和固定,就可获得大量的有丝分裂相细胞,从而进行 染色体标本制备和核型分析。
•
9制片:留固定液 0.5毫升, 用滴管小心冲打成悬液。 从冰箱的冰格中或冰水 中取 出载玻片,每片滴加悬液 1~3滴,吹散,在酒精灯火焰上过火。室温过夜。
11染色:用磷酸缓冲液(PH7.4)稀释后的姬姆萨染色液染色 20分钟,然后倒 去染液,用蒸馏水轻 轻冲洗 . 12镜检:待稍干后,在显微镜下观察,先用低倍镜寻找良好的分裂相,然后再用高 倍油 镜观察。
人染色体组型及其特征
实验材料
• •
1.1试验材料:人外周血淋巴细胞 1.2试验用具:离心管、吸管,量筒、 载玻片,常规清洗烘干,培 养瓶、、1ml/5ml移液枪,灭菌处理, 天平、离心机、恒温培养 箱、显微镜、普通冰箱,酒精灯。 1.3试剂药品 完全培养基 凝血素(PHA ) 5mg/ml
实验1人类外周血淋巴细胞培养及染色体标本制备

实验一人类外周血淋巴细胞培养及染色体标本制备【实验目的】(1)了解人类外周血淋巴细胞培养技术。
(2)初步掌握人类外周血淋巴细胞染色体标本的制备技术。
【实验原理】在健康成年人外周血淋巴细胞中,以小淋巴细胞为主。
在通常情况下,它们都处在间期的G1期或G0期,一般情况下不进行分裂。
但在体外适宜培养条件下,它们经有丝分裂原如植物血球凝集素(Phytohemagglutinin,简称PHA)的作用可发生转化而重新进行有丝分裂活动。
因此,当该类细胞在人体外经PHA 刺激短期培养后,经秋水仙素(colchicine)处理使正在分裂的细胞停止在中期,再经低渗和固定等处理,即可得到较多可供分析的中期染色体标本。
【材料】人外周血【器材与试剂】1、主要器材超净工作台,光学显微镜、恒温培养箱、水平式离心机、高压蒸汽消毒锅、水浴箱、冰箱、离心管、滴管、试管架、酒精灯、载玻片等。
2.主要试剂RPMI-1640培养基、小牛血清、PHA(浓度5mg/ml)、秋水仙素(浓度4ug/ ml), 肝素(配制浓度:0. 4%)、固定液(甲醇与冰醋酸按3: 1配制) 、低渗液(0.075 mol/L 氯化钾) Giemsa染液(浓度5%)。
【实验步骤】1.取材与细胞培养在无菌条件下抽取静脉血0.5 ml,立即接种于盛有5 ml RPMI-1640培养液的培养瓶中,加入5mg/ml PHA 20-40ul,轻轻将其摇匀后放在37℃恒温培养箱中。
2、培养至68 -70h。
然后加人秋水仙素0.05 ml,继续培养2-4h,即可获得细胞。
3.染色体标本制备(1)将培养物吸入离心管内,以1500-2 000 r/min离心5-10 min,用吸管小心吸弃上清液。
(2)将预温至37℃的低渗液7-8 ml加入离心管中,用吸管混匀后放人37℃水浴箱中低渗处理10-20 min 。
中途混匀一次。
(3)取出离心管,加入1 ml固定液,缓慢混匀,立即离心5-10 min(15 00-2 000 r/min)。
人类外周血淋巴细胞的培养及染色体标本制备

细胞与遗传学教研室
一、实验目的 1.掌握人类染色体标本的制作方法 2.了解人类染色体形态结构特征
24hrs 时加 入 BrdU
68 hrs 时加 入秋水仙素
人类外周血
植物血球凝集素 ( PHA) 肝素、培养基、小牛血清
体外培养
72 hrs 后 收集细胞
制作玻片标本
固定
预固定 紫外线照射
四、实验方法
1.外周血细胞培养
(1)采血:无菌,肝素抗凝。 用无菌注射器抽取肝素0.2ml,润湿针筒,推出多 余肝素.消毒后,抽取受试者静脉血2ml。) (2)接种培养:每培养瓶加入0.3~0.5ml(10滴), 接种于装有5ml培养基的培养瓶中,摇匀, 37℃培 养箱中培养68小时。 (20滴) • • (3)秋水仙素处理:0.05~0.4μ g∕ml培养基,轻 摇混匀后,继续培养至72小时 。
人类外周血体外培养收集细胞制作玻片标本固定预固定低渗处理植物血球凝集素pha肝素培养基小牛血清72hrs68hrs入秋水仙素24hrs入brdu紫外线照射giesma染色处理荧光染料染色染色体带的制作方法giesma染色外周血外周血中的淋巴细胞几乎都是处在中的淋巴细胞几乎都是处在gg00期或gg11期期一般情况下是一般情况下是不分裂不分裂的
外周血淋巴细胞
PHA 37℃ 68h
G0期或G1期
秋水仙素 至72 h
三、实验用品
• 1.材料:人体外周血 • 2.器材:培养箱、培养瓶、离心机、刻度离心管、吸 管、恒温水浴锅等 • 3.试剂:培养基、秋水仙素(12.5μ g∕ml)、植物凝 集素(PHA)、肝素、0.075Mkcl低渗液、甲醇、冰乙 酸、PH6.8磷酸缓冲液、Giemsa原液。
人外周血淋巴细胞染色体标本制作
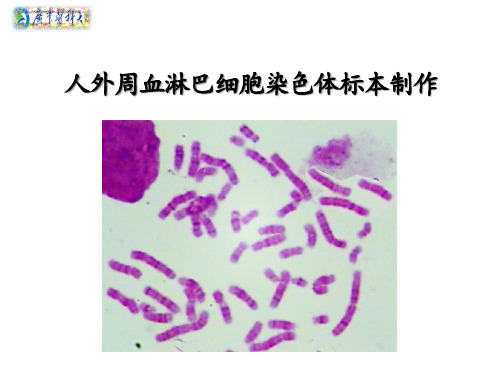
人外周血淋巴细胞染色体标本制作
[目的与要求] 1、掌握外周细胞培养物收获方法; 2、掌握外周血细胞染色体标本制备; 3、熟悉相关试剂的配制。
人外周血淋巴细胞染色体标本制作
[原理]经低渗处理,细胞膨胀,然后用 固定液使细胞膜蛋白变性,保持细胞处于 膨胀状态;调节上述收获细胞的浓ቤተ መጻሕፍቲ ባይዱ,制 成细胞悬液,滴片,即可得到有丝分裂中 期的染色体标本。
人外周血淋巴细胞染色体标本制作
[收获] 1、离心
将培养物转入刻度离心管内,以1500r/min 离心10min,弃上清液,留下沉淀物。
2、低渗 在离心管中加入预温至37℃的低渗液
(0.075 mol/L KCl)8ml,用吸管轻轻吹打混 匀细胞,置入37℃水浴箱中低渗30min。
人外周血淋巴细胞染色体标本制作
[收获] 3、预固定
低渗处理后,在离心管中加入固定液[甲醇 : 冰 乙酸=3:1,新配备]2ml或至10ml刻度,混匀。以 1500r/min离心10min,弃上清液,留下约0.5ml液体 盖着沉淀物,轻柔重悬细胞。
4、第1次固定 预固定后,往离心管加入新鲜因定液至10ml刻度,
充分混匀细胞,在室温中固定30min。以1500r/min离 心10min,弃上清液,留下沉淀。
[培养] 培养72h,并每天将培养瓶振荡1~2次,在终止
培养前2h~4h,在培养物中加入秋水仙素(10mg/L) 0.2ml,混匀,继续培养到收获。
染色体标本制作准备--载玻片清洁
[载玻片清洁]
1、用过饱和洗衣粉溶液浸泡载玻片1h以上; 2、用自来水彻底冲洗干净载玻片上的洗衣粉成分; 3、将干净的载玻片置于长方形浅缸,蒸馏水冲洗3 次后,用蒸馏水浸泡置于冰箱冷冻待用。
人的外周血淋巴细胞培养及染色体制作技术

54生物学通报2011年第46卷第3期人体外周血淋巴细胞培养和染色体标本的制备是遗传学和细胞生物学实验教学中的重要实验项目。
染色体是遗传物质的载体,携带着丰富的遗传信息。
只有获得较好的染色体标本才能进行核型分析,进一步深入地研究染色体的形态、变异和畸变及其与表型或症状之间的关系。
人外周血液中的小淋巴细胞几乎都处在G0期或G1期,一般情况下是不分裂的。
在人工离体培养的条件下,在培养液中加入植物血细胞凝素(PHA),则能刺激小淋巴细胞转化为淋巴母细胞而进行有丝分裂。
这样经过短期培养,秋水仙素的处理,低渗和固定,就可获得大量的有丝分裂细胞,经空气干燥法制片,便可获得质量较好的染色体标本。
由于本实验操作过程较繁琐,且实验过程中许多步骤对于实验结果都非常重要,比如PHA效价、外周血接种量、培养温度及酸碱度、秋水仙素加入时间及浓度、低渗时间、固定次数及时间等,所以学生在实验过程中很难全面掌握每个环节,因此,对于学生实验来说实验的成功率也较低。
作者在本实验室现有的条件下,经过长期摸索,总结出了完整且成熟的人外周血淋巴细胞培养及染色体标本制备的实验方法,现将具体方法介绍如下:1材料和方法1.1材料RPMI1640培养基[1]人静脉血:由阜阳师范学院生命科学学院生物科学专业07级学生提供。
1.2方法1)采血。
用一次性2mL注射器抽取肝素稀释液0.2mL,湿润针管,然后将多余的肝素排除。
以75%酒精清洗并消毒供血者肘部皮肤,用橡皮管结扎静脉回流的上端,用注射器抽取静脉血0.5~2mL,然后转动针管,使血液和肝素混合。
2)接种和培养。
先用酒精消毒培养瓶的翻口瓶塞,然后插入针头,将抽得的抗凝血迅速接种到5mL含适量PHA(约0.2mL)及小牛血清的培养瓶中,每瓶接种全血0.4mL左右(6号针头15~20滴),接种过后再次用酒精消毒瓶塞,并在外面用Parafilm封口膜密封好,轻轻摇匀,置37℃培养箱中培养66~72h。
5blood实验5 人外周血淋巴细胞培养及染色体核型分析

实验5 人外周血淋巴细胞培养及染色体核型分析5.1 相关基础知识人外周血液中的小淋巴细胞,几乎都处在G1期(G0期),一般情况下是不再分裂的。
在培养液中加入植物凝血素(PAH)时,小淋巴细胞受刺激转化为淋巴母细胞,随后进入有丝分裂。
这样经过短期培养、秋水仙素的处理、低渗和固定,就可获得大量的有丝分裂细胞。
目前本方法已为临床医学、病毒学、药理学、遗传毒理学等领域广泛采用。
人类每个体细胞有46条染色体,22对常染色体和一对性染色体,男子是46,XY;女子是46,XX。
根据各组染色体的特征予以分组:A组:(N01~03)是最大的一组染色体,它们的着丝粒在中部或几乎在中部;B组(N04~05)为两对大的亚中着丝粒染色体,它们有显的长臂和短臂;C组(N06~12+X)为中等大小的亚中着丝粒染色体,它们大小相差不多,X染色体大小介于期间,一般难以区分;D组(N013~15)为中等大小的端着丝粒染色体,它们的一个重要形态特征是随体,随体是一对着色很深的小球,处于短臂的末断,随体与短臂之间的区域很少着色;E组(N016~18)包括一对中着丝粒染色体,亚中着丝粒染色体和一对近端着丝粒染色体;F组(N019~20)为两对小的中着丝粒;G组(N021~22+Y)为最小的一组端着丝粒染色体,在N021~22的短臂上可见随体,Y常呈现异固缩状态,着色更深,可以识别。
5.2 实验目的和要求(1)掌握人体微量血液体外培养技术和制备染色体标本的方法;(2)观察人类染色体的形态,并计数、配对、分类和绘图。
5.3 实验材料和仪器5.3.1 实验材料和试剂(1)人的外周血淋巴细胞;(2)Giemsa母液:量取33ml甘油,先在研钵内加入少量甘油与0.5g Giemsa粉混合,研磨至无颗粒为止,再将剩余甘油倒入,搅拌后于56o C水浴保温2小时,再加入33ml甲醇,搅拌均匀后储存于棕色瓶中;(3)Giemsa染色液:将Giemsa母液用0.1M pH7.4磷酸缓冲液稀释至10倍。
人的外周血淋巴细胞培养

人的外周血淋巴细胞培养摘要淋巴细胞是免疫系统中最重要的细胞,在免疫中起关键作用,维持内环境的稳定。
对人的外周血淋巴细胞进行染色体核型分析对人类遗传研究及临床应用有重大意义。
每一物种都有一定数目及一定形态结构的染色体,可在显微镜下观察到。
本次实验的目的就是掌握人体微量血液体外培养制备染色体标本的方法并学习对人的外周血淋巴细胞进行核型分析。
每1ml 外周血中一般含有约1~3×106个小淋巴细胞,几乎都处于G1期或G0期的非增殖状态,一般情况下是不再分裂的。
但当在培养液中加入植物凝血素(PHA)后,淋巴细胞受刺激便转化为淋巴母细胞,重新进入增殖周期,进行有丝分裂。
经过66~72小时(三个周期)的短期培养,秋水仙素的处理,低渗和固定,就可获得大量的有丝分裂相细胞,从而进行染色体标本制备和核型分析。
这种微量全血培养技术已在临床医学、病毒学、药理学、遗传毒理学等方面得到了广泛应用。
本实验采取了人类的外周血进行实验,经各种技术处理后最后得到较为清晰的人体染色体照片。
通过实验发现:人类每个体细胞有46条染色体,22对常染色体和一对性染色体,男性是46,XY;女性是46,XX。
根据染色体的形态、大小、及着丝粒的位置,将人的外周淋巴细胞的46条染色体分为A、B、C、D、E、F、G7组共23种类型。
关键词人的外周血淋巴细胞染色体低渗溶液核型分析秋水仙素动物细胞体外培养Human Peripheral Blood Lymphocyte CultureAbstract: Lymphocytes are among the most important immune system cells in the immune plays a key role in together, in order to maintain a stable environment. To analyze chromosome of lymphocytes is very important. Various biological chromosome number and shape are constant,can be seen under a microscope. The purpose of this experiment is human body trace blood samples were cultured in vitro chromosome preparation methods and studying on the peripheral blood lymphocyte karyotype analysis on.In human body's 1ml circumference blood includes approximately 1~3×106 the small lymphocyte generally, usually they are between time G0 and the G1 time, generally is not divided. But when adding plant in medium coagulopathy (PHA), lymphocyte transformation and stimulated for lymphatic mother cell proliferation capacity, make its recovery, then entering mitosis. After 66~72 hours(three cycles) short-term training, autumn grain processing, daffodil, low permeability and fixed can be gained lots of mitotic cells, for makes the chromosome specimen preparation and analysis. This kind of micro wholeblood culture technique in aspects and so on clinical medicine, virology, Pharmacology, heredity toxicology obtained widespread application.The experimental taken to conduct experiments on human peripheral blood, the various technical ultimately be treated more clear picture of human chromosomes. Through the experiments have found that each human somatic chromosome, 22 to 46 euchromosome sex chromosomes, and a pair of 46 XY; male is, Women are 46, XX. This method has been clinical medicine and virology, pharmacology, genetic toxicology etc widely. According to the chromosomes of the shape, size, and the centromere position, the peripheral lymphocytes 46 chromosomes into A, B, C, D, E, F, the G7 group of 23 types.Key words: Human blood lymphocytes Chromosome Low permeability solutionKaryotype analysis Autumn daffodils element zooblast in vitro raise offcenter前言细胞培养技术是目前生命科学研究领域的一项常用而重要的技术,它涉及的技术有:无菌操作技术、细胞分离技术、细胞培养技术、显微摄影技术、图像分析技术等。
人的外周血淋巴细胞培养

人的外周血淋巴细胞培养摘要:在正常情况下,人外周血淋巴细胞是没有分裂相的,只有在异常情况下才能发现。
植物血球凝集素(PHA)是人类淋巴细胞有丝分裂的刺激剂,在PHA作用下,源出于G0期的淋巴细胞转化为淋巴母细胞,进而进行有丝分裂。
利用PHA的这一特性,淋巴细胞经过含有PHA培养液培养,在体外便可获得丰富的含有丝分裂的生长活跃的细胞群体,终止分裂中期的淋巴细胞便可得到所需要的人体染色体图形。
本实验具有用血量少,操作简单等优点[1]。
关键词:外周血淋巴细胞染色体秋水仙素双抗前言:通过本实验掌握人体外周血离体培养制备染色体标本的方法。
人外周血中的小淋巴细胞几乎都在G1期或G0期,一般情况下是不分裂的。
当在离体培养条件下加入植物凝血素(PHA),小淋巴细胞受刺激转化为淋巴母细胞,随后进入有丝分裂。
经过短期培养,秋水仙素的处理,低渗和固定,就可获得大量的有丝分裂细胞。
细胞遗传学组织培养技术为人类染色体的研究提供了条件。
技术突破主要在于:(1)人体外周血淋巴细胞培养和PHA的应用。
PHA 是从菜豆种子中提取出来的,大量的PHA具有凝血作用。
如果适合,可刺激细胞转为母细胞,从而进行有丝分裂。
(2)秋水仙素的应用。
秋水仙素可阻断纺缍体截止于中期,使染色体个体大,结构清晰,缩短适度,细胞质粘度降低。
(3)低渗处理(水或0.075mlKcl)使红细胞胀破,白细胞胀大,染色体空间变大,易伸展,便于观察[2]。
1设备和药品1.1设备低温冷冻离心机;离心管;精密pH试纸;恒温培养箱;恒温水浴锅;棉花;毛细管;玻璃棒;烧杯;载玻片;培养瓶;采血针;冰柜1.2药品RPMI“1640”粉末;NaHCO3粉末;肝素;秋水仙素;植物凝血素(PHA);青霉素;链霉素;姬姆萨粉末;0.1mol/L磷酸缓冲液;生理盐水;KCl低渗液;蒸馏水;纯甘油;甲醇;酒精2方法2.1药品制备2.1.1 RPMI“1640”培养基:是一种综合培养基,称取“1640”粉末1.05g,用100mL的蒸馏水溶解,如溶液出现浑浊或难以溶解时,可用干冰或CO2处理,如pH值降至6.0时,则可溶解而透明。
人外周血淋巴细胞体外扩增培养后细胞表型变化及生物学活性的研究的开题报告

人外周血淋巴细胞体外扩增培养后细胞表型变化及生物学活性的研究的开题报告一、选题背景和意义人外周血淋巴细胞是人体免疫系统的主要组成部分,它们在身体抵御病原微生物、肿瘤细胞以及其他异物侵袭方面扮演着关键的角色。
在临床治疗中,利用患者自身的免疫系统对抗肿瘤、感染等疾病已成为一种热门的治疗方式。
而淋巴细胞体外扩增培养技术作为一种重要的免疫治疗手段,已经在多个疾病治疗方面得到了应用和发展。
虽然淋巴细胞体外扩增培养技术已经得到广泛应用,但是目前对于扩增培养后淋巴细胞的表型变化和生物学活性研究还相对不足。
本研究旨在通过体外扩增培养人外周血淋巴细胞,从表型和生物学活性两个方面,对其进行详细的研究,为临床治疗提供科学依据和指导。
二、研究内容和主要技术路线1. 研究内容(1)体外扩增培养人外周血淋巴细胞,观察其数量和比例的变化。
(2)通过流式细胞术检测培养后淋巴细胞的表型变化,包括细胞表面标志物和功能分子的表达情况等。
(3)评估扩增后淋巴细胞的生物学活性,包括细胞的增殖能力、细胞因子的分泌水平等。
2. 技术路线(1)利用Ficoll法从人外周血中分离出淋巴细胞。
(2)利用无血清培养基添加激活剂的方法体外扩增培养淋巴细胞。
(3)利用流式细胞术对扩增后淋巴细胞的表型进行分析。
(4)利用MTT法、ELISA法、Western blot等技术对扩增后淋巴细胞的生物学活性进行分析。
三、研究的预期结果和意义通过对体外扩增培养人外周血淋巴细胞的表型和生物学活性的研究,本研究将能够为淋巴细胞体外扩增培养技术的应用提供科学依据和指导。
本研究结果将可以精确预测淋巴细胞在体外培养过程中不同环节的变化,优化淋巴细胞的体外扩增培养条件,提高治疗效果。
同时,本研究也将为深入了解淋巴细胞的生物学功能、免疫学机制以及人类疾病的发生和发展提供基础数据和新思路。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人的外周血淋巴细胞培养摘要:正常情况下哺乳动物的外周血中没有分裂相,这是由于外周血中的小淋巴细胞大多处于G0期。
但在一定条件下,外周血中的小淋巴细胞受刺激转化成淋巴母细胞,随后进入有丝分裂。
本实验介绍人外周血淋巴细胞的培养方法,染色体标本的制备和正常人染色体的组型分析。
[1]关键词:外周血淋巴细胞低渗处理空气干燥法染色体组型分析前言:人体外周血细胞培养是制备染色体标本的常用方法。
此方法取材方便,用血量少,操作简便。
1960年Nowell和Morhead验证,使红细胞凝集从而能分离出白细胞的植物凝集素(phytohaemagglutinin,PHA)是人和其他动物淋巴细胞的有丝分裂的刺激剂。
在PHA的作用下,原来处于G0期的淋巴细胞转换为淋巴母细胞,进而进行有丝分裂。
这样经过短期培养,以秋水仙素或其衍生物秋水仙胺进行处理,经过低渗和固定,就可获得大量的处于有丝分裂时期的细胞[2],因为秋水仙素(或秋水酰胺)可通过干扰微管组装而抑制纺锤丝形成,使细胞分裂顺利进入后期而停滞于中期,从而可在短期内积累大量最适于进行染色体分中期分裂相。
此外,秋水仙素还能使染色单体缩短、分开,使染色体呈现明显形而利于辨认。
淋巴细胞经过培养以后,形成了体外活跃生长的细胞群体,经过空气干燥法制片。
所谓空气干燥法,实际上是将细胞经过秋水仙素—低渗处理—充分的固定—滴片等步骤之后再载玻片上得到染色体制片的技术。
有时,有人把滴片的步骤叫做染色体分散,也有人把这一步和随后的干燥称为空气干燥法。
“空气干燥”就是滴片后,不加热或任何处理,使载玻片在室温中自然干燥的方法。
[3]淋巴细胞的培养已成为制备染色体的最主要的方法。
因为该法材料便宜易得,对同一个体可进行连续观察,并可得到优良的染色体制片。
各种因素的作用效应(如病毒、电离辐射、化学试剂等)可在淋巴细胞的培养条件下进行观察,从而可进行多种在体内无法进行的研究。
本方法已在临床医学、病毒学、药理学、遗传毒理学等方面广泛应用。
[2]染色体标本制备过程中有两个重要环节,其原理是:(1)低渗处理:目的是使水分通过细胞膜向细胞内渗入,导致转化的淋巴细胞,染色体进一步分散而利于分析。
同时,低渗处理还可使红细胞质膜破裂,经后血影浮于上清中被去除,后续的固定过程主要针对淋巴细胞,改善了淋巴细胞的固定质量及标本质量。
(2)固定:目的在于尽快使细胞的结构固定于接近存活的状态,以便作进一步处理,若不固定则可因细胞内蛋白质分解而导致结构变化。
染色体研究中常用固定液为甲醇一冰醋酸(3:1)固定液。
冰醋酸渗透力强,固定迅速,但易使组织膨胀而甲醇则可使组织收缩,两者混合使用能抵消各自的缺点,得到较好的固定效果。
1.材料方法1.1 材料人的外周血淋巴细胞。
1.2 器具采血针、20mL培养瓶、毛细管、离心管、载玻片和盖玻片、显微镜、恒温箱、离心机、电子天平、分析天平、精密PH试纸、移液管、烧杯、酒精灯、移液枪1.3 药品1.3.1 RPMI“1640”培养基称取“1640”粉末1.05 g,用100 mL的双蒸水溶解,溶解后pH 值调至 6.0。
每1000 毫升溶液加NaHCO31.0克,校正PH到7.1。
1.3. 2 肝素作为抗凝剂使用。
称取该粉末8 mg(每mg含126 单位),用2 mL的生理盐水溶解,此溶液的浓度为504 单位/mL。
1.3.3 生理盐水用0.9克NaCL加入100mL蒸馏水中,配制溶液。
1.3.4 秋水仙素作为有丝分裂的阻止剂,它能改变细胞质的粘度,抑制细胞分裂时纺锤体形成,使细胞分裂停留在中期。
称取秋水仙素1mg,用25mL生理盐水溶解,然后放入冰箱4℃保存。
使用时用1mL注射器吸取该溶液0.1mL加入5mL的培养物中,其最终浓度为0.8微克/毫升。
1.3.5 植物凝血素(PHA)是淋巴细胞有丝分裂刺激剂,本实验采用的是市面上购买的PHA粉末,一个针剂为0.2mL。
将1瓶粉末溶在2mL的蒸馏水中。
1.3.6 抗菌素青霉素(以每瓶80 万单位为例):将1瓶青霉素溶在8mL生理盐水中,则每毫升含10万单位。
取0.1mL注入5mL的培养物中,则最终浓度为1000单位/mL。
链霉素(以每瓶100 万单位为例):以4毫升生理盐水稀释,则每毫升含100万单位,取0.1mL注入5mL的培养物中,则最终浓度为100单位/mL。
1.3.7 吉姆萨染液实验室中有现成染液1.3.8 3.5%NaHCO3溶液实验室有已配好的试剂。
1.3.9 0.1mol/L磷酸缓冲液实验室有已配好的试剂。
2 方法步骤2.1 分装培养液用移液管将培养液和其他各试剂分装入培养瓶中,每瓶量为:RPMI“1640”培养基4mL小牛血清1mLPHA 0.2mL双抗(青霉素加链霉素)0.1mL用3.5%NaHCO3溶液调pH到7.3,分装到20mL的培养瓶中,盖好盖子,用标签纸标清姓名,置于冰柜中保存。
用前从冰柜内取出,放入37℃恒温锅中温育10min。
2.2 采血用酒精消毒手指皮肤,用采血针刺破皮肤,再用毛细管取血0.3mL全血,吹入瓶中,轻轻摇动几下,盖好盖子,直立置于37℃恒温箱内培养。
2.3 培养置37℃温箱内培养72 小时——这个时间恰好是白细胞分裂的两个周期。
2.4秋水仙素处理培养终止前在培养物中加入浓度为40μg/mL的秋水仙素0.1mL,最终浓度为0.8μg/mL,置恒温箱中处理4h。
2.5 低渗处理秋水仙素处理完毕,小心地从温箱取出培养瓶,用滴管吸弃上清液,培养物沉积在瓶底,然后加入温育的低渗液(蒸馏水)5 mL,用滴管轻轻冲打成细胞悬液,装入离心管中置37℃温箱处理20 min,使红细胞破碎,白细胞膨胀。
2.6离心以1000r/min,离心5min10s,弃去上清液,收集白细胞。
2.7 固定加入固定液(甲醇∶冰乙酸=3∶l,临时配制)3 mL,片刻后用滴管轻轻冲打成细胞悬液,在室温中固定15 min后,离心,吸去上清液,留下白细胞。
2.8再固定加入固定液2 mL,用吸管轻轻打散,室温下继续固定15min (过夜也可以)。
2.9 再离心以1000r/min,离心5min10s,除去上清液,留下白细胞制片。
2.10 制片用吸管吸取细胞悬液自1m高处,滴在从冰柜中取出的一块干燥洁净的载玻片上,每片滴加悬液1—3 滴,用嘴轻轻吹散,在酒精灯火焰上微微烤干。
2.11 染色用磷酸缓冲液(PH7.4)稀释过的Geimsa 染色液(1︰10)染色20min,然后倒去多余染液。
并用蒸馏水轻轻冲洗。
2.12 镜检待稍干后,在显微镜下观察。
先用低倍寻找良好的分裂相,然后用高倍油镜观察。
选择染色体清晰、分散度好的细胞进行核型分析。
3 结果分析3.1实验结果该图为显微镜视野内所拍到的图3.2 核型分析:人类每个体细胞有46 条染色体,22 对常染色体和一对性染色体,男子是46,XY;女子是46,XX。
可以将人的46 条染色体分成A、B、C、D、E、F、G 七群,作为进一步识别和鉴定染色体的依据。
三个参数:(1)染色体的相对长度(2)臂比率(3)着丝点指数4 分析讨论4.1实验误差分析实验利用的是植物凝血素(PHA)使停止分裂的细胞恢复分裂的原理来获得大量的有丝分裂细胞,从而便于对染色体经行观察。
但淋巴细胞经过培养后,制成的标本质量不佳,染色体不明显,视野中除有染色体以外还有杂菌等,其原因可能为:(1)未作灭菌处理,由于细胞培养是在37℃的环境中进行的,而此温度也是细菌繁殖的最适温度,所以杂菌会出现在视野中。
(2)秋水仙素处理不当,一般秋水仙素溶液的浓度与处理时间有一定的关系,如果处理时间太短,则标本中的分裂细胞就少,相反,如果处理时间太长,则标本中的分裂细胞虽多,但其染色体缩得太短,以致形态特征模糊,不容易观察。
(3)低渗处理不当:低渗处理细胞时间过长,细胞膜往往过早破裂,以致分裂细胞或染色体丢失;如果处理时间不足时,细胞膨胀不够,则染色体分散不佳,难以进行染色体计数分析。
(4)低渗处理完后,细胞悬液可能并没有变浑浊,这有可能是用蒸馏水做低渗液没有使红细胞完全破裂,没有使白细胞充分的膨胀,从而会影响到观察的结果。
(5)在两次离心后,在离心管底没有看到明显的沉淀,有可能是培养基酸碱度没有调到最适的pH值或是培养时间短而导致白细胞量不足,从而影响了观察结果。
(6) 标本固定不充分:如固定液不新鲜,甲醇、冰醋酸的质量不佳,此时染色体形态模糊、不分散,其周围有细胞浆的蓝色背景。
(7)载玻片清洗不彻底:玻片有油迹,致使滴在载玻片上的细胞悬液不能均匀分散,且细胞随液体流动而丢失。
(8)载玻片冷冻不够:合适的冰湿玻片,从冰水中拿出时,其表面有一层霜雪。
如冷冻不够则无此现象,此时细胞难以贴附在载玻片上。
(9)核型图中染色体有的变粗,而有的很细小。
造成这种结果的原因可能是秋水仙素处理不彻底,一部分染色体加倍,而一部分没有。
4.2 实验注意事项4.2.1接种的血样愈新鲜愈好,最好是在采血后24 小时内进行培养,如果不能立刻培养,应置于4℃存放,避免保存时间过久,会影响细胞的活力.4.2.2在培养中成败的关键,除了至为重要的PHA 的效价外,培养的温度和培养液的酸碱度也十分重要.人的外周血淋巴细胞培养最适温度为37±0.5℃.培养液的最适pH7.2~7.4.4.2.3 适量的秋水仙素、适宜的处理时间,是获得良好分裂相的先决条件。
这将影响分裂相的多少和染色体的长短。
由于秋水仙素有强烈的毒性作用,用量过大,作用时间过长,可使缩短和发生异常分裂现象,甚至导致染色体破碎;反之,则染色体数量少而形态细长。
都不宜观察形态及计数。
故秋水仙素的浓度及时间要准确掌握。
4.2.4 低渗处理是获得分散良好的分裂相的关键步骤。
低渗使红细胞膜破裂,淋巴细胞膨胀,低渗处理浓度及时间要适当。
低渗后混匀细胞一定要轻,否则引起膜破裂、染色体散失。
低渗不够,则染色体聚在一起,分散不好。
太过,则造成细胞破碎,染色体丢失。
注意,低渗液在使用前需要在37℃温箱预温。
4.2.5 充分的固定是制备良好分散的染色体的重要步骤。
如果染色体分散的不好,可在余下的细胞悬液中改为甲醇:冰醋酸=1:3的固定液,有时可改善由于低渗处理不够或固定不充分所造成的缺陷。
固定时间可以延长数小时或过夜。
特别要注意的是,固定液要新鲜配制,否则将会形成酯类,从而影响固定的效果。
4.2.6 固定液纯度要高,临用时新鲜配制,应沿管壁慢慢加入后打匀,如果固定液加入太快,会使固定作用过强,染色体扭转;固定液作用不足,染色体出现毛刷状。
4.2.7 滴片是制备染色体的最后一步,也是非常关键的一步。
首先载玻片要非常干净,否则将会影响染色体的分散的效果。
其次,滴片的距离、滴加量的多少、制片的方式都会影响到染色体分散的效果。
