pdl1胃判读标准
教你解读PD-L1表达检测结果!

教你解读PD-L1表达检测结果!作者:闵PD-1/PD-L1抑制剂目前已广泛应用于各种肿瘤的常规治疗中,与此相伴的PD-L1表达也被很多病人知晓,但PD-L1的TPS/CPS评分、如何判读表达高低也让很多病人摸不着头脑,不知从何了解,本篇就简单介绍PD-L1表达的相关内容。
PD-L1表达如何检测PD-L1表达作为最常用的免疫治疗生物标志物,目前主要使用组织样本,采用IHC免疫组化技术检测,获批上市可以使用的检测试剂盒包括有DAKO公司的22c3、28-8试剂盒、罗氏的SP142,SP263试剂盒等等,当下最为常用的检测试剂盒为DAKO公司的22c3试剂盒。
DAKO试剂盒对样本质量有严格要求,组织样本通常需要肿瘤细胞含量30%以上并且能找到至少100个癌细胞,样本合格时检测结果才有参考价值。
PD-L1表达结果如何判读PD-L1表达虽然也使用IHC免疫组化法检测,但不同于诸如TTF-1等常规病理指标简单的用“+/-”判读,PD-L1表达的结果通常使用TPS评分或CPS评分来判读。
TPS定义肿瘤细胞在任何强度下显示部分或完整的膜染色的细胞数占总肿瘤细胞数的百分比。
TPS评分的重点在主要观测对象为肿瘤细胞,计算的是染色的肿瘤细胞占全部肿瘤细胞的百分比,即代表有PD-L1表达的肿瘤细胞的占比。
CPS定义PD-L1染色细胞(包括肿瘤细胞、淋巴细胞、巨噬细胞)的数目之和除以肿瘤细胞总数,乘以100得出结果。
不同于TPS只计算肿瘤细胞情况,CPS几乎将所有染色的细胞都纳入计算,统计的是有PD-L1表达的细胞与肿瘤细胞之间的关系。
举个例子,假如100个肿瘤细胞,其中25个被染色(即有PD-L1表达),那么TPS评分即25%,若除了这25个肿瘤细胞被染色以外,还有25个淋巴细胞被染色,那么CPS评分则为(25+25)/100*100等于50。
如何选择TPS和CPS评分以可瑞达(派姆单抗,K药)为例,不同的癌种使用不同的评分,归纳如下:(以上资料来源FDA批准的可瑞达适应症,不同药物的临界值可能会有差异,以实际使用药物适应症要求为准。
【系列讲座】PD-L1免疫组化检测结果判读标准解读

【系列讲座】PD-L1免疫组化检测结果判读标准解读以PD-1/PD-L1 抗体为代表的免疫检查点抑制剂是近些年肿瘤免疫治疗研究的热点,目前已有多种 PD-1/PD-L1 抗体获得了美国 FDA 批准,用于治疗黑色素瘤、肺癌、尿路上皮癌等多个瘤种。
患者对抗PD-1/PD-L1 抗体的治疗应答与体内PD-L1 的表达水平有关,因而PD-L1 表达水平检测对于指导临床治疗和筛选获益人群具有重要价值。
近日在上海举办的肺癌免疫治疗新进展专家会上,Ventana 美国总部的病理学家张利平博士对美国 FDA 批准的 PD-1/PD-L1 抗体和相关检测产品做了介绍,比较了 4 种 PD-L1 检测克隆的特点,并以其中两个克隆号(Ventana SP263 和 Ventana SP142)为例,对其检测结果的判读标准进行了解读。
FDA批准的PD-1/PD-L1抗体和相关检测目前,美国FDA 批准的PD-1/PD-L1 抗体包括Nivolumab、Pembrolizumab、Atezolizumab、Avelumab 及Durvalumab。
各个药物目前已批准的适应证有所差异,其中值得注意的是Pembrolizumab 近期被批准用于微卫星高度不稳定(MSI-H)的实体瘤的治疗,而无需考虑肿瘤的组织学类型。
除了 Avelumab 以外,其余四个药物都有对应的 PD-L1 检测,相应的检测技术见下表:四种PD-L1检测克隆的比较上述 4 种 PD-L1 检测克隆中仅 Dako IHC 22C3 为伴随诊断,其余均为补充诊断。
两类诊断技术的开发、研制和临床验证过程一致,其区别在于伴随诊断对于安全、有效地使用相应药物是必需的,而补充诊断不是必需的,但可以帮助临床医生对个体患者的治疗风险/益处进行评估。
国际肺癌研究协会(IASLC)牵头发起的 Blueprint 项目对上述 4 种PD-L1 IHC 检测克隆进行了比较。
PD-L1在幽门螺杆菌胃炎不同阶段的表达及意义

·论著·PD L1在幽门螺杆菌胃炎不同阶段的表达及意义罗粟风 张 丹 吕俊衍 文 玉 施春晶 普光宇 姜 鑫 马岚青 【摘要】 目的 旨在深入了解程序化细胞死亡配体 1(PD L1)在幽门螺杆菌(犎狆)胃炎不同阶段的表达及意义。
方法 依据纳入标准及排除标准,选择2019年4月至2020年1月在昆明医科大学第一附属医院接受胃镜检查的12例患者,参照《京都胃炎分类》及《中国慢性胃炎共识意见(2017年,上海)》的标准,在胃镜下钳取胃窦部组织送病理检查,并行14C尿素呼气试验。
依据活体组织病理检查、犎狆特殊染色法及14C尿素呼气试验的结果,将患者分为犎狆阴性非萎缩性胃炎组即正常组(A组)、犎狆阳性非萎缩性胃炎组(B组)、犎狆阳性萎缩性胃炎组(C组)、犎狆阳性萎缩性胃炎伴肠化生组(D组),每组3例,采用免疫组织化学染色法、蛋白质印迹法(Westernblotting)检测各组胃窦部组织中PD L1的表达情况。
结果 Westernblotting结果显示,B组、C组、D组的胃黏膜活体组织中PD L1蛋白表达水平均明显高于A组,差异均有统计学意义(犘均<0.0001);C组的PD L1蛋白表达水平明显高于B组,差异有统计学意义(犘<0.01);D组与C组的PD L1蛋白表达水平差异无统计学意义(犘>0.05)。
免疫组织化学染色结果显示,A组未见明显的PD L1阳性表达细胞,B、C、D组均有明显的PD L1阳性表达细胞,且阳性表达细胞数量均较A组明显增多。
结论 犎狆感染可明显上调胃黏膜组织中PD L1的表达水平,且PD L1的表达随着犎狆胃炎的进展逐渐呈现出升高趋势。
【关键词】 程序性死亡配体1;幽门螺杆菌胃炎;萎缩性胃炎DOI:10.3969/j.issn.1673 534X.2021.06.010 基金项目:国家自然科学基金(81760108、81560099);云南省重点项目(2018FA039);云南省教育厅科学研究基金(2019Y0353);昆明医科大学研究生创新基金(2020S025) 作者单位:650032 昆明医科大学第一附属医院消化内科 罗粟风、张丹对本文有同等贡献,并列第一作者 通信作者:马岚青,Email:531229897@qq.com犈狓狆狉犲狊狊犻狅狀犪狀犱狊犻犵狀犻犳犻犮犪狀犮犲狅犳狆狉狅犵狉犪犿犿犲犱犱犲犪狋犺犾犻犵犪狀犱1犻狀犱犻犳犳犲狉犲狀狋狊狋犪犵犲狊狅犳犎犲犾犻犮狅犫犪犮狋犲狉狆狔犾狅狉犻犵犪狊狋狉犻狋犻狊犔犝犗犛狌犳犲狀犵,犣犎犃犖犌犇犪狀,犔犢犝犑狌狀狔犪狀,犠犈犖犢狌,犛犎犐犆犺狌狀犼犻狀犵,犘犝犌狌犪狀犵狔狌,犑犐犃犖犌犡犻狀,犕犃犔犪狀狇犻狀犵.犇犲狆犪狉狋犿犲狀狋狅犳犌犪狊狋狉狅犲狀狋犲狉狅犾狅犵狔,狋犺犲犉犻狉狊狋犃犳犳犻犾犻犪狋犲犱犎狅狊狆犻狋犪犾狅犳犓狌狀犿犻狀犵犕犲犱犻犮犪犾犝狀犻狏犲狉狊犻狋狔,犓狌狀犿犻狀犵650032,犆犺犻狀犪【犃犫狊狋狉犪犮狋】 犗犫犼犲犮狋犻狏犲 Thispaperaimstogainadeeperunderstandingoftheexpressionandsignificanceofprogrammeddeathligand1(PD L1)indifferentstagesof犎犲犾犻犮狅犫犪犮狋犲狉狆狔犾狅狉犻(犎狆)gastritis.犕犲狋犺狅犱狊 Accordingtotheinclusioncriteriaandexclusioncriteria,twelvepatientswhounderwentgastroscopyintheFirstAffiliatedHospitalofKunmingMedicalUniversityfromApril2019toJanuary2020wereselected.Accordingto《Kyotoclassificationofgastritis》and《ConsensusopinionsonchronicgastritisinChina(2017,Shanghai)》standard,thegastricantrumtissuewasobtainedunderagastroscopeforpathologicalexamination,andthe14Cureabreathtestwasdetected.Accordingtotheresultsofbiopsy,犎狆specialstainingand14Cureabreathtest,thepatientswereassignedtothe犎狆 negativenon atrophicgastritisgroup(GroupA),the犎狆positivenon atrophicgastritisgroup(GroupB),the犎狆 positiveatrophicgastritisgroup(GroupC),andthe犎狆positiveatrophicgastritiswith·044·国际消化病杂志2021年12月第41卷第6期 IntJDigDis,December25,2021,Vol.41,No.6Copyright©博看网 . All Rights Reserved.intestinalmetaplasiagroup(GroupD),3casesineachgroup.ImmunohistochemicalstainingandWesternblottingwereusedtodetecttheexpressionofPD L1ingastricantrumtissuesineachgroup.犚犲狊狌犾狋狊 TheWesternblottingresultsshowthatthePD L1proteinexpressioningastricmucosaltissuesofGroupsB,C,andDissignificantlyhigherthanthatofGroupA,withstatisticallysignificantdifferences(all犘<0.0001).TheexpressionlevelofPD L1proteininGroupCissignificantlyhigherthanthatinGroupB,withastatisticallysignificantdifference(犘<0.01).ThereisnostatisticallysignificantdifferenceinPD L1proteinexpressionbetweenGroupDandGroupC(犘>0.05).TheresultsofimmunohistochemicalstainingindicatethattherearenoobviousPD L1positiveexpressingcellsinGroupA,andthereareobviousPD L1positiveexpressingcellsinGroupsB,C,andD,andthenumberofpositiveexpressingcellsissignificantlyhigherthanthatinGroupA.犆狅狀犮犾狌狊犻狅狀 犎狆infectioncansignificantlyup regulatetheexpressionlevelofPD L1ingastricmucosaltissue,andtheexpressionofPD L1graduallyshowsanupwardtrendwiththeprogressof犎狆gastritis.【犓犲狔狑狅狉犱狊】 Programmeddeathligand1;犎犲犾犻犮狅犫犪犮狋犲狉狆狔犾狅狉犻gastritis;Atrophicgastritis 幽门螺杆菌(犎狆)感染在胃黏膜萎缩和肠化生的发生、发展中起着重要作用,约1%的犎狆胃炎可进展为胃癌[1]。
pd1治疗后疗效评价标准

pd1治疗后疗效评价标准
PD-1 治疗后的疗效评价标准可以根据治疗前后的疾病进展情况和生存状况来评估。
1. 完全缓解(Complete response, CR):所有可评估的病灶消失,持续至少四周。
2. 部分缓解(Partial response, PR):最大病灶直径减少至少30%,持续至少四周。
3. 疾病稳定(Stable disease, SD):病灶大小没有显著缩小或增大,持续至少六周。
4. 疾病进展(Progressive disease, PD):病灶大小增大至少20%,或出现新的病灶。
此外,还可以根据患者的生存状况和生活质量来评估疗效:
1. 生存期延长(Overall survival, OS):患者在治疗后的存活时间。
2. 无进展生存期延长(Progression-free survival, PFS):患者在治疗后的疾病进展前的存活时间。
3. 生活质量改善:治疗后患者的生活质量是否有所改善。
这些评估标准通常由医生根据病人的临床病情和影像学检查结果来进行评估,并结合其他患者指标来综合评估治疗效果。
一文读懂PD-L1检测与判读的质控要求(建议收藏)

一文读懂PD-L1检测与判读的质控要求(建议收藏)随着免疫治疗药物在国内的适应症越来越广泛,以及PD-L1抗体DAKO 22C3、DAKO 28-8和艾德E1L3N在国内的获批,PD-L1免疫组化检测在病理诊断工作中尤为重要,但不同药物所使用的PD-L1抗体的针对不同检测平台、不同克隆号的抗体甚至不同瘤种,其判读标准都存在差异,从而也会导致判读结果的主观性。
要实现PD-L1的精准检测和判读,需从多个方面进行质量控制。
一、检测前的质量控制推荐优先在石蜡包埋肿瘤组织标本切片中进行PD-L1免疫组织化学检测:手术切除标本和活检标本均可用于PD-L1 检测。
手术标本选择代表性蜡块进行PD-L1检测,应避免选择含有坏死组织、挤压细胞及固定不佳等标本块。
表1 PD-L1 IHC前处理条件推荐PD-L1检测前需要对HE染色的切片进行评估,观察是否存在脱片、皱褶、未染色等现象,这些情况可导致切片上肿瘤细胞数量减少、非特异性染色或假阴性等结果。
评估HE切片中肿瘤细胞数量和(或)肿瘤相关免疫细胞:22C3及28-8检测系统要求HE染色切片中至少存在100个活肿瘤细胞;SP142检测系统要求包含至少50 个活肿瘤细胞和(或)肿瘤相关间质。
如HE染色切片不合格,无法进行下一步检测,应再次切片或重新挑选蜡块。
二、PD-L1检测的对照选择目前各种文献、指南均推荐使用扁桃体或胎盘组织作为PD-L1免疫组化检测的阳性对照。
一般胎盘组织PD-L1表达阳性强度要高于扁桃体,但表达强度基本一致;而扁桃体表达呈现出强弱不等的表达。
在扁桃体中,大多数生发中心巨噬细胞呈现弱到中等强度的点状胞膜染色,大多数上皮隐窝细胞呈现中等到强的染色,而大多数淋巴细胞(外套层和生发中心B细胞)和浅表上皮细胞无染色,这种不同强度的表达方式有助于对肿瘤组织进行判读。
可以根据习惯采用适合的阳性对照组织,但原则上应采用上述2种组织,这样检测结果才能具有可比性。
图1扁桃体组织的PD-L1检测结果。
PD-L1判读与尿路上皮癌(UC)

PD-L1判读与尿路上皮癌(UC) 作为泌尿系统最常见的恶性肿瘤,尿路上皮癌(UC)异质性大,不同组织学亚型具有不同的病理学及分子特征,传统化疗方案效果有限,患者易复发、易转移,总体预后较差1。
随着越来越多以PD-1/PD-L1免疫检查点抑制剂为代表的免疫治疗药物获批用于晚期或转移性UC治疗,打破了UC多年来的诊疗瓶颈,为UC患者提供了长期生存的可能。
近日,浙江大学医学院附属第一医院肿瘤内科郑玉龙教授、病理科滕晓东教授就UC免疫治疗新进展及PD-L1 (SP263)检测在UC中的应用与判读标准进行了线上分享。
会议主席广东省人民医院病理医学部刘艳辉教授指出:“近年来,免疫检查点抑制剂在UC等肿瘤治疗中取得了积极进展,为临床提供更多诊疗选择的同时也对病理诊断提出了新的要求。
如何建立统一规范化的PD-L1检测体系及判读标准,帮助临床准确评估患者PD-L1表达水平以筛选出潜在免疫治疗获益人群成为病理医生目前的一大课题。
” PD-L1高表达或成为UC一二线免疫治疗重要参考标准 目前,复发风险仍是非肌层浸润性UC的一个挑战,5年内有近30%至70%的浅表复发风险以及1%至30%的疾病进展为肌层浸润性疾病2。
由于潜在的肾功能不全、功能状态差或合并症,多达50%的晚期UC患者不宜接受顺铂治疗2。
“UC早期易复发,近半数患者对一线铂类药物治疗不耐受,且几乎所有患者会发生疾病进展,而二线化疗方案无振奋性的生存改善,这导致UC长期处于系统性治疗困境。
”郑玉龙教授介绍道,“免疫治疗的出现打破了这一困境,其显著提升了UC患者的生存获益。
值得注意的是,多项临床研究表明,PD-L1高表达者在免疫治疗中显示出了更好的疗效。
” 一项度伐利尤单抗(Durvalumab)单药治疗局部晚期或转移性UC的多中心I/II期开放性临床研究(Study 1108)结果显示,所有入组患者中,PD-L1高表达者接受治疗后客观缓解率(ORR)达27.6%,而PD-L1低表达者仅5.1%;对于二线铂类治疗失败的PD-L1高表达者ORR达27.4%,而PD-L1低表达者仅4.1%。
胃癌中PD-L1蛋白表达及分布特征的病理学意义

网络出版时间:2019-9-127:21 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20190912.0720.010.html胃癌中PD L1蛋白表达及分布特征的病理学意义王岳君,王娜娜,杨苗苗,王 源,孙晶璐,章俊生,孟 刚摘要:目的 检测胃癌中程序性死亡配体 1(programmeddeathligand 1,PD L1)蛋白的表达,总结其在癌组织及癌间质中肿瘤浸润单核细胞(tumorinfiltratingmononuclearcells,TIMCs)中的表达水平及分布特征,探讨影响胃癌PD L1蛋白表达的病理学因素,以提高其判读的准确性及可重复性。
方法 收集安徽医科大学第四附属医院2015~2019年期间110例行胃癌根治切除术标本,运用免疫组化MaxVision两步法检测PD L1蛋白表达,观察其在癌组织及TIMCs中的表达水平及分布特征,计算并比较不同判读方法下PD L1蛋白表达及其检测阳性率的差异,并分析其与临床病理学特征及临床预后的关系。
结果 运用CPS、TPS及MIDS三种不同的判读方法,胃癌中PD L1蛋白的检测阳性率分别为46 4%、24 5%、42 7%,三者一致性较好(P<0 05)。
其中运用CPS检测的阳性率最高,且呈高表达者最多。
CPS、TPS及MIDS三者检测阳性率与胃癌肿瘤实质性坏死、TIMCs数量、肿块大小呈正相关(P<0 05),其中CPS检测PD L1表达还与癌组织浸润深度相关(P<0 05),但与患者性别、年龄、肿瘤病变部位、组织学类型等均无关。
PD L1蛋白高表达者在胃癌组织的分布以弥漫性分布特征为主,低表达者以斑驳样分布特征为主,且无论表达高低均存在癌巢与间质接触面区域PD L1着色强度较高的苔藓样分布特征。
TIMCs中PD L1阳性表达亦以苔藓样分布特征为主,着色细胞主要是淋巴细胞、巨噬细胞等,且接触面并列分布的癌细胞也更易见PD L1阳性表达。
总结:PD-L1免疫组化检测难点与要点
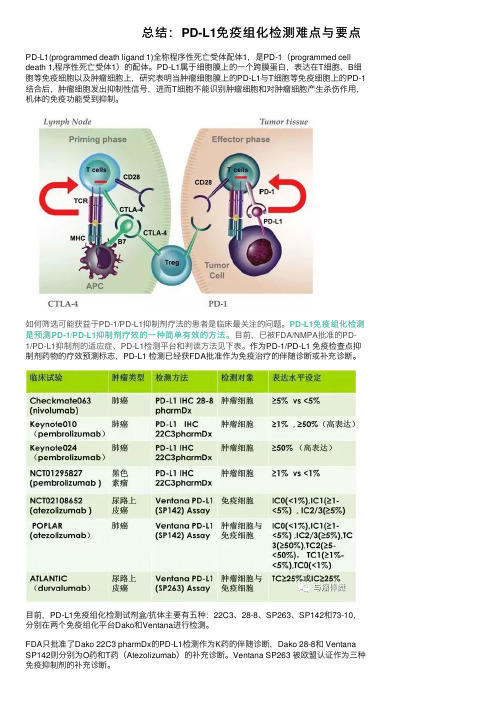
总结:PD-L1免疫组化检测难点与要点PD-L1(programmed death ligand 1)全称程序性死亡受体配体1,是PD-1(programmed cell death 1,程序性死亡受体1)的配体。
PD-L1属于细胞膜上的⼀个跨膜蛋⽩,表达在T细胞、B细胞等免疫细胞以及肿瘤细胞上,研究表明当肿瘤细胞膜上的PD-L1与T细胞等免疫细胞上的PD-1结合后,肿瘤细胞发出抑制性信号,进⽽T细胞不能识别肿瘤细胞和对肿瘤细胞产⽣杀伤作⽤,机体的免疫功能受到抑制。
如何筛选可能获益于PD-1/PD-L1抑制剂疗法的患者是临床最关注的问题。
PD-L1免疫组化检测是预测PD-1/PD-L1抑制剂疗效的⼀种简单有效的⽅法。
⽬前,已被FDA/NMPA批准的PD-1/PD-L1抑制剂的适应症、PD-L1检测平台和判读⽅法见下表。
作为PD-1/PD-L1 免疫检查点抑制剂药物的疗效预测标志,PD-L1 检测已经获FDA批准作为免疫治疗的伴随诊断或补充诊断。
⽬前,PD-L1免疫组化检测试剂盒/抗体主要有五种:22C3、28-8、SP263、SP142和73-10,分别在两个免疫组化平台Dako和Ventana进⾏检测。
FDA只批准了Dako 22C3 pharmDx的PD-L1检测作为K药的伴随诊断,Dako 28-8和 Ventana SP142则分别为O药和T药(Atezolizumab)的补充诊断。
Ventana SP263 被欧盟认证作为三种免疫抑制剂的补充诊断。
当前⾯临的检测难题:1 不同抗体要求使⽤不同的检测平台主流检测平台为两家公司的4种抗体检测平台,分别为DAKO 22C3和28-8检测的AutoStainerLink 48平台和Ventana SP142和SP263检测的Ventana Benchmark Ultra平台。
2 不同的抗体检测结果判读标准不同⽬前主要PD-L1检测抗体使⽤的判读⽅法有TPS、CPS以及分别计算TC和IC判读⽅法,不同判读⽅法的主要差异在与是否计算肿瘤区域阳性表达的免疫细胞数量。
pd-l1检测标准操作规程

pd-l1检测标准操作规程一、背景介绍PD-L1(Programmed Death-Ligand 1)是一种免疫检查点分子,与免疫细胞表面的PD-1受体结合,抑制T细胞的活性。
PD-L1检测可以预测免疫治疗的疗效,为肿瘤患者选择合适的免疫治疗方案提供重要依据。
本操作规程旨在规范PD-L1检测的操作程序,确保结果的准确性和可重复性。
二、试剂和仪器准备1. 试剂准备:根据试剂包装盒说明,按照规定浓度配置所有试剂,确认试剂未过期。
2. 仪器准备:确保光学系统清洁,按照仪器操作手册对设备进行校准和验证,确保仪器正常运行。
三、标本处理1. 标本采集:选择合适的组织样本进行检测,严格按照标本采集规范操作,避免污染和破坏。
2. 标本制备:将组织标本固定后,进行石蜡包埋和切片,确保切片质量符合要求。
四、免疫组织化学染色1. 切片处理:将组织切片取出,去蜡和水洗步骤,确保切片表面干燥。
2. 抗原回复:按照试剂说明,对切片进行抗原回复处理,优化抗原回复条件。
3. 抗体处理:将切片加入抗PD-L1抗体孵育液中,进行免疫反应,时间和温度根据试剂要求设定。
4. 洗涤:用洗涤缓冲液洗涤切片,去除未结合的抗体。
5. 信号放大:加入特定酶的荧光素标记二抗,进行信号放大。
6. 显色:使用显色剂对切片进行显色反应,产生可见的染色信号。
7. 洗涤和封片:用洗涤缓冲液彻底洗涤显色的切片,并进行封片处理。
五、结果分析和报告1. 显微镜观察:使用显微镜观察切片,评估PD-L1的染色强度和表达情况。
2. 结果判读:根据试剂说明书中的标准,对染色结果进行判读,并记录下来。
3. 结果报告:根据实验室内部的报告模板,将结果填写并生成报告,包括PD-L1阳性细胞百分比和染色强度等信息。
六、质量控制和质量保证1. 内部质控:定期进行内部质控,使用已知PD-L1表达样本进行检测,确保结果的准确性和一致性。
2. 外部质控:参与外部质控项目,与其他实验室进行比对,评估实验室的技术水平。
PD-1抑制剂在胃癌的免疫治疗中的应用

㊃综述㊃D O I:10.3969/j.i s s n.1672-9455.2024.03.029P D-1抑制剂在胃癌的免疫治疗中的应用*冒春燕1,2综述,丛辉1,3ә审校1.南通大学附属医院医学检验科,江苏南通226001;2.南通大学医学院,江苏南通226001;3.南通大学附属医院输血科,江苏南通226001摘要:近年来胃癌的发病率不断提高,80%的患者确诊时已到中晚期㊂目前新兴的胃癌免疫治疗法是治疗晚期胃癌的一种很有前景的治疗手段,国内外已经推出的细胞程序性死亡受体-1(P D-1)和细胞程序性死亡配体-1(P D-L1)抑制剂是继细胞毒T淋巴细胞抗原4后最重要的免疫学检查点抑制剂㊂P D-1单抗药纳武利尤单抗和帕博丽珠单抗主要用于胃癌的后线治疗,本文主要对帕博丽珠单抗和纳武利尤单抗在胃癌免疫治疗中的地位和价值展开综述㊂关键词:胃癌;免疫治疗;细胞程序性死亡受体-1;帕博丽珠单抗;纳武利尤单抗中图法分类号:R735.2文献标志码:A文章编号:1672-9455(2024)03-0410-04A p p l i c a t i o n o f P D-1i n h i b i t o r i n i m m u n o t h e r a p y o f g a s t r i c c a n c e r*MA O C h u n y a n1,2,C O N G H u i1,3ә1.D e p a r t m e n t o f L a b o r a t o r y M e d i c i n e,A f f i l i a t e d H o s p i t a l o f N a n t o n g U n i v e r s i t y,N a n t o n g,J i a n g s u226001,C h i n a;2.M e d i c a l S c h o o l o f N a n t o n g U n i v e r s i t y,N a n t o n g,J i a n g s u226001,C h i n a;3.D e p a r t m e n t o f B l o o d T r a n s f u s i o n,A f f i l i a t e d H o s p i t a l o fN a n t o n g U n i v e r s i t y,N a n t o n g,J i a n g s u226001,C h i n aA b s t r a c t:T h e i n c i d e n c e r a t e o f g a s t r i c c a n c e r h a s b e e n i n c r e a s i n g i n r e c e n t y e a r s,a n d80%p a t i e n t s a r e a l-r e a d y i n t h e m i d d l e o r l a t e s t a g e w h e n t h e y a r e d i a g n o s e d.A t p r e s e n t,t h e e m e r g i n g i mm u n o t h e r a p y f o r g a s t r i cc a n c e r i s a p r o m i s i n g t r e a t m e n t m e a n f o r ad v a n ce d g a s t r i c c a n c e r,a n d p r o g r a mm e d c e l l d e a t h r e c e p t o r-1(P D-1)a n d p r o g r a mm e d c e l l d e a t h l i g a n d-1(P D-L1)i n h i b i t o r s h a v e b e e n l a u n c h e d a t h o m e a n d a b r o a d,w h i c h a r e t h e m o s t i m p o r t a n t i mm u n o l o g i c a l c h e c k p o i n t i n h i b i t o r s a f t e r c y t o t o x i c T l y m p h o c y t e-a s s o c i a t e d a n t i g e n-4. T h e P D-1m o n o c l o n a l a n t i b o d y d r u g s,l i k e N i v o l u m a b a n d P e m b r o l i z u m a b,a r e p r i m a r i l y u s e d a s l a t e r-l i n e t h e r a p i e s f o r g a s t r i c c a n c e r,a n d t h i s a r t i c l e r e v i e w s t h e s t a t u s a n d v a l u e o f p e m b r o l i z u m a b a n d n i v o l u m a b i n t h e i mm u n o t h e r a p y o f g a s t r i c c a n c e r.K e y w o r d s:g a s t r i c c a n c e r;i mm u n o t h e r a p y;p r o g r a mm e d c e l l d e a t h r e c e p t o r-1; P e m b r o l i z u m a b; N i v o l u m a b胃癌是世界上第五大恶性肿瘤,同时也是造成人类癌症死亡的第四大因素[1]㊂据统计2020年胃癌占所有癌症死亡人数的7.7%,新发胃癌患者占所有癌症患者的5.5%[2]㊂胃癌是全世界发病率较高的癌症之一[3],好发于东亚地区,其中中国发病率较高[4]㊂胃癌早期并无明显体征且不易观察,约80%的患者发现时已属晚期㊂胃癌是一种侵袭性疾病,易在淋巴结发生转移,且预后较差㊂引起胃癌的危险因素主要包括幽门螺杆菌感染㊁饮食习惯㊁烟草㊁肥胖和辐射[5]㊂随着人们对幽门螺杆菌治疗的重视,近几十年来胃癌的发病率和患病率虽然有所下降,但其病死率仍然处于高位[6]㊂目前进展期胃癌的治疗手段主要是化疗,但单纯化疗效果不尽人意[7],5年内生存率不到20%[8],在胃癌的整体诊断中,对于人表皮生长因子受体2(H E R2)阳性的晚期胃癌患者,除了使用曲妥珠单抗能取得较明显的治疗效果,其余靶向药物的治疗效果均较差㊂我国H E R2阳性的晚期胃癌患者仅占晚期胃癌总患者的12%~13%,所以曲妥珠单抗仅适用于小部分患者,而大部分胃癌患者不适合采用靶向药物治疗,因此靶向药物在胃癌领域的发展前景不容乐观[9]㊂近年来免疫治疗在胃癌治疗领域掀起了一股热潮㊂免疫治疗主要是通过激活人体自身的免疫系统来抗击肿瘤,其基本原理是去除肿瘤细胞的伪装,通过T淋巴细胞识别并杀伤肿瘤细胞㊂近年来,以免疫检查点抑制剂为主的免疫治疗在胃癌综合治疗领域中取得了重要进展,特别是细胞程序性死亡受体-1(P D-1)和细胞程序性死亡配体-1(P D-L1)通路的发现为晚期胃癌患者带来了希望[10]㊂1 P D-1单抗药纳武利尤单抗㊁帕博丽珠单抗近年来,免疫治疗已作为胃癌整体治疗的研发重点之一[11],主要是免疫检查点抑制剂,此外还有P D-1单抗药纳武利尤单抗㊁帕博丽珠单抗等㊂目前免疫治㊃014㊃检验医学与临床2024年2月第21卷第3期 L a b M e d C l i n,F e b r u a r y2024,V o l.21,N o.3*基金项目:江苏省卫生健康委员会重点项目(Z D2022008)㊂ә通信作者,E-m a i l:h u i c j s@163.c o m㊂疗胃癌最常见的药物P D-1在T淋巴细胞中也会有表达,主要抑制T淋巴细胞的功能,防止T淋巴细胞过度激活后导致自身免疫系统疾病的发生,所以P D-1也是一种具有自我保护的蛋白,肿瘤微环境诱导T淋巴细胞表达更多的P D-1来抑制T淋巴细胞的功能[12],另外产生的P D-L1㊁细胞程序性死亡配体-2 (P D-L2),还可以避免误杀T淋巴细胞㊂P D-1抑制剂能够阻止细胞形成P D-1和P D-L1㊁P D-L2,从而活化T淋巴细胞,进而发现并杀伤肿瘤细胞㊂近年来, P D-1抑制剂在对胃癌的免疫治疗方面,也取得了显著进步㊂1.1纳武利尤单抗纳武利尤单抗是一个人类免疫球蛋白G4(I g G4)型的单克隆抗体,能够控制T淋巴细胞表面的P D-1,进而激活T淋巴细胞的肿瘤识别系统,达到消除肿瘤细胞的目的[13]㊂纳武利尤单抗是最早在全球范围内上市的药物,同时也是我国目前在治疗癌症中效果最快的P D-1抗体之一,目前已经成了全球最主要的治疗肿瘤的标准药物㊂对于既往进行过2种或2种以上全身性治疗方法的晚期及高致残率胃部及胃食道结合部(G/G E J)腺癌患者,可使用纳武利尤单抗注射液进行救治㊂纳武利尤单抗注射液已通过中国国家药品监督管理局的许可,成为我国第一种用于晚期胃癌的免疫肿瘤药品[14]㊂1.2帕博丽珠单抗帕博丽珠单抗是一种高选择性㊁人源性的I g G4k a p p a型单克隆抗体,在多类肿瘤中具有活性[15]㊂帕博丽珠单抗是美国食品药品监督管理局(F D A)批准用于胃癌治疗的唯一免疫检查点抑制剂㊂它以29p M高度亲和P D-1,抑制其与P D-L1和P D-L2结合㊂2017年9月,根据K E Y N O T E-059的测试,帕博丽珠单抗已获得F D A许可用于曾进行过2种或2种以上治疗方法的部分晚期或严重转移性胃癌患者,包括含氟嘧啶和铂的化疗方法,以及H E R2/美国东北大学靶向治疗方法[16]㊂帕博丽珠单抗也可用来诊断不可移除的转移性㊁微卫星不稳定性高(M S I-H)及错配修复缺陷(MM R-D)的晚期胃癌[17-18]㊂2 P D-1单抗在胃癌免疫治疗中的应用近年来,以P D-1为主的免疫检查点抑制剂(I C I s)在胃癌的免疫治疗领域引起了高潮,为晚期的胃癌患者带来了曙光㊂I C I s对晚期胃癌三线治疗的重要意义也获得了确认,对一线与二线的治疗方式还将进一步研究与深化㊂在2021版的中国抗癌协会医院肿瘤学协作专家委员会标准中,更新了对晚期胃癌免疫治疗的标准,推荐从三线到一线治疗,从单药治疗到联合化学药物治疗,并针对不同的适用人群选择不同的P D-1单抗㊂2.1帕博丽珠单抗㊁纳武丽珠单抗用于三线或后线治疗2020版中国临床肿瘤学会(C S C O)指南推荐抗P D-1单抗用于晚期胃癌患者的三线或后续治疗[19]㊂2017年美国临床肿瘤学会(A S C O)年会报道的K E Y N O T E-059研究结果证明帕博丽珠单抗单药对于一线㊁二线治疗失败后的胃癌患者是安全有效的[20]㊂在K e y n o t e-059研究序列2中,F D A监测到P D-L1(ȡ1%)的亚组中的客观缓解率(O R R)达到11.2%,并将帕博丽珠单抗作为三线及以上P D-L1晚期G/G E J腺癌患者的药物选择[21]㊂2021版C S C O 指南推荐对于晚期M S I-H/MM R-D胃癌患者增加帕博丽珠单抗单药[19]㊂A T T R A C T I O N-2研究结果证明,对于不可切除的晚期或复发性胃癌,使用纳武利尤单抗进行治疗能显著提高其总生存期(O S)[22],对尚未缓解的胃癌患者生存作用良好,中位生存期高达26.6h㊂2017年9月纳武利尤单抗成功应用在化疗后进展的㊁较不易切除的晚期或复发性胃癌的三线治疗[23]㊂而以上2项临床研究也进一步巩固了P D-1抑制剂在晚期胃癌三线或后线诊断中的关键性意义㊂2.2帕博丽珠单抗㊁纳武丽珠单抗与化疗联合用药用于一线治疗 P D-1单抗正在向一线和二线治疗摸索和推进㊂免疫治疗联合化疗未来有可能发展成为胃癌的一线二线疗法㊂2021年美国国家综合癌症网络(N C C N)V1版胃癌指南推荐纳武利尤单抗联合化疗可作为P D-L1综合阳性评分(C P S)ȡ5分患者的一线疗法[24]㊂欧洲内科肿瘤学会(E M S O)公布的C h e c k M a t e-649研究结果显示,与单纯化疗相比,纳武利尤单抗联合化疗显著延长了P D-L1C P Sȡ5分患者的O S,病死率降低了29%[25]㊂2021年4月F D A 批准纳武利尤单抗+化疗作为晚期胃癌患者的一线治疗方案,且不受P D-L1表达的限制[26]㊂2019年,美国A S C O公布的K E Y N O T E-062结果表明,增加了帕博丽珠单抗单药用于P D-L1C P Sȡ1分患者的一线治疗后,治疗效果显著提高[27];K E Y N O T E-059队列2和队列3评估了帕博丽珠单抗+化疗药物作为晚期G/G E J腺癌的一线治疗效果,发现疗效明显增强[28]㊂K E Y N O T E-059和C h e c k M a t e-6492项研究结果证明,帕博丽珠单抗和纳武利尤单抗与化疗联合用药疗效优于单抗单药的疗效㊂在A T T R A C T I O N-4的研究中,对于未经治疗的G/G E J癌症患者,纳武利尤单抗联合化疗并未延长患者的O S[29]㊂K E Y N O T E-062研究结果显示,帕博丽珠单抗联合化疗对于P D-L1 C P Sȡ1的患者疗效甚微,其O S并未发生显著的改变[27]㊂虽然以上试验证明P D-1单抗在胃癌免疫治疗方面取得了突破,并改变了晚期胃癌一线治疗的局面,但由于免疫治疗在一线治疗中的作用尚未明确,且许多以P D-1单抗药物为基础的研究效果尚未完善,因此还需更多的研究进一步加以验证㊂2.3帕博丽珠单抗㊁纳武利尤单抗与靶向药物联合用于一线㊁二线治疗基于K e y n o t e-811的临床实践研究结果,对于H E R2阳性的不可移除晚期G/G E J 肿瘤患者,美国F D A已经批准将帕博丽珠单抗和曲妥珠单抗+化学治疗作为其一线疗法[30]㊂E P-O C1706是一项帕博利珠单抗联合仑伐替尼用于晚期胃癌的一㊁二线治疗的临床试验,研究结果表明与C P S<1分的患者相比,P D-L1C P Sȡ1分患者的O R R和无进展生存时间(P F S)显著升高,并且C P Sȡ㊃114㊃检验医学与临床2024年2月第21卷第3期 L a b M e d C l i n,F e b r u a r y2024,V o l.21,N o.310分患者的O R R达100%[31]㊂R E G O N I V O试验结果显示,增加纳武利尤单抗与瑞戈非尼联合治疗胃癌后,胃癌患者O R R高达44%,中位P F S为5.6个月[32]㊂J V D F试验评价了雷莫芦单抗与帕博利珠单抗联合治疗初治胃癌患者的效果,O R R仅为25%,而在纳武利尤单抗联合雷莫芦单抗的基础上,再加上紫杉醇化疗方案,胃癌治疗的有效率可达到37.2%[33]㊂以靶向药物治疗联合P D-1单抗为基础的诊疗方法,在胃癌一㊁二线诊疗中已经显示了较好的发展前景,但鉴于尚未充分明确其内在的科学基础,怎样基于高度异质性的癌症特性和免疫微环境特征遴选受益群体,优选联合方法,仍是未来研究的重点㊂另外,放射治疗也是治疗肿瘤的一种手段,人们也在尝试利用放射治疗结合P D-1单抗治疗胃癌㊂HO N G等[34]通过裸鼠模型实验表明放射治疗与免疫检查点抑制剂联合治疗对放射治疗不敏感的胃癌患者具有协同作用㊂但放射性炎症和免疫性炎症叠加的副作用是无法回避的现实问题㊂3 P D-1单抗治疗胃癌的局限性P D-1单抗治疗胃癌的局限性在于它对免疫过程造成的强烈反应,几乎能够侵犯人体所有的细胞部位,但其总体危险性远远低于化疗,而且大部分人能够自行治愈㊂依据K E Y N O T E-059㊁K E Y N O T E-062㊁A T T R A C T I O N-4和K E Y N O T E-649的试验结果,P D-1单抗治疗胃癌的不良反应主要症状有皮疹㊁瘙痒㊁乏力㊁恶心㊁腹泻㊁食欲减退㊁丙氨酸氨基转移酶升高等㊂免疫性疾病的不良反应危害也相对较小,比较典型的是免疫性肺炎㊁免疫性肠炎㊁免疫性甲状腺系统损伤,甚至还有Ⅰ型糖尿病[35]㊂在A T T R A C-T I O N-02试验中,43%的患者在使用纳武利尤单抗治疗后发生了严重的不良反应现象,而其中有近10%的患者发生了如腹泻㊁乏力㊁食欲减退等3~4级严重的不良反应㊂在K E Y N O T E-059队列1中,帕博丽珠单抗治疗组中有17.8%的患者发生了较严重的不良反应,而其中4.6%的患者发生了3~4级严重的不良反应,如倦怠㊁贫血㊁甲状腺功能减退等㊂K E Y N O T E-061是一项利用帕博丽珠单抗研究晚期胃癌的试验,结果表明大约有53%的患者出现了不良反应,其中14%的患者出现了如疲劳㊁贫血等3~5级严重的不良反应[36]㊂上述研究结果表明,P D-1抑制剂对预防胃癌的安全性已得到了足够的验证,优点还包括其不良反应影响较小,而且耐受率高㊂另外,进入胃癌晚期的患者身体状况较差,约有70%的人群不适合P D-1三线及后线治疗,约58%的患者不适合P D-1的二线治疗,且治疗效果不佳[37]㊂4小结纳武利尤单抗和帕博丽珠单抗已获批晚期胃癌三线治疗适应证,一线和二线治疗及联合化疗仍在探索中㊂免疫治疗作为一种新型疗法,正日益成为治疗胃癌的主要手段之一,且在胃癌治疗领域有广阔的前景㊂尽管目前P D-1单抗单药或联合用药治疗胃癌取得了良好的成效,但是O S和O R R仍然较低,如何联合用药使协同治疗发挥更大疗效值得深入探讨㊂目前,由于晚期胃癌的预后较差,对于其最佳的治疗方案,国内外尚未达成共识㊂未来不仅需要深入了解免疫化疗联合作用的机制,还要筛选化疗联合免疫治疗的优势人群,制订适应不同患者的个体化治疗策略㊂胃癌免疫治疗还面临很多未知的问题,期待更多临床治疗结果让晚期的胃癌患者受益㊂参考文献[1]J O H N S T O N F M,B E C K M A N M.U p d a t e s o n m a n a g e m e n t o f g a s t r i c c a n c e r[J].C u r r O n c o l R e p,2019,21(8):67. [2]S U N G H,F E R L A Y J,S I E G E L R L,e t a l.G l o b a l c a n c e r s t a t i s t i c s2020:G L O B O C A N e s t i m a t e s o f i n c i d e n c e a n d m o r t a l i t y w o r l d w i d e f o r36c a n c e r s i n185c o u n t r i e s[J].C A C a n c e r J C l i n,2021,71(3):209-249.[3]MO X,WU Y,C H E N L,e t a l.G l o b a l e x p r e s s i o n p r o f i l i n g o f m e t a b o l i c p a t h w a y-r e l a t e d l n c R N A s i n h u m a n g a s t r i cc a n c e r a nd t he i d e n t if i c a t i o n o f R P11-555H23.1a s a n e wd i a g n o s t i c b i o m a r ke r[J].J C l i n L a b A n a l,2019,33(2): e22692.[4]闫超,陕飞,李子禹.2020年全球胃癌负担分析:聚焦中国流行现状[J].中国肿瘤,2023,32(3):161-170.[5]I L I C M,I L I C I.E p i d e m i o l o g y o f s t o m a c h c a n c e r[J].W o r l d JG a s t r o e n t e r o l,2022,28(12):1187-1203.[6]S O U S A C,F E R R E I R A R,A Z E V E D O N F,e t a l.H e l i c o-b ac t e r p y l o r i i n f e c t i o n:f r o m s t a nd a r d t o a l te r n a t i v e t r e a t-m e n t s t r a t e g i e s[J].C r i t R e v M i c r o b i o l,2022,48(3):376-396.[7]C A O W,C H E N H D,Y U Y W,e t a l.C h a n g i n g p r o f i l e s o fc a n c e r b u rde n w o r l d w i d e a n d i n C h i n a:a s e c o n d a r y a n a l y-s i s of t h eg l o b a l c a n c e r s t a t i s t i c s2020[J].Chi n M e d J(E n g l),2021,134(7):783-791.[8]A L L E M A N I C,M A T S U D A T,D I C A R L O V,e t a l.G l o b a l s u r v e i l l a n c e o f t r e n d s i n c a n c e r s u r v i v a l2000-14(C O N-C O R D-3):a n a l y s i s o f i n d i v i d u a l r e c o r d s f o r37513025p a-t i e n t s d i a g n o s e d w i t h o n e o f18c a n c e r s f r o m322p o p u l a-t i o n-b a s e d r e g i s t r i e s i n71c o u n t r i e s[J].L a n c e t,2018,391 (10125):1023-1075.[9]S MY T H E C,N I L S S O N M,G R A B S C H H I,e t a l.G a s t r i cc a n c e r[J].L a n c e t,2020,396(10251):635-648.[10]侯乐淳,王紫馨,杨天悦,等.P D-1免疫检查点抑制剂在胃癌免疫治疗中的现状和进展[J].肿瘤,2022,42(05): 314-324.[11]WA N G F H,Z HA N G X T,L I Y F,e t a l.T h e C h i n e s eS o c i e t y o f C l i n i c a l O n c o l o g y(C S C O):c l i n i c a l g u i d e l i n e sf o r t h e d i ag n o s i s a n d t r e a t m e n t o f g a s t r i c c a n c e r,2021[J].C a n c e r C o mm u n(L o n d),2021,41(8):747-795.[12]K U O L N,S T O J A N O V S K A L,N U R G A L I K,e t a l.P D-1/P D-L1i n d i s e a s e[J].I mm u n o t h e r a p y,2018,10(2): 149-160.[13]G O O D M A N A M,K A T O S,B A Z H E N O V A L,e t a l.T u m o rm u t a t i o n a l b u r d e n a s a n i n d e p e n d e n t p r e d i c t o r o f r e-s p o n s e t o i mm u n o t h e r a p y i n d i v e r s e c a n c e r s[J].M o lC a n c e r T h e r,2017,16(11):2598-2608.[14]Z HA N G Z,X I E T,Z HA N G X,e t a l.I mm u n e c h e c k p o i n t㊃214㊃检验医学与临床2024年2月第21卷第3期 L a b M e d C l i n,F e b r u a r y2024,V o l.21,N o.3i n h i b i t o r s f o r t r e a t m e n t o f a d v a n c e d g a s t r i c o r g a s t r o e-s o p h a g e a l j u n c t i o n c a n c e r:c u r r e n t e v i d e n c e a n d f u t u r e p e r s p e c t i v e s[J].C h i n J C a n c e r R e s,2020,32(3):287-302.[15]朱小坚,骆晨,朱正明.晚期胃癌中P D-1/P D-L1的表达及其单抗治疗的临床现状[J].现代免疫学,2019,39(1): 52-57.[16]F A S HO Y I N-A J E L,D O N O G HU E M,C H E N H,e t a l.F D A a p p r o v a l s u mm a r y:p e m b r o l i z u m a b f o r r e c u r r e n t l o-c a l l y ad v a n ce d o r m e t a s t a t i c g a s t r i c o r g a s t r o e s o p h a g e a l j u n c t i o n a d e n o c a r c i n o m a e x p r e s s i n g P D-L1[J].O n c o l o-g i s t,2019,24(1):103-109.[17]李健,沈琳.基于K E Y N O T E-059/061/062研究评估帕博利珠单抗治疗微卫星高度不稳定的胃癌或胃食管结合部癌的疗效[J].中国肿瘤临床,2023,50(16):816-820.[18]Y U Y.M o l e c u l a r c l a s s i f i c a t i o n a n d p r e c i s i o n t h e r a p y o fc a n c e r:i mm u n e c h e c k p o i n t i n h i b i t o r s[J].F r o n t M e d,2018,12(2):229-235.[19]陈俊良,王风华.2021版C S C O胃癌诊疗指南转移性胃癌更新解读[J].中国肿瘤临床,2022,49(7):325-330.[20]F U C H S C S,D O I T,J A N G R W,e t a l.S a f e t y a n d e f f i c a-c y o f p e m b r o l i z u m a b m o n o t h e r a p y i n p a t i e n t s w i t h p r e v i-o u s l y t r e a t e d a d v a n c e d g a s t r i c a n d g a s t r o e s o p h a g e a l j u n c-t i o n c a n c e r:p h a s e2c l i n i c a l K E Y N O T E-059t r i a l[J].J A-MA O n c o l,2018,4(5):e180013.[21]J A N J I G I A N Y Y,B E N D E L L J,C A L V O E,e t a l.C h e c k-M a t e-032s t u d y:e f f i c a c y a n d s a f e t y o f n i v o l u m a b a n d n i v-o l u m a b p l u s i p i l i m u m a b i n p a t i e n t s w i t h m e t a s t a t i c e s o p h a g o g a s t r i c c a n c e r[J].J C l i n O n c o l,2018,36(28): 2836-2844.[22]K A N G Y K,B O K U N,S A T OH T,e t a l.N i v o l u m a b i np a t i e n t s w i t h a d v a n c e d g a s t r i c o r g a s t r o-o e s o p h a g e a l j u n c t i o n c a n c e r r e f r a c t o r y t o,o r i n t o l e r a n t o f,a t l e a s t t w o p r e v i o u s c h e m o t h e r a p y r e g i m e n s(O N O-4538-12,A T-T R A C T I O N-2):a r a n d o m i s e d,d o u b l e-b l i n d,p l a c e b o-c o n-t r o l l e d,p h a s e3t r i a l[J].L a n c e t,2017,390(10111):2461-2471.[23]C H E N L T,S A T OH T,R Y U M H,e t a l.A p h a s e3s t u d y o f n i v o l u m a b i n p r e v i o u s l y t r e a t e d a d v a n c e d g a s t r i c o r g a s t r o e s o p h a g e a l j u n c t i o n c a n c e r(A T T R A C T I O N-2):2-y e a r u p d a t e d a t a[J].G a s t r i c C a n c e r,2020,23(3):510-519.[24]A J A N I J A,D'AM I C O T A,B E N T R E M D J,e t a l.G a s-t r i c c a n c e r,v e r s i o n2.2022,N C C N c l i n i c a l p r a c t i c e g u i d e-l i n e s i n o n c o l o g y[J].J N a t C o m p r C a n c N e t w,2022,20(2):167-192.[25]L I U T,B A I Y,L I N X,e t a l.F i r s t-l i n e n i v o l u m a b p l u sc h e m o t h e r a p y v s c h e m o t h e r a p y i n p a t i e n t s w i t h ad v a n ce dg a s t r i c,g a s t r o e s o p h a g e a l j u n c t i o n a n d e s o p h a g e a l a d e n o-c a r c i n o m a:c h e c k m a t e649C h i n e s e s u b g r o u p a n a l y s i s[J].I n t J C a n c e r,2023,152(4):749-760.[26]J A N J I G I A N Y Y,S H I T A R A K,MO E H L E R M,e t a l.F i r s t-l i n e n i v o l u m a b p l u s c h e m o t h e r a p y v e r s u s c h e m o-t h e r a p y a l o n e f o r a d v a n c e d g a s t r i c,g a s t r o-o e s o p h a g e a l j u n c t i o n,a n d o e s o p h a g e a l a d e n o c a r c i n o m a(C h e c k M a t e 649):a r a n d o m i s e d,o p e n-l a b e l,p h a s e3t r i a l[J].L a n c e t, 2021,398(10294):27-40.[27]S H I T A R A K,V A N C U T S E M E,B A N G Y J,e t a l.E f f i-c a c y a nd s a fe t y of p e m b r o l i z u m a b o r p e m b r o l i z u m a b p l u s c h e m o t h e r a p y v s c h e m o t h e r a p y a l o n e f o r p a t i e n t s w i t h f i r s t-l i n e,a d v a n c e dg a s t r i c c a n c e r:th e K E Y N O T E-062p h a s e3r a n d o m i z e d c l i n i c a l t r i a l[J].J AMA O n c o l,2020, 6(10):1571-1580.[28]B A N G Y J,K A N G Y K,C A T E N A C C I D V,e t a l.P e m-b r o l i z u m a b a l o n e o r i nc o m b i n a t i o n w i t h c h e m o t h e r a p y a sf i r s t-l i n e t h e r a p y f o r p a t i e n t s w i t h a d v a n c e dg a s t r i c o rg a s t r o e s o p h a g e a l j u n c t i o n a d e n o c a r c i n o m a:r e s u l t s f r o m t h e p h a s eⅡn o n r a n d o m i z e d K E Y N O T E-059s t u d y[J].G a s t r i c c a n c e r,2019,22(4):828-837.[29]B O K U N,R Y U M H,K A T O K,e t a l.S a f e t y a n d e f f i c a c yo f n i v o l u m a b i n c o m b i n a t i o n w i t h S-1/c a p e c i t a b i n e p l u s o x a l i p l a t i n i n p a t i e n t s w i t h p r e v i o u s l y u n t r e a t e d,u n r e-s e c t a b l e,a d v a n c e d,o r r e c u r r e n t g a s t r i c/g a s t r o e s o p h a g e a l j u n c t i o n c a n c e r:i n t e r i m r e s u l t s o f a r a n d o m i z e d,p h a s e I I t r i a l(A T T R A C T I O N-4)[J].A n n O n c o l,2019,30(2): 250-258.[30]J A N J I G I A N Y Y,K AWA Z O E A,Y AÑE Z P,e t a l.T h eK E Y N O T E-811t r i a l o f d u a l P D-1a n d H E R2b l o c k a d e i nH E R2-p o s i t i v e g a s t r i c c a n c e r[J].N a t u r e,2021,600(7890):727-730.[31]K AWA Z O E A,F U K U O K A S,N A K AMU R A Y,e t a l.L e n v a t i n i b p l u s p e m b r o l i z u m a b i n p a t i e n t s w i t h a d v a n c e dg a s t r i c c a n c e r i n t h e f i r s t-l i n e o r s e c o n d-l i n e s e t t i n g(E P-O C1706):a n o p e n-l a b e l,s i n g l e-a r m,p h a s e2t r i a l[J].L a n c e t O n c o l,2020,21(8):1057-1065.[32]F U K U O K A S,HA R A H,T A K A HA S H I N,e t a l.R e g o-r a f e n i b p l u s n i v o l u m a b i n p a t i e n t s w i t h a d v a n c e d g a s t r i c o r c o l o r e c t a l c a n c e r:a n o p e n-l a b e l,d o s e-e s c a l a t i o n,a n dd o s e-e x p a n s i o n p h a s eⅠb t r i a l(R E G O N I V O,E P O C1603)[J].J C l i n O n c o l,2020,38(18):2053-2061.[33]王雅坤,张小田.胃癌免疫治疗:突破后的挑战[J].循证医学,2021,21(05):257-261.[34]HO N G S,B I M,Y U H,e t a l.R a d i a t i o n t h e r a p y e n h a n c e d t h e r a p e u t i c e f f i c a c y o f a n t i-P D1a g a i n s t g a s t r i c c a n c e r[J]. J R a d i a t R e s,2020,61(6):851-859.[35]K AWA Z O E A,Y AMA G U C H I K,Y A S U I H,e t a l.S a f e-t y a n d e f f i c a c y o f p e m b r o l i z u m a b i n c o m b i n a t i o n w i t h S-1 p l u s o x a l i p l a t i n a s a f i r s t-l i n e t r e a t m e n t i n p a t i e n t s w i t h a d v a n c e d g a s t r i c/g a s t r o e s o p h a g e a l j u n c t i o n c a n c e r:c o h o r t 1d a t a f r o m t h e K E Y N O T E-659p h a s e I I b s t u d y[J].E u r J C a n c e r,2020,129:97-106.[36]S H I T A R A K,ÖZ GÜR OĜL U M,B A N G Y J,e t a l.P e m-b r o l i z u m a b v e r s u s p ac l i t a x e l f o r p r e v i o u s l y t r e a t e d,a d-v a n c e d g a s t r i c o r g a s t r o-o e s o p h a g e a l j u n c t i o n c a n c e r (K E Y N O T E-061):a r a n d o m i s e d,o p e n-l a b e l,c o n t r o l l e d, p h a s e3t r i a l[J].L a n c e t,2018,392(10142):123-133.[37]L E D T,O T T P A,K O R Y T OW S K Y B,e t a l.R e a l-w o r l d t r e a t m e n t p a t t e r n s a n d c l i n i c a l o u t c o m e s a c r o s s l i n e s o f t h e r a p y i n p a t i e n t s w i t h a d v a n c e d/m e t a s t a t i c g a s t r i c o rg a s t r o e s o p h a g e a l j u n c t i o n c a n c e r[J].C l i n C o l o r e c t a lC a n c e r,2020,19(1):32-38.(收稿日期:2023-09-16修回日期:2023-11-28)㊃314㊃检验医学与临床2024年2月第21卷第3期 L a b M e d C l i n,F e b r u a r y2024,V o l.21,N o.3。
2021NCCN胃癌诊疗指南2021.V1

1.不可切除的局部晚期、局部复发或转移性疾病;第三栏;补充建议,如果完成以上检查后上有充足的组织,可行二代测序(NGS)。 三、GAST-B 病理回顾和生物标志物检测原理(1/6)
Sakai D, Boku N, Kodera Y, et al. An intergroup phase III trial of ramucirumab plus irinotecan in third or more line beyond progression after ramucirumab for advanced gastric cancer (RINDBeRG trial). J Clin Oncol 2018;36, (15_suppl):TPS4138. Marabelle A, Fakih M, Lopez J, et al. Association of tumour mutational burden with outcomes in patients with advanced solid tumours treated with pembrolizumab: prospective biomarker analysis of the multicohort, open-label, phase 2 KEYNOTE-158 study. Lancet Oncol 2020;21:1353-1365. Marabelle A, Le DT, Ascierto PA, et al. Efficacy of pembrolizumab in patients with noncolorectal high microsatellite instability/mismatch repair-deficient cancer: results from the phase II KEYNOTE-158 study. J Clin Oncol 2020;38:1-10. 七、GAST-I 生存原则 1.疾病或治疗的长期后遗症管理 在化疗诱导的神经病变下,新增了新的菱形子项目:考虑将有跌倒风险的化疗诱导的神经病变患者转诊至职业、康复和/或物理治疗。
胃癌的分级——精选推荐

胃癌的分级《胃癌研究总则》第1版于1963年由⽇本胃癌研究会(Japanese1Research1Society1for1Gastric1Cancer,lJRSGC)出版。
《⽇本胃癌分级》英⽂版第2版是基于⽇⽂版第13版修订⽽成的,l其⽬的是为胃癌的临床、i病理描述提供⼀个通⽤的语⾔,l有助于提⾼胃癌的诊断和治疗⽔平。
(⼀)总则所见⽤⼤写字母表⽰:iT(肿瘤侵犯深度)、iN(淋巴结转移)、iH(肝转移)、iP(腹膜转移)和M(远处转移)。
字母后标以阿拉伯数字表⽰每种所见的范围。
不明确病例以“X”表⽰。
所见分成四个类别,l即临床、i⼿术、i病理的和最终所见,l分别⽤加在⼤写字母前的⼩写字母c、is、ip和f表⽰。
⾄于同时多原发癌,l以侵犯胃壁最深的肿瘤为准。
1.临床所见:i诊断评价中的任何所见,l包括诊断性腹腔镜,l都被定义为临床所见。
记录为cT2、i1cNl、icM0、iⅢ期c。
2.⼿术所见:i任何术中所见,l包括冰冻切⽚、i细胞学以及切除标本的⼤体检查,l都被定义为术中所见。
治疗性腹腔镜的结果也包括在术中所见之中。
3.病理所见:i内镜、i腹腔镜或⼿术切除所得材料任何镜下所见都被定义为病理所见。
4.最终所见:i基于临床、i⼿术和病理的综合所见被定义为最终所见。
当⼿术和病理所见相⽭盾时,l以病理所见为准。
(⼆)原发病变1.肿瘤位置11每个原发病变都应记录其⼆维的最⼤值。
解剖上胃可分为三个部分:i上(U)、i中(M)和下(L)区。
如果多于⼀个区受累,l所有受累的分区都要按受累程度描述,l肿瘤主体所在的部位列在最前,l如LM或UML。
肿瘤侵及⾷管或⼗⼆指肠的,l分别记作E或D。
胃的横断⾯可分为四等分:i⼩弯和⼤弯,l前壁和后壁,l全周的受累记作“Circ”。
残胃癌的记录要求按下列三个项⽬以连字符相连:i①上次胃切除的原因:i良性病变(B)、i恶性病变(M)或未知的(X)。
②上次胃切除术⾄当前诊断之间相隔年数(未知:iX)。
《基于PD-L1蛋白表达水平的胃癌免疫治疗专家共识(2023年版)》要点

《基于PD-L1蛋白表达水平的胃癌免疫治疗专家共识(2023年版)》要点1 PD-L1蛋白表达检测在胃癌治疗中的总体原则难点1:胃癌领域PD-L1表达判读标准的选择推荐意见1:推荐使用CPS作为胃癌评分指标。
(证据等级:高;推荐级别:高推荐;专家组赞同率:完全同意87.5%,基本同意12.5%)推荐意见2:因目前配套相应设施医院单位较少,临床普及率较低,不常规推荐使用肿瘤区域阳性评分(TAP)作为胃癌评分指标。
(证据等级:高;推荐级别:弱推荐;专家组赞同率:完全同意55.4%,基本同意37.5%)推荐意见3:不常规推荐采用肿瘤比例评分(TPS)作为胃癌评分指标。
(证据等级:低;推荐级别:强推荐;专家组赞同率:完全同意81.2%,基本同意18.7%)推荐意见4:推荐PD-L1 CPS≥5分作为胃癌患者PD-L1高表达诊断阈值。
(证据等级:高;推荐级别:强推荐;专家组赞同率:完全同意81.2%,基本同意18.7%)难点2: PD-L1表达判读方式的选择推荐意见5:免疫组织化学结果判读主要通过人为及半定量判断,存在主观性。
建议在有资质的病理科/实验室由经过PD-L1判读培训合格的病理医师进行诊断,且可使用相同检测方法在多个中心实验室抽样比对以确定检测结果可信度。
(证据等级:高;推荐级别:强推荐;专家组赞同率:完全同意85.7%,基本同意12.5%)推荐意见6:有条件的中心实验室,可考虑采用视觉图像软件对PD-L1染色的面积进行机器读片评估,增加判读速度及重复性。
(证据等级:中;推荐级别:弱推荐;专家组赞同率:完全同意53.6%,基本同意41.1%)难点3: PD-L1检测试剂和平台的选择推荐意见7:PD-L1检测应选用获得认证的抗体与平台,确保检测结果的可靠性。
推荐选用22C3抗体试剂、28-8抗体试剂、SP263抗体试剂用于胃癌PD-L1检测。
(证据等级:高;推荐级别:强推荐;专家组赞同率:完全同意93.7%,基本同意6.2%)推荐意见8:推荐检测报告上注明选用的抗体试剂、平台、CPS具体原始值,若用于伴随诊断,须注意试剂和平台的对应性。
胃癌免疫治疗疗效评估标准

胃癌免疫治疗疗效评估标准
胃癌免疫治疗疗效评估标准通常包括以下几个方面:
1.肿瘤客观反应率(ORR):评估肿瘤缩小或消失的比例,通常使用RECIST(Response Evaluation Criteria in Solid Tumors)或irRECIST (Immune-Related Response Criteria in Solid Tumors)标准进行评估。
2.无进展生存期(PFS):评估治疗后肿瘤无进展的时间长度。
3.总生存期(OS):评估患者从治疗开始到死亡的时间长度。
4.免疫相关反应:评估免疫治疗引起的免疫相关不良事件,如皮肤反应、胃肠道反应等。
5.生物标志物:评估治疗前后肿瘤组织或血液中生物
标志物的变化,如PD-L1表达水平、肿瘤突变负荷等。
需要注意的是,不同的临床试验和研究可能会使用不同的评估标准,具体评估标准应根据具体情况进行选择。
此外,胃癌免疫治疗的疗效评估还需要结合患者的临床症状、体能状态和生活质量等因素进行综合评估。
PD-1PD-L1免疫治疗的各种副作用分级标准详细说明

PD-1PD-L1免疫治疗的各种副作用分级标准详细说明在癌症治疗里,自然而然会产生副作用,无论是化疗、靶向治疗还是现在流行的免疫治疗(PD-1/PD-L1)或者更先进的CAR-T、TCR-T之类的基因疗法,都有副作用,副作用存在于多个方面,主要体现在:皮肤毒性腹泻与结肠炎肝脏毒性免疫治疗肺炎内分泌系统毒性相关不良反应通常分为1-4级,当然,有的则是分为3级或者轻度、中度和重度;皮肤毒性分级 - 分为4级,分别是1-4级:1级 - 可不予理会或局部外用糖皮质激素、口服止痒剂,例如:抗组胺药物,NK-1受体抑制剂等,可进行持续免疫治疗;2级 - 可在改善后恢复免疫治疗,但连续治疗12周后病情依然没有改善,则应停止免疫治疗;3级- 因暂停PD-1/PD-L1抑制剂,并请皮肤科进行皮肤病学评估,包括临床评估、皮肤活检等,治疗上则口服泼尼松(1mg/kg - QD),必要时静脉给药治疗,直到毒性严重程度小于等于1级后。
如果48小时内持续恶化,则考虑家用免疫抑制剂,例如:英夫利昔单抗、环磷酰胺、霉酚酸酯等;腹泻与结肠炎分级 - 分为3级,分别是1-3级:1级 - 小于等于每天4次,予以结肠炎饮食与胃肠动力抑制剂,例如:盐酸哌罗丁胺或复方地芬诺酯口服。
调整饮食并用止泻药2~3天后如症状持续但没有加重则可应用布地奈德;2级 - 大于每天4次小于等于6次,一旦出现镜下明确结肠炎则应暂停PD-1/PD-L1抗体,立即进行糖皮质激素1-2mg/kg QD治疗;3级 - 大于7次以上或存在其它并发症,应该用就停止免疫检查点抑制剂治疗,并予以大剂量糖皮质激素(2-4mg/kg QD)治疗。
如果持续糖皮质激素三天后依然无改善,则应每2周加用一次英夫利昔单抗,如英夫利昔单抗耐药则考虑麦考酚酯;肝脏毒性分级 - 分为4级,分别是1-4级:1级 - 无症状,ALT或AST小于等于2.5* ULN,总胆红素小于等于1.5*ULN。
胃腺癌组织中PD-L1与HER-2的表达及临床意义

网络出版时间:2020-6-2813:40 网络出版地址:https://kns.cnki.net/kcms/detail/34.1073.R.20200628.0848.002.html胃腺癌组织中PD L1与HER 2的表达及临床意义廉 洁,南鹏飞,张冠军,张 昀摘要:目的 观察胃腺癌中PD L1的表达,分析PD L1与HER 2表达的相关性及对预后的影响。
方法 收集西安交通大学第一附属医院存档的75例胃腺癌标本,采用免疫组化MaxVision法及FISH技术检测PD L1、HER 2的表达。
结果 75例胃腺癌中,PD L1阳性43例,阳性率为57 3%,HER 2过表达13例,过表达率为17 3%。
胃腺癌中PD L1表达与分化程度呈负相关(r=-0 26,P<0 05);相关性分析显示,PD L1表达与HER 2表达呈正相关(r=0 25,P=0 029)。
生存分析中HER 2及PD L1不同表达组中HER 2过表达PD L1阳性组的5年生存率最低,且HER 2表达是影响胃腺癌患者生存期的独立预后因素。
结论 PD L1相关治疗可成为胃腺癌治疗的新靶点。
在胃腺癌中联合应用PD L1与抗HER 2治疗可能成为胃腺癌治疗的新途径。
关键词:胃肿瘤;胃腺癌;PD L1;HER 2;免疫组织化学;FISH中图分类号:R735 2 文献标志码:A 文章编号:1001-7399(2020)06-0636-06doi:10.13315/j.cnki.cjcep.2020.06.002接受日期:2020-02-06作者单位:西安交通大学第一附属医院病理科,西安 710061作者简介:廉 洁,女,硕士,医师。
Tel:(029)85323251,E mail:lianjiejzxp@163.com张冠军,男,博士,主任医师,硕士生导师,通讯作者。
Tel:(029)85323251,E mail:zgjdoc@163.com 胃腺癌是全球最常见且是一类分子水平高度异质的恶性肿瘤。
还分不清CPS、TPS、IPS?PD-L1表达指标,一文总结!

还分不清CPS、TPS、IPS?PD-L1表达指标,一文总结!前段时间,在《ESCORT-1st 研究,为何成为食管鳞癌免疫治疗领域的转折点?》这篇文章中,给大家搞了个关于 CPS 评分的投票:(红框为正确选项)有读者在后台留言希望我们出篇文章讲一讲关于PD-L1 表达水平的评价标准的文章,留言区征集意见得到大家的热情点赞(点赞很好,今天继续)!文章今天就给大家安排上!(正文开始,正经学习 )虽然说名义上现在已经进入肿瘤免疫治疗时代,但事实上直到现在还没有一个很好的biomarker 能预测免疫治疗的疗效。
矮子里面拔将军,PD-L1 表达应该是现阶段官方和大家都认可度比较高的biomarker 了。
由于历史发展的各种原因,PD-L1 表达在指南和药品说明书中出现了多种表达方式:TPS、CPS、IPS、TC、IC,今天我们区分解读一下 PD-L1 表达各种 biomarker 含义。
TPS英文:Tumor cell Proportion Score中文:肿瘤细胞阳性比例分数定义:任何强度 PD-L1 膜染色肿瘤细胞占肿瘤细胞的百分比计算方法:CPS英文:Combined Positive Score中文:联合阳性分数定义:每 100 个肿瘤细胞中 PD-L1 染色的肿瘤细胞和肿瘤相关的免疫数之和计算方法:IPS英文:Immune cell Proportion Score中文:免疫细胞阳性比例分数定义:任何强度PD-L1 膜和胞浆染色肿瘤相关免疫细胞占所有肿瘤相关免疫细胞百分比计算方法:TC英文:Tumor cell其他意义:同 TPSIC英文:Immune cell其他意义:同 IPS只看定义大家可能还是不太理解,也不好记忆,我们来实操一下 TPS,CPS,IPS 实际应用举例假定某肿瘤组织中肿瘤细胞为 100 个,肿瘤相关免疫细胞 100 个,PD-L1 染色的肿瘤细胞有60 个,PD-L1 染色的肿瘤相关免疫细胞有30 个,计算此肿瘤组织 TPS,CPS,IPS。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PDL1在胃癌中的表达标准,需要根据PD-L1 CPS评分来判定。
CPS评分即综合阳性评分,是PDL1染色阳性的肿瘤细胞、内皮细胞和淋巴细胞的百分比总分,具体计算方式为:肿瘤细胞染色评分×阳性细胞百分比+内皮细胞染色评分×阳性细胞百分比+淋巴细胞染色评分×阳性细胞百分比。
一般来说,CPS评分越高,患者接受免疫治疗的疗效越好。
根据CPS评分,可以将患者分为CPS≥100、CPS≥50且<100、CPS≥20且<50以及CPS<20四个等级。
其中,CPS≥100的患者接受免疫治疗的效果最佳,预后也最好。
请注意,以上信息仅供参考,具体的PDL1胃判读标准需要根据患者的具体情况和医生的建议来确定。
