2021届高三化学一轮复习——无机物制备流程题(知识精讲与训练)
2021届高三化学一轮复习高考热点问题——无机物制备流程题(有答案和详细解析)
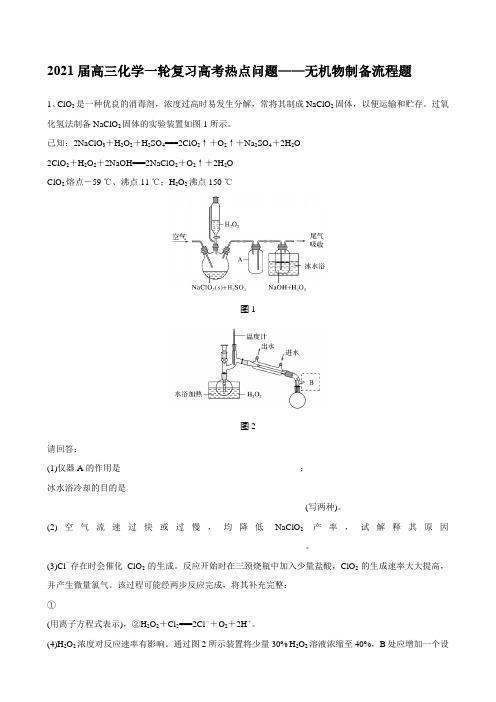
2021届高三化学一轮复习高考热点问题——无机物制备流程题1、ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。
过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2OClO2熔点-59 ℃、沸点11 ℃;H2O2沸点150 ℃图1图2请回答:(1)仪器A的作用是_________________________________________;冰水浴冷却的目的是____________________________________________________________________________________________________(写两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因___________________________________________________________。
(3)Cl-存在时会催化ClO2的生成。
反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。
该过程可能经两步反应完成,将其补充完整:①___________________________________________________________(用离子方程式表示),②H2O2+Cl2===2Cl-+O2+2H+。
(4)H2O2浓度对反应速率有影响。
通过图2所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备。
该设备的作用是_______________________,馏出物是________。
(5)抽滤法分离NaClO2过程中,下列操作不正确的是________。
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀C.洗涤沉淀时,应使洗涤剂快速通过沉淀D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头答案(1)作安全瓶,防止倒吸防止ClO2挥发,防止双氧水分解(2)空气流速过快反应不充分,空气流速过慢,ClO2浓度过高易发生分解(3)2ClO-3+2Cl-+4H+===2ClO2↑+Cl2↑+2H2O(4)降低体系压强,减少双氧水分解H2O(5)C2、实验小组制备高铁酸钾(K2FeO4)并探究其性质。
2021届高三化学一轮复习高考热点问题——无机物制备流程题(有答案和详细解析)

2021届高三化学一轮复习高考热点问题——无机物制备流程题1、醋酸亚铬水合物{[Cr(CH3COO)2]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。
实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。
已知二价铬不稳定,极易被氧气氧化,不与锌反应。
制备过程中发生的相关反应如下:Zn(s)+2HCl(aq)===ZnCl2(aq)+H2(g)2CrCl3(aq)+Zn(s)===2CrCl2(aq)+ZnCl2(aq)2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)===[Cr(CH3COO)2]2·2H2O(s)请回答下列问题:(1)仪器1的名称是________。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是______________(填字母);目的是________________________________。
A.盐酸和三氯化铬溶液同时加入B.先加三氯化铬溶液一段时间后再加盐酸C.先加盐酸一段时间后再加三氯化铬溶液(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭止水夹________(填“A”或“B”,下同),打开止水夹________。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3中与CH3COONa溶液反应外,另一个作用是__________________________________。
(5)已知其他反应物足量,实验时取用的CrCl3溶液中含溶质9.51 g,取用的醋酸钠溶液为1.5L0.1mol·L-1;实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O9.48g,则该实验所得产品的产率为________(不考虑溶解的醋酸亚铬水合物)。
[思路分析](1)实验过程分析:①Cr2+不稳定,极易被O2氧化,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的Cr2+被氧化;②还有一个作用是利用生成氢气,使装置内气压增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合;③装置2中锌粒要过量,除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是:过量的锌与CrCl3充分反应得到CrCl2。
第28讲 物质的制备-2021年高考化学一轮复习名师精讲练

2.从海水中提取镁
冶炼原理
MgCl2(熔融) Mg+Cl2↑
蒸发浓缩:海水中含有 MgCl2,但丰度(浓度)太低,所以要富集
分离 、 提 纯 : 海水中除含有 MgCl2 外,还含有 Na+、K+、Ca2+。、S042-、 Cl-、Br-、I-等其他可溶性离子,所以还要还要分离 、 提 纯 。 可以用价格
二、有机物制备
近几年“有机”实验题在全国卷中频频出现,试题以有机化合物的制备为载体考查常见化学实验仪器的使
用方法,物质的分离、提纯等基本实验操作和注意事项,以及实验条件的控制等,重点考察物质分离中的
蒸馏、分液操作,反应条件的控制,产率的计算等问题。解答此类实验题,首先明确有机化合物间的转化
反应、反应的条件、可能发生的副反应、以及反应物和产物的性质,然后结合化学实验中基本操作(如分液、
2.操作要点
操作
要点
酒精灯加热。酒精灯的火焰温度一般在 400~500 ℃,所以需要温度不太高的实验都可 用酒精灯加热。教材中用酒精灯加热的有机实验有:“乙酸乙酯的制取实验”、“石油的
蒸馏实验”和“石蜡的催化裂化实验”
酒精喷灯加热。酒精喷灯的火焰温度比酒精灯的火焰温度要高得多,所以需要较高温
加热
度的有机实验可采用酒精喷灯加热。教材中用酒精喷灯加热的有机实验是“煤的干馏实
根据反应物及生成物的特点、反应条件等因素确定反应装置。制备气体的实验装
反应装置的设计
置应包括发生装置→净化与干燥装置→收集装置→尾气处理装置。在有机化学反 应中,由于某些原料的沸点较低,副反应比较多,常使用温度计和水浴加热,在
反应装置中有冷凝回流装置
产品的分离提纯 要根据产品的性质选择合适的分离提纯方案
2021届高考一轮(人教版)化学:无机化工工艺流程附答案

2021届高考一轮(人教版)化学:无机化工工艺流程附答案一轮复习:无机工艺流程【试一试】KNO3是重要的化工产品,下面是一种已获得专利的KNO3制备方法的主要步骤:(1)反应Ⅰ中,CaSO4与NH4HCO3的物质的量之比为1∶2,该反应的化学方程式为___________________________________________________。
(2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是__________________________________________________________;从反应Ⅳ所得混合物中分离出CaSO4的方法是趁热过滤,趁热过滤的目的是_________________________________________________________________。
(3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法:取少量K2SO4样品溶解于水,__________________________________________________________。
【答案】(1)CaSO4+2NH4HCO3===CaCO3↓+(NH4)2SO4+H2O+CO2↑(2)分离NH4Cl与K2SO4,加快化学反应速率防止KNO3结晶,提高KNO3的产率(3)加入Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液中滴加AgNO3溶液,若有沉淀生成,说明K2SO4中混有KCl【解析】(1)反应Ⅰ中,CaSO4与NH4HCO3的物质的量之比为1∶2,由流程图可知生成CaCO3、(NH4)2SO4和CO2,由质量守恒可知反应的化学方程式为CaSO4+2NH4HCO3===CaCO3↓+(NH4)2SO4+H2O+CO2↑。
(2)(NH4)2SO4加入KCl,在干态、加热的条件下进行,可生成易分解的氯化铵,加热时氯化铵分解生成氯化氢和氨气,温度降低又生成氯化铵,以此可分离出氯化铵,得到硫酸钾,且能加快反应的速率;从反应Ⅳ所得混合物中分离出CaSO4的方法是趁热过滤,趁热过滤的目的是防止KNO3结晶,提高KNO3的产率。
2021届高三化学一轮复习每天练习20分钟——常见无机实验和物质制备(有答案和详细解析)

2021届高三化学一轮复习每天练习20分钟——常见无机实验和物质制备(有答案和详细解析)1.(2019·安徽十校联考)高纯氧化铁是现代电子工业的重要材料。
如图是用硫酸厂产生的烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁αFe2O3)的生产流程示意图。
下列说法不正确的是()A.酸溶时,常需将烧渣粉碎、并加入过量H2SO4,其目的是提高铁元素的浸出率,同时抑制铁离子的水解B.反应②的离子方程式为FeS2+14Fe3++8H2O===15Fe2++2SO2-4+16H+C.加入NH4HCO3生成FeCO3,检验FeCO3是否洗涤干净的方法是取最后一次洗涤液少量放入试管,滴加盐酸酸化的氯化钡溶液,若无沉淀生成说明洗涤干净D.煅烧时空气中的氧气作氧化剂,所以用氯气代替空气也可得到高纯氧化铁2.实验室用有机含碘(主要以I2和IO-3的形式存在)废水制备单质碘的实验流程如图:已知:Ⅰ.碘的熔点为113 ℃,但固态的碘可以不经过熔化直接升华;Ⅱ.粗碘中含有少量的Na2SO4杂质。
下列说法正确的是()A.操作①和③中的有机相从分液漏斗上端倒出B.操作②中发生反应的离子方程式为IO-3+3SO2-3===I-+3SO2-4C.操作④为过滤D.操作⑤可用如图所示的水浴装置进行3.实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl。
某学生设计了如图方案:如果此方案正确,那么:(1)操作①可选择的仪器为________________。
(2)操作②是否可改为加Ba(NO 3)2溶液____________(填“是”或“否”),原因是___________ _______________________________________________________________________________。
(3)进行操作②后,判断SO 2-4已除尽的方法是__________________________________________ _______________________________________________________________________________。
2021年高考化学一轮总复习 专题强化训练(10)无机化工生产流程题的解题策略(含解析)

2021年高考化学一轮总复习专题强化训练(10)无机化工生产流程题的解题策略(含解析)1.(14分)(xx·聊城模拟)某化学兴趣小组利用某废弃的氧化铜锌矿制取活性ZnO,实验流程如下:请回答下列问题:(1)加入铁粉后发生反应的离子方程式为________________________________,_______________________________________。
(2)甲、乙两同学选用下列仪器,采用不同的方法制取氨气。
①甲同学使用的药品是熟石灰与氯化铵,则应选用装置______(填写装置代号),生成氨气的化学方程式为_____________________________________________;②乙同学选用了装置B,则使用的两种药品的名称为_________。
(3)H2O2的作用是_________________。
(4)除铁过程中得到的Fe(OH)3可用KClO溶液在碱性环境下将其氧化,得到一种高效的多功能水处理剂(K2FeO4),该反应中氧化剂与还原剂的物质的量之比为________。
(5)已知溶液a中含有C、S两种酸根阴离子,若只允许取用一次样品,检验这两种离子存在的实验操作过程为_______________________________。
【解析】(1)氧化铜锌矿与稀硫酸发生反应变为可溶性的ZnSO4、CuSO4;难溶性的物质过滤除去;然后向滤液中加入铁粉,发生反应:Fe+Cu2+Fe2++Cu;Fe+2H+Fe2++H2↑;过滤得到海绵铜,向滤液中加入H2O2,把Fe2+氧化为Fe3+,然后向溶液中通入氨气,调整溶液的pH使Fe3+形成Fe(OH)3沉淀而过滤除去。
(2)①甲同学使用的药品是熟石灰与氯化铵,用固体与固体混合加热制取气体,应该选择装置A;生成氨气的化学方程式是2NH4Cl+Ca(OH)22NH3↑+2H2O+CaCl2;②乙同学选用了装置B,应该是液体与固体不加热制取气体,则使用的两种药品的名称为浓氨水和生石灰(或碱石灰、氢氧化钠固体)。
2021届高考化学一轮复习题型突破:无机工业流程 (解析版)

无机工业流程题1.化学来源于生活又服务于生活,化工生产是指对原料进行化学加工,最终获得有价值的产品的生产过程。
某研究小组利用含硫酸亚铁和硫酸铜的工业废料制备铁红(氧化铁)和硫酸铵晶体。
流程如下:请回答下列问题:(1)操作I的名称________________,滤渣的成分为__________________。
(2)简述下列实验操作:①检验溶液A中金属阳离子的方法为____________________________________________________;②检验固体B是否洗涤干净的方法是____________________________________________________。
(3)请写出溶液A中反应的离子方程式_______________________________________________________(4)测定废料中硫酸铜的质量分数:称取a g废料样品,将操作I得到的滤渣用足量的稀硫酸溶解、过滤、洗涤、干燥,称得固体的质量为b g,则废料中硫酸铜的质量分数为_______________(写出表达式。
)(5)某同学提出另一种制备铁红的方法:往工业废水中加入足量的硫酸和双氧水,通过下列操作也可以得到铁红,请配平下列离子方程式_____ Fe2++ _____ H2O2 + _____ H+= _____ Fe3+ + ____ H2O【答案】(1)过滤 Fe(2) Cu 取少量液体于试管中,滴加少量的酸性高锰酸钾溶液,若高锰酸钾的紫红色褪去,证明含有Fe2+ ;(3)取最后一次洗涤液少许于试管中,加入氯化钡溶液,若无白色沉淀生成,则已洗涤干净(4) 10H2O+ 8NH3 +O2 + 4Fe2+ = 4 Fe(OH)3 + 8NH4+ (5b/2a)×100% (5) 2 1 2 2 2【解析】硫酸亚铁和硫酸铜中加入硫酸和过量的铁粉,铁和硫酸铜反应置换出铜,所以溶液A为硫酸亚铁,滤渣为铁和铜。
2021届高考化学一轮专项提升:无机化工流程(解析版)

无机化工流程1.重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。
制备流程如图所示:回答下列问题(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3−−−→高温 Na2CrO4+ Fe2O3+CO2+ NaNO2。
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。
该步骤不能使用陶瓷容器,原因是__ 。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是________及含硅杂质。
(3)步骤④调滤液2的pH使之变___(填“大”或“小”),原因是_________ __(用离子方程式表示)。
(4)有关物质的溶解度如图所示。
向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。
冷却到___________(填标号)得到的K2Cr2O7固体产品最多。
a.80℃b.60℃c.40℃d.10℃。
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为______。
【答案】(1)2∶7 陶瓷在高温下会与Na 2CO 3反应 (2)铁 Al(OH)3 (3)小 224CrO -+2H +227Cr O -+H 2O (4)d 复分解反应 (5)21190147m m ×100%【解析】 (1)步骤①的主要反应为:FeO ·Cr 2O 3+Na 2CO 3+NaNO 3−−−→高温Na 2CrO 4+ Fe 2O 3+CO 2+NaNO 2。
依据得失电子守恒进行配平,FeO ·Cr 2O 3与NaNO 3的系数比为2:7。
该反应有Na 2CO 3参与反应,不能使用SiO 2及硅酸盐产品。
(2)依据化学反应,可知水溶之后的滤渣只要为Fe 2O 3,主要含有Fe 。
2021届全国新高三化学精品备考 无机化学工艺流程

反应条件 的控制
核心 化学反应
循环利用
产品分离、提纯
目的 所需产品 副产品
主线主产品,副线副产品,回头为循环
chemistry: Not only a science, but also an Art!
2021一轮复习
化工流程题涉及考点
(1)原料的预处理。 (2)反应条件的控制(①pH的控制 ②温度的控制 ③压强的控制 ④化学反应中某试剂加过量的作用 ⑤蒸发、反应时的气体氛围)。
(2010江苏卷·16) 钡盐行业生产中排出大量的钡 泥[主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2 等]。某主要生产BaCl2、BaCO3、BaSO4的化工厂 利用钡泥制取Ba(NO3)2,其部分工艺流程如下:
(2)酸溶时通常控制反应温度不超过70 ℃,且不
使用浓硝酸,原因是 防止反应速率过快 、
2021一轮复习
2021届全国新高三化学精品备考 无机化学工艺流程题
化工流程图题是近几年的高考热点,以真实 的化工生产为背景、化工流程为载体、中学化学 元素化合物知识为基础,联系化学实验基本操作、 化学反应原理和化学计算等知识考查学生的综合 分析能力。
chemistry: Not only a science, but also an Art!
2021一轮复习
一、题型结构 题头:介绍该工艺生产的原材料、目的、原理。 题干:用框图形式将物质转换或分离提纯等主要
生产工艺流程表示出来。
题尾:流程中涉及到的化学知识的补充(尤为重要)
chemistry: Not only a science, but also an Art!
2021一轮复习
原料预处理
无机化工流程题的解题策略(练)高考化学一轮复习讲练测(全国通用)(解析版)

专题讲座(八) 无机化工流程题的解题策略第一部分:高考真题感悟1.(2021·福建·高考真题)明代《徐光启手迹》记载了制备硝酸的方法,其主要流程(部分产物已省略)如下:下列说法错误..的是 A .FeSO 4的分解产物X 为FeOB .本流程涉及复分解反应C .HNO 3的沸点比H 2SO 4的低D .制备使用的铁锅易损坏【答案】A【解析】A .据图可知FeSO 4分解时生成SO 2和SO 3,部分S 元素被还原,则Fe 元素应被氧化,X 为Fe 2O 3,A 错误;B .H 2SO 4与KNO 3在蒸馏条件下生成HNO 3和K 2SO 4,为复分解反应,B 正确;C .H 2SO 4与KNO 3混合后,蒸馏过程中生成HNO 3,说明HNO 3的沸点比H 2SO 4的低,C 正确;D .硫酸、硝酸均可以和铁反应,所以制备使用的铁锅易损坏,D 正确;综上所述答案为A 。
2.(2020·山东·高考真题)以菱镁矿(主要成分为MgCO 3,含少量SiO 2,Fe 2O 3和A12O 3)为原料制备高纯镁砂的工艺流程如下:已知浸出时产生的废渣中有SiO 2,Fe(OH)3和Al(OH)3。
下列说法错误的是A .浸出镁的反应为4232MgO+2NH Cl=MgCl +2NH +H OB .浸出和沉镁的操作均应在较高温度下进行C .流程中可循环使用的物质有NH 3、NH 4ClD .分离Mg 2+与Al 3+、Fe 3+是利用了它们氢氧化物K sp 的不同【答案】B【解析】菱镁矿煅烧后得到轻烧粉,MgCO 3转化为MgO ,加入氯化铵溶液浸取,浸出的废渣有SiO 2、Fe(OH)3、Al(OH)3,同时产生氨气,则此时浸出液中主要含有Mg 2+,加入氨水得到Mg(OH)2沉淀,煅烧得到高纯镁砂。
A.高温煅烧后Mg元素主要以MgO的形式存在,MgO可以与铵根水解产生的氢离子反应,促进铵根的水解,所以得到氯化镁、氨气和水,化学方程式为MgO+2NH4Cl=MgCl2+2NH3↑+H2O,故A正确;B.一水合氨受热易分解,沉镁时在较高温度下进行会造成一水合氨大量分解,挥发出氨气,降低利用率,故B 错误;C.浸出过程产生的氨气可以回收制备氨水,沉镁时氯化镁与氨水反应生成的氯化铵又可以利用到浸出过程中,故C正确;D.Fe(OH)3、Al(OH)3的K sp远小于Mg(OH)2的K sp,所以当pH达到一定值时Fe3+、Al3+产生沉淀,而Mg2+不沉淀,从而将其分离,故D正确;故答案为B。
2021届高考(一轮)化学:无机工艺流程训练题附答案

2021届高考(一轮)化学:无机工艺流程训练题附答案*无机工艺流程*1、从某含有FeCl2、 FeCl,、CuCl 的工业废液中回收铜并制备氯化铁晶体的流程如下:则下列说法正确的是( )A.试剂a 是铁、试剂b 是稀硫酸B.操作Ⅰ、操作Ⅱ、操作Ⅲ所用的仪器完全相同C.试剂c 是氯气,相应的离子反应为2Fe 2++Cl 22Cl -+2Fe 3+D.用KSCN 溶液可检验溶液W 中是否有Fe 2+答案:C解析:试剂a 是铁,加入过量的铁,可把铜全部置换出来,并把FeCl 3还原为FeCl 2,则通过过滤操作Ⅰ得到的滤液X 为FeCl 2溶液,滤渣Y 为铜和过量的铁;由于最终得到的产品是FeCl 3晶体,故试剂b 是稀盐酸,铜不与盐酸反应,铁与盐酸反应生成FeCl 2,故通过过滤操作Ⅱ可得到铜单质,滤液Z 为FeCl 2溶液,在两次过滤得到的FeCl 2液中通入氯气.发生反应: 2FeCl 2+Cl 2=2FeCl 3,将FeCl 2转化为FeCl 3,然后通过操作Ⅲ(蒸发结晶)便可得到氯化铁晶体,蒸发结晶与过滤所使用的仪器不完全相同,故A 、B 项错误,C 项正确:KSCN 溶液不可用来检验Fe 2+,D 项错误2、利用自然资源制备相关化学物质,下列化工生产不可行的是( )A .FeS 2――→O 2高温SO 2――→H 2O H 2SO 3――→O 2H 2SO 4 B .石英砂――→焦炭高温粗硅――→Cl 2粗SiCl 4――→分馏提纯H 2/高温高纯硅 C .提取食盐后的母液――→Cl 2含Br 2的液体――→热蒸气――→冷凝粗Br 2 ――→NaBr (s )蒸馏Br 2 D .铝土矿――→1)NaOH (aq )2)过滤NaAlO 2(aq)――→1)CO 22)过滤Al(OH)3――→煅烧Al 2O 3――→冰晶石电解Al【答案】 A【解析】A项不可用于化工生产,应为FeS2――→O2SO2――→O2SO3――→H2OH2SO4。
2021届高三化学大一轮复习课件——“无机化学工艺流程”题的解题策略(共40张PPT)

[典例1] (2020·山东新高考模拟)普通立德粉(BaSO4·ZnS) 广泛用于工业生产中,可利用ZnSO4和BaS共沉淀法制备。以 粗氧化锌(含Zn、CuO、FeO等杂质)和BaSO4为原料制备立德 粉的流程如下:
(1)生产ZnSO4的过程中,反应器Ⅰ要保持强制通风,原因是 ___________________________________________________。
类型二 以物质分离提纯为主体的化工流程
1.常用的提纯方法
水溶法
除去可溶性杂质
酸溶法
除去碱性杂质
碱溶法
除去酸性杂质
氧化剂或还原剂法
除去还原性或氧化性杂质
加热灼烧法
除去受热易分解或易挥发的杂质
调节溶液的 pH 法 如除去酸性 Cu2+溶液中的 Fe3+等
2.常用的分离方法
分离难溶物和易溶物,根据特殊需要采用趁热过滤 过滤
蒸馏或 分离沸点不同且互溶的液体混合物,如分离乙醇和
分馏 甘油
利用气体液化的特点分离气体,如合成氨工业采用 冷却法
冷却法分离平衡混合气体中的氨气
[注意] 物质分离提纯的原则 (1)不增:不引入新的杂质。 (2)不减:不减少被提纯的物质。 (3)易分离:被提纯物与杂质易于分离。 (4)易复原:被提纯的物质易恢复原来的组成、状态。
(2)物质的分离与提纯 通过调节 pH 使溶液中的金属离子沉淀达到分离除杂的目 的,据此选择需要加入的化学试剂;加入某种物质使难溶物 转化为更难溶的物质后,通过过滤除去等。
(3)化学反应速率与化学平衡理论的运用 例如,研磨使反应物颗粒变小,增大反应物间的接触面积, 从而增大反应速率,提高原料利用率;升高温度能增大反应 速率,使吸热反应平衡正向移动等。
2021届高三化学实验热点问题——无机物制备流程题学案及训练

2021届高三化学实验热点问题——无机物制备流程题学案及训练热点一无机物的制备知识梳理1.无机制备流程图题思维主线(1)规律:主线主产品,分支副产品,回头为循环(2)读流程图①箭头:箭头进入的是投料(反应物)、出去的是主产物或副产物(生成物)。
②三线:出线和进线均表示物料流向或操作流程,可逆线表示物质循环。
2.无机制备流程题中表述性词汇“八大答题方向”化工生产流程和综合实验题中经常会出现一些表述性词语,这些表述性词语就是隐性信息,它可以暗示我们所应考虑的答题角度。
常见的有:(1)“控制较低温度”——常考虑物质的挥发、物质的不稳定性和物质的转化等。
(2)“加过量试剂”——常考虑反应完全或增大转化率、产率等。
(3)“能否加其他物质”——常考虑会不会引入杂质或是否影响产品的纯度。
(4)“在空气中或在其他气体中”——主要考虑O2、H2O、CO2或其他气体是否参与反应或达到防氧化、防水解、防潮解等目的。
(5)“判断沉淀是否洗净”——常取少量最后一次洗涤液于试管中,向其中滴加某试剂,以检验其中的某种离子。
(6)“检验某物质的设计方案”——通常取少量某液体于试管中,加入另一试剂产生某现象,然后得出结论。
(7)“控制pH”——常考虑防水解、促进生成沉淀或除去杂质等。
(8)“用某些有机试剂清洗”——①降低物质溶解度有利于产品析出;②洗涤沉淀:减少损耗和提高利用率等。
3.常用的控制反应条件的方法(见220页)4.常用的分离方法(见221页)强化训练1.N2H4·H2O(水合肼)极毒且不稳定,100 ℃以上易分解失水,常用作还原剂和除氧剂(通常生成N2和H2O),其熔点为-40 ℃,沸点118.5 ℃。
现以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O和无水Na2SO3,其主要流程如下:已知:Cl2(g)+2OH-(aq)===ClO-(aq)+Cl-(aq)+H2O(l)ΔH<0(1)配制30%NaOH溶液时,所需玻璃仪器除量筒、烧杯外,还需要________(填字母)。
高三化学一轮复习《无机物制备流程题》强化训练(2021届)word版含答案

2021届高三化学一轮复习《无机物制备流程题》强化训练1.(2020·郑州市统一测试)As2O3在医药、电子等领域有重要应用。
某含砷元素(As)的工业废水经如下流程转化为粗As2O3。
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。
H3AsO4转化为Na3AsO4反应的化学方程式是_________________________________________________________________。
(2)“氧化”时,1molAsO3-3转化为AsO3-4至少需要O2______mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:a.Ca(OH)2(s)Ca2+(aq)+2OH-(aq) ΔH<0b.5Ca2++OH-+3AsO3-4Ca5(AsO4)3OH ΔH>0研究表明:“沉砷”的最佳温度是85℃。
用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因:__________________________________________________________________________________________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是________________________________________________________________________________________________________。
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。
As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示。
为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_____________________________________________________________________。
2021版新高考化学(人教版)一轮复习热点题型5 无机化学工艺流程题的解题策略

热点题型5无机化学工艺流程题的解题策略——科学探究与创新意识、科学态度与社会责任[热点精讲]一、无机化学工艺流程题的结构二、无机化学工艺流程题中表述性词汇“八大答题方向”化工生产流程和综合实验题中经常会出现一些表述性词语,这些表述性词语就是隐性信息,它可以暗示我们所应考虑的答题角度。
常见的有:1.“控制较低温度”——常考虑物质的挥发、物质的不稳定性和物质的转化等。
2.“加过量试剂”——常考虑反应完全或增大转化率、产率等。
3.“能否加其他物质”——常考虑会不会引入杂质或是否影响产品的纯度。
4.“在空气中或在其他气体中”——主要考虑O2、H2O、CO2、其他气体是否参与反应或达到防氧化、防水解、防潮解等目的。
5.“判断沉淀是否洗净”——常取少量最后一次洗涤液于试管中,向其中滴加某试剂,以检验其中的某种离子。
6.“检验某物质的设计方案”——通常取少量待检液体于试管中,加入另一试剂产生某现象,然后得出结论。
7.“控制pH”——常考虑防水解、促进生成沉淀或除去杂质等。
8.“用某些有机试剂清洗”——(1)降低物质溶解度,有利于产品析出;(1)洗涤沉淀:减少损耗,提高利用率等。
三、无机化学工艺流程题分类突破题型一物质制备类化工流程题1.核心反应——陌生方程式的书写关注箭头的指向:箭头指入→反应物,箭头指出→生成物。
(1)氧化还原反应:熟练应用氧化还原规律,判断产物并配平。
(2)非氧化还原反应:结合物质性质和反应实际情况判断产物。
2.对原料进行预处理的常用方法及其作用(1)研磨——减小固体的颗粒度,增大固体与液体或气体间的接触面积,加快反应速率。
(2)水浸——与水接触反应或溶解。
(3)酸浸——与酸接触反应或溶解,使可溶性金属进入溶液,不溶物通过过滤除去。
(4)灼烧——除去可燃性杂质或使原料初步转化,如从海带中提取碘时的灼烧就是为了除去可燃性杂质。
(5)煅烧——改变结构,使一些物质能溶解,并使一些杂质在高温下氧化、分解,如煅烧高岭土。
2021届高考(一轮)化学:无机工艺流程训练题附答案

2021届高考(一轮)化学:无机工艺流程训练题附答案*无机工艺流程*1、从某含有FeCl2、 FeCl,、CuCl 的工业废液中回收铜并制备氯化铁晶体的流程如下:则下列说法正确的是( )A.试剂a 是铁、试剂b 是稀硫酸B.操作Ⅰ、操作Ⅱ、操作Ⅲ所用的仪器完全相同C.试剂c 是氯气,相应的离子反应为2Fe 2++Cl 22Cl -+2Fe 3+D.用KSCN 溶液可检验溶液W 中是否有Fe 2+答案:C解析:试剂a 是铁,加入过量的铁,可把铜全部置换出来,并把FeCl 3还原为FeCl 2,则通过过滤操作Ⅰ得到的滤液X 为FeCl 2溶液,滤渣Y 为铜和过量的铁;由于最终得到的产品是FeCl 3晶体,故试剂b 是稀盐酸,铜不与盐酸反应,铁与盐酸反应生成FeCl 2,故通过过滤操作Ⅱ可得到铜单质,滤液Z 为FeCl 2溶液,在两次过滤得到的FeCl 2液中通入氯气.发生反应: 2FeCl 2+Cl 2=2FeCl 3,将FeCl 2转化为FeCl 3,然后通过操作Ⅲ(蒸发结晶)便可得到氯化铁晶体,蒸发结晶与过滤所使用的仪器不完全相同,故A 、B 项错误,C 项正确:KSCN 溶液不可用来检验Fe 2+,D 项错误2、利用自然资源制备相关化学物质,下列化工生产不可行的是( )A .FeS 2――→O 2高温SO 2――→H 2O H 2SO 3――→O 2H 2SO 4 B .石英砂――→焦炭高温粗硅――→Cl 2粗SiCl 4――→分馏提纯H 2/高温高纯硅 C .提取食盐后的母液――→Cl 2含Br 2的液体――→热蒸气――→冷凝粗Br 2 ――→NaBr (s )蒸馏Br 2 D .铝土矿――→1)NaOH (aq )2)过滤NaAlO 2(aq)――→1)CO 22)过滤Al(OH)3――→煅烧Al 2O 3――→冰晶石电解Al【答案】 A【解析】A项不可用于化工生产,应为FeS2――→O2SO2――→O2SO3――→H2OH2SO4。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2021届高三化学一轮复习——无机物制备流程题(知识精讲与训练)知识精讲1.无机制备流程图题思维主线(1)规律:主线主产品,分支副产品,回头为循环(2)读流程图①箭头:箭头进入的是投料(反应物)、出去的是主产物或副产物(生成物)。
②三线:出线和进线均表示物料流向或操作流程,可逆线表示物质循环。
2.无机制备流程题中表述性词汇“八大答题方向”化工生产流程和综合实验题中经常会出现一些表述性词语,这些表述性词语就是隐性信息,它可以暗示我们所应考虑的答题角度。
常见的有:(1)“控制较低温度”——常考虑物质的挥发、物质的不稳定性和物质的转化等。
(2)“加过量试剂”——常考虑反应完全或增大转化率、产率等。
(3)“能否加其他物质”——常考虑会不会引入杂质或是否影响产品的纯度。
(4)“在空气中或在其他气体中”——主要考虑O2、H2O、CO2或其他气体是否参与反应或达到防氧化、防水解、防潮解等目的。
(5)“判断沉淀是否洗净”——常取少量最后一次洗涤液于试管中,向其中滴加某试剂,以检验其中的某种离子。
(6)“检验某物质的设计方案”——通常取少量某液体于试管中,加入另一试剂产生某现象,然后得出结论。
(7)“控制pH”——常考虑防水解、促进生成沉淀或除去杂质等。
(8)“用某些有机试剂清洗”——①降低物质溶解度有利于产品析出;②洗涤沉淀:减少损耗和提高利用率等。
3.常用的控制反应条件的方法(见220页)4.常用的分离方法(见221页)强化寻来你1.N2H4·H2O(水合肼)极毒且不稳定,100℃以上易分解失水,常用作还原剂和除氧剂(通常生成N2和H2O),其熔点为-40℃,沸点118.5℃。
现以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O和无水Na2SO3,其主要流程如下:已知:Cl2(g)+2OH-(aq)===ClO-(aq)+Cl-(aq)+H2O(l)ΔH<0(1)配制30%NaOH溶液时,所需玻璃仪器除量筒、烧杯外,还需要________(填字母)。
A.容量瓶B.胶头滴管C.玻璃棒D.锥形瓶(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液充分反应生成NaClO3和NaCl。
实验中为控制反应温度除了用冰水浴、充分搅拌外,还需采取的措施是______。
(3)步骤Ⅱ合成N2H4·H2O的装置如图1所示。
NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。
实验中通过滴液漏斗滴加的溶液是________(填字母);a.尿素溶液b.NaClO碱性溶液c.尿素溶液或NaClO溶液任选其一理由是____________________________________________________________________。
(4)步骤Ⅲ中分离出N2H4·H2O应该采用的方法最合理的是____________________。
(5)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、HSO-3、SO2-3随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。
①边搅拌边向Na 2CO 3溶液中通入SO 2制备NaHSO 3溶液。
实验中确定何时停止通SO 2的方法是________________________。
②请补充完整由NaHSO 3溶液制备无水Na 2SO 3的实验方案:__________________________,用少量无水乙醇洗涤,干燥,密封包装。
(6)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是__________________________。
答案(1)BC (2)缓慢通入Cl 2(3)b 过量的NaClO 溶液会将水合肼氧化(4)减压蒸馏(5)①测量溶液的pH ,若pH 约为4,停止通SO 2②边搅拌边滴加NaOH 溶液,并监测溶液pH ,当pH 接近10时,停止加液,将溶液转移到蒸发皿中,低温蒸发至较多晶体析出,趁热过滤(不得低于34℃)(6)N 2H 4·H 2O 作还原剂生成N 2和H 2O ,分离产品过程容易进行解析(1)配制30%NaOH 溶液时,需要用托盘天平称取一定量的氢氧化钠固体,在烧杯中加入适量的水溶解即可,所需玻璃仪器除量筒、烧杯外,还需要玻璃棒和胶头滴管。
(2)温度超过40℃,Cl 2与NaOH 溶液反应生成NaClO 3和NaCl ,反应的离子方程式为3Cl 2+6OH -====△ClO -3+5Cl -+3H 2O ,实验中控制温度除用冰水浴外,还应控制通入氯气的速率,避免反应过于剧烈,放出大量的热而导致温度升高。
(5)用Na 2CO 3制备无水Na 2SO 3,在Na 2CO 3溶液中通入过量的二氧化硫生成NaHSO 3,然后在NaHSO 3溶液中加入NaOH 溶液可生成Na 2SO 3。
(6)N 2H 4·H 2O 作还原剂时生成N 2和H 2O ,而用Na 2S 或铁屑还原会得到其他杂质,水合肼还原法制得的产品纯度更高。
2.(2019·浙江省诸暨中学高二期中)K 3[Fe(C 2O 4)3]·3H 2O(三草酸合铁酸钾晶体)为翠绿色晶体,溶于水,难溶于乙醇,110℃下失去结晶水,230℃分解;是制备负载型活性铁催化剂的主要原料。
实验室利用(NH 4)2Fe(SO 4)2·6H 2O(硫酸亚铁铵)、H 2C 2O 4(草酸)、K 2C 2O 4(草酸钾)、30%双氧水等为原料制备三草酸合铁酸钾晶体的部分实验过程如下:已知:沉淀:FeC2O4·2H2O既难溶于水又难溶于强酸6FeC2O4+3H2O2+6K2C2O4===4K3[Fe(C2O4)3]+2Fe(OH)3↓、2Fe(OH)3+3H2C2O4+3K2C2O4===2K3[Fe(C2O4)3]+6H2O(1)溶解时加几滴稀硫酸的目的是_____________________________________________。
(2)沉淀过滤后,洗涤1的操作方法是_________________________________________。
(3)加入30%双氧水完全反应后,煮沸的目的是____________________。
(4)洗涤2中所用洗涤试剂最合适的是______________(填字母)。
A.草酸钠溶液B.蒸馏水C.乙醇D.KCl溶液答案(1)抑制Fe2+水解(2)向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复操作2~3次(3)除去过量的双氧水(4)C解析(1)亚铁离子在水溶液中水解,加入稀硫酸抑制水解。
(4)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾晶体)为翠绿色晶体,溶于水,难溶于乙醇,所以最好的洗涤试剂是乙醇。
3.(2019·嘉兴市高二期末)一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O,是一种重要的染料及农药中间体。
某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:相关信息如下:①[Cu(NH3)4]SO4·H2O在溶液中存在以下电离(解离)过程:[Cu(NH3)4]SO4·H2O===[Cu(NH3)4]2++SO2-4+H2O[Cu(NH3)4]2+Cu2++4NH3②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图:请根据以上信息回答下列问题:(1)方案1的实验步骤为:a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥。
①步骤c的抽滤装置如图所示,下列有关抽滤操作说法正确的是________(填字母)。
A.完毕后先关闭水龙头,再拔下导管B.上图装置中只有一处错误C.抽滤后滤液可以从上口倒出,也可从支管倒出D.滤纸应比漏斗内径小且能盖住所有小孔②该方案存在明显缺陷,因为得到的产物晶体中往往含有_________________________杂质,产生该杂质的原因是________________________________________________________。
(2)①方案2的实验步骤为:a.向溶液C中加入适量________,b.抽滤,c.洗涤,d.干燥。
②下列选项中,最适合作为步骤c的洗涤液是___________________________(填字母)。
A.乙醇B.蒸馏水C.乙醇和水的混合液D.饱和硫酸钠溶液洗涤的具体操作是:________________________________________________________。
③步骤d采用__________________干燥的方法。
答案(1)①BD②Cu(OH)2或Cu2(OH)2SO4加热蒸发时NH3挥发,使[Cu(NH3)4]2+Cu2++4NH3平衡向右移动,且Cu2+发生水解(2)①乙醇②C关小水龙头,缓缓加入洗涤剂使沉淀完全浸没,使洗涤剂缓缓地通过漏斗,重复2~3次③低温(或减压或真空或常温风干)解析(1)①根据抽滤操作的规范要求可知:抽滤完毕后,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关水龙头,以防倒吸,故A错误;在抽滤装置图中有一处错误,漏斗颈口斜面应对着吸滤瓶的支管口,故B正确;抽滤得到的滤液应从吸滤瓶的上口倒出,故C错误;滤纸应比漏斗内径略小,且能盖住所有小孔,故D正确。
(2)①根据[Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图知,随着乙醇体积分数的增大,[Cu(NH3)4]SO4·H2O的溶解度降低,为了得到[Cu(NH3)4]SO4·H2O,应向溶液C中加入适量乙醇,然后进行抽滤。
②为了减少[Cu(NH3)4]SO4·H2O的损失,应降低[Cu(NH3)4]SO4·H2O的溶解度,所以应选用乙醇和水的混合液,故答案为C。
③[Cu(NH3)4]SO4·H2O在加热条件下能分解生成水和氨气,从而得不到纯净的[Cu(NH3)4]SO4·H2O,所以不宜采用加热干燥的方法,应采用低温干燥(或减压干燥或真空干燥或常温风干)。
