金属有机化学第十章
有机化学第二版第十章醛和酮

第十章 醛酮含有羰基的化合物:O H O CH3CCH3 O C CH3醛和酮:CH 3C羧酸 羧酸:CH3CO OHCOOH COOH COOHOH CH3CHCOOHO羧酸衍生物:CH3COCl (CH3CO) ( )2OCOOC 2H 5NHOβ-二羰基化合物:CH3CCH2COOC 2H5CH2COOC2H5 COOC2H5210 醛和酮教学大纲(醛和酮)醛和酮的结构与物理性质 醛和酮的结构与物理性质; 醛和酮的化学性质:1.与氢氰酸加成; 2.与亚硫酸氢钠加成; 3.与醇亲核加成; 4.与氨的衍生物反应; 5.与Grignard试剂加成; 试剂加成 6.醇醛缩合反应; 7 卤化和卤仿反应; 7. 卤化和卤仿反应 还 原 反 应 —— 催 化 加 氢 、 金 属 氢 化 物 还 原 、 Clemmenson 还 原 、 WolffKishner黄鸣龙还原、Cannizzaro反应;氧化反应)。
羰基 carbonylOR C H R O C R'醛(aldehyde)O R C O R C R' Ar H Ar O C O C R H酮(Ketone K t )Oβ αC H(R)CC脂肪族醛、酮芳香族醛、酮α,β-不饱和醛、酮4命名:O CH3CCH2CH2CHOO O CH3CCHCCH3 CH2CH=CH24-氧代戊醛3-烯丙基-2,4-戊二酮OO CHO环己酮CHO2'-氧代环己基甲醛CHO OH O CHO苯甲醛2-羟基苯甲醛 (水杨醛)呋喃甲醛 (糠醛)5z醛和酮的结构2spCσOδ C+δO键角接近 120 °1 C=O双键是由一个σ键和一个π键组成的。
2 羰基碳原子为 sp2杂化轨道与氧原子的 p 轨道和其它两个原子 形成三个 形成 个σ键 键,一个 个 p轨 轨道与氧原子的 与氧 子 p轨 轨道侧面交盖成 侧面交 成π键 键, 氧原子上另有两对孤对电子处于氧的s轨道和p轨道中。
有机化学 第10章

2C2H5ONa
+ H2
C2H5ONa +H2O
苯乙醇水=74.118.57.4(64.9℃)
2 2(CH3)3COH + 2K
2(CH3)3COK + H2
强碱性试剂 亲核性相对弱一些
魏能俊 主讲教师:曹瑞军
有机化学
16-10
3 2C2H5OH + Mg
(C2H5O)2Mg 乙醇镁
+ H2
魏能俊
主讲教师:曹瑞军
有机化学
16-6
3、醇的异构和命名
醇的异构主要来自碳链的异构和羟基位置的异构。 醇的系统命名如下: (1)选取含羟基的最长碳链为主链,按主链碳原子数命名为某醇。 (2)从最靠近羟基的一端开始编号,羟基在末端时“1”字可以省略。 (3)不饱和醇应选取同时含不饱和键与羟基在内的最长碳链为主链。 CH3 CH3-C-OH CH3C=CHCH2CHCH3 CH CHCHCH CH H3C 3 2 3
液相测定酸性强弱
H2O > CH3OH > RCH2OH > R2CHOH > R3COH > HCCH > NH3 > RH
总的活性(酸性)顺序为:甲醇>伯醇>仲醇>叔醇 在液相中,溶剂化作用会对醇的酸性强弱产生影响。
O H H R H C
O
H O
H H O H H
CH 3 C CH 3
CH 3 O
16-14
举例如下:
-CHO + H2 Pd/C -CH2OH
CH3CH2O-CO-(CH2)8CO-OCH2CH3
Na+C2H5OH
HO-(CH2)10-OH
第十章金属配位化合物

例: 硫酸一溴五氨合铬(Ⅲ)
配合物[CrBr(NH3)5]SO4,中心离子是__________,
Cr3+
配配位位体数是_N__H_3_、,___B配_r_-_离配子位的原电子荷是数_是___N__、__B__r____,
________
__________,
6
+2
中心离子的氧化数是
,内界是
,
__________
[Ag(NH3)2]+的结构 4d
5s
5p
sp杂化 5p
H3N NH3
结果: [Ag(NH3)2]+形成之前和之后, 中心原子的d电子排
布没有变化 。络合物是直线型,μ = 0
中心离子Ni2+的结构 3d [Ni(NH3)4]2+的结构 3d
4s
4p
sp3杂化
NH3 NH3 NH3
NH3
结果: [Ni(NH3)4]2+形成之前和之后, 中心原子的d电子
Cu(NH 3 ) 4 SO 4
K 3 Fe(NCS) 6
H 2 PtCl 6
Cu(NH 3 ) 4 (OH) 2
K PtCl 5 (NH 3 )
Zn(OH)(H
2 O) 3 NO 3
Co(NH 3 ) 5 (H 2 O) Cl 3
Fe(CO) 5
Co(NO 2 ) 3 (NH 3 ) 3
副篇内容
叶绿素(chlorophylls a)是镁的大环 配合物,作为配位体的卟啉环与Mg2+离 子的配位是通过4个环氮原子实现的。 叶绿素分子中涉及包括Mg原子在内的4 个六元螯环。
叶绿素是一种绿色色素, 它能吸收太阳光的
有机化学第五版第十章酚和醚部分答案

第十章酚、醚参考答案
2 写出下列结构式的系统命名
(6)5-硝基-3-氯-1,2-苯二酚(考察内容:较优官能团的确定,取代基的优先顺序)(7)对溴苯乙醚(对溴苯基乙基醚;考察内容:较优官能团的确定,醚的命名)
3 写出下列化合物的结构式
8 完成下列各反应
(6)(CH3CH2)2CHI + CH3 (考察内容:醚键的断裂,思考:醚键断裂顺序,如果HI不过量产物是什么?)
(8)CH3CHBrCH2OH (考察内容:环氧乙烷的酸性开环,注意酸性开环和碱性开环的不同)
(13)(考察内容:环氧乙烷的碱性开环,S N2开环机理)
(14)(考出内容:环氧乙烷的酸性开环,断键位置类似S N1,反应实质S N2,注意反应的反应机理)
(16)(考察内容:醚键的断裂规律,脂环烃中氢原子表示方法)
(18)(考察内容:酸性开环的断键位置及原因,亲核试剂进攻方向,产物构型)
(19)(考察内容:碱性开环的断键位置,亲核试剂进攻位点、方向,产物
构型)
13 合成题:
3 参考答案:
丙烯在过氧化氢的作用下与HBr加成得到正溴丙烷,正溴丙烷与镁形成丙基溴化镁格氏试剂,后者与丙酮发生加成反应后水解,即可得到1,1-二甲基丁醇,1,1-二甲基丁醇与金属钠反应可得到相应的醇钠;
丙烯与NBS发生自由基取代可得到3-溴丙烯,3-溴丙烯与上面制备得到的醇钠反应即可得到目标产物。
(考察内容:威廉森制醚法: 醇钠和卤代烃的选择原则;醇钠的制备;由烯烃制备一级卤代烃的方法(过氧化效应);烯烃中α氢的取代反应;格氏试剂的制备及应用)。
有机化学-第十章

10.2 醛酮的化学性质
如果利用NaHSO3与羰基化合物加成的可逆性,将 NaCN 与 α-羟基磺酸钠作用,使生成的 HCN 与分解出的羰基化合 物加成生成α-羟基腈,这样也可避免 HCN 的直接使用。 例如:
10.2 醛酮的化学性质
醛、酮与碳负离子的加成
Grignard 试剂,炔钠,Wittig试剂等,都含有碳负离子, 它们与羰基化合物的反应活性很高,有机合成上有广泛的 应用。
10.2 醛酮的化学性质
一、与氨、伯胺的反应
脂肪族醛、酮与氨、伯胺的反应可生成亚胺,也称为席夫 碱(Schiff base):
10.2 醛酮的化学性质
脂肪族醛、酮生成的亚胺中含的C=N双键在反应条件下不 是很稳定的,它易于发生进一步的聚合反应。芳香族的醛、 酮与伯胺反应生成的亚胺则比较稳定。
10.1 醛酮的结构及分类
在醛、酮分子中,羰基碳原子是以sp2 杂化状态与其它三 个原子构成键的,羰基碳原子的P轨道与氧原子上的P轨道 以相互平行的方式侧面重叠形成π键,即羰基是一个平面 构型的; 与羰基碳原子直接相连的其它三个原子处于同一平面内, 相互间的键角约为120度,而π键是垂直于这个平面的。
> > >
>
>
>
>
10.2 醛酮的化学性质
一、与水的加成
甲醛、乙醛、丙酮等小分子羰基化合物在水中的溶解性非 常好,这不仅是它们与水分子之间可以形成氢键,还在于 它们可以与水分子发生加成反应,生成了水合物; 这种水合物只有在水溶液中在一定浓度范围、一定的温度 下才是比较稳定的,游离的羰基水合物(同碳二元醇)是 极不稳定的,它将迅速脱水成为羰基化合物。
有机化学第10章 醛和酮

Witting反应是在醛酮基碳所在处形成碳碳双键的一个重要方法,产物中 没有双键位置不同的异构体。反应条件温和,产率也较好,但产物双键 的构型较难控制。 Witting也因该工作而与Brown H C共享了1979年的诺 贝尔化学奖。 另一种类型的磷叶立德试剂是霍纳(Horner L)提出的:用亚磷酸 酯为原料来代替三苯基膦与溴代乙酸酯得到的试剂磷酸酯,后者在强碱 作用下形成Horner试剂。
另一种类型的磷叶立德试剂是霍纳(Horner L)提出的:用亚磷酸 酯为原料来代替三苯基膦与溴代乙酸酯得到的试剂磷酸酯,后者在强碱 作用下形成Horner试剂。
补充: 醛、酮与炔化钠的加成
R-CC-Na+ NaNH2 (-NH3) R-CCH +
C=O
NH3(液) 或乙醚
C C ONa CR H O 2
• 醛和脂肪族甲基酮(或七元环以下的环酮)与之反应,生成
• -羟基磺酸钠
白色
过量
在酸碱下可逆反应,分离提纯
-羟基磺酸钠与等摩尔的NaCN作用,则磺酸基可被氰基取代, 生成 -羟基腈,避免用有毒的氰化氢,产率也比较高。
3、与醇的加成
*1 反应情况介绍 ① 与醛反应 CH3CH=O + CH3CH2OH
(hydrazine)
C 6H 5 H C O + H2NNH O2 N NO2
(hydrazone)
C 6H 5 H C NNH O 2N NO2 + H 2O
2,4–二硝基苯肼
O O + H2NNHCNH2
2,4–二硝基苯腙
O NNHCNH2 + H2O
氨基脲
(semicarbazine)
缩氨基脲 (半卡巴腙)
有机化学第二版第十章习题答案
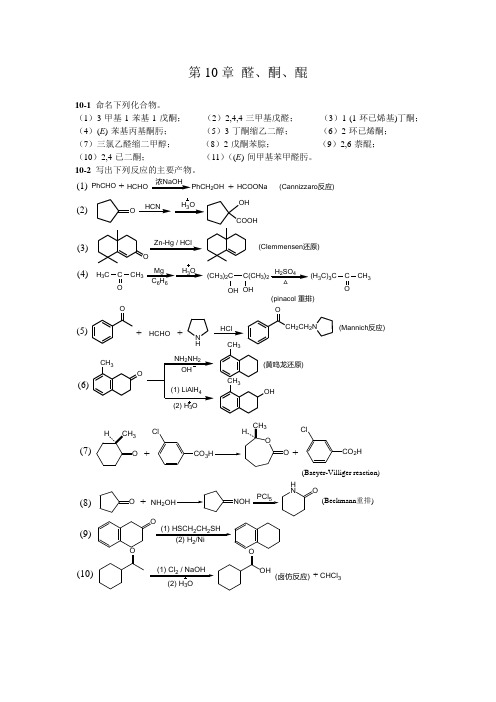
第10章 醛、酮、醌10-1 命名下列化合物。
(1)3-甲基-1-苯基-1-戊酮; (2)2,4,4-三甲基戊醛; (3)1-(1-环已烯基)丁酮; (4)(E )-苯基丙基酮肟; (5)3-丁酮缩乙二醇; (6)2-环已烯酮; (7)三氯乙醛缩二甲醇; (8)2-戊酮苯腙; (9)2,6-萘醌; (10)2,4-已二酮; (11)((E )-间甲基苯甲醛肟。
10-2 写出下列反应的主要产物。
PhCHOHCOONa +浓NaOHHCHO2OH+(Cannizzaro 反应)OZn-Hg / HClHCNH 3OOH COOHO(Clemmensen 还原)H 3CC CH 3O Mg C 6H 6H 3OH 2SO 4△(CH 3)2C C(CH 3)2OH OH(H 3C)3CC CH 3O(pinacol 重排)(1)(2)(3)(4)+HCHO(Mannich 反应)+HCl(5)(6)ON HCH 2CH 2NOCH 3OCH3CH 3OH(黄鸣龙还原)CO 3Cl+CO 2HCl+(Baeyer-Villiger reaction)ONH 2+PCl 5H NO(Beckmann 重排)O(1) HSCH 2CH 2SH2O3OHO(卤仿反应)(7)(8)(9)(10)CHCl 3+(Wittig reaction)CH 3MgBr+Ph 33(13)(12)(11)O+O(1,4-加成产物)OCHCH 2CH 3O OOHHONCOO(双烯合成反应)10-3 比较下列化合物的亲核加成反应活性。
(2)(1)C OCH 3H 3C C CH 3OH 3CC HOCOCH 3H 3C(3)(4)(3)>(1)>(2)>(4)10-4 将下列化合物按烯醇式的含量多少排列成序。
CH 3COCHCOCH 3CH 3COCH 2CH 3(2)(1)PhC H 2C O(3)(4)COCH 3CH 3COCH 2COCH 3C CH 3O(1)>(4)>(3)>(2)10-5 指出下列化合物中,哪些能发生碘仿反应?哪些能与饱和NaHSO 3反应?(2)(1)O(3)(4)(5)ICH 2CHOCH 3CH 2CHOC 6H 5COCH 3CH 3CHOCH 3CH 2CH 2OHCH 3CH 2CCH 2CH 3CH 3CH 2CHCH 3OH(7)(6)(8)O能与饱和NaHSO 3反应的有(1)、(2)、(5)、(8)[脂肪族甲基酮、大多数醛和8个碳以下的脂肪酮能进行此反应]。
《金属有机化学教案》课件

《金属有机化学教案》课件第一章:金属有机化学概述1.1 金属有机化学的定义1.2 金属有机化学的发展简史1.3 金属有机化学的研究方法1.4 金属有机化学的应用领域第二章:金属有机化合物的结构与性质2.1 金属有机化合物的结构特点2.2 金属有机化合物的键合理论2.3 金属有机化合物的物理性质2.4 金属有机化合物的化学性质第三章:金属有机化合物的制备方法3.1 金属有机化合物的合成策略3.2 金属有机化合物的制备方法概述3.3 常见金属有机化合物的制备实例3.4 金属有机化合物的结构表征方法第四章:金属有机化学在材料科学中的应用4.1 金属有机化学在材料合成中的应用4.2 金属有机化学在材料加工中的应用4.3 金属有机化学在功能材料研究中的应用4.4 金属有机化学在新型材料探索中的应用第五章:金属有机化学在有机合成中的应用5.1 金属有机化学在有机合成中的催化作用5.2 金属有机化学在有机合成中的模板作用5.3 金属有机化学在有机合成中的活化作用5.4 金属有机化学在有机合成中的区域选择性控制第六章:金属有机化学在药物化学中的应用6.1 金属有机化学在药物合成中的作用6.2 金属有机化学在药物设计中的应用6.3 金属有机化学在生物活性分子研究中的应用6.4 金属有机化学在药物化学领域的挑战与展望第七章:金属有机化学在有机催化中的应用7.1 金属有机催化原理7.2 金属有机催化剂的设计与合成7.3 金属有机催化在有机合成中的应用实例7.4 金属有机催化的未来发展第八章:金属有机化学在超分子化学中的应用8.1 金属有机超分子的定义与特点8.2 金属有机超分子的设计与合成8.3 金属有机超分子在材料科学中的应用8.4 金属有机超分子研究的挑战与展望第九章:金属有机化学在环境化学中的应用9.1 金属有机化合物在环境污染治理中的应用9.2 金属有机化学在环境监测中的应用9.3 金属有机化学在环境友好材料制备中的应用9.4 金属有机化学在环境保护领域的挑战与展望第十章:金属有机化学实验操作安全10.1 金属有机化学实验操作中的安全问题10.2 金属有机化学实验中的安全操作规范10.3 实验室事故的预防与处理10.4 金属有机化学实验操作的安全教育与培训重点和难点解析一、金属有机化学的定义与研究方法难点解析:金属有机化合物的结构与性质之间的关系,研究方法的原理与实际应用。
有机化学:第十章 醛 酮(1)
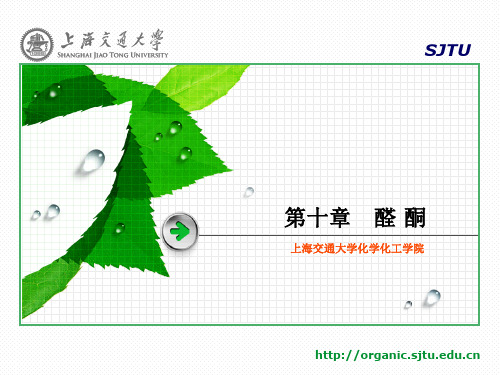
(2) O
O
C OC2H5
H+
O
HOCH2CH2OH
O
O C OC2H5
LiAlH4 (C2H5)2O
O
O
CH2OH H+, H2O
O
CH2OH + HOCH2CH2OH
上海交通大学化学化工学院
(3) 维尼纶:聚乙烯醇含有多个亲水基团,为了提高其耐水性能,可用 甲醛使其部分缩醛化,得到性能优良的合成纤维——维尼纶。
(Ph)3P
- R1 C
R2
上海交通大学化学化工学院
G.Wittg于1953年开始系统研究了它与醛酮的反应,并应用在合 成上。建立了独特的结构和合成方法。
R1 C O + Ph3P C
R2
Ph3P + C
O- C
(Ph)3PO +
R1 CC
R2
缩醛对氧化剂、还原剂、碱稳定,对酸不稳定。
上海交通大学化学化工学院
应用:保护羰基。
(1) CH2 CHCHO
CH2 CH CHO OH OH
2C2H5OH
CH2 CHCH
OC2H5
[O]
OC2H5 H2O
H+, H2O
CH2 CH OH OH
OC2H5 OC2H5
SJTU
第十章 醛 酮
上海交通大学化学化工学院
(一)结构和命名:
1. 结构:
通式:CnH2nO ,醛、酮互为同分异构体。
官能团:
O
O
C H 醛基
C
羰基
碳原子采用sp2 杂化,三个σ键共 平面,羰基碳原子和氧原子上的p轨道 在侧面重叠生成π键 ,氧原子上还有 两对未共用电子。
第十章 还原反应

溶剂也会影响氢化的立体选择性。
官能团的催化氢化
1)不饱和烃的氢化还原
炔键和烯键均易催化氢化还原(钯、铂和Raney镍)
一般条件:条件温和(常温常压) 。
烯烃的活性: 位阻大的烯烃难氢化。
通常孤立的烯键的活性大于共轭双键。
Raney-Ni / H2 Et2O
R
R H
H
Raney-Ni和Pd/C是烯键选择性氢化的常用催化剂,
载体: 活性炭, 氧化铝, 氧化硅,碳酸钙、硫酸钡等。
溶剂: EtOH, EtOAc, Et2O, hexanes等。
催化氢化反应的相对活性:
催化氢化机理——syn
addition
注意:空间位阻效应(从位阻较小的方向进攻)
CH CH 33
Pt/H Pt/H 22
CH CH 33
CH CH 33
R'
Na Na
O C
R'
R
R
HS(溶剂)
Na
O CH
R'
H2O
R' HO CH R
R
存在共轭双键时,优先还原双键
酮的双分子还原
R1 C R2 O R1
+ O
Mg(Hg)
R2
R1 C
R1 C R2 H3C
CH3 CH3 C C CH3
C R2
H2O
OH OH
OH OH
频哪醇 Pinacol
O Mg R2 O C R1
注意:CaH2,NaH2常作为碱
Quenching: Adding water, methanol, saturated NH4Cl or AcOH in the reaction system to stop the reaction。
有机化学第10章 醇、酚、醚

①醇可依分子中所含羟基数目分为一元醇、二元醇及三元醇等,二
元及二元以上的醇称为多元醇。例如:
CH3CH2OH CH2CH2 OH OH
乙醇(一元醇) 乙二醇(二元醇)
CH2CH CH2 OH OH OH
丙三醇(三元醇)
3
②醇也可依分子中烃基的不同而分为脂肪醇(包括饱和醇及不饱和 醇)、脂环醇和芳香醇。 例如:
C(CH3)2或 C(CH3)3
23
在醇的核磁共振谱图中,羟基质子(O—H)由于受
分子间氢键的影响,其化学位移(δ)出现在1~5.5范围 内,在核磁共振谱中产生一个单峰。由于氧的电负性 较大,羟基所连碳原子上的质子的化学位移一般在 3.4~4.0。
24
10.1.4 醇的化学性质
羟基是醇的官能团,作为反应中心羟基决定了醇的化学性质。
2,3-二甲基-3-戊醇
12
不饱和醇的命名,除应选择同时连有羟基和不饱和键的最长碳 链作为主链外,其它原则与饱和醇相同。
CH3CH2CH2CHCH2CH2CH2OH CH CH2
5 6
4
3
2
1
4-丙基-5-己烯-1-醇
CH CHCH3 CH3CH2CHCHCH2CHCH3 CH3 OH
4-甲基-5-乙基-6-辛烯-2-醇
32
醇和氢卤酸反应的速率与醇的结构的关系: 醇的活性顺序是:烯丙型醇、苄基型醇>叔醇>仲醇>伯醇。 例如:
33
利用不同醇与盐酸反应速率的不同,可以区分伯、仲、叔醇。无
水氯化锌与浓盐酸配制的溶液,叫做Lucas试剂。因为水溶性较好的
醇与Lucas试剂反应后,生成与水不互溶的氯代烃,形成乳状的混浊 溶液或分层,所以可利用Lucas试剂鉴别低碳(C6以下)一元伯、仲、叔 醇(C6以上的一元醇水溶性较差,难于用Lucas试剂鉴别)。例如:
有机化学(第五版)第十章 醇、酚、醚

2) 根据分子中烃基的类别分为:脂肪醇、脂环醇、 和芳香醇(芳环侧链有羟基的化合物,羟基直接连在 芳环上的不是醇而是酚)。
3) 根据分子中所含羟基的数目分为:一元醇、二元 醇和多元醇。 两个羟基连在同一碳上的化合物不稳定,这种结 构会自发失水,故同碳二醇不存在。另外,烯醇是不 稳定的,容易互变成为比较稳定的醛和酮。 井冈山大学化学化工学院
井冈山大学化学化工学院
关于频哪醇重排需要注意的问题
3.某些环状结构的频哪醇,重排后可得环扩大产物
井冈山大学化学化工学院
五、Preparation of Alcohols
1.由烯烃制备 1) 烯烃的水合 2) 硼氢化-氧化反应
硼氢化反应操作简单,产率高,是制备伯醇的好办法。
井冈山大学化学化工学院
3)羟汞化-脱汞反应
井冈山大学化学化工学院
乙醇液膜
乙醇(CCl4)
四、Chemical Properties of Alcohols
醇的化学性质主要由羟基官能团所决定,同时也受到烃 基的一定影响,从化学键来看,反应的部位有 C—OH、 O—H、和C—H。
分子中的C—O键和O—H键都是极性键,因而醇分子中有 两个反应中心。 又由于受C—O键极性的影响,使得α—H具 有一定的活性,所以醇的反应都发生在这三个部位上。 井冈山大学化学化工学院
(2)双分子消除反应(E2)
一步反应:
E2反应的特点: 1)一步反应,与SN2的不同在于B:进攻β-H。 E2与SN2是互相竟争的反应。 2)反应要在浓的强碱条件下进行。 3)通过过渡态形成产物,无重排产物。 井冈山大学化学化工学院
2. 消除反应的取向
A. Saytzeff规则:优先生成具有较多烷基取代的(也是较稳定的)烯烃。
有机化学第十章羧酸
Organic Chemistry
10.2 羧酸的物理性质
Physical Properties of Carboxylic Acids
Xiamen University
Physical Constants of Some Carboxylic Acids
Structure HCOOH OrganicCCHh3eCmOisOtrHy
自然界中的羧酸
OH
COOH
Organic Chemistry
HO
OH
胆酸 (Cholic acid)
H
H
CC
CH3(CH2)7
(CH2)7COOH
油酸 ( Oleic acid )
H C
Xiamen UCniHve3r(sCitHy 2)4
HH
C
C
CH2
H C
(CH2)7COOH
亚油酸 ( Linoleic acid )
Xiamen University
O
RC
R
O
羧酸根的共振结构
O C
O
O Organic Chemistry HC O 1.27A
Xiamen University
1.20A O HC OH 1.34A
Organic Chemistry
10.4 羧酸的制备 Preparation of Carboxylic acids
CH3CH2COOH
FCH2COOH
BrCH2COOH
HOCH2COOH
CH2=CHCOOH
XiamenCU6Hni5vCerOsiOtyH HOOCCOOH
m.p. ( ) 8.4 16.6 -22 35.2 50 80 13
有机化学CLASS10

3.3~4.0 ppm
M-18
MS:
M+
不明显
明显
失水峰
6
三. 醇的反应 (Reaction of Alcohols) 与活泼金属的反应(羟基中H的反应) 1. 与活泼金属的反应(羟基中H的反应)
CH3CH2OH
(CH3)3COH
+ +
Na
CH3CH2ONa
(CH3)3COK
+ +
K
1 H2 2 1 H 2 2
CH3 H3C C OH CH3
CH2 H3C C OH2 CH3
快 +
HX
CH2 H3C C OH2 CH3
慢
CH3 H3C C CH3
9
+
H2O
CH3 H3C C CH3
CH3
+
X
快
H3C C
X
CH3
b. 一般伯醇按SN2机理 一般伯醇按S 快 RCH2OH + H 慢
X
δ
RCH2 OH2
R
+
25
注意: 注意:只要在反应中形成
C OH
C
都可发生 片 内 类型重排。 类型重排。 练习: 练习:
O CH
口
口
OH CH2OH
H
CH3 CH3 CH3 C C CH3
CH3 O
极性溶剂
CH3 C CH3 C CH3
OH I
26
四. 醇的制备 (Preparations of Alcohols) 1. 羰基化合物的还原
C C C C
重排动力: 重排动力:
C OH
《有机化学》第十章 醛酮的结构与性质

第十章醛酮的结构与性质引言醛酮分之中都会含有羰基( ),羰基中碳原子是sp2杂化的,三个杂化轨道形成三个δ键,其中一个是和氯形成的δ键。
这三个键在同一平面上,彼此间理论键角为120°,但由于三个键所连基团不同,相互作用有差别,因此键角和理论值略有出入。
碳原子和剩下的一个轨道和氧原子的轨道重叠形成Л键,因此羰基是由一个δ键和一个Л键所组成的碳氧双键,如图:图10.1羰基的结构及其电子云示意图羰基中碳氧双键与烯烃中碳碳双键不同,是极性的双键(由于氯原子的电负性比碳大),成键电子云密度在氧原子处较高,氧原子带部分负电荷(δ-),而碳原子处电子云分布较低,因而带部分正电荷(δ+)。
极性碳氧双键易受到带负电荷或孤对电子的试剂(即亲核试剂)的进攻,发生亲核加成反应,这是羰酮经典的反应之一。
羰基是极性基团具有较强的吸电子诱导反应,因而羰基的α-H具有一定的“酸性”,在碱性条件下离去后形成碳负离子,作为亲核试剂与另一分子的醛(或酮)发生醇醛缩合(或醇酮缩合)反应。
另外醇酮的羰基易发生氧化还原反应。
10.1 亲核加成反应醛酮的亲核加成反应是其经典的反应之一,可用下列通式表示:在反应过程中,首先是试剂的亲核部分(Nu-)向羰基碳进攻,形成负氧离子,再与带正电荷的亲电部分(A+)结合。
影响亲核加成速度主要是电子效应和空间效应。
羰基碳原子的正电性的高低决定反应速度的快慢,吸电子取代基加快反应进程,供电子取代基减慢反应进程。
由于在决定反应速度的步骤中碳原子由于sp2杂化转变为sp3杂化,键角变小,基团的排斥作用增强,因此羰基所连的基团的大小也对反应速度产生影响。
基团越大,空间位阻越大,反应速度越慢。
下列醛酮的亲核加成反应活性由强到弱的顺序为:(1)(2)10.1.1含氧亲核试剂的加成反应1.与水的加成反应水和醇都是含氧的亲核试剂。
在一定的条件下水可与醛酮的羰基加成形成水合物,但是水合物极不稳定,很易失水:(平衡主要偏向反应物方向)只有活性较强的醛的水合物较稳定,如甲醛在水溶液中几乎全部以水合物形式存在,但不能分裂,而三氯乙醛的水合物其吸收光谱图表明不含羰基:水合氯醛2.与醇的加成反应:在干燥的HCl作用下,醛与等摩尔的醇亲核加成生成半缩醛,半缩醛可与另一摩尔的醇发生反应,生成缩醛:半缩醛缩醛缩醛对碱和氧化剂都很稳定,在有机合成中常用此反应来保护醛酮。
金属有机化学第十章 金属卡宾和卡拜络合物

OMe
Cr=C键长:2.04Å 一般C-O键长:1.43 Å Cr-C键长:2.21Å C=O键长:1.23 Å C卡-O键长:1.33Å CH3-O键长:1.46 Å 证明C卡-O介于单、双键之间。
(2)金属卡宾的类型:SFcishcrhoecrk型型卡卡宾宾
稳定卡宾, 含杂原子; 不稳定卡宾,不含杂原子。
Fischer卡宾
H B (b) OC CO CR2
OC Cr C
Nu (a)
OC CO O R (c)
E (d)
(a)卡宾碳具有亲电性,易受亲核试剂 进攻。
Schrock卡宾
B (b')
CMe3
H2C
H
Me3CCH2 Ta C
E (a')
H2C (c') CMe3
CMe3
(a’)M-C极化方向与Fischer型正好 相反,所以亲电试剂加到碳原子上。
N
R
(c)卡宾转化法:
(CO)5Cr
W(CO)6, 140℃ (CO)5W
O
O
(CO)NO(Cp)Mo
Ph
+ OCH3
Fe(CO)5
hv
(CO)4Fe
Ph + CpMo(CO)2NO
OCH3
(ii)Schrock型卡宾的合成
(a)
(Me3CCH2)3TaCl2 Me3CCH2Li
H
(Me3CCH2)3Ta
Cp(Cl)(Me3P)2Ta
CCMe3
(c’)
(Me3CCH2)3Ta
CHCMe3
2Me3P
CHCMe3 Me3CCH2(Me3P)2Ta
CHCMe3
有机化学:第十章 醛、酮类羰基化合物 (2)

C N OH 肟
H2N-NH2 肼
C N NH2 腙
H2N NH
苯肼
NO2
H2N NH
NO2
2,4-二硝基苯肼
C N NH
苯腙
C N NH
NO2
NO2
2,4-二硝基苯腙
羰基化合物胺类加成产物多数为晶体,有固定的熔点,与稀 酸作用,可水解成原来的醛或酮,常用来鉴定(熔点)、分离和 提纯醛或酮。
如苯腙衍生物的应用
C
O
δ+
δ-
CO
羰基化合物电子云结构
2 羰基化合物分类
2.1 按羰基连接的烃基分类 O
脂肪族: CH3 CHO CH3 C CH3 (饱和)
O
CH2 CH CHO CH2 CH C CH3(不饱和)
O
芳香族:
CHO
C
2.2 按羰基数目
一
CH3CH2CH2 CHO
元
O
O
CH3 C CH3 CH3 C C2H5
反应通式:
H2N Y
反应机理:
席呋碱类
C O + H2N Y
OH H C NY
OH CN Y
H
H2O C N Y
加成-消除机理。
反应特点: 反应种类多,大多数羰基化合物都能反应。
H2N-H 氨 H2N-R(Ar) 伯胺
C NH
亚胺
C
N R (Ar)
取代亚胺 西佛(Schiff)碱
H2N-OH 羟胺
C: 醛、酮与炔化钠的加成
R-CC-Na+ + C=O NH3(液)
或乙醚
NaNH2 (-NH3)
R-CCH
C CR H2O C
有机合成 第十章 还原反应

霍夫曼降解:
R-CONH2 + NaOX + 2NaOH
R-NH2 +Na2CO3
山东科技大学 化学与环境工程学院
王鹏
炔烃的溶解金属还原:
非末端炔烃还可通过溶解金属法(Na-NH3(L))还原。 反应主要生成反式构型烯烃,与催化氢化产物相反 反应历程:
目前的研究中,大部分此类反应已经可以
被其他方法代替,但仍具有重要意义
王鹏 山东科技大学 化学与环境工程学院
一、溶解金属还原的原理:
金属溶解于质子性溶剂而将电子直接转移到底
物,随后底物从溶剂中获得质子完成还原 常用的金属有锂、钠、镁、锌、铁等,溶剂有 醇、乙酸、液氨、浓盐酸等 反应的原理决定加氢是分步的,故必为反式
王鹏
山东科技大学 化学与环境工程学院
二、催化氢解
底物分子催化下加氢变为两个或更多分子的还
原过程。 常用于被保护基团的去保护,如苄酯、苄醚等 的苄基可以被Pd-C催化加氢而除去,从而用于 羟基的保护-去保护方案 常用的催化氢解催化剂:
Pd-C和Raney Ni最常使用 卤代烃可以通过催化氢解除去,活性为I>Br>Cl>F
硼氢化钠:氢化钠+硼酸三甲酯 四氢铝锂:氢化锂+无水三氯化铝
王鹏
山东科技大学 化学与环境工程学院
10.3.1 LiAlH4与NaBH4
还原举例
王鹏
山东科技大学 化学与环境工程学院
反应机理:亲核加成-水解
O 机理: R C R + Na BH3 H R OBH2O C H R C R H H2O H
有机化学第十章习题醛酮课后习题答案
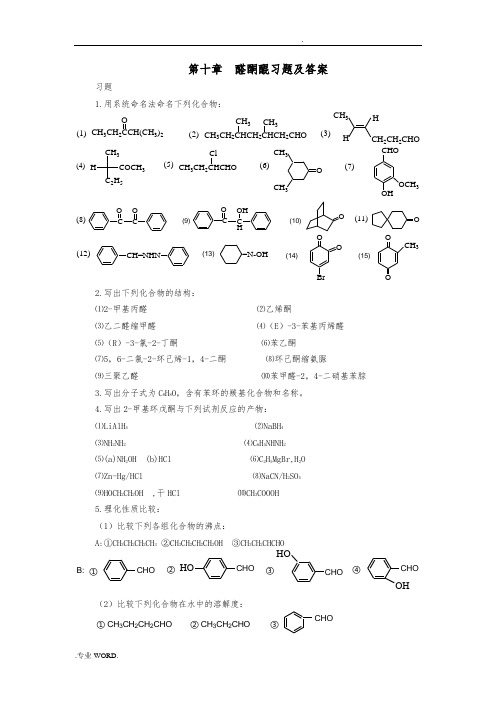
第十章 醛酮醌习题及答案习题1.用系统命名法命名下列化合物: CH 3CH 2CCH(CH 3)2O(1)(2)(3)CH 3CH 2CHCH 2CHCH 2CHOCH 3CH 3CH 3HHCH 2CH 2CHO(4)(5)CH 3C 2H 5COCH 3HCH 3CH 2Cl(6)OCH 3CH 3(7)CHOOHOCH 3(11)(8)(9)(10)CO CO CO C HOH OO(12)(13)(14)(15)CH=NHN=N-OHOOBr OOCH 32.写出下列化合物的结构:⑴2-甲基丙醛 ⑵乙烯酮 ⑶乙二醛缩甲醛 ⑷(E )-3-苯基丙烯醛 ⑸(R )-3-氯-2-丁酮 ⑹苯乙酮 ⑺5,6-二氯-2-环己烯-1,4-二酮 ⑻环己酮缩氨脲⑼三聚乙醛 ⑽苯甲醛-2,4-二硝基苯腙 3.写出分子式为C 8H 8O ,含有苯环的羰基化合物和名称。
4.写出2-甲基环戊酮与下列试剂反应的产物:⑴LiAlH 4 ⑵NaBH 4 ⑶NH 2NH 2 ⑷C 6H 5NHNH 2 ⑸(a)NH 2OH (b)HCl ⑹C 2H 5MgBr,H 2O ⑺Zn-Hg/HCl ⑻NaCN/H 2SO 4 ⑼HOCH 2CH 2OH ,干HCl ⑽CH 3COOOH 5.理化性质比较:(1)比较下列各组化合物的沸点:A:①CH 3CH 2CH 2CH 3 ②CH 3CH 2CH 2CH 2OH ③CH 3CH 2CHCHOOH③①CHO②CHOHOCHOHOCHO④B:(2)比较下列化合物在水中的溶解度:① CH 3CH 2CH 2CHO ② CH 3CH 2CHOCHO③(3)比较下列化合物与HCN 加成反应的活性:③①②④CH 3CHOC 6H 5COCH 3CH 3COCH 3C 6H 5CC 6H 5O(4)比较下列化合物与NaHSO 3加成反应的活性:HOOO③①②(5)比较下列化合物的稳定性:③①②④OHOOO(6)比较下列负离子的稳定性:③①②OOOOOCH 3(7)比较下列化合物pka 的大小:③①②④CH 3CHOC 6H 5COCH 3CH 3COCH 3C 6H 5CC 6H 5O6.完成下列反应:⑴HCN-CH 3CH 2COCH 32SO 4?⑵OH-?NaHSO 3?CH 3COCH 3H 2O⑶CH 3-C-CH 2CH 3OCH 3MgBr H 2O?,⑷CH 3CHOBr 2 / FeH 2O / H +?Mg ??⑸O+CHCNaH 3O +??⑹NH 2OHHCl??C 6H 53O?OCH 3(C 6H 5)3P=CHCH 3⑺+?⑻H 2O,HAcO(1mol) Br 2C CH 3CH 3C-CH 3I 2⑼CH 3OH 3O +?CH 3O ?⑽NaBH 4COOCH 3-C-CH 3⑾?+CH 3OCO H O⑿(CH 3)2NHHCl?O +HCHO+⒀?OCHOClCH 2COOC 2H 5NaOC(CH 3)3⒁+?OMe 2CuLi?+O⒂⒃AlCl 3-CuC 2l 2?CH 3++CO HCl浓NaOH?+?⒄CH 3ICH 3COOOHH 3O +??N⒅CH 3-C-CH 2CH 2BrOOH OH2+Mg?O ?⒆+(CH 3CH 2-C)2OO?OCHOO⒇COCH 3+?O-C-CH 3O OH7.下列化合物:(1)CH 3CHO (2)CH 3CH 2COCH 2CH 3(3)(CH 3)2CHOH (4)O(5) (CH 3)2CHCHO (6) C 6H 5CHO (7) C 6H 5COCH 3(8)CHO能够发生碘仿反应的有?能与亚硫酸氢钠反应的有?能与甲醛发生交叉Cannizzaro 反应的有? 能够与Tollens 试剂反应的有? 能够与Fehling 试剂反应的有? 8.鉴别下列各组化合物:(1)CH 3COCH 2CH 3A.CH 3CH 2CH 2CHO B. C.CH 3CHCH 2CH 3OHD.CH 3CH 2CH 2CH 2OH(2)A.CHO COCH 3B.C.CH=CH 2 D.C CH(3)A.正戊醛 B.苯甲醛 C.2-戊酮 D.3-戊酮 E.2-戊醇 F.3-戊醇(4) A.B.OHOH C.CHOD.O9.解释下列反应的机理:(1):2CH 2CH 2-CH-C-HOO CH 3-3CHO(3):二苯基乙二酮在NaOH 的作用下发生重排,生成二苯基羟乙酸钠,酸化后得到二苯基羟乙酸,如果用CH 3ONa 代替NaOH ,则可以得到二苯基羟乙酸甲酯。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
polyethylene kH/kD = 1.04
Since this experiment was inconclusive, Grubbs designed a stereochemical probe to determine if an -H/D agostic interaction affected the insertion process. The Cossee mechanism should give a nearly 1:1 mixture of diastereomers, since there is no primary isotope effect in this mechanism. The Rooney-Green mechanism would be expected to give a unequal product distribution. A 50:50 diastereomeric ratio of products was produced in the reaction. (J. Am. Chem. Soc. 1985, 107, 3377)
Ziegler was originally studying the Aufbau reaction, which uses trialkyl aluminum compounds to make oligomers from ethylene. Ziegler found that adding transition metals salts resulted in significant changes in the reactivity.
These systems would polymerize ethylene, but slowly. Propylene and other higher alkenes could not be polymerized. The major advance was the introduction of the activator methylaluminoxane (MAO) by Kaminsky (Macromol. Chem. Rapid. Comm. 1983, 4, 417)
J. Chem. Soc., Chem. Comm. 1978, 604
The major difference between the two mechanisms, should be in the kinetic isotope effect. The Green-Rooney mechanism would require a large kinetic isotope effect (ca. 3). Grubbs first carried out the polymerization of a mixture of ethylene and ethylene-d4. (J. Am. Chem. Soc. 1982, 104, 4479), No isotope effect was observed, however this result did not definitively rule out an -elimination mechanism.
The major problems with heterogeneous systems are:
• There are a variety of different catalytic sites with different activity producing polymers with different molecular weights and tactcities. The polymers produced are always blends. • Heterogeneous systems are difficult to tune, because there is not much that can be varied and they are generally poorly understood. Although fairly selective systems have been developed, the work is largely empirical.
K. Ziegler (Angew. Chem., 1952, 64, 233):
This was a heterogeneous process. Insoluble metal salts and trialkylaluminum species were mixed in a hydrocarbon solvent under ethylene pressure.
Initiation:
The active species is believed to be a coordinatively unsaturated metal alkyl formed by reaction of the metal halide salt with the alkyl aluminum species.
The major advantage is that they are heterogeneous and can be used under industrially desirable conditions either in the gas phase or as suspensions.
Mechanism of Alkene Polymerization:
Linear Low Density (LLDPE) High Density (HDPE) Polypropylene Ethylene-Propylene rubber
7,959 13,906 15,448 340
Heterogeneous Olefin Polymerization Catalysts: The Ziegler-Natta systems.
Propagation:
The exact nature of the propagation step was controversial for some time. Cossee proposed a mechanism involving simple migratory insertion of an alkene into a metal alkyl Tetrahedron Lett. 1960, 1(38), 12-16
Chain Tain transfer mechanisms have been identified by modeling studies. -H elimination
Hydrogenation
Chain transfer to aluminum
Chain transfer to monomer
-R elimination -R
Homogeneous Ziegler-Natta-type polymerization catalysts
The first homogeneous systems were based on metallocene dichlorides, and were designed to mimic the activation process believed to occur in the heterogeneous systems.
90 % crystalline
X-ray and IR studies showed that the crystalline material had the same configuration at each chiral center. The polymer was isotactic, (via infra)
G. Natta (J. Am. Chem. Soc. 1955, 77, 1708): Soon after, Natta showed that the Ziegler catalyst would polymerize propylene to give polypropylene.
40 % crystalline material
= open coordination site
Green, and Rooney proposed an alternative mechanism based on an -elimination to give a carbene. Since there were few examples of isolated alkene alkyl complexes that undergo migratory insertion, they felt that an alternative mechanism was necessary. Formation of a metalacycle followed by reductive elimination gives a new metal-alkyl.
Ziegler and Natta shared the 1963 Nobel Prize in chemistry for their contributions.
These systems are still widely used in industry, but from the beginning there was interest in developing homogenous, single-site catalysts for olefin polymerization. These were desired both as model compounds for mechanistic studies and to provide more consistent and tunable catalysts. We will discuss this in detail later.
