长期毒性实验
第15章长期毒性作用及其试验方法课件

七、观察及测定指标
药物的长期毒性试验基本上可通过对实验动物的体 格检查,日常观察,食耗及饮水量,体重和器官重 量,血液学指标,心电图描记,尿液分析,临床生 化检验及病理组织学研究加以确认。
2024/4/9
3
基本概念和目的
长期毒性试验与急性毒性试验的根本差异:
1. 给药的期限不同。
急性毒性试验为一次性给药或 24 小时内多 次给药;
长期毒性试验为连续多日接触一定剂量给药, 给药期限为临床用药的 3-4 倍时间。 对长期毒性试验各国之间无统一的时间规定。
2024/4/9
4
基本概念和目的
2
4
12 70
注:有些资料记载的动物体型系数(R)为此表中R 值的1000 倍,如小鼠R 为59,大鼠R 为 90,这不影响药物剂量的折算。
2024/4/9
28
对于标准体重的动物:
每只用量(mg/只)DB= DA· KB KA
千克体重剂量(mg/kg)dB= dB· KB KA
KA,KB,RA,RB 值由上表查找。
2024/4/9
32
试验设计原则及方法
五、限度试验
经济合作与开发组织(OECD)提出如果一种 化合物以1000mg/kg的剂量,按规定期限连续 给药,不产生任何可观察到的毒性反应,而且根 据结构相关药物的已有资料,估计不会产生毒性 的话,就不需要再用三个剂量来进行试验,除非 预期临床需要更高的剂量。
剂量水平选择的方法
➢(1)半数致死量(LD50)法 ➢(2)短期蓄积试验过渡法 ➢(3)药代动力学(MBS)法 ➢(4)最大耐受量法(MTD法) ➢(5)临床拟用剂量法(ACD法) ➢(6)等效剂量法
2024/4/9
27
中药新药申报资料中长期毒性试验存在的问题

2.剂量的设计: 剂量的设计是长毒试验的关键。常
见问题是:剂量设计不合理,如低剂量 等于或低于药效学的有效剂量,未找出 安全剂量;高剂量设计过低而未找到毒 性剂量;剂量组仅设2个等等。主要原 因可能是:药效学与毒理学试验分离, 试验人员互不交流;不考虑有效剂量与 毒性剂量之间的关系,认为高剂量做了 相当于人临床剂量的50倍就可以了;未
4.恢复期观察及动物数等 有些试验者认为在给药结束时
未发现明显毒性,而不进行恢复期 观察,这种试验设计明显不规范。 恢复期观察的目的是为了观察毒性 反应的可逆程度和可能出现的迟发 性毒性反应,故应重视恢复期的观 察。恢复期观察时间一般应为2—4 周。
.
ቤተ መጻሕፍቲ ባይዱ
3指标的选择
原则上观察指标力求全面并针对受试物特点选 择相应的敏感指标。建议除一般指标外,还应根据 受试物的特点和在其他试验中已观察到的某些改变, 增加相应的观察指标,指标观察全面,以使一次长 毒试验的价值充分得到发挥。组织病理学检查尽量 系统全面,尸检发现异常器官者要有针对性的详细 检查。有些资料中仅检查心、肝、脾、肺、肾、脑 等几个脏器,所检脏器过少。长毒试验设计时建议
.
很多申报者认为中药新药的长毒试验不应 该出现任何毒性反应,这是一个误区。因长毒 试验中的目的是为了找出中毒剂量、确定安全 范围、寻找毒性靶器官、判断毒性的可逆性, 给临床提供参考信息,故中药复方制剂长毒试 验高剂量不应简单追求达到临床剂量的50倍, 而应合理设计才能达到长毒试验的目的。一般 建议高剂量尽可能采用最大给药量或出现明显 中毒甚至个别动物死亡的剂量。当然,一些具 体药物会因某些原因而不一定能完全按要求进
.
长毒试验是临床前毒性评价的主要内 容,是能否过渡至临床试验的主要依据。 其结果为临床安全用药的剂量设计提供参 考依据,为临床毒副反应的监护及生理生 化指标监测提供依据 。 (1)判断受试物是否能进行临床试验; (2)预测人临床用药的可能毒性反应及其 安全范围; (3)为临床初始剂量选择等提供重要的参 考依据; (4)确定临床试验中的防治措施和着重观
药物毒理学长期毒性试验

这对于制定临床试验的剂量方案具有重
要意义
t
预测药物的生殖和发育毒性
某些药物可能对生殖和发育造成不良影
响,长期毒性试验可预测这些潜在毒性
4
方法
进行药物毒理学长期毒性试验时,需要考虑以下因素 实验动物:选择适合的实验动物,如小鼠、大鼠、狗、灵长类等 给药方案:根据药物的性质和实验目的,确定给药的剂量、频率和持续时间 观察指标:在试验期间,定期观察动物的生理指标(如体重、呼吸、体温等)、血液学 指标(如红细胞计数、白细胞计数等)、生化指标(如肝功能、肾功能等)以及其他可能 的毒性反应 病理学检查:在试验结束后,对动物进行病理学检查,以评估药物的毒性作用 数据处理与分析:对试验数据进行整理和分析,评估药物的长期安全性和毒性反应
结果评估
根据上述评估结果,药物开发商可以制定相应的临床 试验方案,确保药物在临床试验中的安全性
x
同时,这些结果也为药物的上市许可提供了重要的参 考依据
-
请各位老师批评指正!
THESIS DEFENSE POWERPOINT
XXXXXXXXXX
指导老师:XXX
答 辩 人 :XXX
2
概念
1
药物毒理学长期毒性试验是 指通过给予实验动物一定剂 量的药物,观察和分析药物
对动物的长期毒性作用
2
长期毒性试验通常采用啮齿类动 物或非啮齿类动物作为研究对象, 连续给药一段时间(如3个月至1 年),以评估药物的长期安全性
3
目的
药物毒理学长期 毒性试验的主要 目的是评估药物 的长期使用对动 物的毒性作用, 包括
5
结果评估
根据长期毒性试验的结果,可以进行如下评估 毒性反应类型与程度:确定药物引起的毒性反应类 型和程度,如轻度、中度或重度 安全剂量范围:根据不同剂量下的毒性反应,确定 药物的安全剂量范围 致癌性评估:根据药物的致癌性检查结果,评估药 物的致癌风险 生殖和发育毒性评估:根据药物的生殖和发育毒性 检查结果,评估药物对生殖和发育的影响2Βιβλιοθήκη XX药物毒理学长 期毒性试验
药物长期毒性实验设计原则

5.2系统尸解 应对所有动物进行尸解,尸解应全面细致,为组 织病理学检查提供参考。具体脏器、组织参见下。 脑(大脑、小脑、脑干),脊髓(颈、胸、腰 段)、垂体 、胸腺、甲状腺、甲状旁腺、食管 、 唾液腺、胃、小肠和大肠、肝脏 、胆囊* 肾脏、肾 上腺、脾脏、胰腺、气管、肺、主动脉 、心脏、附 睾、睾丸、卵巢、子宫、前列腺 乳腺、坐骨神经、 膀胱、眼(眼科检查发现异常时)*、视神经*、给药 局部、骨髓、淋巴结(包括给药局部淋巴结、肠系膜 淋巴结)
如有合理的理由说明所申报的中药、天 然药物复方制剂有一定的安全性,所检查 的脏器和组织可减少为:心、肝、脾肺、 肾、脑、胃、小肠、大肠、垂 体、脊髓、 骨髓、淋巴结、膀胱、睾丸、附睾、子宫、 卵巢、胸腺、肾上腺及给药局部组织等。
5.3病理切片的检查
取得到的脏器进行病理切片的制作,制作过程 包括取材、固定、脱水与透明、浸蜡、包埋、切 片、摊片、染色、封片等过程,对病理切片进行 分析,观察药物对其的毒性反应。
高剂量组
中剂量组:LOAEL
低剂量组:NOAEL
Log[Dose]
7.观察指标 1.一般状况观察 在试验期间,应观察动物外观体征、行为活动、 腺体分泌、呼吸、粪便、摄食量、体重、给药局 部反应。 2.血液学指标 至少应观察红细胞计数、血红蛋白、白细胞 计数及其分类、血小板、网织红细胞计数、凝血 酶原时间等。当受试物可能对造血系统有影响时, 应进一步进行骨髓的检查。见表1
药物长期毒性实验设计原则
外推
一、毒理学的研究方法
急性毒性 长期毒性 特殊毒理学方法
(致突变实验、生殖毒性试验、致癌作用试 验)
长期毒性
长期毒性是指以低剂量外来化合物长期给予实验
动物接触,观察其 对实验动物所产生的毒性效应。 包括行为改变、血液、生化反应以及各器官的损 害程度等。 长期毒性试验是确定外来化合物的毒性下限,即 长期接触该化合物可以引起机体危害的阈剂量和 无作用剂量。为进行该化合物的危险性评价与制 定人接触该化合物的安全限量标准提供毒理学依 据,如最高容许浓度和每日容许摄入量等。
毒理学 长期毒性试验

蓄积毒性作用
药物进入机体后,经过生物转化以代谢产物或化学物原型排出体外。但是,当化学毒物
反复多次给动物染毒,化学毒物进入机体的速度(或总量)超过代谢转化的速度和排泄的速度
(或总量)时,化学毒物或其代谢产物就有可能在机体内逐渐增加并贮留,这种现象称为化学
毒物的蓄积作用 (accumulation) 。
三、长期毒性试验与急性毒性试验的根本差异
1.给药的期限不同
急性毒性试验为一次性给药或 24h 内多次给药。
长期毒性试验为连续多日接触一定剂量给药,给药期限可以从数天至终生甚至数代,一
般为临床用药的 3-4 倍。
表 3-1 常用实验动物的平均寿命及长期毒性试验给药期限
试验动物 平均寿命(年) 亚慢性试验给药期限(月) 慢性试验给药期限(月)
使用本方法时要注意染毒期间定期(每 4 天一次)给动物称重,按实测体重,调整化学毒 物的染毒绝对量。 3.剂量固定的 20 天蓄积法:
通常采用经口灌胃染毒方式,将动物随机分为 5 个组,包括阴性对照组和 1/20 LD50、 l/10 LD50、1/5 LD50 和 1/2 LD50 四个剂量组,每组动物数 10 只,雌雄各半。每日染毒一次, 连续染毒 20 天。观察每组雌雄合计的死亡动物数量。
①供试药物在体内的生物蓄积作用:测定有关的蓄积参数,有助于了解药物的蓄积性。 对于高蓄积性药物应适当减少剂量; ②供试药物是否有可能被特殊的酶所“解毒”或“活化增毒”,而这些酶又是否易被供 试药物本身所诱导或抑制。例如,某些药物如果抑制与其本身代谢或解毒有关的酶,则 该药物的给药剂量应酌情减少。 ③供试物在消化道中的稳定性,与胃肠道内容物有亲和性的药物,应酌情增加剂量。
功,是其它实验动物不可替代的。
药物长期毒性实验设计原则

3.给药方式 原则上应与临床拟用药途径相同。如选择其他
的给药途径,应说明理由 4.给药频率
原则上应每天给药, 且每天给药时间相同。 试验周期长 (3个月或以上)者,也可采取每周 给药6天。特殊类型的受试物由于其毒性特点和 临床给药方案等原因,应根据具体药物的特点设 计给药频率
5.给药期限
表1血液学指标
血液学指标
●红细胞计数
●血红蛋白
●红细胞容积
●平均红细胞容积
●平均红细胞血红蛋白 ●平均红细胞血红蛋白浓 度
●网织红细胞计数 ●白细胞计数及其分类
●血小板计数
●凝血酶原时间
3.血液生化检查 见表2
表2血液生化学指标
血液生化学指标
●天门冬氨酸转氨酶 ●丙氨酸转氨酶
●碱性磷酸酶
●γ-谷氨酰转移酶(非啮齿类动物)
二、长期毒性试验的基本目的
1.预测受试物可能引起的临床不良反应,包括 不良反应的性质、程度、剂量-反应和时间-反应关 系、可逆性等
2.预测临床试验的起始剂量和重复用药的安全 剂量范围(下图)
Biological Response
FEL: Frank Effect Level
LOAEL: Lowest Observable Adverse Effect Level NOAEL:No Observable Adverse Effect Level LOEL: Lowest Observable Effect Level NOEL: No Observable Effect Level
5.2系统尸解
应对所有动物进行尸解,尸解应全面细致,为组 织病理学检查提供参考。具体脏器、组织参见下。
脑(大脑、小脑、脑干),脊髓(颈、胸、腰 段)、垂体 、胸腺、甲状腺、甲状旁腺、食管 、 唾液腺、胃、小肠和大肠、肝脏 、胆囊* 肾脏、肾 上腺、脾脏、胰腺、气管、肺、主动脉 、心脏、附 睾、睾丸、卵巢、子宫、前列腺 乳腺、坐骨神经、 膀胱、眼(眼科检查发现异常时)*、视神经*、给药 局部、骨髓、淋巴结(包括给药局部淋巴结、肠系膜 淋巴结)
药物毒理学长期毒性试验

第三水平,长期毒性试验 (第二阶段)
(1)动物长期毒性试验(半年以上); (2)哺乳类动物致突变试验; (3)啮齿类动物2年致癌试验; (4)人类药代动力学试验; (5)人类临床试验; (6)短期和长期用药的流行病学资料。
(四)药物毒理学研究 在新药临床试验各阶段的任务 第一期临床研究 第二期临床研究
价药物的安全性并不可靠。(原因?) • 安全范围(margin of safety): ED99~LD1(或 ED95~LD5)之间的距离。值越大越安全。
六、药物毒性作用类别
药物不良反应 (adverse reaction):凡是不符合
用药目的并为病人带来不适或痛苦的有害反应统称 为药物不良反应。 包括:副反应、后遗效应、停药反应、毒性反应、 变态反应、特异质反应、致癌性、致畸性、致突变
第三期临) 不良反应(安全性) 大范围的社会考察 提高疗效, 降低不良反应
多数毒物发挥其毒性作用至少经历四个过程:
毒物吸收后经过多种屏障转运到一个或多个靶部位; 进入靶部位的终毒物与内源靶分子发生交互作用; 毒物引起机体分子、细胞和组织水平功能和结构紊乱; 机体启动不同水平的修复机制。当此机制低下或功能和
治疗指数:TI= LD50/ ED50
ED50(median effective dose):
LD50 (median lethal dose ):
药物实验动物的LD50和 ED50的比值称 为治疗指数(therapeutic index, TI) ,用以表示药物的安全性。
安全范围
• 有效量曲线和致死量曲线的斜率不一样时,以TI评
性;
•
急性毒性损害:循环、呼吸及神经
• 慢性毒性损害:肝、肾、骨髓、内分泌 新药临床前评价的作用: • 急性毒性试验:治疗指数、 对机体的可能损害;
不同给药周期的长期毒性试验

不同给药周期的长期毒性试验《中药、天然药物长期毒性试验技术指导原则》和《化学药物长期毒性试验技术指导原则》均在国内首次提出了“可以用不同给药期限的长期毒性试验来分别支持Ⅰ期、Ⅱ期、Ⅲ期临床试验”,即对于一些临床疗程较长的药物,药品注册申请人可以根据药物开发的实际情况,选择在Ⅰ期临床前、Ⅱ期临床前或Ⅲ期临床前分别报送支持不同阶段临床研究的长期毒性试验资料。
以不同给药期限的长期毒性试验来分别支持药物进入I期、II期或Ⅲ期临床试验,并不意味着可以用长期毒性试验的中期报告来支持临床试验,每期长期毒性试验的内容应完整、规范,对结果的分析评价应科学、合理。
若设计一个样本量较大的长毒试验,在1个月、3个月、6个月或9个月时分别处死动物,检测指标,同时设立各个时间点的恢复期,这样就可以在第一时间内完成给药期限较长的长期毒性试验,但这种试验设计并没有充分体现出分阶段临床的科学性,无法达到预期的目的,因此属于不符合要求的分阶段方法。
药审中心鼓励创新性药物在进行长期毒性试验设计时应积极考虑采用“不同给药期限的长期毒性试验来分别支持Ⅰ期、Ⅱ期、Ⅲ期临床试验”,因为对于一个全新的药物,可参考的信息少,通过分阶段的方法可逐步了解药物的毒性,为下一步试验设计提供更充分的信息,可有效地规避风险,提高试验的成功率。
此外,还可在逐步进行试验过程中,根据毒性试验结果和临床研究结果等综合考虑,淘汰开发价值不大的候选药物。
所以,我厂的NO2项目应考虑分阶段申请临床。
通过指导原则及相关文献,我们可认识到各国对重复给药毒性试验并无统一要求,应遵循药物研制开发的客观规律,科学、合理地应用分阶段的毒理试验方法,药物研发是一个渐进的过程,正因为国际上对重复给药毒性试验无统一要求,如何设计并进行合理的试验需靠各试验者的努力,理解其中的科学原理,而不能简单、机械地全盘照搬,应综合考虑多方面因素,如药物的背景资料、前期毒性研究结果等等,对于中药,还应结合临床应用背景情况,科学、合理设计试验,仔细观察指标变化,发现有异常毒性时予以追踪,主动进行探索,加强研究意识,从科学、规范的角度出发进行药物安全性评价,提高药物研究水平。
长期毒性试验

大鼠的长期毒性试验1. 目的:观察连续给予受试动物后由于积蓄而对机体产生的毒性反应及其严重程度,提供毒性反应的靶器官及其损害的可逆性,确定无毒性反应剂量,为人用安全剂量提供参考。
试验条件:2动物:应写明动物的品系,生产单位及生产合格证号,等级,周龄,性别,体重,一般选用动物品系有Wistar、SD、或其他品系的远交系动物。
应根据试验期的长短选用不同周龄的大鼠,试验期在3个月内宜用6~8周龄大鼠,超过三个月者宜用5~6周龄大鼠。
试验开始时,体重差异应不超过平均体重的20%。
实验动物应雌雄分笼饲养,每笼不宜超过5只动物,所有动物试验前至少观察一周,并记录食量和体重等基础数字。
试验报告中应写明饲料供应单位及生产合格证,若用自己配置的饲料,应提供配方及成分含量的检测报告;应写明饲养动物实验室的合格证(未获得合格证者也应注明)及等级。
受试物:应写明受试物的名称、批号、来源、纯度、保存条件及配置方法。
受试物可以是临床试验制剂。
如受试物制剂的体积较大,以不含赋形剂的制剂,如中药浸膏为宜。
固态制剂灌胃给药,可选择适当的溶媒溶解,或研磨成细粉后用1%左右羧甲基纤维素钠(或10%阿拉伯明胶)制成混悬液,但应注意临用前需要摇匀。
避免混悬不匀引起计量误差。
长期毒性试验给药周期较长,固体制剂在配成溶液或混悬液后,冰箱放置,短期内用完,一面受试药物活性降低。
3试验方法:①受试物剂量:一般设三个剂量组和一个对照组。
给受试物剂量单位一般用mg/kg、或g/kg表示。
高剂量组:应使动物产生明显的或严重的毒性反应,或个别动物死亡。
中剂量组:应相当或高于药效学试验的高剂量,应使动物产生轻微的或中等程度的毒性。
低剂量组:略高于整体动物的有效剂量,在此剂量下动物应不出现毒性反应,属基本安全剂量。
对照组:不给收拾药物仅给等容量的溶媒或赋形剂,若所用溶媒或赋形剂可能有毒时,另加一组空白对照。
如果急性毒性试验结果毒性很低,测不出LD50,也未见明显毒性反应,可设高、低两个剂量,高剂量一般为拟用于临床剂量50倍以上(有困难时,可适当减少剂量,最低不能低于临床剂量30倍)并应高于药效学试验的高剂量。
北京大学《药物毒理学》4药物毒理学-长期毒性试验

犬≥8 性别:雌雄各半
如果设计要求在染毒受试物期间处死一部分动物,进行某些指标动态观 察,则在试验开始时应相应增加实验动物数。
整理课件ppt
8
实验动物染毒期限
❖ 在药物临床前毒性研究中,长期毒性试验的期限主要取决于药
物临床拟用的期限,一般为临床拟用期限的2~3倍。 还应有适当的 恢复期。
于 啮齿类,常以腹腔注射作为静脉的替代途径
➢ 经呼吸道:亚慢性:每天吸入4-6小时
整理课件ppt
11
三、试验分组和剂量设计
☻为了要得出明确的剂量-反应关系,和确定未观察到有害作用
剂量(NOAEL),因此至少应设:
高剂量组: 能引起较为明显的毒性作用
☻ 3个剂量组 中剂量组: 应为LOAEL
低剂量组:应相当于NOAEL
☻ 阴性(溶剂)对照组。
整理课件ppt
12
试验分组和剂量设计
1.以相同物种的毒性资料作基础
1-3个月毒性试验的剂 量设计
高剂量组 急性毒性的阈剂量 1/20~1/5 LD50
中剂量组 低剂量组 阴性对照组 组距:3-10倍,最低
不小于2倍
>6个月毒性试验的剂量 设计
高剂量组 亚慢性毒性的MTD或其 1/5~1/2
长期毒性
(chronic toxicity )
/重复给药毒性
(repeated dose toxicity)
北京大学医学部 毒理学系 姚碧云 Tel:82801531
整理课件ppt
1
基本概念
★长期毒性/重复给药毒性(repeated dose toxicity ): 实验动物反复多次接触药物所引起的毒性反应
毒理学中的长期慢性毒性检测方法

毒理学中的长期慢性毒性检测方法毒理学中长期慢性毒性检测方法与探究毒理学是一门旨在研究生命体系中各种化学物质对人类、动物和环境的毒性影响的科学。
在现代人类社会中,人们对各种化学物质的使用越来越频繁,因此对于化学物质的毒性和安全性评估也越来越重要。
而长期慢性毒性检测方法是毒理学研究中不可或缺的一部分。
长期慢性毒性检测方法是对于某一化学物质在动物体内慢性毒性的影响进行评估的方法。
它通过持续给予试验动物某一特定剂量的化学物质来探究其潜在的负面影响。
这种评估需要持续数周至数年的时间,因此其费用和时间成本相对较高。
然而,长期慢性毒性检测方法仍然是毒理学研究中重要的一环。
对于长期慢性毒性检测方法的评估,常用的试验动物有老鼠、大鼠、兔子、狗等。
在一项长期慢性毒性检测实验中,动物要长期接受被测化学物质的暴露,并且要定期采集血样、尿样、组织样本等进行分析。
基于这些分析的结果,可以对被测化学物质在动物体内的影响进行详细的评估和分析。
在长期慢性毒性检测方法的实施中,建立合适的试验方案和得出合适的结论非常重要。
试验方案需要考虑到被测化学物质在动物体内的生物学运作规律,动物对被测化学物质的吸收、代谢和排泄规律等,同时还需要考虑到不同个体之间的生理差异。
得出的结论需要综合考虑所有的实验结果,包括毒性效应、剂量效应、时间效应等多方面信息。
此外,当进行长期慢性毒性检测方法时,还需要注意对于动物的福利问题。
这不仅是出于道德敏感性的考虑,同时也要考虑到动物的健康状况对于实验结果的影响。
因此,在长期慢性毒性检测方法的实施中,需要对于试验动物进行定期的健康检查和妥善的饮食安排。
在现代毒理学研究中,长期慢性毒性检测方法被广泛应用于评估各种化学物质的毒性和安全性。
与其他较短时间的毒性实验相比,长期慢性毒性检测方法可以更加全面地评估某种化学物质的短期和长期效应。
同时,该方法可以探究某种化学物质在不同种类和不同组织中可能发挥不同的毒性效应。
总之,长期慢性毒性检测方法在现代毒理学研究中发挥着重要的作用。
长期毒性试验检测指标
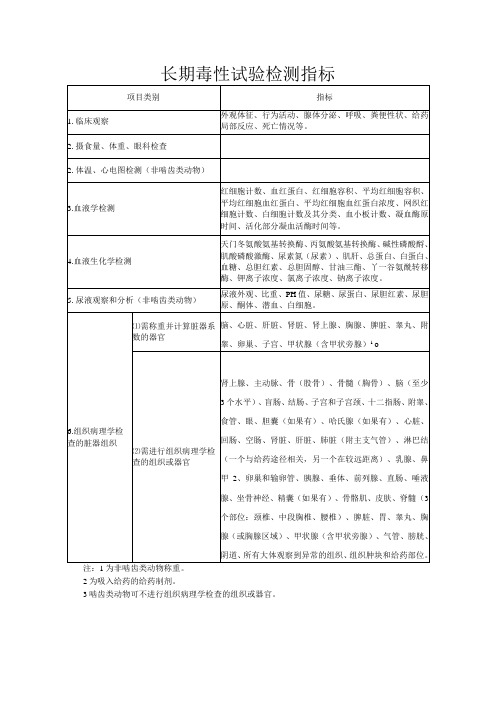
2为吸入给药的给药制剂。
3啮齿类动物可不进行组织病理学检查的组织或器官。
长期毒性试验检测指标
项目类别
指标
1.临床观察
外观体征、行为活动、腺体分泌、呼吸、粪便性状、给药局部反应、死亡情况等。
2.摄食量、体重、眼科检查
2.体温、心电图检测(非啮齿类动物)
3.血液学检测
红细胞计数、血红蛋白、红细胞容积、平均红细胞容积、平均红细胞血红蛋白、平均红细胞血红蛋白浓度、网织红细胞计数、白细胞计数及其分类、血小板计数、凝血酶原时间、活化部分凝血活酶时间等。
4.血液生化学检测
天门冬氨酸氨基转换酶、丙氨酸氨基转换酶、碱性磷酸酹、肌酸磷酸激酶、尿素氮(尿素)、肌肝、总蛋白、白蛋白、血糖、总胆红素、总胆固醇、甘油三酯、丫一谷氨酰转移酶、钾离子浓度、氯离子浓度、钠离子浓度。
液观察和分析(非啮齿类动物)
尿液外观、比重、PH值、尿糖、尿蛋白、尿胆红素、尿胆原、酮体、潜血、白细胞。
6.组织病理学检查的脏器组织
⑴需称重并计算脏器系数的器官
脑、心脏、肝脏、肾脏、肾上腺、胸腺、脾脏、睾丸、附睾、卵巢、子宫、甲状腺(含甲状旁腺)1.o
⑵需进行组织病理学检查的组织或器官
肾上腺、主动脉、骨(股骨)、骨髓(胸骨)、脑(至少3个水平)、盲肠、结肠、子宫和子宫颈、十二指肠、附睾、食管、眼、胆囊(如果有)、哈氏腺(如果有)、心脏、回肠、空肠、肾脏、肝脏、肺脏(附主支气管)、淋巴结(一个与给药途径相关,另一个在较远距离)、乳腺、鼻甲2、卵巢和输卵管、胰腺、垂体、前列腺、直肠、唾液腺、坐骨神经、精囊(如果有)、骨骼肌、皮肤、脊髓(3个部位:颈椎、中段胸椎、腰椎)、脾脏、胃、睾丸、胸腺(或胸腺区域)、甲状腺(含甲状旁腺)、气管、膀胱、阴道、所有大体观察到异常的组织、组织肿块和给药部位。
长期毒性试验-文档资料

适宜温度为 18~27 ℃ 。
ห้องสมุดไป่ตู้
犬
单笼饲养,定量喂食。
Beagle 狗实验前至少驯 养 1~2 周; 杂种狗应先检疫,驱虫。
相对湿度为 40%~70%。
光照宜持续 12 小时明亮,12 小时黑暗。
通风条件良好。
所用饲料应符合动物的营养标准。
雌雄动物应分开饲养,每笼不宜超过 5只
2.饲养管理
如果一种化合物以1000mg/kg 的剂量,按规定期限连续给药, 不产生任何可观察到的毒性反 应,而且根据结构相关药物的 已有资料,估计不会产生毒性 的话,就不需要再用三个剂量 来进行试验,除非预期临床需 要更高的剂量。
6.给药方法及时限
每天给药,每周必须给药 7 天。给药期限长(3个月或以上) 的药物每周至少应给药6天。
主要因素
温度(℃ ) 湿 度 动物类别
小鼠、大鼠
20-26 40-60%
豚鼠、家兔
18-28 40-60% 18-28
犬
40-60%
换气次数
气流速度 压 力 洁 净 度 落下细菌 照 噪 明 声
10-15次/h
13-18cm/s 正 压 100000级 <=3个/皿
150-300 Lux
10-15次/h
低剂量 X高剂量 计算
高剂量组--产生明显或严重的毒性反应,或个 别动物死亡(但死亡率应控制在 20% 以内); 空白对照--溶媒或其它赋形剂,若溶媒或赋形剂有毒性时则增加 正常对照组
<3月,大鼠♂♀各20只/组 ≥3月,大鼠♂♀各30只/组 大动物6-8只/组(♂♀各半)
5.剂量及分组
在选择合适的剂量时还应考虑到: ①药物在体内的生物蓄积作用。对于高蓄积性药物应 适当减少其剂量,否则在长期毒性试验结束时各剂量均有 可能出现毒性作用;
《长期毒性试验》课件

展望
• 长期毒性试验应该更好地结合现代科 技手段进行
• 研究方向要更加多样化,应用对象更 加广泛
• 应该探索和建立其他模式,以更全面, 直观,普遍地评估实验物质对健康的 影响
生理、生化和组织学指标的 检测
长期毒性试验中,需要对实验动物 大量检测并比对其生理、生化和组 织学指标的改变,如肝肾功能,血 液流变学,氧化应激水平等。
长期毒性试验的数据分析
线性剂量-反应模型
该模型可以对人体内长期接 触实验物质后的剂量和反应 之间的关系进行分析,并通 过相关曲线将剂量-反应关系 定量化,以为优化剂量和规 范使用提供依据。
长期毒性试验的应用和意义
1 推动药物研发
长期毒性试验可以有效推动新药研发,对待药物的剂量、安全性和合理用药等方面进行 评估,为临床疗效和治疗效果提供重要依据。
2 建立化学物品安全评价体系
长期毒性试验为有关部门和机构建立起一个完整的化学物品安全评价体系,于化学危害 性的评估和防控提供重要的参考与依据。
生态流行学分析
该类分析方法从人群的角度 去分析,通过对人群中存续 时间较长的疾病与实验物质 暴露的关系进行分析,以发 现相关规律与相应的救治与 预防的策略。
生物信学分析
通过获取实验样本内某些生 物学物质,如基因、蛋白质、 代谢物等的数据信息,进行 计算、处理,以期发现与实 验物质暴露相关的生物标记, 从而对实验物质进行安全评 估。
《长期毒性试验》PPT课件
欢迎大家来到《长期毒性试验》课程,本课程将为您全面解读长期毒性试验 的定义、目的、方法、数据分析、应用和意义。
长期毒性试验的定义
定义
长期毒性试验是评估、研究 某一化学物质、药物或其他 物质对人体或动物体内长期 使用后的影响的一种生物学 检测手段。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
长期毒性试验操作规程
1.目的:
观察连续重复给予受试物对动物所产生的毒性反应,首先出现的症状和严重程度,毒副反应的靶器官及其恢复和发展情况。
确定无毒反应剂量,为拟定人用安全剂量提供参考。
2. 动物和材料:
2.1动物
一类新药首选Beagle犬和猴类,应写明供应单位。
根据试验周期的长短,一般选择性成熟青年动物为受试动物。
二、三、四类新药要求放松一些,但要根据实际情况选择合适的实验动物。
实验前大动物应检测心电,并做血液学和血液生化学分析,指标在正常范围内的动物,方可作为受试动物。
小动物分组方式通常采用随机分组,雌雄各半。
大动物通常每组动物4-6只,雌(无孕)雄各半,随机分组。
2.2 受试物和实验室
3.试验方法
3.1 剂量和分组
3.1.1 一般设2-3个剂量组,一类新药应设三个剂量组和一个对照组。
剂量一般用g(或mg)/kg或单位/kg表示。
低剂量组略高于临床试验人用日最高剂量或按体表面积折算的动物药效学有效剂量。
低剂量组不应出现毒性反应。
高剂量组原则上应产生明显或严重的毒性反应或个别动物死亡。
在高、低两个剂量之间按等比关系再设置一个中剂量。
3.1.2 对照组不给受试物仅给等容量的溶媒或赋形剂。
如这些成分可能有毒性时,应另设一组对照组。
限度试验:如果经小鼠急性毒性口服给药剂量大于5g/kg或注射给药剂量大于2g/kg仍不出现毒性反应和死亡或仅个别动物有毒性反应时,可考虑只作一个高于临床拟用剂量50倍的剂量。
3.2 给药途径与方法
3.2.1 给药应与临床用药途径一致。
3.2.2 口服药途径每天于喂食前定时给予。
若将受试物混在饲料、水中给予,每动物应分笼饲养,并采取严格有效措施,以保证每只动物按量在一定时限内服完。
3.2.3 经静脉、肌肉或皮下途径,其注射部位可于四肢或臀部等处交替进行。
3.2.4 受试物最好是每周7天连续给予,如试验周期在90天以上,可考虑每周给药6天,每天定时给药。
每周可根据体重情况调整给药量,按等容量不等浓度配制药物。
4 试验周期
4.1 长毒试验的给药时间为临床试验用药期的二-三倍,最长半年。
4.2 三、四类新药均符合法定标准;可先做大鼠长期毒性试验。
如无明显毒性反应可免做大动物如Beagle犬与猴类等的长期毒性试验。
5. 检查项目
5.1 一般观察:如行为活动、恶心呕吐、流涎、粪便及体重变化情况等。
5.2 检测项目:
5.2.1 心电检查(必要时做):
5.2.2血液学指标:红细胞或网织红细胞计数、血红蛋白、白细胞计数及其分类、血小板计数、凝血时间。
5.2.3 血液生化学:天门冬氨酸氨基转换酶(AST)、丙氨酸氨基转换酶(ALT)、碱性磷酸酶(ALP)、肌酐(Crea)、尿素氮(BUN)、总蛋白(TP)、白蛋白(ALB)、血糖(GLU)、
总胆红素(T-BIL)、总胆固醇(T-CHO)。
5.2.4 系统尸解和病理组织学检查
5.2.4.1 系统尸解:应全面细致,发现异常器官应重点进行病理组织学检查。
5.2.4.2 脏器称重和脏器系数:剖解后取出心、肝、脾、肺肾、肾上腺、甲状腺、睾丸、卵巢、子宫、脑、前列腺。
5.2.4.3病理组织学检查:高剂量组对照组动物及尸检发现异常器官检查要详细。
其它剂量可取材保存。
在高剂量组发现有异常病变时才进行检查。
检查内容:
一类新药:心、肝、脾、肺、肾、肾上腺、甲状腺、垂体、前列腺、胸腺、脑、胃、睾丸(连附睾)、卵巢、子宫、十二指肠、回肠、结肠、胰腺、膀胱、淋巴结、脊髓、胸骨(骨和骨髓)、视神经。
其它各类新药:心、肝、脾、肺、肾、肾上腺、甲状腺、前列腺、胸腺、胃、睾丸(连附睾)、卵巢、子宫和可能的靶器官。
5.2.5大体尸解和病理组织学检查:
对脏器进行全面肉眼尸检,常规对心、肝、脾、肺、肾五个实质脏器称重、计算脏器系
6.可逆性观察
最后一次给药后4小时,每组活杀部分动物(2/3-1/2),检测各项指标,余下动物停药,继续观察2-4周。
如24小时后的病理学检查发现有异常变化,应将余下动物活杀剖检,重点观察毒性反应器官,以了解毒性反应的可逆程度和可能出现的迟缓性毒性。
7. 指标观察时间
一般状况和症状的观察,每天观察一次。
每周记录饲料消耗和体重一次。
试验周期在三各月以内的,一般在给药前进行一次全面的检查,包括心电图、血液学、血液生化学等各项指标。
在给药周期结束后和可逆性观察结束后再分别进行上述各项指标的检测。
并活杀动物做大体尸解和病理组织学检查。
试验周期在三各月以上的,可在给药中期再进行1-2次心电图、血液学、血液生化学检查。
对有异常的指标可酌情增加测定次数,但抽血量和频度以不影响动物健康为度。
对濒死或死亡动物应及时检查。
